随着经济的发展以及人们生活水平的提高,人们的饮食结构早已发生了巨大的变化,从以植物性食物为主转变成以肉类食品为主[1]。与此同时,随着机械行业和食品加工技术的崛起,越来越多种类的肉制品(如肠类、肉糜类等重组肉制品)出现在人们的生活中。肌原纤维蛋白(myofibrillar protein,MP)是肌肉中一类具有重要生物学功能的结构蛋白群[2],在肌肉蛋白质中占50%~55%。MP是形成凝胶的主要成分[3],与肉制品的质构、保水性、流变性等特性密切相关[4]。为了改善肉制品及其凝胶类肉品品质,通常添加一些具有增稠、保水等性质的多糖,如卡拉胶[5]、膳食纤维[6],以改善其品质。亚麻籽胶(f l axseed gum,FG)是亚麻油工业的副产品,是水溶性的阴离子多糖,通常表现出弱的凝胶状特性,在加热过程中形成热可逆凝胶[7],具有美容、防癌、降低糖尿病和心脏病发病率的保健功效[8]。这些优越的性质使其可以替代卡拉胶、膳食纤维等应用于肉制品中。有研究表明,FG的添加可以显著改善产品品质。孙晓冬等[9]研究FG在肉肠中的应用,结果显示其可以显著改善肉肠加工品品质和复水性。Sun Jian等[10]发现,添加FG可显著提高MP的凝胶保水性。潘丽华等[11]研究不同温度下FG对MP凝胶特性的影响,结果发现FG改善了MP凝胶的保水性,但显著降低了其凝胶强度。
除了添加物和理化条件影响肉制品品质外,一些新型加工处理方式对肉制品品质也有显著地改善作用,其中超高压处理就是一种常用方法。在肉制品开发中,将超高压与多糖添加剂结合已广受关注。Yang Huijuan等[12]单独使用高压技术或与多糖添加剂结合,生产出符合人类健康需求的低脂肉制品。Chen Xin等[13]发现高压处理可以显著提升海藻酸钠-肌动球蛋白凝胶强度,并改善了其凝胶特性。这些都为应用超高压处理改善肉制品凝胶特性提供参考。然而,不同压力下FG与MP相互作用以及对最终热凝胶特性的影响鲜有报道。本实验对不同压力下添加FG对MP分子间作用力、凝胶特性以及微观结构的影响进行研究,以期为更好地利用FG、肉制品的开发和凝胶类产品品质改善提供理论依据。
猪背最长肌 江苏省食品集团;FG 新疆绿旗企业(集团)生物科技有限公司;1-苯胺基萘-8-磺酸(1-aniline naphthalene-8-sulfonic acid,ANS)、双缩脲、牛血清白蛋白、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid),DTNB) 南京化学试剂设备有限公司;K2HPO4·3H2O、KH2PO4、乙二醇双(2-氨基乙基醚)四乙酸(ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA) 国药集团化学试剂有限公司;戊二醛、氯化钠 阿拉丁试剂有限公司。
Avanti J-E离心机 美国Beckman Coulter公司;Ultra Turrax T-25 Basic高速匀浆机 德国IKA公司;TA.XT plus质构仪 英国Stable Micro Systems公司;M2e多功能酶标仪 美国MD公司;MesoMR核磁共振仪 上海纽曼公司;MCR301界面流变仪 奥地利Anton Paar公司;S-IL-100-850-9-W高压设备 英国Stansted Fluid Power公司;S-3000N扫描电子显微镜 日本日立公司。
1.3.1 MP的提取
参照Han Minyi等[14]的方法并适当改进,所有操作环境温度均为4 ℃。背最长肌剔除肉眼可观察到的脂肪,称取80 g,用绞肉机搅碎3 次(3 s/次)。加入4 倍体积的提取液(0.1 mol/L KCl、20 mmol/L K2HPO4/KH2PO4、2 mmol/L MgCl2、1 mmol/L EGTA,pH 7.0),冰浴匀浆30 s,重复两次。将分散好的样品用纱布过滤,2 000×g、4 ℃离心10 min,弃上清液。加入4 倍体积的提取液和质量分数0.5% Triton X-100,冰浴匀浆,双层纱布过滤后2 000×g、4 ℃离心10 min,弃上清液收集沉淀。重复第1步操作,取沉淀加入4 倍体积0.1 mol/L KCl盐溶液重新分散沉淀,2 000×g、4 ℃离心10 min,弃去上清液收集沉淀。重复两次,最后所得沉淀即为纯化的MP,采用双缩脲法测定MP质量浓度,保存于4 ℃冰箱待用。
1.3.2 不同压力MP-FG混合物的制备
参照Chen Xin等[5]的方法将MP质量浓度调成50 mg/mL,FG质量分数为0.3%,充分混匀。分别以压力水平为0.1、100、200、300、400 MPa处理MP-FG混合体系,在同一压力水平下以不加FG的MP作为对照。
1.3.3 动态流变性的测定
参照Li等[15]的方法并作修改,采用50 mm平行板,将MP和MP-FG样品均匀涂布在测试台并赶走气泡。测试频率为1 Hz,狭缝距离为1 mm,应变力为1%。温度程序为从20 ℃以2 ℃/min升温至80 ℃。为了防止升温过程水分蒸发,用石蜡封平行板与空气接触的外沿。每个样品3 个平行。
1.3.4 凝胶的制备
参照Zhang Ziye等[16]的方法并作修改,将制备好的MP与MP-FG加入10 mL小烧杯并置于水浴锅,以2 ℃/min从20 ℃上升到80 ℃,并在80 ℃保持20 min。结束后迅速用冰水冷却,保存在4 ℃冰箱平衡过夜后进行各指标的测定。
1.3.5 保水性的测定
参照Chen Xin等[5]的方法并作适当修改,取3 g凝胶样品于离心管中,4 ℃条件下10 000×g离心10 min,用滤纸吸取离心后的水分,称质量。保水性按公式(1)计算。
式中:m0为离心管质量/g;m2为离心后样品和离心管的质量/g;m1为离心前样品和离心管的质量/g。
1.3.6 凝胶强度的测定
参照Xue Siwen等[17]的方法并作适当修改,将制备好的凝胶直接放在10 mL小烧杯中,采用TA.XT plus质构仪测定。参数设定:使用P/5型号探头,测前速率为2 mm/s,测试速率为1 mm/s,测试距离设为4 mm,触发力设为3 g。每个样品作3 个平行。
1.3.7 活性巯基含量的测定
活性巯基含量的测定参照Guo Xiuyun等[18]的方法并加以修改。用磷酸盐缓冲液将样品稀释至1 mg/mL,取5 mL样品加到10 mL离心管中,再加入20 µL DTNB,振荡均匀后25 ℃反应1 h。反应结束后在412 nm波长处测吸光度,活性巯基含量计算如公式(2)所示。
式中:C0为活性巯基含量/(mol/g);A为412 nm波长处吸光度;ε为摩尔消光系数(13 600 L/(mol·cm));D为稀释倍数;ρ为蛋白质量浓度/(mg/mL)。
1.3.8 疏水性的测定
参考Zhang Ziye等[19]的方法并加以修改,采用疏水探针结合法测定。用磷酸盐缓冲液(含0.6 mol/L NaCl、pH 7.0)将样品稀释至1 mg/mL,取4 mL样品,加入20 µL 15 mmol/L ANS(pH 7.0),混匀后于黑暗处25 ℃孵育20 min。反应结束后,在激发波长375 nm、发射波长460 nm条件下测定其荧光强度以表示其疏水性。
1.3.9 低场核磁共振法对水分分布的测定
参照Han Minyi等[20]的方法并加以修改。取2 g凝胶样品置于直径25 mm的核磁小管中,使用CPMG序列进行测定,质子共振频率为22.6 MHz。测试参数为:回波时间为200 µs,重复扫描32 次,间隔时间为6 500 ms,回波数12 000 个。其数据利用仪器自带的Multi-Exp Inv Analysis软件进行反演,得到对应的峰面积所占比例。
1.3.10 微观结构观察
参照Cao Yingying等[21]的方法并作适当修改。将凝胶切成约2 mm正方体,放入质量分数2.5%戊二醛溶液固定制样,再用不同体积分数乙醇进行梯度脱水。将处理后的样品放入超临界点干燥仪中干燥、喷金后用扫描电子显微镜观察并拍照,加速电压为5 kV,放大2 000 倍。
每个样品至少3 次重复实验,用SAS 8.1软件对实验数据进行分析,采用邓肯氏多重比较法,差异显著性采用t检验进行比较,并用Origin 8.0软件作图。
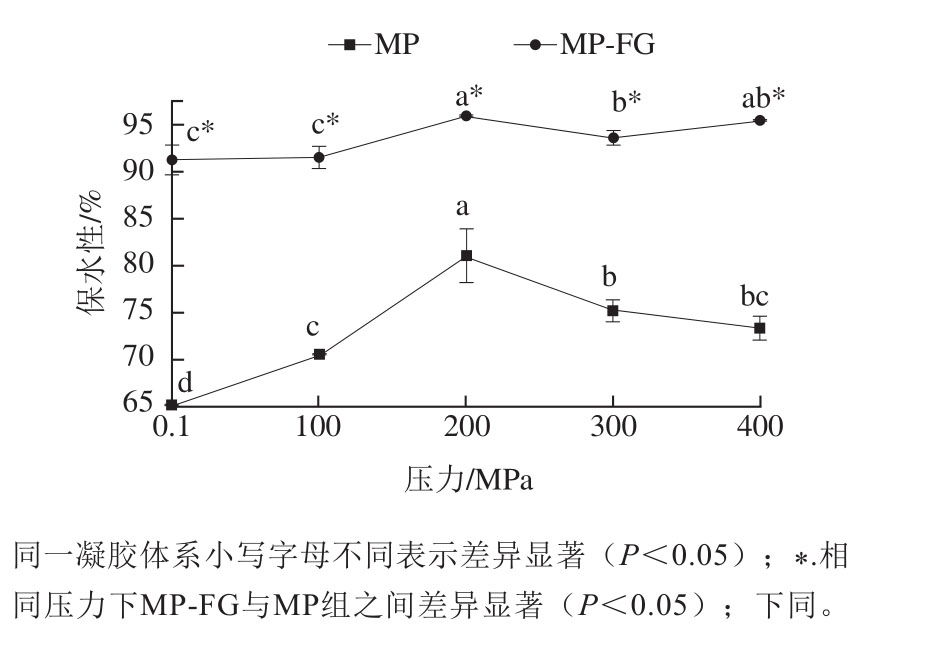
图1 不同压力下FG对MP凝胶保水性的影响
Fig. 1 Effect of fl axseed gum on WHC of myofibrillar protein gel at different pressures
保水性是肉制品热诱导凝胶重要的功能特性之一,对肉的嫩度、颜色等感官指标有着直接的影响。从图1可以看出,经100~200 MPa处理后,对照组MP凝胶的保水性从65.1%显著上升至81.5%(P<0.05)。随着压力升高到300 MPa,MP凝胶的保水性从81.5%降低至75.2%(P<0.05)。当压力从300 MPa上升至400 MPa时,MP凝胶保水性变化不显著(P>0.05)。He Xuanhui等[22]发现大豆分离蛋白在0.1~200 MPa条件下凝胶保水性随着压力增大而增加,这与本研究结论一致。压力过高使蛋白质发生变性,从而降低MP溶解度[7]。在加热过程中,变性的MP无法保留更多的水分,导致凝胶保水性下降。相比于对照组,添加FG后凝胶保水性在0.1~400 MPa压力下均显著提高(P<0.05)。经200 MPa处理后,MP-FG的保水性从91.2%上升至最大值95.8%(P<0.05)。总体来说,MP-FG凝胶保水性随着压力的增大而增加,该结果和不同压力(100~300 MPa)处理海藻酸钠与猪肉凝胶的结果类似[23]。其原因可能是FG具有较弱的凝胶性,可以存在于蛋白凝胶网络空隙中,起到填充持水的作用。另一方面,FG属于阴离子多糖[6],大量带负电的多糖与带正电的蛋白质侧链基团相互作用,提高了MP凝胶保水性。随着压力的增大,MP疏水基团、巯基等基团暴露,这些基团与FG产生交互作用,最终也导致了MP-FG凝胶体系保水性的提高。
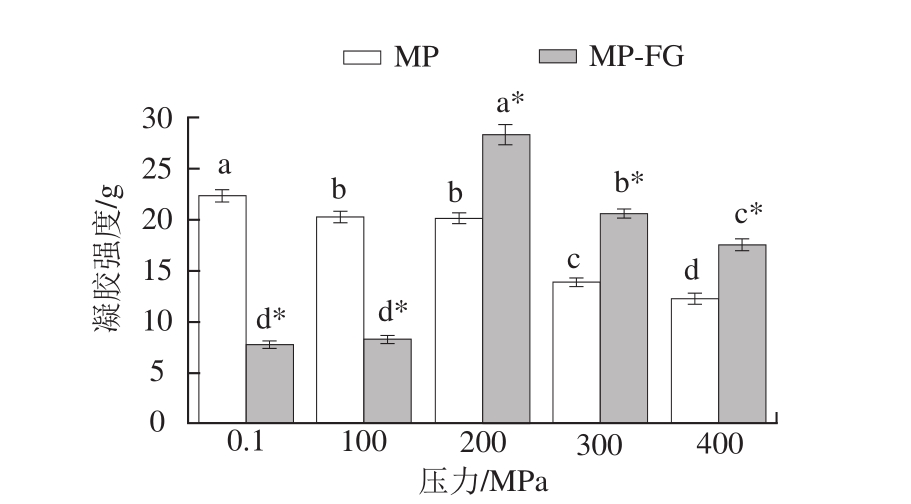
图2 不同压力下FG对MP凝胶强度的影响
Fig. 2 Effect of fl axseed gum on gel strength of myofibrillar protein at different pressures
凝胶强度是凝胶质构的重要指标,关系着肉制品加工质量。从图2可以看出,在未添加FG条件下,MP经100~400 MPa高压处理后,能显著降低其凝胶强度(P<0.05);经100、200 MPa处理的MP凝胶强度变化不明显。类似的结果也出现在经超高压(100~600 MPa)处理的肌球蛋白凝胶[24],高压能够使蛋白变性展开,从而使更多的水分子进入,降低了凝胶强度[5]。在0.1、100 MPa压力下,添加FG均显著降低了MP的凝胶强度(P<0.05),同样的结果也出现在不同加热温度FG对MP凝胶强度影响的研究中,温度达到80 ℃时,添加FG显著降低了MP凝胶强度[11]。当压力大于200 MPa后,MP-FG凝胶强度显著高于MP凝胶(P<0.05),这与200 MPa处理提高了添加质量分数0.75%海藻酸钠的猪肉糜凝胶强度结果[23]相似。随着压力继续增大,MP-FG凝胶强度逐渐降低(P<0.05)。这是因为压力增大使蛋白质与多糖之间相互作用增强,形成聚合物,在蛋白质加热时抑制蛋白质变性,从而降低了MP-FG凝胶强度[25]。
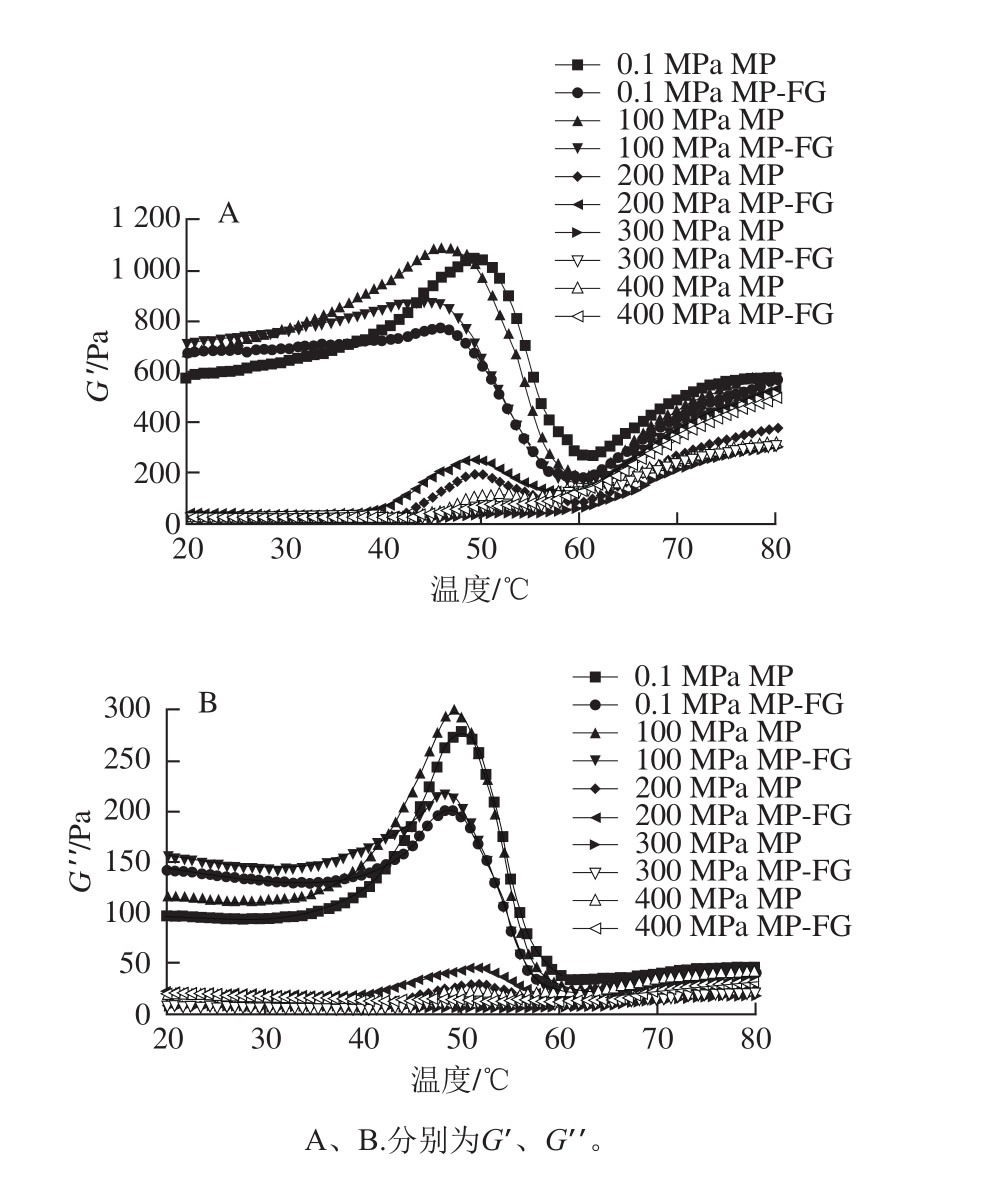
图3 不同压力下FG对MP凝胶流变特性的影响
Fig. 3 Effect of fl axseed gum on rheological properties of myo fibrillar protein gel at different pressures
储能模量(G′)表示流体的弹性,在凝胶形成过程中反映凝胶强度[21]。由图3可以看出,当压力小于200 MPa时,MP与MP-FG凝胶在43~50 ℃范围内均出现明显的热变性峰。此阶段开始形成较为疏松的凝胶结构。出现第1个峰普遍接受的解释为肌球蛋白头部受热部分变性接合,从而导致了G′上升。而50~60 ℃时,G′急剧下降,肌球蛋白进入凝胶减弱阶段。这个阶段主要是因为肌球蛋白尾部打开,增加了体系的流动性,最终导致G′急剧下降。60~80 ℃时,G′随着温度的升高稳步上升,在60 ℃以后肌球蛋白充分变性展开,与现有的结构交联数量增加,形成不可逆凝胶[6]。损耗模量(G′′)反映流体黏性的大小,变化趋势和G′基本一致。
从整体上看,添加FG并不会改变G′曲线的形状。且随着压力的增大,MP和MP-FG凝胶的G′与G′′逐渐降低,这是因为高压可以改变疏水作用和二硫键等作用力,从而影响体系的流变特性,宏观上表现出黏度的变化。添加质量分数0.3% FG提高了MP在对应压力下的G0′与G0′′(分别为20 ℃(起始温度)时的G′和G′′),这是因为FG与胶体相互作用使样品黏度增大,类似的结果也出现在肌动球蛋白-海藻酸钠混合体系中[13]。100~200 MPa条件下,MP和MP-FG凝胶加热过程中存在明显热特性峰;而300~400 MPa时,G′与G′′随温度的增加而增加,原有的特征峰变得不明显甚至消失,表明蛋白质已经发生了变性。当压力达到200 MPa后,G0′与G0′′急剧下降,说明高压导致了体系流动性增加和黏度变小。在0.1、100 MPa时,添加FG显著降低了MP在40~80 ℃时的G′和G′′。然而,当压力大于200 MPa时,MP-FG凝胶的G′与G′′高于MP凝胶,这与凝胶强度的结果吻合。

图4 不同压力下添加FG对MP凝胶弛豫时间(T2)的影响
Fig. 4 Effect of fl axseed gum onT2 relaxation time of myofibrillar protein gel at different pressures
由于低场核磁共振能够进行无损检测,可以了解水分子中氢质子的移动和分布,越来越多地被应用于肉和凝胶制品的保水性分析中。由图4可知,通过对弛豫时间T2进行指数拟合,出现了3 个部分。它们对应的时间分别为T2b(1~10 ms)、T21(100~1 000 ms)和T22(1 000~4 328 ms),这与前人的研究结果[26]相似,分别对应与蛋白分子结合最为紧密的结合水(T2b)、具有弱流动性的不易流动水(T21)和中度可移动的自由水(T22),其对应的峰面积所占比例分别记为PT2b、PT21和PT22。
表1 不同压力下FG对MP凝胶各弛豫峰峰面积比例的影响
Table 1 Effect of fl axseed gum on the proportion of relaxation peak areas of myofibrillar protein gel under different pressures

注:同行肩标小写字母不同表示差异显著(P<0.05);同一压力及指标肩标大写字母不同表示差异显著(P<0.05)。
指标 组别 0.1 MPa 100 MPa 200 MPa 300 MPa 400 MPa PT2b/% MP 1.05±0.22bA 1.10±0.08bA 2.70±0.40aA 2.61±0.14aA 1.27±0.05bA MP-FG 3.38±0.16aB 1.98±0.56bcA 3.32±0.51aA 2.65±0.33baA 1.57±0.44cA PT21/% MP 85.20±1.27cA 95.50±0.17aA 96.30±0.57aA 85.90±0.53cA 88.60±0.93bA MP-FG 94.30±0.93bB 94.80±0.50abA 95.70±0.45aA 95.00±0.52abB 90.90±0.66cB PT22/% MP 13.70±1.26aA 3.35±0.12cA 0.97±0.23dA 11.37±0.66bA 10.60±0.94bA MP-FG 2.24±0.78bB 3.21±0.51bA 1.01±0.27cA 2.33±0.86bB 7.51±0.34aB
由表1可知,常压下,添加FG显著增加了PT2b和PT21,降低了PT22(P<0.05)。说明添加FG显著降低了自由水比例,自由水比例降低导致了凝胶保水性的增加。压力上升到200 MPa时,MP与MP-FG凝胶的PT21均升高,而PT22降低。这表明适当的压力可以使凝胶网络更加致密,最终导致自由水向不易流动水转化。当压力大于200 MPa时,MP与MP-FG凝胶的PT2b、PT21下降,PT22上升,这与Xue Siwen等[27]研究高压对兔肉凝胶水分影响的结果一致。300、400 MPa条件下,添加FG的MP凝胶PT21显著高于对照组,PT22低于对照组,这与保水性的变化趋势基本保持一致,说明不同压力下,FG可以提高MP凝胶中不易流动水的比例,同时降低自由水比例,从而提高其保水性。
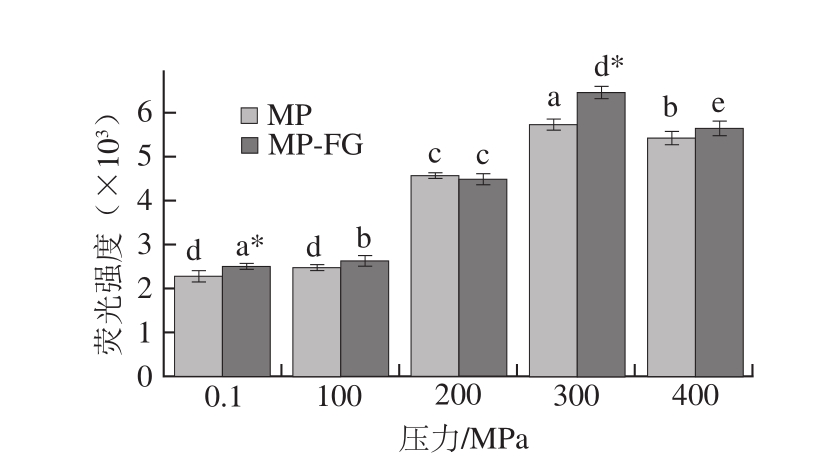
图5 不同压力下FG对MP凝胶疏水性的影响
Fig. 5 Effect of fl axseed gum on hydrophobicity of myofibrillar protein gel at different pressures
疏水性的变化可以反映蛋白质三级结构的变化,蛋白质三级结构的变化可以暴露出疏水基团,影响蛋白凝胶的形成[28]。ANS荧光探针可以结合疏水基团产生强烈的荧光,是目前研究疏水作用力的常用方法。由图5可知,常压下,添加FG显著增加了MP的疏水性(P<0.05)。MP和MP-FG凝胶疏水性均随着压力的升高而升高。当压力升至200、300 MPa时疏水性增加幅度较大,这与前人的研究结果[19]类似。这可能是因为较低的压力无法使蛋白质内部疏水基团充分暴露,随着压力的增加,更多的疏水基团暴露出来,从而提高了MP和MP-FG凝胶的疏水作用[29]。当压力达到400 MPa时,MP和MP-FG凝胶的疏水性不再增加。随着压力的进一步增大,蛋白质分子间聚集程度变大,暴露出来的疏水基团被包埋,使得ANS无法与更多的疏水基团结合,进而导致疏水性的饱和[19]。疏水作用被认为是形成肌球蛋白聚集的先决条件,促进凝胶的形成和多糖与蛋白的相互作用,最终改善凝胶的特性[5]。凝胶的形成是多种作用力作用的结果,疏水基团的过度暴露可能破坏不同作用力之间的平衡,引起凝胶保水性的下降[30]。
巯基具有很强的还原力,活性巯基指的是暴露在蛋白质表面的巯基。在加热过程中巯基可以形成二硫键,对蛋白质功能特性有关键影响[31]。从图6中可以看出,压力达到100 MPa时并不能引起活性巯基含量的显著变化(P>0.05),同样的现象出现在100 MPa处理肌动球蛋白-海藻酸钠混合体系中[7]。这可能是由于压力太小,无法使蛋白质内部巯基暴露。随着压力的增大(100~300 MPa),活性巯基含量整体呈上升趋势,且压力从100 MPa升至200 MPa时活性巯基含量变化幅度较大(P<0.05),这与疏水性的变化基本一致。这说明压力的升高使得蛋白质变性展开,埋在蛋白内部的巯基暴露到表面[29]。当压力上升至400 MPa后,活性巯基含量与300 MPa时没有显著性差异(P>0.05),这说明300 MPa处理可能已经引起了蛋白质内部巯基充分暴露。相比于对照组,在不同压力下,添加FG并未显著改变MP凝胶的活性巯基含量(P>0.05)。
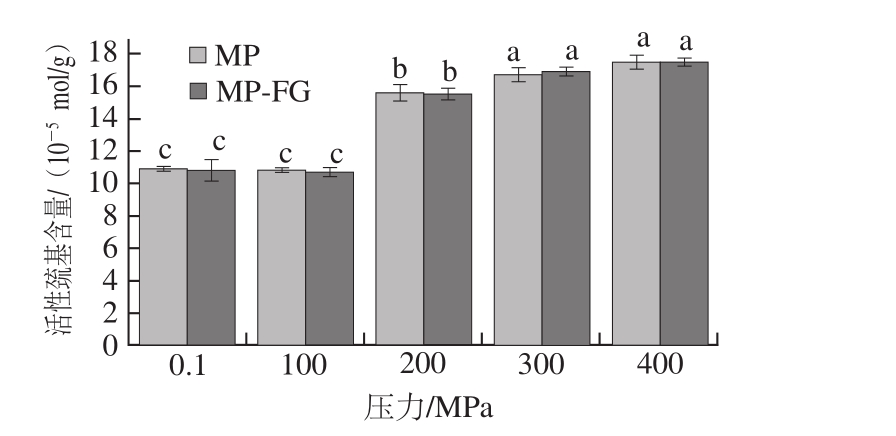
图6 不同压力下FG对MP凝胶活性巯基含量的影响
Fig. 6 Effect of fl axseed gum on reactive sulfhydryl group content of myofibrillar protein gel at different pressures
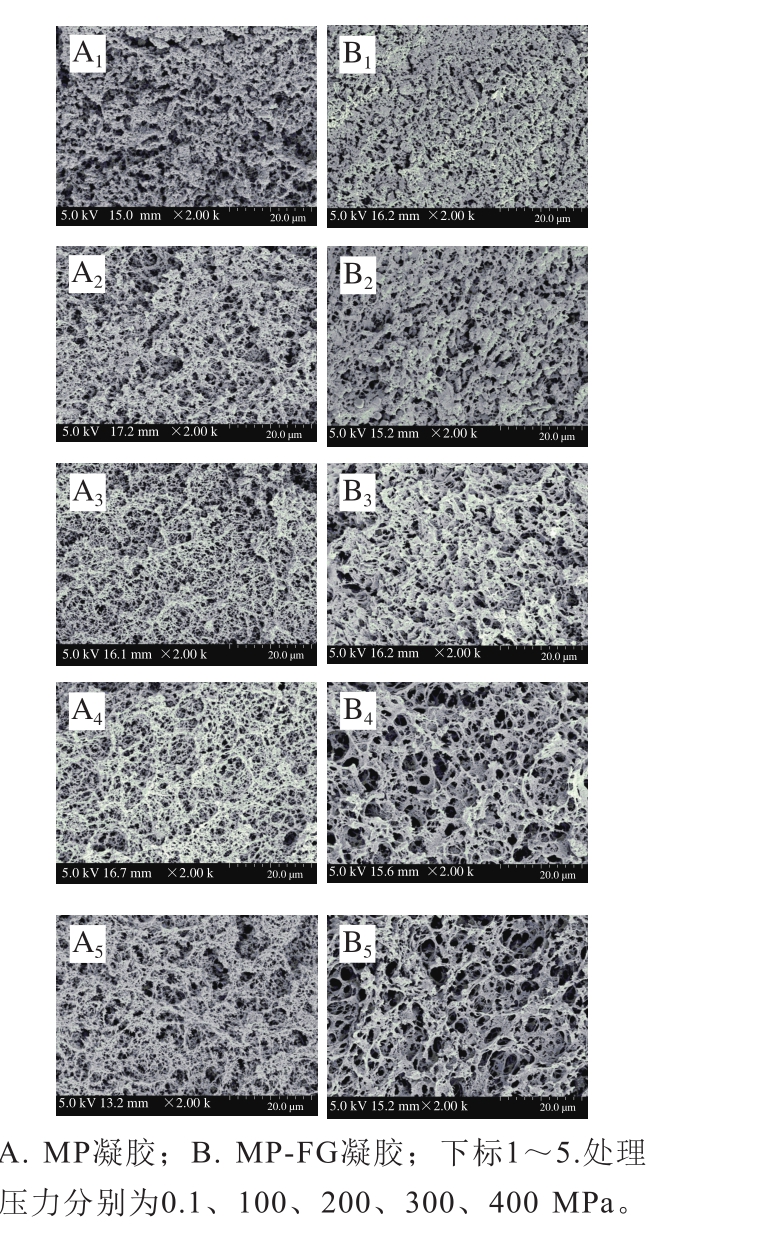
图7 不同压力下FG对MP凝胶微观结构的影响
Fig. 7 Effect of fl axseed gum on microstructure of myofibrillar protein gel at different pressures
三维网络结构对MP凝胶保水性和强度有着重要的影响。从图7中可以看出,0.1 MPa压力下MP凝胶微观结构存在较大孔洞,形成的交联链较粗且松散。添加FG后,FG填充到蛋白凝胶孔隙中,经过加热最终导致MP-FG凝胶表面空洞减少,形成相对致密的凝胶结构。当压力增加到200 MPa时,MP与MP-FG凝胶形成孔径较小、交联较细的致密网状结构。Zhang Ziye等[16]发现200 MPa处理减小了MP溶液的粒度,使其在加热过程中均一排列,最终形成了致密均一的凝胶网络结构。压力大于200 MPa时,MP和MP-FG凝胶表面形成孔径较大、交联较粗糙的网络结构。凝胶网络结构的形成主要取决于变性和聚集的相对速率,聚集速率高于展开速率时,形成的凝胶粗糙、无序。加热前由于高压已经导致蛋白质充分变性展开,因此加热时蛋白质展开速率降低,最终形成孔径较大的网络结构[32]。相比于对照组,MP-FG凝胶形成的网络结构呈片状,孔隙也相对较多。这可能是因为高压促进蛋白与FG的相互作用,以及FG自身具有持水特性[33],最终提高了凝胶保水性。Cando等[34]研究表明微观结构的改变影响凝胶强度,适度的压力促进交联细密的网络结构提高凝胶强度,较高的处理压力(大于300 MPa)导致MP降解或解聚,蛋白质不规律地聚集在一起,诱导其硬度降低,这与本研究结果相似。
0.1 MPa(常压状态)和100 MPa条件下,FG通过增加MP凝胶不易流动水比例,提高了MP的凝胶保水性,但减小了其G′′和G′,导致凝胶强度显著降低(P<0.05)。当压力达到200 MPa时,FG降低MP凝胶自由水比例,增加其结合水比例,进一步提高了MP凝胶的保水性;同时,FG提高了MP凝胶G′′和G′,形成较为致密均一的凝胶网络微观结构,显著增强了MP凝胶强度(P<0.05)。300~400 MPa时,随着压力的进一步升高,FG对MP凝胶保水性和强度的改善作用又显著降低(P<0.05),MP凝胶中自由水比例显著升高,凝胶微观孔洞也明显增多。由此得出:200 MPa高压处理可以进一步增强FG对MP凝胶保水性的改善作用;同时,其形成的微观结构也相对交联致密,改善了常压状态下由于添加FG导致的MP凝胶强度降低问题,因此200 MPa是较佳的处理压力。
[1] 李升升, 韩银仓. 重组肉制品研究进展及发展趋势[J]. 食品工业,2014, 35(6): 235-240.
[2] 栗俊广, 柳红莉, 何菲, 等. 冰温和冷鲜贮藏对鸡肉肌原纤维蛋白凝胶性能和水分状态的影响[J]. 食品科学, 2017, 38(19): 236-246.DOI:10.7506/SPKX1002-6630-201719038.
[3] GROSSI A, OLSEN K, BOLUMAR T, et al. The effect of high pressure on the functional properties of pork myofibrillar proteins[J]. Food Chemistry, 2016, 196: 1005-1015. DOI:10.1016/j.foodchem.2015.10.062.
[4] 夏秀芳, 孔保华, 张宏伟. 肌原纤维蛋白凝胶形成机理及影响因素的研究进展[J]. 食品科学, 2009, 30(9): 264-268. DOI:10.7506/SPKX1002-6630-200909062.
[5] CHEN Xin, CHEN Conggui, ZHOU Yanzi, et al. Effects of high pressure processing on the thermal gelling properties of chicken breast myosin containing κ-carrageenan[J]. Food Hydrocolloids, 2014, 40:262-272. DOI:10.1016/j.foodhyd.2014.03.018.
[6] ZHUANG X, JIANG X, HAN M, et al. Influence of sugarcane dietary fiber on water states and microstructure of myofibrillar protein gels[J]. Food Hydrocolloids, 2016, 57: 253-261. DOI:10.1016/j.foodhyd.2016.01.029.
[7] LIU J, SHIM Y Y, TSE T, et al. Flaxseed gum a versatile natural hydrocolloid for food and non-food applications[J]. Trends in Food Science & Technology,2018, 75: 146-157. DOI:10.1016/j.tifs.2018.01.011.
[8] 黄海浪, 张水华. 亚麻籽的营养成分及其在食品工业中的应用[J]. 食品研究与开发, 2006, 27(6): 147-149. DOI:10.3969/j.issn.1005-6521.2006.06.055.
[9] 孙晓冬, 史峰山, 杜平, 等. 亚麻籽胶在斩拌型肉肠中的应用研究[J]. 食品科学, 2003, 24(11): 88-90. DOI:10.3321/j.issn:1002-6630.2003.11.019.
[10] SUN Jian, LI Xue, XU Xinglian, et al. Inf l uence of various levels of fl axseed gum addition on the water-holding capacities of heat-induced porcine myofibrillar protein[J]. Journal of Food Science, 2011, 76(3):472-478. DOI:10.1111/j.1750-3841.2011.02094.x.
[11] 潘丽华, 冯美琴, 孙健, 等. 不同温度下亚麻籽胶对肌原纤维蛋白凝胶特性的影响及机制[J]. 食品科学, 2016, 37(9): 1-6. DOI:10.7506/spkx1002-6630-201609001.
[12] YANG Huijuan, Han Minyi, BAI Yun, et al. High pressure processing alters water distribution enabling the production of reduced-fat and reduced-salt pork sausages[J]. Meat Science, 2015, 102: 69-78.DOI:10.1016/j.meatsci.2014.10.010.
[13] CHEN Xin, LI Peijun, NISHIUMI T, et al. Effects of highpressure processing on the cooking loss and gel strength of chicken breast actomyosin containing sodium alginate[J]. Food & Bioprocess Technology, 2014, 7(12): 3608-3617. DOI:10.1007/s11947-014-1368-9.
[14] HAN Minyi, ZHANG Yingjun, FEI Ying, et al. Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J]. European Food Research and Technology,2009, 228(4): 665-670. DOI:10.1007/s00217-008-0976-x.
[15] LI J, OULD ELEYA M M, GUNASEKARAN S. Gelation of whey protein and xanthan mixture: effect of heating rate on rheological properties[J]. Food Hydrocolloids, 2006, 20(5): 678-686.DOI:10.1016/j.foodhyd.2005.07.001.
[16] ZHANG Ziye, YANG Yuling, ZHOU Peng, et al. Effects of high pressure modification on conformation and gelation properties of myofibrillar protein[J]. Food Chemistry, 2017, 217: 678-686.DOI:10.1016/j.foodchem.2016.09.040.
[17] XUE Siwen, YANG Huijuan, WANG Huhu, et al. High-pressure effects on the molecular aggregation and physicochemical properties of myosin in relation to heat gelation[J]. Food Research International,2017, 99(1): 413-418. DOI:10.1016/j.foodres.2017.06.014.
[18] GUO Xiuyun, PENG Zengqi, ZHANG Yawen, et al. The solubility and conformational characteristics of porcine myosin as affected by the presence of L-lysine and L-histidine[J]. Food Chemistry, 2015,170: 212-217. DOI:10.1016/j.foodchem.2014.08.045.
[19] ZHANG Ziye, YANG Yuling, TANG Xiaozi, et al. Chemical forces study of heat-induced myofibrillar protein gel as affected by partial substitution of NaCl with KCl, MgCl2 and CaCl2[J]. CyTA-Journal of Food, 2016, 14(2): 239-247. DOI:10.1080/19476337.2015.1091038.
[20] HAN Minyi, WANG Peng, XU Xinlian, et al. Low-field NMR study of heat-induced gelation of pork myofibrillar proteins and its relationship with microstructural characteristics[J]. Food Research International,2014, 62: 1175-1182. DOI:10.1016/j.foodres.2014.05.062.
[21] CAO Yingying, XIA Tianlan, ZHOU Guanghong, et al. The mechanism of high pressure-induced gels of rabbit myosin[J].Innovative Food Science and Emerging Technologies, 2012, 16(39):41-46. DOI:10.1016/j.ifset.2012.04.005.
[22] HE Xuanhui, LIU Hongzhi, LIU Li, et al. Effects of high pressure on the physicochemical and functional properties of peanut protein isolates[J]. Food Hydrocolloids, 2014, 36(5): 123-129. DOI:10.1016/j.foodhyd.2013.08.031.
[23] CHEN C G, GERELT B, JIANG S T, et al. Effects of high pressure on pH, water-binding capacity and textural properties of pork muscle gels containing various levels of sodium alginate[J]. Asian-Australasian Journal of Animal Sciences, 2006, 19(11): 1658-1664. DOI:10.5713/ajas.2006.1658.
[24] 曹莹莹, 张亮, 王鹏, 等. 超高压结合热处理对肌球蛋白凝胶特性及蛋白二级结构的影响[J]. 肉类研究, 2013, 27(1): 1-7.
[25] PÉREZ-MATEOS M, SOLAS T, MONTERO P. Carrageenans and alginate effects on properties of combined pressure and temperature in fish mince gels[J]. Food Hydrocolloids, 2002, 16(3): 225-233.DOI:10.1016/S0268-005X(01)00086-8.
[26] 潘杰, 周颖, 王昱, 等. 超高压对鸡肉肌原纤维蛋白-MgCl2凝胶特性的影响[J]. 食品科学, 2018, 39(11): 89-94. DOI:10.7506/spkx1002-6630-201811014.
[27] XUE Siwen, YANG Huijuan, YU Xiaobo, et al. Applications of high pressure to pre-rigor rabbit muscles affect the water characteristics of myosin gels[J]. Food Chemistry, 2018, 240: 59-66. DOI:10.1016/j.foodchem.2017.07.096.
[28] JIANG L, WANG J, YANG L I, et al. Effects of ultrasound on the structure and physical properties of black bean protein isolates[J].Food Research International, 2014, 62(6): 595-601. DOI:10.1016/j.foodchem.2017.07.096.
[29] CHAN J T Y, OMANA D A, BETTI M. Application of high pressure processing to improve the functional properties of pale, soft, and exudative (PSE)-like turkey meat[J]. Innovative Food Science and Emerging Technologies, 2011, 12(3): 216-225. DOI:10.1016/j.ifset.2011.03.004.
[30] 薛思雯, 邹玉峰, 杨慧娟, 等. 氯化钠浓度对僵直前高压处理兔肉中肌球蛋白凝胶保水性及其胶凝过程中分子特性和结构变化的影响[J]. 食品工业科技, 2017, 38(3): 97-101; 107. DOI:10.13386/j.issn1002-0306.2017.03.010.
[31] 钱畅, 薛思雯, 徐幸莲, 等. 压力水平及氯化钠浓度对兔肌球蛋白凝胶保水性及其胶凝过程中理化特性和结构变化的影响[J]. 食品工业科技, 2018, 39(9): 57-65. DOI:10.13386/j.issn1002-0306.2018.09.011.
[32] LIU R , ZHAO S M, XIONG S B, et al. Role of secondary structures in the gelation of porcine myosin at different pH values[J]. Meat Science, 2008, 80(3): 632-639. DOI:10.1016/j.meatsci.2008.02.014.
[33] CHEN H H, XU S Y, WANG Z. Gelation properties of flaxseed gum[J]. Journal of Food Engineering, 2006, 77(2): 295-303.DOI:10.1016/j.jfoodeng.2005.06.033.
[34] CANDO D, HERRANZ B, JAVIER BORDERÍAS A, et al.Effect of high pressure on reduced sodium chloride surimi gels[J]. Food Hydrocolloids, 2015, 51: 176-187. DOI:10.1016/j.foodhyd.2015.05.016.
Inf l uence of Ultra High Pressure Treatment on the Effect of Flaxseed Gum on the Properties of Pork Myofibrillar Protein Gel
LIU Wang, FENG Meiqin, SUN Jian, et al. Influence of ultra high pressure treatment on the effect of flaxseed gum on the properties of pork myofibrillar protein gel[J]. Food Science, 2019, 40(7): 101-107. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20181130-348. http://www.spkx.net.cn