随着人们对高蛋白食品需求的不断增加,全蛋液在食品加工业中的应用范围也逐渐扩大。但由于蛋内蛋白极易变性,在加工中全蛋液的热凝固温度必须控制在62~67 ℃[1],导致全蛋液的加工工艺以及灭菌都受到温度的限制,全蛋液自身的热敏性使其应用受到很大的局限。因此近些年来国内外蛋品方面的学者大多把通过外部手段提高鸡蛋全蛋液的热稳定性作为研究的热点。
目前,国内外的研究主要集中在通过酶、化学和物理方法修饰鸡蛋蛋白,以改善其热稳定性。刘剑秋等[2]用复合蛋白酶水解鸡蛋1 h,可将其热凝固温度提高至75 ℃。刘俊梅等[3]的实验结果表明用5 U/mg碱性蛋白酶水解蛋清蛋白4 h,其热稳定性达到最高。Lydia等[4]用糖和盐处理全蛋液可使其在80 ℃高温下加热2 min不变性。Ong等[5]研究发现琥珀酸酐可以暴露赖氨酸残基进行琥珀酰化反应,起到修饰蛋白质进而提高热稳定性的效果。然而大多数研究表明,现有的处理手段对鸡蛋蛋白热稳定性的改善效果不够明显,需进一步优化。所以探究一种更好的处理手段也就尤为必要。目前国内外利用琥珀酸酐化学改性修饰蛋白的实例较多,但辛烯基琥珀酸酐(octenyl succinic anhydride,OSA)修饰蛋白质以提高其热稳定性的研究还相对较少。OSA是烯烃和顺丁烯二酸酐反应制得的高活性化学改性剂,含有与琥珀酸酐相似的两个二羧酸酐基,且经过水解仍含有疏水性基团。OSA对蛋白质的改性作用主要是由于其在改性过程中产生的电荷会影响蛋白质的静电和空间位阻[6],从而使得蛋白质的二级结构和三级结构发生变化,通过这种电荷-排斥反应解离蛋白质聚集体,进而改善鸡蛋蛋白的热稳定性。超声处理是一种物理加工方法,在溶液最小程度引入空气的情况下,超声波的使用通过气溶胶的形成和塌陷产生热量和气蚀[7],可能使蛋白质部分变性。但Arzeni等[8]发现仅用超声波处理的再水化蛋清粉末的热稳定性并没有得到改善。而Yang Xue等[9]通过超声辅助α-淀粉酶提高了大米蛋白热凝固温度,Hegg等[10]研究表明超声与十二烷基硫酸钠和月桂酸等结合可改善弱碱性卵白蛋白的热稳定性。因此本研究通过预热、超声与OSA修饰相结合的技术手段使得全蛋液形成稳定的络合物,在高温环境下,这种络合物可以防止蛋白质的进一步解开,从而使蛋白质之间在疏水缔合的同时将大的聚集体最小化,以此来改善鸡蛋蛋白质分散体的热稳定性[11]。首先,经过预热的全蛋液通过OSA化学改性,OSA水解的二羧酸极性部分可能在蛋白质之间发生静电排斥,对提高热稳定性有一定的价值。其次,在超声处理期间其疏水基团会部分松动或暴露,OSA的8 个碳尾可能与暴露的疏水部分相互作用,且超声可以提高OSA的溶解度和分散性,优化OSA的修饰程度[11],使得全蛋液热凝固温度进一步升高,从而使鸡蛋全蛋液在食品加工行业中得到更广泛的应用。
鸡蛋 哈尔滨家乐福超市;OSA 天津市致远化学试剂有限公司。
ALC-310.3电子分析天平、pHS-3C精密pH计 北京赛多利斯仪器系统有限公司;DK-98-II电热恒温水浴锅天津市泰斯特仪器有限公司;恒温磁力搅拌器 常州国华电器有限公司;721-分光光度计 上海元析仪器有限公司;F-4500荧光分光光度计 日本日立公司;GL-21M离心机 上海市离心机械研究所。
1.3.1 改性全蛋液的制备工艺流程
全蛋液→63 ℃加热5 min→达到温度后,4 min时加入OSA(1%、2%、4%、5%、10%、15%、20%,以蛋液质量计)→调节pH值至8.5→琥珀酰化3 h→调节pH值至6.5→超声处理(40 kHz、400 W、50 ℃,8 min)→改性全蛋液。
1.3.2 缓冲液的配制
配制pH 7.4的磷酸盐缓冲液:称取7.9 g NaCl、0.2 g KCl、0.24 g KH2PO4和1.8 g K2HPO4,溶于800 mL蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1 L。保存于4 ℃冰箱中即可。
1.3.3 聚合物分散性指数及粒径的测定
分别将加入不同添加量OSA处理的样品用高速均质机以9 500 r/min均质1 min后,4 000 r/min离心20 min,取上清液100 μL用蒸馏水稀释50 倍,利用激光粒度仪测定聚合物分散性指数(polymer dispersity index,PDI)及粒径。操作参数:温度25 ℃、角度90°、波长632.8 nm。
1.3.4 浊度的分析
分别吸取浊液标准溶液0、0.5、1.25、2.5、5、10 mL和12.5 mL,置于50 mL比色管中,加水至标线。摇匀后即得浊度依次为0%、4%、10%、20%、40%、80%、100%的系列标准溶液。在660 nm波长处测定吸光度并绘制标准曲线。
将不同OSA添加量处理的样品(稀释至50 mL)倒入比色皿中,以蒸馏水作空白,利用分光光度计在660 nm波长处对样品的吸光度进行测定,通过对照标准曲线得到稀释后样品浊度。样品浊度按式(1)计算。
1.3.5 全蛋液流变性质的测定
采用Bohlin Gemini2旋转流变仪,在25 ℃下,选择2°/40 mm平板系统,1 mm平板间距,测定超声-辛烯基琥珀酰化全蛋液的流变行为。
全蛋液静态流变的测定:剪切速率为0~100 s-1。将所测得的表观黏度与剪切速率用幂律方程进行拟合,如式(2)所示。
式中:η为表观黏度/(Pa·s);K为黏性系数;ε为剪切速率/s-1;n为流动指数。
全蛋液动态流变的测定:对样品进行小振幅扫描,测定样品的弹性模量(G′)、黏性模量(G”)、损耗角正切(tanδ)。测定参数:扫描频率0.1~40 Hz;应变力1%。
1.3.6 溶解性的测定
将处理后样品取其上清液10 mL,于7 500 r/min下离心20 min,吸取5 mL上清液,采用Folin-Ciocalteu法[12]测定上清液中蛋白质量,蛋白质的溶解度按式(3)计算。
1.3.7 差示扫描量热法测定热稳定性
称取5.00~8.00 mg样品于铝坩埚内,样品均匀平铺于坩埚底部,密封后放入差示扫描量热(differential scanning calorimetry,DSC)仪样品室内[13]。测定程序为:将样品以10 ℃/min的升温速率从20 ℃加热到120 ℃,进行全蛋液热变性分析。
每个样品进行3 次重复实验,通过SPSS 19.0软件对测得的单因素试验数据进行方差分析,采用t检验进行显著性分析,显著性水平为P<0.05,采用Origin 8.0软件作图。
全蛋液通过预热、超声与OSA修饰相结合形成稳定的络合物,在同一温度不同OSA添加量、同一OSA添加量不同温度下表现出不同的分散状态。PDI反映蛋白质分子之间以及蛋白质和水分子之间作用力的改变:PDI越小,说明蛋白质颗粒粒径分布范围较小[14]。具体测定结果如表1、2所示。
表1 未超声条件下OSA添加量对全蛋液PDI的影响
Table 1 Effect of OSA dosages on PDI of liquid whole egg without ultrasonic treatment
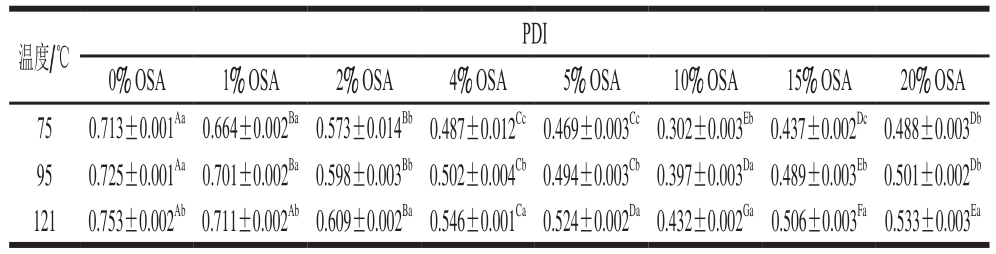
注:同行肩标大写字母不同表示差异显著(P<0.05);同列肩标小写字母不同表示差异显著(P<0.05)。表2同。
温度/℃PDI 0% OSA 1% OSA 2% OSA 4% OSA 5% OSA 10% OSA 15% OSA 20% OSA 75 0.713±0.001Aa0.664±0.002Ba0.573±0.014Bb0.487±0.012Cc0.469±0.003Cc0.302±0.003Eb0.437±0.002Dc0.488±0.003Db 95 0.725±0.001Aa0.701±0.002Ba0.598±0.003Bb0.502±0.004Cb0.494±0.003Cb0.397±0.003Da0.489±0.003Eb0.501±0.002Db 121 0.753±0.002Ab0.711±0.002Ab0.609±0.002Ba0.546±0.001Ca0.524±0.002Da0.432±0.002Ga0.506±0.003Fa0.533±0.003Ea
表2 超声条件下OSA添加量对全蛋液PDI的影响
Table 2 Effect of OSA dosages on PDI of liquid whole egg with ultrasonic treatment
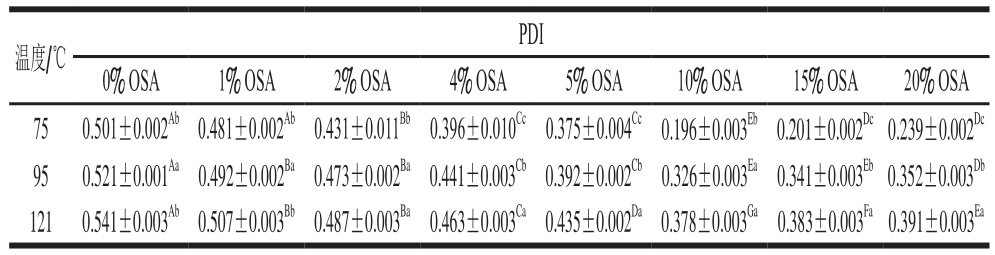
温度/℃PDI 0% OSA 1% OSA 2% OSA 4% OSA 5% OSA 10% OSA 15% OSA 20% OSA 75 0.501±0.002Ab0.481±0.002Ab0.431±0.011Bb0.396±0.010Cc0.375±0.004Cc0.196±0.003Eb0.201±0.002Dc0.239±0.002Dc 95 0.521±0.001Aa0.492±0.002Ba0.473±0.002Ba0.441±0.003Cb0.392±0.002Cb0.326±0.003Ea0.341±0.003Eb0.352±0.003Db 121 0.541±0.003Ab0.507±0.003Bb0.487±0.003Ba0.463±0.003Ca0.435±0.002Da0.378±0.003Ga0.383±0.003Fa0.391±0.003Ea
由表1、2可以看出,同一温度下,随着OSA添加量的增加,全蛋液PDI逐渐降低。表2中,75 ℃下,OSA添加量由0%增加至10%时,全蛋液PDI由0.501降为0.196(P<0.05);且在95 ℃和121 ℃下,OSA添加量由0%增加至10%时,全蛋液PDI由0.521和0.541分别减少至0.326和0.378(P<0.05)。结果表明OSA的加入使得全蛋液PDI显著减小(P<0.05),分散体系中粒径分布范围缩小,颗粒分散性较好[15],这可能是由于OSA的酰化作用降低了全蛋液的整体PDI,且与表1中未超声的辛烯基琥珀酰化全蛋液相比颗粒分散效果更好,因此,也可能是超声处理使得全蛋液通过静电作用得到修饰,降低了颗粒之间的相互作用,从而减小了颗粒粒径的分布范围[16]。当OSA添加量由10%增加至20%时,75 ℃下超声-辛烯基琥珀酰化全蛋液的PDI由0.196升为0.239(P<0.05);且在95 ℃和121 ℃下,超声-辛烯基琥珀酰化全蛋液PDI分别由0.326和0.378升至0.352和0.391(P<0.05)。随着OSA的添加量增加,分散体系中缩小的粒径分布范围又逐渐扩大,这可能是由于OSA添加量的逐渐增加使得蛋白质颗粒不易分散,颗粒总数增多,粒径分布范围变宽,且OSA添加量越大,酰化作用越剧烈,使得处理后全蛋液的蛋白质分散体系中大颗粒数越多[17]。同一添加量时,随着温度的升高,全蛋液的PDI呈增大的趋势,OSA添加量为10%时,鸡蛋全蛋液在75 ℃温度下PDI为0.196,95 ℃为0.326,121 ℃为0.378,差异显著(P<0.05)。同一添加量不同温度整体PDI排列顺序为:PDI75 ℃<PDI95 ℃<PDI121 ℃,说明对于相同OSA添加量,温度升高可以提高全蛋液PDI,表明蛋液粒径分布宽度增加,复合物大分子在溶液中的分散指数增大,溶液中颗粒分散性较差[18],这可能是由于加热诱导蛋白质变性,使得蛋白质分子间相互作用增强,颗粒更容易聚集,颗粒粒径增大。

图1 不同OSA添加量对75 ℃全蛋液粒径分布的影响
Fig. 1 Effect of OSA dosages on particle size distribution of liquid whole egg at 75 ℃

图2 不同OSA添加量对95 ℃全蛋液粒径分布的影响
Fig. 2 Effect of OSA dosages on particle size distribution of liquid whole egg at 95 ℃

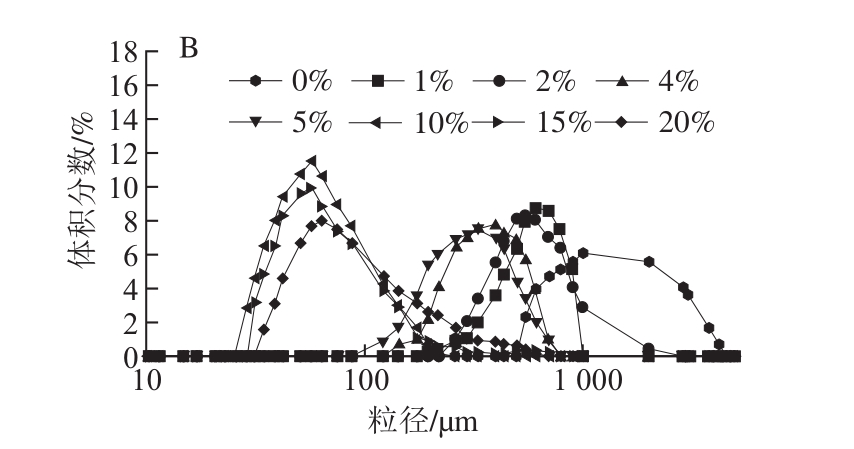
图3 不同OSA添加量对121 ℃全蛋液粒径分布的影响
Fig. 3 Effect of OSA dosages on particle size distribution of liquid whole egg at 121 ℃
综合图1~3可以看出,经OSA酰化处理后,随着OSA添加量的增加,粒径分布均逐渐左移,而且体积分数逐渐增大,这说明OSA使得全蛋液中大颗粒数量减少,大颗粒被分散成了小颗粒,分散体系分散性加强。当OSA添加量为10%时,3 种温度下的未超声与超声-辛烯基琥珀酰化全蛋液均表现为粒径最小,体积分数峰值达到最高。而继续加入OSA,分子粒径变大,这可能是由于过量OSA致使展开的疏水基团暴露形成可溶性复合物引起[19]。当OSA添加量相同时,随着温度的升高,粒径分布向右偏移且体积分数下降。在超声条件下,75 ℃时,添加10%的OSA,粒径分布在10.1~342.0 μm之间且分散体系颗粒峰位在21 μm,随着温度的升高,峰位向粒径较大处偏移。当加热到95 ℃时,OSA添加量为10%时的峰位达到40.01 μm。而温度到121 ℃时,OSA添加量为10%时的峰位则偏移至56.78 μm。这可能是由于加热使得蛋白质肽链逐渐展开,发生变性,形成不规则粒子,从而致使粒径增大[20]。也可能是由于全蛋液受热会引起分子结构发生变化,在其分子表面分布着大部分的疏水氨基酸,加热使得蛋白质之间相互作用增强,蛋白质颗粒更容易聚集,小颗粒的数量减少导致体积分数减小,大颗粒出现使得峰宽变宽[21]。但在3 种温度下,经过超声-辛烯基琥珀酰化处理后的全蛋液粒径均比未经处理的小,且向左偏移的趋势明显,这说明此手段能够在一定程度上改善全蛋液的受热稳定性。


图4 OSA添加量对全蛋液浊度的影响
Fig. 4 Effect of OSA dosages on turbidity of liquid whole egg
浊度指因样品的吸收或颗粒的散射而造成透射光的衰减,可以反映粒子的大小,表征溶液体系中颗粒的聚集程度和稳定性[22]。图4表示不同温度下未超声与超声-辛烯基琥珀酰化全蛋液浊度的变化。与未经处理的全蛋液相比,未超声与超声-辛烯基琥珀酰化全蛋液在3 个温度环境下浊度均呈下降趋势。且在超声时,同一温度下,随着OSA添加量的增加,浊度逐渐降低:75 ℃时,全蛋液浊度由OSA添加量为0%时的79.8%降低为OSA添加量为10%时的45.6%;95 ℃时,全蛋液浊度由OSA添加量为0%时的81.2%降低为OSA添加量为10%时的57.5%;121 ℃时,全蛋液浊度由OSA添加量为0%时的85.7%降低为OSA添加量为10%时的58.9%,且差异显著(P<0.05)。这可能是由于预热诱导蛋白质结构部分解开折叠使其与OSA更完全地结合,同时超声处理可以有效地提高体系的乳化效应,形成均匀的乳状体系[23],从而使浊度逐渐降低。也可能是随着蛋白质分子逐渐溶解,可溶性蛋白含量增加使得全蛋液浊度降低。而继续添加OSA会使经超声处理的全蛋液浊度有所回升:OSA添加量为15%,温度分别为75、95、121 ℃时,全蛋液浊度分别为47.4、59.8、60.6;添加OSA增至20%,温度分别为75、95、121 ℃时,全蛋液浊度分别为46.8、60.3、59.7,均显著增大(P<0.05)。这可能是由于全蛋液中的游离羧基部分水解而导致pH值下降,接近鸡蛋蛋白等电点,发生变性聚集,浊度变大[24]。且同一添加量下随着温度的升高,超声-辛烯基琥珀酰化全蛋液浊度虽在升高,但均低于未处理样液。这可能与鸡蛋蛋白在高温下发生的聚集作用有关,但超声-辛烯基琥珀酰化会减速蛋白可溶性聚集物的形成,从而使得全蛋液浊度降低,受热不易变性,热稳定性提高。
2.3.1 全蛋液的静态流变性质
静态流变学可以研究单一方向稳态剪切作用下聚合物流体的流动和形变,全蛋液的黏度与流变性质的变化会影响其加工、运输、设备的清洗等过程,而且会影响最终产品的品质。OSA添加量对全蛋液静态流变性质的影响结果如图5所示。
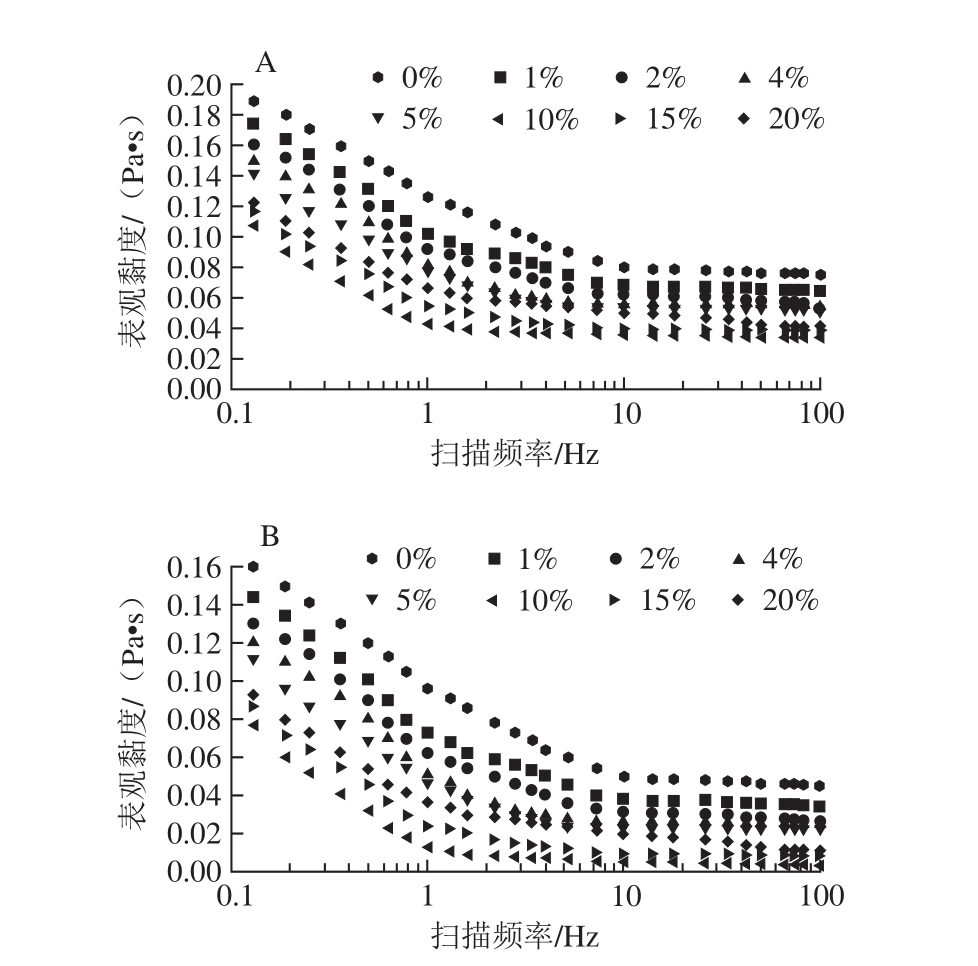
图5 OSA添加量对全蛋液静态流变性质的影响
Fig. 5 Effect of OSA dosages on static rheological properties of liquid whole egg
图5为全蛋液黏度在未超声和超声条件下随扫描频率及OSA添加量变化的曲线图。随着扫描频率的增加,全蛋液表观黏度均呈下降趋势。当扫描频率小于1时,黏度表现为线性下降;而当扫描频率继续增大时,黏度下降趋势趋于平缓。从图5中还可以看出,在OSA添加量为0~10%范围内,随着OSA添加量逐渐增大,全蛋液表观黏度逐渐变小,在10%时,表观黏度最低,说明OSA的添加使得全蛋液发生改性并分散了其聚集,这可能是由于全蛋液的静态流变性质与分子链的长短和聚集程度有关,支链越少,聚集程度越小的液体越容易发生剪切稀化,导致黏度下降,流动性增强[25]。继续添加OSA至15%、20%时,表观黏度又表现为逐渐增大,这可能是由于过量的OSA导致改性后的全蛋液又发生了变性并开始聚集[26]。但总体来看,与未经处理以及未超声酰化的全蛋液相比,经OSA与超声复合改性全蛋液的黏度降低,流动性增强,表明超声-辛烯基琥珀酰化复合改性可以有效改善全蛋液的流变性质。
2.3.2 全蛋液的动态流变性质
动态流变学可以研究周期动态作用下聚合物流体的流动和形变,其中G′、G′′和tan δ是重要的指标参数[27],图6、7分别为未超声和超声时不同OSA添加量全蛋液的G′与G′′频率扫描图以及扫描频率为20 Hz时的tan δ结果。

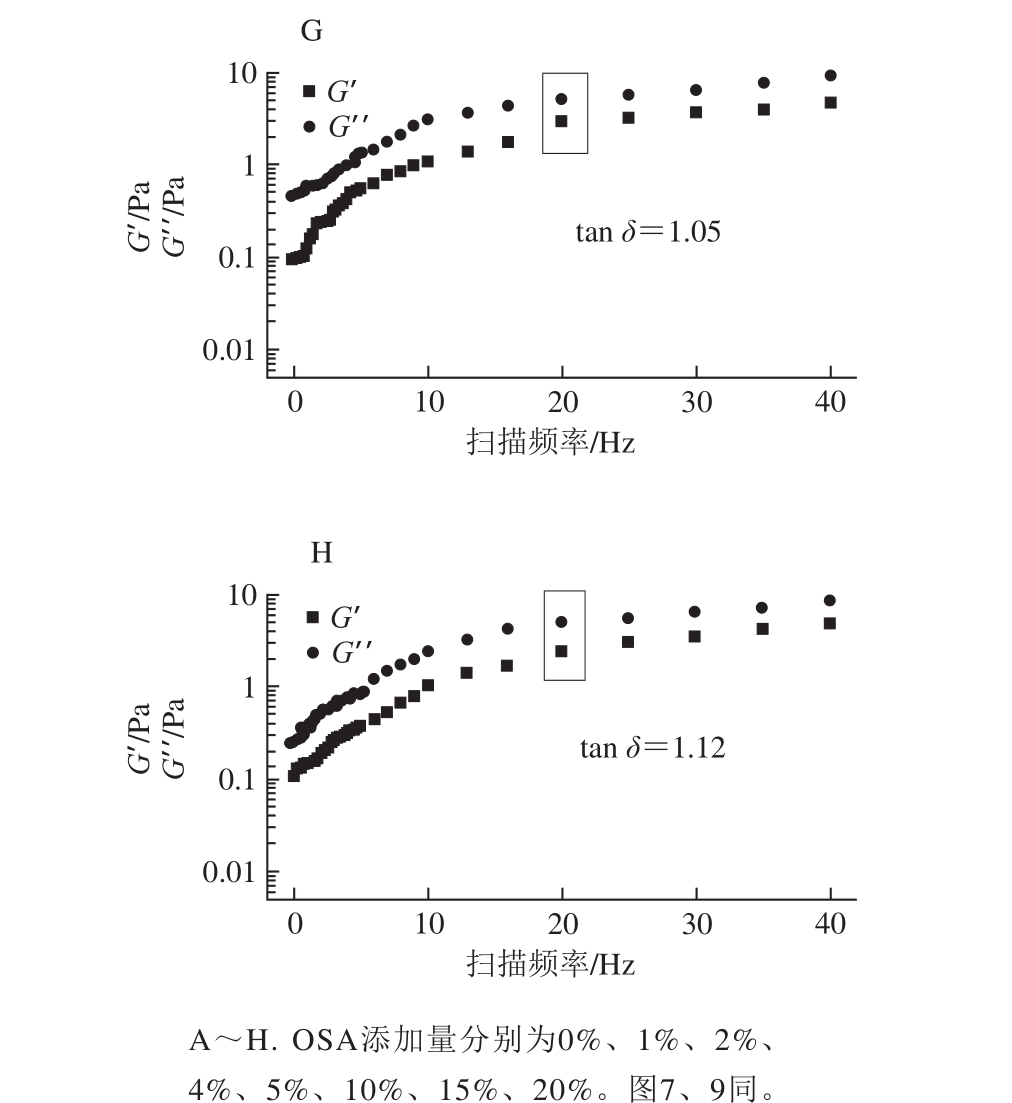
图6 未超声条件下不同OSA添加量全蛋液的G′与G′频率扫描图及tan δ
Fig. 6 G′ and G′′ versus frequency curves and tan δ of liquid whole egg modi fied with different dosages of OSA without ultrasonic treatment
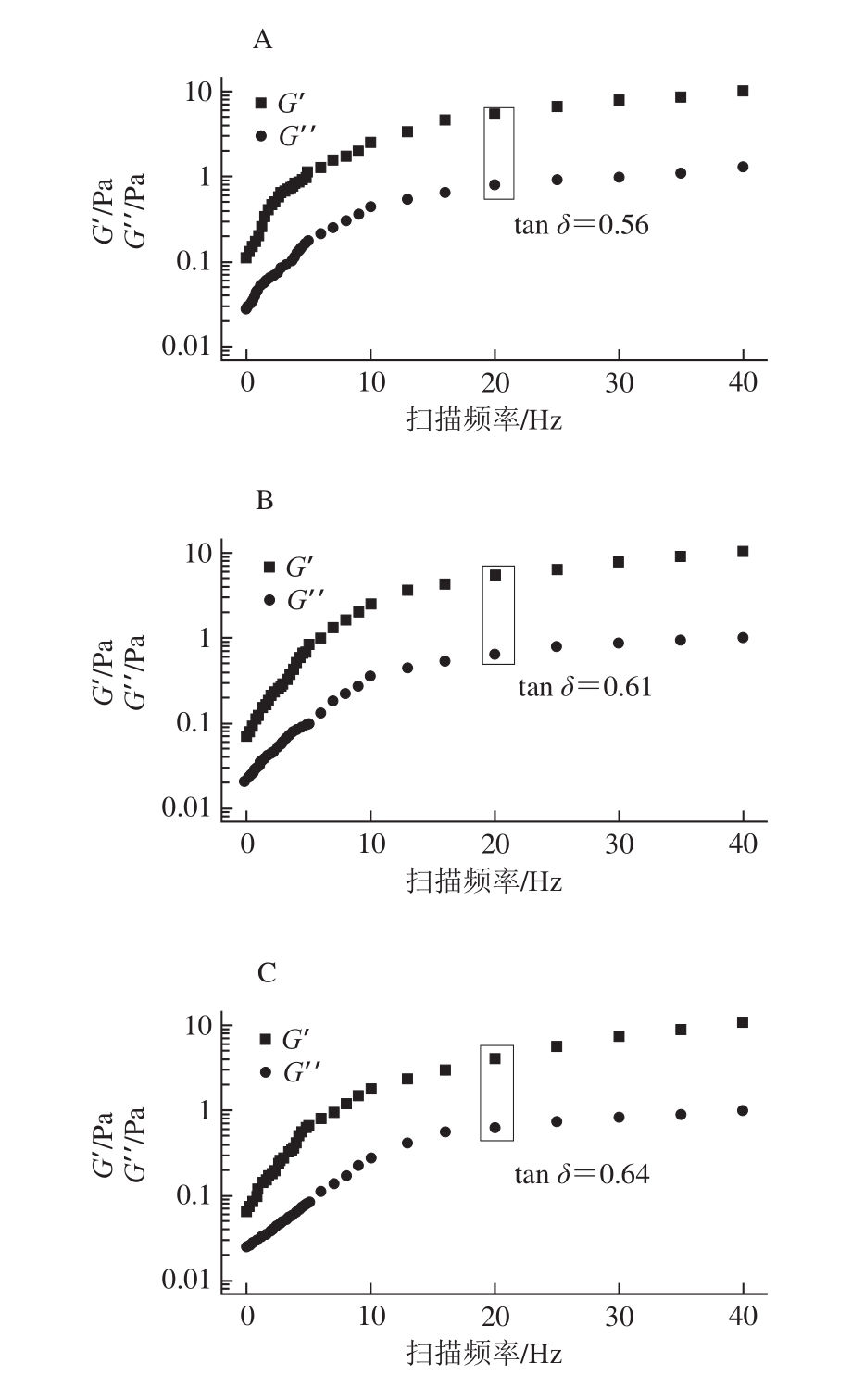
图7 超声条件下不同OSA添加量全蛋液的G′与G′频率扫描图及tan δ
Fig. 7 G′ and G′ versus frequency curves and tan δ of liquid whole egg modi fied with different dosages of OSA with ultrasonic treatment
由图6、7可知,未超声与超声-辛烯基琥珀酰化全蛋液的G′与G′′均随着扫描频率的增大而增加。对比两组图发现,OSA添加量为0%、1%、2%、4%、5%时,全蛋液G′′<G′(tan δ<1),说明其表现出类固体的性质,与凝固性酸奶的特性相似;而当OSA的添加量达到10%、15%、20%时,全蛋液的G′′>G′(tan δ>1),说明此时其表现的是流体性质。全蛋液由“类固体”向“流体”的转变说明其发生改性全蛋液体系中高聚物的含量减少,类固体特性逐渐减弱[28],稳定性不再容易受加热影响,且在超声时效果更明显,这可能是由于OSA与超声复合改性使蛋白质之间的相互作用得到改善,非极性蛋白间的相互作用减弱,从而对全蛋液的动态流变产生影响。tan δ由未处理时的0.56增加到最佳状态的OSA添加量(10%)时的1.12,而且在加入10% OSA时,G′与G′′总体较其他条件下小,这可能是由于全蛋液中蛋白质分子间相互作用力的减弱以及聚集体的分散都会促使全蛋液体现更低的G′与G′′[29],进而表现出更好的流体性质,为全蛋液的进一步深加工提供有利条件。
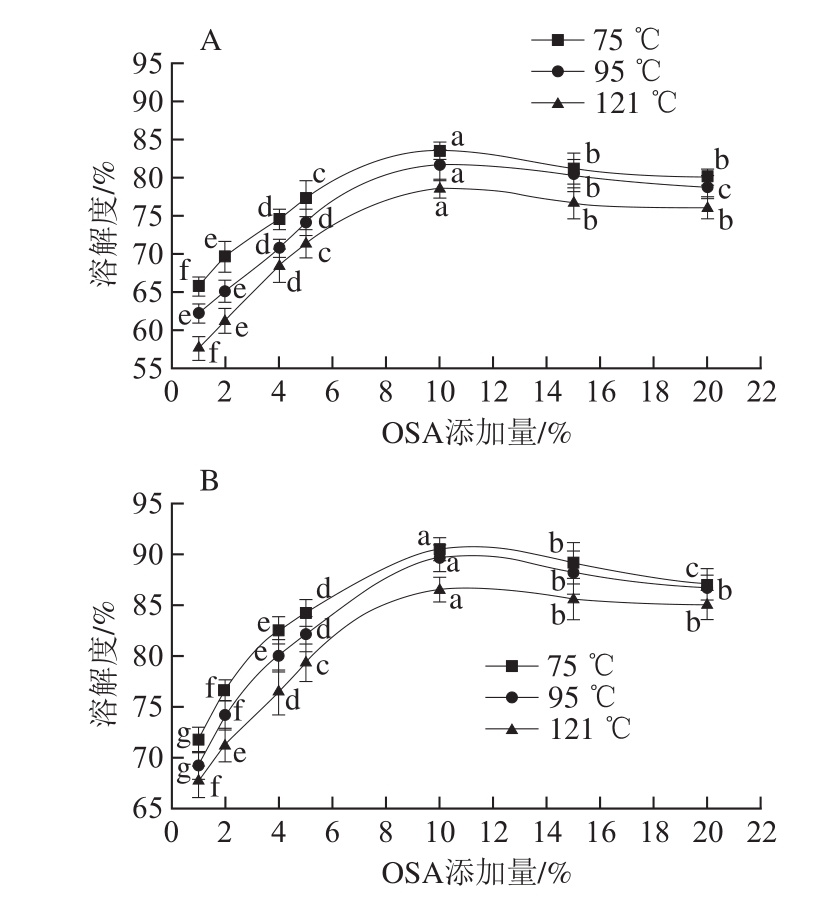
图8 OSA添加量对全蛋液溶解性的影响
Fig. 8 Effect of OSA dosages on solubility of liquid whole egg
全蛋液的溶解性是其与溶剂相互作用平衡的热力学表现形式,也是衡量热稳定性的关键因素[30]。鸡蛋受热时,其蛋白质之间发生疏水相互作用而变化和沉淀。研究表明,温度的提高会使得蛋液中的可溶性蛋白浓度降低,全蛋液稳定性降低。因此为了提高全蛋液的热稳定性,需要减小温度对其溶解性的影响。由图8可见,当OSA添加量在1%、2%、4%、5%、10%时,同一温度下的未超声与超声-辛烯基琥珀酰化全蛋液溶解度随着添加量增加而显著提高(P<0.05),且OSA添加量为10%时全蛋液溶解度达到最高,在超声条件下分别为90.6%(75 ℃)、89.7%(95 ℃)和86.6%(121 ℃),差异显著(P<0.05)。这可能是因为随着OSA琥珀酰化程度的增强,鸡蛋蛋白分子结构中不断引入亲水性基团,蛋白质分子部分展开,暴露的极性基团增多,使得其分子表面形成一种水化层[31],蛋白质在水中溶解度随之而增加,再加上超声处理的空化作用使可溶蛋白成分分散到溶剂中,使疏水性多肽部分展开朝向脂质而极性部分朝向水相[32];同时超声处理可以使
蛋清和蛋黄充分混合形成均一体系,有助于提高蛋白质的溶解度。而当OSA添加量达到15%、20%时,同一温度不同添加量下,全蛋液溶解度又趋向降低,在超声条件下,75 ℃时全蛋液溶解度分别为89.2%(OSA添加量为15%)和87.1%(OSA添加量为20%);95 ℃时全蛋液溶解度分别为88.3%(OSA添加量为15%)和86.8%(OSA添加量为20%);121 ℃时全蛋液溶解度分别为85.7%(OSA添加量为15%)和85.1%(OSA添加量为20%),与添加10% OSA相比显著降低(P<0.05)。这可能是由于辛烯基琥珀酰化增加到一定程度后,展开的蛋白质分子通过疏水相互作用形成聚集体导致蛋白质在水中的溶解性降低并趋向饱和[33]。
表3 未超声条件下不同OSA添加量全蛋液的DSC分析结果
Table 3 DSC analysis of liquid whole egg modified with different dosages of OSA without ultrasonic treatment
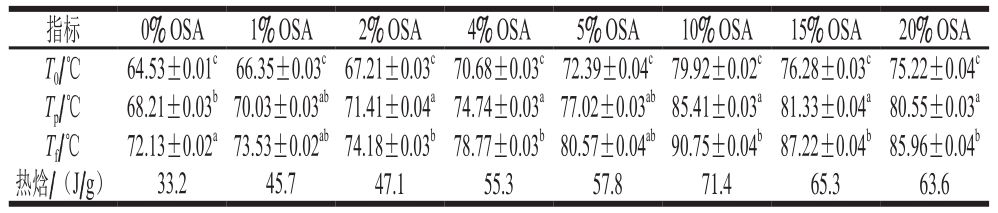
注:T0.起始温度;Tp.热变性温度;Tf.终止温度。同列肩标小写字母不同表示差异显著(P<0.05)。
指标 0% OSA 1% OSA 2% OSA 4% OSA 5% OSA 10% OSA 15% OSA 20% OSA T0/℃ 64.53±0.01c66.35±0.03c67.21±0.03c70.68±0.03c72.39±0.04c79.92±0.02c76.28±0.03c75.22±0.04c Tp/℃ 68.21±0.03b70.03±0.03ab71.41±0.04a74.74±0.03a77.02±0.03ab85.41±0.03a81.33±0.04a80.55±0.03a Tf/℃ 72.13±0.02a73.53±0.02ab74.18±0.03b78.77±0.03b80.57±0.04ab90.75±0.04b87.22±0.04b85.96±0.04b热焓/(J/g) 33.2 45.7 47.1 55.3 57.8 71.4 65.3 63.6
表4 超声条件下不同OSA添加量全蛋液的DSC分析结果
Table 4 DSC analysis of liquid whole egg modified with different dosages of OSA with ultrasonic treatment
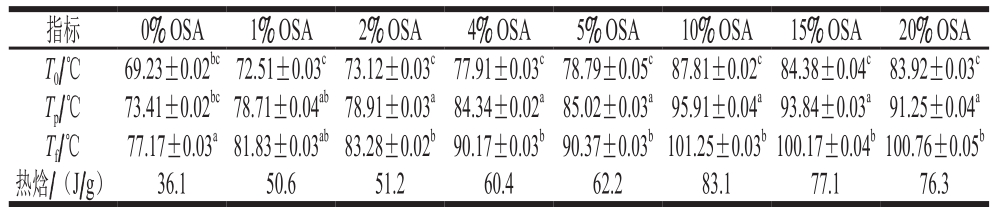
指标 0% OSA 1% OSA 2% OSA 4% OSA 5% OSA 10% OSA 15% OSA 20% OSA T0/℃ 69.23±0.02bc72.51±0.03c73.12±0.03c77.91±0.03c78.79±0.05c87.81±0.02c84.38±0.04c83.92±0.03c Tp/℃ 73.41±0.02bc78.71±0.04ab78.91±0.03a84.34±0.02a85.02±0.03a95.91±0.04a93.84±0.03a91.25±0.04a Tf/℃ 77.17±0.03a81.83±0.03ab83.28±0.02b90.17±0.03b90.37±0.03b101.25±0.03b100.17±0.04b100.76±0.05b热焓/(J/g) 36.1 50.6 51.2 60.4 62.2 83.1 77.1 76.3
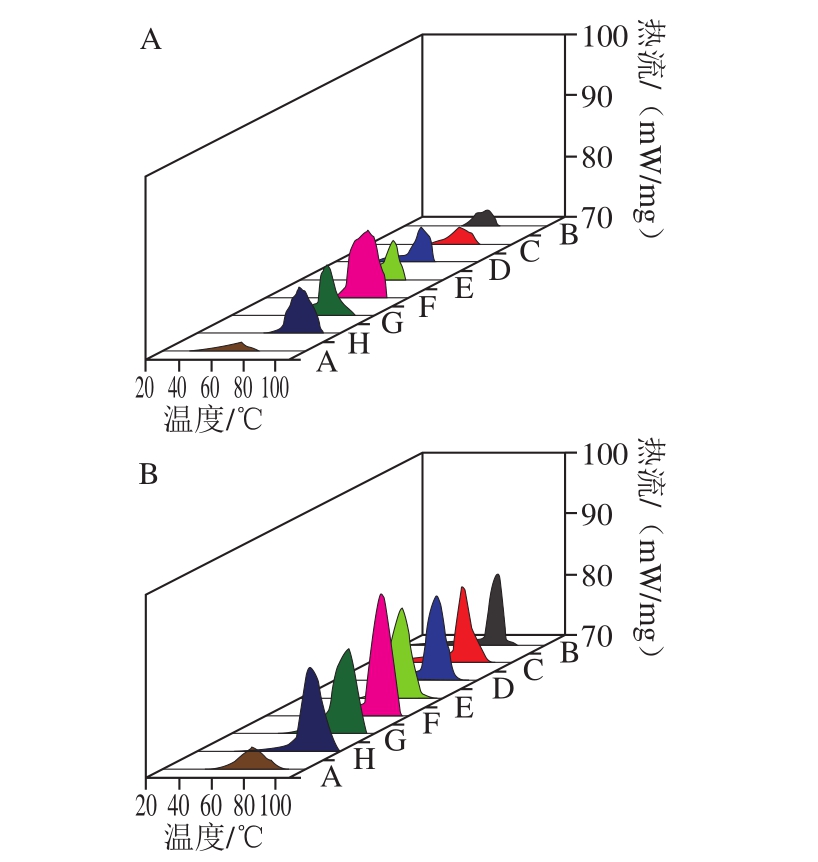
图9 不同OSA添加量全蛋液的DSC扫描结果
Fig. 9 DSC results of liquid whole egg modified with different dosages of OSA
DSC法用于测量蛋白的热变性温度(Tp)和热焓。本实验通过测定不同OSA添加量下鸡蛋全蛋液的热变性温度与热焓值来评价其热稳定性。测定结果如表3、4和图9所示。
表3、4反映了OSA对全蛋液热稳定性的影响。经过OSA酰化处理的全蛋液热变性温度及热焓均提高,且均在OSA为10%时达到最高,超声与OSA酰化结合处理时热变性温度从73.41 ℃(OSA添加量为0%)升高到95.91 ℃(OSA添加量为10%);热焓从36.1 J/g(OSA添加量为0%)增大至83.1 J/g(OSA添加量为10%),说明超声-辛烯基琥珀酰化处理后,蛋白质构象发生变化,蛋白质结构更加稳定。这可能是由于辛烯基琥珀酰化改性将琥珀酰基(HOOCCH2CH2—CO—)共价交联到蛋白质中赖氨酸残基的ε-氨基上,琥珀酰基上有一个亲水性极强的羧基,从而将蛋白质的氨基阳离子用阴性的琥珀酰基封闭,蛋白质净负电荷增加,正电荷减少[34]。增加的净负电荷使得疏水作用所需的自由能增加,进而阻止了蛋白质结构展开。也可能是由于OSA中羧基与蛋白质中氨基的相互作用使得蛋白质分子间聚集程度增加[35]。而全蛋液的热变性过程与氢键断裂有关,变性的蛋白质分子结构展开,与折叠状态相比,全蛋液中的氢键断裂所需的自由能降低从而容易发生热变性[36];因此全蛋液蛋白质分子之间的聚集程度越强,氢键断裂所需的自由能越大,越难发生热变性。从图9可以看出,随着OSA添加量的增加,峰形越来越尖锐,这说明OSA使得全蛋液的热焓逐渐变大,同时说明其热稳定性得到了改善。在超声且OSA添加量为10%时,热变性温度达到最大,为95.91 ℃,且峰形最尖锐,这可能是因为折叠的蛋白质分子内部阴离子与阳离子基团之间存在分子内引力[37],聚集程度达到最大,而继续加入OSA会使得蛋白质内部疏水基团暴露,蛋白质之间发生强烈的静电排斥,疏水性增加,蛋白质结构又会渐渐伸展[38],则会引起热变性温度下降,热焓降低,热稳定性下降。
通过OSA与超声复合处理全蛋液,发现全蛋液的静态流变和动态流变特性均发生变化,主要表现为黏度降低,流动性增强,出现类固体向流体转变的现象,从而降低了受热对全蛋液稳定性的影响,这表明OSA与超声复合处理可对全蛋液蛋白起到改性的效果,提高热稳定性,有利于全蛋液的实际应用。同时从PDI以及粒径的分布现象发现超声-辛烯基琥珀酰化改性全蛋液分散体系中粒径分布范围缩小,颗粒分散性较好。75、95、121 ℃下全蛋液的溶解性和浊度也都得到了改善,且均在OSA添加量为10%时表现为最佳,溶解度分别为90.6%、89.7%和86.6%,浊度分别为45.6%、57.5%和58.9%。通过DSC分析发现,在添加10% OSA处理与超声处理结合时,全蛋液的热变性温度由未经处理时的73.41 ℃增加到95.91 ℃,且热焓由36.1 J/g增大到83.1 J/g。综上所述,在OSA添加量为10%时与超声结合改性可以使得全蛋液的热变性温度提高,增强其热稳定性。
[1] 刘俊梅, 王丹, 李琢伟, 等. 高剪切分散乳化法提高蛋清蛋白质的热稳定性[J]. 粮油加工, 2014(6): 67-70.
[2] 刘剑秋, 迟玉杰. 通过酶改性技术提高鸡蛋的热凝固温度[J]. 食品与发酵工业, 2003, 29(10): 99-101. DOI:10.13995/j.cnki.11-1802/ts.2003.10.025.
[3] 刘俊梅, 王丹, 李琢伟, 等. 酶法提高蛋清蛋白热稳定性的研究[J]. 粮油加工, 2014(5): 66-70. DOI:10.3969/j.issn.2095-6495.2014.05.015.
[4] LYDIA C, VASSILIONS, STEPHEN R E. Heat stability and emulsifying ability of whole egg and egg yolk as related to heat treatment[J]. Food Hydrocolloids, 2005, 19: 533-539. DOI:10.1016/j.foodhyd.2004.10.031.
[5] ONG H N, ARUMUGAM B, TAYYAB S. Succinylation-induced conformational destabilization of lysozymeas studied by guanidine hydrochloride denaturation[J]. Journal of Biochemistry, 2009, 146(6):895-904. DOI:10.1093/jb/mvp136.
[6] ZHAO Y, MA C Y, YUEN S N, et al. Study of succinylated food proteins by raman spectroscopy[J]. Journal of Agricultural and Food Chemistry, 2004, 52(7): 1815-1823. DOI:10.1021/jf030577a.
[7] 康豫博, 朱益佳, 蔺锋, 等. 超细颗粒物超声波团聚的影响因素[J].上海交通大学学报, 2016, 50(4): 551-556. DOI:10.16183/j.cnki.jsjtu.2016.04.012.
[8] ARZENI C, PEREZ O E, PILOSOF A M R, et al. Functionality of egg white proteins as affected by high intensity ultrasound[J].Food Hydrocolloids, 2012, 29(2): 308-316. DOI:10.1016/j.foodhyd.2012.03.009.
[9] YANG Xue, LI Yunliang, LI Suyun, et al. Effects of ultrasoundassisted α-amylase degradation treatment with multiple modes on the extraction of rice protein[J]. Ultrasonics-Sonochemistry, 2018, 40:890-899. DOI:10.1016/j.ultsonch.2017.08.028.
[10] HEGG P, MARTENS H, LOFQVIST B, et al. The protective effect of sodium dodecylsulphate on the thermal precipitation of conalbumin.a study on thermal aggregation and denaturation[J]. Journal of the Science of Food and Agriculture, 1978, 29(3): 245-260.
[11] CHARLWIT K, WANG C, YU C, et al. Combination of treatments to improve thermal stability of egg albumen[J]. LWT-Food Science and Technology, 2016, 72: 267-276. DOI:10.1016/jlwt.2016.04.047.
[12] 江楠, 李潇彬, 顾曼琦, 等. Folin-Ciocalteu比色法测定头花蓼多酚含量[J]. 安徽农业科学, 2017, 45(23): 114-115; 135. DOI:10.13989/jcnki0517-6611.2017.23.037.
[13] LEONE R, COLMAN T, SCHNITZLER E, et al. Evolved gas analysis (coupled TG-DSC-FT-IR) applied in the study of fructooligosaccharides from chicory[J]. Journal of Microbiology Biotechnology and Food Sciences, 2017, 4(1): 10-12.
[14] 刘燕燕, 曾新安, 刘克放. 脉冲电场对大豆分离蛋白分散体系颗粒粒径影响[J]. 食品科学, 2009, 30(9): 73-76. DOI:10.3321/j.issn:1002-6630.2009.09.017.
[15] BANDAI T, HAMAMOTO S, GABRIEL C, et al. The effect of particle size on thermal and solute dispersion in saturated porous media[J]. International Journal of Thermal Sciences, 2017, 122: 74-84.DOI:10.1016/j.ijthermmalsci.2017.08.003.
[16] MARTIN S, WALSH M. Sensory characteristics and functionality of sonicated whey[J]. Food Research International, 2012, 49(2): 694-701.DOI:10.1016/j.foodres.2012.09.018.
[17] 雷丹丹. 辛烯基琥珀酸玉米糊精酯自聚集体的构建及其在姜黄素增溶中的研究[D]. 重庆: 西南大学, 2014: 27-30.
[18] ZHANG Z, ARRIGHI V, CAMPBELL L, et al. Properties of partially denatured whey protein products 2: solution flow properties[J]. Food Hydrocolloids, 2016, 56: 218-226. DOI:10.1016/j.foodhyd2015.12.012.
[19] 陈俊博. 全蛋液/粉贮藏过程凝胶性劣变机制及其控制[D]. 无锡: 江南大学, 2013: 8-9.
[20] FATHNIA M, KHATAEE A. Photocatalytic ozonation of phenazopyridine using TiO2 nanoparticles coated on ceramic plates:mech-anistic studies, degradation intermediates and ecotoxicological assesments[J]. Applied Catalysis A: General, 2015, 491(8): 136-154.DOI:10.1016/j.apcata.2014,10.049.
[21] 沙菲, 仝其根, 王芳, 等. 鸡蛋发酵食品(蛋腐乳)工艺探索与优化[J]. 食品工业科技, 2017, 38(18): 140-144. DOI:10.13386/j.issn1002-0306.2017.18.027.
[22] MEKHLOUFI G, SANCHEZ C, RENARD D, et al. pH-Induced structural transitions during complexation and coacervation of betalactoglobulin and acacia gum[J]. Langmuir, 2015, 21(1): 386-394.DOI:10.1021/la0486786.
[23] 魏本喜, 张晓红, 管小宇, 等. 辛烯基琥珀酸白糊精酯的制备与乳化性质[J]. 食品与发酵工业, 2013, 39(11): 58-61.
[24] 吴梨. 高压脉冲电场作用下蛋清蛋白聚集机理与抑制聚集方法研究[D]. 无锡: 江南大学, 2015: 28-29.
[25] CHEN H Y, WU F F, DUAN X, et al. Characterization of emulsions prepared by egg yolk phosvitin with pectin, glycerol and trehalose[J].Food Hydrocolloids, 2013, 30(1): 123-129. DOI:10.1016/j.foodhyd.2012.05.007.
[26] 李云飞, 殷涌光, 徐树来. 食品物性学[M]. 北京: 中国轻工业出版社,2010: 42-43.
[27] SONG Y H, ZHENG Q. Dynamic rheological properties of wheat fl our dough and proteins[J]. Trends in Food Science & Technology,2007, 18(3): 132-138. DOI:10.13684/j.cnki.spkj.2012.11.040.
[28] 张正茂, 李纪亮. 机械活化-酯化复合改性淀粉的物化特性研究[J].食品研究与开发, 2016, 37(13): 5-9.
[29] 熊礼橙, 牛猛, 张宾佳, 等. 麦麸粒径对全麦面团流变学特性的影响[J]. 食品工业科技, 2017, 38(2): 98-103; 110. DOI:10.13386/j.issn1002-0306.2017.02.010.
[30] 苏宇杰, 徐珍珍, 乔立文, 等. 均质处理对鸡蛋全蛋液功能性质的影响[J]. 食品与发酵工业, 2013, 39(2): 97-101.
[31] CHARLWIT K, WANG T, HAN Z, et al. Improving albumen thermal stability using succinylation reaction with octenyl succinic anhydride[J]. Food Science and Technology, 2016, 73: 630-639.DOI:10.1016/j.lwt.2016.07.003.
[32] 乔立文, 杨新宇, 杨严俊, 等. 热处理对于鸡蛋全蛋液功能性质的影响[J]. 食品工业科技, 2011, 32(11): 134-137. DOI:10.13386/j.issn1002-0306.2011.11.075.
[33] 余晶梅. 荧光探针法和疏水相互作用层析法分析蛋白表面疏水性[D].杭州: 浙江大学, 2014: 29-32.
[34] 杨敏, 杨继涛, 杨晰, 等. 食品蛋白质的琥珀酰化修饰研究进展[J].食品工业科技, 2015, 36(5): 396-399.
[35] MONSELLIER E, REDEKER V, RUIZ-ARLANDIS G, et al.Molecular interaction between the chaperone Hsc70 and the N-terminal flank of huntingtin exon1 modulates aggregation[J]. Journal of Biological Chemistry, 2015, 290(5): 2560-2576. DOI:10.1074/jbc.M114.60332.
[36] 李睿, 王勇章, 李智, 等. 转谷氨酰胺酶添加量对鸡蛋全蛋液热凝固性的影响[J]. 食品与发酵科技, 2014, 50(2): 36-38.
[37] MUSIAL B A, MATIN M N, DANIELSON N D. Effect of an anionic polymer on the separation of cationic molecules by capillary electrophoresis with conductivity detection[J]. Journal of Separation Science, 2015, 25(5/6): 311-318. DOI:10.1002/1615-9314(20020401)25:5/6.
[38] 白俊堃, 肖志刚, 王鹏, 等. 超声促聚集行为对红小豆蛋白结构及功能影响的研究[J]. 粮食与油脂, 2017, 30(4): 80-84.
Improved Thermostablity of Liquid Whole Egg by Octenyl Succinic Anhydride Modification Combined with Ultrasound Treatment
CAO Wenhui, XU Lina, LI Tong, et al. Improved thermostablity of liquid whole egg by octenyl succinic anhydride modification combined with ultrasound treatment[J]. Food Science, 2019, 40(7): 135-143. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20180115-193. http://www.spkx.net.cn