据统计,全球大约有4%的死亡与酗酒有关,已成为国际性的公共卫生问题[1-2]。酒精性肝损伤(alcoholic liver injury,ALD)的发病机制复杂多样,包括免疫功能及脂质代谢紊乱、氧化应激等因素,其中,免疫功能失调在酒精性肝损伤的发生发展中扮演着十分重要的角色[3]。纳豆是大豆经枯草芽孢杆菌发酵成的豆制品,在发酵过程中,枯草芽孢杆菌可分泌大量纳豆激酶,这是一种碱性丝氨酸蛋白酶,以其较强的溶栓能力著称[4],此外,还具有降血压[5]、降血糖[6]、抗氧化[7]等功效。研究显示,纳豆能提高醉酒小鼠肝脏乙醇脱氢酶活性,拮抗酒精引起的肝脏超氧化物歧化酶活力降低和丙二醛含量升高,抑制肝组织肿瘤坏死因子-α基因表达,保护酒精性肝损伤[8];有研究表明,纳豆芽孢杆菌能显著提高鸡脾脏中T淋巴细胞和B淋巴细胞的比例,增强免疫功能[9];纳豆激酶被认为是纳豆中最活跃的功能性成分之一,以上研究均提示,纳豆保护酒精性肝损伤及其改善免疫功能可能是其中的纳豆激酶成分发挥了作用,但关于纳豆激酶能否通过调节免疫功能改善酒精性肝损伤的研究鲜有报道。因此,本研究以纳豆激酶为干预物,以酒精性肝损伤大鼠为研究对象,通过测定其肝脏功能指标和免疫水平指标,初步探讨纳豆激酶对酒精性肝损伤大鼠的改善效果及其免疫增强机制。
S P F级雌性W i s t a r大鼠,8 周龄,体质量180~220 g,购自山东鲁抗医药股份有限公司,许可证号:SCXK(鲁)2014-0007。
纳豆激酶粉(530.39 FU/g) 汤臣倍健股份有限公司;甘利欣(甘草酸二胺胶囊) 江苏正大天晴药业股份有限公司;白酒(酒精体积分数56%) 北京红星股份有限公司;抗TCRαβ-FITC抗体、抗CD161a-PE抗体 美国BD Biosciences公司;抗CD3-FITC抗体、抗 CD4-PE抗体、抗 CD8a-APC抗体 美国BioLegend公司。
Shandon半自动组织包埋机 美国Thermo公司;LKB-5超薄切片机 瑞典LKB公司;JEM1200EX透射电子显微镜 日本电子株式会社;600型全自动生化分析仪日本日立公司;Accuri C6型流式细胞仪 美国BD公司。
1.3.1 动物模型建立及分组
饲喂普通饲料,自由饮水,适应性喂养1 周,采用随机数字表法按体质量随机分为5 组,每组12 只。正常对照组给予生理盐水灌胃;酒精模型组给予白酒灌胃(第1周灌胃6 mL/(kg·d mb),第2周灌胃8 mL/(kg·d mb),第3周灌胃1 0 m L/(k g·d mb),第4~1 0周灌胃11 m L/(k g·d mb);纳豆激酶对照组给予530.39 FU/(kg·d mb)纳豆激酶灌胃;纳豆激酶干预组给予530.39 FU/(kg·d mb)纳豆激酶和酒精灌胃;甘利欣干预组给予200 mg/(kg·d mb)甘利欣和酒精灌胃。后两组灌胃受试物1 h后给予酒精,酒精剂量同酒精模型组,其他组在同等时间给予等量生理盐水灌胃,实验持续10 周。
1.3.2 标本的收集与指标检测
末次灌胃后禁食不禁水12 h,依次称质量后给予质量分数3%戊巴比妥钠麻醉,腹主动脉取血,留取部分全血用于流式细胞术测免疫细胞比例,剩余血离心分离血清用于生化指标检测,留取肝、脾组织,脾称质量,固定部分肝脏用于组织病理学观察和超微结构观察,其余-80 ℃保存用于后续实验。
1.3.3 肝组织病理学观察
取肝组织(1.0 cm×1.0 cm×1.0 cm),用体积分数10%中性甲醛固定后,常规石蜡包埋、切片、脱蜡、苏木精-伊红(hematoxylin and eosin,HE)染色,中性树胶封片,光学显微镜下观察各组大鼠肝脏形态学改变。
1.3.4 肝组织超微结构观察
取各组肝组织样品,体积均为l mm×l mm×l mm,质量分数3%戊二醛固定24 h,0.1 mol/L pH 7.2磷酸盐缓冲液(phosphate buffered saline,PBS)漂洗3 次;l%锇酸固定l h,pH 7.2 PBS漂洗3 次;丙酮逐级脱水,环氧树脂(EPON8l2)包埋,温箱固化,超薄切片,醋酸双氧铀和柠檬酸铅双重染色,透射电子显微镜观察大鼠肝细胞超微结构。
1.3.5 肝功指标测定
采用全自动生化分析仪检测血清谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、γ-谷氨酰转肽酶(gamma-glutamyl transpeptidase,GGT)、胆碱酯酶(cholinesterase,CHE)活力。
1.3.6 脾指数的计算
根据1.3.2节方法取样并称质量后,按下式计算脾指数。
1.3.7 T淋巴细胞亚群及自然杀伤(natural killer,NK)细胞检测
每只大鼠腹主动脉取全血(抗凝)分3 支试管,每支试管100 μL,分别加入300 μL红细胞裂解液,漩涡混匀,冰上放置15 min;4 ℃、450×g离心10 min分离沉淀白细胞,吸弃上清液;向白细胞沉淀中加入200 μL红细胞裂解液,重复上述步骤1 次。向各个试管中加入100 μL pH 7.2 PBS,分别加入3种抗体组合:抗CD3-FITC 1 μL/抗 CD4-PE 2.5 μL、抗CD3-FITC 1 μL/抗CD8a-APC 1 μL、抗TCRαβ-FITC 2 μL/抗CD161a-PE 3 μL(将正常对照组分5 个单染对照,分别只加其中一种抗体,剂量同上);轻轻振荡混匀,室温避光孵育30 min,加2 mL PBS,400×g离心5 min,弃上清液后加1 mL PBS,采用流式细胞仪进行检测。
采用SPSS 18.0软件进行数据处理和统计学分析,方差齐的数据以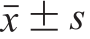 表示,多组间比较采用单因素方差分析,组内两两比较采用最小显著性差异法-t检验,检验标准均为α=0.05。
表示,多组间比较采用单因素方差分析,组内两两比较采用最小显著性差异法-t检验,检验标准均为α=0.05。

图1 大鼠肝组织HE染色观察
Fig. 1 HE staining of liver tissues in rats
由图1可知,正常对照组和纳豆激酶对照组大鼠肝小叶结构清晰,肝细胞索以中央静脉为中心呈放射状排列,细胞排列整齐,胞浆完整充盈;酒精模型组大鼠肝小叶结构模糊,肝索排列紊乱,可见大小不等、形状不一的胞浆空泡和脂肪变性,中央静脉和汇管区可见大量炎性细胞浸润;与酒精模型组相比,纳豆激酶干预组肝细胞损伤程度明显减轻,肝索排列较为整齐,有少量空泡和脂滴,散在可见炎性细胞浸润;甘利欣干预组大鼠肝小叶结构清晰,偶见空泡和脂滴,肝窦无扩张,肝细胞无明显变性、坏死等形态学改变,汇管区有少量炎细胞浸润。
由图2可知,正常对照组和纳豆激酶对照组大鼠肝细胞核呈圆形或椭圆形,核膜完整清晰,线粒体形态正常,粗面内质网排列整齐,核糖体丰富;酒精模型组细胞核出萎缩、变形等改变,线粒体数量减少,粗面内质网扩张断裂,排列紊乱无序,核糖体脱落稀疏,溶酶体数量增加;与酒精模型组相比,纳豆激酶干预组细胞核明显恢复,线粒体病变明显减轻且数目增加,粗面内质网断裂与排列紊乱程度改善,溶酶体数量减少;甘利欣干预组大鼠核膜较规则,线粒体结构正常,粗面内质网排列较整齐,核糖体数量相对增多,偶见溶酶体。
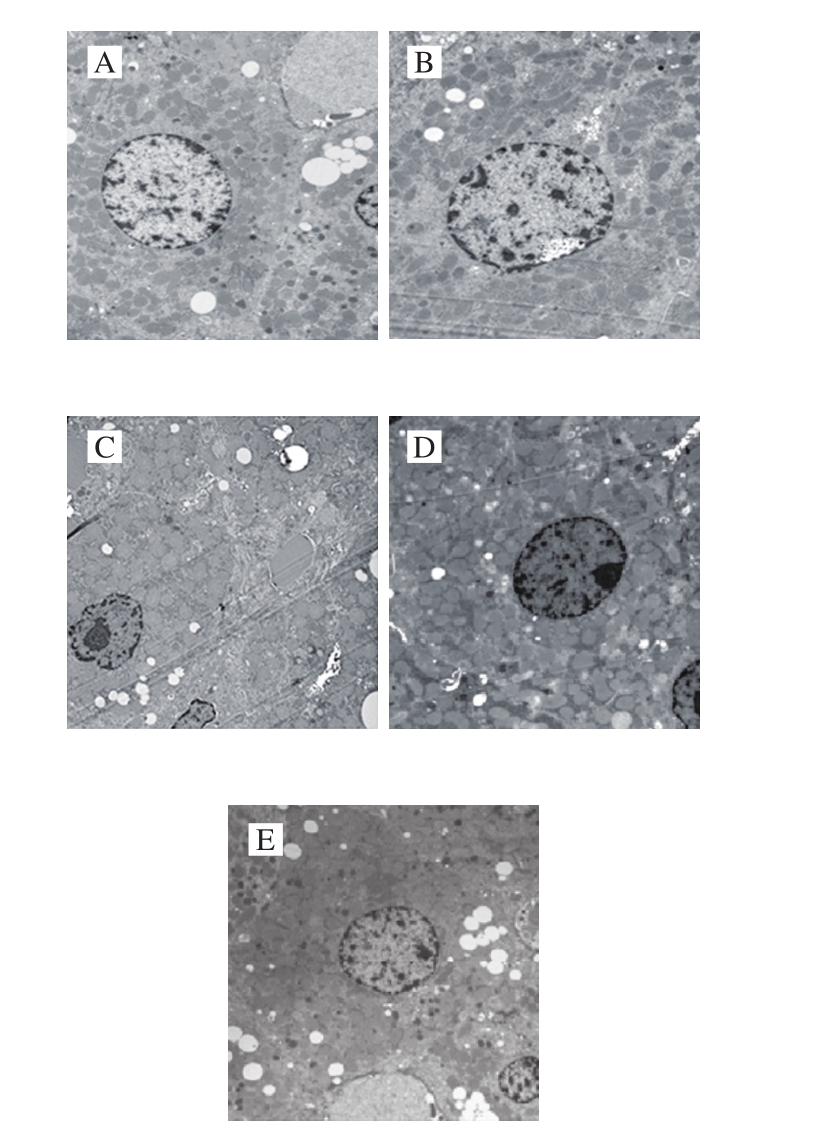
图2 大鼠肝组织超微结构
Fig. 2 Ultrastructure of rat liver tissues
表1 纳豆激酶对大鼠血清ALT、AST、GGT、CHE活力的影响(n=12)
Table 1 Changes in serum levels of ALT, AST, GGT and CHE in rats from different groups (n= 12)
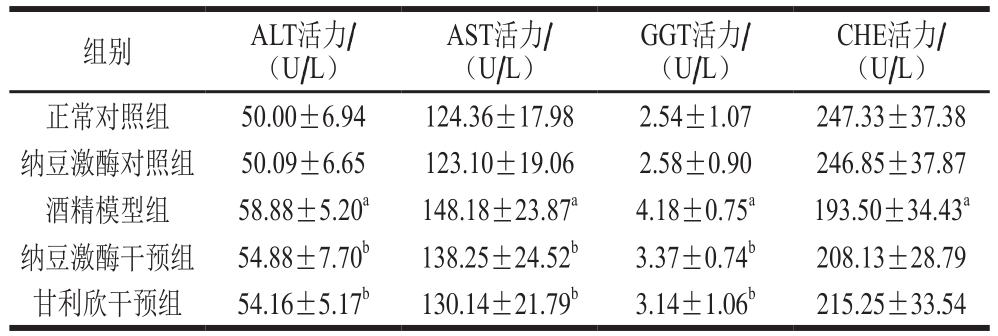
注:a.与正常对照组相比差异显著(P<0.05);b.与酒精模型组相比差异显著(P<0.05)。下同。
CHE活力/(U/L)正常对照组 50.00±6.94 124.36±17.98 2.54±1.07 247.33±37.38纳豆激酶对照组 50.09±6.65 123.10±19.06 2.58±0.90 246.85±37.87酒精模型组 58.88±5.20a 148.18±23.87a 4.18±0.75a 193.50±34.43a纳豆激酶干预组 54.88±7.70b 138.25±24.52b 3.37±0.74b 208.13±28.79甘利欣干预组 54.16±5.17b 130.14±21.79b 3.14±1.06b 215.25±33.54组别 ALT活力/(U/L)AST活力/(U/L)GGT活力/(U/L)
由表1可知,与正常对照组相比,酒精模型组大鼠血清ALT、AST、GGT活力显著上升(P<0.05),CHE活力显著下降(P<0.05);与酒精模型组相比,纳豆激酶干预组和甘利欣干预组大鼠血清ALT、AST、GGT活力均显著下降(P<0.05),CHE活力有一定程度上升,其中,纳豆激酶干预组大鼠血清ALT、AST、GGT活力下降程度和CHE活力上升程度均低于甘利欣干预组。纳豆激酶对照组与正常对照组相比各指标无明显变化。
由表2可知,与正常对照组相比,酒精模型组大鼠体质量、脾质量和脾指数均显著降低(P<0.05);与酒精模型组相比,纳豆激酶干预组和甘利欣干预组大鼠体质量、脾质量和脾指数均有不同程度增高,其中脾指数显著增高(P<0.05),纳豆激酶干预组各指标增高程度均高于甘利欣干预组,纳豆激酶对照组与正常对照组相比各指标无明显变化。
表2 纳豆激酶对大鼠脾指数的影响(n=12)
Table 2 Changes in spleen index in rats from different groups (n= 12)
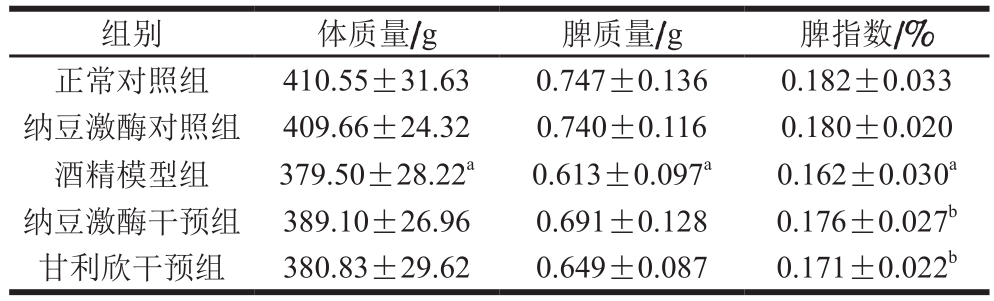
组别 体质量/g 脾质量/g 脾指数/%正常对照组 410.55±31.63 0.747±0.136 0.182±0.033纳豆激酶对照组 409.66±24.32 0.740±0.116 0.180±0.020酒精模型组 379.50±28.22a 0.613±0.097a 0.162±0.030a纳豆激酶干预组 389.10±26.96 0.691±0.128 0.176±0.027b甘利欣干预组 380.83±29.62 0.649±0.087 0.171±0.022b
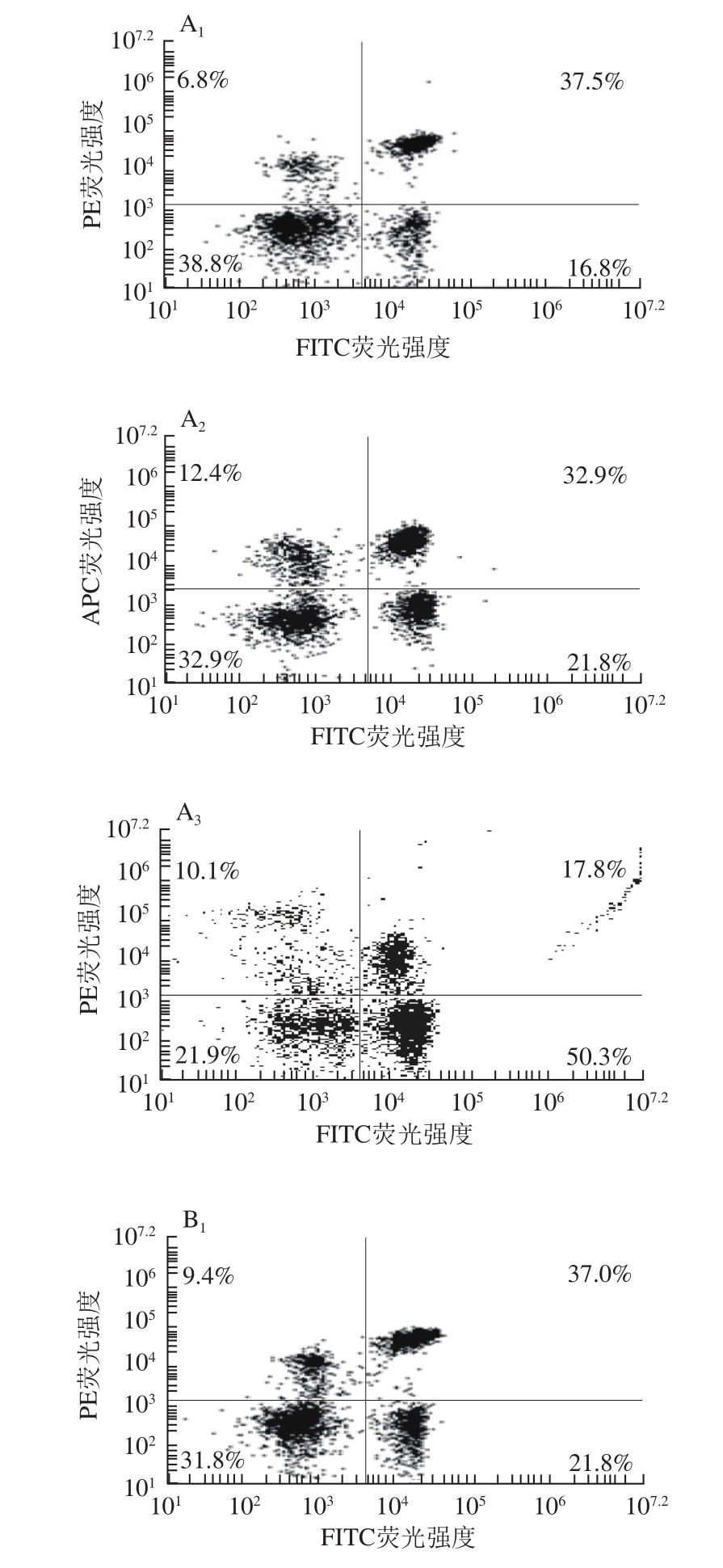
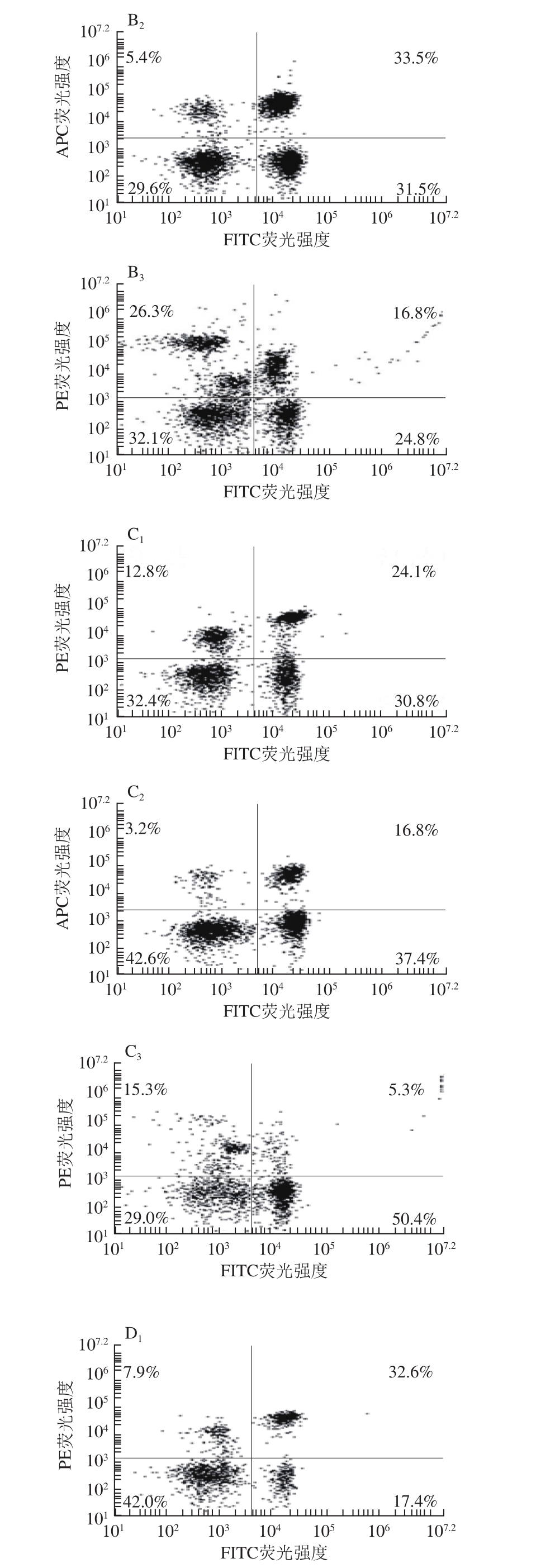
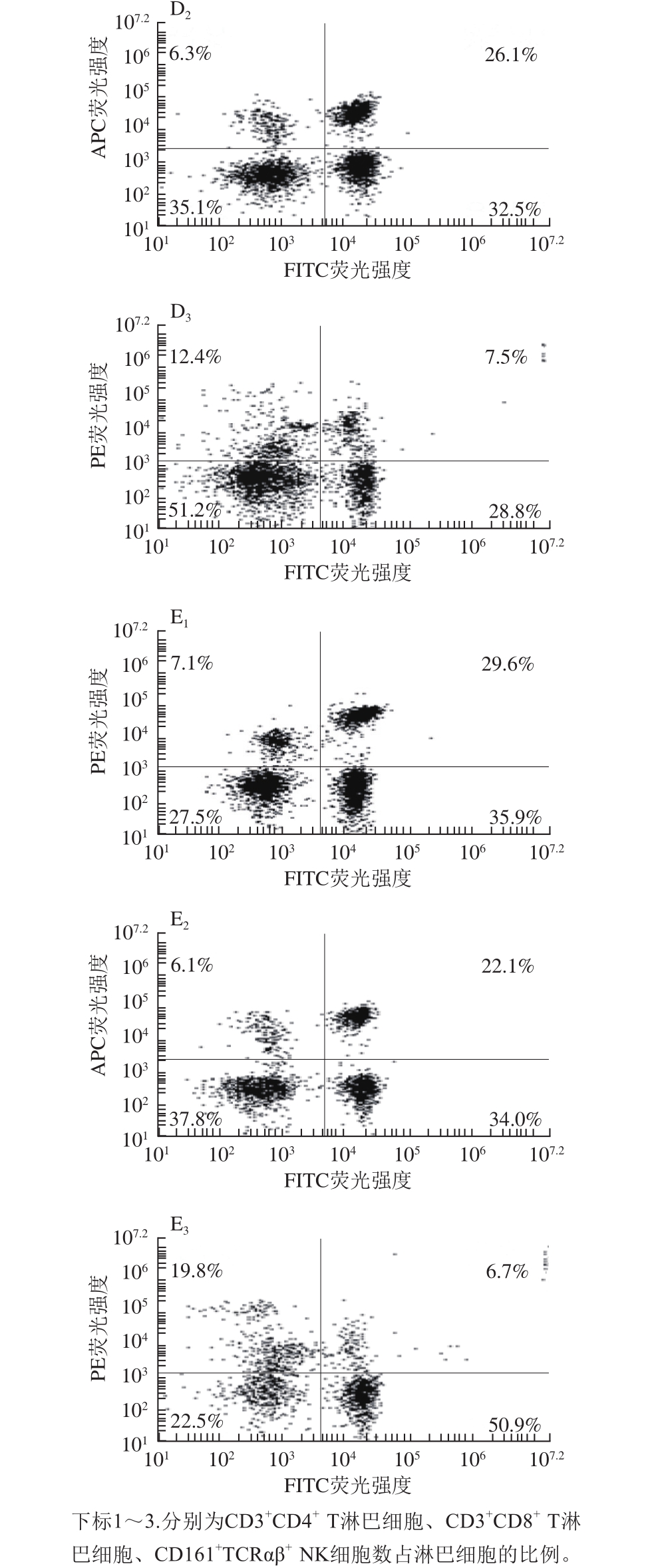
图3 纳豆激酶对大鼠外周血T淋巴细胞亚群和NK细胞的影响
Fig. 3 Effect of nattokinase on T lymphocyte subsets and NK cells in peripheral blood of rats
由图3、表3可知,与正常对照组相比,酒精模型组大鼠外周血CD3+ CD4+ T淋巴细胞比例、CD3+CD8+ T淋巴细胞比例、TCRαβ+CD161+ NK细胞比例均显著下降(P<0.05);与酒精模型组相比,纳豆激酶干预组和甘利欣干预组CD3+CD4+ T淋巴细胞比例和CD3+CD8+ T淋巴细胞比例显著升高(P<0.05),TCRαβ+CD161+ NK细胞比例有不同程度的上升趋势。纳豆激酶干预组各指标升高程度均高于甘利欣干预组,纳豆激酶对照组与正常对照组相比各指标无明显变化。
表3 大鼠外周血T淋巴细胞亚群和NK细胞比例(n=3)
Table 3 Proportion of T lymphocyte subsets and NK cells in peripheral blood of rats (n= 3)

TCRαβ+CD161+NK细胞比例/%正常对照组 36.1±3.4 32.55±2.95 16.45±1.95纳豆激酶对照组 36.4±2.6 32.15±3.05 17.6±2.15酒精模型组 26.3±2.2a 17.2±2.4a 5.4±1.6a纳豆激酶干预组 31.6±2.3b 25.3±1.6b 7.85±1.65甘利欣干预组 29.95±3.35b 23.7±2.6b 6.6±1.5组别 CD3+CD4+ T淋巴细胞比例/%CD3+CD8+ T淋巴细胞比例/%
酒精在体内代谢主要依赖于肝脏,长期过度饮酒易导致肝损伤。多项研究表明,酒精性肝损伤的发生发展过程中存在免疫功能障碍,长期饮酒会抑制机体的天然免疫细胞,降低淋巴细胞亚群和NK细胞的数量和活性,NK细胞脱颗粒的能力受损,明显抑制其免疫功能,引起肝细胞的直接损伤,增强了长期嗜酒者发展为肝炎、肝硬化或肝癌的敏感性[10-12]。纳豆是日本传统发酵豆制品,类似于中国的豆豉[13]。纳豆激酶最早于1987年由日本学者等从纳豆中发现[14],又称纤溶酶,其改善心血管疾病的功能已进行大量研究[15]。郭力榕[8]研究发现,纳豆具有解酒和改善酒精性肝损伤的作用。Xu Xin等[16]研究发现,枯草芽孢杆菌能促进淋巴细胞增殖,激活巨噬细胞,进而增强免疫功能。Inooka等[17]研究表明,枯草芽孢杆菌能增强鸡抗绵羊红细胞抗体的产生,提高其免疫功能。根据以上研究,推测其作用机制与枯草芽孢杆菌分泌的代谢产物纳豆激酶有关,但相关研究少见,因此,本研究选择纳豆激酶作为干预物,探讨纳豆激酶能否通过调节免疫细胞活性改善酒精诱导的肝损伤。
本研究通过酒精灌胃的方法建立大鼠酒精性肝损伤模型,通过肝脏组织形态结构观察,酒精暴露引起大鼠肝脏明显的组织结构损伤,纳豆激酶干预对酒精引起的肝脏损伤有显著改善作用。ALT、AST和GGT是肝细胞内重要的酶,当肝细胞受损时,致使血清酶活性增加[18]。CHE活力是肝合成蛋白质功能指标,血液中含量降低表明肝脏功能异常[19]。本实验血清生化指标结果表明,酒精暴露引起大鼠肝脏功能损伤,纳豆激酶安全、无毒性,能减轻酒精引起的肝脏功能异常,其改善肝脏功能效果低于甘利欣(保肝药)。
脾脏是机体最重要的外周免疫器官之一,是免疫细胞增殖和接受抗原刺激产生相应免疫应答的场所,拥有全身循环T淋巴细胞的25%,直接参与细胞免疫,并对外周血中T淋巴细胞亚群分布有重要调节作用,脾指数间接反应机体的免疫水平[20]。本实验脾指数结果显示,酒精摄入引起大鼠免疫功能降低,纳豆激酶无免疫毒性,且能抑制酒精引起的免疫功能降低,其保护效果优于甘利欣。
近年来的研究表明,T淋巴细胞的免疫状态与酒精性肝损伤的发生发展关系密切[21]。T淋巴细胞亚群水平可评估机体细胞免疫功能状态,CD4+ T淋巴细胞协助其他细胞参与免疫应答;CD8+ T淋巴细胞对免疫应答有负性调节功能[22],两者相互协调,相互制约,共同维系机体的免疫系统稳态,任何一种细胞的数量和功能发生异常变化时,都可导致免疫系统紊乱[23]。研究发现,酒精肝炎患者中通常有淋巴细胞浸润现象,酒精戒断和恢复过程中,淋巴细胞数量没有显著改变[24]。Naude等研究结果显示,青少年酒精性肝损伤患者中,CD4+和 CD8+ T淋巴细胞数量明显下降,导致免疫功能下降,增加传染病的易感性[25]。Laso等研究显示,慢性乙醇摄入影响酒精性肝硬化患者的免疫系统,使 CD4+、CD8+等T淋巴细胞亚群水平降低,T淋巴细胞总量明显下降[26]。NK细胞是机体中主要的天然免疫细胞之一,具有杀伤活性。NK细胞通过特异性受体与靶细胞表面特异性配体相结合,杀伤肿瘤细胞或受感染细胞[27]。具有抗病毒和抗肿瘤、抗纤维化的作用,通过巨噬细胞的极化调节肝脏炎症和细胞修复之间的平衡,在调节组织纤维化和癌症等慢性炎症性疾病中发挥重要作用[28]。有研究显示,NK细胞能抑制肝星状细胞激活,诱导其凋亡[29],对宿主具有保护作用,而酒精摄入会破坏这种保护作用[30];Cui Kele等研究表明,在一个慢性加单狂欢饮酒小鼠模型中,NK细胞通过γ干扰素保护乙醇诱导的肝细胞脂肪变性[31]。本研究结果显示,酒精暴露引起大鼠免疫功能失调,与相关文献报道结果[32]一致;纳豆激酶干预能明显改善酒精引起的免疫功能失调,其机制可能是通过调节CD4+、CD8+ T淋巴细胞亚群和NK细胞比例有关,其免疫调节作用优于甘利欣。
综上所述,长期一定量酒精摄入会引起大鼠肝脏损伤和免疫功能失调,而补充纳豆激酶在一定程度上可以保护酒精性肝损伤,其机制可能是通过调节CD4+ T淋巴细胞、CD8+ T淋巴细胞、NK细胞等免疫细胞比例,提高机体的免疫调节作用有关。
[1] MATHURIN P, BATALLER R. Trends in the management and burden of alcoholic liver disease[J]. Journal of Hepatology, 2015,62(1): S38-S46. DOI:10.1016/j.jhep.2015.03.006.
[2] TESTINO G, LEONE S, BORRO P. Treatment of alcohol dependence:recent progress and reduction of consumption[J]. Minerva Medica,2014, 105(6): 447-466.
[3] BYUN J S, YI H S. Hepatic immune microenvironment in alcoholic and nonalcoholic liver disease[J]. BioMed Research International,2017, 2017(2): 1-12. DOI:10.1155/2017/6862439.
[4] WENG Y, YAO J, SPARKS S, et al. Nattokinase: an oral antithrombotic agent for the prevention of cardiovascular disease[J].International Journal of Molecular Sciences, 2017, 18(3): 523-536.DOI:10.3390/ijms18030523.
[5] LEE B H, LAI Y S, WU S C. Antioxidation, angiotensin converting enzyme inhibition activity, nattokinase, and antihypertension of Bacillus subtilis (natto)-fermented pigeon pea[J]. Journal of Food and Drug Analysis, 2015, 23(4): 750-757. DOI:10.1016/j.jfda.2015.06.008.
[6] DE MELO F C, ZAIA C T, CELLIGOI M A. Levan from Bacillus subtilis Natto: its effects in normal and in streptozotocin-diabetic rats[J]. Brazilian Journal of Microbiology, 2012, 43(4): 1613-1619.DOI:10.1590/S1517-83822012000400046.
[7] TANIGUCHI-FUKATSU A, YAMANAKA-OKUMURA H,NANIWA-KUROKI Y, et al. Natto and viscous vegetables in a Japanese-style breakfast improved insulin sensitivity, lipid metabolism and oxidative stress in overweight subjects with impaired glucose tolerance[J]. Clinical Nutrition Supplements, 2013, 107(8): 1184-1191.DOI:10.1017/S000711451300041X.
[8] 郭力榕. 纳豆冻干粉解酒功效和对酒精性肝损伤保护作用的研究[D]. 上海: 华东师范大学, 2012: 44-45.
[9] INOOKA S, UEHARA S, KIMURA M. The effect of Bacillus natto on the T and B lymphocytes from spleens of feeding chickens[J].Poultry Science, 1986, 65(6): 1217-1219. DOI:10.3382/ps.0651217.
[10] STØY S, DIGE A, SANDAHL T D, et al. Cytotoxic T lymphocytes and natural killer cells display impaired cytotoxic functions and reduced activation in patients with alcoholic hepatitis[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2015,308(4): G269-G276. DOI:10.1152/ajpgi.00200.2014.
[11] BOYADJIEVA N, DOKUR M, ADVIS J P, et al. Chronic ethanol inhibits NK cell cytolytic activity: role of opioid peptide betaendorphin[J]. Journal of Immunology, 2001, 167(10): 5645-5652.DOI:10.4049/jimmunol.167.10.5645.
[12] LASO F J, ALMEIDA J, TORRES E, et al. Chronic alcohol consumption is associated with an increased cytotoxic profile of circulating lymphocytes that may be related with the development of liver injury[J]. Alcoholism Clinical and Experimental Research, 2010,34(5): 876-885. DOI:10.1111/j.1530-0277.2010.01160.x.
[13] 高泽鑫, 何腊平, 刘亚兵, 等. 纳豆激酶的研究进展与展望[J]. 中国酿造, 2017, 36(8): 11-15. DOI:10.11882/j.issn.0254-5071.2017.08.003.
[14] SUMI H, HAMADA H, TSUSHIMA H, et al. A novel fibrinolytic enzyme (nattokinase) in the vegetable cheese Natto; a typical and popular soybean food in the Japanese diet[J]. Experientia, 1987,43(10): 1110-1111. DOI:10.1007/BF01956052.
[15] 谢嵩, 于宗琴, 刘秀菊. 纳豆激酶的制备及其降血脂功效研究[J]. 中国生化药物杂志, 2015, 35(1): 17-20.
[16] XU Xin, HUANG Qin, MAO Yulong, et al. Immunomodulatory effects of Bacillus subtilis (natto) B4 spores on murine macrophages[J].Microbiology and Immunology, 2012, 56(12): 817-824. DOI:10.1111/j.1348-0421.2012.00508.x.
[17] INOOKA S, KIMURA M. The effect of Bacillus natto in feed on the sheep red blood cell antibody response in chickens[J]. Avian Diseases,1983, 27(4): 1086-1089. DOI:10.2307/1590208.
[18] 张伟龙, 肖翔, 潘理想, 等. ADA与ALT、AST、GGT联合检测在肝脏疾病诊断的价值研究[J]. 中国实用医药, 2017, 12(1): 53-55.DOI:10.14163/j.cnki.11-5547/r.2017.01.020.
[19] 凌道融, 方振华. 探究血清前白蛋白与胆碱酯酶在肝病诊断中临床意义[J]. 中国中西医结合消化杂志, 2016(1): 53-55. DOI:10.3969/j.issn.1671-038x.2016.01.14.
[20] 金莉莉, 马俊, 李婷, 等. 不同来源北冬虫夏草活性成分差异及其对小鼠免疫功能的影响[J]. 食品科学, 2015, 36(13): 243-246.DOI:10.7506/spkx1002-6630-201513045.
[21] MATOS L C, BATISTA P, MONTEIRO N, et al. Lymphocyte subsets in alcoholic liver disease[J]. World Journal of Hepatology, 2013, 5(2):46-45. DOI:10.4254/wjh.v5.i2.46.
[22] 庄海滨, 刘金花, 谢平. 右美托咪定对乳腺癌根治术患者T淋巴细胞亚群及NK细胞的影响[J]. 南昌大学学报(医学版), 2014, 54(6): 38-40.
[23] 张媛, 李淑波, 陈建光, 等. 北五味子木脂素对酒精性肝损伤小鼠免疫功能的影响[J]. 北华大学学报(自然科学版), 2016, 17(2): 181-185.DOI:10.11713/j.issn.1009-4822.2016.02.008.
[24] WANG H J, GAO B, ZAKHARI S, et al. Inf l ammation in alcoholic liver disease[J]. Annual Review of Nutrition, 2012, 32(1): 343-368.DOI:10.1146/annurev-nutr-072610-145138.
[25] NAUDE C E, BOUIC P, SENEKAL M, et al. Lymphocyte measures in treatment-naïve 13-15 year old adolescents with alcohol use disorders[J]. Alcohol, 2011, 45(5): 507-514. DOI:10.1016/j.alcohol.2011.02.307.
[26] LASO F J, MADRUGA J I, LÓPEZ A, et al. Distribution of peripheral blood lymphoid subsets in alcoholic liver cirrhosis: influence of ethanol intake[J]. Alcoholism Clinical and Experimental Research,1996, 20(9): 1564-1568. DOI:10.1111/j.1530-0277.1996.tb01700.x.
[27] MILLER A M, HORIGUCHI N, JEONG W I, et al. Molecular mechanisms of alcoholic liver disease: innate immunity and cytokines[J]. Alcoholism Clinical and Experimental Research, 2011,35(5): 787-793. DOI:10.1111/j.1530-0277.2010.01399.x.
[28] TOSELLOTRAMPONT A, SURETTE F A, EWALD S E, et al.Immunoregulatory role of NK cells in tissue inflammation and regeneration[J]. Frontiers in Immunology, 2017, 8(10): 301.DOI:10.3389/fimmu.2017.00301.
[29] CROCI D O, SALATINO M. Tumor immune escape mechanisms that operate during metastasis[J]. Current Pharmaceutical Biotechnology,2011, 12(11): 1923-1936.
[30] GAO B, SEKI E, BRENNER D A, et al. Innate immunity in alcoholic liver disease[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2011, 300(4): 516-525. DOI:10.1152/ajpgi.00537.2010.
[31] CUI Kele, YAN Guoxiu, ZHENG Xiaodong, et al. Suppression of natural killer cell activity by regulatory NKT10 cells aggravates alcoholic hepatosteatosis[J]. Frontiers in Immunology, 2017, 8: 1414.DOI:10.3389/fimmu.2017.01414.
[32] 刘靖靖, 梁惠, 戈娜, 等. 海兔素对酒精性肝损伤大鼠免疫调节作用的研究[J]. 营养学报, 2015, 37(5): 484-489. DOI:10.13325/j.cnki.acta.nutr.sin.2015.05.021.
Nattokinase Alleviates Alcoholic Liver Injury and Modulates Immune Function in Rats
ZHUO Yiyun, LÜ Jing, LIU Ying, et al. Nattokinase alleviates alcoholic liver injury and modulates immune function in rats[J]. Food Science, 2019, 40(7): 156-162. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180326-340.http://www.spkx.net.cn