图1 玉米黄素的分子结构
Fig. 1 Molecular structure of zeaxanthin
近年来,随全球老龄化形势的加剧,阿尔茨海默症(Alzheimer’s disease,AD)作为一种高发态势的神经退行性疾病引起社会各届广泛关注[1-4]。AD的病理机制众多,其中,内质网应激(endoplasmic reticulum stress,ERS)被认为在AD的形成及神经细胞的凋亡中具有重要作用[5-6]。ERS是生物体内错误折叠或未折叠蛋白质数量增多,内质网蛋白质负荷加大、内稳态失衡时的一种应激性反应[7-8]。短期的ERS诱发细胞的未折叠蛋白应答(unfolded-protein response,UPR)反应,可促进异常折叠蛋白质的降解,是细胞的一种保护性机制[9],而长期过度的ERS则使细胞内稳态难以恢复,导致细胞死亡[10-11],大脑神经元缺失是促进AD病理的形成和发展的关键因素。近期研究显示,ERS过度反应可激活γ-裂解酶,继而引起β-淀粉样蛋白水平升高,导致神经细胞凋亡[12]。因此,寻找合适的药物或者生物活性物质抑制ERS反应,提高细胞的存活率可作为治疗AD的新方向。

图1 玉米黄素的分子结构
Fig. 1 Molecular structure of zeaxanthin
玉米黄素(zeaxanthin)是一种类胡萝卜素,具有保护视力、预防心血管疾病、抗衰老及增强免疫力等功效[13-14]。此外,最新研究从分子结构(图1)上指出类胡萝卜素等存在酮κ-环和β-环(如玉米黄素)的理化性质,可能防止β-淀粉样蛋白的聚集,因此,玉米黄素等类胡萝卜素可能有治疗AD的潜力[15]。衣霉素(tunicamycin,TM)是一种天然抗生素,已在体外实验中广泛应用于诱导内质网应激[16-19],激活的内质网随后可触发细胞的凋亡通路,促使细胞死亡[20]。SH-SY5Y细胞为神经母细胞瘤细胞,广泛用于神经退行性疾病细胞模型的建立[21]。本实验用TM处理创建SH-SY5Y细胞损伤模型,用不同浓度的玉米黄素对损伤模型进行预处理或后处理,测定细胞存活率和细胞毒性,来研究玉米黄素对内质网应激引起的细胞损伤的保护作用,为开发玉米黄素的功能性食品及AD等神经退行性疾病的治疗提供科学依据。
玉米黄素(纯度为85.7%,高效液相色谱法鉴定,临用时用无水乙醇溶解成30 mmol/L的储存液) 上海源叶生物科技有限公司。
SH-SY5Y神经母细胞瘤细胞 中国医学科学院基础医学研究所细胞资源中心;RPMI 1640培养基 美国Gibco公司;胎牛血清、胰酶 美国Hyclone公司;双抗(青霉素-链霉素) 北京Solarbio公司;TM(采用二甲亚砜(dimethylsulfoxide,DMSO)溶解,配制成10 μg/μL的储存液,-20 ℃保存,应用时采用培养基稀释至所需终质量浓度) 北京华越洋生物科技有限公司;噻唑蓝美国Sigma公司;乳酸脱氢酶(lactate dehydrogenase,LDH)测定试剂盒 南京建成生物工程研究所。
Varioskan Flash多功能酶标仪、ND-1000型紫外-可见分光光度计 美国赛默飞世尔科技公司;CKX41倒置显微镜 日本Olympus公司;E191IR型CO2细胞培养箱美国金西盟公司。
1.3.1 SH-SY5Y细胞培养
SH-SY5Y神经母细胞瘤细胞复苏后于37 ℃、5% CO2条件下用含有体积分数10%胎牛血清和质量分数1%青链霉素的RPMI 1640培养基培养,取对数生长期细胞进行实验。细胞覆盖率达到70%~80%时进行传代,根据细胞的生长速度定时更换培养液,加药时换成不含血清的培养液。
1.3.2 细胞内质网应激损伤模型的建立
取对数生长期的SH-SY5Y细胞,胰酶消化后按1×104 个/孔接种于96 孔板中,在37 ℃、5% CO2条件下培养24 h,当细胞达到贴壁状态时,弃去上清液,加入由RPMI 1640培养基配制成的不同浓度梯度的TM溶液,每个梯度8 个平行。TM培养36 h后,进行检测,以此来确定TM损伤的最佳处理浓度。
1.3.3 玉米黄素处理及分组
细胞培养过程同1.3.1节,得出TM最佳损伤浓度和时间后,用此浓度建立细胞损伤模型。玉米黄素处理及分组:空白组(不做处理)、损伤组(仅TM处理)、玉米黄素保护组(玉米黄素预处理及后处理)。玉米黄素预处理组使用2、5、10、15、20、100 µmol/L的玉米黄素预处理一定时间后加TM处理36 h,以此筛选玉米黄素的最佳作用浓度,后续用浓度为2、5、10 µmol/L的玉米黄素预处理1、2、3、4、5、6、12、24 h后检测细胞存活率。玉米黄素后处理组先用TM处理30 min,再加不同浓度的玉米黄素处理24 h后进行检测。
1.3.4 细胞活性检测
取对数生长期的SH-SY5Y细胞,胰酶消化后按1×104 个/孔接种于96 孔板中,在37 ℃、5% CO2条件下培养 24 h,经分组处理后,每孔加入噻唑蓝溶液使其终质量浓度为5 mg/mL,37 ℃继续孵育4 h,终止培养,小心吸弃孔内培养上清液,每孔加入150~200 μL DMSO,振荡10 min,使结晶物充分溶解。放入酶标仪,于570 nm波长处测定OD值,按公式(1)计算细胞存活率。
1.3.5 细胞毒性检测
取对数生长期的SH-SY5Y细胞,胰酶消化后按1×105 个/孔接种于24 孔板中,在37 ℃、5% CO2条件下培养24 h,当细胞达到贴壁状态时,弃去上清液,细胞玉米黄素处理及损伤模型建立同1.3.3节。吸取各组培养液20 μL,用LDH试剂盒进行检测。空白组细胞用3%的Triton X-100裂解后测定LDH活力。LDH释放率按公式(3)计算。

测定数据以平均值±标准差表示,用SPSS 19.0和Origin 7.5软件进行数据处理。实验组与对照组比较采用单因素方差分析并用Bonferroni法进行多重比较,P<0.05表示差异显著。
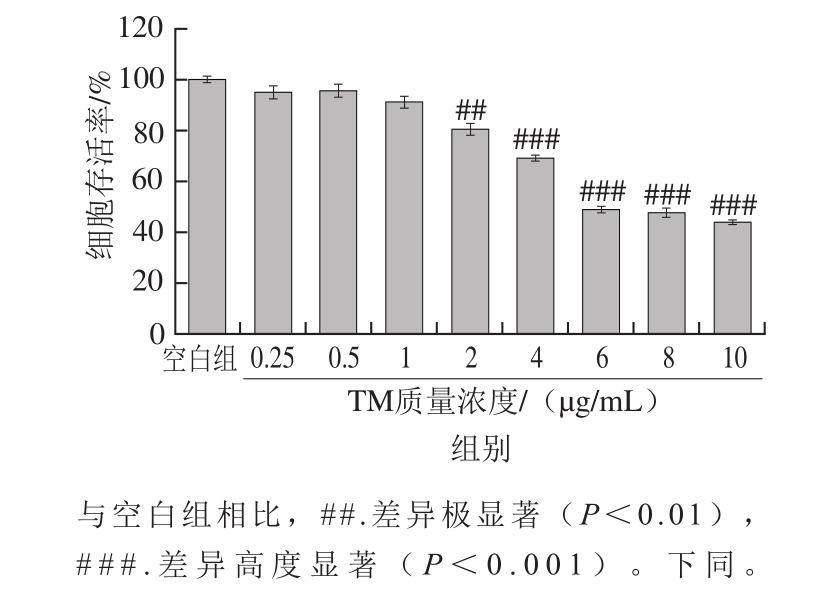
图2 不同质量浓度的TM对SH-SY5Y细胞活性的影响
Fig. 2 Dose-dependent effect of TM on the viability of SH-SY5Y cells
SH-SY5Y细胞用不同浓度的TM溶液培养36 h,由图2可知,不同质量浓度TM对SH-SY5Y细胞的生长均有一定抑制作用,且细胞存活率随TM质量浓度的升高呈下降趋势。与空白组相比,TM质量浓度为2 µg/mL时开始出现极显著抑制作用(P<0.01),当TM质量浓度为4、6 µg/mL时,SH-SY5Y细胞的存活率分别为68.97%和47.73%,因此可选择两者的中间质量浓度5 µg/mL作为后续实验的损伤处理质量浓度。当TM质量浓度太低时,不能有效抑制细胞增殖,而TM质量浓度过高则会引起细胞死亡过量,因此建立细胞损伤模型时,选用5 µg/mL TM处理36 h。
玉米黄素是含紫罗酮环的二羟基类胡萝卜素,它的两个紫罗酮环都是β型,C5和C6间的β-紫罗酮环双键与共轭多烯链结合在一起(图1),这种结构可能防止形成β-淀粉样蛋白聚集,具有治疗AD的潜力。为检测玉米黄素对SH-SY5Y细胞的保护作用,用不同浓度的玉米黄素预处理6 h后再加入5 µg/mL TM。由图3可知,2、5、10 µmol/L的玉米黄素预处理组细胞存活率均高于TM损伤组,其中5 µmol/L时存活率显著升高(P<0.05),但玉米黄素浓度为20 µmol/L时细胞存活率(65.20%)低于损伤组(70.75%),且玉米黄素浓度为100 µmol/L时细胞存活率极显著低于损伤组(P<0.01)。说明玉米黄素浓度过高对细胞会有损伤作用,因此,选择后续实验的玉米黄素浓度为2、5、10 μmol/L,5 μmol/L最佳。
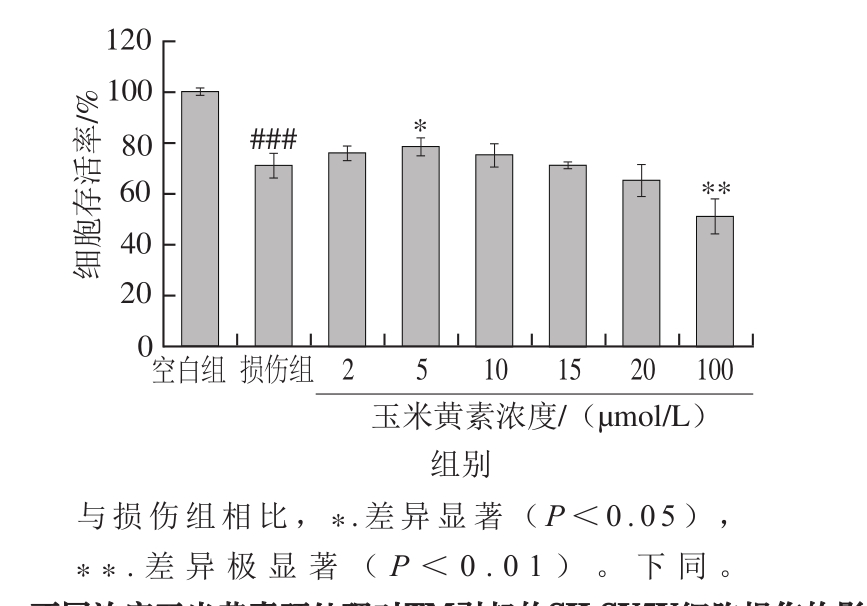
图3 不同浓度玉米黄素预处理对TM引起的SH-SY5Y细胞损伤的影响
Fig. 3 Dose-dependent effect of zeaxanthin on cell viability of SH-SY5Y cells damaged by TM
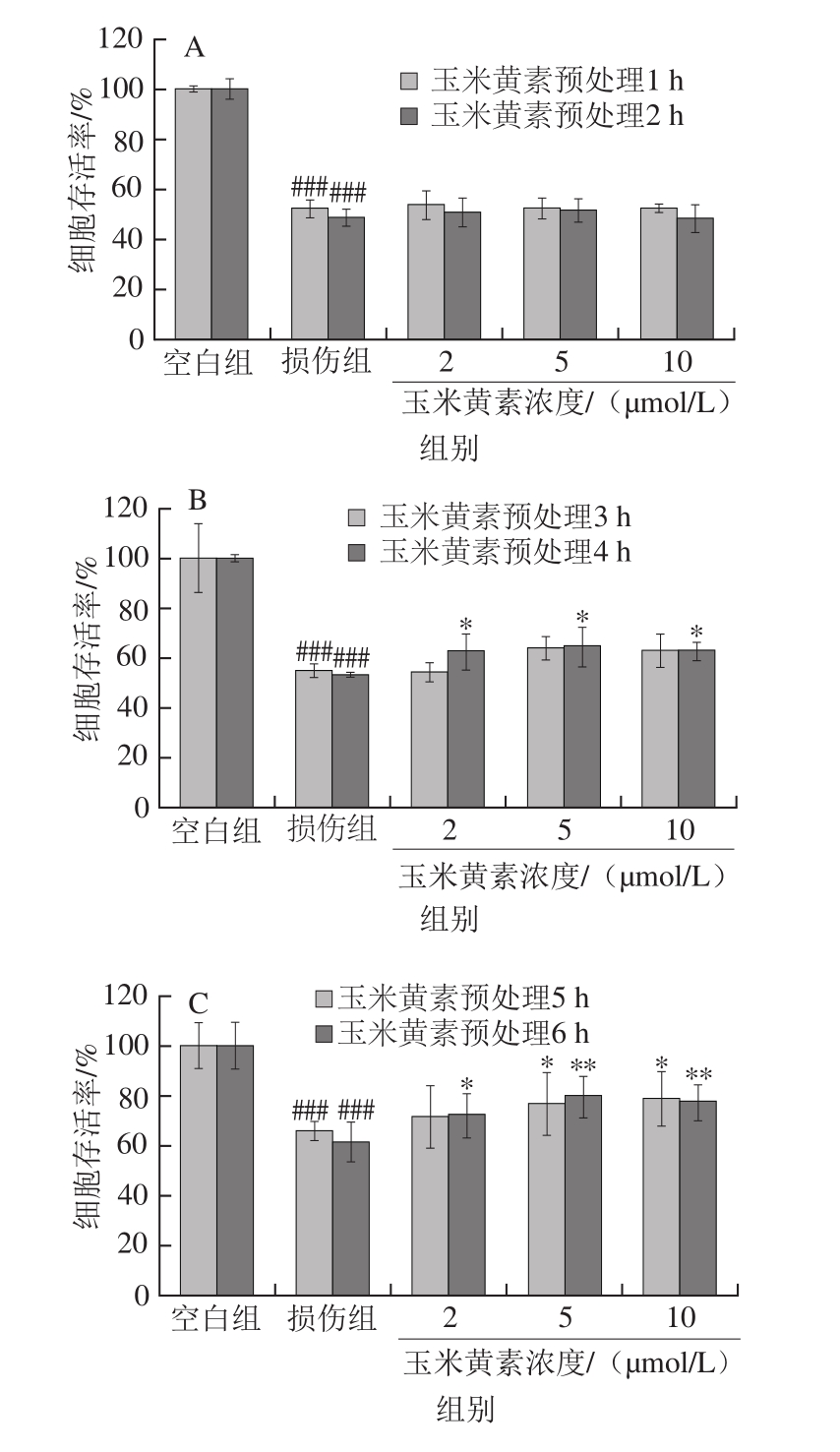
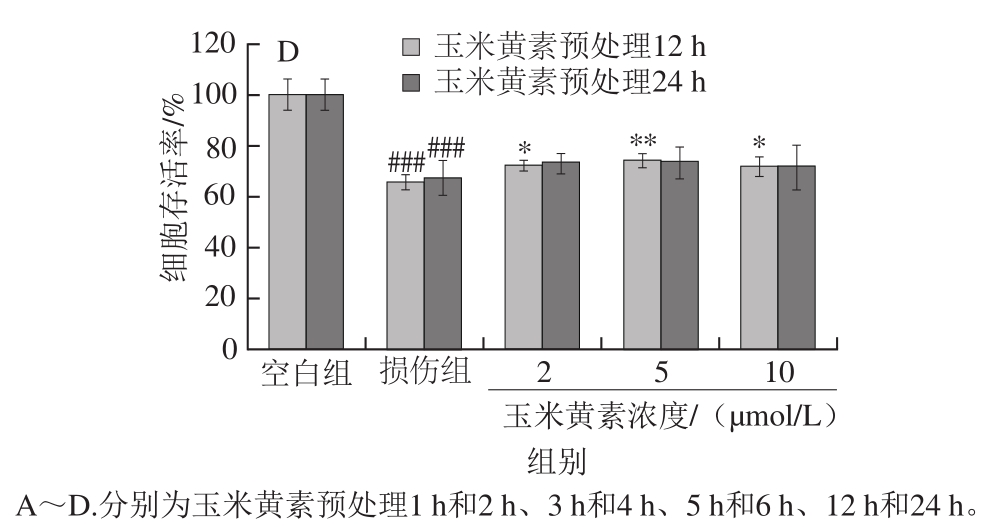
图4 玉米黄素预处理时间对TM引起的SH-SY5Y细胞损伤的影响
Fig. 4 Effect of pretreatment time of zeaxanthin on cell viability of SH-SY5Y cells damaged by TM
如图4A所示,玉米黄素预处理1、2 h的细胞存活率与TM损伤组相比无明显变化(P>0.05),由图4B可知,玉米黄素预处理3、4 h后细胞存活率高于TM损伤组,其中预处理4 h有显著性差异(P<0.05),图4C中,玉米黄素预处理5、6 h后细胞存活率均显著高于TM损伤组(P<0.05),其中预处理6 h的保护作用更加明显(P<0.01)。由图4D可知,与TM损伤组相比,玉米黄素预处理12 h后细胞存活率显著升高(P<0.05),与预处理6 h组一样,当玉米黄素浓度为5 μmol/L时,细胞存活率的升高具有极显著差异(P<0.01),预处理12 h后的细胞存活率开始下降。因此,玉米黄素预处理的时长对细胞活性也有一定的影响,预处理时长为4~12 h,玉米黄素(5 μmol/L)均能缓解TM导致的细胞存活率降低作用,其中玉米黄素5 μmol/L预处理6 h效果最为显著。
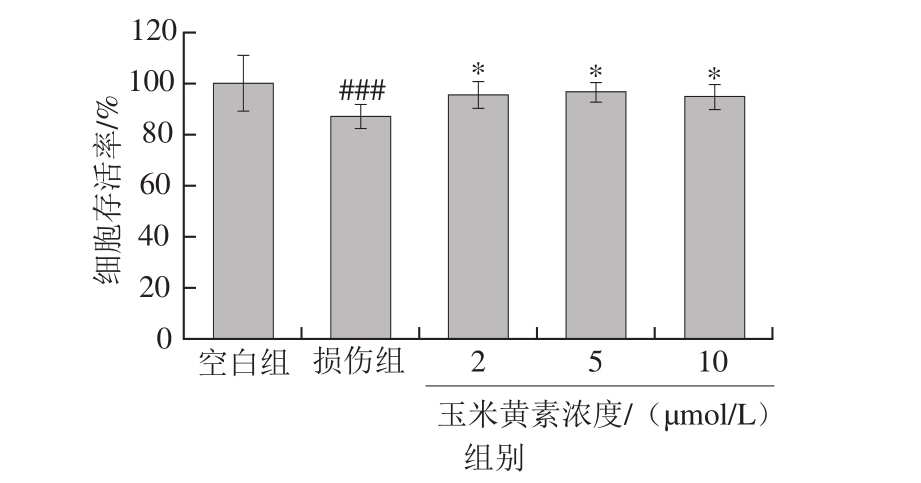
图5 玉米黄素后处理对TM引起的SH-SY5Y细胞损伤的影响
Fig. 5 Effect of post-treatment time of zeaxanthin on cell viability of SH-SY5Y cells damaged by TM
2.3节结果显示玉米黄素能缓解TM导致的细胞存活率的降低,为探究玉米黄素能否逆转TM引起的细胞损伤,SH-SY5Y细胞先用5 µg/mL TM培养30 min,再用2、5、10 μmol/L的玉米黄素后处理24 h,存活率检测结果显示,单独TM损伤30 min的细胞存活率下降了14.1%(P<0.001),而玉米黄素后处理组的细胞存活率均显著高于损伤组(P<0.05)(图5)。此结果说明,玉米黄素不仅能减轻TM引起的细胞损伤作用,并且在一定程度上可逆转TM引起的损伤。
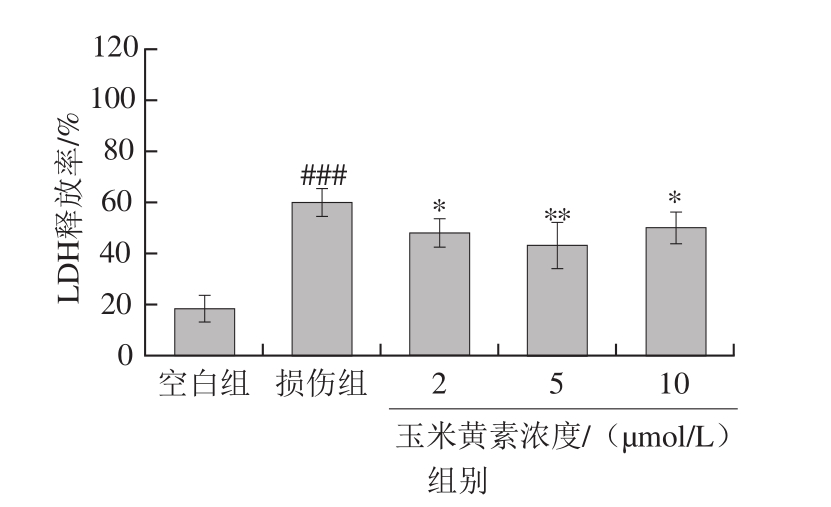
图6 玉米黄素预处理对TM引起的SH-SY5Y细胞LDH活力的影响
Fig. 6 Effect of pretreatment of zeaxanthin on LDH activity of SH-SY5Y cells damaged by TM
细胞损伤而造成的细胞膜结构的破坏会导致胞浆内的LDH释放到培养液中,因此检测培养液中的LDH活力,就可以反映细胞膜结构的完整性和损伤程度,用于细胞毒性的检测。由图6可知,TM损伤处理后,胞浆内LDH的释放率(培养液中的LDH活力)较空白组极显著增加(P<0.01)。之前结果显示预处理6 h对细胞存活率的保护作用最佳,因此选用玉米黄素的预处理时间为6 h。与损伤组相比,2、10 μmol/L玉米黄素预处理组LDH释放率均降低(P<0.05),5 μmol/L处理组LDH释放率极显著低于损伤组(P<0.01),说明玉米黄素能拮抗TM对SH-SY5Y细胞的应激损伤。
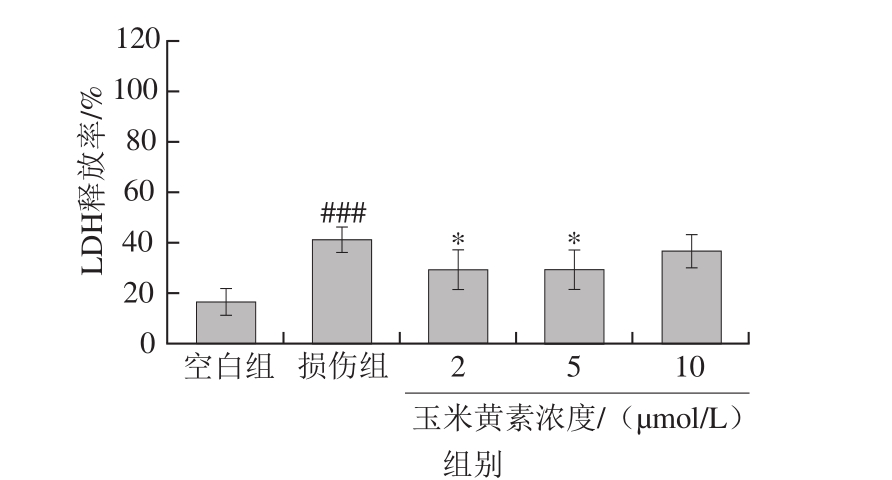
图7 玉米黄素后处理对TM引起的SH-SY5Y细胞LDH释放率的影响
Fig. 7 Effect of post-treatment of zeaxanthin on LDH activity of SH-SY5Y cells damaged by TM
SH-SY5Y细胞先用5 µg/mL TM培养30 min,再用2、5、10 μmol/L的玉米黄素后处理,24 h后检测LDH的释放量。如图7所示,与空白培养液组相比,TM损伤组细胞培养液中的LDH释放率显著升高(P<0.05),表明TM使细胞受损引起了LDH外漏。与TM损伤组相比,玉米黄素各剂量组细胞培养液中LDH释放率有所下降,其中2、5 μmol/L玉米黄素后处理组下降显著(P<0.05),表明玉米黄素后处理可以减缓细胞膜受损程度,阻止细胞内LDH外漏。10 μmol/L玉米黄素处理后LDH的释放率较损伤组虽有下降,但无显著性差异。
AD作为一种中枢神经系统退行性疾病,已经与脑卒中、肿瘤、心脑血管病相匹敌,成为老年人的第四大杀手[22-23]。近几十年来,关于AD的药物开发及临床治疗成果甚微,并且由于AD发病时间晚,目前尚无明确的特异性指标对其进行检测,容易错过最佳治疗时期,因此目前对于AD的研究已经逐渐从治疗到预防的方向转变[24-25],对AD的早期预防成为焦点。营养学上认为早期补充含有益生物活性物质的膳食有助于预防AD[26];病理学方面,在AD患者大脑未出现病理状态的神经元中发现ERS的标志蛋白表达增多的现象[27],这说明ERS发生于AD的早期阶段。此外ERS会引起神经细胞Ca2+稳态失衡,过氧化物增多等一系列生理功能的变化,还能激活UPR的凋亡信号通路,在AD的形成及神经细胞的凋亡中具有重要作用。因此,寻找合适的生物活性物质抑制ERS反应对AD的早期控制和病理抑制具有重要意义。
最新研究表明类胡萝卜素可在治疗神经退行性疾病中发挥有益作用[28-29],指出玉米黄素可能具有抗β-淀粉样蛋白聚集的作用,并且对内质网应激有一定的缓解作用,动物实验证明,玉米黄素能够缓解高糖引起的小鼠认知功能的损伤[30-31]。结合以上研究,推测玉米黄素可能具备预防和治疗AD的潜力。
本实验通过TM诱导SH-SY5Y细胞损伤来建立内质网应激损伤模型,以此探究玉米黄素在AD治疗中的潜力。结果表明,TM浓度为5 μmol/L时,能够对SH-SY5Y细胞造成有效的损伤。TM能够抑制细胞内合成N寡聚糖的第一步反应,从而阻止蛋白质的成熟,并引起ERS,长期过度的ERS使内质网负荷加大,引起细胞死亡。研究显示,2~10 µmol/L玉米黄素能够减轻TM的损伤作用,提高细胞存活率,降低LDH的释放率,并且在一定程度上可逆转TM引起的损伤。预处理时间的研究表明,一定浓度的玉米黄素预处理时长在4~12 h时可以有效缓解TM引起的细胞死亡,且当玉米黄素浓度为5 µmol/L,预处理6 h时保护效果最好。本实验表明,玉米黄素可有效改善内质网应激引起的细胞损伤并维持细胞膜的完整性。但玉米黄素能否改善内质网应激引起的其他变化,如细胞凋亡相关蛋白的表达以及细胞核的形态变化仍需进一步探索,且玉米黄素究竟通过哪一通路抑制内质网应激尚不明确,还需进一步研究。
[1] COLUCCI L, BOSCO M, FASANARO A M, et al. Alzheimer’s disease costs: what we know and what we should take into account[J].Journal of Alzheimers Disease, 2014, 42(4): 1311-1324. DOI:10.3233/JAD-131556.
[2] AN S S, PARK S A, BAGYINSZKY E, et al. A genetic screen of the mutations in the Korean patients with early-onset Alzheimer’s disease[J]. Clinical Interventions in Aging, 2016, 11: 1817-1822.DOI:10.2147/CIA.S116724.
[3] TAYLOR J P, HARDY J, FISCHBECK K H. Toxic proteins in neurodegenerative disease[J]. Science, 2002, 296: 1991-1995.DOI:10.1126/science.106712.
[4] SM D L M. Brain insulin resistance and deficiency as therapeutic targets in Alzheimer’s disease[J]. Current Alzheimer Research, 2012,9(1): 35-66. DOI:10.2174/156720512799015037.
[5] RAO R V, BREDESEN D E. Misfolded proteins, endoplasmic reticulum stress and neurodegeneration[J]. Current Opinion in Cell Biology, 2004, 16(6): 653-662. DOI:10.1016/j.ceb. 2004.09.012
[6] GERAKIS Y, HETZ C. Emerging roles of ER stress in the etiology and pathogenesis of Alzheimer’s disease [J]. The FEBS Journal, 2018,285(6): 995-1011. DOI:10.1111/febs.14332.
[7] GENEREUX J C, QU S, ZHOU M, et al. Unfolded protein responseinduced ERdj3 secretion links ER stress to extracellular proteostasis[J].EMBO Journal, 2015, 34(1): 4-19. DOI:10.15252/embj.201488896.
[8] SAILAJA G S, BHOOPATHI P, GORANTLA B, et al. Abstract 4992: SPARC overexpression induces ER stress leading to autophagymediated apoptosis in neuroblastoma cells[J]. Cancer Research, 2012,72(Suppl 8): 4992. DOI:10.1158/1538-7445.AM2012-4992.
[9] HETZ C, SAXENA S. ER stress and the unfolded protein response in neurodegeneration [J]. Nature Reviews Neurology, 2017, 13(8):477-491. DOI:10.1038/nrneurol.2017.99.
[10] FOUILLET A, LEVET C, VIRGONE A, et al. ER stress inhibits neuronal death by promoting autophagy[J]. Autophagy, 2012, 8(6):915-926. DOI:10.4161/auto.19716.
[11] MUNSHI S, DAHL R. Cytoprotective small molecule modulators of endoplasmic reticulum stress[J]. Bioorganic & Medicinal Chemistry,2016, 24(11): 2382-2388. DOI:10.1016/j.bmc.2016.03.045.
[12] OHTA K, MIZUNO A, LI S, et al. Endoplasmic reticulum stress enhances γ-secretase activity[J]. Biochemical Biophysical Reseaech Communications, 2011, 416(3/4): 362-366. DOI:10.1016/j.bbrc.2011.11.042.
[13] MARESPERLMAN J A, MILLEN A E, FICEK T L, et al. The body of evidence to support a protective role for lutein and zeaxanthin in delaying chronic disease. overview[J]. Journal of Nutrition, 2002,132(3): 518S-524S.
[14] MA L, DOU H L, HUANG Y M, et al. Improvement of retinal function in early age-related macular degeneration after lutein and zeaxanthin supplementation: a randomized, double-masked, placebocontrolled trial[J]. American Journal of Ophthalmology, 2012, 154(4):625-634. DOI:10.1016/j.ajo.2012.04.014.
[15] LAKEY-BEITIA J, DOENS D, JAGADEESH K D, et al. Antiamyloid aggregation activity of novel carotenoids: implications for Alzheimer’s drug discovery[J]. Clinical Interventions in Aging, 2017,12(6): 815-822. DOI:10.2147/CIA.S134605.
[16] KIM H S, KIM T J, YOO Y M. Melatonin combined with endoplasmic reticulum stress induces cell death via the PI3K/Akt/mTOR pathway in B16F10 melanoma cells[J]. PLoS ONE, 2014, 9(3): e92627.DOI:10.1371/journal.pone.0092627.
[17] MOU Z, YUAN Y H, LOU Y X, et al. Bibenzyl compound 20c protects against endoplasmic reticulum stress in tunicamycin-treated PC12 cells in vitro[J]. Acta Pharmacologica Sinica, 2016, 37(12):1525-1533. DOI:10.1038/aps.2016.75.
[18] KAWADA K, IEKUMO T, SAITO R, et al. Aberrant neuronal differentiation and inhibition of dendrite outgrowth resulting from endoplasmic reticulum stress[J]. Journal of Neuroscience Research,2014, 92(9): 1122-1133. DOI:10.1002/jnr.23389.
[19] CHENG T L, CHEN P S, LI R H, et al. Induction of apurinic endonuclease 1 overexpression by endoplasmic reticulum stress in hepatoma cells[J]. International Journal of Molecular Sciences, 2014,15(7): 12442-12457. DOI:10.3390/ijms150712442.
[20] JIAN L, LU Y, LU S, et al. Chemical chaperone 4-phenylbutyric acid protects H9c2 cardiomyocytes from ischemia/reperfusion injury by attenuating endoplasmic reticulum stress-induced apoptosis[J].Molecular Medicine Reports, 2016, 13(5): 4386-4392. DOI:10.3892/mmr.2016.5063.
[21] YANG H, WANG J, SUN J, et al. A new method to effectively and rapidly generate neurons from SH-SY5Y cells[J]. Neuroscience Letters, 2016, 610: 43-47. DOI:10.1016/j.neulet.2015.10.047.
[22] EL HAJ M, COELLO Y, KAPOGIANNIS D, et al. Negative prospective memory in Alzheimer’s disease: “do not perform that action”[J]. Journal of Alzheimer’s Disease, 2018, 61(2): 663-672.DOI:10.3233/JAD-170807.
[23] HAAPASALO A, PIKKARAINEN M, SOININEN H. Alzheimer’s disease: a report from the 7th Kuopio Alzheimer symposium[J].Neurodegenerative Disease Management, 2015, 5: 379-382.DOI:10.2217/nmt.15.31.
[24] LEOUTSAKOS J M, GROSS A L, JONES R N, et al. ‘Alzheimer’s Progression Score’: development of a biomarker summary outcome for AD prevention trials[J]. The Journal of Prevention of Alzheimer’s Disease, 2016, 3(4): 229-235. DOI:10.14283/jpad.2016.120.
[25] SUOMINEN M H, PURANEN T M, JYVAKORPI S K, et al.Nutritional guidance improves nutrient intake and quality of life, and may prevent falls in aged persons with Alzheimer disease living with a spouse (NuAD trial) [J]. Journal of Nutrition Health & Aging, 2015,19(9): 901-907. DOI:10.1007/s12603-015-0558-0.
[26] CARRASCO-GALLARDO C, FARIAS G A, FUENTES P, et al.Can nutraceuticals prevent Alzheimer’s disease? potential therapeutic role of a formulation containing shilajit and complex B vitamins[J].Archives of Medical Research, 2012, 43(8): 699-704. DOI:10.1016/j.arcmed.2012.10.010.
[27] SCHEPER W, HOOZEMANS J J. The unfolded protein response in neurodegenerative diseases: a neuropathological perspective[J]. Acta Neuropathologica, 2015, 130(3): 315-331. DOI:10.1007/s00401-015-1462-8.
[28] PAPANDREOU M A, KANAKIS C D, POLISSIOU M G, et al.Inhibitory activity on amyloid-beta aggregation and antioxidant properties of Crocus sativus stigmas extract and its crocin constituents[J]. Journal of Agriccultural and Food Chemistry, 2006,54(23): 8762-8768. DOI:10.1021/jf061932a.
[29] ONO K, YOSHIIKE Y, TAKASHIMA A, et al. Vitamin A exhibits potent anti-amyloidogenic and fibril-destabilizing effects in vitro[J].Experimental Neurology, 2004, 189(2): 380-392. DOI:10.1016/j.expneurol.2004.05.035.
[30] ZHOU X Y, WANG S S, DING X, et al. Zeaxanthin improves diabetes-induced cognitive deficit in rats through activiting PI3K/AKT signaling pathway[J]. Brain Research Bulletin, 2017, 132: 190-198.DOI:10.1016/j.brainresbull.2017.06.001.
[31] YING C J, CHEN L, WANG S S, et al. Zeaxanthin ameliorates high glucose-induced mesangial cell apoptosis through inhibiting oxidative stress via activating Akt signalling-pathway[J].Biomedicine & Pharmacotherapy, 2017, 90: 796-805. DOI:10.1016/j.biopha.2017.04.013.
Protective Effect of Zeaxanthin on SH-SY5Y Cell Injury Induced by Tunicamycin
WEI Jun, ZHAO Fanfan, LIU Xinjun, et al. Protective effect of zeaxanthin on SH-SY5Y cell injury induced by tunicamycin[J]. Food Science, 2019, 40(7): 163-168. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20171124-303. http://www.spkx.net.cn