
图1 小鼠免疫方案
Fig. 1 Mice immunization protocol
食物过敏通常是由食品中无害蛋白抗原引起的免疫系统紊乱,具有潜在致命性[1]。食物过敏对胃肠道的影响主要表现为口腔刺痛、瘙痒、恶心、腹痛、呕吐;对呼吸道的影响主要表现为气喘和呼吸道炎症;对皮肤的影响主要表现为皮肤红肿、荨麻疹、血管性水肿、瘙痒;也有可能发生全身性过敏反应[1]。近年来,对水产品尤其是虾、蟹等甲壳类水产品过敏的人群比例逐年上升[1]。已有研究表明,南美白对虾(Litopenaeus vannamei)中的主要过敏原为原肌球蛋白(tropomyosin,TM),其能够引起免疫球蛋白(immunoglobulin,Ig)E介导的速发型超敏反应[2]。TM是一种热稳定的蛋白,日常生活中即使经过高温烹饪也难以消除其过敏原性,有大量的学者致力于对其过敏原性削减的研究。研究表明,食物热处理加工过程中的烘烤、油炸、微波、煮沸等方式均不能降低TM的过敏原性[3-10],因此,探究TM致敏机制从而发展相应的过敏防治手段有一定的理论意义和应用价值。
益生菌因其对机体的保健作用而受到广泛的关注,有大量研究表明其能够缓解食物过敏,例如鼠李糖乳杆菌(Lactobacillus rhamnosus GG)、干酪乳酸菌代田株(Lactobacillus casei Shirota)和乳酸双歧杆菌(Bifidobacterium lactis BE)等都被证明具有调节肠道菌群结构、抑制炎症等免疫调节作用[11-13]。此外,乳酸菌和双歧杆菌等益生菌株被发现能够促进IgA的分泌并抑制IgE的分泌,从而增强口服免疫耐受,缓解食物过敏[14-16]。Schiavi等[11]从刀额新对虾(Metapenaeus ensis)中提纯出TM并用以建立致敏模型,通过口服灌胃益生菌混合物(VSL#3),发现其可以缓解小鼠TM过敏。
双歧杆菌是健康婴儿粪便中的优势菌,并且口服后能够定植于肠道中,在黏膜免疫反应中起到重要的作用,进而对食物过敏起到调控作用[17]。肥大细胞(mast cells,MCs)来源于造血干细胞分化,通常分布于黏膜组织,靠近上皮细胞、腺体、平滑肌细胞和神经。MCs作为效应细胞参与IgE介导的食物过敏、哮喘等病理过程。MCs表面的IgE受体一旦与IgE结合或通过其他机制被激活后,能够释放多种不同的介质,从而进一步引起一系列的食物过敏反应[18]。杯状细胞位于肠上皮,其分泌的黏液覆盖于肠上皮细胞,作为第一道物理屏障,阻挡病原菌、过敏原等的入侵;它还能分泌抗菌分子,如溶酶菌和乳铁蛋白。嗜酸性粒细胞(eosinophil,Eo)能够表达FcεR、FcαR、FcγR受体,并与抗原特异性IgE结合,在抗原刺激下引起Eo脱颗粒,从而向肠道黏膜组织中释放炎性颗粒(细胞因子,如血小板活化因子、白三烯等)。
动物模型使对与食物过敏相关的致敏机理、脱敏治疗等的研究成为可能,因此,越来越多的学者建立相应的动物模型开展各项食物过敏相关研究,并取得了丰富的研究成果。Capobianco等[19]从刀额新对虾(Metapenaeus ensis)中提纯出TM,口服灌胃8 周龄雌性C3H/HeJ小鼠构建TM致敏模型,发现通过口服灌胃TM可以构建TM小鼠模型,为TM致敏研究提供了有力的工具和思路。但是目前鲜有雌、雄小鼠在TM致敏模型构建中的比较研究,也鲜有文献报道肠黏膜免疫在TM致敏及益生菌治疗模型中的作用[20],相关问题亟待进一步的研究阐明。
综上所述,本研究以南美白对虾为原料,以TM为过敏原腹腔注射6 周龄雌、雄BALB/c小鼠,构建TM致敏模型;进一步口服灌胃双歧杆菌、凝结芽孢杆菌治疗TM致敏小鼠,构建TM治疗模型;最终从肠黏膜免疫角度探究TM致敏及益生菌治疗机理,为食物过敏机理、益生菌治疗机理、黏膜免疫反应等提供理论依据。
6 周龄SPF级雌、雄性BALB/c小鼠(许可证号:SYXK(浙)2016-0014) 浙江省中医药大学动物实验研究中心。
南美白对虾(Litopenaeus vannamei) 浙江杭州萧山养殖场;长双歧杆菌婴儿亚种1.2202(菌种编号:ATCC15697) 中国普通微生物菌种保藏管理中心;芽孢乳酸菌09.712分离纯化于大黄鱼肠道,由浙江工商大学食品与生物工程学院实验室保存。
胰蛋白胨大豆肉汤培养基(tryptic soy broth,TSB)、乳酸菌选择性培养基(de Man, Rogosa and Sharp,MRS) 青岛高科园海博生物有限公司;兔抗小鼠IgE单克隆抗体、兔抗小鼠IgG2a单克隆抗体、兔抗鼠CD4单克隆抗体 美国Abcam公司;兔抗小鼠蛋白多糖(proteoglycan,PRG)抗体 美国GeneTax公司;小鼠组胺(histamine,HIS)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 杭州百细生物有限公司;3,3’,5,5’-四甲基联苯胺(tetramethylbenzidine,TMB) 美国eBioscience公司;氯乙酸萘酚酯酶染色试剂盒、过碘酸希夫(periodic acid-Schiff,PAS)染色试剂盒、弗氏完全佐剂、弗氏不完全佐剂 美国Sigma公司;其余试剂均购自上海阿拉丁生化科技股份有限公司。
台式冷冻高速离心机 美国Beckman Coulter公司;Milli-Q超纯水装置 美国Millipore公司;VersaMax型酶标仪 美国Molecular Devices公司;STP120脱水机、AP280-2包埋机、HM335E切片机、Eclipse 80i显微镜日本Nikon公司;凝胶成像系统 德国Carl Zeiss公司。
1.3.1 益生菌培养及菌悬液制备
双歧杆菌:称取52.24 g MRS固体粉末溶于1 000 mL蒸馏水中,高温灭菌后备用。取1 mL活化后的双歧杆菌接于100 mL MRS肉汤中,37 ℃培养24 h,3 000 r/min离心10 min取沉淀,用适量磷酸盐缓冲液(phosphate buffered saline,PBS)重悬,调整细胞数为2×1010 CFU/mL。
凝结芽孢杆菌悬液:称取30 g TSB固体粉末溶于1 000 mL蒸馏水中,高温灭菌后备用。取1 mL活化后的凝结芽孢杆菌接于100 mL TSB肉汤中,37 ℃培养12 h,3 000 r/min离心10 min取沉淀,用适量PBS重悬,调整细胞数为2×1010 CFU/mL。
1.3.2 小鼠免疫方案
将60 只6 周龄BALB/c小鼠(雌、雄各半)按照性别分别随机分为5 组,每组6 只,分别记为空白(Ctrl)组、佐剂(Ad)组、TM致敏(TM)组、双歧杆菌治疗(Bi)组、凝结芽孢杆菌治疗(Bc)组。小鼠饲喂条件:温度为(23±3)℃,相对湿度为(50±10)%,自由饮水,按照标准实验动物饲养方法饲养。

图1 小鼠免疫方案
Fig. 1 Mice immunization protocol
小鼠免疫方案如图1所示:小鼠预饲养1 周,第7天开始致敏,将TM溶于PBS(600 μg/100 μL),与等体积的弗氏完全佐剂充分乳化,腹腔注射致敏小鼠,每只小鼠注射200 μL;第14、21天将TM溶液与等体积的弗氏不完全佐剂充分乳化,腹腔注射致敏小鼠,每只小鼠注射200 μL;第28、35天激发小鼠,灌胃对应致敏剂量2 倍的TM进行激发;空白组每次注射等体积的无菌PBS;佐剂组每次注射等体积无菌PBS乳化过的相应佐剂;Bi和Bc组分别从第14天开始口服灌胃2×1010 CFU/mL长双歧杆菌婴儿亚种1.2202菌液、芽孢乳酸菌09.712菌液(300 μL/只),连续灌胃20 d,最后一次激发后禁食。最后一次激发30~60 min观察小鼠的过敏症状,第2天断颈处死。在小鼠第1次致敏前(第7天)、第3次致敏后(第21天)、最后一次激发后(第35天)眼眶静脉取血,血样室温凝固1 h后3 000 r/min离心10 min取上清液得到血清,分装冻存于-20 ℃,避免反复冻融;小鼠致死后分别取小肠、大肠。
1.3.3 过敏症状评分
最后一次激发30~60 min后观察小鼠的过敏及腹泻症状,参照文献[13]评分系统稍作修改,具体评分系统如表1所示。
表1 小鼠腹泻及过敏症状评分表
Table 1 Diarrhea and clinical anaphylaxis symptom scoring system of mice

得分 过敏症状 腹泻症状0无任何过敏症状 无腹泻症状1 小鼠反复抓挠耳朵、嘴巴;后脚反复挠耳道 粪便颗粒状带黏液2 小鼠活动量减少;开始有单独活动;耳朵、眼睛红肿;鼻翼煽动;厌食 粪便基本颗粒状结构消失3 小鼠静止时间长达2 min以上;活动量明显减少;呼吸速率增加;毛发竖立 粪便不成形,夹杂大量的黄色黏液4 眼球突出;结膜充血;刺激后无反应;颤抖;惊厥粪便不成形,呈液体状,肛门部位有轻微粪便残留5死亡 严重水样便,在肛门部位结块,堵住肛门,不及时清理会造成死亡
1.3.4 血清中HIS质量浓度及TM特异性抗体(IgE)水平的检测
小鼠血清中HIS质量浓度的测定参照试剂盒说明书进行。用包被缓冲液(0.05 mol/L Na2CO3/NaHCO3、pH 9.6)稀释TM至10 μg/mL,向96 孔板中每孔加入100 μL,4 ℃包被过夜;用含质量分数0.05%吐温20的PBS(PBST)洗板3 次,拍干;每孔加入200 μL封闭液(含质量分数5%牛血清白蛋白的PBS),室温孵育1 h;用PBST洗板3 次,拍干。每孔加入稀释后的血清(检测IgE时稀释体积比为1∶5、检测IgG2a时稀释体积比为1∶100)100 μL,4 ℃孵育过夜;用PBST洗板3 次,拍干;每孔加入稀释后的酶标二抗(分别为辣根过氧化物酶(horseradish peroxidase,HPR)-IgE、HPR-IgG2a,均以体积比1∶1 000稀释)100 μL,室温孵育1 h;用PBST)洗板5 次,拍干;每孔加入100 μL TMB溶液,室温孵育15 min;每孔加入50 μL终止液,在波长490 nm处测定OD值以表征IgE水平。
1.3.5 杯状细胞PAS染色
将不同部位的肠道切片置于60 ℃烤箱中烘烤2 h,使石蜡切片脱蜡。用去离子水使切片水化。室温下将玻片浸没于高碘酸溶液中5 min,用超纯水将玻片冲洗干净;再于室温下将玻片浸没于Schiff试剂中复染15 min,用流水冲洗玻片5 min;用苏木紫染液复染玻片,用流水冲洗玻片,干燥后封片,用显微镜观察。
1.3.6 MCs氯乙酸萘酚酯酶染色
用柠檬酸-丙酮-甲醇固定剂室温固定切片1 min,用超纯水冲洗干净,在室温下干燥至少20 min。预热50 mL Trizmal 6.3稀释缓冲液至37 ℃,加入1 粒Fast Corinth V Salt,充分溶解后加入2 mL 萘酚AS-D-氯乙酸酯,溶液变混浊,继续搅拌15~30 s,将配制好的染色液倒入玻片染色缸中。将样品玻片置于上述染色液中,37 ℃避光孵育5 min;取出玻片,超纯水冲洗3 min;用苏木精复染,孵育10 min,用流水冲洗干净;室温下干燥后盖片,用显微镜观察。
1.3.7 免疫组化检测小鼠肠道中的CD4+ T细胞和Eo
将不同部位的肠道切片置于60 ℃烤箱烘烤2 h,使石蜡切片脱蜡;用自动染色机程序2(分别用二甲苯、无水乙醇、体积分数95%乙醇浸染15、5、5 min,各2 次)脱蜡至水相;用超纯水水洗2 min。高压锅内放适量自来水,将0.1 mol/L柠檬酸钠缓冲液(pH 6.0)倒入烧杯内(体积视切片数量而定),将烧杯置于高压锅内煮沸(高压锅不需盖紧),将切片放入装有修复液的烧杯内,盖紧高压锅,加热至设定压力冒气后持续2 min,用自来水冷却。用体积分数3% H2O2溶液处理10 min,以消除内源性过氧化物酶活性,降低背景值。用PBS洗5 min,共3 次;滴加一抗(兔抗小鼠CD4或兔抗小鼠PRG抗体),4 ℃孵育过夜,第2天于37 ℃孵育60 min。用PBS洗5 min,共3 次;滴加二抗(HPR标记聚合物),37 ℃孵育20 min;用PBS洗5 min,共3 次;二氨基联苯胺显色5 min。用自动染色机程序2复染、透明后封片,用显微镜观察。
1.3.8 小鼠肠道组织症状评分
小鼠肠道各部位组织症状评分标准如表2所示。
表2 小鼠肠道组织过敏症状评分标准
Table 2 Mice intestinal histological scoring system

得分 症状0无任何组织病变,肠绒毛排列整齐1肠绒毛排列紊乱,肠道完整性被破坏,局部水肿2肠黏膜肌层变厚,固有层松散3肠绒毛局部轻微脱落,炎症细胞浸润4肠绒毛大量脱落,肠腔局部出现溃疡5 肠绒毛基本脱落至肠腔,肠腔中分散着肠绒毛碎片
实验得到的所有数据使用SPSS 14.0、Graph Prism 6.0软件进行独立样本t检验和单因素方差分析,结果以平均值±标准差表示,P<0.05表示存在显著性差异。实验数据使用Graph Prism 6.0软件作图。
如图2所示,雌性小鼠在最后一次致敏后过敏症状较为严重,出现腹泻,反复抓挠耳朵、嘴巴,后脚反复挠耳道,活动量减少,耳朵、眼睛红肿,呼吸速率增加,毛发竖立,眼球突出,结膜充血,刺激后无反应,颤抖,惊厥等过敏症状,甚至出现了小鼠死亡。Bi和Bc组小鼠的过敏症状减弱,与TM组相比存在极显著差异。
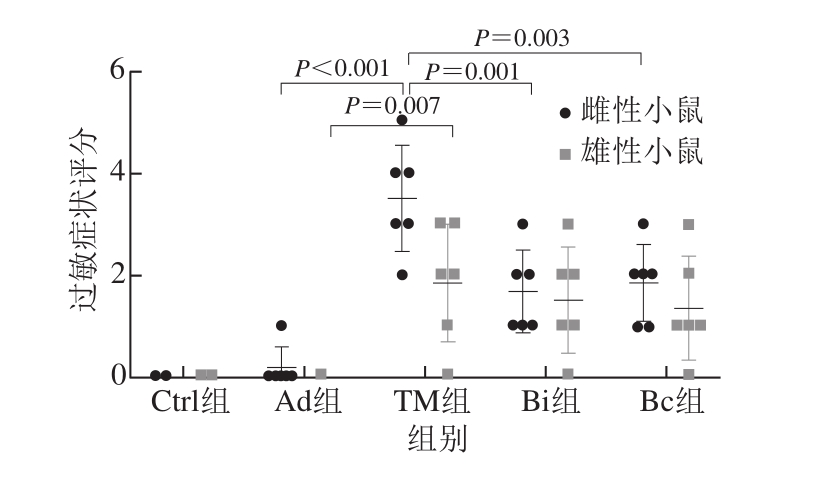
图2 雌、雄TM致敏BALB/c小鼠过敏症状评分
Fig. 2 Anaphylaxis scores in female and male TM-induced BALB/c mice
雄性TM组BALB/c小鼠也同样出现了轻微的过敏症状,相较于佐剂组虽然存在极显著差异,但是过敏症状仍然弱于雌性小鼠。从过敏症状评分来看,长双歧杆菌婴儿亚种1.2202和芽孢乳酸菌09.712并没有起到缓解过敏的益生作用。
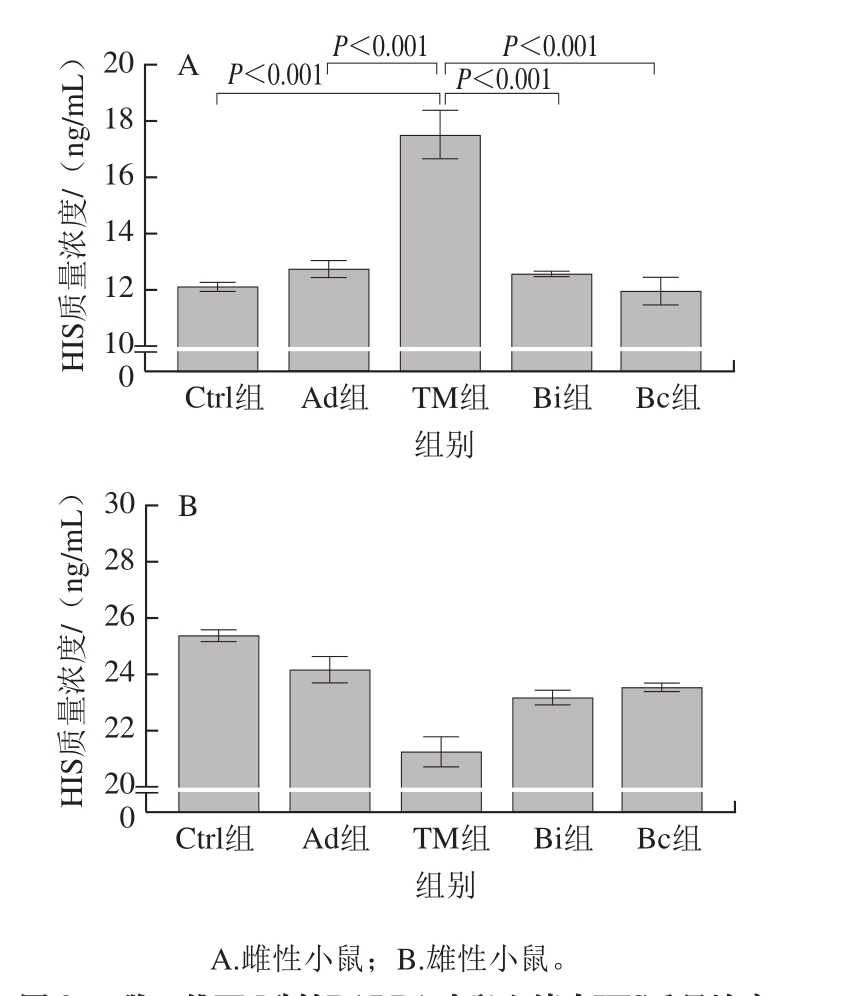
图3 雌、雄TM致敏BALB/c小鼠血清中HIS质量浓度
Fig. 3 Histamine levels in serum samples from female and male BALB/c mice model
从图3A中可知,最后一次致敏后,TM组小鼠血清中的HIS质量浓度高度显著高于佐剂组,Bi和Bc组中HIS质量浓度高度显著低于TM组。HIS是IgE介导的食物过敏的重要炎性介质之一,TM组HIS质量浓度相较于对照组高度显著升高,说明小鼠开始出现过敏反应,并且长双歧杆菌婴儿亚种1.2202和芽孢乳酸菌09.712能够下调TM致敏小鼠血清中HIS质量浓度。
从图3B可知,相较于雌性小鼠,虽然雄性小鼠血清中总体HIS质量浓度较高,但是TM组小鼠并没有出现HIS质量浓度增加的情况,说明并没有出现HIS炎性介质的释放,益生菌也没有起到调节HIS质量浓度的益生作用。因此,单从小鼠血清中HIS质量浓度变化的角度来说,雌性小鼠更容易构建TM致敏及益生菌治疗模型。

图4 不同组别雌性BALB/c小鼠血清中TM特异性IgE水平
Fig. 4 TM-specific IgE levels in serum samples from female BALB/c mice model
如图4所示,最后一次致敏后TM组小鼠血清中的抗原特异性IgE水平明显增加,说明TM引起了较为严重的食物过敏反应。Bi组小鼠血清中TM特异性IgE水平显著下降,Bc组小鼠血清中IgE水平也有下调。而雄性小鼠血清中未检测到TM特异性IgE。由此可知,雌性小鼠更容易构建TM诱导的IgE介导的食物过敏模型,并且长双歧杆菌婴儿亚种1.2202和芽孢乳酸菌09.712均能够下调TM致敏小鼠血清中IgE水平,缓解食物过敏。
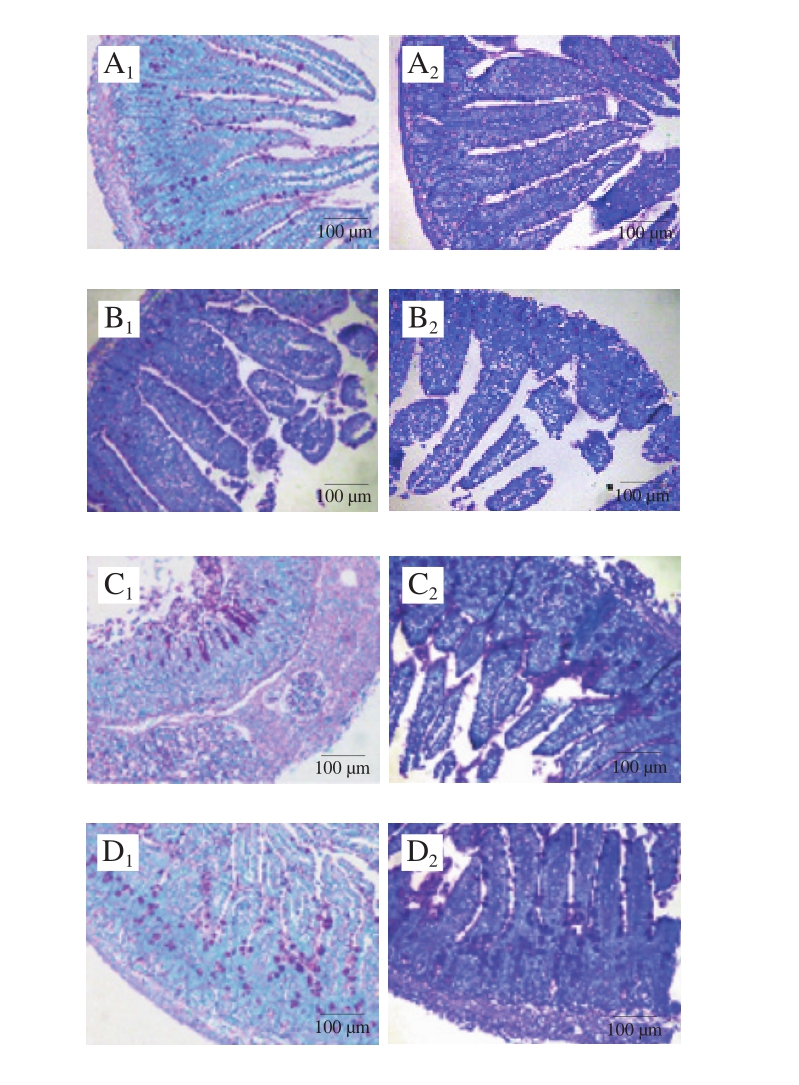
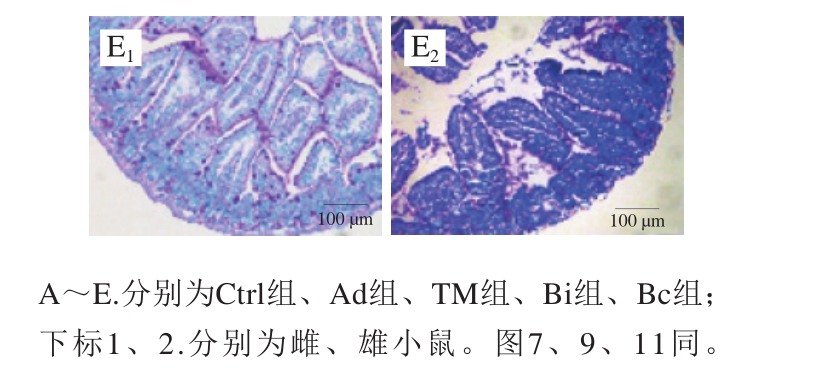
图5 雌、雄小鼠PAS染色肠道组织切片图
Fig. 5 Periodic acid-Schiff staining of gut segments in female and male mice
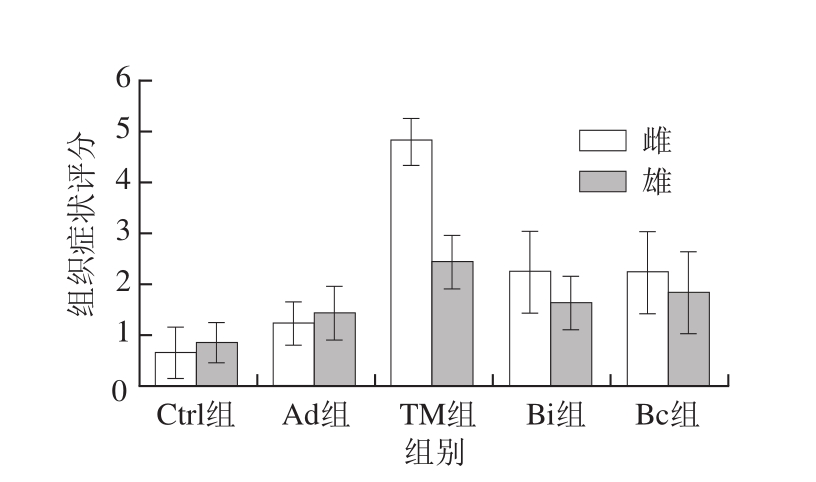
图6 雌、雄小鼠PAS染色肠道组织切片的组织症状评分
Fig. 6 Histological scores of periodic acid-Schiff staining in female and male mice
从图5、6可以看出,雌、雄性小鼠空白组中,肠绒毛完整排列整齐,杯状细胞均匀分布于肠绒毛上。与空白组相比,佐剂组黏膜厚度略有增加,而其他方面并无太大差别。TM组雌、雄小鼠差异很大,雌性小鼠肠绒毛出现大量断裂、坏死,排列紊乱,甚至脱落到肠腔,肠腔内可见大量的绒毛碎片,肠黏膜逐渐增厚,甚至出现溃疡和坏死,且杯状细胞数目明显减少,这与绒毛大量断裂脱落、肠黏膜肌层的病变有关;而雄性小鼠过敏症状较弱。观察雌性小鼠Bi组和Bc组可以看出,相比于TM组,其肠绒毛未出现大量脱落的现象,肠绒毛排列、黏膜肌层厚度均与空白组相似,说明长双歧杆菌婴儿亚种1.2202和芽孢乳酸菌09.712有效缓解了小鼠的过敏症状,保护了其肠道的完整性,且使其杯状细胞的数目增加、分布均匀。Bi组小鼠的小肠绒毛长度、隐窝深度、黏膜厚度和黏膜肌层厚度与空白组无异,说明长双歧杆菌婴儿亚种1.2202具有更好的治疗效果;而雄性小鼠中差异不明显。
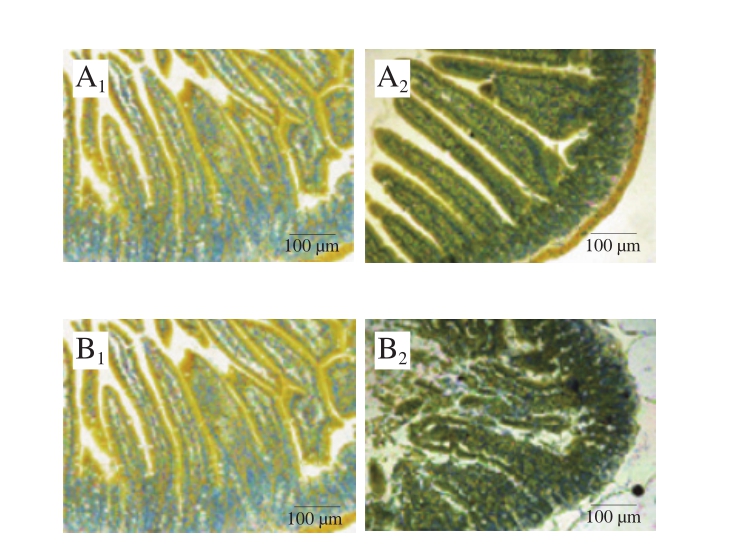
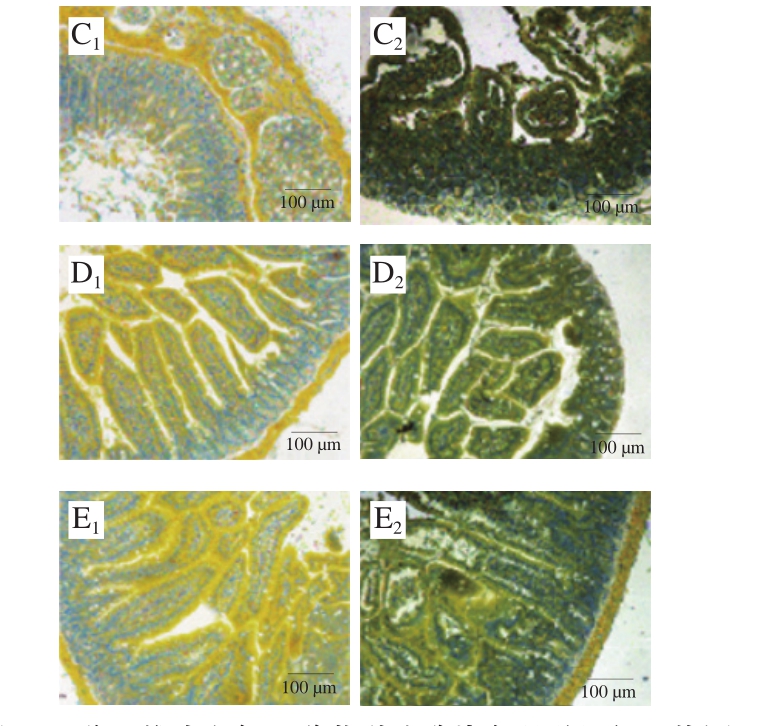
图7 雌、雄小鼠氯乙酸萘酚酯酶染色肠道组织切片图
Fig. 7 Chloroacetate esterase staining of gut segments in female and male mice
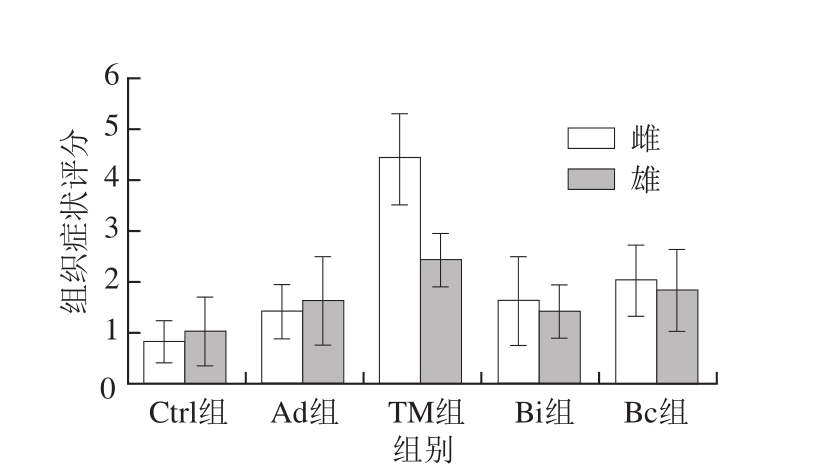
图8 雌、雄小鼠氯乙酸萘酚酯酶染色肠道组织切片的组织症状评分
Fig. 8 Histological scores of chloroacetate esterase staining of gut segments in female and male mice
与杯状细胞相似,通过比较图7、8中雌、雄小鼠的过敏程度以及MCs的数目可以发现,雌性小鼠致敏效果更好,致敏程度更严重,MCs脱颗粒,肠黏膜增厚严重,基本无完整的肠绒毛存在,并且伴随着溃疡的出现。长双歧杆菌婴儿亚种1.2202和芽孢乳酸菌09.712的治疗效果明显,小肠组织的溃疡和炎症情况明显减轻。雄性小鼠的致敏和治疗的效果不明显。

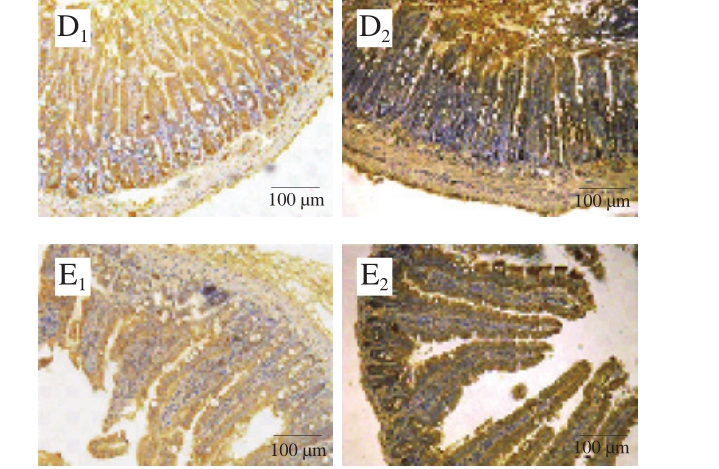
图9 雌、雄小鼠肠道各部位CD4+ T细胞免疫组化图
Fig. 9 Immunohistochemistrical analysis of gut segments for CD4+ T cells in female and male mice
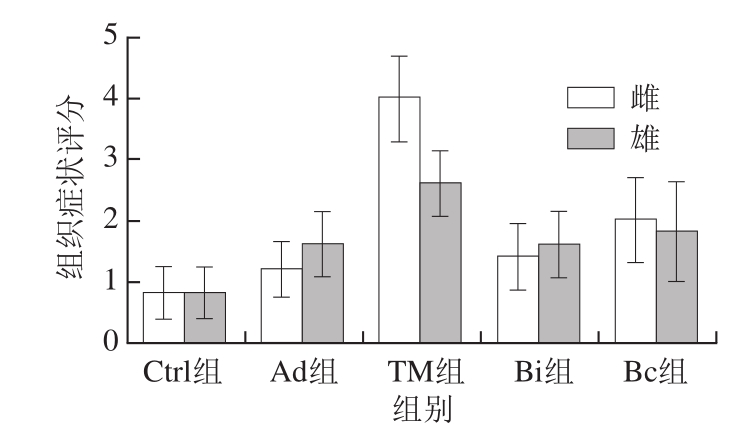
图10 雌、雄小鼠肠道CD4+ T细胞免疫组化组织症状评分
Fig. 10 Histological scores of immunohistochemistrical analysis for CD4+ T cells in female and male mice
从图9、10中可以看出,TM组小鼠相较于空白组和佐剂组过敏程度更严重,不仅肠绒毛大量断裂、坏死并脱落到肠腔,而且出现肠黏膜增厚甚至溃疡和坏死,CD4+ T细胞数目明显增加。相比于TM组,Bi、Bc组小鼠肠绒毛未出现大量脱落的现象,肠绒毛排列、黏膜肌形态健康,说明长双歧杆菌婴儿亚种1.2202和芽孢乳酸菌09.712具有明显的治疗作用,且能使CD4+ T细胞的数目增加、分布均匀。而雄性小鼠过敏症状不明显。
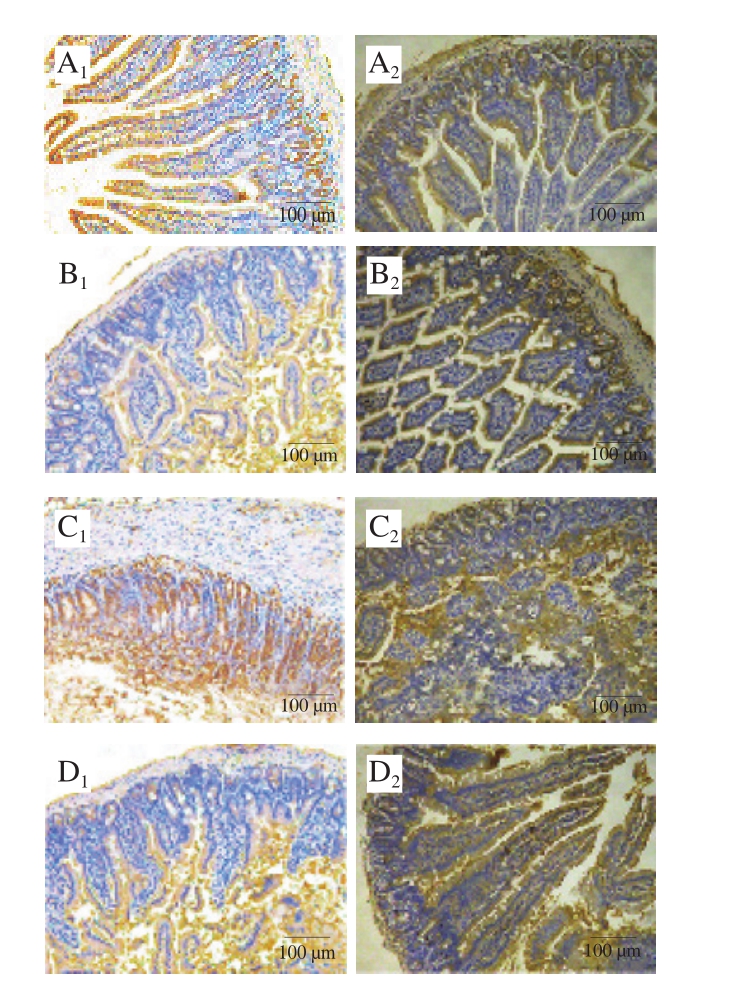
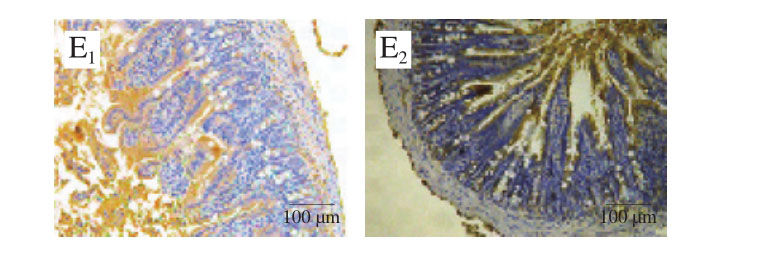
图11 雌、雄小鼠肠道各部位Eo免疫组化图
Fig. 11 Immunohistochemistry of gut segments for eosinophils in female and male mice
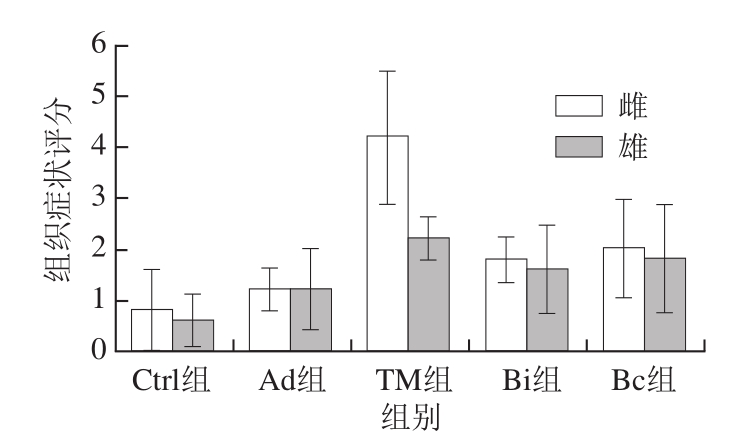
图12 雌、雄小鼠肠道免疫组化组织症状评分
Fig. 12 Histological scores of immunohistochemistrical analysis for eosinophils in female and male mice
从图11、12中可以看出,TM致敏后Eo的分泌明显增加,充满于肠绒毛和肠黏膜内。比较雌、雄小鼠可以发现,雌性小鼠的过敏反应更强烈,黏膜增厚数倍;通过益生菌治疗,其肠道组织过敏反应明显好转,且Eo清晰、均匀。雄性小鼠变化不明显,难以看出清晰的变化规律。
小鼠模型具有周期短、免疫系统与人类相似等优点,这使其在免疫学基础研究中被广泛应用[21]。小鼠的过敏反应与人类十分相似,包括过敏症状、体液免疫和细胞免疫等方面,因此常被用于构建食物过敏模型[11-12,22-27]。但是小鼠致敏模型的构建受多方面因素的影响,比如性别、基因背景、小鼠品系、致敏方式、过敏原来源、佐剂的使用等,阐明这些因素的影响程度及其机制对于建立稳定可靠的模型,开展进一步的研究至关重要。
性别被认为是影响过敏的因素之一,通常认为雌性小鼠更易发生过敏,表现为产生更多的抗原特异性IgE,同时CD4+ T细胞表达上调,细胞因子白介素-4含量增加,淋巴细胞和Eo浸润,调节性T细胞数量减少[21,28]。除此之外,激素也是影响免疫系统的因素之一,如睾丸激素和雌激素[29]。尽管大量食物过敏的模型均使用雌性动物,但是近年来雄性小鼠在过敏中的应用也为食物过敏研究提供了新的角度。雄性小鼠致敏前服用雷帕霉素可以降低IgE水平,使局部(肠道)和全身(血清)MCs反应减弱以及过敏症状减轻[30]。尽管已经有研究用雌性BALB/c小鼠构建了TM致敏模型,但是对雄性小鼠TM模型的建立鲜有报道[11,19,23-24,26,31]。因此,本研究同时选用了雌性和雄性小鼠构建致敏模型,并比较了两者的差异,旨在为TM致敏模型的构建提供一些理论参考。
实验结果表明,雌性小鼠在致敏后血清中TM特异性IgE水平和HIS质量浓度明显高于雄性小鼠。Pilegaard等[32]的研究同样表明雌性小鼠相较于雄性小鼠更容易发生食物过敏,从而产生更多的IgE。这可能与小鼠体内的性激素有关,雌激素可以增强抗体分泌和体液免疫,从而使小鼠更容易过敏[29]。通过将TM组小鼠与治疗组小鼠相比,其炎症相关性指标如IgE水平、HIS质量浓度都有所下调,表明无论是长双歧杆菌婴儿亚种1.2202还是芽孢乳酸菌09.712都能在一定程度上缓解TM过敏。
食物过敏原被肠道消化,由肠道上皮细胞转运并被肠道相关的淋巴组织捕获,从而产生免疫应答,如T细胞分化、炎性细胞因子产生、MCs和嗜酸性细胞浸润,进一步诱发免疫肠道组织损伤和黏膜紊乱[33-34]。
通过PAS染色法、氯乙酸萘酚酯酶染色法和免疫组化法病理切片,可以发现TM组小鼠肠道发生组织病变,主要表现在肠绒毛排列紊乱、肠绒毛脱落至肠腔、局部出现溃疡、黏膜基层变厚等黏膜组织病变。过敏相关细胞如杯状细胞、MCs、CD4+ T细胞数量增加,Eo浸润,部分细胞开始凋亡。长双歧杆菌婴儿亚种1.2202和芽孢乳酸菌09.712能够缓解肠道组织病变。
肠道菌群在食物过敏中起着重要的作用。Hill等通过研究无菌小鼠、抗生素处理小鼠及野生型小鼠,发现野生型小鼠的食物过敏耐受性更强[35]。双歧杆菌、芽孢杆菌能够通过重建肠道菌群结构调节肠道代谢产物,进而影响肠黏膜免疫反应,缓解食物过敏[36-38]。因此,长双歧杆菌婴儿亚种1.2202和芽孢乳酸菌09.712的益生作用可能与其能够改变肠道菌群的结构有关,其具体的机制有待于进一步研究。
[1] PRESTER L. Seafood allergy, toxicity, and intolerance: a review[J].Journal of the American College of Nutrition, 2016, 35(3): 271-283.DOI:10.1080/07315724.2015.1014120.
[2] SHANTI K N, MARTIN B M, NAGPAL S, et al. Identification of tropomyosin as the major shrimp allergen and characterization of its IgE-binding epitopes[J]. The Journal of Immunology, 1993, 151(10):5354-5363. DOI:10.0000/PMID7693809.
[3] BESLER M, STEINHART H, PASCHKE A. Stability of food allergens and allergenicity of processed foods[J]. Journal of Chromatography B: Biomedical Sciences and Applications, 2001, 756(1/2): 207-228.DOI:10.1080/10408398.2015.1045965.
[4] LONG F Y, YANG X, WANG R R, et al. Effects of combined high pressure and thermal treatments on the allergenic potential of shrimp(Litopenaeus vannamei) tropomyosin in a mouse model of allergy[J].Innovative Food Science & Emerging Technologies, 2015, 29: 119-124. DOI:10.1016/j.ifset.2015.03.002.
[5] LÜ L T, LIN H, LI Z X, et al. Effect of 4-hydroxy-2-nonenal treatment on the IgE binding capacity and structure of shrimp (Metapenaeus ensis) tropomyosin[J]. Food Chemistry, 2016, 212: 313-322.DOI:10.1016/j.foodchem.2016.05.152.
[6] SONG Y N, LI Z X, LIN H, et al. Effect of malondialdehyde treatment on the IgE binding capacity and conformational structure of shrimp tropomyosin[J]. Food Chemistry, 2015, 175: 374-380. DOI:10.1016/j.foodchem.2014.12.001.
[7] LÜ L T, LIN H, LI Z X, et al. Identification of oxidative modification of shrimp (Metapenaeus ensis) tropomyosin induced by malonaldehyde[J]. European Food Research and Technology, 2014,239(5): 847-855. DOI:10.1007/s00217-014-2281-1.
[8] GÁMEZ C, ZAFRA M P, SANZ V, et al. Simulated gastrointestinal digestion reduces the allergic reactivity of shrimp extract proteins and tropomyosin[J]. Food Chemistry, 2015, 173: 475-481. DOI:10.1016/j.foodchem.2014.10.063.
[9] WU L S, LI Z X, LU Z C, et al. In-vitro simulated gastric fluid digestion and immunogenicity of different crustacean protein extracts[J]. International Journal of Food Properties, 2015, 18(1): 43-53. DOI:10.1080/10942912.2013.805766.
[10] WILD L G, LEHRER S B. Fish and shellfish allergy[J].Current Allergy and Asthma Reports, 2005, 5(1): 74-79.DOI:10.1159/000375508.
[11] SCHIAVI E, BARLETTA B, BUTTERONI C, et al. Oral therapeutic administration of a probiotic mixture suppresses established Th2 responses and systemic anaphylaxis in a murine model of food allergy[J]. Allergy, 2011, 66(4): 499-508. DOI:10.1111/j.1398-9995.2010.02501.x.
[12] MEIJERINK M, WELLS J M, TAVERNE N, et al. Immunomodulatory effects of potential probiotics in a mouse peanut sensitization model[J].FEMS Immunology & Medical Microbiology, 2012, 65(3): 488-496.DOI:10.1111/j.1574-695X.2012.00981.x.
[13] TAN J, MCKENZIE C, VUILLERMIN P J, et al. Dietary fiber and bacterial SCFA enhance oral tolerance and protect against food allergy through diverse cellular pathways[J]. Cell Reports, 2016, 15(12):2809-2824. DOI:10.1016/j.celrep.2016.05.047.
[14] MATSUZAKI T, YAMAZAKI R, HASHIMOTO S, et al. The effect of oral feeding of Lactobacillus casei strain Shirota on immunoglobulin E production in mice[J]. Journal of Dairy Science, 1998, 81(1): 48-53.DOI:10.3168/jds.S0022-0302(98)75549-3.
[15] MAJAMAA H, ISOLAURI E, MAIJA S, et al. Lactic acid bacteria in the treatment of acute rotavirus gastroenteritis[J]. Journal of Pediatric Gastroenterology and Nutrition, 1995, 20(3): 333-338.DOI:10.1097/00005176-199504000-00012.
[16] YASUI H, NAGAOKA N, MIKE A, et al. Detection of Bifidobacterium strains that induce large quantities of IgA[J].Microbial Ecology in Health and Disease, 1992, 5(3): 155-162.DOI:10.3109/08910609209141310.
[17] NOWAK-WEGRZYN A, SZAJEWSKA H, LACK G. Food allergy and the gut[J]. Nature Reviews Gastroenterology & Hepatology, 2017,14(4): 241-257. DOI:10.1038/nrgastro.2016.187.
[18] REBER L L, SIBILANO R, MUKAI K, et al. Potential effector and immunoregulatory functions of mast cells in mucosal immunity[J].Mucosal Immunology, 2015, 8(3): 444-463. DOI:10.1038/mi.2014.131.
[19] CAPOBIANCO F, BUTTERONI C, BARLETTA B, et al. Oral sensitization with shrimp tropomyosin induces in mice allergenspecific IgE, T cell response and systemic anaphylactic reactions[J].International Immunology, 2008, 20(8): 1077-1086. DOI:10.1093/intimm/dxn065.
[20] LAM Y F, TONG K K, KWAN K M, et al. Gastrointestinal immune response to the shrimp allergen tropomyosin: histological and immunological analysis in an animal model of shrimp tropomyosin hypersensitivity[J]. International Archives of Allergy & Immunology,2015, 167(1): 29-40. DOI:10.1159/000431228.
[21] HALEY P J. Species differences in the structure and function of the immune system[J]. Toxicology, 2003, 188(1): 49-71. DOI:10.1016/S0300-483X(03)00043-X.
[22] KWON H K, LEE C G, SO J S, et al. Generation of regulatory dendritic cells and CD4+ Foxp3+ T cells by probiotics administration suppresses immune disorders[J]. Proceedings of the National Academy of Sciences, 2010, 107(5): 2159-2164. DOI:10.1073/pnas.0904055107.
[23] LIU G M, LI B, YU H L, et al. Induction of mud crab (Scylla paramamosain) tropomyosin and arginine kinase specific hypersensitivity in BALB/c mice[J]. Journal of the Science of Food and Agriculture, 2012, 92(2): 232-238. DOI:10.1002/jsfa.4565.
[24] WAI C Y Y, LEUNG N Y H, HO M H K, et al. Immunization with hypoallergens of shrimp allergen tropomyosin inhibits shrimp tropomyosin specific IgE reactivity[J]. PLoS ONE, 2017, 9(11):e111649. DOI:10.1371/journal.pone.0111649.
[25] KIM Y H, YANG X, YAMASHITA S, et al. 1,2,3,4,6-penta-O-galloyl-β-D-glucopyranose increases a population of T regulatory cells and inhibits IgE production in ovalbumin-sensitized mice[J].International Immunopharmacology, 2015, 26(1): 30-36. DOI:10.1016/j.intimp.2015.02.025.
[26] SHI C L, PAN T, CAO M J, et al. Suppression of Th2 immune responses by the sulfated polysaccharide from Porphyra haitanensis in tropomyosin-sensitized mice[J]. International Immunopharmacology,2015, 24(2): 211-218. DOI:10.1016/j.intimp.2014.11.019.
[27] WAI C Y Y, LEUNG N Y H, LEUNG P S C, et al. T cell epitope immunotherapy ameliorates allergic responses in a murine model of shrimp allergy[J]. Clinical & Experimental Allergy, 2016, 46(3): 491-503. DOI:10.1111/cea.12684.
[28] MELGERT B N, POSTMA D S, KUIPERS I, et al. Female mice are more susceptible to the development of allergic airway inf l ammation than male mice[J]. Clinical & Experimental Allergy, 2005, 35(11):1496-1503. DOI:10.1111/j.1365-2222.2005.02362.x.
[29] CHEN W, MEMPEL M, SCHOBER W, et al. Gender difference, sex hormones, and immediate type hypersensitivity reactions[J]. Allergy,2008, 63(11): 1418-1427. DOI:10.1111/j.1398-9995.2008.01880.x.
[30] YAMAKI K, YOSHINO S. Preventive and therapeutic effects of rapamycin, a mammalian target of rapamycin inhibitor, on food allergy in mice[J]. Allergy, 2012, 67(10): 1259-1270. DOI:10.1111/all.12000.
[31] LEUNG P S C, LEE Y S, TANG C Y, et al. Induction of shrimp tropomyosin-specific hypersensitivity in mice[J]. International Archives of Allergy and Immunology, 2008, 147(4): 305-314.DOI:10.1159/000144038.
[32] PILEGAARD K, MADSEN C. An oral Brown Norway rat model for food allergy: comparison of age, sex, dosing volume, and allergen preparation[J]. Toxicology, 2004, 196(3): 247-257. DOI:10.1016/j.tox.2003.11.010.
[33] NOWAKWEGRZYN A, SZAJEWSKA H, LACK G. Food allergy and the gut[J]. Nature Reviews Gastroenterology and Hepatology, 2017,14(4): 241-257. DOI:10.1038/nrgastro.2016.187.
[34] HE S H, ZHANG H Y, ZENG X N, et al. Mast cells and basophils are essential for allergies: mechanisms of allergic inflammation and a proposed procedure for diagnosis[J]. Acta Pharmacologica Sinica,2013, 34(10): 1270-1283. DOI:10.1038/aps.2013.88.
[35] HILL D A, SIRACUSA M C, ABT M C, et al. Commensal bacteria-derived signals regulate basophil hematopoiesis and allergic inf l ammation[J]. Nature Medicine, 2013, 18(4): 538-546. DOI:10.1038/nm.2657.
[36] ŻUKIEWICZSOBCZAK W, WRÓBLEWSKA P, ADAMCZUK P, et al.Probiotic lactic acid bacteria and their potential in the prevention and treatment of allergic diseases[J]. Central European Journal of Immunology, 2014, 39(1): 104-108. DOI:10.5114/ceji.2014.42134.
[37] AZAD M B, KONYA T, GUTTMAN D S, et al. Infant gut microbiota and food sensitization: associations in the first year of life[J]. Clinical and Experimental Allergy, 2015, 45(3): 632-643. DOI:10.1111/cea.12487.
[38] WALSH C J, GUINANE C M, O’TOOLE P W, et al. Beneficial modulation of the gut microbiota[J]. FEBS Letters, 2014, 588(22):4120-4130. DOI:10.1016/j.febslet.2014.03.035.
Construction of Tropomyosin-Sensitized Mouse Model and Effect of Lactic Acid Bacteria-Induced Intestinal Mucosal Immunity on Allergenicity
FU Linglin, FU Shujie, HUANG Jianjian, et al. Construction of tropomyosin-sensitized mouse model and effect of lactic acid bacteria-induced intestinal mucosal immunity on allergenicity[J]. Food Science, 2019, 40(7): 169-176. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180710-131. http://www.spkx.net.cn