杏(Prunus armeniaca L.)在新疆园艺产业中占重要地位。2016年,新疆杏种植面积达1.24×109 m2,产量达1.15×106 t[1]。杏属呼吸跃变型果实,常温下易发生腐败变质。低温贮藏虽可有效抑制杏果实采后腐烂,但会导致冷敏性果实杏发生生理紊乱,出现冷害现象[2]。研究发现,可溶性糖不仅能通过调节蛋白质合成来作为植物生长控制的基础[3],还可作为活性氧清除剂,维持细胞内活性氧平衡,对植物抗低温逆境起重要作用[4-5]。如红树莓中糖的积累能增强其抗冷害逆境耐受力[6]。近几年来,糖在植物抗冷害胁迫中起到的调节作用成为研究热点。
油菜素内酯是一种新型甾体植物生长激素,它能充分激发植物内在潜能,促进生长,增加产量,同时提高植物的抗寒、抗病、抗盐等能力,使植物的耐逆性增强,被认为是第六大类植物激素[7-8]。但从植物中提取油菜素内酯工艺复杂,成本昂贵,所以更多使用的是利用麦角甾醇等天然甾体化合物改造合成的油菜素甾体化合物产品,24-表油菜素内酯(24-epibrassinolide,EBR)就是其中一种[9]。目前,针对EBR的研究更多地集中于大豆[10]、黑麦草[11]的抗盐胁迫,葡萄叶片[12]的抗病害胁迫,及番茄植株[13]的抗弱光胁迫等积极作用,近年来研究也证实了EBR能对桃[14]、茄子[15]果实冷害进行有效控制,关注点多在冷害控制效果与活性氧代谢的研究上,但EBR对果实糖含量和冷害关系的影响鲜见报道。
本研究以新疆‘赛买提’杏为实验材料,探究EBR对杏果实冷害发生情况与可溶性糖含量变化及其关系的影响,为完善低温胁迫下可溶性糖对果实的保护机制和采后果实低温适应性诱导提供参考依据。
新疆‘赛买提’杏采自于新疆库车县乌恰镇杏果园。杏果实硬度用GY-B型果实硬度计(探头直径4 mm)在果实赤道部位等距离取3个点测定并取平均值,可溶性固形物质量分数用WYT-J型手持糖度仪进行测定,选取硬度在13~15 kg/cm2,可溶性固形物质量分数在10%~12%之间、无病虫害、无机械损伤的果实,采摘后于12 h之内运回新疆农业大学果蔬采后生理研究室。
蔗糖、葡萄糖、山梨醇、果糖标准品及乙腈(色谱纯) 美国Sigma公司;EBR(粉剂,纯度≥90%)上海源叶生物科技有限公司。
LC-20A高效液相色谱(high performance liquid chromatography,HPLC)系统(配有RID-10A示差折光检测器和LabSolutionsLCsolution色谱工作站) 日本岛津公司;GL-20G-2高速冷冻离心机 上海安亭科学仪器厂;TU-1810紫外分光光度计 北京普析通用仪器有限公司;XMTD-4000电热恒温水浴锅 北京永光明仪器厂;DDS-307电导率仪 上海精密科学仪器有限公司;KQ-250DE数控超声波清洗器 昆山市超声仪器有限公司。
1.3.1 原料处理
根据前期预实验,在0~2 mg/L范围内,质量浓度0.9 mg/L的EBR溶液处理后,‘赛买提’杏冷藏期间各品质指标表现最优,质量浓度过高会加快果实腐烂;因此选择0.9 mg/L作为本实验处理的质量浓度。用减压渗透[16]的方式处理杏果实,将浸泡有杏果实的EBR溶液抽气减压至0.05 MPa保持2 min,之后恢复常压继续浸泡5 min,自然晾干后置于温度为0 ℃、相对湿度为90%~95%的冷库贮藏。以蒸馏水处理作为对照组,每处理选用300 个杏果实,重复3 次。
1.3.2 冷害指数测定
参照Wang Zhen等[17]的方法,将杏果实冷害分为5 级。其中,0级:无冷害发生;1级:冷害面积0~5%之间;2级:冷害面积5%~25%之间;3级:冷害面积25%~50%之间;4级:冷害面积大于50%;按公式(1)计算冷害指数。每处理观察100 个杏果实,重复3 次,总共统计样本量为300 个杏果实。
1.3.3 冷害发病率测定
以单个果实冷害程度达1级及以上计为发病果,按式(2)计算冷害发病率。每处理观察100 个杏果实,重复3 次,总共统计样本量为300 个杏果实。
1.3.4 细胞膜透性测定
使用打孔器(直径5 mm)取杏果肉并切成厚度约2 mm圆片,测定新鲜圆片浸提液的电导率(L1)和煮沸后果实圆片的电导率(L0),按式(3)计算的比值即相对电导率(Le),以相对电导率来表示细胞膜渗透率,每处理选果3 个,重复3 次。
1.3.5 MDA含量测定
参照曹建康等[1 8]的方法测定丙二醛(malondialdehyde,MDA)含量。
1.3.6 可溶性糖含量测定
采用HPLC测定可溶性糖含量。提取方法:称取2.00 g杏果肉样品,加入4.00 mL超纯水冰浴研磨匀浆,后用2.00 mL超纯水清洗研钵,转入到离心管中,先超声提取5 min后转入水浴锅80 ℃提取15 min,10 000×g离心20 min后取上清液,残渣加超纯水后重复以上步骤一次,合并上清液,定容于25 mL容量瓶,过0.45 μm滤膜,备用。每处理选果3 个,重复3 次。
测定条件:流动相为乙腈-水(体积比75∶25),流速为1 mL/min,柱温50 ℃,进样体积20 μL,分析时长15 min。检测器:RID-10A示差折光检测器,色谱柱:Kromasil氨基色谱柱(4.6 mm×250 mm,5 μm)。
标准曲线的制作:分别准确称取100 mg蔗糖、葡萄糖、山梨醇、果糖标准品,用超纯水定容至10 mL,配制质量浓度为10.00 mg/mL的混合标准品母液,梯度稀释至5.00、2.50、2.00、1.00、0.50、0.25 mg/mL的标准溶液,经0.45 μm滤膜过滤,备用。
采用Excel 2007软件和SPSS 19.0软件进行数据分析。差异显著性分析方法用单因素方差分析,P<0.05表示差异显著。

图1 EBR处理对杏果实冷害指数(A)和冷害发病率(B)的影响
Fig. 1 Effect of EBR treatment on chilling injury index (A) and chilling injury rate (B) of apricots
同一贮藏时间,不同处理组小写字母不同表示差异显著(P<0.05)。下同。
如图1A所示,对照组在贮藏第21天出现冷害症状,EBR处理组较对照组推后7 d出现冷害现象。随着贮藏时间延长,对照组与处理组冷害指数均呈现上升趋势,且处理组杏果实冷害指数始终低于对照组。到贮藏第42天时,EBR处理组冷害指数比对照组低24.2%(P<0.05)。说明EBR处理可明显降低杏果实贮藏期间冷害指数。
由图1B可知,整个贮藏期EBR处理杏果实冷害发病率始终低于对照组,到贮藏期结束时,对照组杏果实冷害发病率为42.3%,EBR处理组为31.5%,比对照组低25.5%(P<0.05)。说明EBR处理可有效抑制杏果实冷害发病率,延缓杏果实冷害的发生。

图2 EBR处理对杏果实细胞膜渗透率(A)和MDA含量(B)的影响
Fig. 2 Effect of EBR treatment on cell membrane permeability (A) and malondialdehyde content (B) of apricots
果蔬组织受到低温胁迫时,细胞膜结构与功能都受到影响,往往表现为细胞膜透性增加和电解质外渗[19],由图2A可知,EBR处理后杏果实细胞膜渗透率总体呈现上升趋势,且处理组始终显著低于对照组(P<0.05),在第28、42天分别比对照组低16.8%、17.4%,说明EBR处理可保护细胞膜结构完整性,有效抑制杏果实冷害的发生。
MDA是膜脂过氧化的产物之一[20],由图2B可知,整个低温贮藏期间EBR处理组MDA含量始终低于对照组,到第28天时,EBR处理组与对照组MDA含量分别达到0.68、0.84 nmol/g,随后差距逐渐加大,到贮藏期结束时EBR处理组MDA含量比对照组低22.3%(P<0.05)。表明EBR处理能有效抑制杏果实冷藏期间膜脂过氧化进程,从而延缓衰老。
由图3可知,标准样中各组分依次的出峰顺序为果糖、山梨醇、葡萄糖和蔗糖,保留时间分别7.298、8.048、8.532、11.686 min。样品可溶性糖HPLC结果见图4。
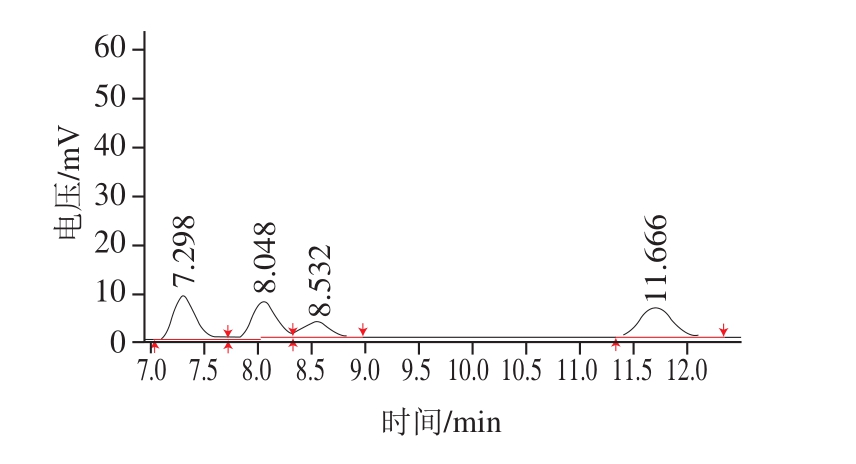
图3 糖混合标准品的HPLC图
Fig. 3 High performance liquid chromatogram of mixed saccharide standards

图4 鲜杏果实样品可溶性糖成分的HPLC图
Fig. 4 High performance liquid chromatogram of soluble saccharides in apricots

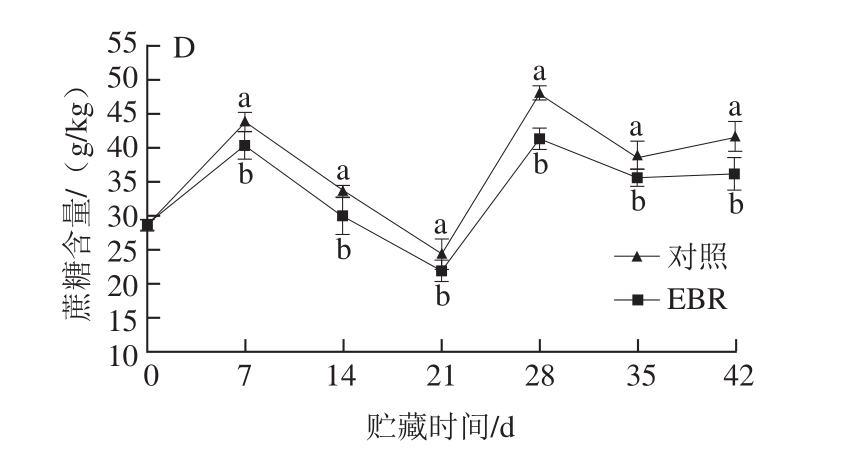
图5 EBR处理对杏果实果糖(A)、山梨醇(B)、葡萄糖(C)、蔗糖(D)含量的影响
Fig. 5 Effect of EBR treatment on the contents of fructose (A),sorbitol (B), glucose (C) and sucrose (D) in apricots
如图5A所示,果糖含量在整个贮藏期间呈现不断上升的趋势,且EBR处理组杏果实果糖含量始终高于对照组。在贮藏前期,果糖含量保持平缓上升,对照组在21 d后,上升幅度陡然增大,而EBR处理组则推迟7 d后上升幅度显著加大。第35、42天时,处理组果糖含量分别比对照组高49.5%和19.4%(P<0.05)。表明EBR处理可明显增加低温贮藏期间杏果实果糖含量。
杏果实贮藏中后期(14~21 d)EBR处理组与对照组山梨醇含量变化趋势相同(图5B),呈降-升-降的趋势,且EBR处理组含量始终高于对照组,在第7天时出现最大差异,此时处理组比对照组高18.2%(P<0.05),贮藏到42 d时,EBR处理组与对照组山梨醇含量均达到最低,表明EBR处理可增加杏果贮藏期间山梨醇含量,但贮藏结束时,两组山梨醇含量比初始均稍有下降。
葡萄糖含量经EBR处理后在贮藏前期无明显变化(图5C),21 d后逐渐增大,直到贮藏结束时达到47.4 g/kg。对照组果实葡萄糖含量在冷藏开始时先逐步下降,14 d时达最低值后缓慢上升,到贮藏结束时比EBR处理组低31.2%(P<0.05)。表明EBR处理可显著增加低温贮藏期间杏果实葡萄糖含量。
蔗糖含量变化与其他糖分相反(图5D),EBR处理后蔗糖含量始终低于对照组。0 d时两组蔗糖含量为28.8 g/kg,到第7天时,EBR处理组蔗糖含量上升到40.4 g/kg,低于对照组7.8%(P<0.05),随后下降到最低值22.1 g/kg(21 d时),低于对照组9.7%(P<0.05),之后缓慢上升,到贮藏结束时低于对照组13.1%(P<0.05)。对照组变化趋势与处理组相同。
可溶性糖是影响果实风味与质量的重要因素之一[21]。在本研究中测得杏果实中可溶性糖主要有果糖、山梨醇、葡萄糖、蔗糖,与前人实验结果[22]类似。EBR处理增加了杏果实冷藏期间果糖、山梨醇和葡萄糖含量,EBR处理对杏果实冷藏期间品质的保持起到积极作用。李园园[23]、柳巧禛[24]等的研究也表明EBR处理保持了草莓、‘赤霞珠’葡萄果实的贮藏品质。同时,EBR处理明显降低了杏果实冷藏期间冷害指数、冷害发病率、MDA含量与细胞膜渗透率,有效抑制了杏果实冷害的发生,而可溶性糖除了是果实品质的重要组成,对保护果实免受冷应激损伤同样起重要作用。已有的研究表明,桃在5 ℃贮藏28 d时出现冷害现象,较没出现冷害的0 ℃贮藏果实表现出更低的蔗糖含量和较高的葡萄糖和果糖含量[25];1 ℃贮藏时冷害较轻的‘宁海白’枇杷比冷害严重的‘大红袍’枇杷葡萄糖、果糖含量高[26];一氧化氮(NO)熏蒸李果实较非熏蒸组,果糖和葡萄糖含量增高,蔗糖含量降低,冷害症状显著降低[27]。山梨醇代谢在蔷薇科植物中起重要作用,已有研究发现苹果抗寒性与山梨醇含量呈正相关[28]。以上结论均证实糖在采后果实抗低温逆境胁迫中起重要作用。
氧化应激反应是诱导细胞损伤的关键因素之一,一方面葡萄糖与果糖作为主要还原糖,其积累可以缓解氧化应激反应,提高膜的稳定性,抵抗低温胁迫造成的损伤[29]。其中葡萄糖可通过戊糖磷酸途径清除活性氧[30],还可作为抗坏血酸合成的前体物,诱导抗坏血酸-谷胱甘肽循环减缓果实冷害的发生[31],这在桃[25]、枇杷[32]、芒果[33]中已经得到证实。而生物膜系统的损伤在膜脂相变理论[34]中是植物遭受低温逆境时的原初反应,这将导致胞内物质的损失与电解质渗透及膜脂过氧化的增加。另一方面,糖物质积累可调节渗透势,维持细胞渗透压平衡,保持细胞水分,稳定磷脂双分子层的原始结构,减轻低温对生物膜的损伤[35]。MDA是膜脂过氧化的产物,过多的MDA会影响膜结构稳定,扰乱正常的生理代谢[20]。在本研究中EBR在提高果糖、山梨醇和葡萄糖含量的同时降低MDA含量与细胞膜渗透率,缓解了冷害的发生。
在本研究中,杏果实经EBR处理后蔗糖含量有所下降,Wang Zhen等[17]针对鲜食吊干杏的研究表明,草酸处理能降低蔗糖含量和冷害发生,与本研究结论相似。Shao Xingfeng等[32]研究表明,热处理后枇杷果实冷藏期间蔗糖含量降低,冷害程度减轻;而Holland等[36]则研究得出热处理可增加蔗糖含量而减轻冷藏期间橘子冷害的发生。因此,关于蔗糖在植物抗冷害中起的作用可能因果实品种、成熟度等的不同有所变化,至于哪一种糖在抗低温胁迫中起最重要作用尚未定论。
果实低温贮藏期间不同类型糖的变化模式非常复杂,糖对抗冷胁迫的调控机理尚不明确,还需应用分子技术,研究糖代谢中关键酶的基因组学与相关蛋白表达,进一步探讨糖作为信号分子对果实抗低温的调控作用,以此为农业产业发展提供助力。
本研究表明,EBR处理可明显降低杏果实低温贮藏期间冷害指数、冷害发病率与MDA含量、细胞膜透性,增强杏果实抗冷性,这可能与果糖、山梨醇、葡萄糖含量的增加密切相关。
[1] 新疆维吾尔自治区统计局. 新疆统计年鉴2017[M]. 北京: 中国统计出版社, 2017: 195-196.
[2] KOUSHESH S M, ARZANI K, BARZEGAR M. Postharvest polyamine application alleviates chilling injury and affects apricot storage ability[J]. Journal of Agricultural and Food Chemistry, 2012,60(36): 8947-8953. DOI:10.1021/jf302088e.
[3] LASTDRAGER J, HANSON J, SMEEKENS S. Sugar signals and the control of plant growth and development[J]. Journal of Experimental Botany, 2014, 65(3): 799-807. DOI:10.1093/jxb/ert474.
[4] ELS K, DARIN P, JACO V, et al. Plant sugars are crucial players in the oxidative challenge during abiotic stress: extending the traditional concept[J]. Plant Cell and Environment, 2013, 36(7): 1242-1255.DOI:10.1111/pce.12061.
[5] MATROS A, PESHBV D, PEUKERT M, et al. Sugars as hydroxyl radical scavengers: proof-of-concept by studying the fate of sucralose in Arabidopsis[J]. Plant Journal, 2015, 82(5): 822-839. DOI:10.1111/tpj.12853.
[6] PALONEN P, BUSZARD D, DONNELLY D. Changes in carbohydrates and freezing tolerance during cold acclimation of red raspberry cultivars grown in vitro and in vivo[J]. Physiologia Plantarum, 2000, 110(3): 393-401. DOI:10.1111/j.1399-3054.2000.1100314.x.
[7] MOORE T C. Biochemistry and physiology of plant hormone[M].Berlin: Springer-Verlag, 1989: 255-264.
[8] 李辉, 左钦月, 涂升斌. 油菜素内酯生物合成和代谢研究进展[J].植物生理学报, 2015, 51(11): 1787-1798. DOI:10.13592/j.cnki.ppj.2015.0377.
[9] 王广聚, 董服灿, 董建军, 等. 24-表油菜素内酯的合成及应用研究[J].农药, 2001(6): 12-15. DOI:10.16820/j.cnki.1006-0413.2001.06.004.
[10] 吴杨, 高慧纯, 张必弦, 等. 24-表油菜素内酯对盐碱胁迫下大豆生育、生理及细胞超微结构的影响[J]. 中国农业科学, 2017, 50(5):811-821. DOI:10.3864/j.issn.0578-1752.2017.05.004.
[11] WU W L, ZHANG Q, ERVIN E H, et al. Physiological mechanism of enhancing salt stress tolerance of perennial ryegrass by 24-epibrassinolide[J]. Frontiers in Plant Science, 2017, 8: 1-11.DOI:10.3389/fpls.2017.01017.
[12] 刘庆, 栾雪涛, 徐世彦, 等. 24-表油菜素内酯对葡萄叶片抵御霜霉菌侵染的影响[J]. 中国农业科学, 2016, 49(15): 3010-3018.DOI:10.3864/j.issn.0578-1752.2016.15.015.
[13] 李宁. 外源24-表油菜素内酯增强番茄植株弱光胁迫耐性的生理机制[D]. 南京: 南京农业大学, 2014: 1-63.
[14] GAO H, ZHANG Z K, LV X G, et al. Effect of 24-epibrassinolide on chilling injury of peach fruit in relation to phenolic and proline metabolisms[J]. Postharvest Biology and Technology, 2016, 111: 390-397. DOI:10.1016/j.postharvbio.2015.07.031.
[15] GAO H, KANG L N, LIU Q, et al. Effect of 24-epibrassinolide treatment on the metabolism of eggplant fruits in relation to development of pulp browning under chilling stress[J]. Journal of Food Science and Technology, 2014, 52(6): 3394-3401. DOI:10.1007/s13197-014-1402-y.
[16] 赵亚婷, 朱璇, 马玄, 等. 采前水杨酸处理对杏果实抗病性及苯丙烷代谢的诱导[J]. 食品科学, 2015, 36(2): 216-220. DOI:10.7506/spkx1002-6630-201502042.
[17] WANG Zhen, CAO Jiankang, JIANG Weibo. Changes in sugar metabolism caused by exogenous oxalic acid related to chilling tolerance of apricot fruit[J]. Postharvest Biology and Technology,2016, 114: 10-16. DOI:10.1016/j.postharvbio.2015.11.015.
[18] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 轻工业出版社, 2007: 148-149.
[19] KHAN M M, AL-MAS’OUDI R S M, AI-SAID F, et al. Salinity effects on growth, electrolyte leakage, chlorophyll content and lipid peroxidation in cucumber (Cucumis sativus L.)[J]. International Proceedings of Chemical Biological and Environmental, 2013, 55(6):28-32. DOI:10.7763/IPCBEE.2013.V55.6.
[20] ZHANG C F, TIAN S P. Crucial contribution of membrane lipids unsaturation to acquisition of chilling-tolerance in peach fruit stored at 0 ℃[J]. Food Chemistry, 2009, 115(2): 405-411. DOI:10.1016/j.foodchem.2008.12.021.
[21] ITAI A, TANAHASHI T. Inhibition of sucrose loss during cold storage in Japanese pear (Pyrus pyrifolia Nakai) by 1-MCP[J]. Postharvest Biology and Technology, 2008, 48(3): 355-363. DOI:10.1016/j.postharvbio.2007.10.015.
[22] 杜改改, 李泰山, 刁松锋, 等. 6 个杏李品种果实甜酸风味品质分析[J]. 果树学报, 2017, 34(1): 41-49. DOI:10.13925/j.cnki.gsxb.20160108.
[23] 李园园, 王莉, 周梦洁, 等. 2,4-表油菜素内酯对草莓果实贮藏品质及抗氧化活性的影响[J]. 食品科学, 2018, 39(1): 279-284.DOI:10.7506/spkx1002-6630-201801042.
[24] 柳巧禛, 秦晨亮, 代红军. 24-表油菜素内酯对“赤霞珠”葡萄品质及蔗糖代谢相关酶活性的影响[J]. 北方园艺, 2016(15): 38-41.DOI:10.11937/bfyy.201615009.
[25] WANG K, SHAO X F, GONG Y F, et al. The metabolism of soluble carbohydrates related to chilling injury in peach fruit exposed to cold stress[J]. Postharvest Biology and Technology, 2013, 86(3): 53-61.DOI:10.1016/j.postharvbio.2013.06.020.
[26] CAO S F, YANG Z F, ZHENG Y H. Sugar metabolism in relation to chilling tolerance of loquat fruit[J]. Food Chemistry, 2013, 136(1):139-143. DOI:10.1016/j.foodchem.2012.07.113.
[27] SINGH S P, SINGH Z, SWINNY E E. Postharvest nitric oxide fumigation delays fruit ripening and alleviates chilling injury during cold storage of Japanese plums (Prunus salicina Lindell)[J].Postharvest Biology and Technology, 2009, 53(3): 101-108.DOI:10.1016/j.postharvbio.2011.01.011.
[28] JACKSON M B, BLACK C R. Interacting stresses on plants in a changing climate[M]. Berlin: Springer-Verlag, 1993: 647-657.
[29] GILL S S, TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 2010, 48(12): 909-930. DOI:10.1016/j.plaphy.2010.08.016.
[30] COUEE I, SULMON C, GOUESBET G, et al. Involvement of soluble sugars in reactive oxygen species balance and responses to oxidative stress in plants[J]. Journal of Experimental Botany, 2006, 57(3):449-459. DOI:10.1093/jxb/erj027.
[31] LINSTERI C L, CLARKE S G. L-Ascorbate biosynthesis in higher plants: the role of VTC2[J]. Trends in Plant Science, 2008, 13(11):567-573. DOI:10.1016/j.tplants.2008.08.005.
[32] SHAO Xingfeng, ZHU Yong, CAO Shifeng, et al. Soluble sugar content and metabolism as related to the heat-induced chilling tolerance of loquat fruit during cold storage[J]. Food and Bioprocess Technology,2013, 6(12): 3490-3498. DOI:10.1007/s11947-012-1011-6.
[33] ZAHARAH S S, SINGH Z. Postharvest nitric oxide fumigation alleviates chilling injury, delays fruit ripening and maintains quality in cold-stored ‘Kensington Pride’ mango[J]. Postharvest Biology and Technology, 2011, 60(3): 202-210. DOI:10.1016/j.postharvbio.2011.01.011.
[34] WONGSHEREE T, KETSA S, VAN DOORN W G. The relationship between chilling injury and membrane damage in lemon basil (Ocimum citriodourum ) leaves[J]. Postharvest Biology and Technology, 2009,51(1): 91-96. DOI:10.1016/j.postharvbio.2008.05.015.
[35] ANCHORDOGUY T J, RUDOLPH A S, CARPENTER J F,et al. Modes of interaction of cryoprotectants with membrane phospholipids during freezing[J]. Cryobiology, 1987, 24(4): 324-331.DOI:10.1016/0011-2240(87)90036-8.
[36] HOLLAND N, MENEZES H C, LAFUENT M T. Carbohydrates as related to the heat-induced chilling tolerance and respiratory rate of ‘Fortune’ mandarin fruit harvested at different maturity stages[J]. Postharvest Biology and Technology, 2002, 25(2): 181-191.DOI:10.1016/S0925-5214(01)00182-X.
Effect of 24-Epibrassinolide on Cold Resistance and Soluble Sugar Content in Apricots during Postharvest Storage
ZHANG Zhurun, ZHANG Ruijie, ZHAO Jin, et al. Effect of 24-epibrassinolide on cold resistance and soluble sugar content in apricots during postharvest storage[J]. Food Science, 2019, 40(7): 198-203. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20180226-199. http://www.spkx.net.cn