
图1 TMAO形成及其促进AS作用途径
Fig. 1 Effect of TMAO production on AS
心血管疾病(cardiovascular disease,CVD)是当今社会危害人类健康、导致人类死亡最主要的疾病之一。《2016年中国心血管病报告》表明,CVD死亡率目前仍居我国疾病死亡构成的首位,高于肿瘤和其他疾病,占居民疾病死亡构成的40%以上[1]。动脉粥样硬化(atherosclerosis,AS)是CVD的主要病理基础[2],其发展受多种因素共同调节。动脉壁内皮细胞的受损会促使血循环中的单核细胞黏附到血管内皮表面,并从单核细胞分化为巨噬细胞。巨噬细胞通过吞噬内皮下层的氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)进一步发展为泡沫细胞,并在内皮下层脂质堆积,形成AS斑块[3-5]。此外,平滑肌细胞的增殖会导致覆盖脂质核心的炎性纤维组织应激增生,形成粥样斑块,造成动脉壁变厚及失去弹性[6],动脉管腔狭窄闭塞进而引起梗塞[7]。从传统上来看,内皮细胞、巨噬细胞、平滑肌细胞是构成AS病灶的三要素,它们相互作用,促进AS发展[7]。人们的日常膳食结构、生活方式、环境和遗传等因素都对AS的发生、发展过程存在一定影响。随着人们物质生活水平的提高,大众对于饮食影响AS这一方面的关注度逐渐提升。
研究表明,肉、蛋、海鲜类食物中含量丰富的三甲胺(trimethylamine,TMA)类结构营养素如胆碱、L-肉碱等,在肠道菌群作用下最终可生成氧化三甲胺(trimethylamine-N-oxide,TMAO),且杂食者相较于素食者可产生更多TMAO[8]。人群实验表明,血清中TMAO水平的升高会使颈动脉内膜中层厚度增加,且独立于已有的CVD危险因素[9]。TMAO能从抑制胆汁酸合成转运和促进泡沫细胞形成两方面造成胆固醇在体内的堆积,促进AS的发生发展[10-12]、血小板聚集[13]以及糖尿病和高血压的形成[14]。然而,胆碱作为人体必需营养素,具有抗炎、调节免疫功能[15]、改善脂质代谢[16]、促进脑发育[17]等有益功能,在日常生理功能和疾病预防中都发挥着重要作用,因此胆碱的摄入无法被完全避免。而通过抑制TMAO的生成代谢,减小AS风险,可开启CVD防治的一个新方向。
膳食胆碱、磷脂酰胆碱、肉碱在人体中主要经过两个阶段最终形成TMAO。第1阶段为膳食胆碱等通过肠道菌群TMA裂解酶作用,裂解C—N键,形成TMA。第2阶段为TMA通过门脉循环进入肝脏,并在黄素单加氧酶3(flavin-containing monooxygenase 3,FMO3)作用下迅速氧化形成TMAO。
TMAO能通过降低胆汁酸合成主要酶如胆固醇7α-羟化酶(cholesterol 7α-hydroxy-lase,CYP7A1)、胆固醇27α-羟化酶(cholesterol 27α-hydroxy-lase,CYP27A1)和胆汁酸转运蛋白(Oatp1、Oatp4、CFTR/MRP、Mrp2、Ntcp)表达,抑制胆汁酸合成和转运[18]。胆汁酸是胆固醇代谢的主要去路,人体内约有50%的胆固醇会在肝脏中被代谢为胆汁酸,最终通过粪便排出体外或经肠肝循环重吸收回肝脏[19]。而胆汁酸的合成途径主要有两条:一条为经典途径,也是合成胆汁酸的主要通路,该通路的限速酶为CYP7A1,CYP7A1能催化胆固醇合成7α-羟化胆固醇,经一系列酶促反应生成胆汁酸,并通过扩大胆汁酸池增加胆固醇转运;另一条为替代途径(约占人体总胆汁酸合成的25%),在经典途径受阻时可被激活,其限速酶为CYP27A1,它不仅能影响胆汁酸的生物合成,还能催化胆固醇合成27-羟基胆固醇直接流入肝脏代谢成胆汁酸[20-23]。CYP7A1和CYP27A1表达的降低会抑制胆汁酸合成,同时干扰血循环中的胆固醇逆向转运(reverse cholesterol transport,RCT)[8,12,24],造成胆固醇在细胞内的堆积,进而导致AS,造成CVD发病率的上升[10,25]。
胆固醇会在巨噬细胞中聚集并使巨噬细胞泡沫化,形成泡沫细胞,其在AS进程中发挥着重要作用[26]。TMAO能通过促进巨噬细胞A1型清道夫受体(scavenger receptor A1,SR-A1)和B类清道夫受体36(cluster of differentiation 36,CD36)的表达,参与泡沫细胞的形成[24]。CD36作为巨噬细胞表面起识别、内吞ox-LDL作用的主要清道夫受体[27],能刺激巨噬细胞与ox-LDL结合,使胆固醇在巨噬细胞中聚集[28],导致巨噬细胞泡沫化。最新研究发现,单独使用TMAO可以增加ox-LDL诱导的CD36表达[29]。SR-A1能与ox-LDL特异性结合,导致巨噬细胞内的胆固醇堆积[30]。当巨噬细胞无法清除自身过量的胆固醇时,则会由巨噬细胞进一步发展为泡沫细胞,这也是泡沫细胞形成的主要机制[31-32]。ox-LDL在泡沫细胞中大量堆积使细胞胀破死亡后,会形成富含胆固醇的脂质核心,并在内皮细胞等作用下形成AS斑块[33];另一方面,TMAO能干扰RCT,促进泡沫细胞形成[24]。RCT是指将肝外组织细胞内的胆固醇经脂蛋白运输到肝脏,以胆汁形式分泌,最终通过粪便排出体外的胆固醇代谢过程,也是机体排出过多胆固醇的唯一途径[34-35]。TMAO可能通过抑制RCT,使胆固醇在巨噬细胞内不断积累,形成泡沫细胞,进而产生AS斑块[24-25]。细胞实验发现,TMAO还能通过丝裂原活化蛋白激酶和核因子-κB信号通路促进血管炎症[36],激活细胞间黏附分子ICAM-1,加速泡沫细胞形成和AS发展进程[29,37],但此结果还需进一步实验证实。ICAM-1为免疫球蛋白超家族成员,正常情况下ICAM-1不表达或很少表达,但在AS形成过程中,动脉内皮的损伤会引起内皮细胞表面黏附性的改变,并促进单核细胞黏附、迁移至内皮下层,转化为巨噬细胞,摄取脂质形成泡沫细胞[38]。
因此,可以通过调节肠道菌群抑制TMA生成和FMO3活性以减少TMAO产生,促进胆汁酸合成转运,抑制TMAO参与泡沫细胞形成,从而达到抗AS的目的(图1)。

图1 TMAO形成及其促进AS作用途径
Fig. 1 Effect of TMAO production on AS
机体内的TMAO水平很大程度上影响着AS的发病率,而食品功能成分干预正是通过不同的途径调节体内TMAO水平,从而抑制AS的发生、降低发病风险。
肠道菌群能将膳食胆碱、肉碱等转化为TMAO的前体物质TMA。肠道菌群组成的差异与肥胖和糖尿病等慢性代谢疾病以微妙的方式相互关联[39-41],且其还参与血小板功能调节,能增加血栓形成[42]。研究表明,肠道菌群的丰度与CVD的标志物有显著相关性,其中丰度低的个体更易出现脂质代谢异常[43]。人群研究发现肠道菌群可能通过调节受试者体内脂质代谢来影响AS,且以拟杆菌、普雷沃氏菌、梭状芽孢杆菌等为代表[44]。Liao Zhenlin等[45]发现茶叶中的活性物质茶多酚可促进肠道中双歧杆菌生长从而抑制AS的发生。红枣[46]、豆渣[47-48]等膳食纤维能通过在肠道中被微生物分解产生短链脂肪酸,降低肠道环境pH值,从而促进乳酸杆菌等益生菌的生长,抑制沙门氏菌等致病菌的生长,达到改善脂质代谢的目的[49]。近期研究显示,改善肠道菌群调节脂质代谢可能与TMAO抑制有关[50],但目前国内外有关于这方面的营养干预研究较少。
采用户天然多酚类化合物白藜芦醇(resveratrol,RSV)喂养C57BL/6J小鼠,发现小鼠肠道中拟杆菌属、乳杆菌属、双歧杆菌属等益生菌株相对丰度增加,普雷沃氏菌、幽门螺杆菌的相对丰度降低,并伴随着血浆中TMA和TMAO水平显著降低,肝脏胆汁酸合成增加。结果表明RSV可能通过重塑肠道中菌群的比例和构成,增强拟杆菌属、乳杆菌属、双杆菌属等有益菌株的相对比例,抑制TMAO的合成,达到抗AS效果[10]。动物研究采用抗生素处理小鼠,诱导小鼠体内肠道菌群失活,发现使用初期可抑制TMA生成,但长期使用单一抗生素(使用环丙沙星6 个月),则失去抑制TMA生成的作用,这一发现与耐抗生素微生物扩大现象一致[51]。大蒜中的有效成分大蒜素是一种具有抗菌疗效的天然植物化合物[52]。给小鼠喂食饮食肉碱和大蒜素,结果表明肉碱造模组小鼠粪便微生物菌群中的罗宾逊菌比例(与TMAO水平呈正相关)高于对照组,且其血浆TMAO水平是对照组的4~22 倍。肉碱加大蒜素的干预组小鼠罗宾逊菌的比例处于对照组和造模组之间,但血浆TMAO水平与对照组相比没有差异[53]。这项研究结果表明膳食大蒜素可能是通过与硫醇基团的快速反应抑制微生物中的某些含硫酶[54],从而抑制肉碱饮食诱导的肠道菌群功能改变,降低TMAO水平。而到目前为止,尚鲜有报道肠道菌群中具体负责产生TMA的细菌种类,因此难以直接证明大蒜素对TMA生产者的抑制效果[53]。Hernández-Alonso[55]和Lamuel-Paventos[56]等在探索开心果有益功效的过程中发现,胆碱含量丰富的开心果却能使血浆TMAO含量减少。推测这可能是因为开心果中富含以原花青素为主的聚合多酚,能在肠道中被肠道菌群代谢,增加双歧杆菌和乳酸杆菌比例。喂食肠杆菌ZDY01能使小鼠血浆TMAO和盲肠TMA水平显著降低,并且降低螺杆菌科等致病菌的相对比例。ZDY01可作为一种益生菌,通过直接抑制肠道中TMA的生成来重塑肠道菌群,从而减少TMAO含量[57]。
通过食品功能成分干预重塑肠道菌群的构成、比例和数量,影响TMAO前体物质的产生进而调节AS为目前研究的主要途径。但同时用胆碱、肉碱等TMAO前体物质加功能成分干预的研究并不多,且多以动物实验为主,仍需更多相关细胞实验和人群实验来支持。
TMA进入肝脏转化为TMAO需要FMOs参与调节[8]。而在FMO家族中FMO3的活性最高,小鼠中FMO3过表达会使血浆TMAO水平显著升高,FMO3不表达则可降低TMAO水平[12]。Warrier等[58]给敲除FMO3基因小鼠喂食胆固醇,发现相较于未敲除小鼠,其胆汁的分泌减少,并伴随着血浆中TMAO水平的下降。通过进一步研究发现,FMO3的活性与性别显著相关,且小鼠中雌鼠比雄鼠FMO3表达量高。这主要是因为在雌鼠中,大多数TMAO是由肝脏FMO3产生的,但是在缺乏肝脏FMO3的雄鼠中,大部分TMAO的产生是FMO1在起作用[12]。
FMO3之前已被证明由性激素和胆汁酸共同调节,但FMO1受性别影响较小[12,59]。通过药物来抑制FMO家族和特异性抑制FMO3的活性也被认为是一种可能减少TMAO合成、降低AS风险的潜在治疗措施。然而,FMO3被抑制会使得TMA在体内蓄积过多,产生鱼腥味气体,使人产生三甲基氨尿症等不良反应[60-61],不利于身体健康,因此这项治疗措施的可行性较低,其相关的营养干预研究也很少。
TMAO能下调胆汁酸合成主要酶和胆汁酸转运蛋白的表达,减少胆汁酸的分泌,引起胆汁酸池大小及组成成分改变,进而限制体内胆固醇分解代谢[10]。将TMAO饮食组小鼠的肝脏与普通饮食组小鼠相比,发现关键胆汁酸合成限速酶CYP7A1和CYP27A1表达显著降低,且胆汁酸转运蛋白Oatp1、Oatp4、CFTR/MRP、Mrp2、Ntcp表达也显著下降。这表明TMAO可能通过抑制胆汁酸合成和转运途径从而干扰血循环中的RCT[8]。
RSV被证实能改善高脂喂养小鼠的高胆固醇血症[62]。给C57BL/6J小鼠喂食RSV,发现相较于胆碱饮食组小鼠,RSV干预组小鼠血浆中TMA和TMAO水平与对照组相比显著降低,且伴随着CYP7A1表达的显著上调和法尼酯X受体(farnesoid X receptor,FXR)、成纤维细胞生长因子15(fibroblast growth factor 15,FGF15)表达的下调[10]。FXR-FGF15轴与CYP7A1之间存在着负反馈调节,同时这也是维持胆汁酸稳态最重要的机制之一[63]。RSV可能通过上调CYP7A1表达以及下调FXR-FGF15轴反作用于CYP7A1,增加了胆汁酸的合成代谢[10]。通过实验发现,促进胆汁酸代谢以增加胆固醇的排出可以减少脂质堆积,降低AS风险。
TMAO可能通过促进巨噬细胞受体SR-A1、CD36表达上调和抑制RCT进程加速泡沫细胞形成[24-25]。通过对ApoE-/-小鼠分别进行胆碱、TMAO、甜菜碱饮食饲养,并以正常饮食小鼠作为对照,发现与对照组相比,胆碱、TMAO、甜菜碱处理都上调了小鼠CD36和SR-A1的表达水平。这表明TMAO及其前体物质胆碱和甜菜碱在增强巨噬细胞的胆固醇积聚和泡沫细胞形成中起着重要的作用,其可能通过上调CD36和SR-A1表达量,促使LDL氧化成ox-LDL来增强胆固醇的聚积和泡沫细胞的生成,从而导致炎症的产生[24]。
M1和M2型巨噬细胞存在着相反的作用,M1型巨噬细胞具有促炎作用,而M2型巨噬细胞具有抗炎作用[64]。饮食中TMAO可能通过增加巨噬细胞M1的表达比例、减少巨噬细胞M2表达来加重脂肪组织炎症[65]。已有研究证实,鱼油能改善由TMAO加剧的脂肪组织炎症[65],并促进肥胖小鼠的脂肪组织巨噬细胞由M1表型转为M2表型[66]。鱼油可能通过下调有关巨噬细胞的表达,缓解或抑制TMAO产生的危害。而也有研究发现鱼肉中存在促AS风险因子,Yazdekhasti等[67]在研究鱼类蛋白保健功效时发现,分别喂食鱼蛋白、酪蛋白、大豆蛋白饮食的ApoE-/-小鼠中,鱼蛋白组ApoE-/-小鼠与酪蛋白及大豆蛋白组小鼠相比CD36得到明显上调,这会使得AS斑块显著增大,加剧心血管损伤。该研究组分析,这可能是因为与酪蛋白和大豆蛋白相比,鱼蛋白分离物中有更高含量的脂肪酸,尤其是饱和脂肪酸、单不饱和脂肪酸以及胆固醇。当机体无法完全排除过多的饱和脂肪酸以及残留的胆固醇时,就会促使泡沫细胞的形成,增加AS风险。此外,摄入奶酪也可以降低TMAO的产量[68],其机制可能是发酵乳制品尤其是奶酪会通过消化碳水化合物产生短链脂肪酸,降低肠道环境pH值,从而促进乳酸杆菌等有益菌群增加[69-70],而且短链脂肪酸还能通过下调巨噬细胞清道夫受体CD36,减少巨噬细胞的黏附和迁移以及增加斑块稳定性来改善病变[71]。葡萄和黑豆皮等果蔬中富含花色苷,流行病学研究显示花色苷具有降低AS风险的功效[72-73]。刘素稳[74]通过研究发现,蓝靛果花色苷提取物能使小鼠血浆TMAO水平下降,且能通过上调巨噬细胞中ATP结合盒转运体A1和ATP结合盒转运蛋白G5/G8(ATP-binding cassette transporter G5/G8,ABCG5/G8)的表达,加速小鼠巨噬细胞RCT进程,达到显著抗AS作用。通过活体小鼠模型发现,抑制TMAO诱导的从巨噬细胞到泡沫细胞的形成过程,促进RCT以增加胆固醇的排出,可以减少脂质堆积、减轻炎症,降低AS风险。
研究表明,苦荞麦可以预防CVD[75]。苦荞麦黄酮可升高血浆中一氧化氮(nitric oxide,NO)和内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)浓度,降低TMAO喂养小鼠血浆中甘油三酯、总胆固醇、低密度脂蛋白胆固醇等含量,减少TMAO诱导的心血管功能障碍。推测其可能通过激活eNOS/NO通路,刺激NO和eNOS等合成来预防内皮功能障碍,降低AS风险[76]。动物实验发现,麦麸可激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路,推测活化的肠上皮AMPK能对肠道菌群裂解酶产生抑制作用,减少TMA产生[77]。而人群研究通过给志愿者服用多菌株益生菌multi-strain probiotic VSL#3,发现其对TMAO血浆浓度无影响,其具体机制仍需进一步研究(表1)[78]。
表1 食品或功能成分调节TMAO对AS的影响
Table 1 Bioactive compounds in foods alleviates atherosclerosis by regulating the formation of TMAO
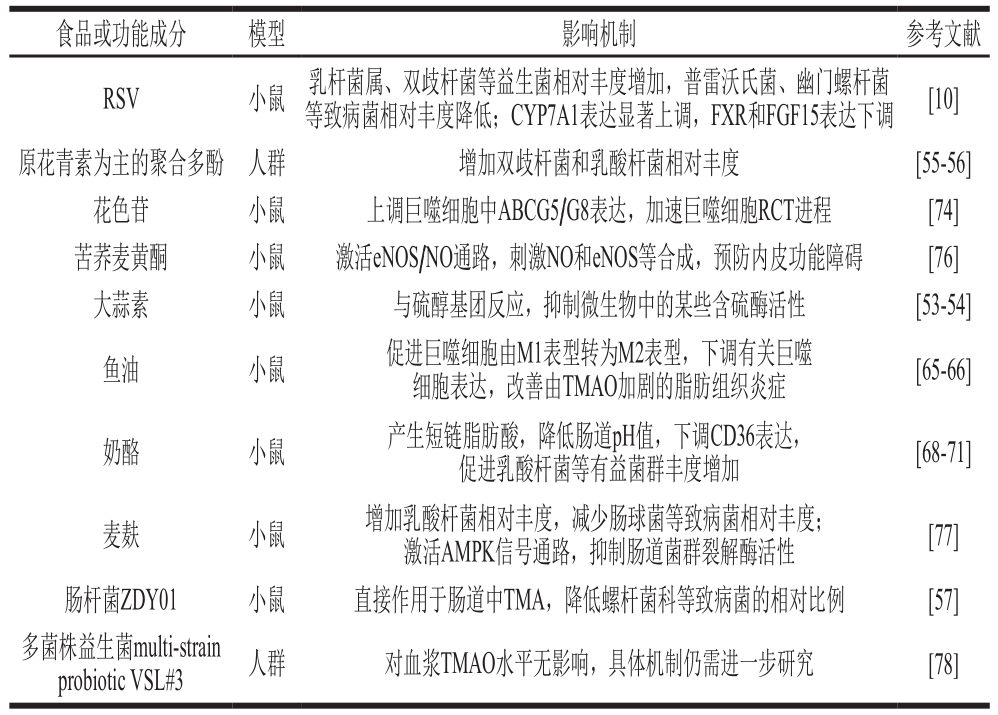
食品或功能成分 模型 影响机制 参考文献RSV 小鼠 乳杆菌属、双歧杆菌等益生菌相对丰度增加,普雷沃氏菌、幽门螺杆菌等致病菌相对丰度降低;CYP7A1表达显著上调,FXR和FGF15表达下调 [10]原花青素为主的聚合多酚 人群 增加双歧杆菌和乳酸杆菌相对丰度 [55-56]花色苷 小鼠 上调巨噬细胞中ABCG5/G8表达,加速巨噬细胞RCT进程 [74]苦荞麦黄酮 小鼠 激活eNOS/NO通路,刺激NO和eNOS等合成,预防内皮功能障碍 [76]大蒜素 小鼠 与硫醇基团反应,抑制微生物中的某些含硫酶活性 [53-54]鱼油 小鼠 促进巨噬细胞由M1表型转为M2表型,下调有关巨噬细胞表达,改善由TMAO加剧的脂肪组织炎症 [65-66]奶酪 小鼠 产生短链脂肪酸,降低肠道pH值,下调CD36表达,促进乳酸杆菌等有益菌群丰度增加 [68-71]麦麸 小鼠 增加乳酸杆菌相对丰度,减少肠球菌等致病菌相对丰度;激活AMPK信号通路,抑制肠道菌群裂解酶活性 [77]肠杆菌ZDY01 小鼠 直接作用于肠道中TMA,降低螺杆菌科等致病菌的相对比例 [57]多菌株益生菌multi-strain probiotic VSL#3 人群 对血浆TMAO水平无影响,具体机制仍需进一步研究 [78]
研究发现胆碱、肉碱等代谢产物TMAO可能成为新的独立的CVD危险因素。而胆碱作为人体必需营养素可对许多疾病有改善作用,因此通过干预TMAO形成过程来降低AS风险具有重要意义。食品功能成分可以通过抑制TMAO的生成途径来降低AS风险。本文综述了调节TMAO作用于AS的4 个方面:重塑肠道菌群构成比例;抑制肝脏中FMO3活性;促进胆汁酸合成转运;减少泡沫细胞生活,为未来防治AS提供了新的思路和理论依据。综合目前的研究进展,仍存在一些问题需进一步探讨研究。肠道菌群中作用于胆碱、L-肉碱、磷脂酰胆碱,负责产生TMA的具体细菌种类没有完全明确,研究仍处于表面阶段,需要进一步探索论证。同时,TMAO影响AS的具体作用机理仍不十分明确,有待进一步探讨。此外,目前该方向的研究多以动物实验为主,以干扰肠道菌群途径入手,相关人群实验、体外模拟实验以及进一步的分子机制研究相对缺乏,需要引起重视。综上所述,通过干预TMAO这一途径进一步了解膳食对CVD的干预具有重要意义。
[1] 陈伟伟, 高润霖, 刘力生, 等. 《中国心血管病报告2016》概要[J]. 中国循环杂志, 2017, 32(6): 521-530. DOI:10.3969/j.issn.1000-3614.2017.06.001.
[2] HANSSO G K. Inflammation, atherosclerosis, and coronary artery disease[J]. The New England Journal of Medicine, 2005, 352(16): 429-430. DOI:10.1056/NEJM200507283530425.
[3] 张娥, 徐藜栩, 赵统德, 等. 水蛭对动脉粥样硬化发生的相关细胞作用研究进展[J]. 中国动脉硬化杂志, 2017, 25(11): 1184-1188.DOI:10.3969/j.issn.1007-3949.2017.11.020.
[4] SWIRSKI F K, NAHRENDORF M. Leukocyte behavior in atherosclerosis, myocardial infarction, and heart failure[J]. Science,2013, 339: 161-166. DOI:10.1126/science.1230719.
[5] TABAS I, GLASS C K. Anti-inflammatory therapy in chronic disease: challenges and opportunities[J]. Science, 2013, 339: 166-172.DOI:10.1126/science.1230720.
[6] ROSS R. The pathogenesis of atherosclerosis: a perspective for the 1990s[J]. Nature, 1993, 362: 801-809. DOI:10.1038/362801a0.
[7] ROSS R. Atherosclerosis: an inflammatory disease[J]. New England Journal of Medicine, 1999, 340(2): 115-126. DOI:10.1056/NEJM199901143400207.
[8] KOETH R A, WANG Z, LEVISON B S, et al. Intestinal microbiota metabolism ofL-carnitine, a nutrient in red meat, promotes atherosclerosis[J]. Nature Medicine, 2013, 19(5): 576-585.DOI:10.1038/nm.3145.
[9] RANDRIANARISOA E, LEHNSTEFAN A, WANG X L, et al.Relationship of serum trimethylamineN-oxide (TMAO) levels with early atherosclerosis in humans[J]. Scientific Reports, 2016, 6: 1-9.DOI:10.1038/srep26745.
[10] CHEN M L, YI L, ZHANG Y, et al. Resveratrol attenuates trimethylamine-N-oxide (TMAO)-induced atherosclerosis by regulating TMAO synthesis and bile acid metabolism via remodeling of the gut microbiota[J]. MBIO, 2016, 7(2): e02210-e02215.DOI:10.1128/mBio.02210-15.
[11] 王伟占, 田凤石. 氧化三甲胺与动脉粥样硬化关系研究进展[J]. 天津医药, 2015, 43(4): 443-445. DOI:10.11958/j.issn.0253-9896.2015.04.030.
[12] BENNETT B J, DE AGUIAR VALLIMTQ, WANG Z N, et al.Trimethylamine-N-oxide, a metabolite associated with atherosclerosis,exhibits complex genetic and dietary regulation[J]. Cell Metabolism,2013, 17(1): 49-60. DOI:10.1016/j.cmet.2012.12.011.
[13] ZHU W, GREGORY J C, ORG E, et al. Gut microbial metabolite TMAO enhances platelet hyperreactivity and thrombosis risk[J]. Cell,2016, 165(1): 111-124. DOI:10.1016/j.cell.2016.02.011.
[14] TANG W H, HAZEN S L. The gut microbiome and its role in cardiovascular diseases[J]. Circulation, 2017, 135(11): 1008-1010.DOI:10.1161/CIRCULATIONAHA.116.024251.
[15] BOROVIKOVA L V, IVANOVA S, ZHANG M, et al. Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin[J]. Nature, 2000, 405: 458-462. DOI:10.1038/35013070.
[16] WU G S, ZHANG L Y, LI T T, et al. Choline deficiency attenuates body weight gain and improves glucose tolerance in ob/ob mice[J].Journal of Obesity, 2012(6): 1-7. DOI:10.1155/2012/319172.
[17] PACELLI C, COLUCCIA A, GRATTAGLIANO I, et al. Dietary choline deprivation impairs rat brain mitochondrial function and behavioral phenotype[J]. Journal of Nutrition, 2010, 140(6): 1072-1079. DOI:10.3945/jn.109.116673.
[18] WANG Z N, ZHAO Y Z. Gut microbiota derived metabolites in cardiovascular health and disease[J]. Protein & Cell, 2018, 9(5): 416-431. DOI:10.1007/s13238-018-0549-0.
[19] ORG E, MEHRABIAN M, LUSIS A J. Unraveling the environmental and genetic interactions inatherosclerosis: central role of the gut microbiota[J]. Atherosclerosis, 2015, 241(2): 387-399. DOI:10.1016/j.atherosclerosis.2015.05.035.
[20] 连冠, 鱼毛毛, 徐璐, 等. 葡萄籽多酚降血脂及抗动脉粥样硬化的作用及机制[J]. 中国动脉硬化杂志, 2015, 23(2): 121-126.
[21] REDINGER R N. Nuclear receptors in cholesterol catabolism:molecular biology of the enterohepatic circulation of bile salts and its role in cholesterol homeostasis[J]. Journal of Laboratory & Clinical Medicine, 2003, 142(1): 7-20. DOI:10.1016/S0022-2143(03)00088-X.
[22] MIYAKE J H, DUONG-POLK X T, TAYLOR J M, et al. Transgenic expression of cholesterol-7-alpha-hydroxylase prevents atherosclerosis in C57BL/6J mice[J]. Arteriosclerosis Thrombosis and Vascular Biology, 2002, 22(1): 121-126. DOI:10.1161/hq0102.102588.
[23] 张久聪, 聂青和. 胆汁酸代谢及相关进展[J]. 胃肠病学和肝病学杂志, 2008, 17(11): 953-956. DOI:10.3969/j.issn.1006-5709.2008.11.027.
[24] WANG Z, KLIPFELLE, BENNETT B J, et al. Gut fl ora metabolism of phosphatidylcholine promotes cardiovascular disease[J]. Nature, 2011,472: 57-63. DOI:10.1038/nature09922.
[25] FEBBRAIO M, PODREZ E A, SMITH J D, et al. Targeted disruption of the class B scavenger receptor CD36 protects against atherosclerotic lesion development in mice[J]. Journal of Clinical Investigation, 2000,105(8): 1049-1056. DOI:10.1172/JCI9259.
[26] 梁洁玲, 王洋洋, 司艳辉, 等. ABCA1和ABCG1在动脉粥样硬化中的研究进展[J]. 黑龙江医学, 2016, 40(10): 972-973. DOI:10.3969/j.issn.1004-5775.2016.10.046.
[27] YUAN Y, LI P, YE J. Lipid homeostasis and the formation of macrophage-derived foam cells in atherosclerosis[J]. Protein & Cell,2012, 3(3): 173-181. DOI:10.1007/s13238-012-2025-6.
[28] 冯家烜, 徐茂锦. CD36与糖尿病动脉粥样硬化关系的研究进展[J].实用糖尿病杂志, 2009, 5(1): 3-4.
[29] GENG J, YANG C C, WANG B J, et al Trimethylamine N-oxide promotes atherosclerosis via CD36-dependent MAPK/JNK pathway[J].Biomedicine & Pharmacotherapy, 2017, 97: 941-947. DOI:10.1016/j.biopha.2017.11.016.
[30] ZHAO Z, DE BEER M C, CAI L, et al. Low-density lipoprotein from apolipoprotein E-deficient mice induces macrophage lipid accumulation in a CD36 and scavenger receptor class A-dependent manner[J]. Arteriosclerosis Thrombosis & Vascular Biology, 2005,25(1): 168-173. DOI:10.1161/01.ATV.0000149145.00865.d9.
[31] QIAN F, LIAO J, VILLELLA J, et al. Effects of 1-methyltryptophan stereoisomers on IDO2 enzyme activity and IDO2-mediated arrest of human T cell proliferation[J]. Cancer Immunology Immunotherapy,2012, 61(11): 2013-2020. DOI:10.1007/s00262-012-1265-x.
[32] METZ R, SMITH C, DUHADAWAY J B, et al. IDO2 is critical for IDO1-mediated T-cell regulation and exerts a non-redundant function in inf l ammation[J]. International Immunology, 2014, 26(7): 357-367.DOI:10.1093/intimm/dxt073.
[33] 王竹, 高永翔. 动脉粥样硬化与巨噬细胞源性泡沫细胞的相关研究进展[J]. 细胞与分子免疫学杂志, 2015, 31(6): 853-855.DOI:10.13423/j.cnki.cjcmi.007439.
[34] RADER D J, ALEXANDER E T, WEIBEL G L, et al. The role of reverse cholesterol transport in animals and humans and relationship to atherosclerosis[J]. Journal of Lipid Research, 2009, 50(Suppl 1):S189-S194. DOI:10.1194/jlr.R800088-JLR200.
[35] LEWIS G F, RADER D J. New insights into the regulation of HDL metabolism and reverse cholesterol transport[J].Circulation Research, 2005, 96(12): 1221-1232. DOI:10.1161/01.RES.0000170946.56981.5c.
[36] SELDIN M M, MENG Y, QI H, et al. Trimethylamine N-oxide promotes vascular inf l ammation through signaling of mitogen-activated protein kinase and nuclear factor-κB[J]. Journal of the American Heart Association, 2016, 5(2): 1-12. DOI:10.1161/JAHA.115.002767.
[37] MA G, PAN B, CHEN Y, et al. Trimethylamine N-oxide in atherogenesis: impairing endothelial self-repair capacity and enhancing monocyte adhesion[J]. Bioscience Reports, 2017, 37(2): 1-12.DOI:10.1042/BSR20160244.
[38] 孙平, 陈文强, 李宗信, 等. 中西医干预动脉粥样硬化ICAM-1表达的研究进展[J]. 安徽中医药学院学报, 2007, 26(3): 62-64.DOI:10.3969/j.issn.1000-2219.2007.03.026.
[39] DUMAS M E, KINROSS J, NICHOLSON J K. Metabolic phenotyping and systems biology approaches to understanding metabolic syndrome and fatty liver disease[J]. Gastroenterology, 2014,146(1): 46-62. DOI:10.1053/j.gastro.2013.11.001.
[40] RIDAURA V K, FAITH J J, REY F E, et al. Gut microbiota from twins discordant for obesity modulate metabolism in mice[J]. Science,2013, 341: 1069-1070. DOI:10.1126/science.1241214.
[41] TURNBAUGH P J, HARMADY M, YATSUNENKO T, et al. A core gut microbiome in obese and lean twins[J]. Nature, 2009, 457: 480-484. DOI:10.1038/nature07540.
[42] ZHU W, GREGORY J C, ORG E, et al Gut microbial metabolite TMAO enhances platelet hyperreactivity and thrombosis risk[J]. Cell,2016, 165(1): 111-124. DOI:10.1016/j.cell.2016.02.011.
[43] LE C E, NIELSEN T, QIN J, et al. Richness of human gut microbiome correlates with metabolic markers[J]. Nature, 2013, 500: 541-546.DOI:10.1038/nature12506.
[44] GÓZD-BARSZCZEWSKA A, KOZIOŁ-MONTEWKA M,BARSZCZEWSKI P, et al. Gut microbiome as a biomarker of cardiometabolic disorders[J]. Annals of Agricultural & Environmental Medicine, 2017, 24(3): 416-422. DOI:10.26444/aaem/75456.
[45] LIAO Zhenlin, ZENG Benhua, WANG Wei, et al. Impact of the consumption of tea polyphenols on early atherosclerotic lesion formation and intestinalbifidobacteriain high-fat-fed ApoE-/-mice[J].Frontiers in Nutrition, 2016, 3(4): 1-9. DOI:10.3389/fnut.2016.00042.
[46] 白冰瑶, 刘新愚, 周茜, 等. 红枣膳食纤维改善小鼠功能性便秘及调节肠道菌群功能[J]. 食品科学, 2016, 37(23): 254-259. DOI:10.7506/spkx1002-6630-201623042.
[47] LI T, ZHONG J Z, WAN J, et al. Effects of micronized okara dietary fiber on cecal microbiota, serum cholesterol and lipid levels in BALB/c mice[J]. International Journal of Food Sciences & Nutrition, 2013,64(8): 968-973. DOI:10.3109/09637486.2013.809705.
[48] 吴占威, 胡志和, 邬雄志. 豆渣膳食纤维及豆渣超微化制品对小鼠肠道菌群的影响[J]. 食品科学, 2013, 34(3): 271-275.
[49] 王晨, 钟赛意, 邹宇晓. 膳食纤维经肠道微生态途径调节脂质代谢作用的研究进展[J/OL]. (2018.02.09) [2018-11-30]. http://kns.cnki.net/kcms/detail/11.2206.TS.20180209.1040.030.html.
[50] KASSELMAN L J, ERNICE N A, DELEON J, et al. The gut microbiome and elevated cardiovascular risk in obesity and autoimmunity[J]. Atherosclerosis, 2018, 271: 203-213. DOI:10.1016/j.atherosclerosis.
[51] TANG W H, WANG Z, LEVISON B S, et al. Intestinal microbial metabolism of phosphatidylcholine and cardiovascular risk[J].New England Journal of Medicine, 2013, 368(17): 1575-1584.DOI:10.1056/NEJMoa1109400.
[52] CHU Y L, HO C T, RAJASEKARANR, et al. Allicin induces p53-mediated autophagy in HepG2 human liver cancer cells[J]. Journal of Agricultural and Food Chemistry, 2012, 60(34): 8363-8371.DOI:10.1021/jf301298y.
[53] WU W K, PANYOD S, HO C T, et al. Dietary allicin reduces transformation of L-carnitine to TMAO through impact on gut microbiota[J]. Journal of Functional Foods, 2015, 15: 408-417.DOI:10.1016/j.jff.2015.04.001.
[54] ANKRI S, MIRELMAN D. Antimicrobial properties of allicin from garlic[J]. Microbes & Infection, 1999, 1(2): 125-129. DOI:10.1016/S1286-4579(99)80003-3.
[55] HERNÁNDEZ-ALONSO P, CAÑUETO D, GIARDINA S, et al.Effect of pistachio consumption on the modulation of urinary gut microbiota-related metabolites in prediabetic subjects[J]. Journal of Nutritional Biochemistry, 2017, 45: 48-53. DOI:10.1016/j.jnutbio.2017.04.002.
[56] LAMUEL-PAVENTOS R M, ONGE M S. Prebiotic nut compounds and human microbiota[J]. Critical Reviews in Food Science Nutrition,2016, 57(14): 3154-3163. DOI:10.1080/10408398.2015.1096763.
[57] QIU L, YANG D, TAO X Y, et al. Enterobacter aerogenes ZDY01 attenuates choline-induced trimethylamine N-oxide levels via remodeling gut microbiota in mice[J]. Journal of Microbiology and Biotechnology,2017, 27(8): 1491-1499. DOI:10.4014/jmb.1703.03039.
[58] WARRIER M, SHIH D M, BURROWS A C, et al. The TMAO generating enzyme flavin monooxygenase 3 is a central regulator of cholesterol balance[J]. Cell Reports, 2015, 10(3): 326-338.DOI:10.1016/j.celrep.2014.12.036.
[59] VEERAVALLI S, KARU K, SCOTT F, et al. Effect of flavincontaining monooxygenase (FMO) genotype, mouse strain and gender on trimethylamine N-oxide production, plasma cholesterol concentration and an index of atherosclerosis[J]. Drug Metabolism and Disposition, 2017, 46(1): 20-25. DOI:10.1124/dmd.117.077636.
[60] TREACY E P, AKERMAN B R, CHOW L M L, et al. Mutations of the flavin-containing monooxygenase gene (FMO3) cause trimethylaminuria, a defect in detoxication[J]. Human Molecular Genetics, 1998, 7(5): 839-845. DOI:10.1093/hmg/7.5.839.
[61] YEUNG C K, ADMAN E T, RETTIE A E. Functional characterization of genetic variants of human FMO3 associated with trimethylaminuria[J]. Archives of Biochemistry & Biophysics, 2007,464(2): 251-259. DOI:10.1016/j.abb.2007.04.014.
[62] CHEN Q, WANG E M, MA L P, et al. Dietary resveratrol increases the expression of hepatic 7α-hydroxylase and ameliorates hypercholesterolemia in high-fat fed C57BL/6J mice[J]. Lipids in Health & Disease, 2012, 11(1): 56-63. DOI:10.1186/1476-511X-11-56.
[63] SINAL C J, TOHKIN M, MIYATA M, et al. Targeted disruption of the nuclear receptor FXR/BAR impairs bile acid and lipid homeostasis[J].Cell, 2000, 102(6): 731-744. DOI:10.1016/S0092-8674(00)00062-3.
[64] JOHNSON J L, NEWBY A C. Macrophage heterogeneity in atherosclerotic plaques[J]. Current Opinion in Lipidology, 2009, 20(5):370-378. DOI:10.1097/MOL.0b013e3283309848.
[65] GAO X, XU J, JIANG C Z, et al. Fish oil ameliorates trimethylamine N-oxide-exacerbated glucose intolerance in high-fat diet-fed mice[J].Food & Function, 2015, 6(4): 1117-1125. DOI:10.1039/c5fo00007f.
[66] LUDWIG T, WORSCH S, HEIKENWALDER M, et al. Metabolic and immunomodulatory effects of n-3 fatty acids are different in mesenteric and epididymal adipose tissue of diet-induced obese mice[J]. American Journal of Physiology Endocrinology & Metabolism, 2013, 304(11):E1140-E1156. DOI:10.1152/ajpendo.00171.2012.
[67] YAZDEKHASTI N, BRANDSCH C, SCHMIDT N, et al. Fish protein increases circulating levels of trimethylamine-N-oxide and accelerates aortic lesion formation in ApoE null mice[J]. Molecular Nutrition &Food Research, 2016, 60(2): 358-368. DOI:10.1002/mnfr.201500537.
[68] ZHENG H, YDEC C, CLAUSEN M R, et al. Metabolomics investigation to shed light on cheese as a possible piece in the French paradox puzzle[J]. Journal of Agricultural and Food Chemistry, 2015,63(10): 2830-2839. DOI:10.1021/jf505878a.
[69] STONGE M P, FARNWORTH E R, JONES P J H. Consumption of fermented and nonfermented dairy products: effects on cholesterol concentrations and metabolism[J]. American Journal of Clinical Nutrition, 2000, 71(3): 674-681. DOI:10.1093/ajcn/71.3.674.
[70] BELITZ H D, GROSCH D I W. Milk and dairy products[M]. Berlin:Springer Berlin Heidelberg, 2004: 521-576.
[71] AHUILAR E C, LEONEL A J, TEIXEIRA L G, et al. Butyrate impairs atherogenesis by reducing plaque inflammation and vulnerability and decreasing NFκB activation[J]. Nutrition Metabolism &Cardiovascular Diseases Nmcd, 2014, 24(6): 606-613. DOI:10.1016/j.numecd.2014.01.002.
[72] WANG D L, ZOU T B, YANG Y, et al. Cyanidin-3-O-β-glucoside with the aid of its metabolite protocatechuic acid, reduces monocyte infiltration in apolipoprotein E-deficient mice[J]. Biochemical Pharmacology, 2011, 82(7): 713-719. DOI:10.1016/j.bcp.2011.04.007.
[73] IVERSON S J, LANG S L C, COOPER M H. Comparison of the bligh and dyer and folch methods for total lipid determination in a broad range of marine tissue[J]. Lipids, 2001, 36(11): 1283-1287.DOI:10.1007/s11745-001-0843-0.
[74] 刘素稳. 蓝靛果花色苷提取物调节胆固醇代谢机理研究[D]. 沈阳:沈阳农业大学, 2017: 87-107.
[75] KIM H J, PARK K J, LIM J H. Metabolomic analysis of phenolic compounds in buckwheat (Fagopyrum esculentum M.) sprouts treated with methyl jasmonate[J]. Journal of Agricultural and Food Chemistry,2011, 59(10): 5707-5713. DOI:10.1021/jf200396k.
[76] HU Y Y, ZHAO Y, YUAN L, et al. Protective effects of tartary buckwheat flavonoids on high TMAO diet-induced vascular dysfunction and liver injury in mice[J]. Food & Function, 2015, 6(10):3359-3372. DOI:10.1039/c5fo00581g.
[77] LI Q, WU T, LIU R, et al. Soluble dietary fiber reduces trimethylamine metabolism via gut microbiota and co-regulates host AMPK pathways[J]. Molecular Nutrition & Food Research, 2017, 61(12): 1-11.DOI:10.1002/mnfr.201700473.
[78] BOUTAGY N E, NEILSON A P, OSTERBERG K L, et al. Probiotic supplementation and trimethylamine-N-oxide production following a highfat diet[J]. Obesity, 2015, 23(12): 2357-2363. DOI:10.1002/oby.21212.
A Review of Recent Literature on Effects of Bioactive Compounds in Foods on Trimethylamine-N-oxide-Mediated Atherosclerosis
GUO Jingting, JIAO Rui, JIANG Xinwei, et al. A review of recent literature on effects of bioactive compounds in foods on trimethylamine-N-oxide-mediated atherosclerosis[J]. Food Science, 2019, 40(7): 261-267. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20180313-164. http://www.spkx.net.cn