
图1 茶儿茶素及其氧化形成的二聚体的结构式
Fig. 1 Chemical structures of monomeric and oxidized dimeric tea catechins
茶叶中儿茶素(即茶儿茶素)主要包括表儿茶素(epicatechin,EC)、表没食子儿茶素(epigallocatechin,EGC)、表儿茶素没食子酸酯(epicatechin gallate,ECG)和表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG),其中,EGCG和EGC总量占儿茶素总量的70%以上。在茶叶加工以及茶深加工过程中,儿茶素在一定的条件下经多酚氧化酶(polyphenol oxidase,PPO)作用发生氧化反应,从而产生儿茶素单醌,醌类物质之间或醌类物质与儿茶素单体进一步发生偶联聚合反应形成复杂的茶多酚氧化聚合产物[1]。茶黄素类(theaflavins,TFs)和聚酯型儿茶素(theasinensins,TSs)是儿茶素的主要二聚体,对红茶的品质非常重要,决定着红茶的感官特性和内在品质[2-3]。本文总结了近年来国内外关于儿茶素酶性氧化生成二聚体的途径、儿茶素酶性氧化中的外源PPO及其与底物的特异性、儿茶素酶性氧化产物中的二聚物生物活性及外源酶催化合成二聚体在生产实践中的应用等方面的研究现状,目的在于深入分析儿茶素酶性氧化作用的机理及影响因素,同时也为儿茶素氧化产物的合成及多元化利用提供可行性参考。
茶儿茶素属于黄烷醇类化合物,是2-苯基苯并吡喃衍生物,结构由A、B和C基本环核组成。根据B环的结构特征,茶儿茶素分为两种类型:邻苯二酚型(EC、ECG)和连苯三酚型(EGC、EGCG)。研究发现,儿茶素氧化生成二聚体有两条主要的途径:第一条途径是邻苯二酚型儿茶素与连苯三酚型儿茶素发生氧化聚合生成具有苯并卓酚酮结构的TFs,红茶中的TFs主要包括茶黄素(theaflavin,TF或TF1)、茶黄素-3-没食子酸酯(theaflavin-3-gallate,TF-3-G或TF2A)、茶黄素-3’-没食子酸酯(thealfavin-3’-gallate,TF-3’-G或TF2B)、茶黄素-3,3’-双没食子酸酯(theaflavin-3,3’-digallate,TF-3,3’-DG或TF3)[4-5];另一条途径是连苯三酚型儿茶素单体发生氧化偶联形成儿茶素二聚体TSs(主要有A、B、C、D、E等不同种类,分别简称为TSA、TSB、TSC、TSD、TSE等)[6-7]。不同类型的儿茶素、TFs和TSs的结构见图1。儿茶素酶性氧化生成TFs和TSs的途径见图2。红茶制造过程中,分布在叶片不同部位的PPO和茶儿茶素类物质相遇,邻苯二酚型和连苯三酚型的儿茶素之间发生氧化偶联生成TFs[4],在发酵工序后期,TFs积累达到最大值后呈逐渐下降趋势。TFs是构成红茶滋味和汤色的一种重要物质,尤其对滋味的鲜爽度贡献较大,且与茶汤的亮度相关,同时也是形成茶汤金圈的主要物质。在红茶发酵阶段,连苯三酚型儿茶素在PPO的作用下生成儿茶素醌[8],两个单体醌聚合形成醌二聚体,即脱氢聚酯型儿茶素(dehydrotheasinensins,DTSs),DTSs极不稳定[9],容易发生还原反应生成TSs,如脱氢聚酯型儿茶素A(dehydrotheasinensin A,DTSA)在干燥或pH 6.8条件下降解生成TSA、TSD和其他氧化产物[10],或在VC的作用下发生还原反应生成TSA[11]。由此可以推断出,通过连苯三酚型儿茶素的B环发生氧化并聚合生成不稳定的DTSs是形成TSs最为关键的反应[12]。

图1 茶儿茶素及其氧化形成的二聚体的结构式
Fig. 1 Chemical structures of monomeric and oxidized dimeric tea catechins
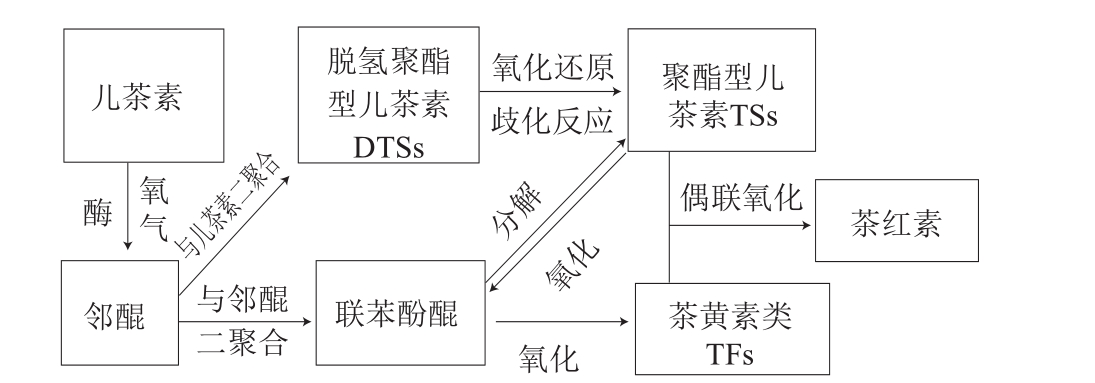
图2 TFs和TSs的形成途径
Fig. 2 Formation pathway of TFs and TSs
PPO是自然界分布极广的一种氧化还原酶,广义上的PPO包括酪氨酸酶、儿茶酚氧化酶和漆酶。PPO的共同特征是能够通过氧分子氧化单酚或多酚形成对应的醌。酪氨酸酶(EC. 1.14.18.1)是双功能酶,具有单酚酶和双酚酶活性,即能催化单酚发生羟基化,并进一步催化邻羟基酚氧化生成醌[13];儿茶酚氧化酶(EC. 1.10.3.2)可有氧催化邻苯二酚生成邻醌,其主要来自植物,是茶树体内的一种重要酶类,对茶树的生长发育具有积极意义,并在茶叶加工中占有极为重要的地位,其活性的高低也是决定茶树品种适制性的一个重要指标[14]。从基因组学角度分析,植物源的PPO可分为3 类:苹果单独为一类;大部分草本植物,如烟草、蚕豆、西红柿、马铃薯、大部分番薯、甘蔗可聚为一类;茶树与商陆、杏、葡萄和波菜等聚为一类,其中茶树与商陆的关系较近[15-16]。漆酶(EC. 1.10.3.1)能有氧催化苯酚或对苯酚生成对苯醌,可作用于EGC和EGCG的三羟基B环,也可作用位于ECG和EGCG的C环上的没食子酰基[17]。在以上3 类PPO中,漆酶由于可以作用于广泛的底物而表现出独特性,来源于真菌的漆酶能够催化多酚、氨基酚、甲氧基苯酚、芳香胺、木质素等发生氧化,在食品、造纸和环境保护等领域有较广泛应用。
2.2.1 儿茶酚氧化酶及其催化儿茶素氧化
研究发现,日本梨和莲藕等植物匀浆作为PPO酶源催化儿茶素氧化的产物和茶鲜叶PPO催化儿茶素得到的氧化产物极为接近[18]。为了研究儿茶素氧化产物及其形成机理,获得足量的儿茶素酶促氧化产物,研究者逐渐将关注点转移到了茶树以外的植物和微生物来源的PPO酶源。王丽璞[19]选择7 种不同的植物材料为PPO酶源物质,活力大小依次为:茄子(174 U)>土豆(92 U)>甘薯(64 U)>梨(44 U)>藕(28 U)>苹果(24 U)>茶鲜叶(10 U),并利用茄子中的PPO催化绿茶粉合成TFs,得到较高得率的TFs纯化产物。叶飞等[20]研究中得到的砂梨和茶叶PPO活力分别为254.72 U/mL和23.9 U/mL。罗玲等[21]测定的果蔬PPO活力从大到小依次为梨(633 U/mL)、山药(310 U/mL)、土豆(286 U/mL)、红薯(43 U/mL)、苹果(35 U/mL)。以上结果得到的PPO活力不同,一方面可能是PPO的底物和PPO活力测定方法不一致;另一方面也可能是同一材料的品种和成熟度不同。周仲华等[16]利用生物信息学方法从天然植物中筛选天然PPO酶源,发现供试的10 种植物材料中均有不同程度的PPO活力,其中砂梨和甘薯的PPO活力最高,且高于茶叶PPO活力。以上研究结果均表明,来自其他植物的PPO活力大多高于茶树鲜叶中的PPO活力。
Tanaka等[18,22]开启了植物匀浆催化儿茶素氧化的研究,首先采用香蕉果肉匀浆催化EGC氧化,发现有二聚物生成,再进一步通过对来自49 个科的62 种植物匀浆催化儿茶素氧化发现,许多植物匀浆都能催化EC和EGC生成TF,其中日本梨和未成熟枇杷果实匀浆催化合成TF的能力最强。TF进一步和EGC发生氧化反应,生成theanaphthoquinone,而且,在茶树鲜叶、茄子、日本橘子匀浆催化氧化的产物中存在新的代谢产物DTSs。TF也可以和EC的醌进一步发生偶联反应生成新的产物[23]。在(+)-GC、(-)-GC和(-)-EGC溶液中分别加入日本梨匀浆作为PPO酶源进行氧化反应,只有(-)-EGC氧化产物中以脱氢聚酯型儿茶素C(dehydrotheasinensin C,DTSC)为主,而其他两者生成的都是非DTSC的二聚体产物,其中,(+)-GC氧化产物为proepitheaflagallin型二聚体,(-)-GC氧化产物则为(+)-GC氧化产物的对映异构体;同时,梨PPO对EC的催化速率也远低于对EGC的催化速率。由此可以推断出,将连苯三酚型B环转变成醌的酶促氧化和随后发生的非酶促偶联反应都对空间结构要求很严格[24]。Matsuo等[25]模拟红茶加工中的干燥工序,将梨匀浆催化(-)-EGC的反应液加热到80 ℃,将产物分离后,发现了一些新的氧化产物和TSC、TSE、脱氢聚酯型儿茶素E(dehydrotheasinensin E,DTSE),由此提出在红茶加工过程中可能存在新的氧化作用机制。罗玲等[21]研究发现,梨与红薯的PPO共同作用时对EGC的转化能力高于其余酶源的PPO,而在梨与土豆的PPO共同作用下,EGCG和EC是主要的被氧化的成分。同时,梨与土豆、山药、苹果、红薯4 种组合PPO中,转化茶多酚形成茶黄素起主导作用的都是梨PPO,而土豆PPO与梨PPO之间存在较好的协同作用。Matsuo等[26]研究发现,日本梨匀浆催化儿茶素生成的二聚体氧化产物包括TFs和DTSs,而未成熟的温州蜜桔(果直径约3.0 cm)匀浆催化茶儿茶素氧化后二聚体产物中没有TFs,只有DTSs。两种匀浆的底物选择性差异很可能与连苯三酚型儿茶素的氧化还原势能较低直接相关。与茶树鲜叶匀浆相比,鳟梨和雪莲果的果实匀浆具有较强的催化合成TF的能力[27]。
以上研究结果可以说明,不同植物来源的PPO催化相同的儿茶素组分时,催化速率和催化能力存在差异;催化不同的儿茶素组分,生成的二聚体氧化产物类型也不同,而且生成的TFs、TSs、DTSs数量也各不相同。明确以上特点,就可以通过设计不同的酶促反应模式来获得所需类型的儿茶素二聚体氧化产物。
2.2.2 酪氨酸酶、漆酶催化儿茶素氧化
Selinheimo等[28]比较了不同来源的酪氨酸酶的底物特异性,发现尽管大部分酪氨酸酶的单酚酶活力比二酚酶活力低很多,白腐真菌(Pycnoporus sanguineus)却例外,它催化L-型老安设左旋多巴氧化时单酚酶活力与二酚酶活力的比值最大。此外,不同来源的酪氨酸酶具有较为相似的催化反应机制。张婉蓉等[29]以不同酚类物质为底物,获得产PPO能力较强的菌株CSN-13,将其在28 ℃下培养5 d,酶活力提高近10 倍。Lee等[30]利用从普洱茶中分离出的真菌菌株分泌漆酶,并将分离纯化后的漆酶催化EGCG氧化,发现反应条件对氧化速率和产物的类型及浓度有显著影响;在中性条件下,10.0 µg漆酶70 ℃催化1.0 mL 1.0 mmol/L的EGCG 150 min,EGCG的转化率达到69.27%,生成的产物主要是茶红素类、茶褐素类以及游离的儿茶素和EGC。Verloop等[17]发现,来自双孢蘑菇中的酪氨酸酶和漆酶能够改变绿茶提取物中酚类物质的组成,提高TFs含量,而且含有没食子酰基的儿茶素和氧化酶的种类是产物中TFs浓度的决定性因素。酪氨酸酶催化EGC和EC能得到较多且稳定的TFs,而漆酶催化产物多为不可溶的复合物;同时,酪氨酸酶作用于绿茶提取物比作用于红茶提取物能生成更多的TFs。茶叶提取物中儿茶素的组成也影响到氧化产物的生成。Narai-Kanayama等[31]利用双孢蘑菇酪氨酸酶催化EC、EGC、ECG和EGCG,得到的表观米氏常数Km值分别为3.78、5.55、0.80 mmol/L和3.05 mmol/L;其中EC的消耗速率最大,为其他底物的4 倍以上;当酶作用于两两组合底物时,EC和EGC作为底物时合成TF1的效率最高,但生成其他类型的茶黄素组分的量很低;推断儿茶素的酶促氧化和来自不同类型醌之间的非酶促偶联氧化还原反应是同时发生的,尤其是后者反应引起EGC和EGCG的量迅速减少,特别是EGCG的量显著减少,导致醌类的聚合反应受到限制,从而影响到TFs的生成;当采用绿茶提取物作为底物时,在EGCG初始浓度较低的情况下,酪氨酸酶促合成TF1的效率最高,同时,其他茶黄素组分也显著增加。Yabuki等[32]研究发现不同来源PPO对邻苯二酚型儿茶素(EC、ECG)和连苯三酚型儿茶素(EGC、EGCG)有不同的特异性,对邻苯二酚型儿茶素特异性更强的PPO比那些对两种儿茶素具有相似特异性的PPO催化合成TFs的效率更高;例如,菌菇酪氨酸酶催化合成TFS比其他来源的PPO(如漆酶、胆红素氧化酶和茶叶PPO)效率更高,因为酪氨酸酶催化EC的起始速率是催化EGC的11.6 倍,而漆酶和茶鲜叶粗酶液对应值分别是1.6 倍和1.8 倍;由此推断,可能是由于非酶促偶联反应是发生在邻苯二酚醌和未被氧化的连苯三酚之间,所以当过量的连苯三酚型儿茶素EGC存在时,酪氨酸酶催化合成TFs的量会显著增加。
以上关于酪氨酸酶、漆酶催化儿茶素氧化的研究结果说明,类似于植物来源的PPO,来源于真菌的酪氨酸酶和漆酶催化特点也随底物儿茶素种类、儿茶素组成比例、反应条件表现不同,催化儿茶素氧化的产物中二聚体TFs的研究较多,而关于TSs的相关研究鲜有报道,对酪氨酸酶、漆酶在催化儿茶素氧化时生成的二聚体氧化产物方面还有待深入研究。
2.2.3 外源PPO及儿茶素二聚体产物的制备
关于外源PPO催化制备二聚体产物的研究,报道较多的是外源PPO的分离纯化与固定化[29,33-35]、合成TFs条件的优化和TFs的分离制备[20,36-39],而有关TSs的制备鲜见报道。
儿茶素在PPO或过氧化物酶(peroxidase,POD)和H2O2等的共同作用下,普遍形成不同聚合度的儿茶素氧化物,这些多样化聚合物的混合物统称为茶红素[40],茶红素占红茶可溶性固形物质量分数的60%~70%,对红茶的色泽、滋味和品质有重要的贡献。Yassin等[41]通过采用液相色谱-电喷雾离子阱质谱(liquid chromatography electrospray ionization tandem mass spectrometry,LC-ESIITMS)检测茶红素组分,洗脱得到的茶红素部分主要包括TSC和TSA两类组分。Hashimoto等[7]通过HPLC分析发酵过程中茶多酚的变化证实了鲜叶中儿茶素在内源PPO催化下生成TSs的速率比生成TFs更快。由于在生成TFs和TSs过程中同时存在酶促氧化和非酶促氧化反应,伴生产物很可能对这两类氧化产物的合成有不同程度影响,即同作为茶红素的前体物,TFs和TSs这两类儿茶素氧化产物的生成,不仅存在反应底物上的竞争,在形成途径上也存在PPO催化途径的竞争。徐斌等[42]初步研究了不同pH值条件下TSs的形成机理及其与TFs的竞争性形成,发现在菌菇酪氨酸酶的催化下,儿茶素单体氧化和单体间氧化生成产物的变化趋势因底物的性质存在差异;如在pH 6.0条件下,EC的存在会导致EGCG生成TSs的量减少,而较多的EGCG参与到生成TF-3-G的反应中,说明这两类二聚体因为底物相同而存在竞争性形成关系。Itoh等[43]发现漆酶催化儿茶素氧化时生成产物的种类受到底物来源及其中的特定组分影响,当漆酶分别催化绿茶提取物中的EGC和EGCG发生氧化时,底物组分中的没食子酸能够促使EGC/EGCG和连苯三酚结合生成TF的衍生物,如Epitheaflagallin(ETFG)和Epitheaflagallin 3-O-gallate(ETFGg)。
二聚物TFs和TSs由于对红茶品质的积极贡献或具有优异的生物活性受研究者越来越多的关注[3,44-45],也逐渐成为评价红茶产品等级和品质的依据[46-47]。近些年来,研究者对TFs的生物活性做了比较全面的工作,证实了该类物质具有多种与人体健康有关的潜在功效。TFs的4 种单体中,关于TF-3,3’-DG的生物活性研究报道较多,主要集中在抗氧化[48-49]、抗炎[50-51]、减肥[52-53]和预防癌症[54]等方面。TFs聚合物类具有抗流感[55]和抗牙周病[43]的作用。连苯三酚型儿茶素的总量占到儿茶素总量的70%以上,因此,研究由连苯三酚型儿茶素氧化生成的氧化产物具有更重要的作用。实际上,TSs在不同茶类产品中存在的范围更为广泛,且在发酵程度较高的茶类中其含量远高于TFs含量,因此TSs对发酵茶类的风味品质可能有更为重要的影响,更需要引起研究者的关注[3,45]。与EGCG相比,TSD能够更有效地抑制淋巴瘤U937细胞的增殖[56],TSA能够增强槲皮素的溶解性[57],缓解四氯化碳造成的肝损伤[58]。TSs能够抑制环氧合酶-2的生成[59],此外,TSs也具有降血糖[45]和抗病毒[60]等生物活性。但是,根据红茶发酵条件的不同,在红茶加工过程中得到的二聚体含量也有较大变化。其中,TFs仅占红茶干质量的0.4%~1.9%[61-62],在红茶茶汤中质量浓度约为0.8~2.0 mg/100 mL[63]。TSs约为红茶干质量的0.5%~1.5%[42],此外,浸提方法会影响二聚体含量的检测值[64]。从红茶中大量制备这些具有生理活性的氧化产物不仅耗时费力,而且已有的关于二聚物稳定特性研究证明这些单体的分离也不易操作[32,65],关于这两类物质及其单体在体内的生理活性以及在食品和保健产品中的应用研究报道也不多[31]。因此,研究者多集中于儿茶素氧化产物的化学合成和酶促合成,且与化学合成方法相比,酶促合成方法不仅能降低环境污染,还可以提高工业化的效率[30]。
为了增强发酵茶产品茶汤的色泽、滋味和提高产品的功能性,外源PPO越来越多地应用在茶叶加工中。Tanaka等[66]发现在红茶揉捻过程中加入新鲜枇杷叶能够加速儿茶素的酶促氧化过程,其中TFs中的TF-3-G和TF-3,3’-DG含量分别为对照组的1.43 倍和1.38 倍。Shii等[45]在茶叶揉捻过程中,将茶树鲜叶和枇杷叶按照质量比9∶1进行混合,得到了一种具有减肥和降血糖功能的发酵茶,并首次从商品茶中检测出DTSH和TSH的存在。叶飞等[20]在红茶发酵过程中添加砂梨水提取液(PPO酶液与揉捻叶的质量比为1∶10),显著提高了红茶的TFs含量,红茶的香气成分中β-紫罗酮和橙花醇含量提高约10%。付赢萱等[67]以大叶种六级晒青毛茶为实验材料,采用PPO(活力为845 U/mg)作用于普洱茶渥堆发酵过程,经不同浓度PPO处理后的普洱茶中茶多酚和儿茶素的消耗率均加快,且与PPO的添加量呈负相关;发酵前期TFs生成速度加快,后期TFs氧化生成茶红素和茶褐素的速度提高;加入PPO的普洱茶发酵18 d后基本具备熟茶品质,其中1.6 U/g和3.2 U/g PPO组普洱茶汤色红浓明亮、滋味醇厚回甘、香气浓郁,表现出类似陈年普洱茶的品质特点。Nakayama等[68]在夏秋茶鲜叶揉捻过程中加入切片的未成熟温州蜜桔果(前、后两者质量比3∶1),烘干后用热水浸提得到混合发酵茶提取物,其中的TFs、TSs含量分别可达5.10 mg/100 g和14.35 mg/100 g;且该提取物能够抑制胰脂肪酶活性,具有降血脂功能特性,具有作为新型的功能食品材料开发的潜力。Li Qingrong等[69]在工夫红茶揉捻过程中添加甘薯PPO(4 000 U/g),发酵7 h,TFs转化量提高30%;在红碎茶的揉切过程中添加甘薯PPO(2 000 U/g,以干茶叶质量计),发酵15 min,红茶中的TFs含量提高了18%。该研究为制备高茶黄素红茶提供了切实可行的方案,同时也提出了一种利用甘薯废水的绿色高效途径。
对于茶叶加工领域,研究儿茶素氧化过程和氧化产物具有非常重要的意义。研究儿茶素的酶促氧化途径,有利于从本质上把握发酵茶加工中的品质变化,此外,儿茶素氧化聚合物具有广泛的生理药理活性,具有潜在的资源利用前景。儿茶素氧化产物的组成极为复杂,目前人们仅仅明确了红茶多酚类物质的部分化学特性。
近年来,研究者一直在探索研究儿茶素酶促氧化生成二聚体的竞争机制,但是,目前仅对不同来源的PPO酶促催化合成茶黄素类进行了较为广泛的研究,而外源PPO酶促合成聚酯型儿茶素的报道还很少。因此,有必要对不同来源PPO作用下竞争性生成茶黄素类和聚酯型儿茶素这两类二聚体进行深入的机理研究。需要进一步明确氧化生成的醌类的后续反应类型,即醌类是与儿茶素单体结合还是相邻的醌发生聚合。同时,以上研究对于揭示儿茶素氧化生成茶黄素类和聚酯型儿茶素这两类二聚体的竞争机理尤为重要。
[1] LI S M, LO C Y, PAN M H, et al. Black tea: chemical analysis and stability[J]. Food and Function, 2013, 4(1): 10-18. DOI:10.1039/c2fo30093a.
[2] HILTON P J, ELLIS R T. Estimation of the market value of central African tea by theaf l avin analysis[J]. Journal of the Science of Food and Agriculture, 1972, 23(2): 227-232. DOI:10.1002/jsfa.2740230210.
[3] TANAKA T, MATSUO Y, KOUNO I. Chemistry of secondary polyphenols produced during processing of tea and selected foods[J].International Journal of Molecular Sciences, 2010, 11(1): 14-40.DOI:10.3390/ijms11010014.
[4] TAKINO Y, IMAGAWA H, HORIKAWA H, et al. Studies on the mechanism of the oxidation of tea leaf catechins: part III. formation of a reddish orange pigment and its spectral relationship to some benzotropolone derivatives[J]. Agricultural and Biological Chemistry,1964, 28(1): 64-71.
[5] TAKINO Y, FERRETTI A, FLANAGAN V, et al. The structure of theaflavin, a polyphenol of black tea[J]. Tetrahedron Letters, 1965,6(45): 4019-4025. DOI:10.1016/S0040-4039(01)99608-X.
[6] NONAKA G, KAWAHARA O, NISHIOKA I. Tannins and related compounds. XV. a new class of dimeric fl avan-3-olgallates, theasinensins A and B, and proanthocyanidin gallates from green tea leaf[J]. Chemical and Pharmaceutical Bulletin, 1983, 31(11): 3906-3914.
[7] HASHIMOTO F, NONAKA G, NISHIOKA I. Tannins and related compounds. CXIV. structures of novel fermentation products,theogallinin, theaf l avonin and desgalloyl theaf l avonin from black tea,and changes of tea leaf polyphenols during fermentation[J]. Chemical and Pharmaceutical Bulletin, 1992, 40(6): 1383-1389.
[8] TANAKA T, MINE C, WATARUMI S, et al. Accumulation of epigallocatechin quinone dimers during tea fermentation and formation of theasinensins[J]. Journal of Natural Products, 2002, 65(11): 1582-1587. DOI:10.1021/np020245k.
[9] TANAKA T, MATSUO Y, KOUNO I. A novel black tea pigment and two new oxidation products of epigallocatechin-3-O-gallate[J].Journal of Agricultural and Food Chemistry, 2005, 53(19): 7571-7578.DOI:10.1021/jf0512656.
[10] TANAKA T, WATARUMI S, MATSUO Y, et al. Production of theasinensins A and D, epigallocatechin gallate dimers of black tea, by oxidation-reduction dismutation of dehydrotheasinensin A[J]. Tetrahedron, 2003, 59(40): 7939-7947. DOI:10.1016/j.tet.2003.08.025.
[11] SHII T, MIYAMOTO M, MATSUO Y, et al. Biomimetic onepot preparation of a black tea polyphenol theasinensin A from epigallocatechin gallate by treatment with copper(II) chloride and ascorbic acid[J]. Chemical and Pharmaceutical Bulletin, 2011, 59(9):1183-1185.
[12] WEERAWATANAKORN M, HUNG W L, PAN M H, et al.Chemistry and health beneficial effects of oolong tea and theasinensins[J]. Food Science and Human Wellness, 2015, 4:133-146. DOI:10.1016/j.fshw.2015.10.002.
[13] LERCH K. Neurospora, tyrosinase: structural, spectroscopic and catalytic properties[J]. Molecular and Cellular Biochemistry, 1983,52(2): 125-138. DOI:10.1007/BF00224921.
[14] 黄建安, 黄意欢, 罗军武, 等. 茶树多酚氧化酶基因的SNP分析[J]. 湖南农业大学学报(自然科学版), 2007, 33(4): 454-458; 485.
[15] 赵东, 刘祖生, 奚彪. 茶树多酚氧化酶基因的克隆及其序列比较[J].茶叶科学, 2001, 21(2): 94-98.
[16] 周仲华, 张达, 倪贺, 等. 生物信息学筛选催化茶黄素合成的多酚氧化酶[J]. 华南师范大学学报(自然科学版), 2017, 49(3): 59-67.
[17] VERLOOP A J W, GRUPPEN H, BISSCHOP R, et al. Altering the phenolicsprofile of a green tea leaves extract using exogenous oxidases[J]. Food Chemistry, 2016, 196: 1197-1206. DOI:10.1016/j.foodchem.2015.10.068.
[18] TANAKA T, MINE C, INOUE K, et al. Synthesis of theaf l avin from epicatechin and epigallocatechin by plant homogenates and role of epicatechin quinone in the synthesis and degradation of theaf l avin[J].Journal of Agricultural and Food Chemistry, 2002, 50(7): 2142-2148.DOI:10.1021/jf011301a.
[19] 王丽璞. 茶黄素制备与纯化条件的初步研究[D]. 南京: 南京农业大学, 2011: 23-29.
[20] 叶飞, 高士伟, 龚自明. 砂梨多酚氧化酶处理对夏秋红茶品质的影响[J]. 食品科学, 2013, 34(23): 92-95.
[21] 罗玲, 王洪新, 胡倩倩, 等. 几种复合天然多酚氧化酶氧化茶多酚的比较研究[J]. 食品与生物技术学报, 2015, 34(4): 385-389.
[22] TANAKA T, KONDOU K, KOUNO I. Oxidation and epimerization of epigallocatechin in banana fruits[J]. Phytochemistry, 2000, 53(2):311-316. DOI:10.1016/S0031-9422(99)00533-6.
[23] LI Y, SHIBAHARA A, MATSUO Y, et al. Reaction of the black tea pigment theaf l avin during enzymatic oxidation of tea catechins[J]. Journal of Natural Products, 2010, 73(1): 33-39. DOI:10.1021/np900618v.
[24] MATSUO Y, YAMADA Y, TANAKA T, et al. Enzymatic oxidation of gallocatechin and epigallocatechin: effects of C-ring configuration on the reaction products[J]. Phytochemistry, 2008, 69(18): 3054-3061.DOI:10.1016/j.phytochem.2007.08.007.
[25] MATSUO Y, HAYASHI T, SAITO Y, et al. Structures of enzymatic oxidation products of epigallocatechin[J]. Tetrahedron, 2013, 69(42):8952-8958. DOI:10.1016/j.tet.2013.07.045.
[26] MATSUO Y, TADAKUMA F, SHII T, et al. Selective oxidation of pyrogallol-type catechins with unripe fruit homogenate of Citrus unshiu and structural revision of oolongtheanins[J]. Tetrahedron, 2015,71(17): 2540-2548. DOI:10.1016/j.tet.2015.03.016.
[27] VAN DER WESTHUIZEN M, STEENKAMP L, STEENKAMP P,et al. Alternative pathway implicated as an inf l uencing factor in the synthesis of theaf l avin[J]. Biocatalysis and Biocatalysis, 2016, 33(5/6):298-309. DOI:10.3109/10242422.2016.1163341.
[28] SELINHEIMO E, NIEIDHIN D, STEFFENSEN C, et al.Comparison of the characteristics of fungal and plant tyrosinases[J].Journal of Biotechnology, 2007, 130(4): 471-480. DOI:10.1016/j.jbiotech.2007.05.018.
[29] 张婉蓉, 巫婷玉, 杨民和. 产多酚氧化酶茶树内生真菌的筛选及产酶条件优化[J]. 茶叶科学, 2015, 35(3): 271-280.
[30] LEE Y, LIN Z, DU G C, et al. The fungal laccase-catalyzed oxidation of EGCG and the characterization of its products[J]. Journal of the Science of Food and Agriculture, 2015, 95(13): 2686-2692. DOI:10.1002/jsfa.7003.
[31] NARAI-KANAYAMA A, KAWASHIMA A, UCHIDA Y, et al.Specificity of tyrosinase-catalyzed synthesis of theaflavins[J].Journal of Molecular Catalysis B Enzymatic, 2016, 133: 5452-5458.DOI:10.1016/j.molcatb.2017.03.009.
[32] YABUKI C, YAGI K, NANJO F. Highly efficient synthesis of theaflavins by tyrosinase from mushroom and its application to theaf l avin related compounds[J]. Process Biochemistry, 2017, 55: 61-69. DOI:10.1016/j.procbio.2017.02.002.
[33] TAO Y M, YAO L Y, QIN Q Y, et al. Purification and characterization of polyphenol oxidase from jackfruit (Artocarpus heterophyllus)bulbs[J]. Journal of Agricultural and Food Chemistry, 2013, 61(51):12662-12669. DOI:10.1021/jf403828e.
[34] MARRUFO-HEMÁNDEZ N A, PALMA-OROZCO G, BELTRÁN H I, et al. Purification, partial biochemical characterization and inactivation of polyphenol oxidase from Mexican Golden Delicious apple (Malus domestica)[J]. Journal of Food Biochemistry, 2017,41(3): e12356. DOI:10.1111/jfbc.12356.
[35] 安燕, 张玉星, 顾雪梅, 等. 固定化多酚氧化酶及其酶促氧化酚类物质研究[J]. 环境科学与技术, 2013, 36(9): 21-25.
[36] FANG W P, WANG L P, YU J, et al. Studies on optimum conditions of synthesizing theaf l avins by using bio-enzyme method[J]. Applied Mechanics and Materials, 2012, 138/139: 929-932. DOI:10.4028/www.scientific.net/AMM.138-139.929.
[37] 蒋长兴, 焦云鹏, 熊清平, 等. 山药氧化酶特性及茶黄素的合成[J].江苏农业科学, 2013, 41(8): 277-280.
[38] 张元, 钱文俊, 韩永涛, 等. HPLC分析Cu2+对茶酶源酶促氧化合成茶黄素的影响[J]. 西北农业学报, 2015, 24(10): 118-123.
[39] LEI S C, XIE M H, HU B, et al. Effective synthesis of theaflavin-3,3’-digallate with epigallocatechin-3-O-gallate and epicatechin gallate as substrates by using immobilized pear polyphenol oxidase[J].International Journal of Biological Macromolecules, 2017, 94(Pt A):709-718. DOI:10.1016/j.ijbiomac.2016.10.072.
[40] KUHNERT N. Chemistry and biology of the black tea thearubigins and of tea fermentation[M]// PREEDY V R. Tea in health and disease prevention. San Diego: Elsevier Academic Press, 2013: 343-360.DOI:10.1016/B978-0-12-384937-3.00029-X.
[41] YASSIN G H, KOEK J H, JAYARAMAN S, et al. Identification of novel homologous series of polyhydroxylated theasinensins and theanaphthoquinones in the SII fraction of black tea thearubigins using ESI/HPLC tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2014, 62(40): 9848-9859. DOI:10.1021/jf502220.
[42] 徐斌, 江和源, 张建勇, 等. 不同pH条件下TSs的形成机理及其与TFs的竞争性形成研究[J]. 茶叶科学, 2015, 35(3): 281-289.
[43] ITOH N, KUROKAWA J, ISOGAI Y, et al. Functional characterization of epitheaf l agallin 3-O-gallate generated in laccasetreated green tea extracts in the presence of gallic acid[J]. Journal of Agricultural and Food Chemistry, 2017, 65(48): 10473-10481.DOI:10.1021/acs.jafc.7b04208.
[44] MIYATA Y, TAMARU S, TANAKA T, et al. The flavins and the asinensin a derived from fermented tea have antihyperglycemic and hypotriacylglycerolemic effects in KK-A(y) mice and Sprague-Dawley rats[J]. Journal of Agricultural and Food Chemistry, 2013, 61(39):9366-9372. DOI:10.1021/jf400123y.
[45] SHII T, TANAKA T, WATARUMI S, et al. Polyphenol composition of a functional fermented tea obtained by tea-rolling processing of green tea and loquat leaves[J]. Journal of Agricultural and Food Chemistry, 2011, 59(13): 7253-7260. DOI:10.1021/jf201499n.
[46] GUO X M, LONG P P, MENG Q L, et al. An emerging strategy for evaluating the grades of Keemun black tea by combinatory liquid chromatography-orbitrap mass spectrometry-based untargeted metabolomics and inhibition effects on α-glucosidase and α-amylase[J]. Food Chemistry, 2018, 246: 74-81. DOI:10.1016/j.foodchem.2017.10.148.
[47] ZHANG C, SUEN C L, YANG C, et al. Antioxidant capacity and major polyphenol composition of teas as affected by geographical location, plantation elevation and leaf grade[J]. Food Chemistry, 2018,244: 109-119. DOI 10.1016/j.foodchem.2017.09.126.
[48] BUTT M S, IMRAN A, SHARIF M K, et al. Black tea polyphenols: a mechanistic treatise[J]. Critical Reviews in Food Science and Nutrition,2014, 54(8): 1002-1011. DOI:10.1080/10408398.2011.623198.
[49] KIMUTAI S, WANYOKO J, KINYANJUI T, et al. Determination of residual catechins, polyphenolic contents and antioxidant activities of developed theaflavin-3,3’-digallate rich black teas[J]. Food and Nutrition Sciences, 2016, 7(3): 180-191. DOI:10.4236/fns.2016.73020.
[50] KO H J, LO C Y, WANG B J, et al. Theaflavin-3,3’-digallate, a black tea polyphenol, attenuates adipocyte-activated inflammatory response of macrophage associated with the switch of M1/M2-like phenotype[J]. Journal of Functional Foods, 2014, 11: 36-48.DOI:10.1016/j.jff.2014.09.003.
[51] DING Y P, CHEN B C, GAO Z L, et al. Pre-treated theaf l avin-3,3’-digallate has a higher inhibitory effect on the HCT116 cell line[J].Food & Nutrition Research, 2017, 61(1): 1400340. DOI:10.1080/1654 6628.2017.1400340.
[52] UCHIYAMA S, TANIGUCHI Y, SAKA A, et al. Prevention of diet-induced obesity by dietary black tea polyphenols extract in vitro and in vivo[J]. Nutrition, 2011, 27(3): 287-292. DOI:10.1016/j.nut.2010.01.019.
[53] TAKEMOTO M, TAKEMOTO H, SAIJO R. Theaf l avin synthesized in a selective, domino-type, one-pot enzymatic biotransformation method with camellia sinensis cell culture inhibits weight gain and fat accumulation to high-fat diet-induced obese mice[J]. Biological and Pharmaceutical Bulletin, 2016, 39(8): 1347-1352. DOI:10.1248/bpb.b16-00284.
[54] GAO Y, RANKIN G O, TU YY, et al. Theaflavin-3,3’-digallate decreases human ovarian carcinoma OVCAR-3 cell-induced angiogenesis via Akt and Notch-1 pathways, not via MAPK pathways[J]. International Journal of Oncology, 2016, 48(1): 281-292.DOI:10.3892/ijo.2015.3257.
[55] ZU M, YANG F, ZHOU W, et al. In vitro anti-influenza virus and anti-inflammatory activities of theaflavin derivatives[J]. Antiviral Research, 2012, 94(3): 217-224. DOI:10.1016/j.antiviral.2012.04.001.
[56] PAN M H, LIANG Y C, LIN-SHIAU S Y, et al. Induction of apoptosis by the oolong tea polyphenol theasinensin A through cytochrome c release and activation of caspase-9 and caspase-3 in human U937 cells[J]. Journal of Agricultural and Food Chemistry, 2000, 48(12):6337-6346. DOI:10.1021/jf000777b.
[57] CAO R, KOBAYASHI Y, NONAKA A, et al. NMR spectroscopic and quantum mechanical analyses of enhanced solubilization of hesperidin by theasinensin A[J]. Pharmaceutical Research, 2015, 32(7):2301-2309. DOI:10.1007/s11095-015-1621-6.
[58] HUNG W L, YANG G, WANG Y C, et al. Protective effects of theasinensin A against carbon tetrachloride-induced liver injury in mice[J]. Food and Function, 2017, 8(9): 3276-3287. DOI:10.1039/C7FO00700K.
[59] HOU D X, MASUZAKI S, TANIGAWA S, et al. Oolong tea theasinensins attenuate cyclooxygenase-2 expression in lipopolysaccharide (LPS)-activated mouse macrophages: structureactivity relationship and molecular mechanisms[J]. Journal of Agricultural and Food Chemistry, 2010, 58(24): 12735-12743.DOI:10.1021/jf103605j.
[60] ISAACS C E, XU W M, MERZ G, et al. Digallate dimers of(-)-epigallocatechin gallate inactivate herpes simplex virus[J].Antimicrobial Agents and Chemotherapy, 2011, 55: 5646-5653.DOI:10.1128/AAC.05531-11.
[61] SANG S, LAMBERT J D, TIAN S, et al. Enzymatic synthesis of tea theaflavin derivatives and their anti-inflammatory and cytotoxic activities[J]. Bioorganic and Medicinal Chemistry, 2004, 12(2): 459-467. DOI:10.1016/j.bmc.2003.10.024.
[62] SHARMA K, BARI S S, SINGH H P. Biotransformation of tea catechins into theaflavins with immobilized polyphenol oxidase[J].Journal of Molecular Catalysis B: Enzymatic, 2009, 56(4): 253-258.DOI:10.1016/j.molcatb.2008.05.016.
[63] HENNING S M, FAJARDO-LIRA C, LEE H W, et al. Catechin content of 18 teas and a green tea extract supplement correlates with the antioxidant capacity[J]. Nutrion and Cancer, 2003, 45(2): 226-235.DOI:10.1207/S15327914NC4502-13.
[64] 薛金金, 江和源, 张建勇, 等. 响应面法优化聚酯型儿茶素浸提条件[J].中国食品学报, 2015, 15(10): 105-113.
[65] 徐斌, 江和源, 张建勇, 等. 溶液中TSA及其前体物质DTSA的生成和稳定特性研究[J]. 中国食品学报, 2016, 16(5): 53-60.
[66] TANAKA T, MIYATA Y, TAMAYA K, et al. Increase of theaf l avin gallates and thearubigins by acceleration of catechin oxidation in a new fermented tea product obtained by the tea-rolling processing of loquat(Eriobotrya japonica) and green tea leaves[J]. Journal of Agricultural and Food Chemistry, 2009, 57(13): 5816-5822. DOI:10.1021/jf900963p.
[67] 付赢萱, 刘通讯. 多酚氧化酶对普洱茶渥堆发酵过程中品质变化的影响[J]. 现代食品科技, 2015, 31(3): 197-201.
[68] NAKAYAMA H, YUITO N, MIYATA Y, et al. Hypolipidemic property of a new fermented tea made with third crop green tea(Camellia sinensis) leaves and unripe satsuma mandarin (Citrus unshiu) fruits[J]. Food Science & Technology Research, 2015, 21(1):77-86. DOI:10.3136/fstr.21.77.
[69] LI Qingrong, LUO Jialing, ZHOU Zhonghua, et al. Simplified recovery of enzymes and nutrients in sweet potato wastewater and preparing health black tea and theaflavins with scrap tea[J]. Food Chemistry,2018, 245: 854-862. DOI:10.1016/j.foodchem.2017.11.095.
Recent Progress in Synthesis of Oxidized Dimeric Catechin Catalyzed by Exogenous Polyphenol Oxidase
FU Jing, JIANG Heyuan, ZHANG Jianyong, et al. Recent progress in synthesis of oxidized dimeric catechin catalyzed by exogenous polyphenol oxidase[J]. Food Science, 2019, 40(7): 274-280. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180206-089. http://www.spkx.net.cn