酒花与啤酒中单萜化合物的研究进展
洪 凯,马长伟*
(中国农业大学食品科学与营养工程学院,植物蛋白与谷物加工北京市重点实验室,北京 100083)
摘 要:单萜化合物是酒花和啤酒中香气化合物的重要组成部分,具有典型的酒花香气特征,在自然界中以游离态和糖苷结合态两种形式存在。本文重点阐述了酒花中单萜化合物的生物合成途径、控制其合成的关键酶和基因以及酒花中单萜醇化合物相互转化关键酶的研究进展。此外,本文还综述了酒花与啤酒中单萜化合物的变化及其影响因素,糖苷结合态单萜化合物的结构、含量及其分析方法,并对单萜化合物在啤酒中的研究前景进行展望。
关键词:酒花;啤酒;香气化合物;单萜;生物合成途径
萜类化合物是植物次生代谢产物最大的家族之一,在自然界中广泛分布,目前已知的萜类物质超过5.5万 种[1],萜类物质以异戊二烯作为基本单元,因此,也被称为类异戊二烯化合物。单萜化合物是萜类化合物中的重要组成成分,广泛存在于高等植物的分泌组织中,目前已知的单萜化合物有1 000多种[2],多具有较强的香气,是化妆品工业的重要原料[3]。同时,单萜化合物因为食用安全且对微生物具有较强的抑制作用,故也被作为防腐剂广泛应用于食品领域。单萜化合物根据化学结构的不同,分为游离态和糖苷结合态;根据碳架的不同,又分为无环单萜、单环单萜和双环单萜[4]。
用于啤酒酿造的酒花是成熟的雌性酒花,其苞片内表面的下端被一层腺毛覆盖,称为蛇麻腺,也称为分泌腺或盾状毛,是由角质层围成的空腔,空腔内包含一组分泌细胞。酒花蛇麻腺中合成并积累3 类主要次生代谢产物:酒花精油、苦味酸和异戊二烯类黄酮。商业酒花受酒花品种、种植环境和栽培模式等因素的影响通常在这些组分的含量上有差异,这决定了它们在啤酒的苦味、香味和口感方面的作用也各不相同。有研究证明,采摘时间对酒花中单萜和其他香气化合物具有显著影响,而修枝时间对酒花以及啤酒的香气影响不大[5-6]。酒花精油是酒花的主要香气成分,占酒花质量的0.5%~3.0%,酒花精油的组成由酒花基因型决定,其组成差异与苦味酸、异戊二烯类黄酮共同作为区分不同品种酒花的指标。酒花精油中萜类物质含量最丰富,约占90%[7],在萜类物质中又以单萜类化合物最多。因此,单萜类化合物对酒花及啤酒的香气具有突出贡献。
目前,大多数关于单萜类化合物的研究集中在酒花花果上,而在酒花其他组织中发现单萜类化合物的报道较少,酒花毛囊是否是单萜类化合物生物合成和贮存的专用器官目前也还没有定论。另有研究发现,酿酒酵母体内存在单萜类化合物合成的甲羟戊酸途径(mevalonate pathway,MVA),而且有学者完成了多种萜类化合物在酿酒酵母内的表达,利用代谢工程改造酿酒酵母或者其他微生物生产萜类化合物[1-2,8-9]。
1 酒花中单萜化合物的生物合成
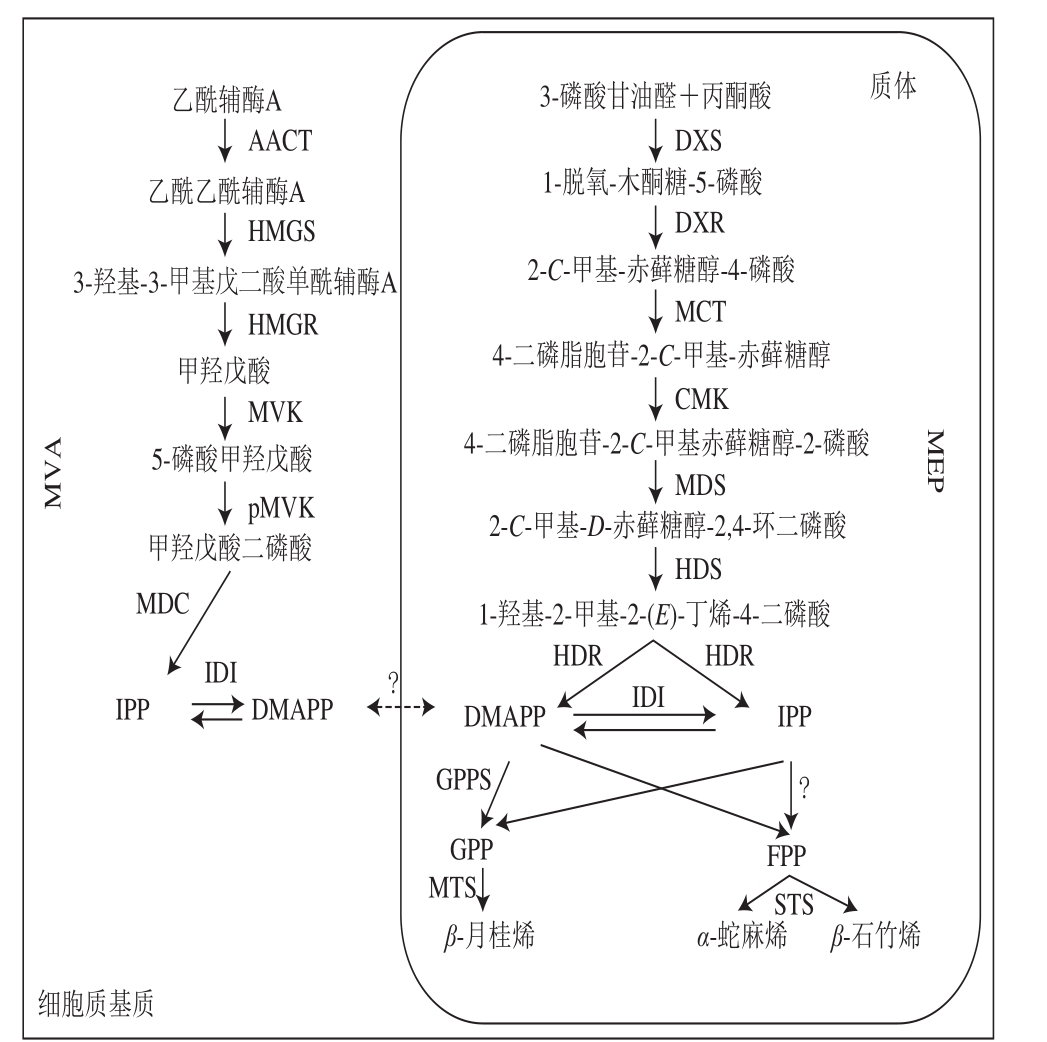
植物萜类化合物的生物合成主要有以下两条途径:1)位于植物细胞质体中的甲基磷酸赤藓糖途径(2-methyl-D-erythritol-4-phosphate pathway,MEP);2)位于细胞质中的MVA[10]。
酒花中的单帖化合物主要通过MEP在质体中合成。以糖酵解产物丙酮酸和3-磷酸甘油醛为起点,在1-脱氧-木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose-5-phosphate synthase,DXS)的作用下转化为1-脱氧-木酮糖-5-磷酸,而后1-脱氧-木酮糖-5-磷酸还原异构酶(1-deoxy-D-xylulose-5-phosphate reductoisomerase,DXR)催化1-脱氧-木酮糖-5-磷酸转化为2-C-甲基-赤藓糖醇-4-磷酸。2-C-甲基-赤藓糖醇-4-磷酸又经2-C-甲基-D-赤藓糖醇-4-磷酸胞苷酰转移酶(2-C-methyl-D-erythritol 4-phosphate cytidylyltransferase,MCT)环化作用生成4-二磷酸胞苷-2-C-甲基-赤藓糖醇,之后在4-二磷酸胞苷-2-C-甲基-D-赤藓糖醇激酶(4-diphosphocytidyl-2-C-metllyl-D-erythritol kinase,CMK)的作用下,生成4-二磷酸胞苷-2-C-甲基赤藓糖醇-2-磷酸,再经过2-C-甲基赤藓糖醇-2,4-环二磷酸合成酶催化生成2-C-甲基-D-赤藓糖醇-2,4-环二磷酸,进一步在l-羟基-2-甲基-2-(E)-丁烯基-4-二磷酸合成酶(1-hydroxy-2-methyl-2-(E)-butenyl-4-diphosphate synthase,HDS)作用下形成1-羟基-2-甲基-2-(E)-丁烯-4-二磷酸,并在4-羟基-3-甲基丁-2-烯基二磷酸还原酶(4-hydroxy-3-methylbut-2-enyl diphosphate reductase,HDR)的作用下催化形成中间体异戊烯基焦磷酸(isopentenyl pyrophosphate,IPP)及其双键异构体二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate,DMAPP),最后各1分子的2 个同分异构中间体IPP和DMAPP在香叶基焦磷酸合成酶(geranyl diphosphate synthase,GPPS)的作用下经头尾缩合生成香叶基焦磷酸(geranyl diphosphate,GPP)[11]。GPP是所有单萜化合物生物合成的底物,在单萜合成酶作用下催化合成一系列单萜化合物。
Goese等通过13C标记的高通量组学研究证明,酒花中葎草酮化合物分子结构中的碳原子来自于脱氧木糖[12];Champagne等在酒花中鉴定出了MEP合成萜类化合物时上游部分全部的酶(图1),而在MVA中只鉴定出了乙酰乙酰辅酶A硫解酶(acetoacetyl coenzyme A (CoA)thiolase,AACT)[13],由此证实了MEP在酒花腺毛的萜类物质合成中起主要作用。Wang Guodong等鉴定了酒花中除MCT和CMK以外所有与质体MEP中的酶对应的表达序列标签(expressed sequence tag,EST),而没有发现与MVA中的酶对应的EST[14]。同样,Nagel等发现了100 个与MEP相关的EST,却只发现了10 个与MVA相关的EST,并且只在质体中发现了IPP/DMAPP异构酶[15]。
GPPS催化生成作为单萜合成直接底物的GPP,被子植物中的GPPS由两个亚基组成,因此,GPPS分为异二聚体和同二聚体。GPPS的小亚基在同二聚体中时是无活性的。酒花中GPPS的小亚基作为功能性异二聚体的活性调节剂,促进IPP向生成GPP的方向进行,而抑制其向香叶基GPP(geranyl GPP,GGPP)的转化[16]。
Gutensohn等[17]在番茄果实中共表达金鱼草GPPS小亚基基因和甜罗勒细胞质萜烯合成酶基因,发现与单独引入萜烯合成酶相比单萜积累增加。该实验还表明,GPP可以从质体转移到细胞质中。GPPS的大亚基在以DMAPP和IPP为底物时可以具有GGPP合成酶(GGPP synthase,GGPPS)活性[16],GPPS的这个大亚基同时接受GPP作为IPP的共同基质,形成法尼基焦磷酸和GGPP。最近的研究结果验证了在细胞质中过表达GPPS可以形成碳链更长的萜类化合物[18],这也印证了GPPS小亚基位于叶绿体的外部,表明IPP和GPP在细胞质基质和质体之间可以进行有效的转运。在单萜合成酶基因的研究中,Champagne等鉴定出对应于单萜合成酶的2 个EST,在与全长序列比对后,确定这2 个EST属于相同的2型单萜合成酶,该酶催化酒花精油中主要单萜β-月桂烯的体外合成[13]。
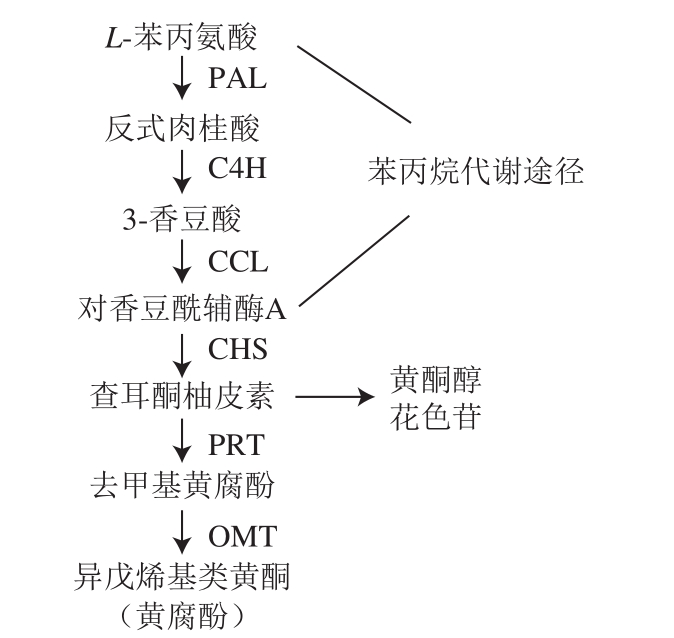
目前,越来越多的证据表明,苯丙烷途径和萜类合成途径之间存在相互联系(图2)。金鱼草花中的单萜合成依赖于GPPS和单萜烯合成酶的活性,它们同时也通过尚未表征的上游调节机制影响苯丙烷的产生[20]。最近在番茄腺毛的研究中发现,缺失查耳酮异构酶(合成类黄酮的中心前体柚皮素)会削弱萜类物质的生成[21]。此外,玫瑰花中的转录因子PAP1(MYB家族)可能对诱导苯丙烷和萜类化合物通路中挥发性化合物的产生起到共同促进的作用[22]。黄腐酚是酒花中最典型的异戊烯基类黄酮化合物,研究证明,黄腐酚在癌症发展的各个阶段有着良好的抑制效果[23-24];同时,黄腐酚和8-异戊烯基柚皮素可以通过调节葡萄糖和脂质代谢来改善与2型糖尿病相关的代谢紊乱[25]。Matoušek等[26]发现,转录因子HlWRKY1和AtWRKY75在异戊烯基类黄酮化合物的合成调控中起着重要作用。Ban Zhaonan等[27]鉴定出两个不具备催化活性的查耳酮异构酶(CHIL1和CHIL2),参与并调控酒花中黄腐酚的生物合成。证明CHIL2能够与黄腐酚合成通路中上、下游蛋白查耳酮合成酶和膜定位的异戊烯基转移酶互作并提高它们的活性,形成的代谢复合体可以高效催化黄腐酚的生物合成;而CHIL1能够结合黄腐酚代谢途径中柚皮素查耳酮和脱甲基黄腐酚等中间化合物,稳定这些化合物的开环结构,进而维持其生物活性;同时此研究还证明了使用酵母作为工程菌株高效生产黄腐酚的可行性。雌酒花腺毛中异戊烯基类黄酮化合物的含量非常可观,因此,研究酒花中这两种途径之间的关系对于酒花中功能性成分的开发具有重要的指导意义。
2 酒花中单萜化合物的种类
2.1 游离态
酒花精油中的单萜化合物主要由单萜烯和单萜醇类化合物组成[28]。单萜烯易挥发、氧化聚合,在水、麦芽汁和啤酒中的溶解度很低,其中大部分在麦汁煮沸过程中蒸发损失,最终进入啤酒中的单萜烯类化合物非常少[29]。β-月桂烯是重要的单萜化合物,赋予新鲜酒花刺激性气味[30],其含量占总酒花精油的30%~60%[31]。酒花精油中其他的单萜化合物含量明显较低,包括罗勒烯、β-蒎烯、柠檬烯和p-异丙基苯等[32]。酒花中的萜醇类化合物主要包括芳樟醇、香叶醇、橙花叔醇、橙花醇和松油醇,其中芳樟醇含量最丰富,由Chapman于1903年最先鉴定[32]。芳樟醇被认为是啤酒中重要的酒花香味指示化合物。芳樟醇既具有紫丁香、铃兰香与玫瑰花香,又有木香、果香气息,香气柔和。芳樟醇对酒花香气特征的贡献取决于酒花的添加方式。采用传统的酿造方法时,酒花在煮沸阶段添加,大部分芳樟醇从醪液中挥发损失,对啤酒的香气贡献很小;而在发酵阶段添加时,发酵液的温度较低,芳樟醇对啤酒中香气的贡献则比较明显。芳樟醇存在两种立体异构体:(R)-(-)-芳樟醇和(S)-(+)-芳樟醇。(R)-(-)-芳樟醇阈值较低,风味活性更强,并且在芳樟醇中通常占92%~94%。香叶醇、橙花醇是酒花精油的重要组成部分,香叶醇具有温和、甜蜜的玫瑰花气息和苦味感。而橙花醇具有令人愉快的玫瑰花和橙花香气,香气平和,微带柠檬果香。橙花醇是香叶醇的异构体,其香气比香叶醇柔,并带有新鲜的清香和柑橘香调。目前,工业合成香叶醇和橙花醇的方法主要是通过β-蒎烯、芳樟醇、柠檬醛等合成[33-35]。近来学者将来自酒花、薄荷和甜罗勒的单萜合成基因编辑进酵母中,通过控制单萜(芳樟醇和香叶醇)合成途径关键基因的表达,代替传统啤酒酿造中添加酒花的做法,实现了不使用酒花就能达到在啤酒中增加单萜醇的效果,是对啤酒酿造工艺的创新[36]。
单萜醇除赋予啤酒鲜明的香气外,还具有重要的生物活性。Miyashita等[37]通过活体实验发现,阿霉素和芳樟醇结合使用能够显著抑制肿瘤细胞的生长。Yu等[38]发现香叶醇能够抑制细胞内甲羟戊酸的生物合成,从而限制蛋白质的异戊烯化,进而对小鼠肝癌和黑色素瘤细胞的生长起到抑制作用。Carnesecchi等[39]发现,香叶醇能抑制70%结肠肿瘤细胞的生长,使细胞内鸟氨酸脱羧酶活力降低50%,抑制细胞内丁二胺的生成。Carnesecchi等[40]的研究还表明,香叶醇造成癌细胞中的胸苷酸合成酶和胸苷激酶表达量减少1 倍。Burke等[41]发现香叶醇还能抑制胰腺肿瘤细胞的生长。
2.2 糖苷结合态
人们对糖苷类风味化合物的研究始于1969年。Francis等首次在玫瑰中证实了糖苷类风味前体物的存在[42]。Williams等的研究发现,在葡萄果实中存在着一些水溶性糖苷结合态化合物,这些化合物在水解后对香气具有较大贡献[43]。大量研究表明,植物材料中的风味化合物主要以非挥发性、无气味、键合态糖苷的形式贮存和转运。
已有研究表明,这些糖苷类化合物也存在于酒花和啤酒中[44-46]。糖苷化合物由糖和糖苷配基两部分组成,糖的异头碳结合到糖苷配基的羟基上。糖苷中的糖可以是单糖、二糖或多糖。水解糖苷并释放糖苷配基的酶,其特异性与糖苷键和糖的类型相关。由此产生的酶解产物分为3 类:简单醇、萜烯醇和羰基化合物[46]。
Kollmannsberger等发现,在酒花及其乙醇树脂提取物中均能检测到相当含量的单萜醇,但二氧化碳提取物中却未检测到。在啤酒中也能鉴定出相同的糖苷。这些糖苷类化合物虽然总量很低,但从酒花糖苷中释放的芳樟醇和一些非类胡萝卜素化合物可能有助于提高啤酒的酒花风味[45]。
3 啤酒酿造过程中单萜化合物的转化
3.1 游离态单萜化合物的生物转化
酒花中的单萜化合物最终通过发酵过程进入啤酒中,这些单萜化合物在啤酒中的含量及对应的阈值各不相同,所以对啤酒香气的贡献也存在差异。来自酒花精油的单萜醇——芳樟醇在啤酒中始终能被检测到,且含量显著高于其风味阈值(R-芳樟醇的风味阈值为2.2 μg/L,S-芳樟醇的风味阈值为180 μg/L),因此,常被用来作为检测啤酒中酒花香气强度和质量的参照物[47]。除了芳樟醇,其他的萜烯醇,如香叶醇、香茅醇、松油醇、橙花醇等来源于酒花精油的香气成分也能从啤酒中检测到,它们对啤酒的香气特性也有一定贡献[48-49]。
芳樟醇被确定为新鲜或干酒花中最有效的风味化合物之一[50],对啤酒的酒花香味有很大贡献[51]。其浓度被认为可用于预测啤酒的风味强度。在啤酒酿造的不同阶段添加酒花对酒体香气的贡献差异较大,传统酿造工艺中酒花在麦汁煮沸阶段加入,在这个过程中芳樟醇的浓度会降低超过95%[48]。采用外加酒花精油或者二氧化碳提取物酿造的啤酒中,这些芳香烃也会很快消散。在外加芳樟醇的啤酒中,其含量在啤酒贮藏期的前2 周快速下降。王露等[52]的研究发现,在煮沸结束、回旋沉淀槽及主发酵结束后添加酒花较煮沸结束前10 min添加能显著提高萜烯醇及其立体异构体在啤酒中的含量,且在贮藏期间可能存在着一系列的相互转化。在此期间,啤酒中的萜烯醇如香叶醇、芳樟醇、橙花醇等化合物的浓度在发酵和老化过程中有所增加。发酵前期萜烯醇的变化被认为是酵母代谢的作用,在发酵后期酵母细胞膜的通透性增加,糖苷酶得以分泌到细胞外,此时萜烯醇含量的增加多归因于糖苷结合态萜烯醇的解离[52-53]。
King等[54]研究了芳樟醇、香叶醇、香茅醇等酒花精油香气成分在发酵体系中的生物转化,发现拉格酵母和艾尔酵母均能将香叶醇转化成香茅醇,将芳樟醇和橙花醇转化成α-松油醇。拉格酵母还能进一步产生萜烯酯类,如乙酸香叶酯和乙酸香茅酯。Gamero等发现,不同酵母菌种对香叶醇的吸收和转化比例不同,香叶醇向芳樟醇和α-松油醇的化学转化缓慢[55]。Brodkorb等[56]发现,卡斯特式菌(Castellaniella defragrans)具备转化月桂烯、香叶醇和芳樟醇的能力,并成功分离出了芳樟醇脱水异构酶,测定出该酶的分子质量为160 kDa,由4 个亚基组成。Ullah[57]和Bell[58]等分别发现,在假单胞菌(Pseudomonas putida)和新鞘氨醇杆菌(Novosphingobium aromaticivorans)中存在使里那醇转化为氧合里那醇的酶,但到目前为止,鲜见关于酿酒酵母中单萜化合物转化酶的报道。
3.2 糖苷结合态单萜化合物的释放
糖苷结合态风味化合物的分析步骤包括分离、水解、测定等[45-46,59]。首先需要对酒花或啤酒中糖苷结合态单萜化合物进行吸附、分离,常用吸附剂包括Amberlite XAD-2树脂、反相硅胶等,常用洗脱剂有乙醇、戊烷、二氯甲烷、乙酸乙酯、甲醇等。Kollmannsberger等[45]加入内标苯基-β-D-葡糖苷后,用热水或甲醇-水(体积比4∶1)提取酒花中的糖苷化合物,然后将提取物用交联聚乙烯吡咯烷酮处理,再经过滤并浓缩干燥,用戊烷-二氯甲烷(体积比2∶1)萃取挥发性化合物。最后在Amberlite XAD-2树脂上分级分离后,将甲醇洗脱液浓缩至干,即制得糖苷提取物。对糖苷结合态化合物进行鉴定,常用技术包括高效液相色谱、尺寸排阻色谱、逆流色谱等。获得物质单体后,可进一步对其结构进行分析鉴定,常用技术包括质谱检测法、傅里叶变换红外光谱法、核磁共振等方法[59-60]。
糖苷结合态单萜化合物通过糖苷酶或酸的作用裂解糖苷键释放出游离态单萜化合物并进一步发生前文所述的分子间相互转化。通过对糖苷结合态风味前体物进行水解,可获得相应的糖配体和糖苷配基,对糖配体的测定可知糖苷结合态单萜化合物的总含量,对糖苷配基的研究可了解组成糖苷的单萜化合物种类和含量等。糖苷的水解方式分为酸水解和酶促水解[46]。其中,酸水解简单易行,但对产物的影响较大,可能导致单萜化合物发生重排,若水解温度过高,甚至会产生不良风味;而酶促水解所需条件温和,产物更接近实际状态。其中对单糖苷类单萜化合物而言,需要相应的β-D-葡萄糖苷酶作用打开糖苷键,释放出挥发性的单萜化合物组分。
4 结 语
单萜化合物是酒花和啤酒中挥发性化合物的重要组成部分,是表征酒花典型特征的香气化合物。随着近年来国内精酿啤酒的兴起和流行,尤其是晚投和干投酒花工艺的采用,单萜化合物对于啤酒酿造的意义更加凸显。单萜化合物的组成和来源十分复杂,主要以游离态和糖苷结合态两种形式存在于酒花和啤酒中。当前,各种新型分析技术不断涌现,为深入研究酒花和啤酒中单萜化合物的香气特征、结构鉴定以及组成变化等提供了更多有效的技术手段。
目前,我国的酒花产业发展亟待完善。深入调查我国现有主栽酒花品种以及重要野生酒花品种中游离态和结合态单萜化合物的组成和香气特征,对于充分利用和深入挖掘我国地方酒花品种的酿造品质具有指导意义;同时,进一步考察酒花栽培措施、啤酒酿造工艺对单萜化合物组成的影响,对于全面评价和提升酒花和啤酒的香气品质具有重要的实际应用价值。
研究酒花中单萜化合物的代谢途径及其调控网络将是一项极具挑战性的工作。随着功能基因组学的发展,将转录组学和代谢组学方法在酒花单萜合成途径中进行结合研究,有可能成为寻找单萜化合物代谢相关基因的有效途径。目前,关于酒花单萜化合物代谢途径的研究热点主要集中在通过基因重组技术优化酒花单萜合成代谢途径中的关键反应步骤,和使用工程菌株作为载体表达获取大量相关酶和特定的单萜产物两方面。后续研究可以从限速酶、转录因子、转运蛋白以及代谢途径的限制作用等方面进一步阐明上述代谢途径的分子调控机制。
参考文献:
[1] 刘继栋. 代谢工程改造酿酒酵母生产单萜的关键问题解析[D].无锡: 江南大学, 2013: 1-2.
[2] MI J, BECHER D, LUBUTA P, et al. De novo production of the monoterpenoid geranic acid by metabolically engineered Pseudomonas putida[J]. Microbial Cell Factories, 2014, 13(1): 1-11. DOI:10.1186/s12934-014-0170-8.
[3] BAKKALI F, AVERBECK S, AVERBECK D, et al. Biological effects of essential oils: a review[J]. Food and Chemical Toxicology, 2008,46(2): 446-475. DOI:10.1016/j.fct.2007.09.106.
[4] SWIFT K A D. Catalytic transformation of the major terpene feedstocks[J]. Topics in Catalysis, 2004, 27(1/2/3/4): 143-155.DOI:10.1023/B:TOCA.0000013549.60930.da.
[5] MATSUI H, INUI T, OKA K, et al. The influence of pruning and harvest timing on hop aroma, cone appearance, and yield[J]. Food Chemistry, 2016, 202: 15-22. DOI:10.1016/j.foodchem.2016.01.058.
[6] SCHNAITTER M, WIMMER A, KOLLMANNSBERGER H, et al.Inf l uence of hop harvest date of the ‘Mandarina Bavaria’ hop variety on the sensory evaluation of dry-hopped top-fermented beer[J]. Journal of the Institute of Brewing, 2016, 122(4): 661-669. DOI:10.1002/jib.382.
[7] ERI S, KHOO B K, LECH J, et al. Direct thermal desorption-gas chromatography and gas chromatography-mass spectrometry profiling of hop (Humulus lupulus L.) essential oils in support of varietal characterization[J]. Journal of Agricultural and Food Chemistry, 2000,48(4): 1140-1149. DOI:10.1021/jf9911850.
[8] MISAWA N. Pathway engineering for functional isoprenoids[J].Current Opinion in Biotechnology, 2011, 22(5): 627-633.DOI:10.1016/j.copbio.2011.01.002.
[9] YE V M, BHATIA S K. Pathway engineering strategies for production of beneficial carotenoids in microbial hosts[J]. Biotechnology Letters,2012, 34(8): 1405-1414. DOI:10.1007/s10529-012-0921-8.
[10] CHAPPELL J. The biochemistry and molecular biology of isoprenoid metabolism[J]. Plant Physiology, 1995, 107(1): 1-6. DOI:10.1104/pp.107.1.1.
[11] WITHERS S T, KEASLING J D. Biosynthesis and engineering of isoprenoid small molecules[J]. Applied Microbiology and Biotechnology,2006, 73(5): 980-990. DOI:10.1007/s00253-006-0593-1.
[12] GOESE M, KAMMHUBER K, BACHER A, et al. Biosynthesis of bitter acids in hops. a13C-NMR and2H-NMR study on the building blocks of humulone[J]. European Journal of Biochemistry, 1999,263(2): 447-454. DOI:10.1046/j.1432-1327.1999.00518.x.
[13] CHAMPAGNE A, BOUTRY M. A comprehensive proteome map of glandular trichomes of hop (Humulus lupulus L.) female cones:identification of biosynthetic pathways of the major terpenoid-related compounds and possible transport proteins[J]. Proteomics, 2017,17(8): 1-10. DOI:10.1002/pmic.201600411.
[14] WANG Guodong, TIAN Li, AZIZ N, et al. Terpene biosynthesis in glandular trichomes of hop[J]. Plant Physiology, 2008, 148(3):1254-1266. DOI:10.1104/pp.108.125187.
[15] NAGEL J, CULLEY L K, LU Y P, et al. EST analysis of hop glandular trichomes identifies an O-methyltransferase that catalyzes the biosynthesis of xanthohumol[J]. The Plant Cell Online, 2008, 20(1):186-200. DOI:10.1105/tpc.107.055178.
[16] WANG G D, DIXON R A. Heterodimeric geranyl(geranyl)diphosphate synthase from hop (Humulus lupulus L.) and the evolution of monoterpene biosynthesis[J]. Proceedings of the National Academy of Sciences, 2009, 106(24): 9914-9919. DOI:10.1073/pnas.0904069106.
[17] GUTENSOHN M, ORLOVA I, NGUYEN T T H, et al. Cytosolic monoterpene biosynthesis is supported by plastid-generated geranyl diphosphate substrate in transgenic tomato fruits[J]. The Plant Journal,2013, 75(3): 351-363. DOI:10.1111/tpj.12212.
[18] XI J, ROSSI L, LIN X, et al. Overexpression of a synthetic insectplant geranyl pyrophosphate synthase gene in Camelina sativa alters plant growth and terpene biosynthesis[J]. Planta, 2016, 244(1): 215-230. DOI:10.1007/s00425-016-2504-8.
[19] KOCÁBEK T, MISHRA A K, MATOUŠEK J, et al. The R2R3 transcription factor HlMYB8 and its role in flavonoid biosynthesis in hop (Humulus lupulus L.)[J]. Plant Science, 2018, 269: 32-46.DOI:10.1016/j.plantsci.2018.01.004.
[20] DUDAREVA N, MARTIN D, KISH C M, et al. (E)-β-Ocimene and myrcene synthase genes of floral scent biosynthesis in snapdragon:function and expression of three terpene synthase genes of a new terpene synthase subfamily[J]. Plant Cell, 2003, 15(5): 1227-1241.DOI:10.1105/tpc.011015.
[21] KANG J, MCROBERTS J, SHI F, et al. The flavonoid biosynthetic enzyme chalcone isomerase modulates terpenoid production in glandular trichomes of tomato[J]. Plant Physiology, 2014, 164(3):1161-1174. DOI:10.1104/pp.113.233395.
[22] ZVI M M, SHKLARMAN E, MASCI T, et al. PAP1 transcription factor enhances production of phenylpropanoid and terpenoid scent compounds in rose flowers[J]. New Phytologist, 2012, 195(2):335-345. DOI:10.1111/j.1469-8137.2012.04161.x.
[23] GERHAUSER C, ALT A, HEISS E, et al. Cancer chemopreventive activity of xanthohumol, a natural product derived from hop[J].Molecular Cancer Therapeutics, 2002, 1(11): 959-969.
[24] ZANOLI P, ZAVATTI M. Pharmacognostic and pharmacological profile of Humulus lupulus L.[J]. Journal of Ethnopharmacology, 2008,116(3): 383-396. DOI:10.1016/j.jep.2008.01.011.
[25] COSTA R, RODRIGUES I, GUARDÃO L, et al. Xanthohumol and 8-prenylnaringenin ameliorate diabetic-related metabolic dysfunctions in mice[J]. The Journal of Nutritional Biochemistry, 2017, 45: 39-47.DOI:10.1016/j.jnutbio.2017.03.006.
[26] MATOUŠEK J, KOCÁBEK T, PATZAK J, et al. The “putative” role of transcription factors from HlWRKY family in the regulation of the final steps of prenylf l avonid and bitter acids biosynthesis in hop(Humulus lupulus L.)[J]. Plant Molecular Biology, 2016, 92(3): 263-277. DOI:10.1007/s11103-016-0510-7.
[27] BAN Zhaonan, QIN Hao, MITCHELL A J, et al. Noncatalytic chalcone isomerase-fold proteins in Humulus lupulus are auxiliary components in prenylated flavonoid biosynthesis[J]. Proceedings of the National Academy of Sciences, 2018, 115(22): E5223-E5232.DOI:10.1073/pnas.1802223115.
[28] SHARPE F R, LAWS D R J. The essential oil of hops: a review[J].Journal of the Institute of Brewing, 1981, 87: 96-107. DOI:10.1002/j.2050-0416.1981.tb03996.x.
[29] ALMAGUER C, SCHÖNBERGER C, GASTL M, et al. Humulus lupulus: a story that begs to be told. a review[J]. Journal of the Institute of Brewing, 2014, 120(4): 289-314. DOI:10.1002/jib.160.
[30] VAN DE VELDE N, VERZELE M. High performance liquid chromatography of hop and beer extracts with photodiode array detection[J]. Journal of the Institute of Brewing, 1986, 92(6): 584-587.DOI:10.1002/j.2050-0416.1986.tb04457.x.
[31] THOMPSON M L, MARRIOTT R, DOWLE A, et al.Biotransformation of β-myrcene to geraniol by a strain of Rhodococcus erythropolis isolated by selective enrichment from hop plants[J].Applied Microbiology and Biotechnology, 2010, 85(3): 721-730.DOI:10.1007/s00253-009-2182-6.
[32] STEVENS R. The chemistry of hop constituents[J]. Chemical Reviews, 1967, 67(1): 19-71.
[33] 刘先章, 王振洪, 蒋同夫. 合成香叶醇和橙花醇的研究[J]. 林产化学与工业, 1989(4): 11-19.
[34] 黄宇平, 刘建军, 陈伟强, 等. 钒化合物催化芳樟醇酯化异构制取香叶醇、橙花醇[J]. 林产化工通讯, 2005(2): 28-30.
[35] 尹显洪. 柠檬醛还原制备橙花醇香叶醇的新方法[J]. 化学通报,1997(8): 57-58.
[36] DENBY C M, LI R A, VU V T, et al. Industrial brewing yeast engineered for the production of primary fl avor determinants in hopped beer[J]. Nature Communications, 2018, 9(1): 965-971. DOI:10.1038/s41467-018-03293-x.
[37] MIYASHITA M, SADZUKA Y. Effect of linalool as a component of Humulus lupulus on doxorubicin-induced antitumor activity[J].Food and Chemical Toxicology, 2013, 53: 174-179. DOI:10.1016/j.fct.2012.11.035.
[38] YU S G, HILDEBRANDT L A, ELSON C E. Geraniol, an inhibitor of mevalonate biosynthesis, suppresses the growth of hepatomas and melanomas transplanted to rats and mice[J]. Journal of Nutrition, 1995,125(11): 2763-2767.
[39] CARNESECCHI S, SCHNEIDER Y, CERALINE J, et al. Geraniol,a component of plant essential oils, inhibits growth and polyamine biosynthesis in human colon cancer cells[J]. Journal of Pharmacology and Experimental Therapeutics, 2001, 298(1): 197-200.
[40] CARNESECCHI S, BRAS-GONÇALVES R, BRADAIA A, et al.Geraniol, a component of plant essential oils, modulates DNA synthesis and potentiates 5-f l uorouracil efficacy on human colon tumor xenografts[J]. Cancer Letters, 2004, 215(1): 53-59. DOI:10.1016/j.canlet.2004.06.019.
[41] BURKE Y D, STARK M J, ROACH S L, et al. Inhibition of pancreatic cancer growth by the dietary isoprenoids farnesol and geraniol[J].Lipids, 1997, 32(2): 151-156. DOI:10.1007/s11745-997-0019-y.
[42] FRANCIS M J, ALLCOCK C. Geraniol β-D-glucosides; occurrence and synthesis in rose fl owers[J]. Phytochemistry, 1969, 8: 1339-1347.
[43] WILLIAMS P J, CYNKAR W, FRANCIS I L, et al. Quantification of glycosides in grapes, juices, and wines through a determination of glycosyl glucose[J]. Journal of Agricultural and Food Chemistry, 1995,43(1): 121-128. DOI:10.1021/jf00049a023.
[44] MURAKAMI A A, NAVARRO A L, RYDER D S, et al. Use of glycosides extracted from hop plant parts to flavor malt beverages:WO03078562[P]. 2003-09-25[2018-11-29]. https://patents.google.com/patent/WO2003078562A8.
[45] KOLLMANNSBERGER H, BIENDL M, NITZ S. Occurence of glycosidically bound flavour compounds in hops, hop products and beer[J]. Monatsschr Brauwiss, 2006, 5(6): 83-89.
[46] SHARP D C, VOLLMER D M, QIAN Y P, et al. Examination of glycoside hydrolysis methods for the determination of terpenyl glycoside contents of different hop cultivars[J]. Journal of the American Society of Brewing Chemists, 2017, 75(2): 101-108.DOI:10.1094/ASBCJ-2017-2071-01.
[47] VAN OPSTAELE F, DE ROUCK G, DE CLIPPELEER J, et al.Analytical and sensory assessment of hoppy aroma and bitterness of conventionally hopped and advanced hopped pilsner beers[J]. Journal of the Institute of Brewing, 2010, 116(4): 445-458. DOI:10.1002/j.2050-0416. 2010.tb00796.x.
[48] KISHIMOTO T, WANIKAWA A, KAGAMI N, et al. Analysis of hop-derived terpenoids in beer and evaluation of their behavior using the stir bar-sorptive extraction method with GC-MS[J]. Journal of Agricultural and Food Chemistry, 2005, 53(12): 4701-4707.DOI:10.1021/jf050072f.
[49] KISHIMOTO T, WANIKAWA A, KONO K, et al. Comparison of the odor-active compounds in unhopped beer and beers hopped with different hop varieties[J]. Journal of Agricultural and Food Chemistry,2006, 54(23): 8855-8861. DOI:10.1021/jf061342c.
[50] STEINHAUS M, SCHIEBERLE P. Comparison of the most odoractive compounds in fresh and dried hop cones (Humulus lupulus L.Variety Spalter Select) based on GC-olfactometry and odor dilution techniques[J]. Journal of Agricultural and Food Chemistry, 2000,48(5): 1776-1783. DOI:10.1021/jf990514l.
[51] PEACOCK V E, DEINZER M L. Chemistry of hop aroma in beer[J].Journal of the American Society of Brewing Chemists, 1981, 39(4):136-141.
[52] 王露, 江伟, 刘翔, 等. 酒花萜烯醇及其立体异构体在啤酒酿造中的检测及其变化研究[J]. 食品与发酵工业, 2014(7): 149-155.DOI:10.13995/j.cnki.11-1802/ts.2014.07.008
[53] LERMUSIEAU G, BULENS M, COLLIN S. Use of GC-olfactometry to identify the hop aromatic compounds in beer[J].Journal of Agricultural and Food Chemistry, 2001, 49(8): 3867-3874.DOI:10.1021/jf0101509.
[54] KING A, RICHARD D J. Biotransformation of monoterpene alcohols by Saccharomyces cerevisiae, Torulaspora delbrueckii and Kluyveromyces lactis[J]. Yeast, 2000, 16(6): 499-506. DOI:10.1002/(SICI)1097-0061(200004)16:6<499:AID-YEA548>3.0.CO;2-E.
[55] GAMERO A, MANZANARES P, QUEROL A, et al. Monoterpene alcohols release and bioconversion by Saccharomyces species and hybrids[J]. International Journal of Food Microbiology, 2011, 145(1):92-97. DOI:10.1016/j.ijfoodmicro.2010.11.034.
[56] BRODKORB D, GOTTSCHALL M, MARMULLA R, et al. Linalool dehydratase-isomerase, a bifunctional enzyme in the anaerobic degradation of monoterpenes[J]. Journal of Biological Chemistry,2010, 285(40): 30436-30442. DOI:10.1074/jbc.M109.084244.
[57] ULLAH A J H, MURRAY R I, BHATTACHARYYA P K, et al. Protein components of a cytochrome P-450 linalool 8-methyl hydroxylase[J].Journal of Biological Chemistry, 1990, 265(3): 1345-1351.
[58] BELL S G, DALE A, REES N H, et al. A cytochrome P450 class I electron transfer system from Novosphingobium aromaticivorans[J].Applied Microbiology and Biotechnology, 2010, 86(1): 163-175.DOI:10.1007/s00253-009-2234-y.
[59] YOSHIHISA T, DAIKI H, MASAYOSHI T, et al. New chromanone and acylphloroglucinol glycosides from the bracts of hops[J].Phytochemistry Letters, 2012, 5(3): 514-518. DOI:10.1016/j.phytol.2012.05.003.
[60] DAS A J, KHAWAS P, MIYAJI T, et al. Phytochemical constituents,attenuated total reflectance Fourier transform infrared analysis and antimicrobial activity of four plant leaves used for preparing rice beer in Assam, India[J]. International Journal of Food Properties, 2016,19(9): 2087-2101. DOI:10.1080/10942912.2015.1104695.
Monoterpene Compounds in Hops and Beer: A Review
HONG Kai, MA Changwei*
(Beijing Key Laboratory of Plant Protein and Cereal Processing, College of Food Science and Nutritional Engineering,China Agricultural University, Beijing 100083, China)
Abstract: Monoterpene compounds are important components in hops and beer, responsible for the typical hop aroma attributes in beer. In nature, these compounds exist in both free and glycosidically bound forms. This review focuses on recent progress in understanding the monoterpene biosynthesis pathways, the key enzymes and genes involved in monoterpene synthesis in hops and the important enzymes responsible for the conversion of monoterpene alcohols during beer fermentation. Meanwhile, the change of monoterpenoids in hops and beer and the factors affecting it, as well as the structures and contents of glycoside-bound monoterpenoids and analytical methods for the analysis of these compounds are also reviewed in this paper. Finally, future research directions are discussed.
Keywords: hops; beer; aroma compounds; monoterpenes; biosynthesis pathway
收稿日期:2018-03-06
基金项目:西藏自治区科技重大专项(ZD20170014)
第一作者简介:洪凯(1992—)(ORCID: 0000-0001-5724-4119),男,博士研究生,研究方向为啤酒酿造科学与技术。E-mail: hongkai@cau.edu.cn
*通信作者简介:马长伟(1965—)(ORCID: 0000-0003-3114-1781),男,教授,博士,研究方向为啤酒酿造科学与技术。E-mail: chwma@cau.edu.cn
DOI:10.7506/spkx1002-6630-20180306-074
中图分类号:TS262.5
文献标志码:A
文章编号:1002-6630(2019)07-0328-07
引文格式:洪凯, 马长伟. 酒花与啤酒中单萜化合物的研究进展[J]. 食品科学, 2019, 40(7): 328-334. DOI:10.7506/spkx1002-6630-20180306-074. http://www.spkx.net.cn
HONG Kai, MA Changwei. Monoterpene compounds in hops and beer: a review[J]. Food Science, 2019, 40(7): 328-334.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180306-074. http://www.spkx.net.cn