 ±s表示。
±s表示。脂肪氧合酶(lipoxygenase,LOX)属于氧化还原酶[1],是一种含非血红素铁的双加氧酶。LOX专一性作用于多不饱和脂肪酸的顺,顺-1,4-戊二烯基位置,通过分子内加氧,生成具有共轭双键的氢过氧化物[2]。LOX在生物体内的主要作用底物是亚麻酸、亚油酸和花生四烯酸,依据其加氧位置的特异性,将LOX分为5-LOX、8-LOX、9-LOX、10-LOX、11-LOX、12-LOX、13-LOX、15-LOX,其中15-LOX广泛存在于动植物、细菌和真菌中[3-5]。15-LOX对脂肪酸的作用底物除了亚油酸、亚麻酸和花生四烯酸,还可以是磷脂、胆固醇脂,甘油三脂等含有不饱和脂肪酸以及更复杂的脂质蛋白质分子。猪的白血球型12-LOX与人的网织红细胞15-LOX相近,既能催化C-12氧化,也可催化C-15氧化,15-LOX的最适底物为亚油酸并且催化C-13氧化[6-7]。
Andre等[8]于1932年首次发现酶促氧化反应是大豆制品的豆腥味的主要来源,其中的关键酶即LOX。Fu Xiangjin等[9-10]研究证实白鲢鱼在贮藏和加工过程中出现的腥味增强主要是由白鲢鱼体内的LOX催化降解不饱和脂肪酸产生的各种醛类物质引起的。此后,人们对LOX在食品加工贮藏过程中对风味的影响进行了广泛研究。研究表明,LOX氧化多不饱和脂肪酸生成的氢过氧化物极不稳定,进一步反应生成多种挥发性化合物,这些物质一方面形成食品的主要风味物质,例如新鲜水果蔬菜的风味物质醛类即由LOX氧化多不饱和脂肪酸途径生成[11-12],干腌肉制品的主要风味物质己醛也是脂质氧化降解生成[13-14];另一方面,食品中脂质的过度氧化产生刺激性气味物质,不仅导致食品风味劣变,还造成食物多不饱和脂肪酸含量下降,导致食物营养品质的下降并增加食品储藏的困难[15-20]。脂类物质的氧化分为自动氧化和酶促氧化[21],LOX是酶促氧化最主要的内源酶。Gata等[22]通过硫酸铵沉淀、DEAE阴离子交换和疏水层析等纯化步骤从猪股二头肌中分离得到一种LOX,对其性质的研究表明LOX可能参与伊比利亚火腿的风味形成。Jin Guofeng等[23]研究表明LOX在干腌培根加工过程中的脂肪氧化起重要作用,温度、酸度和盐含量是影响LOX活力的主要因素。研究LOX在肉品脂质氧化过程中的作用及其影响因素,对调控肉品风味品质具有重要的理论和实践意义。
尽管人们早已认识到LOX在肉品加工中的潜在应用价值,但从猪肉中直接获得不仅得率低而且纯化难,获得LOX纯酶的成本很高;通过LOX基因的克隆与表达,经简单的纯化过程,获得高纯度的LOX,能有效解决上述问题[23]。至今为止,还未曾有体外重组表达猪肉LOX的报道。为更好地研究猪肉加工和贮藏过程中风味物质的产生机理和途径,研发新型工艺,既保留风味物质又能保持猪肉加工过程中的品质和营养价值。猪肉12-LOX的编码基因序列已在GenBank公布(GenBank登录号M31417.1)。猪肉12-LOX包括两个结构域:N端的β桶结构域属于C2家族蛋白,主要负责12-LOX与膜的结合;C端的催化结构域。本研究以猪肉为原料,从中获取12-脂肪氧合酶催化结构域(12-lipoxygenase catalytic domain,12-LOXcd)的编码基因,对该酶进行提取纯化,并对其酶学性质进行研究,与大豆LOX的酶学性质进行比较,因为大豆中LOX含量与活力较高且研究较多,为猪肉制品的加工和贮藏加工提供技术和数据支持[24]。
大肠杆菌DH5α 南京擎科生物工程有限公司;大肠杆菌表达载体pMBP 本实验室保藏;TransStart®FastPfu DNA Polymerase试剂盒、大肠杆菌TranSetta2 北京全式金生物技术有限公司;酵母提取物、胰蛋白胨 美国Oxoid公司;琼脂粉 南京奥多福尼生物科技有限公司;质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒 天根生化科技(北京)有限公司;异丙基β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)、氨苄青霉素、卡那霉素 上海生工生物股份有限公司;亚油酸、大豆脂氧酶(15 MU)美国Sigma公司;pMD19-T 载体、反转录试剂盒、限制性内切酶、T4 DNA连接酶 宝生物工程(大连)有限公司;TEV蛋白酶 本实验室制备;其他试剂为国产分析纯。
LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g。加水溶解后,加水定容到1 000 mL。配制固体培养基时,每100 mL加入琼脂粉1.5 g。
UV-6100型分光光度计 上海美普达仪器有限公司;TP600梯度升降温功能聚合酶链式反应(polymerase chain reaction,PCR)仪 上海天呈医流科技股份有限公司;M124A分析天平 意大利BEL公司;ZEALWAY(致微)G154DWS灭菌器 厦门仪器有限公司;Mini-PROTEANTetra Cell电泳仪 美国Bio-Rad公司;DYCP-31DN琼脂糖水平电泳仪电泳槽、DYCP-31DN琼脂糖水平电泳仪电泳槽 北京六一仪器厂;AKTA蛋白纯化系统 美国GE Healthcare公司;BioTekSynergy2多功能酶标仪 美国BioTek公司;Scientz-IID超声波细胞粉碎机 宁波新芝生物科技有限公司;Tanon-1600全自动凝胶成像分析仪 上海天能仪器有限公司;VD-650超净工作台 苏州江东精密仪器有限公司;ZQTY-90S台式全温振荡培养箱 上海知楚仪器有限公司。
1.3.1 引物设计与合成
由NCBI公布的猪肉基因组12-LOX基因预测序列,筛选到该基因的CDS序列,运用Primer 5.0设计基因的特异性引物。上游引物(F):5’-TTCCATATGGGCACTGCCCGCACA-3’(下划线是NdeI酶切位点);下游引物(R):5’-CGCTCGAGGATGGCCACACTGTTT-3’(下划线是XhoI酶切位点)。引物由南京擎科生物科技有限公司合成。
1.3.2 总RNA提取及cDNA合成
猪肉总RNA的提取根据TaKaRa公司的TRIzol说明书进行操作。取猪腿肉100 mg,提取总RNA,总RNA经电泳检测,Eppendorf公司核酸定量分析仪测定OD260 nm/OD280 nm比值及浓度,以1 μg总RNA为模板,按照cDNA合成试剂盒说明书进行反转录。反转录程序:37 ℃、15 min,85 ℃、5 s,4 ℃保存,若要长期保存则应放于-20 ℃。
1.3.3 目的基因的获得
以cDNA为模板进行PCR扩增,反应体系为50 μL,其中模板1 μL,上、下游引物各1 μL,5×TransStart®FastPfu Buffer 10 μL,TransStart® FastPfu DNA Polymerase 1 μL,5×激活剂5 μL,2.5 mmol/L dNTPs 4 μL,ddH2O 27 μL。扩增程序:95 ℃预变性2 min;95 ℃、20 s;60 ℃、20 s;72 ℃、90 s,进行35 个循环;72 ℃延伸30 s。PCR产物用1%的琼脂糖凝胶电泳检测。PCR产物进行纯化回收,连接至pMD19-T载体,转化至DH5α感受态细胞,取少量菌液涂在含氨苄青霉素的固体培养基上,37 ℃培养过夜,然后挑取阳性单菌落进行培养,经菌落PCR和酶切鉴定,将连接正确的重组基因质粒送至南京生物工程股份有限公司测序。
1.3.4 重组表达载体的构建
凝胶回收的PCR产物以及原核表达载体pMBP分别用NdeI和XhoI在37 ℃条件下双酶切2 h,再分别进行切胶纯化回收后,用T4连接酶连接(22 ℃,2 h),将重组质粒全部转化至大肠杆菌DH5α感受态细胞。涂布于含有卡娜青霉素的LB平板,倒置,37 ℃培养过夜。挑取单菌落进行菌液PCR鉴定是否构建成功,筛选出阳性重组质粒并送至南京生物工程股份有限公司测序。
1.3.5 融合蛋白的原核表达及可溶性分析
经过鉴定正确的重组质粒转化到大肠杆菌TranSetta2感受态细胞,过夜培养后挑取单菌落接种至5 mL含100 μg/mL卡那青霉素的LB培养基中,37 ℃、200 r/min摇床振荡培养,当菌液浓度OD600 nm值为0.6~0.8时,加入IPTG至终浓度为0.25 mmol/L,22 ℃、200 r/min诱导过夜。离心收集沉淀,1∶5的比例加入缓冲液(20 mmol/L磷酸盐,pH 7.6,120 mmol/L NaCl)重悬菌体,于超声波细胞破碎仪上破碎10 min(80 W,φ 2,开1 s,停3 s),取出40 μL作为总菌后12 000 r/min、4 ℃离心5 min,分别取出上清液、沉淀40 μL,加入10 μL十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfatepolyacrylamide gel electrophoresis,SDS-PAGE)上样缓冲液,95 ℃加热10 min,12 000 r/min离心5 min。用12% SDS-PAGE检测融合蛋白是否为可溶性蛋白,设置不加IPTG诱导的菌液作为对照。
1.3.6 重组融合蛋白的诱导表达及纯化
将上述鉴定能可溶性表达12-LOXcd的菌落接种于1 L含卡那青霉素的LB液体培养基中进行诱导表达,同时接种1 L含氨苄青霉素的LB液体培养基(Tev-nohis)。分别离心(4 000 r/min,20 min)收集菌体,用Binding Buffer(20 mmol/L磷酸盐,pH 7.6,150 mmol/L NaCl,5 mmol/L咪唑,10%甘油)重悬菌体,冰浴条件下超声破碎30 min(功率150 W,超声1 s,间停3 s),再离心(12 000 r/min,20 min,4 ℃)收集上清液,弃菌体沉淀,将两个菌液的上清液混匀后放4 ℃酶切24 h,切除麦芽糖结合蛋白(maltose binding protein,MBP)。24 h后,上清液12 000 r/min、4 ℃离心20 min,留上清液。镍柱平衡后将上清液加入镍亲和层析柱中,分别用不同浓度的咪唑洗脱液洗脱并收集,初步纯化目的蛋白,取收集的样液加入SDS-PAGE上样缓冲液,加热(95 ℃,10 min),用12% SDS-PAGE检测重组蛋白的表达情况。将较纯的样品用10 kDa的超滤管离心浓缩(4 ℃,3 500×g,10 min/次)。最后用Superdex G200进一步纯化,然后再次用SDS-PAGE检测纯化的产物并离心浓缩。用蛋白定量试剂盒测定蛋白浓度,分装后置于-80 ℃保存。
1.3.7 猪肉12-LOXcd、大豆LOX活力测定及酶学性质比较
1.3.7.1 底物溶液配制
0.5 mmoL亚油酸溶于5 mL含180 μL Tween 20的脱氧重蒸水中,充分混匀;滴加1 mol/L NaOH溶液充分混匀使体系成为清澈透明的液体,再用1 mol/L HCl溶液调pH值至9.0,最后用脱氧重蒸水定容至50 mL。将配制好的亚油酸储备液分装保存在EP管中,并于-20 ℃下贮存[25]。
1.3.7.2 酶活力测定
猪肉12-LOXcd活力测定在Kermasha等[26]的方法基础上进行改进。取200 μL亚油酸底物储备液与2.9 mL、50 mmol/L的柠檬酸缓冲液(pH 5.5)充分混合,待其在234 nm波长处的吸光度稳定后,加入100 μL酶液(稀释10 倍),迅速混合,于234 nm波长处测定其1.0 min内吸光度的增加量。以200 μL亚油酸底物储备液与2.9 mL柠檬酸缓冲液混合为空白。
LOX活力定义[27]:在一定的温度和pH值条件下,反应体系在234 nm波长处每分钟吸光度增加0.001表示为1 个酶活力单位(U)。
1.3.7.3 最适pH值及其pH值稳定性
按1.3.7.2节所述,在37 ℃下利用pH 4.0~10.0系列缓冲溶液分别替代反应体系中的50 mmol/L、pH 5.5柠檬酸缓冲溶液测定酶活力,以酶活力最高值为100%,计算不同pH值下的相对活力,分析不同pH值对酶活力的影响情况。pH值为4.0、5.0、6.0缓冲液用50 mmol/L的柠檬酸和柠檬酸三钠配制;pH 7.0、8.0缓冲液用50 mmol/L的磷酸氢二钠和磷酸二氢钠配制;pH 9.0、10.0缓冲液用50 mmol/L甘氨酸和NaOH配制。
进一步考察酶pH值稳定性。将酶液分别置于上述不同的pH值缓冲液中,于37 ℃下孵育1 h,取出测定酶活力,以酶活力初始值为100%,计算不同pH值下的残留活力。
1.3.7.4 最适温度及热稳定性
按1.3.7.2节所述,分别在10、20、30、40、50、60、70 ℃测定猪肉12-LOXcd和大豆LOX活力,以酶活力最高值为100%,计算不同温度下的相对活力。
进一步考察猪肉12-LOXcd、大豆LOX在不同温度下的稳定性。将酶液分别置于10、20、30、40、50、60 ℃下保存30 min,取出测定酶活力,以酶活力最高值为100%,计算不同温度下酶的残留活力。
1.3.7.5 NaCl添加量对酶活力的影响
用最适pH值下的缓冲液分别配制0%、1%、3%、5%、7%、9%的NaCl溶液。然后在室温条件下按1.3.7.2节方法所述进行酶活力测定。
1.3.8 猪肉12-LOXcd的底物特异性
分别以不同浓度的亚油酸、亚麻酸、花生四烯酸为底物,采用双倒数作图法求得不同底物的Km,比较猪肉12-LOXcd对不同底物的亲和力。
采用凝胶成像仪对电泳图进行分析。每组实验做3个平行,酶活力图采用Origin 8.0进行数据分析,测定结果以 ±s表示。
±s表示。
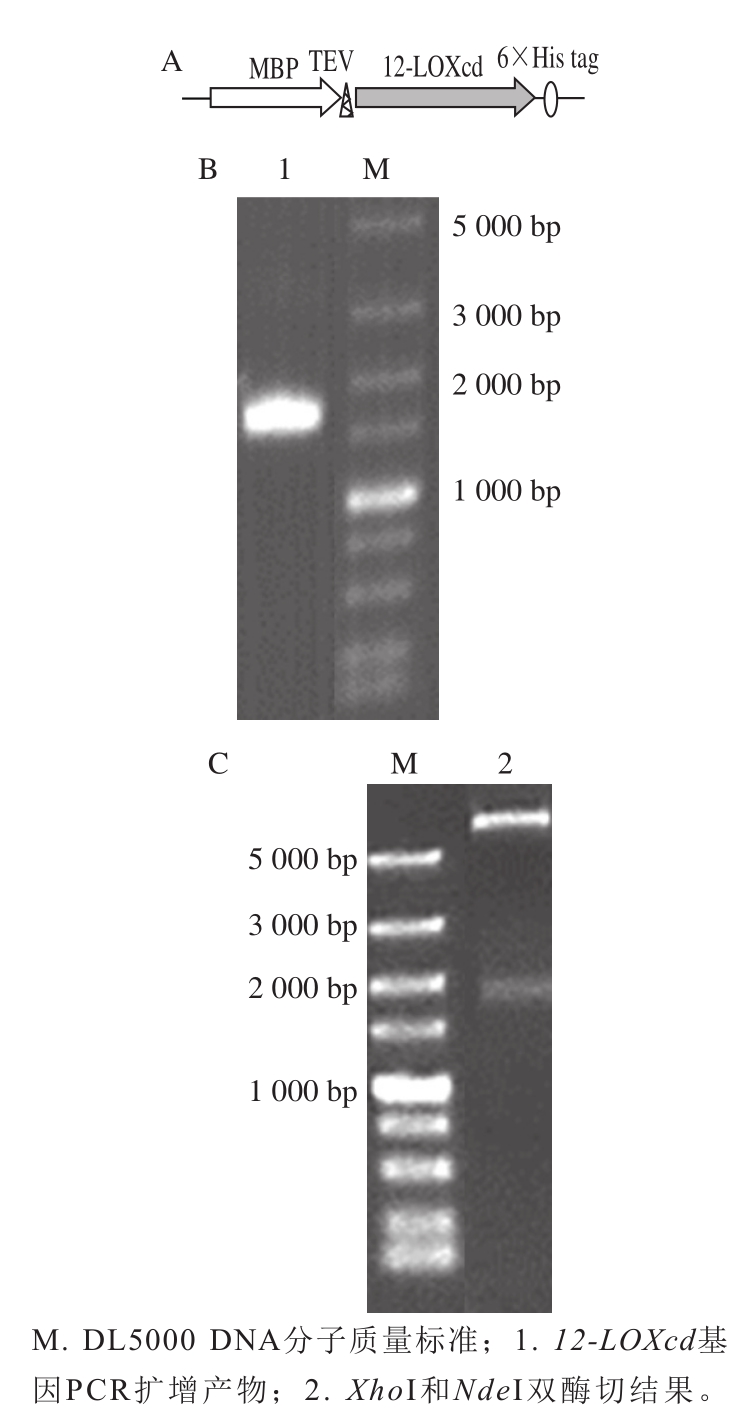
图 1 pMBP-12-LOXcd融 合蛋白示意图(A)、12-LOXcd基因扩增结果(B)及重组质粒的酶切鉴定(C)
Fig. 1 Schematic demonstration of pMBP-12-LOXcd fusion protein (A),PCR-amplified 12-LOXcd (B) and identification of recombinant plasmid pMBP-12-LOXcd by enzymatic digestion (C)
初期研究发现12-LOXcd蛋白在大肠杆菌中表达以包涵体形式存在,包涵体形式表达蛋白质的氨基酸不能形成正确的空间结构,影响蛋白的活性,如果对包涵体蛋白进行变性复性等操作,使蛋白活性丢失,影响后续研究和应用。经过多次实验发现,使用MBP作为分子伴侣蛋白与12-LOXcd融合表达可以有效解决蛋白以包涵体形式在大肠杆菌中表达的问题[28],因此本研究将MBP的编码基因malE通过基因重组技术构建入普通表达载体中,并同时引入了TEV酶切位点(图1A),便于后续切除融合蛋白N端的MBP。
以获得的cDNA为模板,扩增得到的PCR产物经琼脂糖凝胶电泳后可见1 656 bp处的片段(图1B),条带大小符合预期。预测12-LOXcd编码553 个氨基酸,分子质量为62 kDa。
将构建成功的重组质粒用NdeI和XhoI双酶切鉴定(图1C),得到约5 400 bp的大片段和约1 700 bp的小片段,分别与pMBP和12-LOXcd基因大小相符。进一步测序结果均准确无误,表明目的基因已成功克隆至表达载体pMBP中,重组表达质粒构建成功,命名为pMBP-12-LOXcd。

如图2所示,第1泳道即未加IPTG诱导剂的重组菌在预期大小的条带处没有明显的表达条带出现;第4泳道明显看出该系统能大量可溶性表达融合pMBP-12-LOXcd蛋白,大小约100 kDa(12-LOXcd 62 kDa和MBP 40 kDa),与预期大小一致。
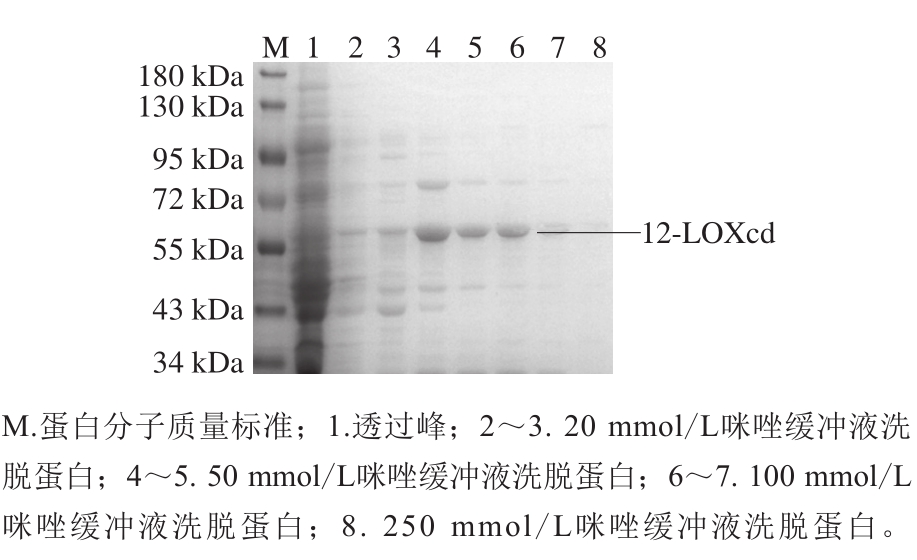
2.3.1 猪肉12-LOXcd重组蛋白的初步纯化
融合pMBP-12-LOXcd蛋白在纯化前进行TEV蛋白酶切,SDS-PAGE显示成功将MBP标签切除,得到C端带有His标签的12-LOXcd蛋白(~62 kDa),采用Ni-NTAAgarose亲和层析纯化。收集不同咪唑浓度缓冲液洗脱得到的组分,进行SDS-PAGE检测。图3结果显示,通过20 mmol/L和50 mmol/L咪唑洗脱可去除较多杂蛋白,100 mmol/L和250 mmol/L的咪唑洗脱可得到较纯的12-LOXcd重组蛋白,说明可以用此方法纯化目的蛋白。将100 mmol/L和250 mmol/L咪唑洗脱收集得到的蛋白用截留分子质量为10 kDa的超滤管进行浓缩,为下一步凝胶过滤层析做准备。
2.3.2 12-LOXcd重组蛋白的凝胶过滤层析

图 4 12-LOXcd凝胶过滤层析色谱图及SDS-PAGE图谱
Fig. 4 Gel filtration chromatography and SDS-PAGE analysis of recombinant 12-LOXcd protein
如图4所示,浓缩后的蛋白经过Superdex G200层析柱纯化后得到3 个洗脱峰,分别收集不同的洗脱峰并用12% SDS-PAGE检测。结果显示,经凝胶过滤层析后的蛋白条带单一,杂带消失。图中2号洗脱峰为目的蛋白12-LOXcd,将该洗脱峰收集的蛋白用10 kDa的超滤管浓缩后,用蛋白定量试剂盒测定蛋白浓度,分装后放-80 ℃保存待用。
2.4.1 pH值对酶活力影响及其稳定性
在室温条件下,测定LOX在不同pH值条件下的活力,结果如图5所示。在pH 4.0~6.0猪肉12-LOXcd活力逐渐增加,在pH 6.0时,酶活力达到最大,之后随着pH值的升高而降低,当pH值达到10.0时,大豆LOX活力基本为0;大豆LOX与猪肉12-LOXcd有相同的变化趋势,其最适pH值为8.0。猪肉12-LOXcd在酸性条件下酶活力较高,这与陈欣[29]、Gate[22]、何立超[25]等研究结果一致。酶的活性中心结构在不同pH值条件下会发生变化,因此随着pH值的改变,酶与底物的结合方式和生成中间产物会发生变化,从而影响酶反应速率[30]。本实验中,当pH值小于6.0时,随着缓冲液pH值的升高,12-LOXcd的活性状态可能在逐渐地向有利于催化反应发生的方向发生改变,因此随着pH值的逐渐升高,12-LOXcd活力呈逐渐增大趋势。
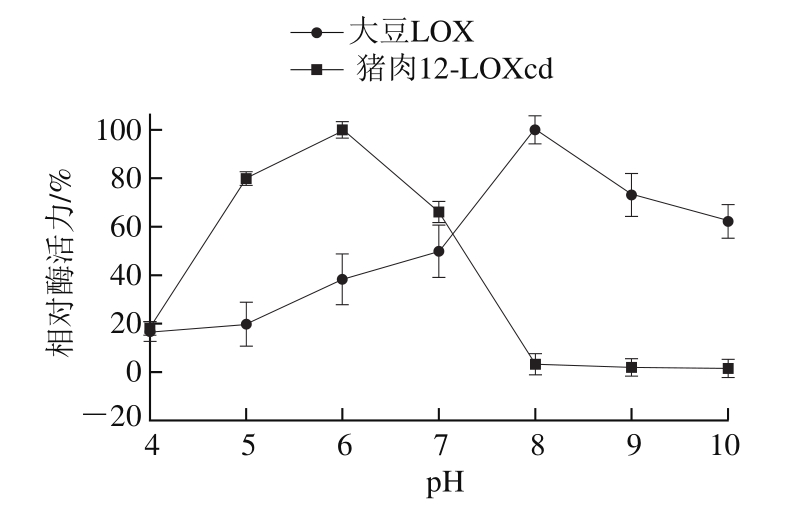
图 5 pH值对大豆LOX和猪肉12-LOXcd活力的影响
Fig. 5 Effect of pH value on the activity of soybean LOX and pig muscle 12-LOXcd
进一步考察酶pH值稳定性,测定两种酶在不同pH值(4.0~10.0)缓冲液体系下孵育1 h后的剩余酶活力。由图6可知,猪肉12-LOXcd在中性和酸性条件下稳定性较差,随着pH值的升高,猪肉12-LOXcd的稳定性明显提高,而大豆LOX在碱性环境下稳定性较差。在pH 10条件下处理1 h,猪肉12-LOXcd的残留活力高达初始酶活力的80%,而此时大豆LOX的残留活力仅为初始酶活力的40%。
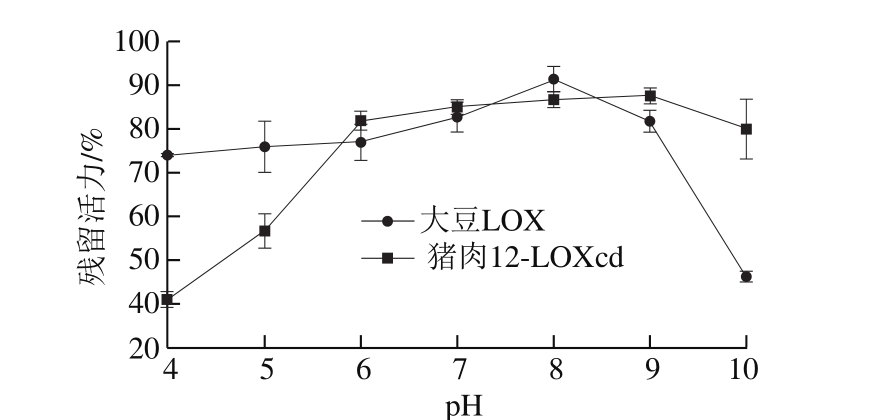
图 6 大豆LOX和猪肉12-LOXcd的pH值稳定性
Fig. 6 pH stability of soybean LOX and pig muscle 12-LOXcd
2.4.2 温度对酶活力及稳定性的影响
由图7可以看出,猪肉12-LOXcd和大豆LOX活力均呈先上升后下降的趋势,其最适反应温度分别为30 ℃和20 ℃。何立超等[31]研究发现樱桃谷鸭胸肉LOX纯酶的最适温度为30 ℃,与本研究具有一致性;而王邦国等[32]研究发现白鲢鱼肌肉LOX最适作用温度为40 ℃,这与本研究结果存在一定差异,可能与不同种类的动物有关。温度升高能够增加反应的活化分子数,从而加快反应速率,促进酶促反应。但温度过高导致蛋白质变形,又会使酶活力下降。在本实验中当温度上升到约45 ℃时,猪肉12-LOXcd活力下降至最适温度条件下的50%以下,说明猪肉12-LOXcd蛋白质在此温度条件下可能已经发生变性,而在温度达到60 ℃时,酶活力基本为零。

图 7 温度对猪肉12-LOXcd和大豆LOX活力的影响
Fig. 7 Effect of temperature on the activity of soybean LOX and pig muscle 12-LOXcd
进一步观察两种LOX的热稳定性,分别在10~70 ℃条件下孵育酶液30 min,取出并立即在冰水浴中冷却后,测定残余脂氧合酶活力,由图8可知,随着温度的升高,猪肉12-LOXcd与大豆LOX残留活力均不断下降,但猪肉12-LOXcd残留活力的变化比较平缓,在40 ℃时仍保留70%以上活力;而大豆LOX的残留酶活力急剧下降。陈欣等[29]的研究结果显示,大豆LOX与麻鸭LOX的残留活力均随温度的升高而降低,当温度低于50 ℃时,两者的变化不明显,但当温度高于50 ℃时,大豆LOX残留酶活急剧下降,而麻鸭LOX残留酶活力的变化则较为平缓。因此LOX在肉制品的加工应用中能够保持一定的活力。

图 8 猪肉12-LOXcd和大豆LOX的热稳定性
Fig. 8 Thermal stability of soybean LOX and pig muscle 12-LOXcd
2.4.3 NaCl添加量对酶活力的影响
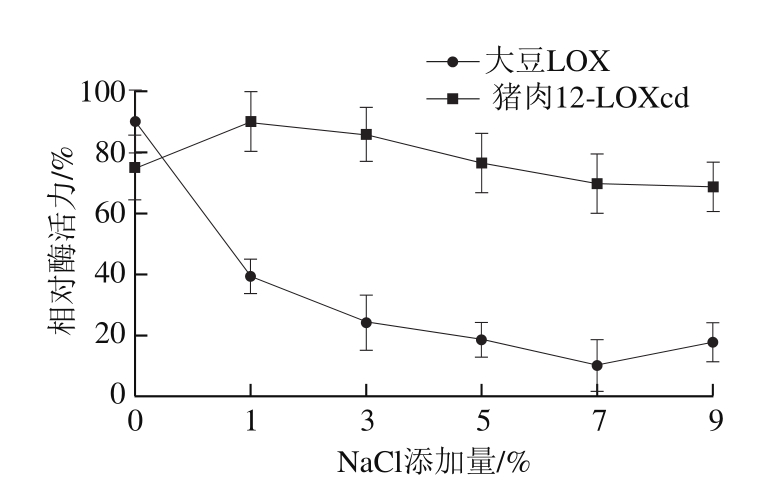
图 9 NaCl添加量对猪肉12-LOXcd、大豆LOX活力的影响
Fig. 9 Effect of NaCl concentration on the activity of soybean LOX and pig muscle 12-LOXcd
由图9可以看出,猪肉12-LOXcd活力在NaCl质量分数为1%时达到最高。继续增加盐分含量,酶活力略微下降,但仍能够保持较高的活力。这与Jin Guofeng等[23]的研究结果具有一定的一致性,即在一定范围内增加培根中盐分含量能够促进肌肉中脂肪的氧化,但当盐分含量达到一定值后,若继续增大盐分含量又会抑制脂质氧化。总体而言,猪肉12-LOXcd在较高NaCl质量分数下较稳定,而大豆LOX活力则随着NaCl质量分数的增加而持续降低。
以亚油酸、亚麻酸和花生四烯酸作为反应的底物,根据双倒数作图法求得各个底物的Km,检测猪肉12-LOXcd对不同底物的亲和性。求得亚油酸的Km为0.40 mmol/L,亚麻酸Km为0.55 mmol/L,花生四烯酸Km为4.15 mmol/L。Km越小,底物亲和力越大,因此猪肉12-LOXcd对亚油酸的亲和性最高,这与Gata等[22]研究结果具有一致性。
LOX对肉品加工贮藏过程中的风味品质起重要调节作用,目前国内外研究相对较少,仅有Jin Guofeng等[23]、郇延军[13]研究了干腌肉制品加工过程中LOX活力变化,表征了粗酶的变化及其活性;此外,Gata等[22]通过复杂的纯化步骤从猪股二头肌中分离得到一种LOX,初步研究显示其可能参与伊比利亚火腿的风味形成。本研究运用基因重组技术将猪肉12-LOXcd基因克隆到表达载体pMBP,并导入到大肠杆菌中进行诱导表达,成功构建pMBP-12-LOXcd的大肠杆菌表达体系;通过Ni-NTA亲和层析和凝胶过滤层析,最终获得了高纯度的12-LOXcd,并对其酶学性质进行了研究。结果表明,在以亚油酸为底物时,猪肉12-LOXcd受温度、pH值和NaCl质量分数的调节,其最适反应温度为30 ℃,最适pH值为6.0,在NaCl质量分数1%时活性最高,并且在较高NaCl质量分数下仍保持较高活性。因此,通过调节肉品加工过程的加工条件可以调控LOX活性及脂质酶促氧化的进程。
[1] 闫静芳, 王红霞, 郭玉鑫, 等. 脂肪氧合酶的研究及应用进展[J]. 食品安全质量检测学报, 2013(3): 799-805.
[2] ALBERTI J C, MARIANI M, GAMBOTTI C, et al. A functional role identified for conserved charged residues at the active site entrance of lipoxygenase with double specificity[J]. Journal of Molecular Catalysis B Enzymatic, 2016, 123: 167-173. DOI:10.1016/j.molcatb.2015.10.011.
[3] LIAVONCHANKA A, FEUSSNER I. Lipoxygenases: occurrence,functions and catalysis[J]. Journal of Plant Physiology, 2006, 163(3):348-357. DOI:10.1016/j.jplph.2005.11.006.
[4] 曲清莉, 傅茂润, 代红飞. 脂氧合酶(LOX)在脂肪酸氧化中的作用研究进展[J]. 食品研究与开发, 2015(10): 137-142. DOI:10.3969/j.issn.1005-6521.2015.10.037.
[5] 刘松, 陆信曜, 周景文, 等. 脂肪氧合酶结构、分子改造与发酵研究进展[J]. 生物技术通报, 2015, 31(12): 34-41. DOI:10.13560/j.cnki.biotech.bull.1985.2015.12.005.
[6] RANKIN S M, PARTHASARATHY S, STEINBERG D. Evidence for a dominant role of lipoxygenase(s) in the oxidation of LDL by mouse peritoneal macrophages[J]. Journal of Lipid Research, 1991, 32(3): 449.
[7] TAYEB A H, SADEGHIFAR H, HUBBE M A, et al. Lipoxygenasemediated peroxidation of model plant extractives[J]. Industrial Crops &Products, 2017, 104: 253-262. DOI:10.1016/j.indcrop.2017.04.041.
[8] ANDRE E, HOU K W. The presence of a lipid oxidase in soybean[J].Comptes Rendues de l'Academie Des Sciences Paris, 1932, 194: 645-647.
[9] FU X J, XU S Y, WANG Z. Kinetics of lipid oxidation and offodor formation in silver carp mince: the effect of lipoxygenase and hemoglobin[J]. Food Research International, 2009, 42(1): 85-90.DOI:10.1016/j.foodres.2008.09.004.
[10] FU X J, LIN Q L, XU S Y, et al. Effect of drying methods and antioxidants on the flavor and lipid oxidation of silver carp slices[J].LWT-Food Science and Technology, 2015, 61(1): 251-257.DOI:10.1016/j.lwt.2014.10.035.
[11] 汪晓鸣, 陆兆新. 脂肪氧合酶在农产食品中应用的研究进展[J]. 核农学报,2013, 27(10): 1547-1552. DOI:10.11869/hnxb.2013.10.1547, PP. 1547-1552.
[12] CAI Q X, WU Y Y, LI L H, et al. Lipid oxidation and fatty acid composition in salt-dried yellow. Croaker (Pseudosciaena polyactis)during processing[J]. 中国海洋大学学报: 英文版, 2017, 16(5):855-862. DOI:10.1007/s11802-017-3233-8.
[13] 郇延军. 金华火腿加工过程中脂类物质及风味成分变化的研究[D].南京: 南京农业大学, 2005.
[14] ROLDAN M, ANTEQUERA T, ARMENTEROS M, et al. Effect of different temperature-time combinations on lipid and protein oxidation of sous-vide cooked lamb loins[J]. Food Chemistry, 2014, 149: 129-136. DOI:10.1016/j.foodchem.2013.10.079.
[15] 曹锦轩, 吕彤, 王颖, 等. 脂肪相关酶类在干腌肉制品风味形成过程中的作用[J]. 现代食品科技, 2015(1): 254-258. DOI:10.13982/j.mfst.1673-9078.2015.1.043.
[16] 吴宝森, 孙玥晖, 刘姝韵, 等. 肉和肉制品中脂质氧化的研究进展[J].食品安全质量检测学报, 2017, 8(3): 814-818. DOI:10.3969/j.issn.2095-0381.2017.03.015.
[17] NAVICHA W B, HUA Y, MASAMBA K, et al. Optimization of soybean roasting parameters in developing nutritious and lipoxygenase free soymilk[J]. Journal of Food Measurement & Characterization,2017, 11(4): 1899-1908. DOI:10.1007/s11694-017-9572-8.
[18] STEPHANY M, BADER-MITTERMAIER S, SCHWEIGGERTWEISZ U, et al. Lipoxygenase activity in different species of sweet lupin (Lupinus L.) seeds and flakes[J]. Food Chemistry, 2015, 174:400-406. DOI:10.1016/j.foodchem.2014.11.029.
[19] MANDAL S, DAHUJA A, SANTHA I M. Lipoxygenase activity in soybean is modulated by enzyme-substrate ratio[J]. Journal of Plant Biochemistry & Biotechnology, 2014, 23(2): 217-220. DOI:10.1007/s13562-013-0203-0.
[20] MASHIMA R, OKUYAMA T. The role of lipoxygenases in pathophysiology; new insights and future perspectives[J]. Redox Biology, 2015, 6: 297-310. DOI:10.1016/j.redox.2015.08.006.
[21] 张迎阳. 干腌肉制品中脂质自动氧化机理及调控机制研究[D].南京: 南京农业大学, 2014.
[22] GATA J L, AND M C P, MACÍAS P. Lipoxygenase activity in pig muscle:purification and partial characterization[J]. Journal of Agricultural & Food Chemistry, 1996, 44(9): 2573-2577. DOI:10.1021/jf960149n.
[23] JIN G F, ZHANG J H, YU X, et al. Crude lipoxygenase from pig muscle: partial characterization and interactions of temperature,NaCl and pH on its activity[J]. Meat Science, 2011, 87(3): 257-263.DOI:10.1016/j.meatsci.2010.09.012.
[24] 张充, 周孝伟, 吕凤霞, 等. 重组鱼腥藻脂肪氧合酶基因的克隆表达、分离纯化及活性分析[J]. 生物工程学报, 2012, 28(4): 440-456.
[25] 何立超, 马素敏, 李成梁, 等. 温度、盐分以及pH值对鸭肉脂肪氧合酶活性的交互影响[J]. 江苏农业学报, 2016, 32(6): 1404-1409.DOI:10.3969/j.issn.1000-4440.2016.06.032.
[26] KERMASHA S, METCHE M. Characterization of seed lipoxygenase of Phaseolus vulgaris cv. Haricot.[J]. Journal of Food Science, 1986,51(5): 1224-1227. DOI:10.1111/j.1365-2621.1986.tb13090.x.
[27] SZYMANOWSKA U, JAKUBCZYK A, BARANIAK B, et al.Characterisation of lipoxygenase from pea seeds (Pisum sativum var. Telephone L.)[J]. Food Chemistry, 2009, 116(4): 906-910.DOI:10.1016/j.foodchem.2009.03.045.
[28] BATAILLE L, 李亚茹. 以麦芽糖结合蛋白作水溶性标签的疏水类弹性蛋白多肽的表达与纯化[J]. 中国医药工业杂志, 2016(2): 245-245.
[29] 陈欣, 姚忠, 徐为民, 等. 麻鸭脂肪氧合酶的分离纯化及其性质研究[J].食品与发酵工业, 2013, 39(12): 39-43.
[30] SUDHARSHAN E, SRINIVASULU S, RAO A G A. pH-induced domain interaction and conformational transitions of lipoxygenase-1[J].Biochimica Et Biophysica Acta, 2000, 1480(1/2): 13. DOI:10.1016/S0167-4838(00)00099-6.
[31] 何立超, 赵见营, 田甜, 等. 樱桃谷鸭胸肉脂肪氧合酶的分离纯化及其酶学特性研究[J]. 食品科学, 2013, 34(7): 166-170. DOI:10.7506/spkx1002-6630-2013.07.035.
[32] 王帮国, 林琳, 余振宇, 等. 白鲢鱼肌肉脂肪氧合酶提取条件优化及酶学性质研究[J]. 食品工业科技, 2017, 38(9): 113-118. DOI:10.13386/j.issn1002-0306.2017.09.013.
Expression, Purification and Characterization of 12-Lipoxygenase Catalytic Domain from Pig Muscle