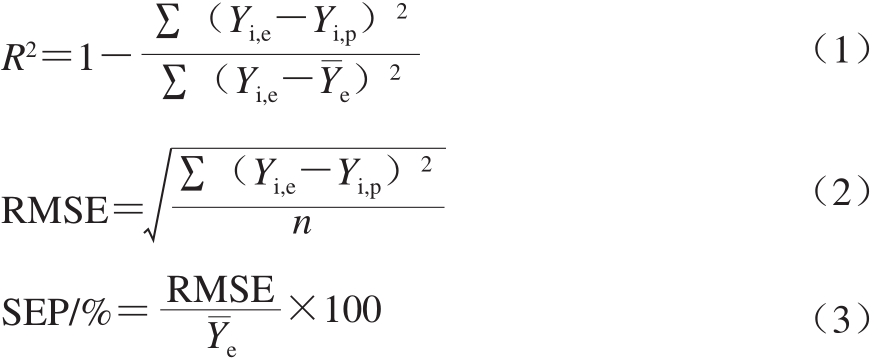
布拉酵母(Saccharomyces boulardii)属于酿酒酵母亚种[1],具有降解毒素、调节肠道菌群和增强消化道免疫等功能,已被临床用于治疗腹泻等疾病[2-4]。布拉酵母在动物养殖中也表现出良好效果,作为饲料添加剂在很多国家均通过了相关认证[6-8],在畜牧业中应用前景广阔。但布拉酵母高密度培养产量低、价格昂贵,市场上含有1.3×109 CFU的布拉酵母菌粉售价约为40~45 元,这也限制布拉酵母推广应用。因此优化布拉酵母高密度发酵培养基及发酵工艺,对促进布拉酵母的推广应用具有重要意义。
高密度培养核心在于为菌体提供合适的营养成分和生长条件。目前针对布拉酵母及酿酒酵母属的培养基优化主要采用单因素、正交设计和响应面优化法(response surface methodology,RSM)等方法[9-12]。但酵母菌在发酵过程中需要多种营养成分,各成分间的相互作用复杂,具有高度的非线性,传统优化方法在处理非线性问题时具有一定局限性。而人工神经网络(artificial neural network,ANN)能够反映复杂的非线性关系,表现出很强的非线性映射能力,适用于非线性问题的建模、估计和预测[13-18]。遗传算法(genetic algorithm,GA)具有全局寻优能力,可对模型进行全局性的训练和优化,获得最优方案[19-22]。本研究通过ANN与GA相结合,优化获得最优培养基。在此基础上,对影响布拉酵母菌生长的多种因素进行优化,建立适宜的高密度培养条件,为布拉酵母的推广应用奠定基础。
1.1.1 菌株
布拉酵母菌(Saccharomyces boulardii)为实验室保存菌种。
1.1.2 培养基
斜面培养基:葡萄糖20 g/L、酵母粉10 g/L、蛋白胨20 g/L、琼脂20 g/L、自然pH值。
种子培养基:葡萄糖20 g/L、酵母粉10 g/L、蛋白胨20 g/L、自然pH值。
初始发酵培养基:葡萄糖40 g/L、硝酸钾14 g/L、蛋白胨45 g/L、玉米浆15 g/L、酵母营养盐3 g/L、磷酸二氢钾0.6 g/L、硫酸镁0.8 g/L、自然pH值。
ZHWY-200B型全温摇床 上海智城分析仪器制造有限公司;CT14RD11台式离心机 上海天美生化仪器设备有限公司;FR124CN型分析天平 奥豪斯仪器有限公司;SGD-IV型还原糖测定仪 山东省科学院生物研究所;GS-F2001-MM 1 L四联体玻璃发酵罐、50 L发酵罐上海顾信生物科技有限公司。
1.3.1 菌株培养
摇瓶培养:经斜面培养基活化后,取一环转接至种子培养基中,30 ℃、220 r/min培养12 h后获得种子液。以8%接种量接种至发酵培养基中,自然pH值,30 ℃、220 r/min培养24 h。
发酵罐培养:初始装液量为60%,流加1 mol/L的氢氧化钠和盐酸溶液维持pH值,接种量、温度、pH值、溶氧水平等条件根据实验情况决定。
1.3.2 指标测定
菌体布拉酵母产量的测定:取一定量将发酵液于8 000 r/min离心5 min去上清液,用生理盐水洗涤菌体2 次,于105 ℃烘干至恒质量后称质量。
葡萄糖质量浓度利用全自动还原糖测定仪测定;氨氮质量浓度采用甲醛法测定[23]。1.3.3 发酵培养基的确定
1.3.3.1 显著因素筛选及中心组合设计(central composite design,CCD)试验
在前期实验基础上,筛选得到葡萄糖(A)、硝酸钾(B)、蛋白胨(C)、玉米浆(D)、酵母营养盐(E)、磷酸二氢钾(F)、硫酸镁(G)7 种培养基组分,借助Minitab16软件采用N为12的Plackett-Burman试验设计筛选显著因素[24-26]。CCD与Box-Behnken试验相比,对各因素的取值范围更广,为提高优化精确度,借助Design-Expert 8.0对显著因素进行CCD试验。
1.3.3.2 RSM模型的建立
借助Design-Expert 8.0.6软件,对相应数据进行RSM分析,并模拟出关于布拉酵母产量和培养基组分关系的回归方程模型。此外,使用方差(R2)、均方根误差(root mean squared error,RMSE)和预测标准误差(standard error of prediction,SEP)对该模型的拟合精度和预测精度进行评估[27-28],其计算见式(1)~(3):
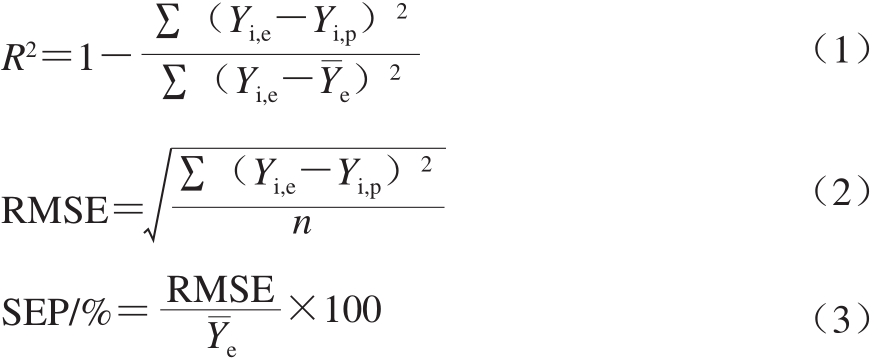
式中:Yi,e为实验值;Yi,p为模型预测值;n为实验组数; 为实验平均值。
为实验平均值。
1.3.3.3 ANN模型的建立
通过MATLAB 7.8软件将显著因素质量浓度作为ANN的输入值、菌体布拉酵母产量为输出值,运用反向传播方法建立3 层ANN模型。tansig函数和purelin函数分别作为隐含层传递函数和输出层传递函数,训练函数为trainlm函数,并对模型的拟合精度和预测精度进行评估。
1.3.3.4 GA寻优获得最优配方
将训练完毕的较优模型作为GA的拟合函数,通过MATLAB 7.8软件中GA工具箱搜寻输入及输出变量的最优解[28]。具体过程包括:采用二进制编码将各变量的参数集进行编码;确定群规模大小,选择杂交、变异方法和交叉、变异的概率等参数,随机产生初始种群;适应度评价;判断是否满足终止条件,如不满足则进行循环,直到满足条件;输出GA最优解。
1.3.4 发酵工艺优化和放大培养
以布拉酵母菌体产量为考察对象,利用1 L四联体发酵罐对温度、接种量、pH值、溶氧等发酵条件进行优化,绘制其生长曲线。在此基础上进行流加培养,控制发酵过程中的糖含量和氨氮含量,直至发酵结束。在前期高密度发酵培养基和发酵工艺优化的基础上,利用50 L发酵罐放大培养,并对发酵过程中菌体布拉酵母产量、葡萄糖和氨氮含量变化进行监控。
每组实验均进行3 次平行测定,用借助Minitab 16和Design-Expert 8.0对数据进行统计分析。P<0.05,表明具有显著性。
2.1.1 Plackett-Burman试验结果
对发酵基础培养基中的7 种成分葡萄糖、硝酸钾、蛋白胨、玉米浆、酵母营养盐、磷酸二氢钾、硫酸镁质量浓度进行显著因素筛选,结果见表1,各因素分析见表2。
表 1 Plackett-Burman试验设计与结果
Table 1 Plackett-Burman design with experimental results g/L
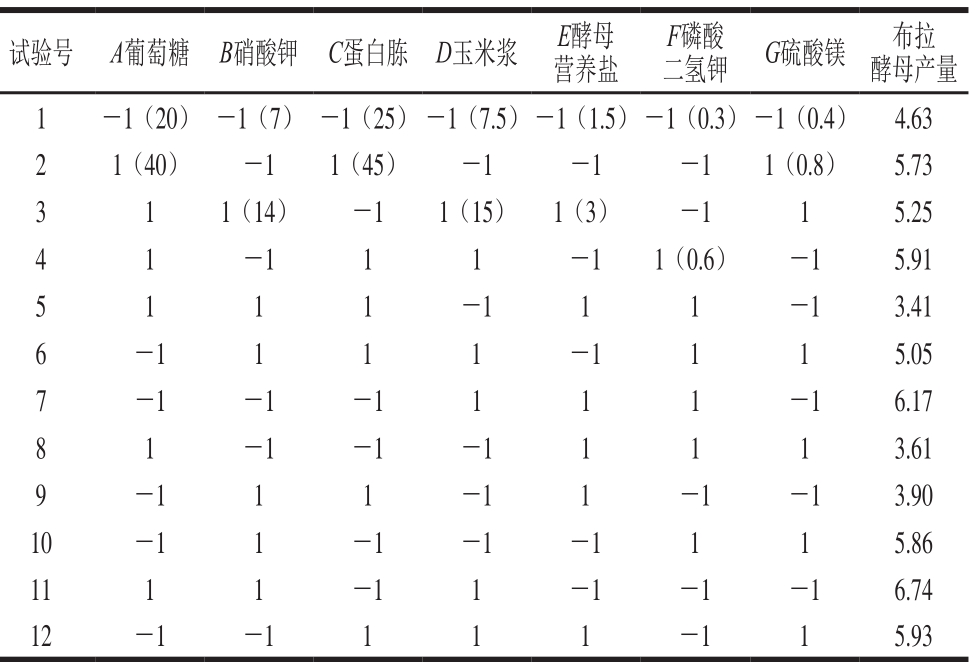
试验号 A葡萄糖 B硝酸钾 C蛋白胨 D玉米浆 E酵母营养盐F磷酸二氢钾 G硫酸镁 布拉酵母产量1 -1(20) -1(7) -1(25) -1(7.5)-1(1.5)-1(0.3) -1(0.4) 4.63 2 1(40) -1 1(45) -1 -1 -1 1(0.8) 5.73 3 1 1(14) -1 1(15) 1(3) -1 1 5.25 4 1 -1 1 1 -1 1(0.6) -1 5.91 5 1 1 1 -1 1 1 -1 3.41 6 -1 1 1 1 -1 1 1 5.05 7 -1 -1 -1 1 1 1 -1 6.17 8 1 -1 -1 -1 1 1 1 3.61 9 -1 1 1 -1 1 -1 -1 3.90 10 -1 1 -1 -1 -1 1 1 5.86 11 1 1 -1 1 -1 -1 -1 6.74 12 -1 -1 1 1 1 -1 1 5.93
表 2 各因素影响的主效应分析
Table 2 Analysis of main effects of medium components

注:R2=97.2%,R2Adj=92.3%。
因素 效应值 T值 P值A葡萄糖 0.727 8.43 0.001 B硝酸钾 0.218 2.53 0.064 C蛋白胨 0.525 5.97 0.004 D玉米浆 0.411 4.76 0.009 E酵母营养盐 -0.130 -1.51 0.207 F磷酸二氢钾 0.007 0.09 0.933 G硫酸镁 0.102 1.18 0.302
由表2可知,培养基各组分对布拉酵母产量影响显著性次序为:葡萄糖>蛋白胨>玉米浆>硝酸钾>酵母营养盐>硫酸镁>磷酸二氢钾。P<0.05,在95%的置信区间内对发酵模型影响显著,其中葡萄糖、蛋白胨和玉米浆的P值小于0.05,其余因素的P值大于0.05。回归方程为:Y=5.182 2+0.727 8A+0.218 9B+0.515 5C+0.411 1D-0.130 0E+0.007 8F+0.102 3G。模型P值为0.006,R2=97.2%,表明拟合程度较好,因此确定葡萄糖、蛋白胨和玉米浆为显著因素并进行CCD试验。
2.1.2 RSM模型建立及分析
借助Design-Expert 8.0.6软件,对表3数据进行RSM分析,并获得模拟回归方程,结果见表4。
表 3 CCD试验设计与结果
Table 3 Central composite design with experimental and predicted results g/L
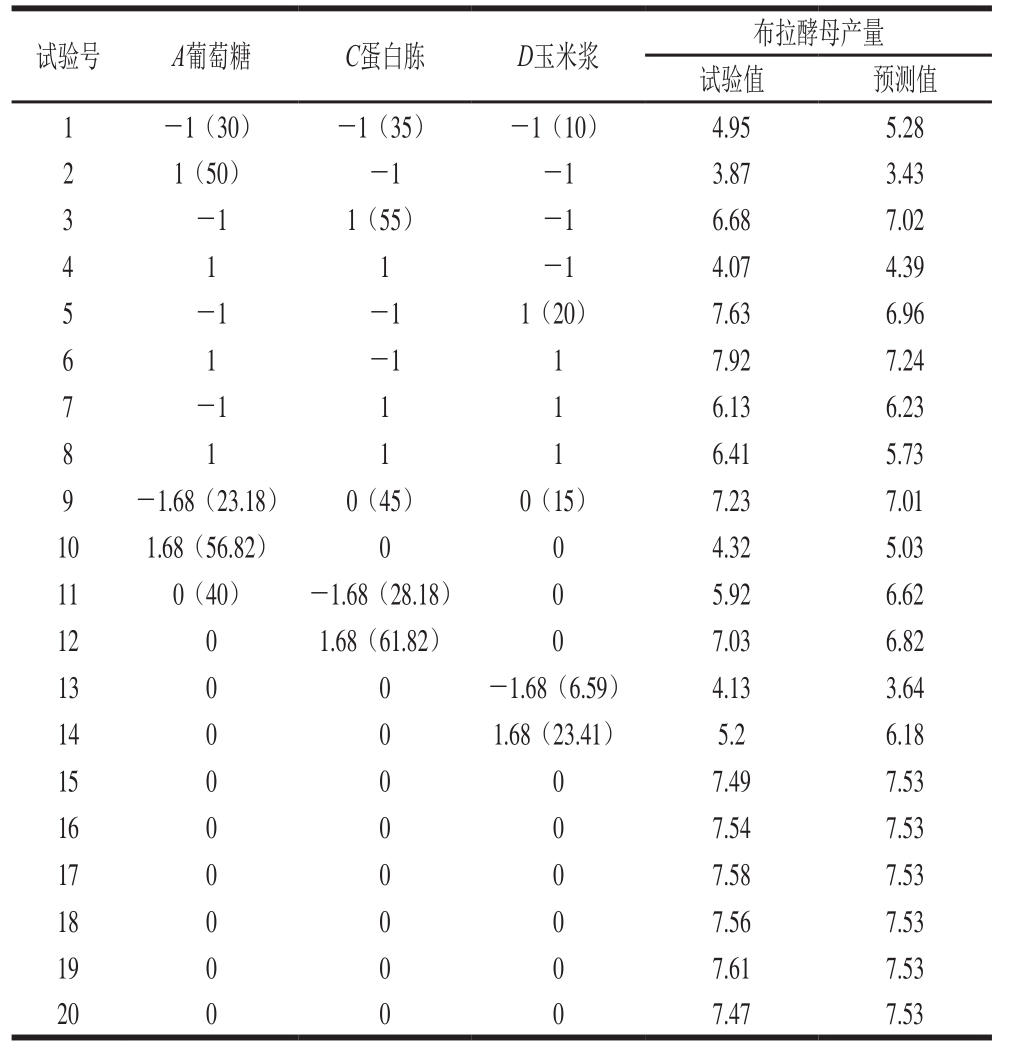
试验号 A葡萄糖 C蛋白胨 D玉米浆 布拉酵母产量试验值 预测值1 -1(30) -1(35) -1(10) 4.95 5.28 2 1(50) -1 -1 3.87 3.43 3-1 1(55) -1 6.68 7.02 4 1 1-1 4.07 4.39 5-1 -1 1(20) 7.63 6.96 6 1-1 1 7.92 7.24 7-1 1 1 6.13 6.23 8 1 1 1 6.41 5.73 9 -1.68(23.18) 0(45) 0(15) 7.23 7.01 10 1.68(56.82) 0 0 4.32 5.03 11 0(40) -1.68(28.18) 0 5.92 6.62 12 0 1.68(61.82) 0 7.03 6.82 13 0 0 -1.68(6.59) 4.13 3.64 14 0 0 1.68(23.41) 5.2 6.18 15 0 0 0 7.49 7.53 16 0 0 0 7.54 7.53 17 0 0 0 7.58 7.53 18 0 0 0 7.56 7.53 19 0 0 0 7.61 7.53 20 0 0 0 7.47 7.53
该模型的回归方程Y1=7.53-0.59A+0.058C+0.76D-0.19AC+0.53AD-0.62CD-0.53A2-0.29C2-0.93D2。从表4可以看出,P<0.05,说明该项在95%的置信区间内显著,失拟项P值小于0.000 1,说明该模型对布拉酵母发酵过程的模拟能力较差,不能准确反映布拉酵母产量预测值与试验值之间的关系。
表 4 RSM方差分析
Table 4 Analysis of variance of response surface quadratic regression model
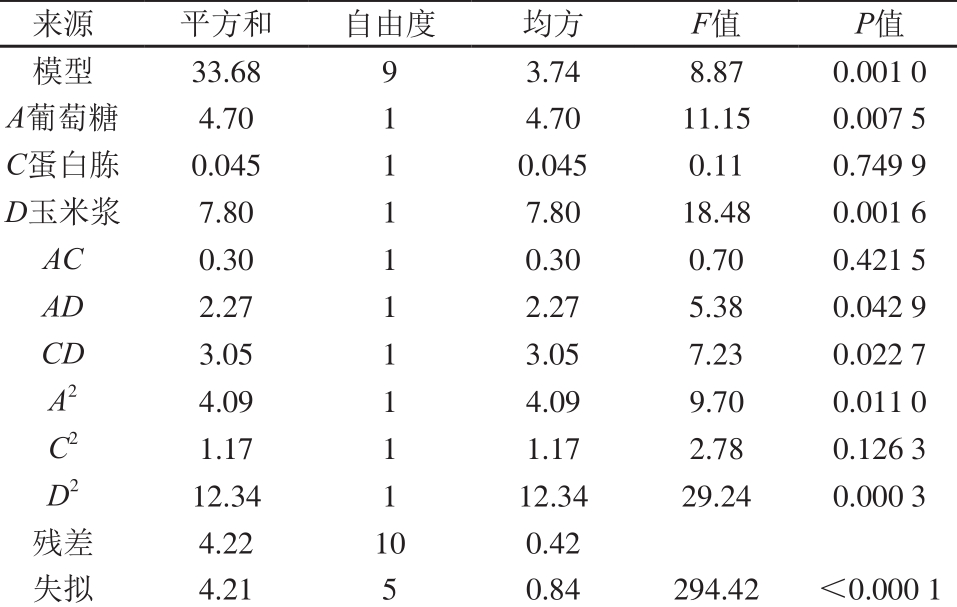
来源 平方和 自由度 均方 F值 P值模型 33.68 9 3.74 8.87 0.001 0 A葡萄糖 4.70 1 4.70 11.15 0.007 5 C蛋白胨 0.045 1 0.045 0.11 0.749 9 D玉米浆 7.80 1 7.80 18.48 0.001 6 AC 0.30 1 0.30 0.70 0.421 5 AD 2.27 1 2.27 5.38 0.042 9 CD 3.05 1 3.05 7.23 0.022 7 A2 4.09 1 4.09 9.70 0.011 0 C2 1.17 1 1.17 2.78 0.126 3 D2 12.34 1 12.34 29.24 0.000 3残差 4.22 10 0.42失拟 4.21 5 0.84 294.42 <0.000 1
2.1.3 ANN模型及分析
以CCD数据作为样本,使用trainlm算法对神经网络进行训练。采用反向传播方法建立ANN模型。为防止过度拟合,在保证训练精度的情况下,尽量减少中间隐含层数量,训练后比较发现,当隐含层神经元为6时,能对实验数据准确拟合。所以本实验选择拓扑结构为3-6-1的神经网络。由图1可以看出,经过200 次迭代后网络收敛精度达到10-2,样本训练能较快达到收敛。
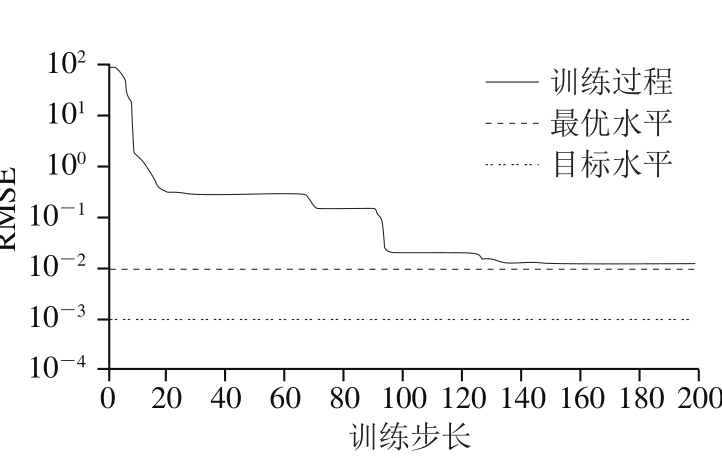
图 1 BP神经网络训练过程
Fig. 1 Training course of BP neural network
2.1.4 RSM模型和ANN模型的对比

图 2 ANN和RSM模型预测产量与实验值对比
Fig. 2 ANN and RSM prediction versus experimental values
由图2可以看出,ANN模型的预测值与实验值的拟合程度较好,RSM模型的预测值则更多地分散于实验值附近。为进一步比较建立RSM模型和ANN模型的拟合能力、预测能力,分别计算2 个模型的R2、RMSE和SEP。根据表3计算得出,RSM模型R2=0.89,RMSE=0.46 g/L,SEP=7.26%,ANN模型R2=0.99,RMSE=0.03 g/L,SEP=0.55%。ANN模型拥有更大R2和更小的RMSE、SEP,模型表现出较好的拟合能力以及预测能力。可能原因是RSM通过二次多项式建立模型,拟合能力不足,不能较好地反映培养基各组分间的非线性关系。而ANN模型是根据现有的实验数据进行迭代计算,不像RSM模型需要预先给定函数,所以处理非线性问题的能力更强。
2.1.5 GA优化
GA可直接对结构对象进行相关操作,不存在求导和函数连续性的限定,具有全局寻优的优势。综合考虑精度、收敛速度以及计算规模等条件,将每代染色体种群设为30,在求出所有染色体适应度后,通过轮盘赌选择法对种群进行选择,最大迭代次数为500,采用单点交叉和单点变异,交叉概率为0.5,变异概率为0.08。GA寻优过程见图3。
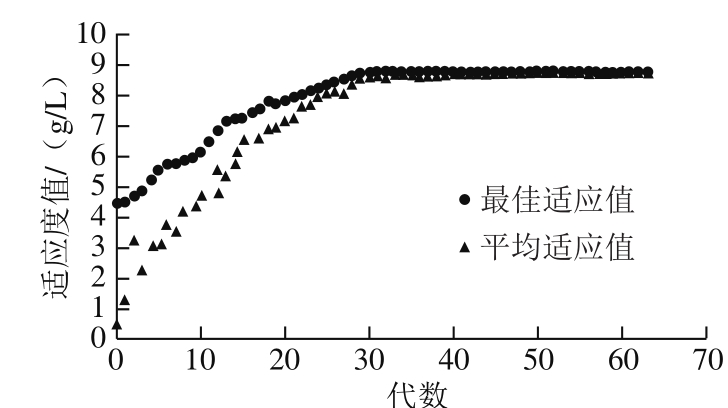
图 3 GA优化过程中最佳适应值和平均适应值的变化过程
Fig. 3 Evolution of the best and mean fitness in GA
经过63 次GA优化计算后,GA优化得到的布拉酵母产量最大值为8.28 g/L,并获得3 种成分最佳组成:葡萄糖40.52 g/L、蛋白胨36.8 g/L、玉米浆17.32 g/L。最终得到最优培养基配方:葡萄糖40.52 g/L、蛋白胨36.8 g/L、玉米浆17.32 g/L、硝酸钾14 g/L、酵母营养盐1.5 g/L、磷酸二氢钾0.6 g/L、硫酸镁0.8 g/L。在该培养条件下,经过3 次重复实验得到布拉酵母平均产量为8.21 g/L,说明ANN-GA预测具有较好的预测能力。
在确定的最优摇瓶培养条件基础上,利用1 L四联体发酵罐对发酵过程中的温度、pH值、接种量、溶氧水平等因素进行优化。
由图4A可知,布拉酵母在发酵第21小时进入稳定期。当培养温度达到30 ℃时,布拉酵母产量达到最大值,超过30 ℃则有下降的趋势,可能原因是在30 ℃时布拉酵母内环境较为稳定,新陈代谢所需酶的活性达到较高水平,因此确定30 ℃为布拉酵母最适培养温度。由图4B可知,当接种量为6%时布拉酵母生长较为缓慢,当接种量为10%时布拉酵母产量达到最大,当继续增加接种量,布拉酵母产量则有下降趋势。因此确定接种量为10%,后续优化在该基础上进行。
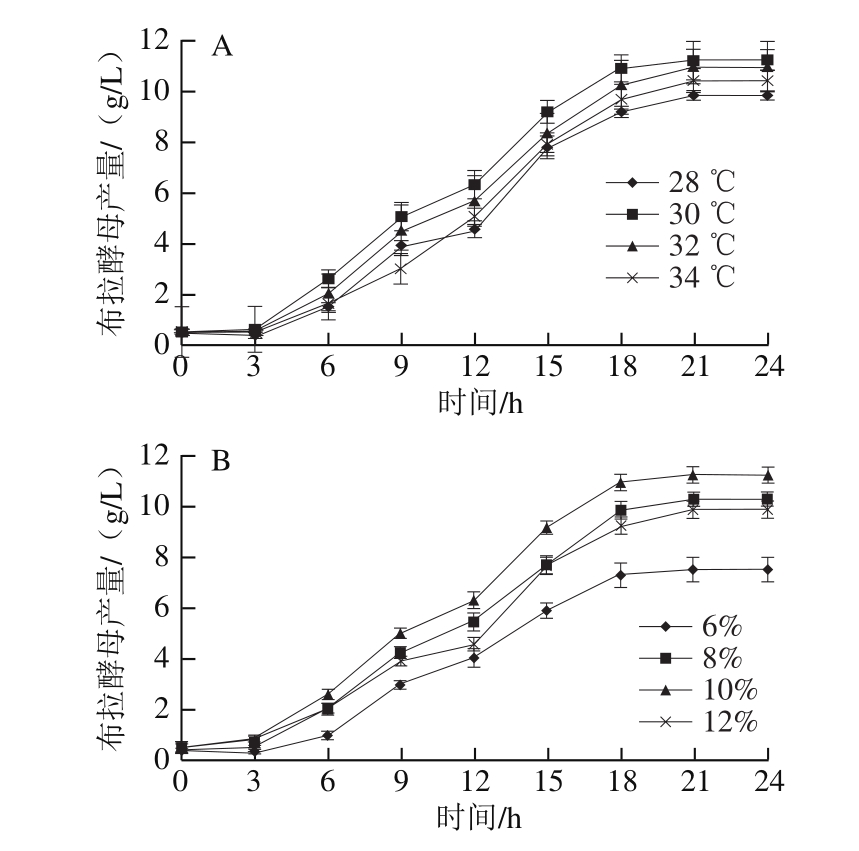

图 5 pH值(A)及溶氧量(B)对布拉酵母产量的影响
Fig. 5 Effect of pH (A) and dissolved oxygen level (B) on dry biomass yield of S. boulardii
由图5A可知,当发酵过程中pH值为4.0~5.0时,布拉酵母产量呈现出上升的趋势,pH 5.0时达到16.63 g/L;当培养基初始pH 5.5时,布拉酵母产量降至15.21 g/L,可能原因是在pH 5.0条件下,培养基中各成分的溶解程度较好,细胞能够很好地利用并进行生长代谢,过高或者过低的pH值环境都不利于该酵母菌的生长,因此确定pH 5.0时为最适值。在布拉酵母发酵过程中,需氧量受菌体浓度、培养基各种成分浓度等多种因素的影响。通过调节空气流量、罐压和搅拌速率分别控制溶氧量为30%、35%、40%、45%,由图5B看出,溶氧量控制在40%(空气流量控制在0.6~1 L/(L·min),搅拌速率400~600 r/min,罐压0.05~0.07 MPa)的情况下,发酵水平较为理想。综上可得,布拉酵母最佳培养条件为温度30 ℃、接种量10%、恒定pH 5.0、溶氧量40%,在该条件下菌体产量达到19.43 g/L,后续优化在该基础上进行。
碳源是异养型微生物所需要的重要能量来源,碳源过低会导致营养不足,菌体无法正常生长代谢,而过高的碳源又会影响细胞渗透压[29]。利用1 L发酵罐研究发酵过程中碳源质量浓度对布拉酵母生长的影响,由图6A可知,发酵至第8小时葡萄糖基本消耗完毕,通过流加葡萄糖溶液,控制发酵液中糖质量浓度为1、3、5、7 g/L,菌体产量较未流加时分别提高55.94%、89.50%、80.65%和59.55%。当葡萄糖质量浓度增大到5 g/L时,布拉酵母产量呈下降趋势,可能是由于培养基中糖质量浓度过高对细胞造成渗透压胁迫。因此确定3 g/L为最适残糖质量浓度。
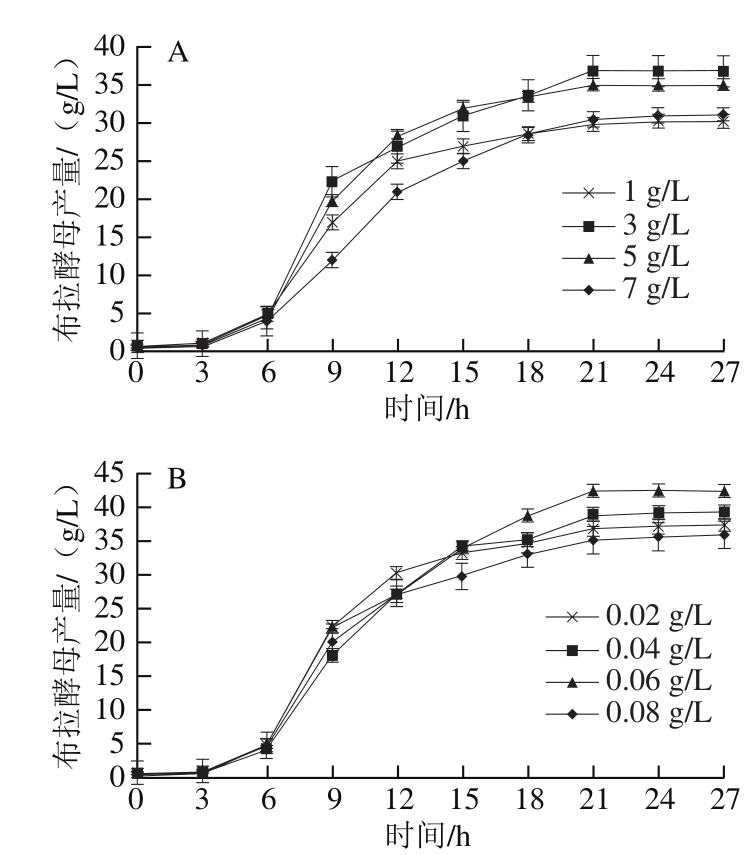
图 6 葡萄糖质量浓度(A)及氨氮质量浓度(B)对布拉酵母产量的影响
Fig. 6 Effect of glucose (A) and ammoniacal nitrogen concentration (B)on dry biomass yield of S. boulardii
前期Plackett-Burman试验表明蛋白胨对布拉酵母发酵培养影响显著,因此选择蛋白胨为流加氮源。由图6B可知,当控制发酵中后期氨氮质量浓度为0.06 g/L时,布拉酵母产量达到最大值(42.36 g/L),较未流加蛋白胨时提高15.05%,因此确定最适氨氮质量浓度为0.06 g/L。
由图7可知,布拉酵母在0~2 h生长缓慢,菌体产量较低,葡萄糖质量浓度由40.52 g/L下降到35.32 g/L。从第2小时开始菌体布拉酵母产量迅速提高,布拉酵母对葡萄糖和氨氮的消耗大幅增加。第8小时时发酵液中葡萄糖基本消耗完毕,通过流加葡萄糖溶液维持残糖量为3 g/L。发酵至12 h菌体布拉酵母产量为36.25 g/L,此时通过流加蛋白胨溶液维持氨氮质量浓度为0.06 g/L,直到第28小时发酵结束,菌体布拉酵母产量达到51.21 g/L。
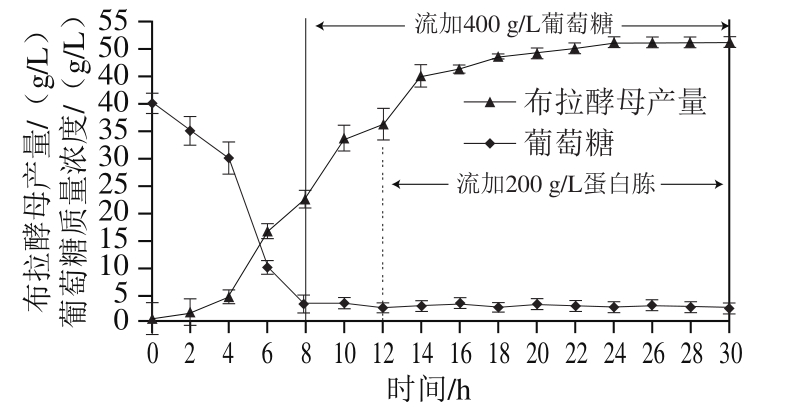
图 7 布拉酵母补料培养生长曲线
Fig. 7 Growth curve of S. boulardii in fed-batch fermentation
本实验对显著因素进行筛选,并采用CCD,通过构建ANN模型和RSM模型预测培养基的组成。结果表明,在处理该非线性问题时,ANN模型比RSM模型有着更好的拟合和预测能力。陆震鸣等[13]分别采用ANN模型和RSM模型对樟芝发酵建立模型,结果证明,ANN模型的拟合性和预测能力更强,与本实验所得结论一致。
培养基组成和质量浓度是影响布拉酵母生长的重要因素。本研究在ANN模型的基础上,通过GA寻优获得最佳培养基配方,摇瓶培养后菌体产量可达8.21 g/L。雷张藤[9]利用RSM法优化培养基,布拉酵母菌体布拉酵母产量为6.56 g/L。杜晓蒙等[10]通过正交法优化布拉酵母培养基,菌体布拉酵母产量为6.5 g/L,为本实验结果的79.9%。本研究将有机氮源和无机氮源相结合,能满足菌体的不同生长阶段需求。酵母营养盐中含有多种离子,玉米浆含有多种生长因子和前体物质,能够为布拉酵母菌的生长代谢提供丰富的营养[31]。此外在菌种代谢过程中培养基成分之间作用复杂,具有高度的非线性,而传统优化方法难以解决该问题,本实验利用ANN模型与GA优化相结合,提高了优化精度。
在布拉酵母的高密度发酵工艺基础上,流加葡萄糖和蛋白胨控制适宜的葡萄糖和氨氮浓度,培养28 h后布拉酵母产量达到51.21 g/L。雷张藤[9]仅流加单一葡萄糖溶液培养至42 h,菌体布拉酵母产量仅为12.76 g/L,为本实验结果的75%。由此可见在高密度发酵过程仅流加碳源难以满足菌体的营养。氮源是构成蛋白质、核酸及其他氮素化合物的重要物质,同时控制适当的碳源和氨氮含量能有效提升布拉酵母产量。
[1] MARTIN F S, VIERIRA A T, ELIAN S D, et al. Inhibition of tissue inflammation and bacterial translocation as one of the protective mechanisms of Saccharomyces boulardii against Salmonella infection in mice[J]. Microbes and Infection, 2013, 15(4): 270-279.DIO:10.1016/j.micinf.2012.12.007.
[2] BERNI C R, CUCCHIARA S, CUOMO R, et al. Saccharomyces boulardii: a summary of the evidence for gastroenterology clinical practice in adults and children[J]. European Review for Medical and Pharmacological Sciences, 2011, 15(7): 809-822. DOI:10.1016/j.euroneuro.2010.11.003.
[3] MOMBELLI B, GISMONDO M R. The use of probiotics in medical practice[J]. International Journal of Antimicrobial Agents, 2000, 16(4):531-536. DOI:10.1016/S0924-8579(00)00322-8.
[4] BUTS J P. Twenty-five years of research on Saccharomyces boulardii trophic effects: updates and perspectives[J]. Digestive Diseases and Sciences, 2009, 54(1): 15-18. DOI:10.1007/s10620-008-0322-y.
[5] DOROTA C, PATRICK R. Experimental effects of Saccharomyces boulardii on diarrheal pathogens[J]. Microbes and Infection, 2002,4(7): 733-739. DOI:10.1016/s1286-4579(02)01592-7.
[6] GIANG H H, VIET T Q, OGLE B, et al. Growth performance,digestibility, gut environment and health status in weaned piglets fed a diet supplemented with a complex of lactic acid bacteria alone or in combination with Bacillus subtilis and Saccharomyces boulardii[J].Livestock Science, 2012, 143(2): 132-141. DOI:10.1016/j.livsci.2010.01.010.
[7] OEZTUERK H, SCHROEDER B, BEYERBACH M, et al. Influence of living and autoclaved yeasts of Saccharomyces boulardii on in vitro rminal microbial metabolism[J]. Journal of Dairy Science, 2005, 88(7):2594-2600. DOI:10.3168/jds.S0022-0302(05)72935-0.
[8] 楚杰, 张大伟, 郝永任, 等. 布拉氏酵母菌对肠道菌群紊乱的调整作用研究[J]. 中国畜牧兽医, 2008, 35(7): 87-89.
[9] 雷张藤. 保拉迪酵母菌粉的制备及稳定性研究[D]. 西安: 陕西科技大学, 2017: 39-42.
[10] 杜晓蒙, 陶如玉, 圣志存, 等. 培养基组成对布拉氏酵母生长的影响及其优化[J]. 食品研究与开发, 2014, 35(5): 105-108. DOI:10.3969/j.issn.1005-6521.2014.05.030.
[11] 王学锋, 苑伟, 刘延琳. 培养基的主要成分对优选酿酒酵母生物量的影响[J]. 中国酿造, 2010(8): 18-21. DOI:10.3969/j.issn.0254-5071.2010.08.006.
[12] 王子辉. 布拉迪酵母菌高生物量及高产海藻糖菌株的筛选[D].济南: 山东轻工业学院, 2011: 44-46.
[13] 陆震鸣, 何喆, 许泓瑜, 等. 基于人工神经网络-遗传算法的樟芝发酵培养基优化[J]. 生物工程学报, 2011, 25(12): 1773-1779.DOI:10.13345/j.cjb.2011.12.007.
[14] 王莹, 栾天齐, 朴美子. 基于神经网络和遗传算法的醋酸发酵培养基优化[J]. 中国食品学报, 2012, 12(5): 88-94. DOI:10.3969/j.issn.1009-7848.2012.05.015.
[15] TIAN H, LIU C, GAO X D. et al. Optimization of auto-induction medium for G-CSF production by Escherichia coli using artificial neural networks coupled with genetic algorithm[J]. World Journal of Microbiology & Biotechnology, 2013, 29(3): 505-513. DOI:10.1007/s11274-012-1204-1.
[16] SINGH V, KHAN M, KHAN S, et al. Optimization of actinomycin V production by Streptomyces triostinicus using artificial neural network and genetic algorithm[J]. Applied Microbiology Biotechnology, 2009,82(2): 379-385. DOI:10.1007/s00253-008-1828-0.
[17] LAN Z, ZHAO C, GUO W, et al. Optimization of culture medium for maximal production of spinosad using an artificial neural networkgenetic algorithm modeling[J]. Journal of Molecular Microbiology and Biotechnology, 2015, 25(4): 253-261. DOI:10.1159/000381312.
[18] 王军峰, 杜吉泉, 储炬, 等. 应用神经网络和遗传算法优化利福霉素B发酵培养基[J]. 中国抗生素杂志, 2006, 31(5): 278-280.DOI:10.3969/j.issn.1001-8689.2006.05.006.
[19] 彭锋, 李安明. BP神经网络和遗传算法在红发夫酵母培养基优化中的应用[J]. 环境应用与微生物学报, 2008, 14(6): 834-837.DOI:10.3724/SP.J.1145.2008.00834.
[20] 姚博, 贠建民, 艾对元, 等. 基于径向基神经网络和遗传算法的聚谷氨酸发酵培养基优化[J]. 食品科学, 2018, 39(6): 107-115.DOI:10.3321/j.issn:1002-6630.2006.10.069.
[21] 李妍, 赵文静, 高鹏飞, 等. 优化益生菌Lactobacillus casei Zhang高密度培养条件[J]. 微生物学通报, 2009, 36(2): 181-186.DOI:10.13344/j.microbiol.china.2009.02.001.
[22] 洪厚胜, 窦冰然, 郭会明. 基于面包酵母中海藻糖提取工艺优化及菌株筛选的高密度培养工艺[J]. 食品科学, 2018, 39(6): 122-129.DOI:10.7506/spkx1002-6630-201806020.
[23] 周旻. 夫西地酸发酵工艺的初步研究[D]. 石家庄: 河北科技大学,2012: 16-17.
[24] 刘开放, 王敏, 郑君, 等. 骆驼凝乳酶工程菌发酵培养基的优化[J]. 现代食品科技, 2007, 32(13): 170-176. DOI:10.13982/j.mfst.1673-9078.2017.12.026.
[25] FRODA A, FITZGERALD G F. Biotechnological approaches to the understanding and improvement of mature cheese flavor[J]. Current Opinion in Biotechnology, 2000, 11(5): 484-489. DOI:10.1016/S0958-1669(00)00130-0.
[26] 冯培勇, 赵彦宏, 张丽. 响应面法优化黑曲霉产纤维素酶发酵条件[J]. 食品科学, 2009, 30(23): 335-339. DOI:10.3321/j.issn:1002-6630.2009.23.076.
[27] ADHIKARI K, HEYMANN H, HUFF H E. Textural characteristics of lowfat, fullfat and smoked cheeses: sensory and instrumental approaches[J]. Food Quality and Preference, 2003, 14(3): 211-218.DOI:10.1016/s0950-3293(02)00067-8.
[28] 周景文, 徐建, 陈守文, 等. 基于径向基神经网络和遗传算法的聚谷氨酸发酵培养基优化[J]. 食品科学, 2006, 27(10): 288-292.DOI:10.3321/j.issn:1002-6630.2006.10.069.
[29] ZHAO Z Y, MA S S, LI A, et al. Effects of trophic modes, carbon sources, and salinity on the cell growth and lipid accumulation of tropic ocean oilgae strain Desmodesmus sp. WC08[J]. Applied Biochemistry and Biotechnology, 2016, 180(3): 452-463. DOI:10.1007/s12010-016-2109-5.
[30] BI F, MENT D, LURIA N, et al. Mutation of AREA affects growth,sporulation, nitrogen regulation, and pathogenicity in Colletotrichum gloeosporioides[J]. Fungal Genetics and Biology, 2017, 99: 29.DOI:10.1016/j.fgb.2016.12.006.
[31] 王丽君, 梁万秋, 李华乔, 等. 发酵过程玉米浆质量研究[J]. 科技创新导报, 2011(6): 6. DOI:10.3969/j.issn.1674-098X.2011.06.005.
Optimization of High Cell Density Fermentation of Saccharomyces boulardii for Enhanced Biomass Production
刘开放, 席志文, 黄林娜, 等. 布拉酵母高密度发酵培养基及发酵工艺优化[J]. 食品科学, 2019, 40(8): 56-62.