葡萄(Vitis vinifera)有“水果之神”的称号,属葡萄科,落叶藤本植物。葡萄分布在温带至亚热带地区,遍及亚洲、欧洲和美洲。葡萄果酒、果醋加工过程中产生大量废弃的葡萄果渣,然而,葡萄果渣仍有大量的葡萄皮和葡萄籽,其中富含氨基酸、维生素、黄酮等有效活性成分,对提高人体免疫力、保护心脑血管、抗衰老、维持机体平衡的作用很大。将葡萄果渣制作酵素饮品,不仅能减少发酵行业带来的废弃物污染问题,并且能极大地提高葡萄果渣的利用率与附加值[1]。
益生菌利用果蔬中糖类、蛋白质、维生素、花色苷等营养成分并代谢转换成小分子活性物质如氨基酸、酶类、有机酸等,不仅保留了天然果香,还增加了营养密度[2]。王珍珍等[3]发现树莓酵素中主要微生物是酵母菌,并从树莓酵素中分离鉴定、筛选出耐高糖、耐酸性等耐高渗特性的鲁氏接合酵母。海棠果酵素中主要筛选菌株为鼠李糖乳杆菌,体外益生功能评价显示,该菌株具有显著降低胆固醇能力[4]。马晓伟等[5]研究表明,火龙果酵素中添加的益生菌主要是产乳酸芽孢杆菌、植物乳杆菌、鼠李糖杆菌,该益生菌群不仅将火龙果果香和乳酸发酵风味完美结合,而且可使发酵后的火龙果酵素液营养丰富。
葡萄果渣酵素是以葡萄果渣为主要原料,利用微生物发酵得到的具有营养和保健作用的产品。葡萄果渣酵素从选材到发酵工艺不仅保留了原料本身的营养价值,而且通过微生物发酵不断产生新的活性物质,融合互补,协同增效[6]。本研究对多菌种发酵葡萄果渣酵素工艺条件进行了优化,以期进一步研究工业化规模生产工艺,为多菌种酵素的广泛应用提供理论支持[7]。
1.1.1 材料与菌种
葡萄果渣由南京汇科生物工程设备有限公司提供。
德氏乳杆菌保加利亚亚种(编号NJUTLO31605)、许氏醋酸菌(编号NJUTAO11605)为实验室保藏;动物双歧杆菌(编号21709)、嗜热链球菌(编号20372)、副干酪乳杆菌(编号20241)、酵母菌(编号1001)购于中国工业微生物菌种保藏管理中心。
1.1.2 菌种培养基
乳酸菌通用培养基(MRS):蛋白胨1 g/100 mL、牛肉浸膏1 g/100 mL、酵母抽提物0.5 g/100 mL、磷酸氢二钾0.2 g/100 mL、柠檬酸氢二铵0.2 g/100 mL、乙酸钠0.5 g/100 mL、葡萄糖2 g/100 mL、吐温80 0.1 g/100 mL、硫酸锰0.025 g/100 mL、硫酸镁0.058 g/100 mL(如为固体培养基,再加入1.5%~1.7%琼脂粉),于121 ℃高压蒸汽灭菌锅中灭菌20 min。
酵母浸出粉胨葡萄糖培养基(YPD):酵母膏1%、葡萄糖2%、鱼粉蛋白胨2%(如为固体培养基,再加入1.5%~1.7%琼脂粉),于121 ℃高压蒸汽灭菌锅中灭菌20 min。
许氏醋酸菌种子培养基:葡萄糖0.5 g,酵母粉0.5 g,水100 mL,121 ℃、0.1 MPa灭菌20 min,冷却至30 ℃,加入3.0 mL无水乙醇。
1.1.3 试剂
糖蜜 市售工厂制糖副产品;果胶酶(5 U/mg)国药集团化学试剂有限公司;氢氧化钠、没食子酸标准品、邻苯三酚、福林酚、三氯化铁 阿拉丁化学试剂有限公司;2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS) 美国Sigma公司。
BSA124电子天平 赛多利斯科学仪器有限公司;数显电子恒温水浴锅 江苏金坛宏华仪器厂;TGL-20B高速台式离心机 上海安亭科学仪器厂;UVmini-1240紫外分光光度计 日本岛津有限公司;5 L自吸式搅拌发酵罐 南京汇科生物工程设备有限公司;超净工作台无锡一净净化设备厂;WBL2531H多功能搅拌机 美的集团股份有限公司;YXQ-LS-50SII立式压力蒸汽灭菌锅上海博迅有限公司医疗设备厂。
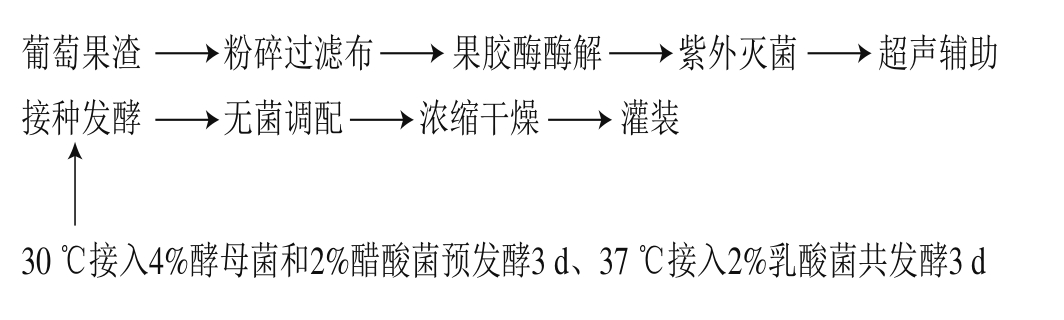
1.3.1 葡萄果渣酵素的基本工艺流程[8]

1.3.2 菌种的活化
配制各菌种所需培养基,分别在其中接入10%(体积分数)液态保藏的乳酸菌、酵母菌、醋酸菌菌液。乳酸菌培养温度为37 ℃,厌氧培养48~72 h;酵母菌培养温度为30℃,摇床转速为200 r/min,培养24 h;醋酸菌培养温度为30 ℃,摇床转速为180 r/min,培养48~72 h。
1.3.3 果胶酶酶解
经粉碎过后的葡萄果渣中仍含有丰富果胶的葡萄皮,为使葡萄皮分解成小分子,需添加果胶酶将其酶解成易于生物体转化和利用的糖类小分子。称取果胶酶7.5 g,葡萄果渣料液比1∶2(g/mL),调pH 4.5,在50 ℃条件下,用0.15%果胶酶处理葡萄果渣液120 min,以分解葡萄果渣中的果胶,使细胞更易破碎,降低葡萄果渣液的黏度[9]。
1.3.4 发酵罐培养基配方
添加比例为糖蜜∶葡萄果渣∶水=1∶2∶6(m/m)。
糖蜜的处理:将甘蔗糖蜜稀释至25~35 °Bx,用硫酸调节pH 5.0,加热煮沸至95 ℃,冷却静置12 h,尽可能除去糖蜜中胶体和色素,使用前在121 ℃条件下灭菌20 min。
辅助因子的添加:将尿素稀释为含N量8 g/100 mL的溶液;将磷酸二氢铵稀释为含P量8 g/100 mL;发酵罐实消后添加VB1 0.1 g、VB2 0.1 g、VB6 0.1 g、生物素0.05 g[10]。
1.3.5 接种发酵
将发酵罐灭菌后冷却至室温。加入原料和发酵培养液,调整底物初始pH 5.0~5.5。在初始pH 5.0~5.5、糖添加量8%、活菌接种量12%、超声时间60 min条件下,接入菌液,酵母菌、醋酸菌分别按4%、2%的接种量接入发酵罐,30 ℃条件下发酵3 d后接入2%乳酸菌,调整温度于37 ℃条件下共同发酵3 d,过程中测定其理化指标及抗氧化性能。
1.3.6 发酵初始条件的确定
首先考察超声频率、功率、温度对不同阶段微生物产酶及活菌率的影响,确定最佳超声条件的基础上,利用超声辅助法制备葡萄果渣酵素的考察因素有初始pH值(4.5、5.0、5.5、6.0、6.5)、糖添加量(2%、4%、6%、8%、10%)、活菌接种量(2%、4%、8%、12%、16%)、超声时间(0、30、60、90、120 min),研究其对葡萄果渣酵素发酵液中超氧化物歧化酶(superoxide dismutase,SOD)活力和活菌量的影响。
在单因素试验基础上,进一步采用Box-Behnken试验设计,以SOD活力为响应值,设计4因素3水平的响应面分析试验,采用Design-Expert软件进行响应面分析优化葡萄果渣酵素的初始发酵条件,因素和水平如表1所示。
表 1 响应面试验因素及水平
Table 1 Factors and levels used in Box-Behnken design

水平 因素A初始pH B糖添加量/% C活菌接种量/% D超声时间/1 4.5 8 8 30 2 5.0 6 12 60 3 5.5 10 16 90
1.3.7 指标测定
酵母菌活菌数的测定:按照血球计数法操作[11-13];乳酸菌活菌数的测定:按照美蓝计数法操作[11-13];醋酸菌活菌数的测定:按照平板计数法操作[11-13]。
可滴定酸度的测定:参考GB/T 12456—2008《食品中总酸的测定》中滴定法。
SOD活力的测定:按照邻苯三酚自氧化法GB/T 5009.171—2003《保健食品中超氧化物歧化酶(SOD)活性的测定》操作。
总酚含量的测定:福林-酚法[14]。分别移取1 mL没食子酸标准液和样品液于试管中,各加入5 mL超纯水和3 mL 10%福林-酚试剂,振荡,混匀静置5 min后加入4 mL 12%碳酸钠溶液,最后用超纯水定容至25 mL,35 ℃水浴反应1.5 h后在700 nm波长处测定吸光度。
原花青素含量的测定:准确量取1 mL样液,加入5 mL 5 g/100 mL的香草醛甲醇溶液及4 mL 10%盐酸甲醇溶液,35 ℃混合摇匀静置20 min,按照优化后方法,测定火龙果酵素中原花青素的在波长500 nm条件下的吸光度,计算原花青素的含量[15-16]。
ABTS阳离子自由基清除能力的测定:ABTS试剂盒法[17],以样品质量浓度对自由基清除率作图并进行线性拟合,计算IC50值,IC50值定义为清除率为50%时所需抗氧化剂质量浓度。用pH 7.4的磷酸盐缓冲液配制5 mmol/L的ABTS储液,与MnO2反应后过滤,再用PBS(pH 7.4)稀释到734 nm波长处吸光度为0.68~0.72,-20 ℃保存备用。在反应体系中,于10 mL比色管中加入50 μL不同质量浓度的样品或参比溶液(二甲基亚砜),再加入3 mL的ABTS反应溶液,振荡摇匀,于室温下避光静置6 min,测定溶液在734 nm波长处的吸光度。以不同质量浓度Trolox为标准品,绘制标准曲线,结果表示为每克干物质的Trolox当量[18-20]。
式中:A为样品管的吸光度;A0为对照管的吸光度。
有机酸含量的测定[21-25]:Agilent 1200高效液相色谱仪检测[26],色谱柱:Inertsil ODS-2(150 mm×4.6 mm);流动相:0.02 mol/L KH2PO4溶液;液相条件:等梯度洗脱20 min,流速1 mL/min,温度30 ℃,进样量10 μL,检测波长210 nm。样品用超纯水稀释10 倍,用0.22 μm滤膜过滤后直接进样,每个样品平行3 次。
1.3.8 感官评价标准
感官评价标准[27]见表2。
表 2 葡萄果渣酵素感官评价标准
Table 2 Criteria for sensory evaluation of fermented grape pomace

?
本实验采用Origin、Design-Expert软件对数据进行处理与分析。
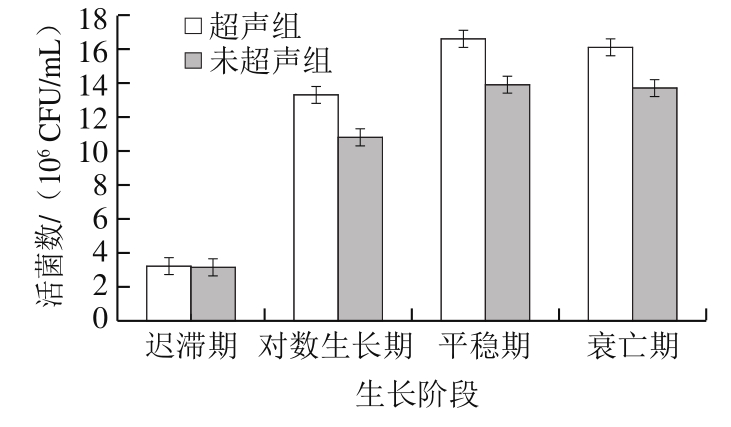
图 1 超声对菌体不同生长阶段的活菌数影响
Fig. 1 Effects of ultrasonic treatment on the number of viable cells at different growth stages
应用于生物发酵工程的超声波主要是功率超声波,在一定功率和超声强度下,对微生物进行超声不仅能改变酶分子的构象、促进微生物产酶速率,还能促进乳糖水解、减少固形物含量。根据超声波对不同阶段微生物产酶及活菌率的影响,确定了最佳超声阶段为菌种生长期,最佳超声条件为超声频率40 kHz、功率50 W、超声温度30 ℃。如图1所示,对不同生长期的微生物进行超声,其活菌数变化趋势较明显,在对数生长期施加超声条件对活菌数影响最大,此时活菌数增长了近1 个数量级。由图1可得,对迟滞期的菌种施加超声与未施加超声变化不明显;在对数生长期,超声刺激酵母菌产生高级醇及益生菌副产物,同时减少代谢过程产生的CO2,从而促进细胞增殖,考虑到该生长阶段对原料的转化和利用率很高,因此在该阶段施加超声效果最佳。此外,超声辅助发酵对菌体的平稳期、衰亡期均有一定作用,在菌体繁殖达到平衡状态时,低强度超声波能稳定增加体系中酶类、氨基酸等小分子物质,积累更多的营养成分;在衰亡期施加超声为发酵体系增添独特的香气成分[28]。

图 2 各因素对SOD活力及活菌质量浓度的影响
Fig. 2 Influence of various factors on SOD activity and viable bacterial number
A.初始pH值;B.活菌接种量;C.糖添加量;D.超声时间。
利用超声法辅助发酵葡萄果渣酵素,不仅对生物成长起到促进作用,提高产酶,还能增加生物量,加速在发酵过程中代谢与合成的物质交换[29]。在糖添加量8%、活菌接种量8%、超声60 min的条件下,发酵6 d后测定SOD活力及活菌质量浓度,由图2A可见,葡萄果渣酵素发酵初始pH 5.5时达到最佳点,由于酵母菌、乳酸菌和醋酸菌共酵在pH 5.5时生长状态最佳,此条件下SOD活力高达266 U/mL,且发酵过程中活菌质量浓度达到最大,选择最佳初始pH 5.5时感官评分最高。
由图2B可见,在糖添加量8%、初始pH 5.5、超声60 min的条件下,调整温度于37 ℃条件下共同发酵3 d。发酵6 d后测定SOD活力及活菌数,活菌接种量8%时,SOD活力高达318 U/mL,活菌质量浓度高达7.89 g/100 mL。考虑到菌种共酵产生的气味芳香及最大菌种活率,选择最佳接种量8%时感官评分最高[30]。
由图2C可见,在初始pH 5.5、超声60 min、接种量8%(酵母菌、醋酸菌分别按4%、2%的接种量接入发酵罐,30 ℃条件下发酵3 d后接入2%乳酸菌,调整温度于37 ℃条件下共同发酵3 d)的条件下,发酵6 d后测定SOD活力及活菌数,糖添加量为6%时,提供的碳源较为丰富,菌体通过耗糖完成生长代谢的过程,但过高的糖分会抑制菌体生长,SOD活力高达348 U/mL,活菌数高达8.4 g/100 mL。糖蜜是制糖工业的副产品,将糖蜜代替葡萄糖不仅能融合糖蜜香气,还能降低工业成本。发酵初期,酵母菌好氧发酵需要糖蜜源源不断供应,此时糖蜜添加过多容易产生Crabtree效应,糖蜜过少又会导致菌种营养不够,发酵活力低下,从而影响整个发酵周期以及发酵产品的活性[31-32]。考虑到菌种共酵产生的气味芳香及最大菌种活率,选择最佳糖添加量8%时感官评分最高。
由图2D可见,在糖添加量8%、初始pH 5.5、接种量8%(酵母菌、醋酸菌分别按4%、2%的接种量接入发酵罐,30 ℃条件下发酵3 d后接入2%乳酸菌,调整温度于37 ℃条件下共同发酵3 d)的条件下,改变超声时间,测定发酵6 d后的SOD活力及活菌数,超声时间为60 min下,SOD活力高达280 U/mL,活菌质量浓度高达8.5 g/100 mL。适当超声能改变酵母菌、醋酸菌、乳酸菌菌体内产生的酶分子构象,提高酶活力,超声时间过长过短都会影响到酶活力以及发酵液中的活性物质。考虑到菌种共酵产生的气味芳香及最大菌种活率,最佳超声时间60 min时感官评分最高。
利用Design-Expert软件对表3中27 组试验数据进行二次项回归拟合,分别得到Y值与初始pH值、糖添加量、活菌接种量、超声时间4 个因素的二次多项回归方程为:
Y=1 013.06+22.37B-29.53C-41.82AB+41.56AD-5.28BC+25.26CD-125.33A2-142.41B2-160.88C2-66.32D2
由表4可以看出,二次回归模型Y值显著,可以用来拟合4 个因素对葡萄果渣酵素发酵过程产酶和活菌数的影响。Y值失拟项不显著,回归方程拟合性良好。回归方程分析表明:一次项A、C、D,交互系数AB、AC、BC、BD、CD,二次项系数B2、C2、D2影响显著或极显著。F值反映了各因子对于响应值的重要性,A>D>C>B,对葡萄果渣酵素发酵工艺的影响顺序为:初始pH值>超声时间>活菌接种量>糖添加量。
表 3 Box-Behnken试验设计与结果
Table 3 Box-Behnken design with experimental results
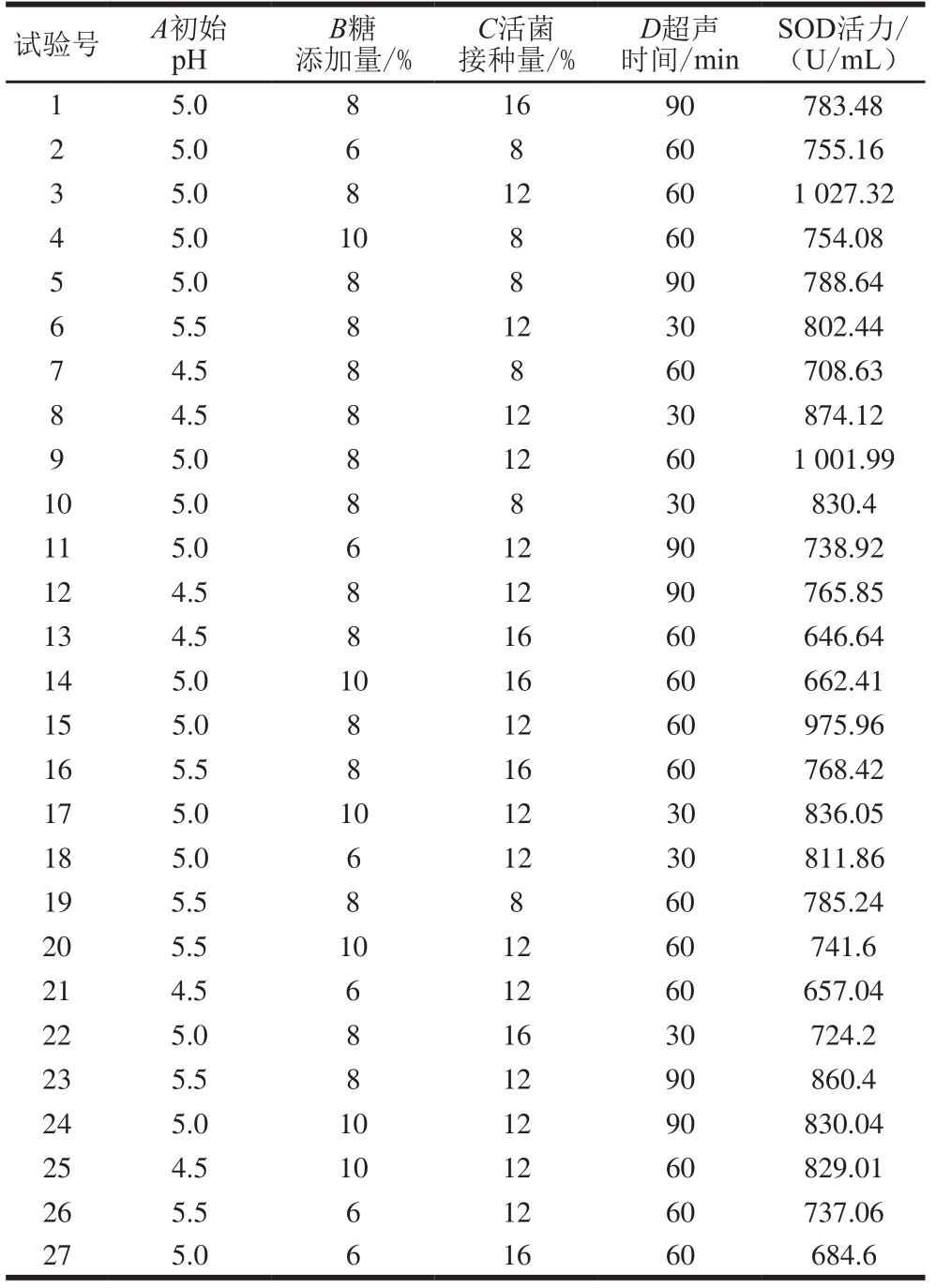
试验号 A初始pH B糖添加量/%C活菌接种量/%D超声时间/min SOD活力/(U/mL)1 5.0 8 16 90 783.48 2 5.0 6 8 60 755.16 3 5.0 8 12 60 1 027.32 4 5.0 10 8 60 754.08 5 5.0 8 8 90 788.64 6 5.5 8 12 30 802.44 7 4.5 8 8 60 708.63 8 4.5 8 12 30 874.12 9 5.0 8 12 60 1 001.99 10 5.0 8 8 30 830.4 11 5.0 6 12 90 738.92 12 4.5 8 12 90 765.85 13 4.5 8 16 60 646.64 14 5.0 10 16 60 662.41 15 5.0 8 12 60 975.96 16 5.5 8 16 60 768.42 17 5.0 10 12 30 836.05 18 5.0 6 12 30 811.86 19 5.5 8 8 60 785.24 20 5.5 10 12 60 741.6 21 4.5 6 12 60 657.04 22 5.0 8 16 30 724.2 23 5.5 8 12 90 860.4 24 5.0 10 12 90 830.04 25 4.5 10 12 60 829.01 26 5.5 6 12 60 737.06 27 5.0 6 16 60 684.6
表 4 回归方程的方差分析
Table 4 Analysis of variance for regression model
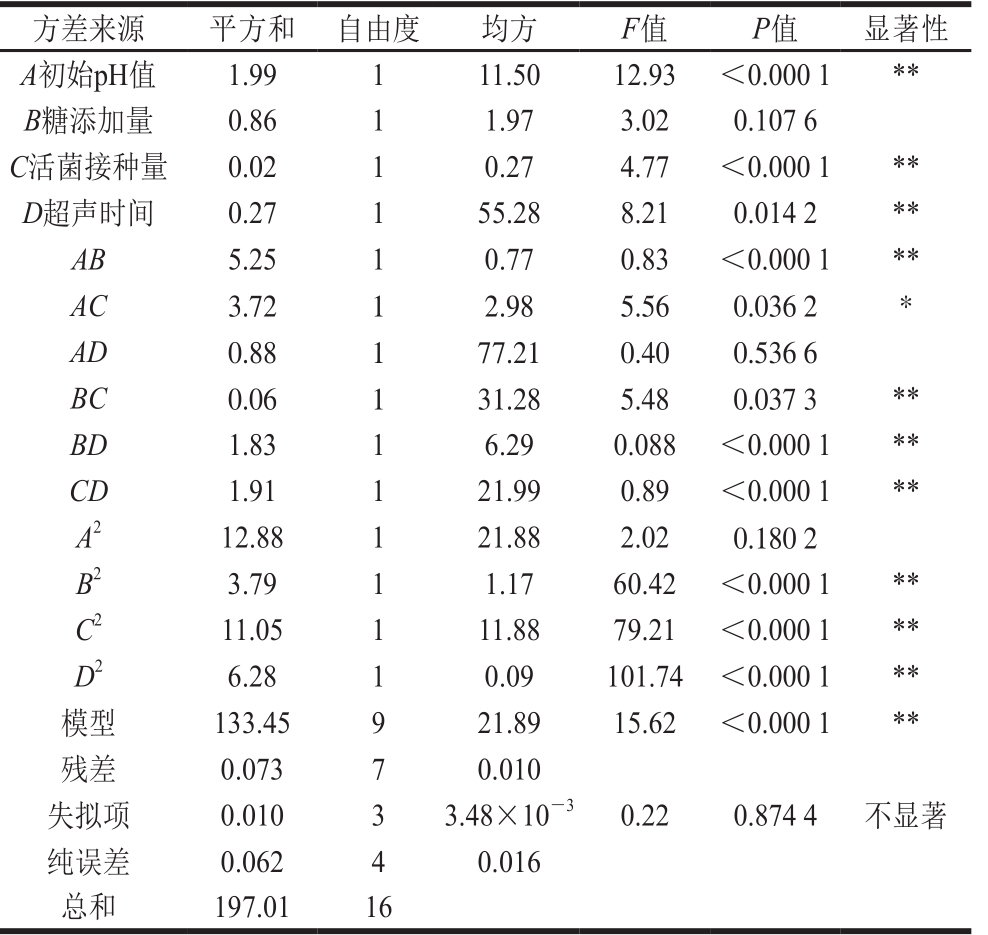
注:*. P<0.05,差异显著;**. P<0.01,差异极显著。
方差来源 平方和 自由度 均方 F值 P值 显著性A初始pH值 1.99 1 11.50 12.93 <0.000 1 **B糖添加量 0.86 1 1.97 3.02 0.107 6 C活菌接种量 0.02 1 0.27 4.77 <0.000 1 **D超声时间 0.27 1 55.28 8.21 0.014 2 **AB 5.25 1 0.77 0.83 <0.000 1 **AC 3.72 1 2.98 5.56 0.036 2 *AD 0.88 1 77.21 0.40 0.536 6 BC 0.06 1 31.28 5.48 0.037 3 **BD 1.83 1 6.29 0.088 <0.000 1 **CD 1.91 1 21.99 0.89 <0.000 1 **A2 12.88 1 21.88 2.02 0.180 2 B2 3.79 1 1.17 60.42 <0.000 1 **C2 11.05 1 11.88 79.21 <0.000 1 **D2 6.28 1 0.09 101.74 <0.000 1 **模型 133.45 9 21.89 15.62 <0.000 1 **残差 0.073 7 0.010失拟项 0.010 3 3.48×10-3 0.22 0.874 4 不显著纯误差 0.062 4 0.016总和 197.01 16
为直观地反映出各因素及其交互作用对响应值的影响结果,以SOD活力为指标,对上述回归方程绘制三维响应面及其等高线图,见图3。
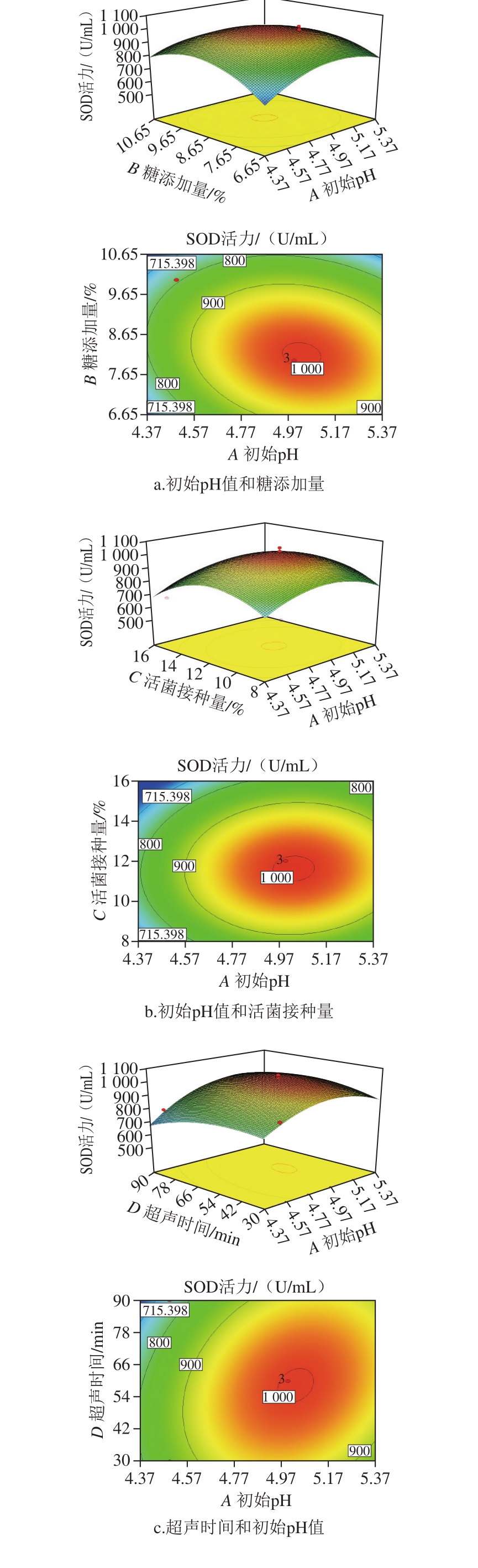
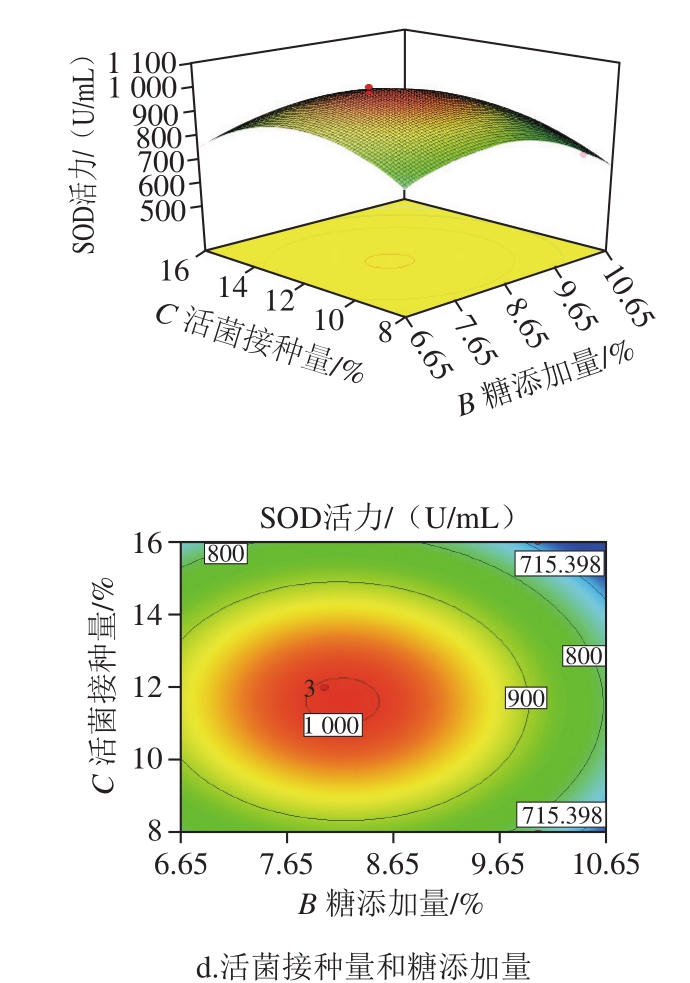
图 3 各因素交互作用对SOD活力影响的响应面和等高线图
Fig. 3 Response surface and contour plots showing the interactive effects of various factors on SOD Activity
葡萄果渣酵素在益生菌作用下产酶,酶活力是衡量发酵体系是否达到成熟的一个指标,是酵素行业广泛测定的营养指标之一,由于活菌数越多,酶活力越强[33]。为直观反映各因素及其交互作用对酶活的影响结果,对回归方程绘制三维响应面图及其等高线。由图3a可知,初始pH值和糖添加量的交互影响明显,随着糖添加量的增加,酶活逐渐增大,糖添加量超过8%后,酶活为逐渐降低,初始pH值也同单因素试验的结果相符。由图3b可知,活菌接种量和初始pH值交互作用显著,SOD活力在活菌接种量8%~16%、初始pH在4.5~5.5范围内有最大值。由图3c可知,等高线图接近圆形,因此确定初始pH值和超声时间作用不显著。由图3d可知,两者交互作用显著,随着活菌接种量、糖添加量的增加,酶活力呈现极大值点。通过分析计算得到超声促进葡萄果渣酵素发酵产酶的最优条件为:初始pH 5.00、糖添加量8.11%、活菌接种量11.75%、超声时间57.61 min。此条件下,感官评分高达87 分,模型预测发酵液的SOD活力为1 004.22 U/mL,比优化前有明显提高。
一次性补料方式是传统的发酵方法,发酵过程中各参数可以宏观反映出发酵机理的变化,但是由于体系中碳源的转化使微生物的后期生长比较困难,容易使菌体走向自溶。在工业生产中既要保证发酵质量,又要正确判断发酵终点,把握发酵周期是重中之重。本实验对传统酵素工艺中一次性投料进行改进,探索分批补料方式对葡萄果渣酵素发酵过程理化指标变化及发酵终点的影响。因此将响应面优化过后的最佳工艺条件在5 L罐上进行工艺放大,采用分批补料方式探索其对残糖量、乙醇体积分数、酸度等理化指标的影响。从图4可见,不同补料方式对葡萄果渣酵素发酵过程中糖的利用程度有明显差别,一次性补料来看,在接入酵母菌和醋酸菌共酵18 h以内,发酵过程中残糖量逐渐降低,直至48 h后残糖量变化幅度很小,该方式得到的活菌质量浓度为4.88 g/100 mL;而通过分批补料方式来看,微生物对糖的利用率很大,由于发酵18~24 h酵母菌、醋酸菌对糖的大量需求,使糖不断转化为代谢产物,此时残糖量很低,对体系进行补料后,24~54 h内接入的乳酸菌与前两者共酵耗糖产生酶类、氨基酸等小分子,研究发现益生菌菌种之间有一定的互利共生作用,酵母菌和乳酸菌之间存在代谢产物互补机制,酵母菌产生易于吸收的中链脂肪酸甘露糖,从而促进乳酸菌的生长,乳酸菌代谢产物乳糖又为酵母菌提供生长条件,二者紧密联系,互相取长补短。54~90 h对体系进行再次补料,60 h后残糖量仍有较大变化,可推测有机酸的生成及分解芳香物质,使果渣发酵液形成独特香郁的风味及口感,形成稳定的平衡体系[34]。
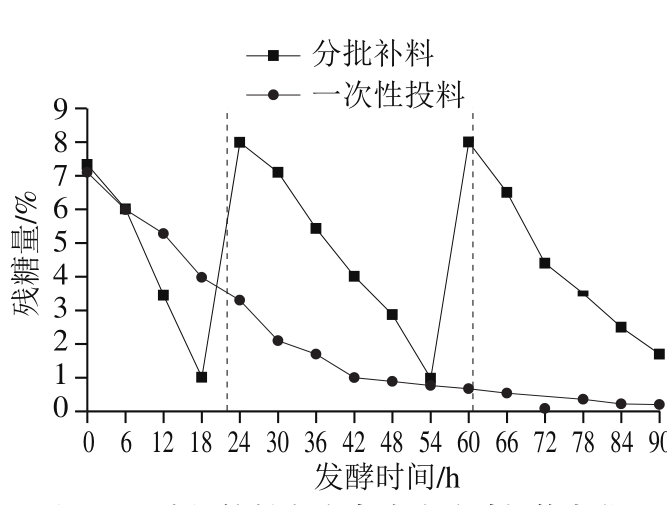
图 4 分批补料方式中残糖随时间的变化
Fig. 4 Change in residual sugar over time in fed-batch mode
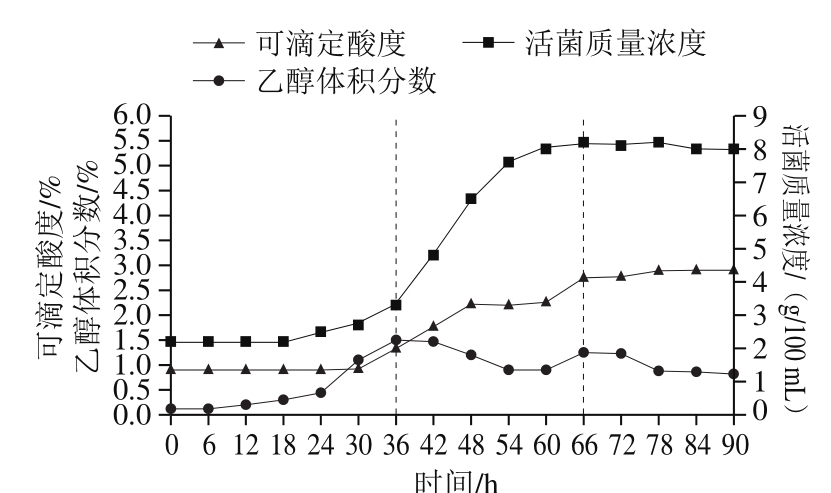
图 5 分批补料方式中乙醇体积分数、可滴定酸度、活菌质量浓度随时间的变化
Fig. 5 Change in alcohol content, acidity and viable bacterial count over time in fed-batch mode
采用分批补料方式对优化后的发酵工艺进行5 L罐实验,对发酵过程中酸度、乙醇体积分数、活菌数等参数进行分析测定,结果如图5所示,可滴定酸度总体呈现两个峰值,第1个是发酵30~48 h时从原来的0.9%达到2.3%,第2个峰值是60~72 h达到2.7%。乙醇体积分数的变化幅度较大,由于酵母菌在厌氧条件下发酵产生乙醇,因此前36 h乙醇体积分数不断上升,从0.1%涨到1.35%,发酵达到36 h后,醋酸菌利用乙醇并进行代谢合成新物质,不断繁殖,乙醇体积分数开始慢慢减少,由于二次补料操作,本身是优势菌种的酵母菌由于对糖利用率加大,产乙醇速度加快,乙醇量堆积再次为醋酸菌提供营养原料,发酵结束时,乙醇体积分数稳定在0.8%。发酵过程中,活菌数不断上升,在24~60 h之间微生物大量繁殖与堆积,达到峰值,最大活菌质量浓度为8.0 g/100 mL,该法得到的菌体生长量远超过一次性投料方式。
2.5.1 葡萄果渣酵素的理化指标测定结果
对pH值、可滴定酸度、还原糖、总酚的检测结果见表5。葡萄果渣酵素的pH值随着发酵时间延长,从初始pH 5.0逐渐降低,直至发酵结束时降低到pH 3.5,过程中由于微生物发酵产生乙酸、有机酸等代谢产物,使反应体系走向成熟,超声过后的酵素发酵周期缩短了近3 h,不仅加快了反应进程,而且使本身富含酚类物质的葡萄皮果渣经过转化与利用,总酚质量浓度在5 d达到5.5 mg/mL,比未超声组总酚含量有显著提升。此外,在发酵前期,由于果蔬中本身富含葡萄糖、果糖,加之人工添加的葡萄糖,总糖含量较高,直至酵母菌发酵进入对数生长期,耗糖量大大增加;在发酵后期,乳酸菌及醋酸菌为优势菌群,耗糖量增加,同时乙酸含量增加,乙醇减少。
表 5 发酵前后理化指标对比
Table 5 Comparison of physical and chemical indexes before and after fermentation
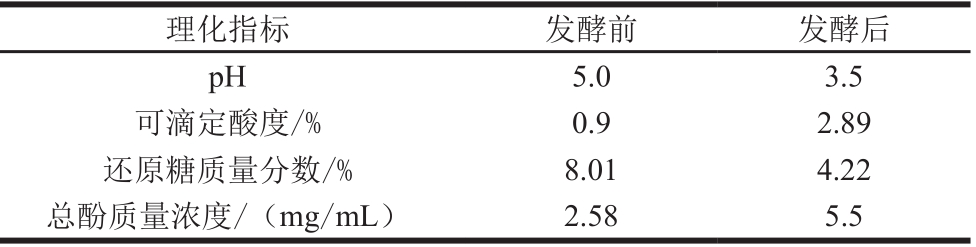
理化指标 发酵前 发酵后pH 5.0 3.5可滴定酸度/% 0.9 2.89还原糖质量分数/% 8.01 4.22总酚质量浓度/(mg/mL) 2.58 5.5
酵素产品抽检严格按照三级采样方案设定的指标,在n 个样品中,允许全部样品中相应微生物指标小于或等于m值,允许有不大于c 个样品的微生物指标在m和M之间,不允许有样品中微生物指标检验值大于M值。微生物指标检测结果见表6,采用平板计数法,大肠杆菌、霉菌菌落数均小于10 CFU/mL,沙门氏菌、金黄色葡萄球菌均未检出。
表 6 葡萄果渣酵素的微生物指标检测结果
Table 6 Microbiological indicators of fermented grape pomace

检验项目 检验方法及采样方案 检验结果/(CFU/mL)检验方法 n c m M菌落总数 GB 4789.2—2016 5 2 102 104 ≤10 000大肠菌落 GB 4789.3—2016 5 2 1 10 ≤10霉菌 GB 4789.15—2016 ≤10沙门氏菌 GB 29921—2013 未检出金黄色葡萄球菌 GB 29921—2013 未检出
2.5.2 葡萄果渣酵素功能成分的测定结果
酵母菌在厌氧条件下产生乙醇,乙醇又可促进醋酸菌生长;酵母菌和乳酸菌互相利用产生次级代谢产物及有机酸,从而提高酶活与活菌数,如表7所示,发酵结束时对数生长期酶活力最大,达到988 U/mL,比发酵前的SOD活力提高了1.19 倍。葡萄本身含有黄酮类化合物,是天然的抗氧化活性物质,葡萄果皮中单聚体酚类物质经益生菌的转化与利用,原花青素质量浓度达到了3.78 mg/mL,比发酵前葡萄果渣中的原花青素含量提高了40%。乳酸菌能为酵母菌提供发酵碳源,如牛乳生产过程中添加的酵母菌和乳酸菌,酵母菌不能直接利用乳糖,而乳酸菌可将乳糖转化为半乳糖和葡萄糖,因此乳酸菌也为酵母菌提供了碳源;乳酸菌还可通过丙酮酸盐裂解酶将丙酮酸盐转化为甲酸盐,或者将柠檬酸盐分解为甲酸盐、乙酸盐、乳酸盐、双乙酰、乙酰甲基原醇、2,3-丁二醇等芳香物质,为发酵体系增加风味成分。有研究推测酵母菌与乳酸菌共生体系中存在一种适应反应机制,这种机制一旦被激活,酵母菌会产生“交叉保护”的现象,促使酵母菌对外界抵抗能力增强,如高渗透压、高温、较低pH值等环境。随着发酵时间的推进,发酵体系中pH值逐渐降低,而酵母菌活力并没有因此走向自溶或衰亡,而是与乳酸菌互相利用、达到稳定共生的平衡体系[35]。
表 7 发酵前后功能成分指标对比
Table 7 Comparison of functional components before and after fermentation

功能成分指标 发酵前 发酵后原花青素质量浓度/(mg/mL) 2.50 3.78 SOD活力/(U/mL) 450.1 988活菌质量浓度/(g/100 mL) 1.1 8.5
有机酸是发酵过程中改变风味的重要考察因素,研究表明,有机酸种类会随着多菌种共酵代谢底物的变化而发生改变,果蔬发酵过程中会有少量丙酮酸、富马酸、莽草酸等有机酸生成,其中莽草酸就是多种有机酸代谢过程中的重要产物。苹果酸与乳酸菌进行的二次发酵过程中,L-苹果酸在乳酸菌的苹果酸-乳酸酶及Mn2+的催化下转变成L-乳酸和CO2的过程。乳酸菌经三羧酸循环代谢出的柠檬酸在发酵过程产生独特香气的双乙酰;乳酸菌进而将柠檬酸分解成为乙酸和丙酮酸等,乙酸是短链脂肪酸,可以有效改善人体肠道环境、起到调节肠道菌群的作用。综上所述,有机酸种类越是丰富,得到的酵素风味越是独特,营养越丰富。如图6所示,10 min内4 种有机酸全部被洗脱下来,经测定得到葡萄果渣酵素中有机酸种类主要为酒石酸、苹果酸、琥珀酸、柠檬酸,对比有机酸标准品图谱可见,4 种有机酸含量分别为:柠檬酸>琥珀酸>酒石酸>苹果酸,保留时间分别为5.234、4.201、3.470、2.445 min,线性关系良好,R2均大于0.999 0。酵母菌、乳酸菌、醋酸菌混合发酵过程产生次级代谢产物及有机酸,葡萄果渣中大量的多酚类物质,如儿茶素类没食子酸酯、原花青素类等活性成分,发酵过程中散发葡萄特有的醇、酚、萜类香气,不仅提高酶活与活菌量,而且融合随发酵时间的延长,葡萄果渣酵素香气独特且绵密。得到的葡萄果渣酵素上清液色泽透明亮丽,香气绵柔,口感、滋味评价均较高。
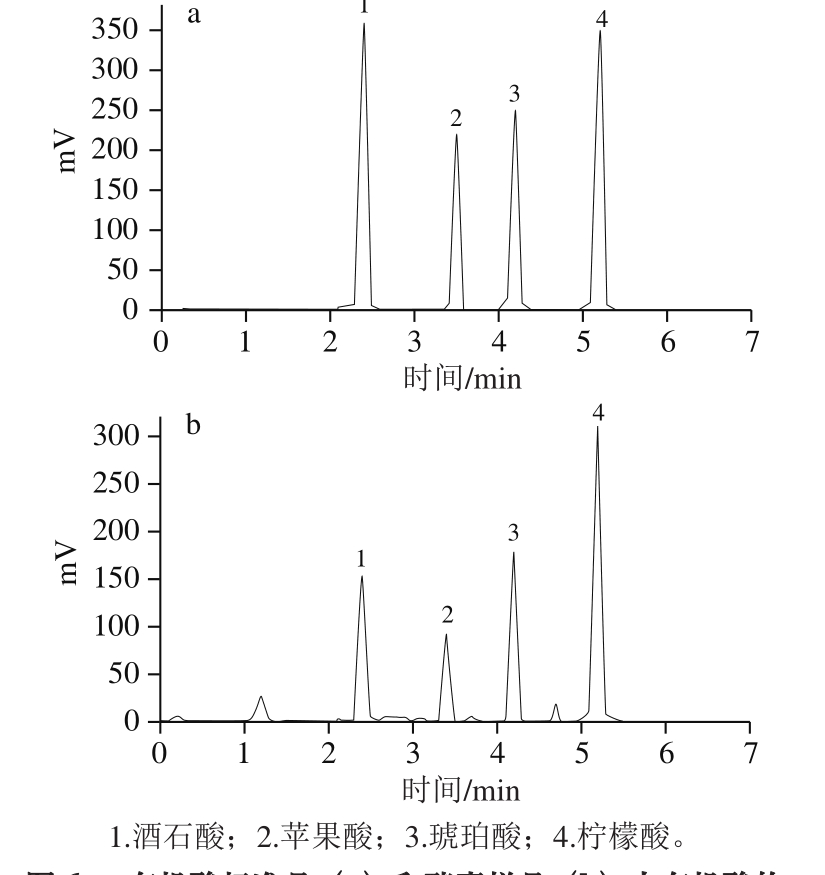
图 6 有机酸标准品(a)和酵素样品(b)中有机酸的高效液相色谱分离图谱
Fig. 6 HPLC for a mixture of standard organic acids and organic acids from fermented grape pomace
2.5.3 清除ABTS阳离子自由基的能力
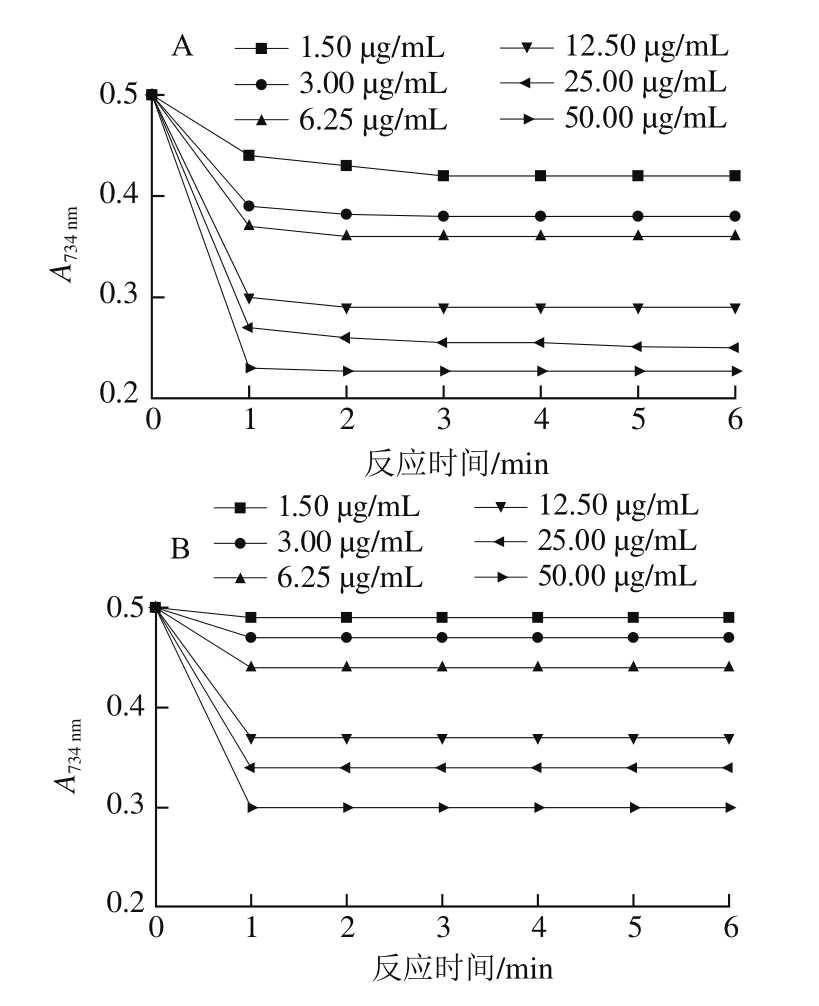
图 7 酵素样品(a)和Trolox标准品(b)清除ABTS阳离子自由基的能力
Fig. 7 ABTS radical scavenging capacity of Trolox standard and fermented grape pomace
在0~50 μg/mL的质量浓度范围,Trolox对自由基清除率有良好的线性关系,得到的标准曲线方程为:Y=2.010 0X-3.480 0,R2=0.993 6。
半抑制浓度即IC50,通常IC50值越小,代表酵素的抗氧化能力越强。ABTS经氧化后生成相对稳定的蓝绿色的ABTS水溶性自由基,酵素中的抗氧化剂与ABTS阳离子自由基反应后使其溶液褪色,特征吸光度降低,溶液褪色越明显则表明所检测物质的总抗氧化能力越强。自由基产生过多或清除过慢,会对生物体产生一系列损害,加速机体的衰老过程并诱发各种疾病。如图7所示,复合酵素对ABTS阳离子自由基有较强的清除能力,计算得到葡萄果渣酵素的ABTS阳离子自由基清除能力为(44.5±2.5)μg/g。该酵素对水溶性ABTS阳离子自由基的抑制率明显高于Trolox所对应的抑制率。
本研究以废弃葡萄果渣为原料,经酵母菌、双歧杆菌、植物乳杆菌、干酪乳杆菌、醋酸菌等多菌种共酵得到富含原花青素、SOD的葡萄果渣酵素。在确定最佳超声条件的基础上,考察初始pH值、糖添加量、接种量、超声时间对发酵过程中SOD活力及活菌质量浓度的影响,进一步对发酵工艺条件进行响应面优化试验,得到最佳发酵工艺条件为:初始pH 5.0、糖添加量8%、活菌接种量12%、超声时间60 min。将该最佳发酵条件应用于5 L发酵罐的工艺探索,得到周期为72 h的分批补料方式下,葡萄果渣酵素的理化指标、微生物及功能成分指标,总酚质量浓度达到5.5 mg/mL,发酵结束时pH值为3.5,SOD活力达到988 U/mL,比发酵前的SOD活力提高了1.19 倍;葡萄本身含有黄酮类化合物,是天然的抗氧化活性物质,葡萄果皮中单聚体酚类物质经益生菌的转化与利用,原花青素含量达到了3.78 mg/mL,比发酵前葡萄果渣中的原花青素含量提高了40%;微生物指标如霉菌、大肠杆菌等致病菌都未检出,活菌数达到8.5 g/100 mL;采用总抗氧化能力试剂盒测定得到该酵素对ABTS阳离子自由基清除能力为(44.5±2.5)μg/g。此外,经测定得到葡萄果渣酵素中有机酸种类主要为酒石酸、苹果酸、琥珀酸、柠檬酸,发酵过程中散发葡萄特有的醇、酚、萜类香气,葡萄果渣酵素香气独特且绵密,上清液色泽透明亮丽,香气绵柔,口感、滋味评价较高。
[1] 刘加友, 王振斌. 微生物酵素食品研究进展[J]. 食品与发酵工业,2016, 42(1): 273-276. DOI:10.13995/j.cnki.11-1802/ts.201601048.
[2] 毛建卫, 吴元锋, 方晟. 微生物酵素研究进展[J]. 发酵科技通讯,2010, 39(3): 42-44. DOI:10.3969/j.issn.1674-2214.2010.03.018.
[3] 王珍珍, 沙如意, 蔡成岗, 等. 树莓酵素中耐高渗酵母菌的分离鉴定及生长特性研究[J]. 食品工业科技, 2017, 38(8): 178-182.DOI:10.13386/j.issn1002-0306.2017.08.026.
[4] 杨志鹏, 王婷, 袁峰, 等. 海棠果酵素产品开发及其生物活性研究[J]. 中国调味品, 2018(1): 48-51. DOI:10.3969/j.issn.1000-9973.2018.01.010.
[5] 马晓伟, 林小晖, 杜冰. 益生菌发酵火龙果饮料的工艺研究[J]. 饮料工业, 2017, 20(3): 48-52. DOI:10.3969/j.issn.1007-7871.2017.03.017.
[6] 杨培青, 李斌, 颜廷才, 等. 蓝莓果渣酵素发酵工艺优化[J]. 食品科学, 2016, 37(23): 205-210. DOI:10.7506/spkx1002-6630-201623034.
[7] 杨婧娟, 李娜, 赵声兰. 一种酵素的配方优化研究[J]. 中国酿造,2016, 35(1): 95-99. DOI:10.11882/j.issn.0254-5071.2016.01.021.
[8] 王超, 余学军, 陈潇逸, 等. 杨梅渣提取物及其抗氧化活性研究[J].食品工业, 2013(11): 166-170. DOI:1002-0306(2011)02-0085-04.
[9] 李杰, 赵声兰, 陈朝银. 核桃青皮果蔬酵素的成分组成及体外抗氧化活性研究[J]. 食品工业科技, 2016, 37(10): 117-122.DOI:10.13386/j.issn1002-0306.2016.10.014.
[10] 陈庶来, 杨小明, 刘伟民, 等. 糙米酵素发酵工艺的研究[J]. 食品科学, 2005, 26(7): 275-277. DOI:10.3321/j.issn:1002-6630.2005.07.067.
[11] 江洁, 刘晓兰, 薛振磊, 等. 乳酸菌和酵母菌共生发酵茶饮料的研制[J]. 食品科学, 2001, 22(1): 44-46. DOI:10.3321/j.issn:1002-6630.2001.01.010.
[12] 战伟伟, 魏晓宇, 高本杰, 等. 蓝靛果椰子复合酵素发酵工艺优化[J]. 中国酿造, 2017, 36(1): 191-195. DOI:10.11882/j.issn.0254-5071.2017.01.040.
[13] 侯利娟, 邱志超, 王俊玲, 等. 酵母菌发酵生产糙米酵素条件优化的研究[J]. 黑龙江科学, 2016, 7(15): 6-7. DOI:10.3969/j.issn.1674-8646.2016.15.003.
[14] 李杰, 赵声兰, 陈朝银. Folin-Ciocalteu比色法测定核桃青皮果蔬酵素总多酚含量[J]. 中国酿造, 2015, 34(9): 130-134. DOI:10.11882/j.issn.0254-5071.2015.09.030.
[15] 朱曼利, 郭会明, 孙宏韬, 等. 火龙果酵素中原花青素含量测定方法的建立[J]. 中国酿造, 2017, 36(4): 184-187. DOI:10.11882/j.issn.0254-5071.2017.04.038.
[16] SERRA A, MACIA A, ROMERO M P, et al. Rapid methods to determine procyanidins, anthocyanins, theobromine and caffeine in rat tissues by liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography B, 2011, 879(19): 1519-1528.DOI:10.1016/j.jchromb.2011.03.042.
[17] MENG F, CHEN T, MA D, et al. Reclamation of herb residues using probiotics and their therapeutic effect on diarrhea[J]. Mediators of Inflammation, 2017, 2017(3): 1-8. DOI:10.1155/2017/4265898.
[18] 蒋增良, 毛建卫, 黄俊, 等. 蓝莓酵素在天然发酵过程中抗氧化性能的变化[J]. 食品工业科技, 2013, 34(2): 194-197. DOI:1002-0306(2013)02-0194-05.
[19] MPOFU A, LINNEMANN A R, SYBESMA W, et al. Development of a locally sustainable functional food based on mutandabota, a traditional food in southern Africa.[J]. Journal of Dairy Science, 2014,97(5): 2591-2599. DOI:10.3168/jds.2013-7593.
[20] 梁贵秋, 吴婧婧, 董桂清, 等. 食用桑椹酵素发酵工艺研究[J].食品与发酵科技, 2016, 52(6): 36-40. DOI:0.3969/j.issn.1674-506X.2016.06-008.
[21] MIRANDA-CASTILLEJA D E, MARTINEZ-PENICHE R Á,ROQUET-JALMAR M N, et al. Enological qualities and interactions between native yeast and lactic acid bacteria from Queretaro, Mexico:co-selection of wine microorganisms[J]. Journal of Food Science,2018, 83(7): 1904-1912. DOI:10.1111/1750-3841.14197.
[22] 程勇杰, 陈小伟, 王珍珍, 等. 树莓酵素与蓝莓酵素有机酸分析及其体外抗氧化性能[J]. 食品工业科技, 2017, 38(20): 141-145.DOI:10.13386/j.issn1002-0306.2017.20.026.
[23] HAO S, NI X, DONG Z, et al. Bidirectional immunomodulating activity of fermented polysaccharides from Yupingfeng[J].Research in Veterinary Science, 2017, 110: 22-28. DOI:10.10.16/j.rvsc.2016.10.015.
[24] 张思, 王蕾, 张志旭, 等. 16 种市售酵素食品功能分析与评价[J].食品与机械, 2016, 32(9): 196-200. DOI:10.13652/j.issn.1003-5788.2016.09.046.
[25] 艾学东, 胡丽娜. 水果植物复合酵素饮料的研制[J]. 食品与发酵科技, 2015, 51(2): 105-108. DOI:10.3969/j.issn.1674-506X.2015.02-024.
[26] 程勇杰, 陈小伟, 王珍珍, 等. 树莓酵素与蓝莓酵素有机酸分析及其体外抗氧化性能[J]. 食品工业科技, 2017, 38(20): 141-145.DOI:10.13386/j.issn1002-0306.2017.20.026.
[27] 高亮, 谭德星, 王延龙, 等. 酵素菌发酵中药渣试验研究[J].现代农业科技, 2016, 18(90): 144-146. DOI:10.3969/j.issn.1007-5739.2016.18.090.
[28] 闫彬, 贺银凤. 乳酸菌与酵母菌共生机理综述[J]. 食品科学, 2012,33(3): 277-281. DOI:10.7506/spkx1002-6630-201703058.
[29] 王振斌, 刘加友, 严贤, 等. 超声辅助多菌种发酵制备葛根酵素的研究[J]. 食品研究与开发, 2016, 37(13): 160-165. DOI:10.3969/j.issn.1005-6521.2016.13.038.
[30] 宋娇娇, 杨勇, 谭洪弟, 等. 响应面法优化超声提取总核苷工艺[J].酿酒科技, 2018(3): 52-56. DOI:10.13746/j.njkj.2018032.
[31] 陈安徽, 陈尚龙, 巫永华, 等. 黄精酵素口服液中钙、铁和锌的形态分析[J]. 现代食品科技, 2016, 32(1): 272-277. DOI:10.13982/j.mfst.1673-9078.2016.1.043.
[32] 刘春花, 吴彬彬, 陈宏运, 等. 植物发酵液(酵素)对小鼠免疫功能的影响[J]. 食品研究与开发, 2016, 37(18): 173-178. DOI:10.3969/j.issn.1005-6521.2016.18.041.
[33] 于晓艳, 任清, 卢舒娴, 等. 微生物酵素主要功效酶活力的测定[J]. 食品科技, 2008, 33(7): 193-196. DOI:10.3969/j.issn.1005-9989.2008.07.056.
[34] 张梦梅, 刘芳, 胡凯弟, 等. 酵素食品微生物指标与主要功效酶及有机酸分析[J]. 食品与发酵工业, 2017, 43(9): 195-200. DOI:10.13995/j.cnki.11-1802/ts.014137.
[35] 赵芳芳, 莫雅雯, 蒋增良, 等. 功能性微生物酵素产品的研究进展[J].食品与发酵工业, 2016, 42(7): 283-287. DOI:10.13995/j.cnki.11-1802/ts.201607046.
Optimization of Fermentation Process and Physicochemical Properties of Probiotic Fermented Grape Pomace