
图 1 37 种脂肪酸甲酯混合标准品的BID气相色谱图
Fig. 1 BID GC profiles of mixed standards of 37 fatty acid methyl ester
绿豆是我国重要的杂粮作物之一,可简单蒸煮食用或加工成多种产品,作为良好的药食同源食材深受大众喜爱[1]。绿豆品质关系到原粮加工性能及其营养价值,绿豆中的脂肪酸组成是绿豆品质形成的重要指标,因此脂肪酸含量及其分析方法研究对绿豆等杂粮生产及科学研究具有指导意义[2-4]。
粮食中脂肪酸含量分析主要采用气相色谱法,多采用不同极性的石英毛细管柱进行组分分离[5-6],结合氢火焰离子化检测器(flame ionization detector,FID)或质谱进行检测[7-8],其中FID是文献报道中最为常见的检测器。在样品前处理方面,主要采用溶剂萃取、索氏提取或超临界萃取等方法提取脂肪[9-11],经浓缩后再由氢氧化钾-甲醇等方法进行甲酯化后上机分析。虽然目前的脂肪酸组分测定方法较为成熟,但在样品前处理方面存在样品量需求大,有机溶剂消耗多及流程繁琐等不足。与此同时,在作物逆境生理或化学调控研究领域,受环境胁迫或化学调控下的原粮品质受到关注,而在上述特定研究中,供试样品量较少的问题给分析方法的灵敏度及重现性带来新的挑战,因此有必要创新分析方法。近年来,日本岛津公司推出介质阻挡放电氦等离子体检测器(dielectric barrier discharge ionization detector,BID),是一种通用型检测器,利用高纯氦气在绝缘介质上产生氦等离子体,释放出高能量光子(17.7 eV)用以离子化目标组分,可测定除氖和载气氦以外的全部化合物,包括无机气体和可挥发有机物[12-17]。目前该检测器的应用多集中在永久性气体(H2、O2、N2、CO、CH4和CO2)等组分的分析检测,如高炉煤气、水煤气、化工气、合成气、填埋气的检测分析中[18-23],对有机化合物的检测鲜有报道。本课题组在预实验中通过对37 种脂肪酸甲酯混合标准品测试发现BID对脂肪酸甲酯类化合物具有较高的灵敏度及良好的线性范围,有望能通过此检测器提升或改进原有方法,因此本实验拟在深入比较BID和FID对脂肪酸检测性能的基础上,结合实际样品的检测要求,采用BID建立绿豆中脂肪酸组成分析方法,实现通过少量样品即可满足脂肪酸快速分析的目标。
实验所用绿豆品种为‘绿丰2号’,该品种为农业部审定的黑龙江省适种品种,于2017年5月种植于黑龙江省农业科学院耕作栽培研究所冷害试验基地并于当年收获,收获样品在自然干燥后清除杂质,并置于网袋内于阴凉干燥处保存,测试前采用3100型实验室锤式旋风粉碎磨于16 800 r/min粉碎处理10 min,过100 目筛待用。
异辛烷、甲醇(色谱纯) 天津市大茂化学试剂厂;氢氧化钾(优级纯) 天津市科密欧试剂公司;无水硫酸钠(优级纯) 天津光复精细化工研究所;37 种脂肪酸甲酯混合标准品(序列号:965931N2190083) 上海安谱科学仪器有限公司;色谱标准物质(正十二烷、正十四烷、正十六烷,质量浓度100 ng/µL,瓶号:BW3093) 中国计量科学研究院;超纯氦气(纯度99.999 9%,瓶号:00020654) 吴江梅塞尔工业气体有限公司。
Nexis GC-2030气相色谱仪(配有BID、FID、150 位自动进样器、LabSolutions色谱工作站)、GCMS-QP2010 Ultra气相色谱-质谱联用仪(配有12 位自动进样器,GCMS solution质谱工作站) 日本岛津公司;ML104电子分析天平(感量为0. 000 1 g) 瑞士梅特勒-托利多公司;TGL-16B小型台式离心机 上海安亭科学仪器厂;3100型实验室锤式旋风粉碎磨 瑞典波通公司。
1.3.1 气相色谱仪系统校正
为保证BID检测方法的可靠性及BID与FID性能比较的系统一致性,本实验在测试前进行仪器系统的校正,所用载气为超纯氦气以消除气源影响[23]。依据日本岛津公司标准安装报告书(QMS-2021)要求,在待机状态下,利用系统自检模式扫描一段BID背景信号,计算信号噪声及基线漂移。在噪声及漂移值达标后,平行采集5 次色谱标准物质(正十二烷、正十四烷、正十六烷)的出峰时间及峰面积,进行灵敏度及精密度考察;利用色谱标准物质分别通过BID及FID系统进行测试并记录组分保留时间,通过仪器气体流量增益校正使BID和FID各组分出峰时间保持一致。
1.3.2 仪器检测条件
1.3.2.1 BID
色谱柱:HP-88石英毛细管柱(100 m×0.25 mm,0.25 µm)88%-氰丙基/芳基-聚硅氧烷固定液;载气:超纯氦气(纯度99.999 9%);载气流量:1.5 mL/min;程序升温:由120 ℃起始保持1 min,以10 ℃/min升至175 ℃保持10 min,以5 ℃/min升至210 ℃保持5 min,再以5 ℃/min升至230 ℃保持10 min;进样口温度:250 ℃;隔垫吹扫流量:3 mL/min;分流比:1∶60;检测器温度:280 ℃;等离子体放电气体流量:40 mL/min;进样体积:1 µL。
1.3.2.2 FID
色谱进样口程序升温测试条件与BID相同。检测器温度:280 ℃;氢气流量:25 mL/min;空气流量:250 mL/min;尾吹气流量:30 mL/min。
1.3.2.3 气相色谱-质谱联用组分定性条件
色谱进样口程序升温测试条件与BID相同。质谱接口温度:250 ℃;离子源温度:230 ℃;四极杆温度:150 ℃;电子电离源:70 eV;扫描模式:SCAN;扫描范围:m/z 29~550;溶剂延迟时间:8 min。
1.3.3 FID与BID对组分信号响应能力的比较
参考Franchina等[15]的方法。在最佳仪器条件下,对37 种脂肪酸甲酯混合标准品分别采用FID与BID进行检测,每种检测器平行进样5 次采集峰面积及峰面积归一化数据,分别计算峰面积及峰面积归一化平均值,以平均值比较2 种检测器对各组分信号响应强度及响应能力。利用SPSS 19.0数据处理软件进一步对FID和BID两种检测器对各脂肪酸甲酯组分峰面积及峰面积归一化数据进行单因素方差分析,考察2 种检测器对各目标组分的灵敏度及准确性差异。
1.3.4 样品前处理
参考田甜等[24]研究方法并重新设计。准确称取样品50.0 mg于1.5 mL离心管中,依次加入1.00 mL异辛烷、30.0 µL氢氧化钾-甲醇溶液和10.0 mg无水硫酸钠,封盖振摇60 s,静置5 min后再次振摇60 s,12 000 r/min离心10 min,取上层清液加入样品瓶中上机检测。
1.3.5 组分定性与定量方法学考察
实际样品组分定性采用标准品保留时间定性,并采用气相色谱-质谱联用仪电子电离源(70 eV)结合NIST谱库检索辅助定性[25]。在方法学考察前,将混合标准品溶液逐级稀释并分别进样采集目标组分峰面积,将各组分质量浓度对应峰面积进行线性回归计算得出回归方程及相关系数,依据回归方程及3 倍信噪比计算检测限。对同一样品按六边形分布划分等距取样点,于6 个取样点平行取样进行样品前处理并分别上机检测,以各组分峰面积计算相对标准偏差考察方法重现性。标准品及样品获得的色谱图在数据处理前通过相同的背景基线文件消除程序升温产生基线漂移的影响,积分方法采用峰底连线及双峰谷点中心切割方式,采用外标法及峰面积归一化法对实际样品定量。
数据统计采用SPSS 19.0(IBM SPSS Statistics)统计分析软件对BID组和FID组数据进行统计学分析。图像处理方法采用LabSolutions 5.90(Shimadzu Corporation)色谱处理软件和Origin 8.5图形处理软件(OriginLab)对采集色谱数据进行峰面积积分、峰标记及谱图成像处理。
在最终的系统校正条件下,BID基线噪声值为74.00 µV,漂移值为1 233.36 µV。色谱标准物质正十二烷、正十四烷和正十六烷平均保留时间分别为2.095、3.234 min和6.024 min,平均峰面积分别为1 648 536、1 655 980和1 643 613,其中第3个峰正十六烷保留时间相对标准偏差为0.006%,峰面积相对标准偏差为0.405%。BID和FID分别测定正十六烷保留时间偏差为0.018%,上述说明仪器状态符合测试要求。

图 1 37 种脂肪酸甲酯混合标准品的BID气相色谱图
Fig. 1 BID GC profiles of mixed standards of 37 fatty acid methyl ester
实验采用37 种脂肪酸甲酯混合标准品对BID进行系统适应性考察,在最终测试条件下获得BID气相色谱如图1所示。由图1可知,色谱系统对组分分离状况良好,BID对溶剂和37 种脂肪酸甲酯的信号响应正常,对各组分出峰几乎无歧视效应,说明BID作为气相色谱一种通用型检测器对脂肪酸甲酯具有良好的系统适应性。22.5 min后的基线漂移由程序升温引起,可通过扣除空运行获得的背景文件达到平直状态,满足定量要求。
表 1 BID与FID信号响应性能比较Table 1 Comparison of signal response performance of BID and FID
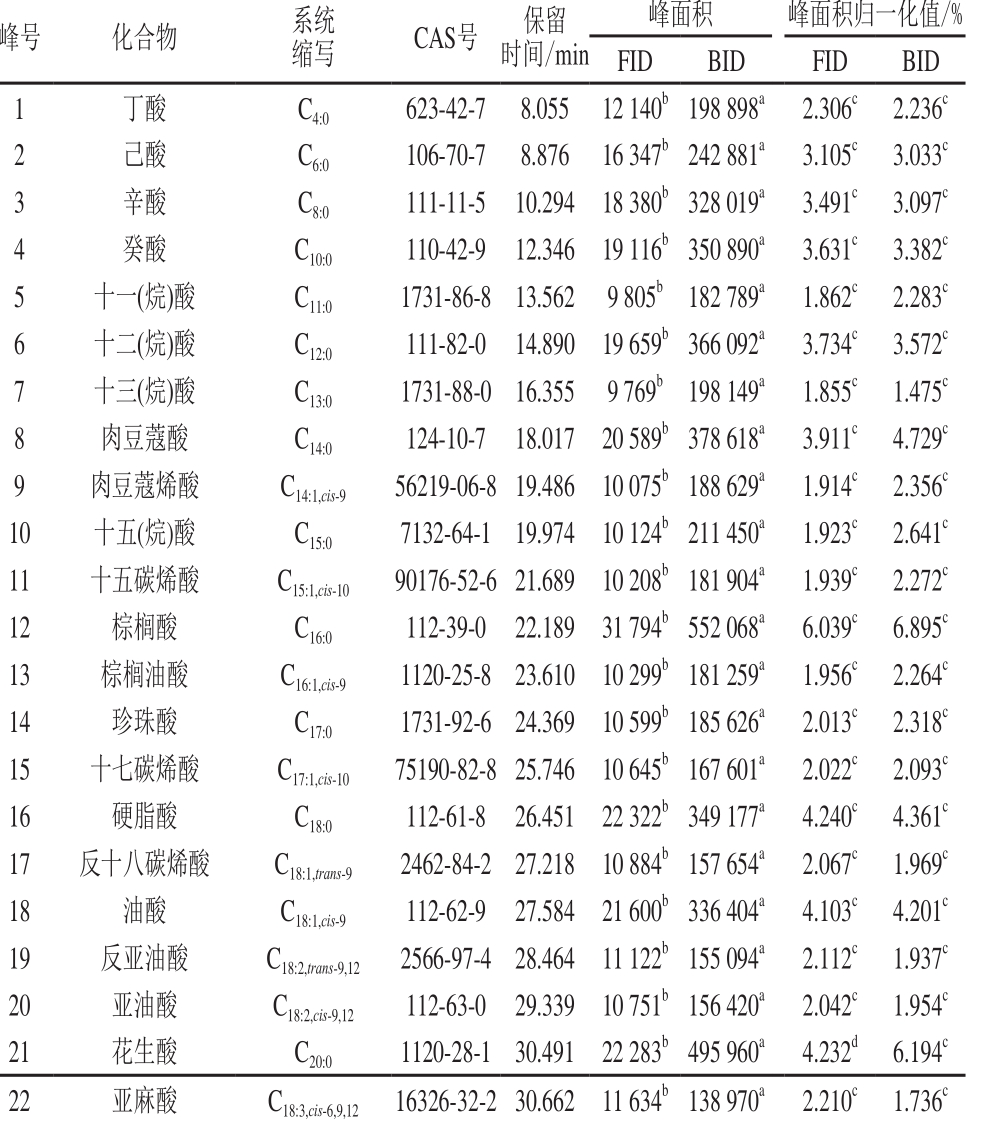
号 化合物 系统缩写 CAS号 保留时间/min峰面积 峰面积归一化值/%FID BID FID BID 1 丁酸 C4:0 623-42-78.05512 140b198 898a2.306c2.236c 2 己酸 C6:0 106-70-78.87616 347b242 881a3.105c3.033c 3 辛酸 C8:0 111-11-510.29418 380b328 019a3.491c3.097c 4 癸酸 C10:0 110-42-912.34619 116b350 890a3.631c3.382c 5 十一(烷)酸 C11:0 1731-86-8 13.562 9 805b 182 789a 1.862c 2.283c 6 十二(烷)酸 C12:0 111-82-0 14.890 19 659b366 092a 3.734c 3.572c 7 十三(烷)酸 C13:0 1731-88-0 16.355 9 769b 198 149a 1.855c 1.475c 8 肉豆蔻酸 C14:0 124-10-7 18.017 20 589b378 618a 3.911c 4.729c 9 肉豆蔻烯酸 C14:1,cis-9 56219-06-819.486 10 075b188 629a 1.914c 2.356c 10 十五(烷)酸 C15:0 7132-64-1 19.974 10 124b211 450a 1.923c 2.641c 11 十五碳烯酸 C15:1,cis-10 90176-52-621.689 10 208b181 904a 1.939c 2.272c 12 棕榈酸 C16:0 112-39-0 22.189 31 794b552 068a 6.039c 6.895c 13 棕榈油酸 C16:1,cis-9 1120-25-8 23.610 10 299b181 259a 1.956c 2.264c 14 珍珠酸 C17:0 1731-92-6 24.369 10 599b185 626a 2.013c 2.318c 15 十七碳烯酸 C17:1,cis-10 75190-82-825.746 10 645b167 601a 2.022c 2.093c 16 硬脂酸 C18:0 112-61-8 26.451 22 322b349 177a 4.240c 4.361c 17 反十八碳烯酸 C18:1,trans-9 2462-84-2 27.218 10 884b157 654a 2.067c 1.969c 18 油酸 C18:1,cis-9112-62-927.58421 600b336 404a4.103c4.201c 19 反亚油酸 C18:2,trans-9,12 2566-97-4 28.464 11 122b155 094a 2.112c 1.937c 20 亚油酸 C18:2,cis-9,12 112-63-0 29.339 10 751b156 420a 2.042c 1.954c 21 花生酸 C20:0 1120-28-1 30.491 22 283b495 960a 4.232d 6.194c 22 亚麻酸 C18:3,cis-6,9,12 16326-32-2 30.662 11 634b138 970a 2.210c 1.736c
续表1
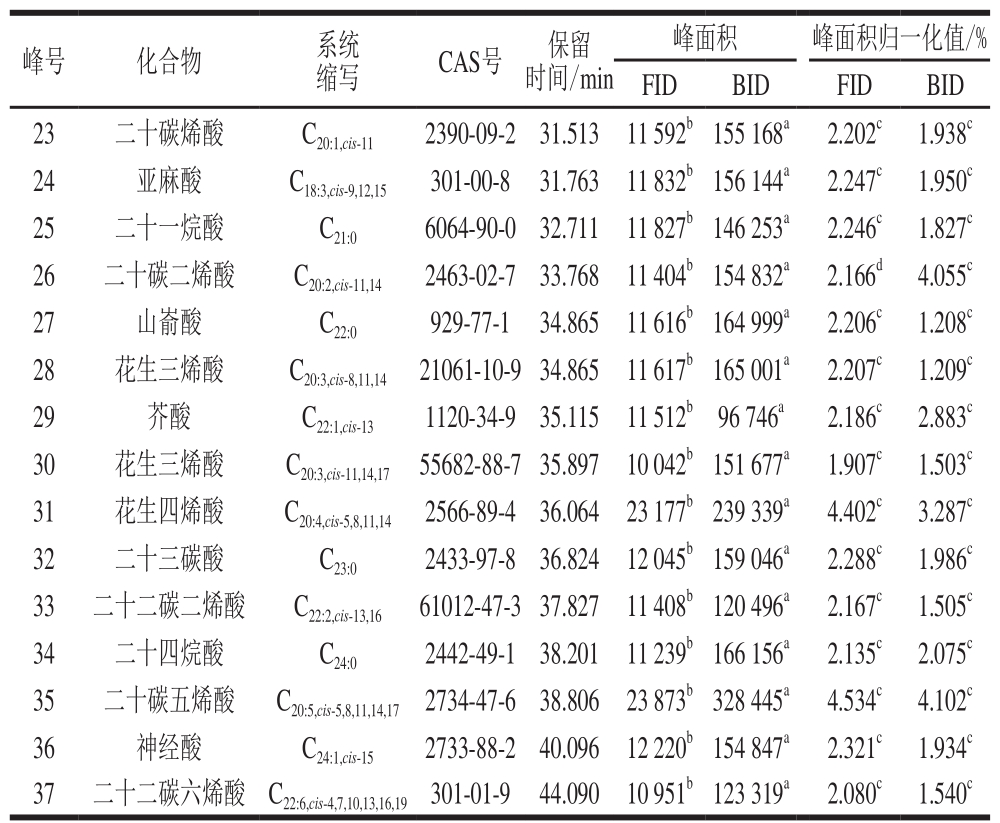
注:峰27和28由于无法分离采用峰面积平均化处理。同一指标同行不同小写字母表示差异显著(P<0.05)。
峰号 化合物 系统缩写 CAS号 保留时间/min峰面积 峰面积归一化值/%FID BID FID BID 23 二十碳烯酸 C20:1,cis-11 2390-09-2 31.513 11 592b155 168a 2.202c 1.938c 24 亚麻酸 C18:3,cis-9,12,15 301-00-8 31.763 11 832b156 144a 2.247c 1.950c 25 二十一烷酸 C21:0 6064-90-0 32.711 11 827b146 253a 2.246c 1.827c 26 二十碳二烯酸 C20:2,cis-11,14 2463-02-7 33.768 11 404b154 832a 2.166d 4.055c 27 山嵛酸 C22:0 929-77-1 34.865 11 616b164 999a 2.206c 1.208c 28 花生三烯酸 C20:3,cis-8,11,14 21061-10-934.865 11 617b165 001a 2.207c 1.209c 29 芥酸 C22:1,cis-131120-34-935.11511 512b96 746a2.186c2.883c 30 花生三烯酸 C20:3,cis-11,14,17 55682-88-735.897 10 042b151 677a 1.907c 1.503c 31 花生四烯酸 C20:4,cis-5,8,11,14 2566-89-4 36.064 23 177b239 339a 4.402c 3.287c 32 二十三碳酸 C23:0 2433-97-8 36.824 12 045b159 046a 2.288c 1.986c 33 二十二碳二烯酸 C22:2,cis-13,16 61012-47-337.827 11 408b120 496a 2.167c 1.505c 34 二十四烷酸 C24:0 2442-49-1 38.201 11 239b166 156a 2.135c 2.075c 35 二十碳五烯酸 C20:5,cis-5,8,11,14,17 2734-47-6 38.806 23 873b328 445a 4.534c 4.102c 36 神经酸 C24:1,cis-15 2733-88-2 40.096 12 220b154 847a 2.321c 1.934c 37 二十二碳六烯酸 C22:6,cis-4,7,10,13,16,19 301-01-9 44.090 10 951b123 319a 2.080c 1.540c
如表1所示,经各峰面积均值比较,BID较FID对各组分灵敏度均高出1 个数量级,部分组分信号响应比达到15 倍以上,为针对少量实际样品采用微型样品前处理方法检测提供前提条件。峰面积归一化结果表明,2 种检测器的测试准确性相当,说明BID对各组分响应能力相当,几乎无组分歧视。单因素方差分析结果表明,2 种检测器对各组分峰面积数据的差异均显著,对各组分峰面积归一化数据除花生酸和二十碳二烯酸外均差异不显著,对花生酸和二十碳二烯酸2 种组分的响应表现为增强,其原因可能在于BID对高碳数脂肪酸甲酯的离子化效率更高[15]。上述进一步说明BID对各组分响应灵敏度高且数据准确性好,证明采用BID建立脂肪酸含量测定方法具有可行性。
表 2 目标组分线性方程、相关系数和线性范围
Table 2 Linear equations, correlation coefficients and linear ranges for target components

峰号 组分 回归方程 相关系数r2线性范围/(µg/检测限/(µg/相对标准偏差/%1 棕榈酸 Y=920.12X+7.869 6 0.999 9 0.6~599.0 0.105 1.24 2 硬脂酸 Y=1 745.9X-0.173 9 0.999 8 0.2~200.8 0.137 1.26 3 油酸 Y=1 501.1X+0.483 1 0.999 7 0.4~399.0 0.153 1.19 4 亚油酸 Y=1 637.5X-0.147 7 0.999 9 0.4~400.0 0.142 1.04 5 γ-亚麻酸 Y=989.56X+4.466 1 0.999 8 0.2~200.1 0.196 1.35 6 α-亚麻酸 Y=1 437.1X+5.496 5 0.999 9 0.2~198.2 0.125 1.26 7 山嵛酸 Y=1 596.9X-4.369 7 0.999 7 0.2~199.0 0.134 1.28 8 二十碳五烯酸 Y=896.51X+3.411 2 0.999 6 0.4~399.0 0.159 1.34
由表2可知,BID对目标组分表现出较高的灵敏度和良好的线性响应范围。方法中各组分相对标准偏差在1.04%~1.35%之间,具有较高的重现性,证明采用微型样品前处理方法在BID高灵敏度的线性区间内具有较好的方法适应性。

图 2 绿豆样品的BID气相色谱图
Fig. 2 BID gas chromatography profile of mung bean sample
由图2可知,以峰面积归一化对各脂肪酸组成进行计算,结果显示被测绿豆样品中棕榈酸相对含量为(24.610±0.305)%,硬脂酸为(3.979±0.050)%,油酸为(9.010±0.107)%,亚油酸为(43.865±0.456)%,γ-亚麻酸为(0.162±0.002)%,α-亚麻酸为(16.818±0.212)%,山嵛酸为(1.266±0.016)%,二十碳五烯酸为(0.290±0.004)%,其中5 种含量较高的脂肪酸组分检测结果与前人的研究报道[6]相似。与前人研究方法比较,由于BID方法的高灵敏度,能够检测样品中微量组分如γ-亚麻酸等,可为相关研究提供更多组分信息。在进行大量样品检测应用后,证明所建方法可满足环境胁迫及化学调控下绿豆脂肪酸品质的检测要求,同时样品需求量及实际消耗量仅为常规方法的百分之一,同时由于采用简化的样品前处理方法,样品的检测效率也得到提高。
本研究基于BID气相色谱技术并采用微型样品前处理建立绿豆中脂肪酸组成测定方法,该方法检测器系统适应性强、灵敏度高、色谱柱组分分离选择性好[26-27]。与以往研究报道相比,由于采用高灵敏度检测器,能够测出原粮中5 种常见脂肪酸之外的3 种微量组分[28],且对微量组分检测的峰面积相对标准偏差均小于1.35%,证明其灵敏度和稳定性与质谱检测器相当[29];采用微型样品前处理所需固体样品量达到毫克级,能满足珍贵样品的分析检测[30],在实际应用中,本方法可实现单一绿豆植株不同结荚点内绿豆的脂肪酸组成分析,提高研究层次;实验试剂消耗少,所用甲酯化试剂及溶剂约为文献报道所用量5%~20%,且试剂为低值试剂,可节约分析成本[31];样品前处理流程简单、快速、通量高,单一样品前处理流程可在15 min内完成,提高了分析效率。本研究所建方法可为作物栽培、种质资源及食品科学研究提供技术保障,可拓宽BID的应用范围,为其在微量或痕量有机物分析方法学领域提供实践基础。
[1] 林伟静, 曾志红, 钟葵, 等. 不同品种绿豆的品质及饮料加工特性研究[J]. 核农学报, 2012, 26(4): 685-691.
[2] 蔡晓宁, 张来林, 陶琳岩. 不同储藏条件下绿豆品质变化规律研究[J]. 河南工业大学学报(自然科学版), 2016, 37(2): 16-21.DOI:10.16433/j.cnki.issn1673-2383.2016.02.004.
[3] 马秀杰. 间作对绿豆生物性状、产量和品质的影响[J]. 核农学报,2014, 28(3): 546-551. DOI:10.11869/j.issn.100-8551.2014.03.0546.
[4] TIAN Q, ZHANG W L, LI Q, et al. Research progress of quality characteristics and comprehensive utilization of mung beans[J].Agricultural Science & Technology, 2017, 18(1): 127-133; 136.DOI:10.16175/j.cnki.1009-4229.2017.01.029.
[5] 谢艳华, 谢靓, 李跑, 等. 豆类脂肪酸分析方法研究现状及进展[J]. 食品与机械, 2016, 32(12): 213-217. DOI:10.13652/j.issn.1003-5788.2016.12.046.
[6] 杨亚琴, 周其芳, 刘进玺, 等. 气相色谱法测定食用豆中主要脂肪酸含量[J]. 食品安全质量检测学报, 2017, 8(2): 574-578. DOI:10.3969/j.issn.2095-0381.2017.02.035.
[7] 范胜栩, 李斌, 孙君明, 等. 气相色谱法定量检测大豆5 种脂肪酸[J]. 中国油料作物学报, 2015(4): 548-553. DOI:10.7505/j.issn.1007-9084.2015.04.017.
[8] 田翔, 乔治军, 田琴, 等. 气相色谱-质谱法定性定量测定糜子中的脂肪酸[J]. 食品科学, 2016, 37(14): 128-131. DOI:10.7506/spkx1002-6630-201614022.
[9] 雷雨和, 眭玥, 骞宇, 等. 永川毛霉型豆豉中脂肪酸提取力法比较研究[J]. 中国调味品, 2014(5): 114-117. DOI:10.3969/j.issn.1000-9973.2014.05.030.
[10] 蒋立文, 郑兵福, 李白玉, 等. 四棱豆油脂、脂肪酸、蛋白质、氨基酸的分析[J]. 食品科学, 2010, 31(10): 231-234.
[11] 刘俊英, 谢国莉, 危晴, 等. 小米中脂肪酸的GC-MS法测定及营养价值分析[J]. 食品研究与开发, 2012, 33(2): 165-167; 168.DOI:10.3969/j.issn.1005-6521.2012.02.049.
[12] 王新新. 介质阻挡放电及其应用[J]. 高电压技术, 2009, 35(1): 1-11.
[13] KUNZE K, MICIEA M, FRANZKE J, et al. The dielectric barrier discharge as a detector for gas chromatography[J]. Spectrochimica Acta (Part B), 2003, 58: 1435-1443. DOI:10.1016/S0584-8547(03)00104-6.
[14] MIRABELLI M F, WOLF J C, ZENOBI R. Atmospheric pressure soft ionization for gas chromatography with dielectric barrier discharge ionization-mass spectrometry (GC-DBDI-MS)[J]. Analyst, 2017, 142:1909-1915. DOI:10.1039/c7an00245a.
[15] FRANCHINA F A, MAIMONE M, SCIARRONE D, et al. Evaluation of a novel helium ionization detector within the context of (low-) flow modulation comprehensive two-dimensional gas chromatography[J].Journal of Chromatography A, 2015, 1402: 102-109. DOI:10.1016/j.chroma.2015.05.013.
[16] ANSGAR T K, TORBEN L, STEFAN Z. A sensitive gas chromatography detector based on atmospheric pressure chemical ionization by a dielectric barrier discharge[J]. Journal of Chromatography A, 2017, 1483: 120-126.DOI:10.1016/j.chroma.2016.12.071.
[17] 洪欢欢, 赵鹏, 宁录胜, 等. 基于新型介质阻挡放电离子源的药物快速检测方法研究[J]. 分析化学, 2017, 45(10): 1529-1534.DOI:10.11895/j.issn.0253-3820.170360.
[18] 李福芬, 古锐帆, 孙赟珑, 等. 气相色谱法BID检测器上TO-14A VOCs标准气体分析方法的研究[J]. 低温与特气, 2014, 32(6): 37-42.DOI:10.3969/j.issn.1007-7804.2014.06.009.
[19] 刘慧, 时自立, 李峰. DID气相色谱法分析精丙烯中微量永久性气体杂质[J]. 河南化工, 2015, 32: 54-57. DOI:10.14173/j.cnki.hnhg.2015.08.015.
[20] 方华, 周朋云, 庄鸿涛. 氦离子化检测器(PDHID)与火焰离子化检测器(FID)在高纯气体分析中的性能比较[J]. 低温与特气, 2011, 29(1):33-42. DOI:10.3969/j.issn.1007-7804.2011.01.010.
[21] 刘晓红, 于大秋, 任越, 等. 脉冲放电氦离子化气相色谱仪在特种气体分析中的应用[J]. 低温与特气, 2016, 34(1): 32-38. DOI:10.3969/j.issn.1007-7804.2016.01.008.
[22] 李富勇, 郭东方, 金伟, 等. 气相色谱用氦等离子体离子化检测器研究进展[J]. 分析科学学报, 2012, 28(2): 279-284.
[23] 田肖丹, 杨文军, 刘淼, 等. 气相色谱用氦直流等离子体离子化检测器的研究[J]. 化学学报, 1996, 54(7): 691-696. DOI:10.3969/j.issn.1006-3536.2009.05.023.
[24] 田甜, 武俊瑞, 岳喜庆, 等. 传统豆酱中脂肪酸酯化方法的选择与组成分析[J]. 食品科学, 2014, 35(18): 78-83. DOI:10.7506/spkx1002-6630-201418015.
[25] 张耀广, 王玉英, 柴艳兵, 等. GC-MS法测定生鲜牛乳脂肪酸组成及含量的研究[J]. 食品研究与开发, 2015, 36(13): 99-102.DOI:10.3969/j.issn.1005-6521.2015.13.028.
[26] 黄丽, 李金林, 王楚芳, 等. 婴幼儿配方谷粉中多组分反式脂肪酸的同步测定[J]. 食品与机械, 2018, 34(2): 57-57; 137. DOI:10.13652/j.issn.1003-5788.2018.02.012.
[27] 杨晓琴, 黄元波, 郑云武, 等. 水红木果油的超声辅助提取与脂肪酸组成研究[J]. 西南林业大学学报, 2018, 38(1): 169-174.DOI:10.11929/j.issn.2095-1914.2018.01.026.
[28] 陈展宇, 常雨婷, 付良帅, 等. 新老大豆品种不同冠层籽粒脂肪酸含量与叶片光合速率研究[J]. 西北农林科技大学学报(自然科学版),2018, 46(1): 95-102. DOI:10.13207/j.cnki.jnwafu.2018.01.013.
[29] 钱宗耀, 刘河疆, 张维维, 等. 气质联用-内标法测定豆类中脂肪酸含量及因子分析[J]. 中国粮油学报, 2017, 32(2): 130-134; 139.DOI:10.3969/j.issn.1003-0174.2017.02.023.
[30] 谢庆方, 张丽霞, 张振山. 不同品种红麻籽油的品质及微量成分分析[J]. 河南工业大学学报(自然科学版), 2018, 39(1): 39-44.DOI:10.16433/j.cnki.issn1673-2383.2018.01.007.
[31] 庄海旗, 刘江琴, 崔燎, 等. 南海海域8 种金线鱼肌肉的脂肪酸分析[J]. 现代食品科技, 2018, 34(3): 218-225. DOI:10.13982/j.mfst.1673-9078.2018.03.032.
Determination of Fatty Acids in Mung Bean by Gas Chromatography with Dielectric Barrier Discharge Ionization Detector
贾鹏禹, 孙蕊, 赵晶晶, 等. 介质阻挡放电氦等离子体-气相色谱测定绿豆中脂肪酸含量[J]. 食品科学, 2019, 40(8):119-123. DOI:10.7506/spkx1002-6630-20180430-392. http://www.spkx.net.cn
JIA Pengyu, SUN Rui, ZHAO Jingjing, et al. Determination of fatty acids in mung bean by gas chromatography with dielectric barrier discharge ionization detector[J]. Food Science, 2019, 40(8): 119-123. (in Chinese with English abstract)