
图 1 甲醇体积分数对苯丙素类成分提取率的影响
Fig. 1 Effect of MeOH concentration on the yield of phenylpropanoids
杜仲(Eucommia ulmoides Oliv.)为杜仲科杜仲属植物,现已收入我国药食同源管理系统,已被世界许多国家引用栽培,供保健、药用和观赏[1]。《神农本草经》《本草纲目》《本草经集注》等典籍中就记载了杜仲的保健功能。传统上以杜仲皮为保健原料,由于当杜仲的生长年限到达20 a左右,其杜仲皮才更具有保健功效[2],而杜仲剥皮会导致树木死亡[3],严重破坏我国二级保护植物杜仲资源。为解决当前杜仲树皮资源问题,急需探索杜仲其他药用部位中的相似活性成分。近期报道发现,杜仲叶中富含的苯丙素类成分具有广泛的降压、抗菌、抗病毒、抗肿瘤、抗氧化、强筋健骨、增加胃肠蠕动和促进胃液分泌的药理作用[4-6]。目前针对杜仲中木脂素类、黄酮类活性成分的检测分析方法较多[7-11],而针对杜仲中苯丙素类成分的研究相对较少[12]。苯丙素作为杜仲中主要活性成分,不同药用部位含量不同,具有一定的开发价值[13-14]。有研究报道称杜仲叶中的绿原酸含量远高于杜仲干皮[15-16],但鲜见对不同生长年限的杜仲叶、干皮中一系列苯丙素类成分的含量进行比较研究。因此,本实验建立同时测定杜仲中的绿原酸、咖啡酸、原儿茶酸、松柏苷、紫丁香苷5 种苯丙素类活性成分的高效液相色谱(high performance liquid chromatography,HPLC)法,分别测定树龄为16、18、20、22、24 a的杜仲叶与杜仲干皮2 种部位中绿原酸、咖啡酸、原儿茶酸、松柏苷、紫丁香苷5 种苯丙素类成分含量,为药食同源植物的质量控制指标提供依据,并为其开发研究提供一定的参考价值。
生长年限分别为16、18、20、22、24 a的杜仲叶、杜仲干皮样品来自陕西省汉中市略阳县国家杜仲良种基地。
标准品:紫丁香苷、绿原酸、咖啡酸(纯度>98%)中国药品生物制品检定所;原儿茶酸(纯度>98%)大连美仑生物技术有限公司;松柏苷(纯度≥98%)上海源叶生物科技有限公司;乙腈为色谱纯;实验用水为去离子水;其他所用试剂均为分析纯。
LC-20A HPLC仪(包括SPD-20A紫外检测器)日本岛津公司;KQ2200D型数控超声波清洗器 昆山市超声仪器有限公司;DFT-50手提式高速万能粉碎机温岭市林大机械有限公司;Unique-LC R20多功能超纯水系统 厦门锐思捷水纯化技术有限公司;D3024R高速冷冻离心机 大龙兴创实验仪器有限公司;BS124S型分析天平 赛多利斯科学仪器有限公司。
1.3.1 超声辅助法提取苯丙素类成分的单因素试验
因绿原酸、咖啡酸、原儿茶酸、松柏苷、紫丁香苷5 种苯丙素类活性成分极性较大,通常可选择甲醇、乙醇或水进行提取,为将苯丙素类成分提取全面,选择极性相对较大的甲醇作为提取溶剂。分别对甲醇体积分数、超声提取时间、料液比进行单因素试验,考察各因素对杜仲中苯丙素类成分含量提取率的影响[17-19]。
1.3.1.1 甲醇体积分数对杜仲样品中苯丙素类成分提取率的影响
分别精密称取4 份杜仲样品20 g,分别加入体积分数25%、50%、75%、100%甲醇溶液,料液比为1∶10(g/mL),超声提取30 min,以杜仲中苯丙素类成分提取率之和为考察指标,考察甲醇体积分数对杜仲中苯丙素类成分提取率的影响。
1.3.1.2 超声提取时间对杜仲样品中苯丙素类成分提取率的影响
分别精密称取4 份杜仲样品20 g,加入体积分数100%甲醇溶液,料液比为1∶10(g/mL),超声提取15、30、45、60 min,以杜仲中苯丙素类成分提取率之和为考察指标,考察超声提取时间对杜仲中苯丙素类成分提取率的影响。
1.3.1.3 料液比对杜仲样品中苯丙素类成分提取率的影响
分别精密称取4 份杜仲样品20 g,加入体积分数100%甲醇溶液,料液比分别为1∶5、1∶10、1∶15、1∶20(g/mL),超声提取30 min,以杜仲中苯丙素类成分提取率之和为考察指标,考察料液比对杜仲中苯丙素类成分提取率的影响。
1.3.2 苯丙素类成分HPLC测定
1.3.2.1 色谱条件
色谱柱:HiQ Sil C18(250 mm×4.6 mm,5 μm);流动相为0.2%甲酸溶液(A)-乙腈(B);梯度洗脱程序:0~12 min,4%~12% B;12~35 min,12%~14% B;流速1.0 mL/min;柱温25 ℃;检测波长277 nm;进样量5 μL。
1.3.2.2 混合标准品溶液的制备
分别精密称取绿原酸、咖啡酸、原儿茶酸、松柏苷、紫丁香苷标准品适量,用无水甲醇溶解,配制成1 mg/mL的混合标准品溶液。
1.3.2.3 供试品溶液的制备
分别精密称取粉碎后的杜仲叶、杜仲干皮粉末1.0 g,加入10 mL无水甲醇超声提取30 min,过滤,保留滤液。滤渣再次加入10 mL无水甲醇超声提取30 min,过滤,合并滤液,混匀。分别从各合并滤液中吸取1 mL,12 000 r/min离心10 min,取上清液即得。
1.3.2.4 方法学考察
用R studio软件Tidyverse包,对所得数据进行可视化处理及统计分析。
苯丙素类是广泛存在于药用植物中的天然产物,具有非常丰富的生理活性,尤其具有降压、抗炎、抗肿瘤、抗氧化等药理活性[22]。杜仲中苯丙素类成分功能已经成为天然降压、抗炎保健食品的重要来源[23],现已成为众多植物学家,药物化学家的重点研究对象。绿原酸、咖啡酸、松柏苷、原儿茶酸、紫丁香苷为杜仲中苯丙素类代表性成分,并且这5 种成分也是其他某些药用植物的质量控制标准。其中绿原酸、咖啡酸、原儿茶酸的降压、抗菌抗炎活性机制已有大量研究报道[24-28]。因此本实验选择以上5种苯丙素类成分为测量指标,研究不同生长年限杜仲叶、杜仲干皮中苯丙素类成分含量,为杜仲的开发研究提供一定的参考价值。根据大部分研究报道可知,建立测定杜仲中绿原酸含量的HPLC方法相对较多,针对性建立测量杜仲中一系列苯丙素类成分的HPLC方法却很罕见,本实验的检测方法对于富含这5 种苯丙素类成分的天然药物质量评价、含量分析具有一定的参考价值。
线性关系:取1.3.2.2节原儿茶酸、松柏苷、紫丁香苷、绿原酸、咖啡酸的混合标准品溶液,精密梯度稀释成质量浓度分别为1、0.1、0.01、0.001、0.000 1 mg/mL的含有5 种苯丙素类成分的混合标准品溶液,在1.3.2.1节色谱条件下进样,进样量为5 µL,以标准品质量浓度X(mg/mL)为横坐标,色谱峰峰面积Y为纵坐标,绘制标准曲线。
精密度:将1.3.2.2节混合标准品溶液梯度稀释成低、中、高3 种不同质量浓度(0.01、0.1、1 mg/mL)的供试品溶液,并连续进样5 次,每次5 μL,按1.3.2.1节HPLC条件测定峰面积,分别计算各成分峰面积的相对标准偏差。
稳定性:取同一供试品溶液,分别于0、4、8、12、16、20、24 h进样5 µL,按1.3.2.1节HPLC条件测定峰面积,分别计算各成分峰面积的相对标准偏差。
重复性:分别称取杜仲叶、干皮粉末各5 份,按1.3.2.3节方法制备供试品溶液(n=3),按1.3.2.1节HPLC条件测定峰面积,计算各成分峰面积相对标准偏差。
加标回收率:称取已知含量的杜仲叶粉末适量,共6 份,按1.3.2.3节方法平行制备供试品溶液,精密称取10 mL供试品溶液,分别适量加入1.3.2.2节混合标准品溶液,按1.3.2.1节HPLC条件进样测定,计算原儿茶酸、松柏苷、紫丁香苷、绿原酸、咖啡酸的加标回收率与相对标准偏差[20-21]。
1.3.2.5 样品测定
将经过1.3.2.3节方法处理的各供试品溶液应用1.3.2.1节色谱条件进行HPLC测定,进样量为5 μL,应用外标法测定含量。
2.2.1 甲醇体积分数的影响

图 1 甲醇体积分数对苯丙素类成分提取率的影响
Fig. 1 Effect of MeOH concentration on the yield of phenylpropanoids
由图1可知,甲醇体积分数对杜仲中苯丙素类成分提取率影响较大,随甲醇体积分数的增加,苯丙素类成分提取率随之增加,且在甲醇体积分数为100%时,苯丙素类成分提取率最大。所以选择100%甲醇溶液作为提取溶液。
2.2.2 超声提取时间的影响
由图2可知,超声提取时间对杜仲中苯丙素类成分提取率影响较大,随超声提取时间的延长,苯丙素类成分提取率随之增加,且在超声提取时间为30 min时,苯丙素类成分提取率最大,可得最佳超声提取时间为30 min。

图 2 超声提取时间对苯丙素类成分提取率的影响
Fig. 2 Effect of extraction time on the yield of phenylpropanoids
2.2.3 料液比的影响
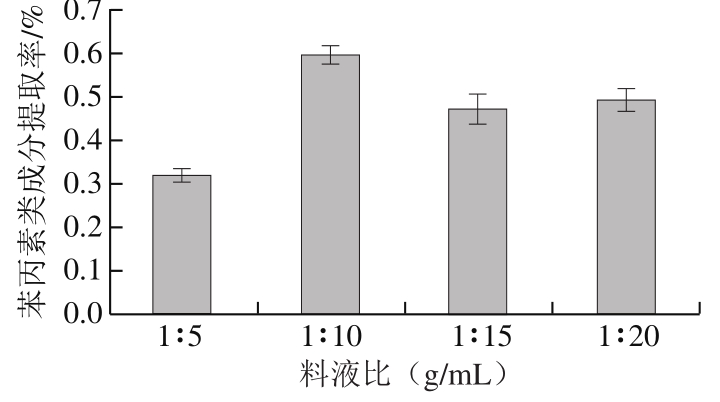
图 3 料液比对苯丙素类成分提取率的影响
Fig. 3 Effect of solid to solvent ratio on the yield of phenylpropanoids
由图3可知,随着溶剂量的增加,苯丙素类成分提取率呈增加趋势。当料液比为1∶10(g/mL)时,提取率达到最大值,当溶剂量继续增加时提取率呈下降趋势,可得最佳料液比为1∶10(g/mL)。
2.3.1 色谱条件选择结果
本实验通过借鉴测定杜仲中绿原酸含量HPLC方法[29-30],建立1.3.2.1节色谱条件。实验过程中发现选择甲醇为流动相时,5 种成分的色谱峰出现堆积现象,于是选择极性更大的乙腈作为流动相。在流动相A的选择上,实验初期存在峰后拖现象,于是将流动相A在0.1%甲酸的基础上改为0.2%甲酸后,峰拖尾现象明显改善。实验结果表明,在最终HPLC条件下各色谱峰分离效果最佳。
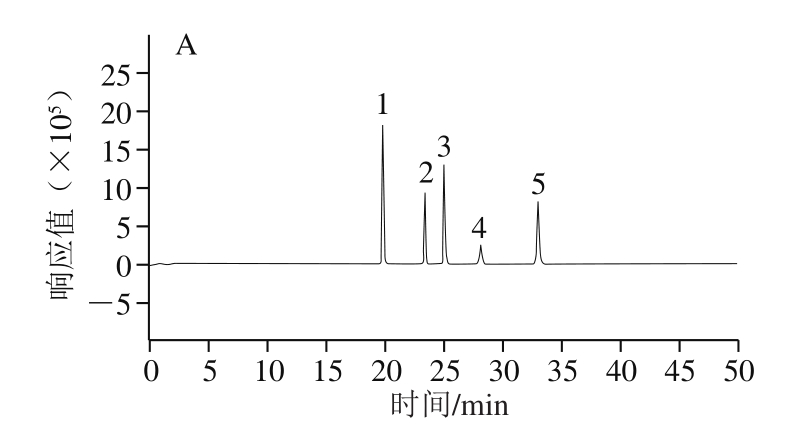
2.3.2 HPLC分析
如图4所示,杜仲叶、干皮样品中5 种苯丙素成分分离度良好,基线平稳,出峰完全且峰形规范。
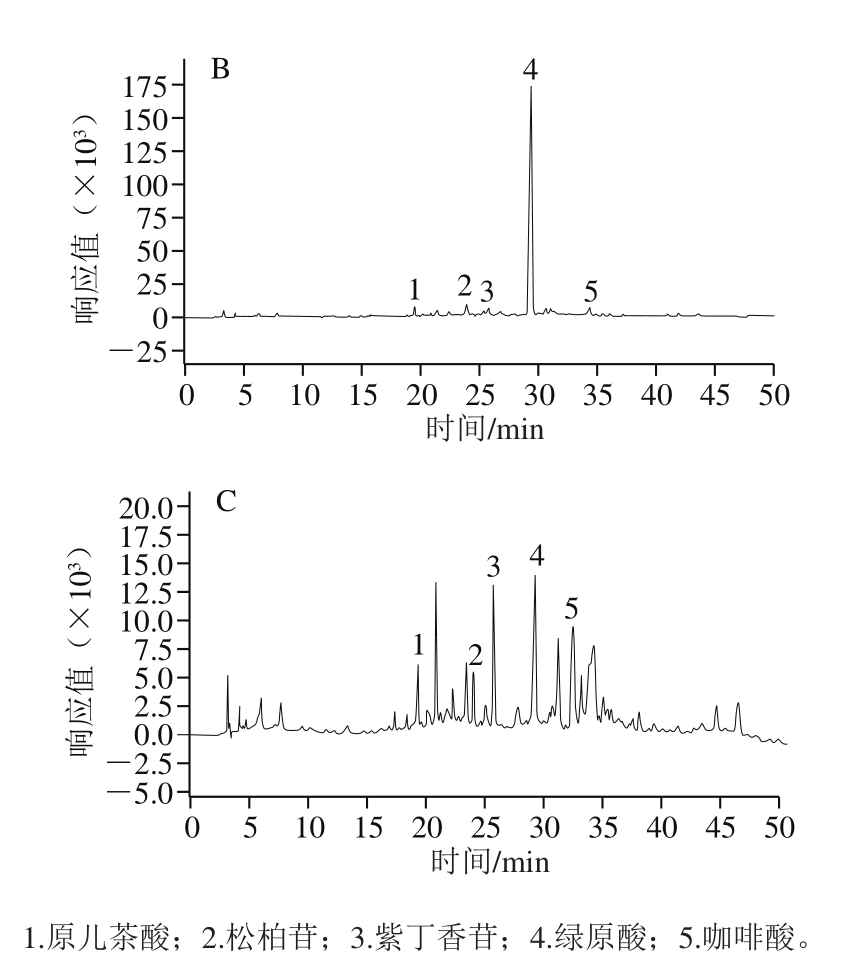
图 4 混合标准品(A)、杜仲叶样品(B)、杜仲干皮样品(C)的
HPLC图
Fig. 4 HPLC chromatograms of standard mixture (A), E. ulmoides Oliv. leaves (B), and barks (C)
2.3.3 方法学考察结果
2.3.3.1 线性关系
由表1可知,各苯丙素类成分在各自线性范围内线性关系良好。
表 1 5 种成分的线性关系
Table 1 Linear relationships of five phenylpropanoids

成分 波长/nm 线性方程 R2 线性范围/(mg/mL)原儿茶酸 277 y=0.969 3x+7.338 0 0.998 9 0.001 6~0.04松柏苷 277 y=0.957 7x+6.943 2 0.998 7 0.008~0.04紫丁香苷 277 y=0.958 7x+7.175 1 0.998 6 0.013~0.029绿原酸 277 y=1.016 7x+6.614 7 0.999 7 0.04~1咖啡酸 277 y=0.929 9x+7.124 3 0.994 0 0.001 6~0.029
2.3.3.2 精密度
结果显示,低质量浓度组中绿原酸、松柏苷、原儿茶酸、紫丁香苷、咖啡酸峰面积相对标准偏差分别为0.89%、1.43%、2.87%、2.09%、4.15%;中质量浓度组中绿原酸、松柏苷、原儿茶酸、紫丁香苷、咖啡酸峰面积相对标准偏差分别为1.76%、2.88%、1.09%、3.25%、2.87%;高质量浓度组中绿原酸、松柏苷、原儿茶酸、紫丁香苷、咖啡酸峰面积相对标准偏差分别为4.31%、0.98%、2.87%、1.23%、3.28%,表明分析方法的精密度良好。
2.3.3.3 稳定性
结果显示绿原酸、松柏苷、原儿茶酸、紫丁香苷、咖啡酸峰面积相对标准偏差分别为0.78%、1.55%、0.99%、2.35%、0.98%,说明样品在24 h内稳定。
2.3.3.4 重复性
结果显示,原儿茶酸、松柏苷、紫丁香苷、绿原酸、咖啡酸峰面积相对标准偏差分别为0.53%、0.97%、1.12%、1.44%、0.67%。表明该方法重复性较好。
2.3.3.5 加标回收率
根据1.3.2.4节方法学考察中加标回收率考察方法,计算原儿茶酸、松柏苷、紫丁香苷、绿原酸、咖啡酸的加标回收率与相对标准偏差,结果如表2所示,此方法具有较好的检测性能。
表 2 回收率实验结果
Table 2 Results of recovery tests
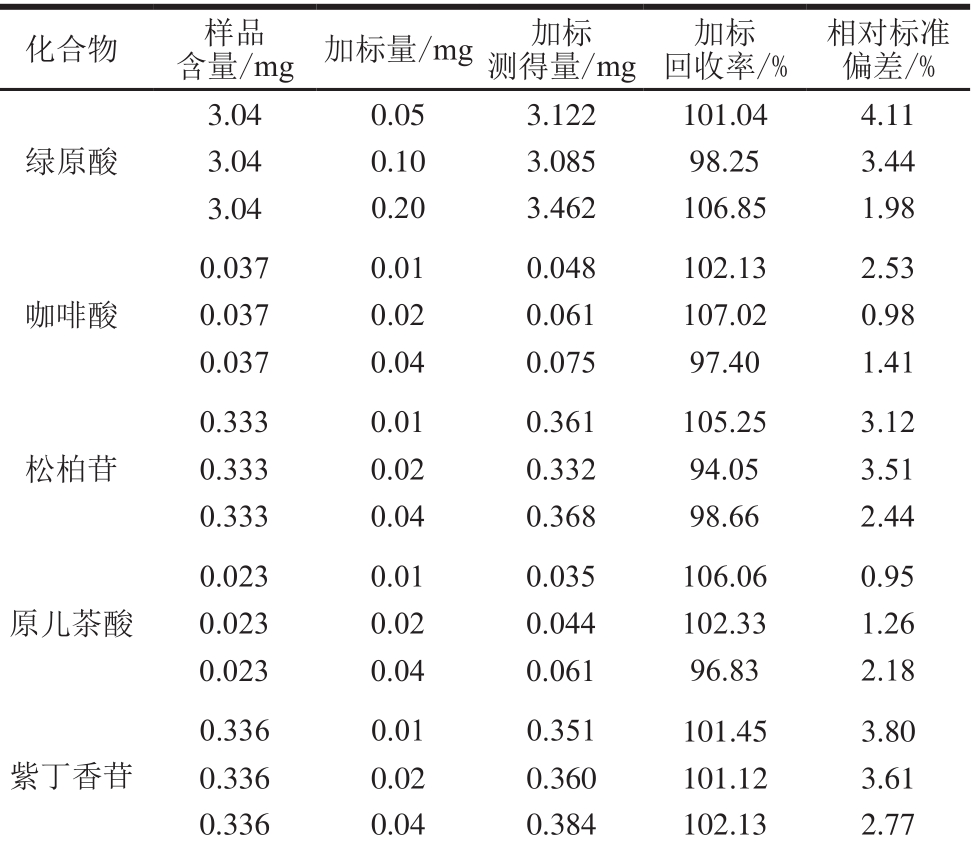
化合物 样品含量/mg加标量/mg加标测得量/mg加标回收率/%相对标准偏差/%绿原酸3.04 0.05 3.122 101.04 4.11 3.04 0.10 3.085 98.25 3.44 3.04 0.20 3.462 106.85 1.98咖啡酸0.037 0.01 0.048 102.13 2.53 0.037 0.02 0.061 107.02 0.98 0.037 0.04 0.075 97.40 1.41松柏苷0.333 0.01 0.361 105.25 3.12 0.333 0.02 0.332 94.05 3.51 0.333 0.04 0.368 98.66 2.44原儿茶酸0.023 0.01 0.035 106.06 0.95 0.023 0.02 0.044 102.33 1.26 0.023 0.04 0.061 96.83 2.18紫丁香苷0.336 0.01 0.351 101.45 3.80 0.336 0.02 0.360 101.12 3.61 0.336 0.04 0.384 102.13 2.77
取树龄为16、18、20、22、24 a的杜仲叶、杜仲干皮样品,按1.3.2.3节方法分别制备供试品溶液,后采用1.3.2.1节HPLC条件进行测定(n=3),取平均值后,根据2.3.3.1节各成分的标准曲线计算5 种苯丙素类成分的含量,如表3所示。
表 3 不同生长年限杜仲叶、干皮5 种苯丙素类成分测定结果Table 3 Contents of 5 phenylpropanoids in E. ulmoides Oliv. leaves and barks in various growing years
μg/g

苯丙素类成分16 a 18 a 20 a 22 a 24 a叶 干皮 叶 干皮 叶 干皮 叶 干皮 叶 干皮绿原酸 3 039.89 83.94 730.79 141.66 1 867.44 28.58 1901.44 28.51 4 600.0042.28原儿茶酸 2.63 8.9 6.48 20.64 7.32 1.71 19.63 22.63 15.66 20.52松柏苷 101.60 80.24 607.42 141.52 88.14 37.81 56.39 45.86 333.49 28.50紫丁香苷 336.36 98.16 312.66 13.36 501.22 110.49 191.00 101.08 157.01 12.89咖啡酸 5.23 15.48 8.48 2.42 9.49 7.18 23.89 6.71 36.82 18.24
为使各样品中5 种苯丙素类成分含量数据更便于比较,使用R语言Tidyverse包将表3中数据进行可视化处理。由于不同药用部位杜仲样品中的苯丙素类成分含量差距巨大,于是将所有含量结果进行取对数(lg)运算,如图5所示。
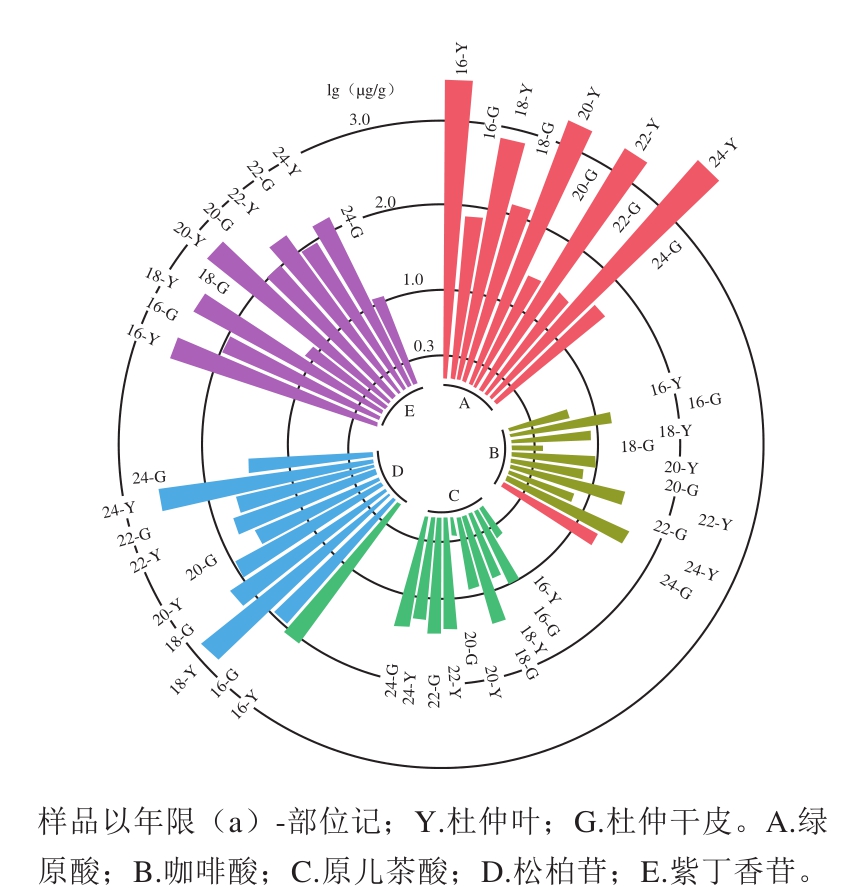
图 5 杜仲样品中5 种苯丙素类活性成分含量的环状柱形图Fig. 5 Circular barplot of contents of 5 phenyl compounds in E. ulmoides Oliv. samples
研究表明,杜仲叶、干皮中均含有这5 种苯丙素类化合物,但其含有量差别较大。由图5可知,绿原酸在杜仲叶与杜仲干皮中含量差异尤为明显(P<0.01),杜仲叶中的绿原酸含量平均约为杜仲干皮中的57 倍;杜仲叶中松柏苷、紫丁香苷含量约为杜仲干皮的1.24、9.19 倍;咖啡酸、原儿茶酸在杜仲叶、干皮中含量均较低,且含量差距不大,咖啡酸在杜仲叶中含量约为干皮的2.4 倍,而杜仲干皮中的原儿茶酸含量大部分要高于杜仲叶。杜仲叶中的多数苯丙素类成分含量存在远高于杜仲干皮的现象。因为各生长年限的杜仲叶、杜仲干皮中均含有这5 类具有降压、抗炎作用的苯丙素类活性成分,且杜仲叶中的5 种苯丙素类活性成分总量高于杜仲干皮,所以在抗炎杀菌、降压药物使用上,可以考虑使用杜仲叶代替杜仲干皮。
以HPLC法同时测定杜仲中绿源酸、咖啡酸、原儿茶酸、松柏苷、紫丁香苷5 种苯丙素类成分含量,建立HPLC含量测定方法,此分析方法精密度、稳定性、重复性好,可作为杜仲中5 种苯丙素类成分的检测方法,为杜仲的综合利用和深度开发提供质量控制参考依据。由于各生长年限的杜仲叶与杜仲干皮中均含有这5 类活性成分,且杜仲叶与杜仲干皮中的成分含量存在明显不同,这在将杜仲应用于抗炎杀菌、降压、强筋健骨保健品的开发上应当注意。因为杜仲叶中苯丙素类成分含量较高,且杜仲叶为可再生资源,所以可进一步考虑有关杜仲叶的研究与开发。
[1] 李世全. 杜仲药用价值的研究与开发[J]. 中国现代中药, 1999(1):25-26. DOI:10.13313/j.issn.1673-4890.1999.01.010.
[2] 王丽楠, 杨美华. 不同部位、不同生长年限杜仲有效成分的含量变化(摘要)[C]//全国天然药物资源学术研讨会. 2008.
[3] 余椿生, 常效琳. 杜仲大面积环状剥皮后树皮再生的解剖学初步观察[J]. 中药材科技, 1979(4): 15-19. DOI:10.13863/j.issn1001-4454.1979.04.004.
[4] ZHU M J, CAI C F, TAN N H, et al. Anti-fatigue effects of extracts from Pedicularis densispica Franch on exercise mice[J].Natural Product Research and Development, 2012, 24: 1545-1548.DOI:10.16333/j.1001-6880.2012.11.009.
[5] CAI R L, YANG M H, SHI Y, et al. Antifatigue activity of phenylethanoid-rich extract from Cistanche deserticola[J].Phytotherapy Research, 2010, 24(2): 313-315. DOI:10.1002/ptr.2927.
[6] 王娟娟, 秦雪梅, 高晓霞, 等. 杜仲化学成分、药理活性和质量控制现状研究进展[J]. 中草药, 2017, 48(15): 3228-3237. DOI:10.7501/j.issn.0253-2670.2017.15.031.
[7] 周云雷, 郭婕, 王志宏, 等. HPLC法同时测定矮林杜仲叶中6 种成分含量[J]. 中药材, 2015, 38(3): 540-543. DOI:10.13863/j.issn1001-4454.2015.03.029.
[8] 魏薇, 王建刚. HPLC测定不同树龄杜仲叶中黄酮类成分的含量[J].安徽农业科学, 2011, 39(18): 10779-10781. DOI:10.3969/j.issn.0517-6611.2011.18.020.
[9] 陈晓青. 液相色谱方法用于复杂体系的分离分析研究[D]. 长沙:中南大学, 2006.
[10] 曹宇. 杜仲盐炙的化学成分和质量研究[D]. 沈阳: 辽宁中医药大学,2009.
[11] 何峰, 王永林, 郑林, 等. UPLC-PDA-ESI-MS分析杜仲中化学成分[J]. 中国实验方剂学杂志, 2014, 20(3): 59-62. DOI:10.11653/syfj2014030059.
[12] LUO X, MA M, CHEN B, et al. Analysis of nine bioactive compounds in Eucommia ulmoides Oliv. and their preparation by HPLC-photodiode array detection and mass spectrometry[J]. Journal of Liquid Chromatography & Related Technologies, 2004, 27(1): 63-81.DOI:10.1081/JLC-120027086.
[13] YUAN P F, MA Y J, SU D, et al. Quantification of seven phenylpropanoid compouds in Chinese cinnamomi crotex and ramulus by HPLC[J]. Journal of Chinese Pharmaceutical Sciences, 2015(9):591-599. DOI:10.5246/jcps.2015.09.075.
[14] 褚洪标, 张志华, 陈冬, 等. 大王马先蒿苯丙素类含量测定及有效部位抗疲劳活性研究[J]. 天然产物研究与开发, 2016(5): 754-760.DOI:10.16333 /j.1001-6880.2016.5.021.
[15] CHEN X J, ZHOU C S, WEI W. The comparison between different extractions of chlorogenic acid and flavonoid in Eucommia ulmoides Olive[J]. Chinese Journal of Biochemical Pharmaceutics, 2006, 27(1):38-40. DOI:10.3969/j.issn.1005-1678.2006.01.012.
[16] 陈乃炽, 汪洪武, 刘艳清, 等. 杜仲叶中绿原酸的提取与含量测定[J]. 经济林研究, 2001(2): 59-61. DOI:10.14067/j.cnki.1003-8981.2001.02.021.
[17] 陈海莉. 杜仲叶提取物制备工艺及质量标准研究[D]. 开封: 河南大学, 2014.
[18] 许先猛, 董文宾. 杜仲叶总黄酮的超声提取工艺[J]. 食品研究与开发, 2010, 31(12): 15-18. DOI:10.3969/j.issn.1005-6521.2010.12.005.
[19] 齐惠丽, 赵广荣, 李东. 杜仲叶中绿原酸的超声提取工艺研究[J].西北药学杂志, 2007, 22(6): 300-301. DOI:10.3969/j.issn.1004-2407.2007.06.008.
[20] 龙文静, 张盛, 袁玲, 等. 反相高效液相色谱法同时测定咖啡豆中的6 种酚酸类化合物[J]. 色谱, 2011, 29(5): 439-442. DOI:10.3724/SP.J.1123.2011.00439.
[21] 马伟, 曾里, 程健, 等. HPLC法测定杜仲茶中车叶草苷含量的研究[J].食品与发酵科技, 2016, 52(3): 93-96. DOI:10.3969/j.issn.1674-506X.2016.03-022.
[22] 项丽玲, 温亚娟, 苗明三. 杜仲叶的化学、药理及临床应用分析[J]. 中医学报, 2017, 32(1): 99-102. DOI:10.16368/j.issn.1674-8999.2017.01.024.
[23] 姜凌宇, 姜月华, 郭金昊, 等. 杜仲治疗高血压研究进展[J].山东中医杂志, 2017(3): 249-252. DOI:10.16295/j.cnki.0257-358x.2017.03.023.
[24] 潘梓烨, 常念伟, 周梦鸽, 等. 桑菊饮抗炎活性成分筛选与单体验证[J]. 中草药, 2016, 47(8): 1289-1296. DOI:10.7501/j.issn.0253-2670.2016.08.007.
[25] 刘静. 忍冬藤注射液制剂的研究[D]. 长春: 吉林大学, 2013.
[26] 骆成尧. 绿原酸与咖啡酸体外代谢机制及相互作用研究[D]. 南昌:南昌大学, 2012.
[27] 宋亚玲, 王红梅, 倪付勇, 等. 金银花中酚酸类成分及其抗炎活性研究[J]. 中草药, 2015, 46(4): 490-495. DOI:10.7501/j.issn.0253-2670.2015.04.006.
[28] 周英, 李敏, 杨付梅, 等. 绿原酸、咖啡酸、阿魏酸对微血管内皮细胞的损伤作用[J]. 中国药理学通报, 2016, 32(10): 1474-1475.DOI:10.3969/j.issn.1001-1978.2016.10.027.
[29] 戚向阳, 陈维军, 张声华. 反相高效液相色谱法测定杜仲中京尼平苷、京尼平苷酸及绿原酸的含量[J]. 药物分析杂志, 2000(1): 22-24.DOI:10.1007/s11769-000-0028-3.
[30] 薛晓丽. 高效液相色谱法测定金银花中绿原酸的含量[J]. 江苏农业科学, 2010(2): 296-297. DOI:10.3969/j.issn.1002-1302.2010.02.122.
Simultaneous Determination of Five Phenylpropanoids in Eucommia ulmoides Oliv. from Different Ages and Parts by HPLC