2 种蛋白酶酶解曲拉干酪素条件优化及抗氧化性比较
刘倩霞,刘 东,张 俊,王 娇,何兴芬,杨富民*,赵保堂*
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
摘 要:以曲拉干酪素为原料、水解度为指标,在酶解时间、酶解温度、pH值、曲拉干酪素质量浓度、酶添加量单因素试验基础上,采用响应面试验对碱性蛋白酶和胰蛋白酶酶解工艺条件进行优化,并对2 种酶解液的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、超氧阴离子自由基、羟自由基清除率,Fe2+、Cu2+螯合能力和还原力等抗氧化性指标进行比较。结果表明,碱性蛋白酶和胰蛋白酶分别在酶解时间3.8、2.5 h,酶解温度49.8、47.8 ℃,曲拉干酪素质量浓度60、35 g/L,pH 8.5、7.5,酶添加量140、2 900 U/g时水解度最大,为24.25%和13.57%。碱性蛋白酶解液超氧阴离子自由基清除率、Fe2+螯合能力显著低于胰蛋白酶解液(P<0.01);羟自由基清除能力高于胰蛋白酶解液(P>0.05);2 种蛋白酶酶解液在酶解液质量浓度1~5 mg/mL时,Cu2+螯合能力、DPPH自由基清除率和还原力随质量浓度均呈上升趋势,Cu2+螯合能力低于Fe2+螯合能力(P>0.05),DPPH自由基清除率和还原力二者差异显著(P<0.01)。2 种蛋白酶对酶解物抗氧化性指标影响不同,碱性蛋白酶酶解物抗氧化性相对较优。
关键词:曲拉干酪素;碱性蛋白酶;胰蛋白酶;酶解工艺;抗氧化性
牦牛乳与其他牛乳相比,其营养成分如蛋白质、脂肪、乳糖等含量较高[1]。曲拉是牧民将牦牛乳采用简单方法脱脂后,在自然条件下微生物发酵产酸[2],使酪蛋白凝固、结块、风干后的产品,亦称为粗奶酪[3]。曲拉除当作食物外,主要用于干酪素和酪朊酸盐等的生产[4]。曲拉干酪素产品通常作为一种天然的食品添加剂和营养改良剂应用于食品和医药行业[5],在精细化工行业也有广泛应用,如化妆品、合成染料以及香料香精等,也可作为接触剂、组织改良剂、增光剂等[6]。随着曲拉干酪素用途的扩展,对于某些特定品质和功能,如抗氧化性等的要求也不断提高。研究表明,选择适当的蛋白酶水解多肽,可制备多种生物活性肽,提高产品的附加值[7]。蛋白质水解产物的抗氧化活性取决于蛋白酶的种类和水解条件,由于酶的特异性,将产生不同的小肽和游离氨基酸。游离氨基酸和肽段的大小、水平和组成的变化影响抗氧化性。大豆蛋白、乳清蛋白、小麦蛋白等不同来源的蛋白水解物具有良好的抗氧化能力[8-10],但有关牦牛曲拉酶解产物抗氧化性的研究报道较少。为探讨甘南夏河藏区曲拉酶解产物的抗氧化性,以碱性蛋白酶和胰蛋白酶作为水解酶,以水解度为指标,采用响应面法优化2 种蛋白酶酶解曲拉干酪素的条件,通过测定酶解产物超氧阴离子自由基、羟自由基清除率等抗氧化性指标比较2 种酶酶解曲拉干酪素溶液的抗氧化能力。本研究旨在明确碱性蛋白酶和胰蛋白酶曲拉干酪素酶解液抗氧化性的差异,为曲拉干酪素酶解工艺以及产物的进一步利用提供依据。
1 材料与方法
1.1 材料与试剂
曲拉产自甘肃甘南夏河县,曲拉干酪素(蛋白质质量分数≥90.0%) 甘肃华安生物科技集团;2-氨基-2-(羟甲基)-1,3-丙二醇(2-amino-2-(hydroxymethyl)-1,3-propanediol,TRIS)、碱性蛋白酶(200 000 U/g)、胰蛋白酶(250 U/mg) 日本Solarbio公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)美国Sigma公司;ferrozine 北京中生瑞泰科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
UV759(PC)紫外-可见分光光度计 上海悦丰仪器仪表有限公司;HH-4A恒温搅拌水浴锅 常州金坛精达仪器制造有限公司;PHS-3C pH计、精密天平 上海精密科学仪器有限公司;GT10-1型高速台式离心机 北京时代北利离心机有限公司。
1.3 方法
1.3.1 曲拉干酪素酶解
烧杯中加入蒸馏水,预热到适宜温度,取定量的曲拉干酪素加入蒸馏水中,适量NaOH(1 mol/L)溶液助溶,使曲拉干酪素溶解完全,调节溶液pH值到设定值,加入酶,酶解一定时间(反应过程中保持pH值恒定),反应结束后,沸水浴20 min灭酶活性,冷却至常温后,离心取上清液(4 000 r/min,20 min),冷冻干燥,每个实验重复3 次。
1.3.2 酶解单因素试验
参照郑志强[10]、张根生[11]等方法略作修改,碱性蛋白酶在酶解温度50 ℃、曲拉干酪素质量浓度60 g/L、pH 8.5、酶添加量140 U/g、酶解时间3.5 h的条件下;胰蛋白酶在酶解温度45 ℃、曲拉干酪素质量浓度35 g/L、pH 7.5、酶添加量3 000 U/g、酶解时间2.5 h的条件下,保持其他条件不变,改变其中一个因素,以水解度为指标,进行单因素试验。因素设置:碱性蛋白酶:酶解温度分别为40、45、50、55、60 ℃;曲拉干酪素质量浓度分别为30、40、50、60、70 g/L;pH 7.5、8.0、8.5、9.0、9.5;酶添加量分别为80、100、120、140、160 U/g。胰蛋白酶:酶解温度分别为35、40、45、50、55 ℃;曲拉干酪素质量浓度分别为25、30、35、40、45 g/L;pH 6.5、7.0、7.5、8.0、8.5;酶添加量分别为1 500、2 000、2 500、3 000、3 500 U/g。碱性蛋白酶和胰蛋白酶酶解时间均设置为0~5.0 h,每0.5 h取样。
1.3.3 响应面试验
依据单因素试验结果,选取酶解时间(X1)、酶解温度(X2)、酶添加量(X3)和pH值(X4)为影响因素,以水解度作为响应值,采用4因素3水平分析方法,设计见表1。
表 1 Box-Behnken试验因素与水平
Table 1 Factors with actual and coded levels used in Box-Behnken design
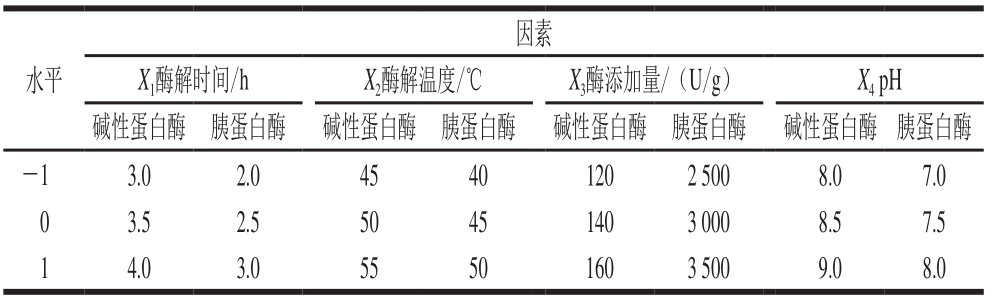
水平因素X1酶解时间/h X2酶解温度/℃ X3酶添加量/(U/g) X4 pH 碱性蛋白酶 胰蛋白酶 碱性蛋白酶 胰蛋白酶 碱性蛋白酶 胰蛋白酶 碱性蛋白酶 胰蛋白酶-1 3.0 2.0 45 40 120 2 500 8.0 7.0 0 3.5 2.5 50 45 140 3 000 8.5 7.5 1 4.0 3.0 55 50 160 3 500 9.0 8.0
碱性蛋白酶 胰蛋白酶 碱性蛋白酶 胰蛋白酶 碱性蛋白酶 胰蛋白酶 碱性蛋白酶 胰蛋白酶-1 3.0 2.0 45 40 120 2 500 8.0 7.0 0 3.5 2.5 50 45 140 3 000 8.5 7.5 1 4.0 3.0 55 50 160 3 500 9.0 8.0
1.3.4 水解度测定
水解度测定参照文献[11]方法。
1.3.5 抗氧化性的测定
1.3.5.1 超氧阴离子自由基清除能力的测定
参考Li Xican[12]方法:吸取2.0 mL样品于试管中与2 950 μL Tris-HCl(pH 7.4)溶液和50 μL 5 mmol/L联苯三酚混合,快速振荡,在325 nm波长处测定30 s时的吸光度A1,300 s时为A2,计算见公式(1):
式中:ΔAs=A2-A1;ΔAb为空白组吸光度,双蒸水取代样品。
1.3.5.2 羟自由基清除率的测定
参考Zhang Yufeng等[13]方法:吸取1.0 mL样品于试管中,依次向试管内加入1.0 mL 1.865 mmol/L邻二氮菲-乙醇溶液,2.0 mL 0.2 mol/L磷酸盐缓冲溶液(pH 7.4),1.0 mL 1.865 mmol/L FeSO4·7H2O和1.0 mL 0.03% H2O2溶液,振荡均匀,恒温水浴(37 ℃)反应60 min,冷却至室温,4 000 r/min离心10 min,532 nm波长处测定吸光度As,计算见公式(2):
式中:Ab为空白组吸光度,双蒸水取代样品;An为损伤组吸光度,双蒸水代替H2O2溶液。
1.3.5.3 DPPH自由基清除率的测定
参考Tai等[14]方法略作调整:将2 mL样品与2 mL 0.1 mmol/L DPPH-95%乙醇溶液混合,暗处反应30 min,3 000 g/min离心15 min,517 nm波长处测定吸光度,计算见公式(3):
式中:As为2 mL样品与DPPH溶液吸光度;Ac为2 mL样品与2 mL 95%乙醇溶液吸光度;Ab为2 mL样品与DPPH-95%乙醇溶液吸光度。
1.3.5.4 还原力的测定
参考Gu Fenglin等[15]方法。将1 mL样品与2.5 mL 0.2 mol/L磷酸盐缓冲溶液(pH 6.6)与2.5 mL 1%铁氰化钾溶液混匀,50 ℃水浴反应20 min,加入2.5 mL 10%三氯乙酸溶液,3 000 r/min离心10 min,取2.5 mL上清液,依次加入2.5 mL双蒸水、0.5 mL 0.1% FeCl3溶液,室温放置10 min,于700 nm波长处测定吸光度。
1.3.5.5 Fe2+螯合能力的测定
参考Carrasco-Castilla等[16]方法。将1 mL样品与0.1 mL 2 mmol/L FeCl2溶液和3.7 mL双蒸水预混合,加入0.2 mL 5 mmol/L ferrozine溶液,3 000 g/min离心5 min,离心后混合物在室温下放置20 min于562 nm波长处测定吸光度,计算见公式(4):
式中:As为样品吸光度;Ac为对照组吸光度,双蒸水取代样品。
1.3.5.6 Cu2+螯合能力的测定
参照Zhu Lijuan等[17]方法,在1 mL样品中依次加入1 mL 2 mmol/L CuSO4溶液、1 mL中性吡啶溶液、20 μL 0.1%邻苯二酚紫溶液迅速混匀,室温放置5 min,于632 nm波长处测定吸光度,计算见公式(5):
式中:As为样品组吸光度;Ab为对照组吸光度,双蒸水取代样品。
1.4 统计分析
数据采用SPSS 24.0软件进行方差分析和多重比较。
2 结果与分析
2.1 单因素试验结果
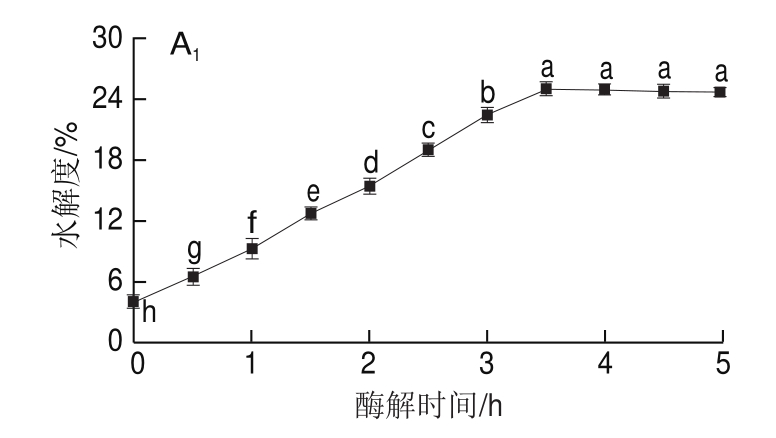
由图1A1、B1可知,随着酶解时间的延长,碱性蛋白酶在0~3.5 h、胰蛋白酶在0~2.5 h内,水解度均呈上升。碱性蛋白酶在3.5 h达到最大,水解度为24.97%,胰蛋白酶则在2.5 h达到最大,水解度为12.29%。之后随着时间延长,2 种酶的水解度均稍有下降,但变化均不明显(P>0.05)。其原因可能是因为在酶解初期,由于酶切位点较多,导致水解度上升趋势明显,而随着酶解时间不断延长,暴露的酶切位点相对较少,使反应速率逐渐下降,反应趋势减弱。
由图1A2、B2可知,碱性蛋白酶和胰蛋白酶分别在酶解温度50、45 ℃以下时,随着酶解温度的升高,水解度均不断增大。在50、45 ℃时分别达到最大,水解度分别为25.15%、13.72%,之后随着温度的逐渐升高,水解度略有下降,这是由于温度升高导致酶失活的结果。
由图1A3、B3可知,随着曲拉干酪素质量浓度的增加,水解度整体呈先增大后减小趋势,碱性蛋白酶在曲拉干酪素质量浓度60 g/L达到最大,水解度为25.65%,胰蛋白酶在曲拉干酪素质量浓度35 g/L时达到最大,为12.65%。底物质量浓度在一定范围内,反应体系的溶质含量少,酶与底物反应完全,水解度呈增大趋势,随着底物质量浓度逐渐增加,酶与底物结合饱和,同时由于反应体系的流动性变差,使反应速率降低,水解度稍有下降。
由图1A4、B4可知,在一定的pH值范围内,水解度呈增加趋势,碱性蛋白酶在8.5时达到最大,为25.15%,胰蛋白酶在7.5时达到最大,为14.05%,但随着pH值的不断增加,水解度均有所下降,pH值影响酶与蛋白质之间的解离状态,要使水解度呈最大值,必须是反应体系处于适宜的酸碱环境,不适宜将会导致酶的空间结构改变,使部分酶活性降低。
由图1A5、B5可知,随着酶添加量的增加,水解度呈上升趋势,碱性蛋白酶在酶添加量140 U/g时,水解度最大,为25.65%;胰蛋白酶在酶添加量3 000 U/g时,水解度达到最大,为13.28%。之后随酶添加量增大,水解度均稍有下降。适宜的酶添加量可与底物充分结合、反应完全,当酶添加超量时,超量部分酶无法与底物结合,水解度则基本无明显变化。
2.2 响应面试验结果
2.2.1 碱性蛋白酶
表 2 碱性蛋白酶响应面试验设计及结果
Table 2 Response surface design with results for optimization of alkaline protease hydrolysis
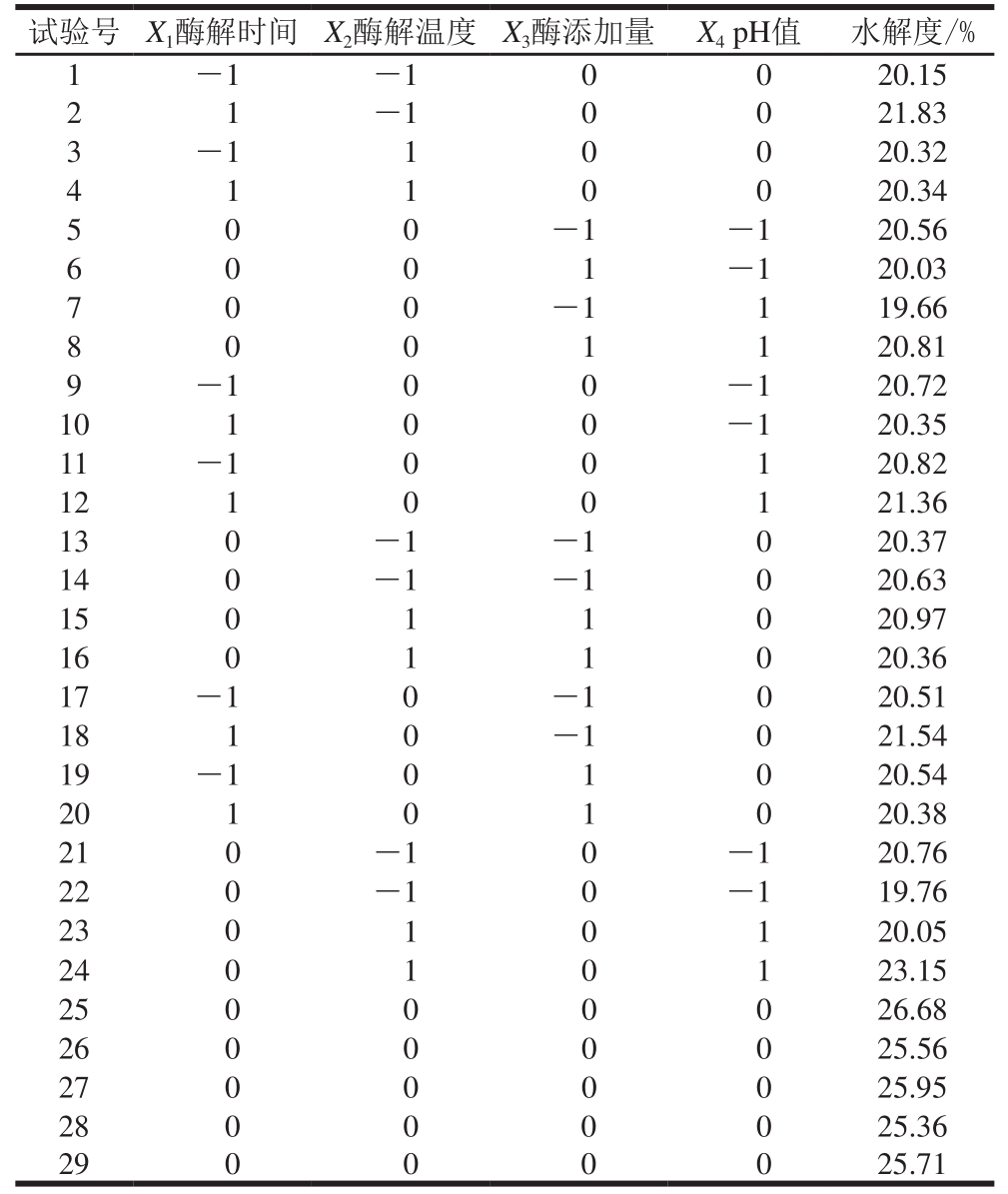
试验号 X1酶解时间 X2酶解温度 X3酶添加量 X4 pH值 水解度/%1 -1 -1 0 0 20.15 2 1 -1 0 0 21.83 3 -1 1 0 0 20.32 4 1 1 0 0 20.34 5 0 0 -1 -1 20.56 6 0 0 1 -1 20.03 7 0 0 -1 1 19.66 8 0 0 1 1 20.81 9 -1 0 0 -1 20.72 10 1 0 0 -1 20.35 11 -1 0 0 1 20.82 12 1 0 0 1 21.36 13 0 -1 -1 0 20.37 14 0 -1 -1 0 20.63 15 0 1 1 0 20.97 16 0 1 1 0 20.36 17 -1 0 -1 0 20.51 18 1 0 -1 0 21.54 19 -1 0 1 0 20.54 20 1 0 1 0 20.38 21 0 -1 0 -1 20.76 22 0 -1 0 -1 19.76 23 0 1 0 1 20.05 24 0 1 0 1 23.15 25 0 0 0 0 26.68 26 0 0 0 0 25.56 27 0 0 0 0 25.95 28 0 0 0 0 25.36 29 0 0 0 0 25.71
表 3 碱性蛋白酶二次回归方程模型方差分析
Table 3 Analysis of variance for the quadratic regression model for alkaline protease hydrolysis

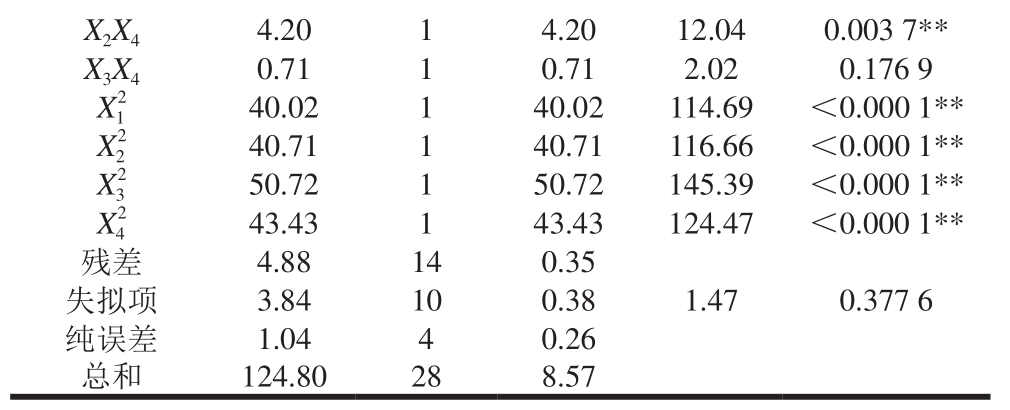
方差来源 总方差 自由度 均方差 F值 P值模型 119.91 14 8.57 24.55 <0.000 1**X1酶解时间 0.62 1 0.63 1.80 0.201 9 X2酶解温度 0.02 1 0.02 0.04 0.836 6 X3酶添加量 0.0027 1 0.0027 0.01 0.931 2 X4 pH值 1.12 1 1.12 3.22 0.094 5 X1X2 0.69 1 0.69 1.97 0.181 8 X1X3 0.35 1 0.35 1.01 0.330 9 X1X4 0.21 1 0.21 0.59 0.453 9 X2X3 0.19 1 0.19 0.54 0.473 6
注:**. P<0.01,差异极显著;*. P<0.05,差异显著。下同。
X2X4 4.20 1 4.20 12.04 0.003 7**X3X4 0.71 1 0.71 2.02 0.176 9 X12 40.02 1 40.02 114.69 <0.000 1**X22 40.71 1 40.71 116.66 <0.000 1**X32 50.72 1 50.72 145.39 <0.000 1**X42 43.43 1 43.43 124.47 <0.000 1**残差 4.88 14 0.35失拟项 3.84 10 0.38 1.47 0.377 6纯误差 1.04 4 0.26总和 124.80 28 8.57
利用Design-Expert 8.0设计软件,采用Box-Behnken试验设计方案,结果见表2。以酶解温度、酶解时间、酶添加量、pH值对酶解工艺参数进行优化,获得二次回归方程为:
水解度=25.85+0.23X1+0.036X2-0.015X3+0.31X4-0.41X1X2-0.30X1X3+0.23X1X4-0.22X2X3+1.02X2X4+0.42XX-2.48X2-2.51X2-2.80X2-2.59X2 341234
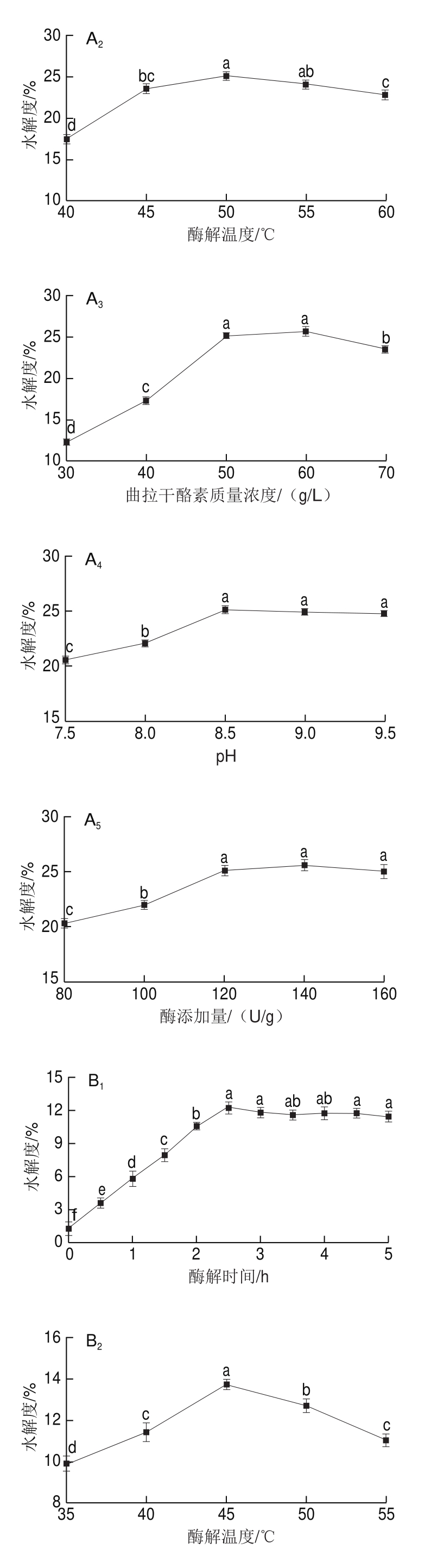
由表3可知,试验所选用的回归模型极显著(P<0.000 1),失拟项P值为0.377 6,不显著;模型R2Adj为0.921 7,R2=0.960 9,说明该模型与实际相切合,建立较合理,试验误差小,信噪比15.036大于4。
由图2可以看出,pH值变化对水解度的影响显著,酶解温度和酶添加量的影响不显著。酶解温度与pH值之间的交互作用极显著(P<0.01),其他因素之间存在一定交互作用,F值越大影响越显著,响应面的梯度曲线曲面弯曲程度大,表示影响越显著[18]。各因素对水解度的影响顺序为X3<X2<X1<X4,与回归结果分析相一致。
综合单因素及响应面试验结果,碱性蛋白酶酶解曲拉干酪素的优化工艺参数为酶解时间3.84 h、酶解温度49.84 ℃、酶添加量139.37 U/g、pH 8.54,预测值为24.88%,按最优条件为碱性蛋白酶酶解时间3.8 h、酶解温度49.8 ℃、曲拉干酪素质量浓度60 g/L、pH 8.5、酶添加量140 U/g,验证实验(n=3)得水解度为24.25%。
2.2.2 胰蛋白酶
表 4 胰蛋白酶响应面试验设计及结果Table 4 Response surface design with results for trypsin hydrolysis
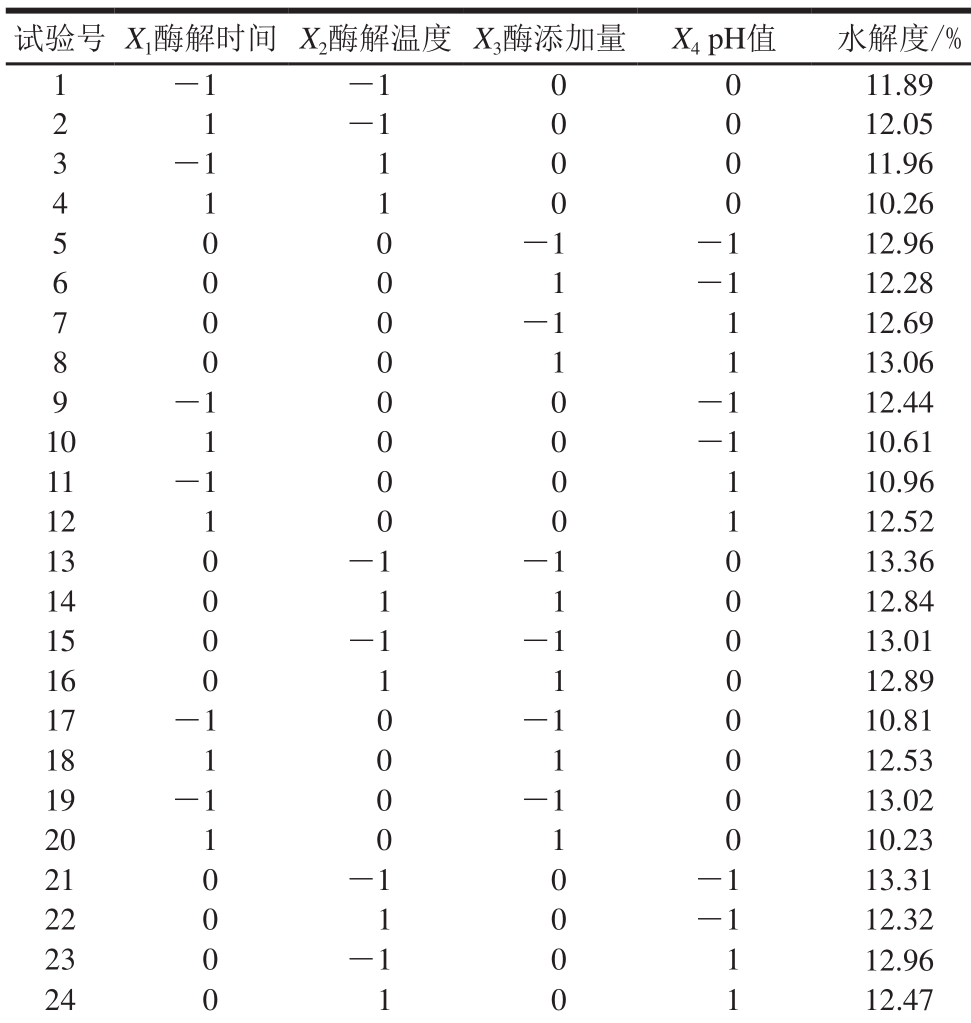
试验号 X1酶解时间 X2酶解温度 X3酶添加量 X4 pH值 水解度/%1 -1 -1 0 0 11.89 2 1 -1 0 0 12.05 3 -1 1 0 0 11.96 4 1 1 0 0 10.26 5 0 0 -1 -1 12.96 6 0 0 1 -1 12.28 7 0 0 -1 1 12.69 8 0 0 1 1 13.06 9 -1 0 0 -1 12.44 10 1 0 0 -1 10.61 11 -1 0 0 1 10.96 12 1 0 0 1 12.52 13 0 -1 -1 0 13.36 14 0 1 1 0 12.84 15 0 -1 -1 0 13.01 16 0 1 1 0 12.89 17 -1 0 -1 0 10.81 18 1 0 1 0 12.53 19 -1 0 -1 0 13.02 20 1 0 1 0 10.23 21 0 -1 0 -1 13.31 22 0 1 0 -1 12.32 23 0 -1 0 1 12.96 24 0 1 0 1 12.47

25 0 0 0 0 13.72 26 0 0 0 0 13.77 27 0 0 0 0 13.96 28 0 0 0 0 13.92 29 0 0 0 0 13.28
胰蛋白酶响应面设计及结果见表4,胰蛋白酶酶解工艺二次回归方程为:水解度=13.73-0.24X1-0.32X2-0.058X3+0.062X4-0.46X1X2-1.13X1X3+0.85X1X4+0.10X2X3+0.13X2X4+0.26X3X4-1.68X12-0.43X22-0.38X32-0.52X42。
表 5 胰蛋白酶二次回归方程模型方差分析
Table 5 Analysis of variance for the quadratic regression model for trypsin hydrolysis

?
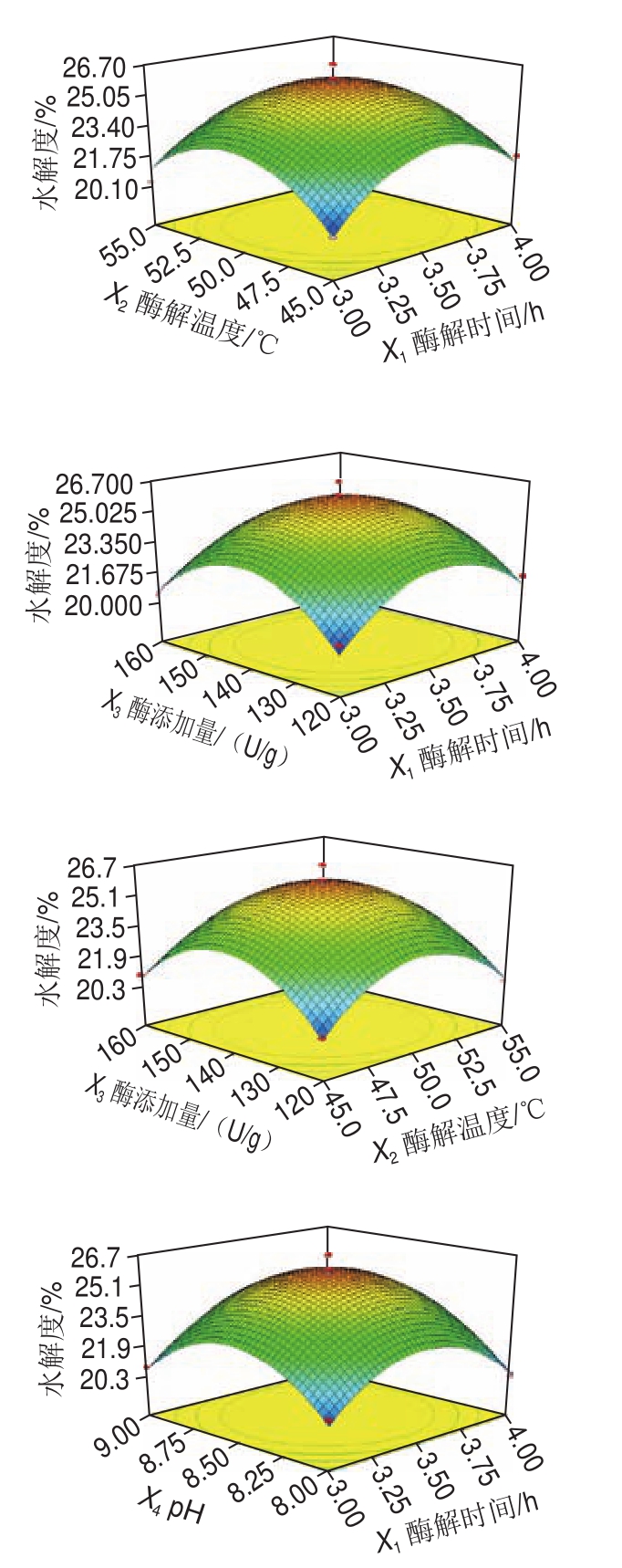
表5表明,试验所选用的模型极显著(P<0.000 1),失拟项P值为0.644 7,不显著;模型R2Adj为0.942 4,R2=0.971 2,说明该模型试验误差小,拟合程度较好,信噪比19.289大于4。
由图3可见,交互项(X1X2、X1X3、X1X4)对水解度影响极显著(P<0.01),交互项(X2X3、X2X4、X3X4)影响均不显著(P>0.05),二次项(X22、X32、X42)对水解度的影响极显著(P<0.01),各因素对水解度的影响顺序为X3<X4<X1<X2。
综合以上单因素及响应面试验结果,胰蛋白酶优化工艺参数为酶解时间2.53 h、酶解温度47.79 ℃、酶添加量2 882.00 U/g、pH 7.50,水解度预测值为13.80%,按最优条件为胰蛋白酶酶解时间2.5 h、酶解温度47.8 ℃、曲拉干酪素质量浓度35 g/L、pH 7.5、酶添加量2 900 U/g,验证实验(n=3)得水解度为13.57%,实验值与预测值基本切合。
2.3 2 种蛋白酶酶解液抗氧化性
2.3.1 超氧阴离子自由基清除能力
酶解液对超氧阴离子自由基的清除属浓度依赖型,由图4可知,随着酶解液质量浓度的增大,酶解液的清除能力呈上升趋势。其中,酶解后胰蛋白酶的清除能力显著(P<0.01),胰蛋白酶超氧阴离子自由基清除率从74.05%上升到82.07%,增大8.02%(P<0.05),碱性蛋白酶组从67.31%上升到77.27%,增大9.96%(P<0.01),曲拉干酪素溶解液(对照)增加不明显(P>0.05)。歧化和其他类型的反应可产生H2O2和羟自由基[20-21],使清除能力增强,2 种酶均能够显著提高水解度,产生的小分子质量肽段增多[22]。郑志强[10]和Raghavan[19]等报道,水解度越大,酶解液的抗氧化性越强,研究与Yu Jie等[23]报道的螺旋藻酶解液清除超氧阴离子自由基的趋势相一致。
2.3.2 羟自由基清除能力由图5可知,随着酶解液质量浓度的增大,酶解液的羟自由基清除能力呈现上升趋势,但2 种蛋白酶无显著性差异(P>0.05)。羟自由基可以与细胞中几乎所有的物质发生反应,从而诱导产生对细胞的严重破坏[24-25],本实验结果与Zhang Yufeng等[25]报道的碱性蛋白酶酶解鹰嘴豆羟自由基清除效果不一致,其原因可能是曲拉与鹰嘴豆蛋白结构不同、酶解条件等不同所造成的。
2.3.3 DPPH自由基清除能力
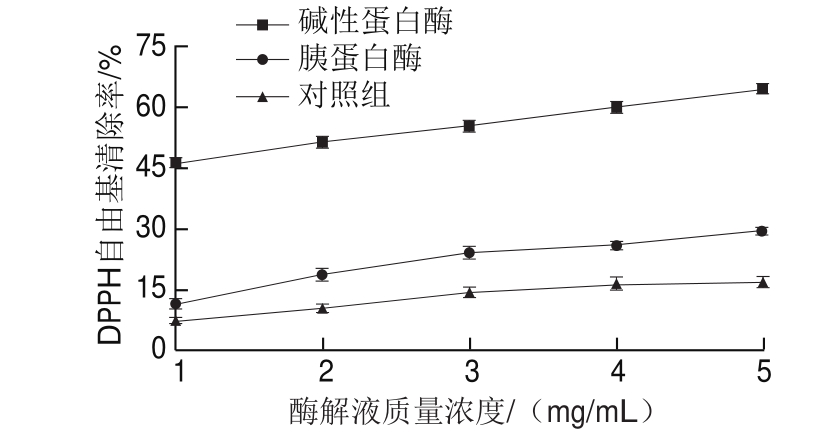
随着酶解液质量浓度的增大,酶解液DPPH自由基清除能力均呈上升趋势。由图6可见,5.0 mg/mL碱性蛋白酶解液DPPH自由基清除率较1.0 mg/mL提高18.32%,显著高于胰蛋白酶(P<0.01)。胰蛋白酶组结果增长缓慢,趋势平缓,清除能力不到30%,2 种蛋白酶之间差异显著(P<0.01)。碱性蛋白酶较胰蛋白酶清除效果更佳,可能是因为碱性蛋白酶主要酶解疏水性的氨基酸,电子供体存在于酶解液中,自由基与之反应结合为稳定产物[27]。DPPH自由基可与供给质子抗氧化剂等反应清除自由基,降低吸光度[28],溶液颜色从深紫色逐渐变为黄色,通过接受电子或氢自由基形成非磁性分子[29]。结果与Ghribi等[26]报道的鹰嘴豆碱性蛋白酶酶解物DPPH自由基清除率相一致,与郑志强等[10]的报道存在差异,需进一步研究。
2.3.4 还原力
由图7可知,酶解液还原力随着酶解液质量浓度的增加而增大,碱性蛋白酶在1.0 mg/mL时为0.46,5.0 mg/mL达到0.64,增大26%(P<0.01);胰蛋白酶从1.0 mg/mL时的0.11增大到5.0 mg/mL的0.29,增大62%(P<0.01),相比于曲拉干酪素溶解液和胰蛋白酶,碱性蛋白酶组的增加显著(P<0.05),但增加趋势胰蛋白酶明显优于碱性蛋白酶(P<0.01)。还原力测定通常用于评估天然抗氧化剂提供电子或氢的能力[30],一种样品具有更高还原能力则具有更好的供电子能力,吸光度越高,还原力越大[31]。酶解能够提高酶解液的还原力,原因是酶解液可以作为电子供体发挥作用,释放出来的还原剂能够快速与铁氰化钾形成络合物,使Fe3+还原成Fe2+。结果与于丽娜等[32]关于酶解花生的报道相一致。
2.3.5 Fe2+螯合能力
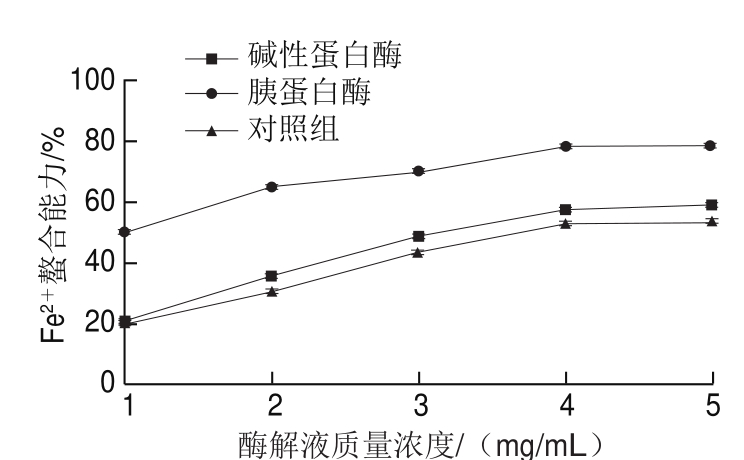
由图8可知,酶解液对Fe2+的螯合能力随着酶解液质量浓度增加而增加。对于碱性蛋白酶,当酶解液质量浓度从1.0 mg/mL增加到5.0 mg/mL时,螯合能力从20.93%增加到59.32%(P<0.01),胰蛋白酶则从50.25%增加到78.60%(P<0.01),本实验与Carrasco-Castilla等[16]报道的胰蛋白酶酶解菜豆具有良好的Fe2+螯合能力相一致。过渡金属离子通过作为单电子供体形成烷氧基自由基而与过氧化物反应速度非常快[33],在体内发生多种氧化反应,Fe2+可催化Haber-Weiss反应,即Fe2+和过氧化氢同时存在情况下,转化为羟自由基,与邻近的生物分子快速反应并引起严重的损害[34]。胰蛋白酶属特殊多酶体系,可水解产生带有羧端的氨基酸,蛋白质的游离羧端是金属离子的潜在结合位点,酶解物作为金属螯合化合物是有效的[35],胰蛋白酶的螯合效果优于碱性蛋白酶。
2.3.6 Cu2+螯合能力
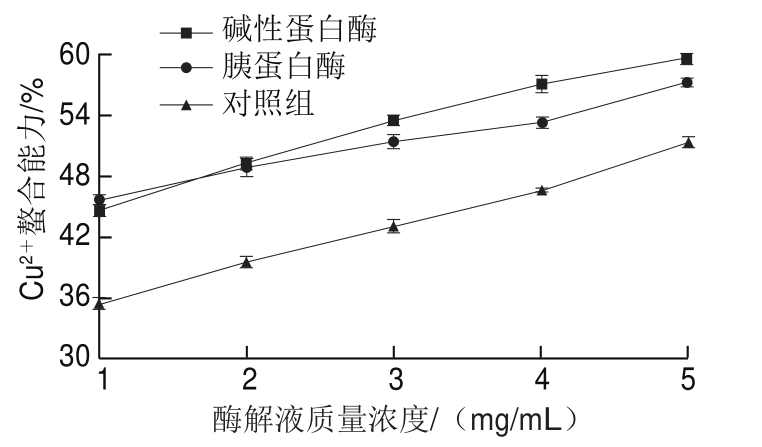
由图9可知,随着酶解液质量浓度的增加,Cu2+螯合能力逐渐增大,碱性蛋白酶组从44.52%增大到59.65%,增大15.13%(P<0.05),胰蛋白酶组从45.67%增大到57.18%,增加11.51%(P<0.05),与曲拉干酪素溶解液相比均显著增大(P<0.01),但2 种蛋白酶之间差异不显著(P>0.05)。由于特定的肽结构和氨基酸侧链基团不仅在终止自由基链反应而且在螯合过渡金属离子中起重要作用[36]。酶解后,酶解物Cu2+螯合能力增加。酶的性质不同则酶切位点不同,形成的分子质量大小不同,形成的氨基酸肽链组成不同,与金属离子的配位键则存在差异,将导致酶解液金属离子螯合能力不同[37]。此外,酶解液Cu2+螯合能力取决于Cu2+配位点多少、分子质量大小以及肽段结构等[38-39]。
3 结 论
采用碱性蛋白酶和胰蛋白酶对曲拉干酪素进行酶解,通过单因素和响应面试验优化,分别在酶解时间3.8、2.5 h、酶解温度49.8、47.8 ℃、曲拉干酪素质量浓度60、35 g/L,pH 8.5、7.5,酶添加量140、2 900 U/g时水解度较高。
曲拉干酪素碱性蛋白酶和胰蛋白酶2 种酶解液,均表现出良好的抗氧化性和电子或氢供体能力。通过对抗氧化性的比较,清除羟自由基、DPPH自由基能力和还原力的效果碱性蛋白酶相对较好,超氧阴离子自由基清除效果则胰蛋白酶解液优于碱性蛋白酶解液。金属螯合能力方面,碱性蛋白酶解液Cu2+螯合能力优于胰蛋白酶解液,而Fe2+螯合能力则相反。碱性蛋白酶酶解曲拉干酪素的水解度明显优于胰蛋白酶,更适宜用于曲拉干酪素的酶解。随着对曲拉干酪素抗氧化肽活性功能研究的深入,需要对不同分子质量肽段进行分离、纯化、鉴定,明确其肽序列,深入研究肽的结构和特定的抗氧化机制及动物体抗氧化性效果等。
参考文献:
[1] 李亚茹, 郝力壮, 牛建章, 等. 牦牛乳与其他哺乳动物乳功能性营养成分的比较分析[J]. 食品科学, 2016, 37(7): 249-253. DOI:10.7506/spkx1002-6630-201607044.
[2] 陈梦音, 王琳琳, 韩玲, 等. 基于主成分和聚类分析的曲拉品质的综合评价[J]. 食品科学, 2017, 38(13): 102-107. DOI:10.7506/spkx1002-6630-201713017.
[3] 韩玲, 张福娟, 甘伯中, 等. 牦牛“曲拉”干酪素凝乳酶的选择及工艺参数优化[J]. 农业工程学报, 2007, 23(7): 226-229. DOI:10.3321/j.issn:1002-6819.2007.07.044.
[4] 张蓓. 藏族传统曲拉制作过程中乳酸菌群变化及曲拉中益生性乳杆菌的筛选和功能性评价[D]. 郑州: 郑州大学, 2017.
[5] LIN K, ZHANG L W, HAN X, et al. Novel angiotensin I-converting enzyme inhibitory peptides from protease hydrolysates of Qula casein:quantitative structure-activity relationship modeling and molecular docking study[J]. Journal of Functional Foods, 2017, 32: 266-277.DOI:10.1016/j.jff.2017.03.008 1756-4646.
[6] 李志成, 蒋爱民, 岳田利, 等. 山羊乳酪蛋白酶解工艺及抗氧化性研究[J]. 食品科学, 2009, 30(21): 252-257. DOI:10.3321/j.issn:1002-6630.2009.21.059.
[7] MAO X Y, NI J R, SUN W L, et al. Value-added utilization of yak milk casein for the production of angiotensin-I-converting enzyme inhibitory peptides[J]. Food Chemistry, 2007, 103(4): 1282-1287.DOI:10.1016/j.foodchem.2006.10.041.
[8] 张娜, 郭庆启, 黄文秀, 等. 大豆蛋白肽-酪蛋白非磷酸肽组装产物的荧光光谱分析及抗氧化性研究[J]. 食品科学, 2017, 38(17): 42-46.DOI:10.7506/spkx1002-6630-201717008.
[9] CORROCHANO A R, BUCKIN V, KELLY P M, et al. Invited review: whey proteins as antioxidants and promoters of cellular antioxidant pathways[J]. Journal of Dairy Science, 2018, 101(6): 4747-4761. DOI:10.3168/jds.2017-13618.
[10] 郑志强, 李宝林, 郝利民, 等. 不同蛋白酶对小麦蛋白酶解物抗氧化活性的影响[J]. 食品科学, 2017, 38(7): 161-166. DOI:10.7506/spkx1002-6630-201707026.
[11] 张根生, 丁琬莹, 王月, 等. 响应面法优化双酶酶解酪蛋白工艺[J].食品科学, 2013, 34(21): 237-241. DOI:10.7506/spkx1002-6630-201321048.
[12] LI X C. Improved pyrogallol autoxidation method: a reliable and cheap superoxide-scavenging assay suitable for all antioxidants[J]. Journal of Agricultural & Food Chemistry, 2012, 60(25): 6418. DOI:10.1021/jf204970r.
[13] ZHANG Y F, DUAN X, ZHUANG Y. Purification and characterization of novel antioxidant peptides from enzymatic hydrolysates of tilapia (Oreochromis niloticus) skin gelatin[J].Peptides, 2012, 38(1): 13-21. DOI:10.1016/j.peptides.2012.08.014.
[14] TAI A, IOMORI A, ITO H. Structural evidence for the DPPH radicalscavenging mechanism of 2-O-α-D-glucopyranosyl-l-ascorbic acid[J].Bioorganic & Medicinal Chemistry, 2017, 25(20): 5303-5310.DOI:10.1016/j.bmc.2017.07.044.
[15] GU F L, ABBAS S, ZHANG X M. Optimization of Maillard reaction products from casein-glucose using response surface methodology[J].LWT-Food Science and Technology, 2009, 42(8): 1374-1379.DOI:10.1016/j.lwt.2009.03.012.
[16] CARRASCO-CASTILLA J, HERNÁNDEZ-ÁLVAREZ A J,JIMÉNEZ-MARTÍNEZ C, et al. Antioxidant and metal chelating activities of peptide fractions from phaseolin and bean protein hydrolysates[J]. Food Chemistry, 2012, 135(3): 1789-1795.DOI:10.1016/j.foodchem.2012.06.016.
[17] ZHU L J, CHEN J, TANG X Y, et al. Reducing, radical scavenging,and chelation properties of in vitro digests of alcalase-treated zein hydrolysates[J]. Journal of Agricultural & Food Chemistry, 2008,56(8): 2714-2721.
[18] 宋佳敏, 王鸿飞, 孙朦, 等. 响应面法优化金蝉花多糖提取工艺及抗氧化活性分析[J]. 食品科学, 2018, 39(4): 275-281. DOI:10.7506/spkx1002-6630-201804041.
[19] RAGHAVAN S, KRISTINSSON H G, LEEUWENBURGH C.Radical scavenging and reducing ability of tilapia (Oreochromis niloticus) protein hydrolysates[J]. Journal of Agricultural and Food Chemistry, 2008, 56(21): 10359-10367.
[20] MOURE A, DOMÍNGUEZ H, PARAJÓ J C. Antioxidant properties of ultrafiltration-recovered soy protein fractions from industrial effluents and their hydrolysates[J]. Process Biochemistry, 2006, 41(2): 447-456.DOI:10.1016/j.procbio.2005.07.014.
[21] GHRIBI A M, SILA A, PRZYBYLSKI R, et al. Purification and identification of novel antioxidant peptides from enzymatic hydrolysate of chickpea (Cicer arietinum L.) protein concentrate[J]. Journal of Functional Foods, 2015, 12(1/2/3/4): 516-525. DOI:10.1016/j.lwt.2012.08.002.
[22] MACDONALD J, GALLEY H F, WEBSTER N R. Oxidative stress and gene expression in sepsis[J]. British Journal of Anaesthesia, 2003,90(2): 221-232. DOI:10.1093/bja/aeg034.
[23] YU J, HU Y, XUE M, et al. Purification and identification of antioxidant peptides from enzymatic hydrolysate of Spirulina platensis[J]. Journal of Industrial Microbiology & Biotechnology 2016, 26(7): 1216-1223. DOI:10.4014/jmb.1601.01033.
[24] CÖMERT E D, GÖKMEN V. Evolution of food antioxidants as a core topic of food science for a century[J]. Food Research International,2018, 105: 76-93. DOI:10.1016/j.foodres.2017.10.056.
[25] ZHANG Y F, DUAN X, ZHUANG Y L. Purification and characterization of novel antioxidant peptides from enzymatic hydrolysates of tilapia (Oreochromis niloticus) skin gelatin[J].Peptides, 2012, 38(1): 13-21. DOI:10.1016/j.peptides.2012.08.014.
[26] GHRIBI A M, GAFSI I M, SILA A, et al. Effects of enzymatic hydrolysis on conformational and functional properties of chickpea protein isolate[J]. Food Chemistry, 2015, 187: 322-330. DOI:10.1016/j.foodchem.2015.04.109.
[27] BENJAKUL S, VISESSANGUAN W, PHONGKANPAI V, et al.Antioxidative activity of caramelisation products and their preventive effect on lipid oxidation in fish mince[J]. Food Chemistry, 2005,90(1/2): 231-239. DOI:10.1016/j.foodchem.2004.03.045.
[28] NAZEER R A, KUMAR N S S, GANESH R J. In vitro, and in vivo,studies on the antioxidant activity of fish peptide isolated from the croaker (Otolithes ruber) muscle protein hydrolysate[J]. Peptides,2012, 35(2): 261-268. DOI:10.1016/j.peptides.2012.03.028.
[29] MAO X Y, CHENG X, WANG X, et al. Free-radical-scavenging and anti-inflammatory effect of yak milk casein before and after enzymatic hydrolysis[J]. Food Chemistry, 2011, 126(2): 484-490. DOI:10.1016/j.foodchem.2010.11.025.
[30] AHMADI F, KADIVAR M, SHAHEDI M. Antioxidant activity of Kelussia odoratissima Mozaff. in model and food systems[J]. Food Chemistry, 2007, 105(1): 57-64. DOI:10.1016/j.foodchem.2007.03.056.
[31] YOSHIMURA Y, IIJIMA T, WATANABE T, et al. Antioxidative effect of Maillard reaction products using glucose-glycine model system[J]. Journal of Agricultural & Food Chemistry, 1997, 45(10):4106-4109.
[32] 于丽娜, 高俊安, 杨庆利, 等. 不同处理条件对花生抗氧化肽抗氧化活性的影响[J]. 食品科学, 2012, 33(11): 104-110.
[33] GORDON M H. Food Antioxidants: the mechanism of antioxidant action in vitro[M]. Berlin: Springer Netherlands, 1990: 1-18.
[34] AFANAS'EV I B, DCROZHKO A I, BRODSKII A V, et al. Chelating and free radical scavenging mechanisms of inhibitory action of rutin and quercetin in lipid peroxidation[J]. Biochemical Pharmacology,1989, 38(11): 1763-1769.
[35] WIJEWICKREME A N, KITTS D D, DURANCE T D. Reaction conditions influence the elementary composition and metal chelating affinity of nondialyzable model Maillard reaction products[J]. Journal of Agricultural & Food Chemistry, 1998, 45(12): 4577-4583.
[36] DÍAZ M, DUNN C M, MCCLEMENTS D J, et al. Use of caseinophosphopeptides as natural antioxidants in oil-in-water emulsions[J]. Journal of Agricultural & Food Chemistry, 2003, 51(8):2365-2370.
[37] KONG B H, XIONG Y L L. Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action[J]. Journal of Agricultural & Food Chemistry, 2006, 54(16): 6059-6068.
[38] NALINANON S, BENJAKUL S, KISHIMURA H, et al.Functionalities and antioxidant properties of protein hydrolysates from the muscle of ornate threadfin bream treated with pepsin from skipjack tuna[J]. Food Chemistry, 2011, 124(4): 1354-1362. DOI:10.1016/j.foodchem.2010.07.089.
[39] ALEMÁN A, GIMÉNEZ B, PÉREZSANTIN E, et al. Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptide sequences isolated from squid gelatin hydrolysate[J].Food Chemistry, 2011, 125(2): 334-341. DOI:10.1016/j.foodchem.2010.08.058.
Optimization of Hydrolysis Conditions of Qula Casein with Two Proteases and Comparative Antioxidant Activity of Hydrolysates
LIU Qianxia, LIU Dong, ZHANG Jun, WANG Jiao, HE Xingfen, YANG Fumin*, ZHAO Baotang*
(College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
Abstract: The enzymatic hydrolysis of Qula casein with either alkaline protease or trypsin was optimized based on degree of hydrolysis (DH). The effects of hydrolysis time, temperature, pH, substrate concentration and enzyme concentration on DH were investigated by one-factor-at-a-time method. Subsequently, response surface methodology was used to optimize four significant variables. The resulting hydrolysates were comparatively evaluated for their 1,1-diphenyl-2-picrylhydrazyl(DPPH), superoxide anion and hydroxyl radical scavenging capacity, Fe2+ and Cu2+ chelating ability, and reducing power.The results showed that the optimal hydrolysis time, temperature, substrate concentration, pH and enzyme concentration were 3.8 h, 49.8 ℃, 60 g/L, 8.5 and 140 U/g for alkaline protease; and 2.5 h, 47.8 ℃, 35 g/L, 7.5 and 2 900 U/g for trypsin, yielding the maximum DH value of 24.25% and 13.57%, respectively. The alkaline protease hydrolysate had significantly lower superoxide anion radical scavenging capacity and Fe2+ chelating ability (P < 0.01) but higher hydroxyl radical scavenging capacity than the trypsin hydrolysate (P > 0.05). For both hydrolysates, Cu2+ chelating ability, DPPH radical scavenging capacity and reducing power increased with increasing concentration from 1 to 5 mg/mL, and Cu2+chelating ability was lower than Fe2+ chelating ability (P > 0.05). Significant difference (P < 0.01) was found as far as DPPH radical scavenging capacity and reducing power were concerned. In summary, the two proteases had different impacts on the antioxidant activity of hydrolysates and the alkaline protease hydrolysate better antioxidant properties.Keywords: Qula casein; alkaline protease; trypsin; enzymatic hydrolysis process; antioxidant activity
收稿日期:2018-04-28
基金项目:国家自然科学基金地区科学基金项目(31560430);甘肃农业大学伏羲杰出人才培育计划项目(No.Gaufx-02J02)
第一作者简介:刘倩霞(1992—)(ORCID: 0000-0002-8936-4702),女,硕士研究生,研究方向为乳品科学。E-mail: 2425770387@qq.com
*通信作者简介:杨富民(1961—)(ORCID: 0000-0003-0748-2631),男,教授,博士,研究方向为畜产品加工与品质控制。E-mail: yfumin@163.com赵保堂(1985—)(ORCID: 0000-0003-4966-1822),男,讲师,博士,研究方向为天然产物开发。E-mail: zhaobaotang@126.com
DOI:10.7506/spkx1002-6630-20180428-366
中图分类号:TS252.42
文献标志码:A
文章编号:1002-6630(2019)08-0225-10
引文格式:
刘倩霞, 刘东, 张俊, 等. 2 种蛋白酶酶解曲拉干酪素条件优化及抗氧化性比较[J]. 食品科学, 2019, 40(8): 225-234.
DOI:10.7506/spkx1002-6630-20180428-366. http://www.spkx.net.cn
LIU Qianxia, LIU Dong, ZHANG Jun, et al. Optimization of hydrolysis conditions of Qula casein with two proteases and comparative antioxidant activity of hydrolysates[J]. Food Science, 2019, 40(8): 225-234. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20180428-366. http://www.spkx.net.cn

 碱性蛋白酶 胰蛋白酶 碱性蛋白酶 胰蛋白酶 碱性蛋白酶 胰蛋白酶 碱性蛋白酶 胰蛋白酶-1 3.0 2.0 45 40 120 2 500 8.0 7.0 0 3.5 2.5 50 45 140 3 000 8.5 7.5 1 4.0 3.0 55 50 160 3 500 9.0 8.0
碱性蛋白酶 胰蛋白酶 碱性蛋白酶 胰蛋白酶 碱性蛋白酶 胰蛋白酶 碱性蛋白酶 胰蛋白酶-1 3.0 2.0 45 40 120 2 500 8.0 7.0 0 3.5 2.5 50 45 140 3 000 8.5 7.5 1 4.0 3.0 55 50 160 3 500 9.0 8.0