可食性膜以其取材方便、可食用、易被生物降解、对环境无污染等优点,成为食品包装材料的重要研究方向[1]。其中,多糖类可食性膜因其均匀、透明、有适宜的机械性能等特点日益受到关注。目前,用于制备多糖类可食性膜的基材主要有淀粉、纤维素、壳聚糖、普鲁兰多糖、海藻酸钠、魔芋葡甘聚糖、果胶等[2-5],其中壳聚糖具有生物可降解性、较好的生物相容性、广谱抑菌性和优良的成膜特性而被广泛使用,但其抑菌活性较弱[6-9]。为弥补以上不足,通常将抑菌剂直接添加到壳聚糖中制备可食性抑菌膜[10-12]。啤酒花软树脂成分之一的β-酸具有较强的抑菌作用,其氢化衍生物六氢-β-酸抑菌、防腐活性更强[13],还具有抗肿瘤、抗氧化等功效[14],在近年来的研究中逐渐被关注。
对于可食性功能膜而言,功能性添加剂是提供包装膜功能活性的重要组分。前期对六氢-β-酸的抑菌和抗氧化活性的研究已表明,六氢-β-酸具有较强的抗氧化和抑菌活性,对大肠杆菌和金黄葡萄球菌的最小抑菌浓度小于20 µg/mL[15-16]。综合考虑六氢-β-酸的水溶性及抑菌活性的问题,通过预实验比较,确定1 000 µg/mL添加量研究壳聚糖-六氢-β-酸可食性抑菌膜的制备工艺。机械性能是可食性膜中的重要性能,其中抗拉强度(tensile strength,TS)和断裂伸长率(elongation at break,EB)是包装材料非常重要的参数[17]。TS表示膜抵抗拉伸的能力,以维持膜的结构完整性。EB与膜断裂时的拉伸性有关,使膜具有柔软性。因此,选择TS和EB作为评价指标,优化壳聚糖-六氢-β-酸可食性抑菌膜的工艺条件。
本研究以膜的机械性能为考察指标,以六氢-β-酸为抑菌剂,在单因素试验结合正交试验优化甘油体积分数、壳聚糖质量浓度及干燥温度及其交互作用对制备壳聚糖-六氢-β-酸可食性抑菌膜影响的基础上,研究抑菌剂六氢-β-酸在55%、75%、95%乙醇溶液中(模拟含有超过20%乙醇溶液的食品体系、油水乳浊液体系、油性食品体系)的释放;并以Peppas和Peleg方程进行拟合,确定抑菌剂的释放规律,以期为壳聚糖-六氢-β-酸可食性抑菌膜的开发应用提供理论支持。
壳聚糖(脱乙酰度>90%) 上海蓝季科技发展有限公司;六氢-β-酸(纯度≥95%) 实验室制备[18];甘油(质量分数≥98.0%) 西安化学试剂厂;乙酸、无水乙醇等均为分析纯;实验用水为二次蒸馏水。
DF-II型集热式磁力加热搅拌器 金坛市医疗仪器厂;FAH04N型电子天平 上海民桥精密科学仪器有限公司;DPH-420型电热恒温培养箱 北京市永光明仪器厂;KQ5200B型超声波清洗器 昆山市超声仪器有限公司;H5KT型静态力学测试仪 英国Tinus Olsen公司;UV-5300PC型紫外-可见分光光度计 上海元析仪器有限公司。
1.3.1 单因素试验
1.3.1.1 甘油体积分数的确定
将1 g壳聚糖溶解于50 mL体积分数2%乙酸溶液中,70 ℃搅拌至完全溶解,得到2 g/100 mL壳聚糖溶液。待冷却至室温后,搅拌下分别加入与壳聚糖溶液体积分数为1%、2%、3%、4%甘油,25 ℃搅拌1 h,加入10 mg/mL六氢-β-酸溶液5 mL,25 ℃搅拌1 h后,静置过夜。超声脱气2 h后,取21 g膜液,流延法将膜液铺在17.5 cm×7.5 cm玻璃板上,40 ℃干燥20 h后,揭膜。以膜的机械性能为指标,确定甘油最佳体积分数。
1.3.1.2 壳聚糖质量浓度的确定
分别将0.5、0.75、1、1.25 g壳聚糖溶解于50 mL体积分数2%乙酸溶液中,70 ℃搅拌至完全溶解,得到1、1.5、2、2.5 g/100 mL壳聚糖溶液。待冷却至室温后,加入1.3.1.1节确定最佳体积分数甘油,后续膜的制备过程和测定方法同1.3.1.1节,确定壳聚糖最佳质量浓度。
1.3.1.3 干燥温度的确定
在1.3.1.1节和1.3.1.2节结果基础上按照1.3.1.1节的步骤铺膜,分别于30、40、50、60 ℃干燥20 h后,揭膜。以膜的机械性能为指标,确定最佳干燥温度。
1.3.2 正交试验
在单因素试验结果的基础上,以甘油体积分数、壳聚糖质量浓度、干燥温度为影响因素,设计正交试验,以膜TS和EB评分和为指标,对壳聚糖-六氢-β-酸可食性抑菌膜的制备条件进行优化,确定膜的最佳工艺。
TS和EB评分按如下方法计算:设正交试验的组数为n,每组正交试验的测定次数均为3 次,则TS和EB均有3n 个数据,分别表示为TS11,…,TSn3和EB11,…,EBn3。令min{TS11,…,TSn3}或min{EB11,…,EBn3}=1 分,max{TS11,…,TSn3}或max{EB11,…,EBn3}=10 分,则将TS评分与对应EB评分之和作为正交试验的评价指标。
1.3.3 膜的机械性能测定
分别在制备好的膜中取5 个点,用游标卡尺测定其厚度,取平均值。将膜切成10 cm×2 cm大小的膜片,用静态力学测试仪测定膜的TS和EB。初始夹距为33 mm,拉伸速率为5 mm/min[19-20]。TS和EB的计算见式(1)、(2):
式中:F为拉伸时的最大拉力/N;L为膜的宽度/mm;d为膜的厚度/mm。
式中:L0为膜的初始长度/mm;L1为膜断裂时的长度/mm。
1.3.4 释放实验
1.3.4.1 六氢-β-酸标准曲线的制作
准确称取105 ℃烘干至恒质量的六氢-β-酸10 mg,甲醇溶解并定容至100 mL,得六氢-β-酸标准溶液。分别移取六氢-β-酸标准溶液0.2、0.5、1.0、1.5、2.0、2.5 mL于10 mL容量瓶中,用甲醇定容至刻度,于350 nm波长处测定吸光度。以吸光度A对六氢-β-酸质量浓度C(μg/mL)进行拟合,得回归方程为A=0.052 4C+0.001 4,R2=0.999 1,线性范围为2~25 μg/mL。
1.3.4.2 六氢-β-酸释放量的测定
将最佳工艺所制备的膜裁剪为1 cm×2 cm的长条,置于100 mL具塞锥形瓶中,加入55%、75%、95%乙醇溶液50 mL,分别于25、30、35 ℃释放一定时间,取1 mL摇匀后的释放液测定350 nm波长处的吸光度,以相应释放溶剂为参比,根据标准曲线计算六氢-β-酸含量,释放量按式(3)计算:
1.3.4.3 释放模型的建立
采用2 种经验模型确定释放实验的机制,利用Korsmeyer-Peppas模型的广义表达式研究聚合物松弛导致活性成分从聚合物向溶剂中的扩散,其方程见式(4):
式中:MF,t/MF,e为在t时释放活性成分的百分比;k为与扩散过程有关的速率常数;n为扩散指数,表示与释放机制相关的参数。n≤0.5,说明释放过程是按照Fick扩散或准Fick扩散进行;n>0.5,为非Fick扩散,即扩散和聚合物松弛的速率相当[21-22]。
Peleg模型主要用于根据实验数据预测释放动力学,见公式(5):
式中:MF,t为t时溶剂中活性成分的含量;k1为与扩散过程开始时质量转移率成反比的模型的动力学常数;k2为与渐近值有关的模型常数,主要与平衡值有关(1/MF,e,其中MF,e为平衡时释放活性成分的量)[23-24]。
1.3.4.4 扩散系数
对于短期释放(MF,t/MF,e<0.67)的扩散系数计算见式(6)[25]:
以MF,t/MF,e对t0.5进行线性拟合,斜率(S)的表达式见式(7):根据所拟合方程的斜率,按式(8)计算扩散系数Dp:
式中:MF,t/MF,e为在t时释放的活性成分的百分比;Dp为扩散系数;Lp为膜厚度,全浸泡释放实验中为膜厚度的一半。
所有数据均平行3 次测定,结果以 ±s表示。以Origin 8.6软件作图并进行释放实验的数据处理。
±s表示。以Origin 8.6软件作图并进行释放实验的数据处理。
2.1.1 甘油体积分数对膜机械性能的影响

图 1 甘油体积分数对膜机械性能的影响
Fig. 1 Effect of glycerol concentration on mechanical properties of film
聚合物形成的膜强度大,易脆裂,具有较高的TS和较低的EB,不能用于食品包装,通常加入增塑剂对其机械性能进行改善[26]。甘油是可食性膜中最常用的增塑剂,其对膜机械性能的影响如图1所示。甘油对膜的TS和EB具有显著影响。随着甘油体积分数的逐渐增大,膜的TS显著降低,而EB先增大后基本稳定。这主要是甘油分子容易插入到壳聚糖分子链中,破坏壳聚糖分子间的氢键作用,使其与壳聚糖结合,增加聚合物分子间的距离,使膜变得柔软,从而TS降低,而EB增大[27]。综合考虑,甘油体积分数为2%时,膜的TS和EB均较优。
2.1.2 壳聚糖质量浓度对膜机械性能的影响
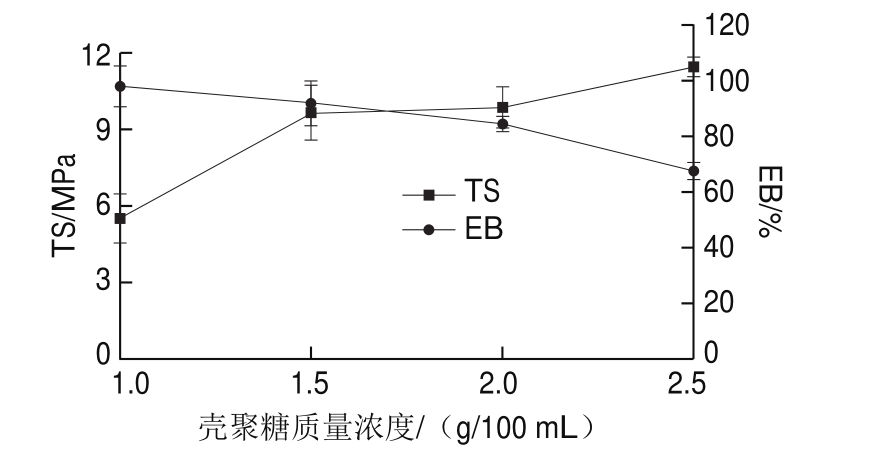
图 2 壳聚糖质量浓度对膜机械性能的影响
Fig. 2 Effect of chitosan concentration on mechanical properties of film
由图2可知,随着壳聚糖质量浓度的增大,膜的TS呈现逐渐增加的趋势,EB呈现逐渐降低的趋势。这是因为单位体积内壳聚糖分子的增加,增加氢键的数目,使高分子间的结合更加紧密,从而使TS增大,EB减小。当壳聚糖质量浓度从1.5 g/100 mL增大到2 g/100 mL时,TS和EB的变化均不显著,因此,壳聚糖质量浓度为1.5~2 g/100 mL时,膜的机械性能较好。

图 3 干燥温度对膜机械性能的影响
Fig. 3 Effect of drying temperature on mechanical properties of film
2.1.3 干燥温度对膜机械性能的影响由图3可知,干燥温度对膜的TS和EB影响较显著。随着干燥温度的升高,膜的TS显著增大,EB逐渐降低。当干燥温度从40 ℃升高到50 ℃时,膜的TS增加幅度比较大;而EB几乎不变。当继续升高温度时,TS变化平缓,而EB显著降低。这主要是膜液在干燥过程中受温度的影响,膜液中并不只是单纯的溶剂蒸发,壳聚糖和甘油之间的氢键作用会随温度的变化而相应改变。温度过低时,分子运动速度相对缓慢,溶剂蒸发慢,使成膜分子间无法有序交联形成较规则的聚集态结构,且膜中含水分多,表面较黏。温度过高时,使溶剂蒸发速度过快,导致膜表面出现针孔、褶皱厚薄不均等缺陷。另外,温度过高使壳聚糖与甘油过早地被沉积下来,成膜分子间结构紊乱,从而降低膜的机械性能[28]。因此,综合考虑,选择干燥温度为40~50 ℃。
通过单因素试验确定甘油体积分数、壳聚糖质量浓度和干燥温度的水平。以TS和EB的综合评分为指标,设计L9(34)正交试验对膜的制备工艺进行优化,并采用重复观测值的方差分析对试验结果进行分析。正交试验结果见表1、方差分析见表2。
表 1 L9(34)正交试验设计与结果
Table 1 Results of L9 (34) orthogonal array design
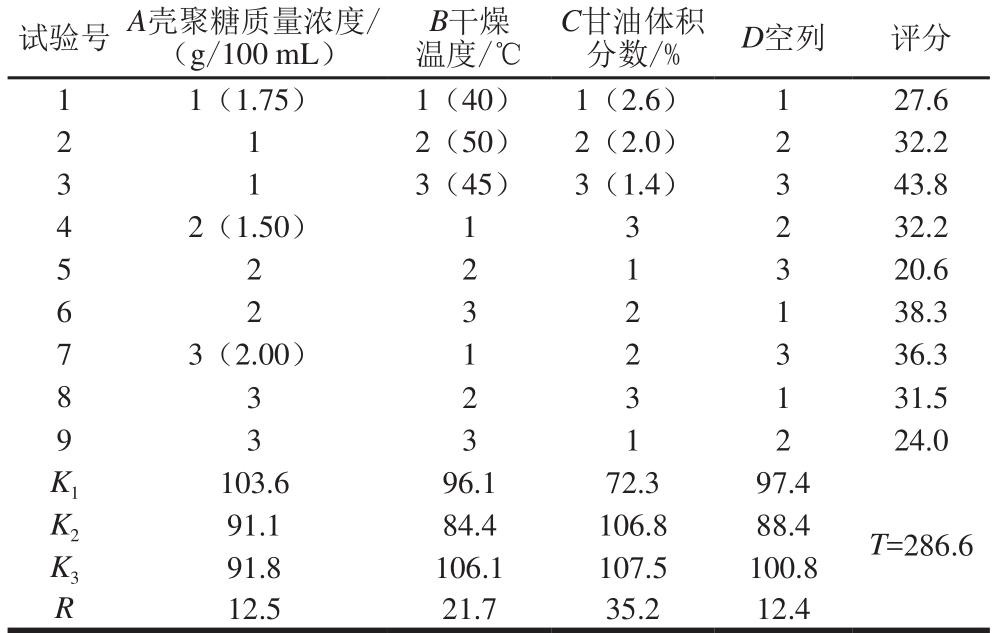
试验号 A壳聚糖质量浓度/(g/100 mL)B干燥温度/℃C甘油体积分数/% D空列 评分1 1(1.75) 1(40) 1(2.6) 1 27.6 2 1 2(50) 2(2.0) 2 32.2 3 1 3(45) 3(1.4) 3 43.8 4 2(1.50) 1 3 2 32.2 5 2 2 1 3 20.6 6 2 3 2 1 38.3 7 3(2.00) 1 2 3 36.3 8 3 2 3 1 31.5 9 3 3 1 2 24.0 K1 103.6 96.1 72.3 97.4 T=286.6 K2 91.1 84.4 106.8 88.4 K3 91.8 106.1 107.5 100.8 R 12.5 21.7 35.2 12.4
表 2 L9(34)正交试验的方差分析Table 2 Analysis of variance of L9 (34) orthogonal array design
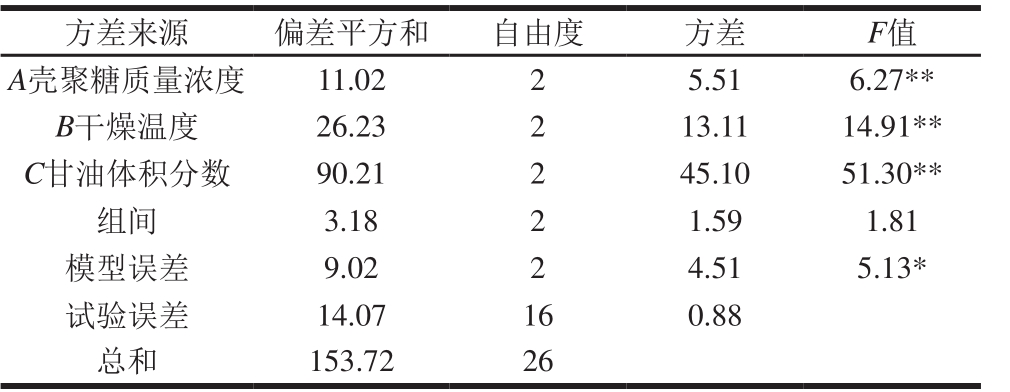
注:**.差异极显著,P<0.01;*.差异显著,P<0.05。下同。F0.01(2,16)=6.23,F0.05(2,16)=3.63。
方差来源 偏差平方和 自由度 方差 F值A壳聚糖质量浓度 11.02 2 5.51 6.27**B干燥温度 26.23 2 13.11 14.91**C甘油体积分数 90.21 2 45.10 51.30**组间 3.18 2 1.59 1.81模型误差 9.02 2 4.51 5.13*试验误差 14.07 16 0.88总和 153.72 26
由表2可看出,甘油体积分数、壳聚糖质量浓度、干燥温度对膜的机械性能影响均极显著。从模型误差和试验误差显著性可看出,两者存在显著差异,这主要是未考虑因素间的交互作用导致的。为进一步优化膜的制备工艺,除甘油体积分数、壳聚糖质量浓度、干燥温度3 个影响因素外,还考虑三者间的交互作用,且从表1筛选2 个较优水平,进行L8(27)正交试验,结果见表3。
表 3 L8(27)正交试验设计与结果
Table 3 Results of L8 (27) orthogonal array design

试验号A壳聚糖质量浓度/%B干燥温度/℃ABC甘油体积分数/%ACBC空列评分1 1(1.75) 1(45) 1 1(2.0) 1 1 1 30.1 2 1 1 1 2(1.4) 2 2 2 27.2 3 1 2(40) 2 1 1 2 2 32.2 4 1 2 2 2 2 1 1 32.8 5 2(2.00) 1 2 1 2 1 2 15.7 6 2 1 2 2 1 2 1 28.2 7 2 2 1 1 2 2 1 22.5 8 2 2 1 2 1 1 2 31.3
K1 122.2 101.2 111.0 100.5 121.8 109.9 113.5 K2 97.7 118.7 109.0 119.5 98.2 110.1 106.4T=220.0 R 24.5 17.5 2.0 19.0 23.6 0.2 7.1
从表3可以看出,A1B2C2组合,即壳聚糖质量浓度1.75 g/100 mL、干燥温度40 ℃、甘油体积分数1.4%时,膜的机械性能最佳。从极差可知,影响因素的大小为A>AC>C>B>AB>BC。各因素及交互作用的方差分析见表4。
表 4 L8(27)正交试验方差分析
Table 4 Analysis of variance of L8 (27) orthogonal array design
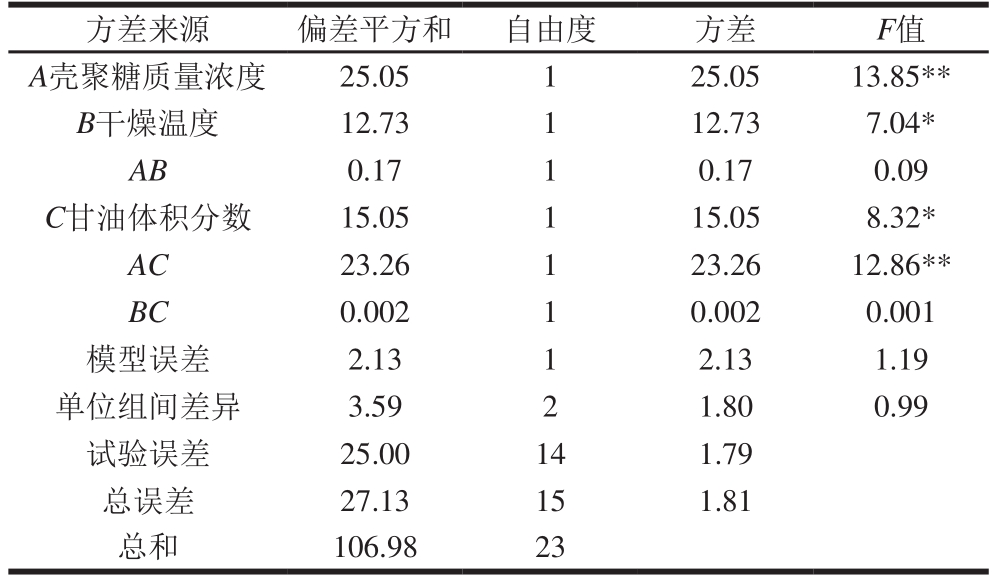
注:F0.01(1,14)=8.86,F0.05(1,14)=4.60,F0.01(1,15)=8.68,F0.05(1,15)=4.55,F0.01(2,15)=6.36,F0.05(2,15)=3.68。
方差来源 偏差平方和 自由度 方差 F值A壳聚糖质量浓度 25.05 1 25.05 13.85**B干燥温度 12.73 1 12.73 7.04*AB 0.17 1 0.17 0.09 C甘油体积分数 15.05 1 15.05 8.32*AC 23.26 1 23.26 12.86**BC 0.002 1 0.002 0.001模型误差 2.13 1 2.13 1.19单位组间差异 3.59 2 1.80 0.99试验误差 25.00 14 1.79总误差 27.13 15 1.81总和 106.98 23
从表4可看出,模型误差与试验误差不存在显著差异,说明优化模型正确。影响膜机械性能的因素大小顺序为A>AC>C>B,而AB和BC对其无影响。
可食性膜中抑菌剂的释放速率是影响食品货架期的重要因素,太快使得其抑菌有效期缩短,太慢则达不到明显的抑菌效果,因此,需要其具有合适的释放速率,即抑菌剂的释放速率略大于有害菌的临界生长速率[29]。结合数学模型确定抑菌剂的释放规律,对于评估抑菌剂在食品中的浓度,确定抑菌剂保持在关键抑制浓度的时间起着重要的作用。

图 4 六氢-β-酸在乙醇溶液中的释放曲线
Fig. 4 Release curves of hexahydro-β-acids in ethanol aqueous solutions
从图4可知,六氢-β-酸在95%乙醇溶液中释放缓慢,而在75%和55%乙醇溶液的释放较快。这与于文喜[30]关于山梨酸钾从低甲氧基果胶/羧甲基纤维素膜中释放到95%和55%乙醇溶液的研究结果一致。出现这种现象的原因主要是乙醇含量减小,壳聚糖-六氢-β-酸膜更容易溶胀,导致高分子网络结构遭到破坏,从而增大六氢-β-酸的释放量。在各释放体系中,随着温度的升高,释放量总体呈逐渐增大的趋势。另外,温度越高,分子运动加剧而使溶出速率增大,使六氢-β-酸的释放也越快,到达平衡的时间缩短。这一结果也出现在白藜芦醇[31]和叔丁基对苯二酚[32]从聚乳酸膜向乙醇中的迁移研究。
分别以Peppas模型和Peleg模型对实验数据进行处理,计算其对应的参数,结果如表5所示。
表 5 Peppas和Peleg模型的相关参数
Table 5 Parameters of Peppas and Peleg models
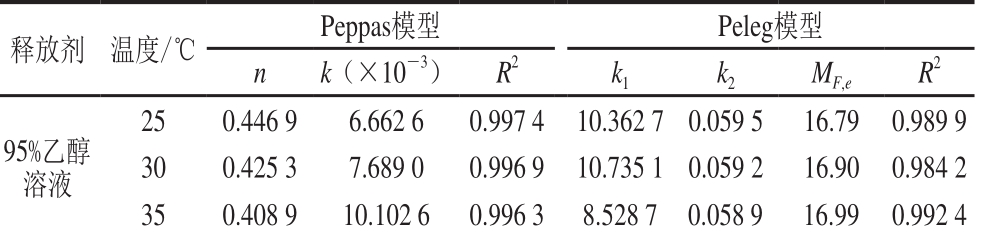
释放剂 温度/℃ Peppas模型 Peleg模型n k(×10-3) R2 k1 k2 MF,e R2 95%乙醇溶液25 0.446 9 6.662 6 0.997 4 10.362 7 0.059 5 16.79 0.989 9 30 0.425 3 7.689 0 0.996 9 10.735 1 0.059 2 16.90 0.984 2 35 0.408 9 10.102 6 0.996 3 8.528 7 0.058 9 16.99 0.992 4
按照正交试验筛选出的膜的最佳制备条件:壳聚糖质量浓度1.75 g/100 mL、干燥温度40 ℃、甘油体积分数1.4%,进行3 次验证实验,结果可得TS分别为29.70、29.01、29.07 MPa,EB分别为83.45%、80.08%、80.33%。TS和EB的相对标准偏差分别为1.31%、1.91%。3 次验证的结果与表3正交试验的第4组的结果(TS为28.50 MPa,EB为81.22%)无显著差异,且相对标准偏差较小,说明该工艺具有可重复性。
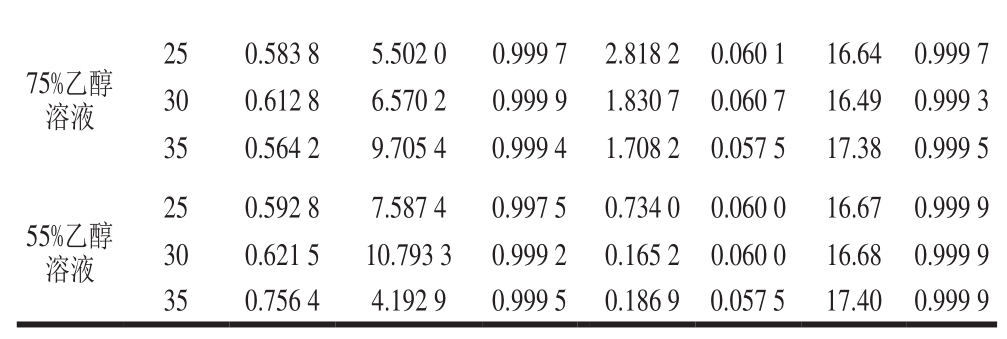
75%乙醇溶液25 0.583 8 5.502 0 0.999 7 2.818 2 0.060 1 16.64 0.999 7 30 0.612 8 6.570 2 0.999 9 1.830 7 0.060 7 16.49 0.999 3 35 0.564 2 9.705 4 0.999 4 1.708 2 0.057 5 17.38 0.999 5 55%乙醇溶液25 0.592 8 7.587 4 0.997 5 0.734 0 0.060 0 16.67 0.999 9 30 0.621 5 10.793 3 0.999 2 0.165 2 0.060 0 16.68 0.999 9 35 0.756 4 4.192 9 0.999 5 0.186 9 0.057 5 17.40 0.999 9
根据Peppas模型对六氢-β-酸在95%、75%和55%乙醇溶液的释放进行拟合,R2均在0.995以上,说明具有较好的拟合度。从n值可知,六氢-β-酸在95%乙醇溶液中释放的n值均小于0.5,说明其扩散机制为准Fick扩散,而在75%和55%乙醇溶液n值均大于0.5,为非Fick扩散。为进一步研究六氢-β-酸在75%和55%乙醇溶液的释放机制,采用Peleg模型对其进行拟合,发现R2均大于0.995,且其计算的最大释放量与实验中的最大释放量无明显差异(t<t临界值),说明Peleg模型能够较好地预测六氢-β-酸在75%和55%乙醇溶液中的释放动力学。

图 5 温度对六氢-β-酸在乙醇水溶液中扩散系数的影响
Fig. 5 Effect of temperature on the diffusion coefficient of hexahydroβ-acids in ethanol aqueous solutions
扩散系数是衡量活性成分释放快慢的物理量。从图5可看出,随着温度的升高,扩散系数总体呈逐渐上升的趋势,加之膜的溶胀性,扩散系数在55%乙醇溶液中变化最为明显。这主要是由于聚合物网络结构松弛后,升高温度,分子热运动加剧,自由体积变大,扩散系数也越大[33]。因此,释放溶剂中的含水量和温度是影响六氢-β-酸扩散的重要因素。
以机械性能为评价指标,通过单因素试验结合正交试验优化壳聚糖-六氢-β-酸可食性抑菌膜的制备工艺,其最佳制备条件为:壳聚糖质量浓度1.75 g/100 mL、干燥温度40 ℃、甘油体积分数1.4%,此工艺条件下膜TS为29.26 MPa,EB为81.29%,影响因素依次为壳聚糖质量浓度>壳聚糖质量浓度与甘油体积分数交互作用>甘油体积分数>干燥温度。以六氢-β-酸的释放量为指标,研究六氢-β-酸在95%、75%和55%乙醇溶液的释放。通过Peppas和Peleg方程可知,六氢-β-酸在95%乙醇溶液中的释放过程为Fick扩散,而75%和55%乙醇溶液中符合Peleg方程;对扩散系数的分析表明释放溶剂中含水量和温度是影响六氢-β-酸扩散的重要因素。本研究建立壳聚糖-六氢-β-酸可食性抑菌膜的制备工艺及释放模型,为该抑菌膜的开发应用提供理论支持。
[1] ESPITIA P J P, DU W X, AVENA-BUSTILLOS R D J, et al. Edible films from pectin: physical-mechanical and antimicrobial properties:a review[J]. Food Hydrocolloids, 2014, 35: 287-296. DOI:10.1016/j.foodhyd.2013.06.005.
[2] 李帅, 钟耕辉, 刘玉梅. 多糖类可食性膜的研究进展[J]. 食品科学,2018, 39(3): 309-316. DOI:10.7506/spkx1002-6630-201803046.
[3] ATARÉS L, CHIRALT A. Essential oils as additives in biodegradable films and coatings for active food packaging[J]. Trends in Food Science &Technology, 2016, 48: 51-62. DOI:10.1016/j.tifs.2015.12.001.
[4] WANG K, WU K, XIAO M, et al. Structural characterization and properties of konjac glucomannan and zein blend films[J].International Journal of Biological Macromolecules, 2017, 105: 1096-1104. DOI:10.1016/j.ijbiomac.2017.07.127.
[5] WEI X Q, PANG J, ZHANG C F, et al. Structure and properties of moisture-resistant konjac glucomannan films coated with shellac/stearic acid coating[J]. Carbohydrate Polymers, 2015, 118: 119-125.DOI:10.1016/j.carbpol.2014.11.009.
[6] GENSKOWSKY E, PUENTE L A, PÉREZ-LVAREZ J A, et al.Assessment of antibacterial and antioxidant properties of chitosan edible films incorporated with maqui berry (Aristotelia chilensis)[J].LWT-Food Science and Technology, 2015, 64(2): 1057-1062.DOI:10.1016/j.lwt.2015.07.026.
[7] ULBIN-FIGLEWICZ N, ZIMOCH-KORZYCKA A, JARMOLUK A.Antibacterial activity and physical properties of edible chitosan films exposed to low-pressure plasma[J]. Food and Bioprocess Technology,2014, 7(12): 3646-3654. DOI:10.1007/s11947-014-1379-6.
[8] MOHAMED C, CLEMENTINE K A, DIDIER M, et al. Antimicrobial and physical properties of edible chitosan films enhanced by lactoperoxidase system[J]. Food Hydrocolloids, 2013, 30(2): 576-580.DOI:10.1016/j.foodhyd.2012.07.018.
[9] 孟晓荣, 张敏, 胡新婷, 等. 壳聚糖对食品中常见菌的抑制研究[J]. 食品与机械, 2007, 23(2): 90-92. DOI:10.13652/j.issn.1003-5788.2007.02.025.
[10] RUIZ-NAVAJAS Y, VIUDA-MARTOS M, SENDRA E, et al. In vitro antibacterial and antioxidant properties of chitosan edible films incorporated with Thymus moroderi or Thymus piperella essential oils[J]. Food Control, 2013, 30(2): 386-392. DOI:10.1016/j.foodcont.2012.07.052.
[11] MA Q M, ZHANG Y, CRITZER F, et al. Physical, mechanical, and antimicrobial properties of chitosan films with microemulsions of cinnamon bark oil and soybean oil[J]. Food Hydrocolloids, 2016, 52:533-542. DOI:10.1016/j.foodhyd.2015.07.036.
[12] BOURBON A I, PINHEIRO A C, CERQUEIRA M A, et al.Physico-chemical characterization of chitosan-based edible films incorporating bioactive compounds of different molecular weight[J].Journal of Food Engineering, 2011, 106(2): 111-118. DOI:10.1016/j.jfoodeng.2011.03.024.
[13] 肖小年, 吴凌伟, 范青生, 等. 酒花浸膏及其异构化衍生物抗食品腐败菌的初步研究[J]. 天然产物研究与开发, 2001, 13(4): 47-50.DOI:10.16333/j.1001-6880.2001.04.015.
[14] 肖小年, 马永花, 易醒, 等. 六氢β-酸的抗氧化功能研究[J]. 江西农业大学学报, 2008, 30(3): 517-520. DOI:10.13836/j.jjau.2008105.
[15] 徐海宁, 刘玉梅. 六氢β-酸环糊精包合物与食品添加剂的协同抗氧化活性[J]. 食品科学, 2018, 39(7): 33-40. DOI:10.7506/spkx1002-6630-201807006.
[16] 徐海宁, 普燕, 刘玉梅. 六氢β-酸环糊精包合物的抑菌活性及其稳定性[J]. 精细化工, 2018, 35(1): 51-57; 157. DOI:10.13550/j.jxhg.2018.01.008.
[17] LIU J, LIU S, WU Q Q, et al. Effect of protocatechuic acid incorporation on the physical, mechanical, structural and antioxidant properties of chitosan film[J]. Food Hydrocolloids, 2017, 73: 90-100.DOI:10.1016/j.foodhyd.2017.06.035.
[18] 刘玉梅, 汤坚, 刘奎钫, 等. 新型抑菌剂六氢-β-酸的合成工艺研究[J]. 食品工业科技, 2008, 29(11): 225-229. DOI:10.13386/j.issn1002-0306.2008.11.044.
[19] SUN L J, SUN J J, CHEN L, et al. Preparation and characterization of chitosan film incorporated with thinned young apple polyphenols as an active packaging material[J]. Carbohydrate Polymers, 2017, 163:81-91. DOI:10.1016/j.carbpol.2017.01.016.
[20] 高丹丹, 江连洲, 张超, 等. 响应面法优化普鲁兰多糖-明胶可食性膜制备工艺[J]. 食品科学, 2012, 33(18): 21-24.
[21] SIEPMANNA J, PEPPAS N A. Modeling of drug release from delivery systems based on hydroxypropyl methylcellulose (HPMC)[J].Advanced Drug Delivery Reviews, 2001, 48: 139-157.
[22] 张玉亭, 雷桥, 包建强, 等. 乳清蛋白抗菌薄膜中山梨酸钾的扩散性研究[J]. 食品工业科技, 2015, 36(13): 262-265. DOI:10.13386/j.issn1002-0306.2015.13.047.
[23] PELEG M. An empirical model for the description of moisture sorption curves[J]. Journal of Food Science, 1988, 53(4): 1216-1219.
[24] TALON E, TRIFKOVIC K T, VARGAS M, et al. Release of polyphenols from starch-chitosan based films containing thyme extract[J]. Carbohydrate Polymers, 2017, 175: 122-130. DOI:10.1016/j.carbpol.2017.07.067.
[25] YU W X, HU C Y, WANG Z W. Release of potassium sorbate from pectin-carboxymethyl cellulose films into food simulant[J]. Journal of Food Processing and Preservation, 2017, 41(2): e12860. DOI:10.1111/jfpp.12860.
[26] 卢星池, 肖茜, 邓放明. 多糖类可食用膜研究进展[J]. 食品与机械,2014, 30(4): 261-265. DOI:10.13652/j.issn.1003-5788.2014.04.065.
[27] GALDEANO M C, MALI S, GROSSMANN M V E, et al. Effects of plasticizers on the properties of oat starch films[J]. Materials Science and Engineering C, 2009, 29(2): 532-538. DOI:10.1016/j.msec.2008.09.034.
[28] 陈金凤, 文玉, 赵国华. 响应面法优化阿魏酸淀粉酯膜制备工艺[J].食品科学, 2015, 36(24): 23-28. DOI:10.7506/spkx1002-6630-201524004.
[29] 陈默. 大豆分离蛋白抑菌膜性能评价及抑菌剂释放研究[D]. 无锡:江南大学, 2010: 9.
[30] 于文喜. 果胶/纤维素基抗菌膜制备及抗菌剂释放研究[D]. 无锡: 江南大学, 2016: 44-48.
[31] SOTO-VALDEZ H, AURAS R, PERALTA E. Fabrication of poly(lactic acid) films with resveratrol and the diffusion of resveratrol into ethanol[J]. Journal of Applied Polymer Science, 2011, 121(2): 970-978. DOI:10.1002/app.33687.
[32] ALMASI H, GHANBARZADEH B, DEHGHANNYA J, et al.Development of a novel controlled-release nanocomposite based on poly (lactic acid) to increase the oxidative stability of soybean oil[J].Food Additives & Contaminants: Part A, 2014, 31(9): 1586-1597.DOI:10.1080/19440049.2014.935962.
[33] 钱浩杰, 穆宏磊, 郜海燕, 等. 聚乳酸抗菌包装中麝香草酚在食品模拟物中迁移规律[J]. 食品科学, 2018, 39(3): 274-281. DOI:10.7506/spkx1002-6630-201803041.
Preparation of Chitosan-Hexahydro-β-Acids Edible Antibacterial Films and Release Behavior of Antibacterial Agent
李帅, 钟耕辉, 陈婷, 等. 壳聚糖-六氢-β-酸可食性抑菌膜的制备及抑菌剂的释放[J]. 食品科学, 2019, 40(8): 235-241.