高效液相色谱-串联质谱法测定杂粮豆类中11 种真菌毒素
张新娜1,马丽艳1,2,*,潘赛超1,张春娇1,张永新1,周 昉1,黄昆仑1,2,戴蕴青1,2
(1.农业部农产品贮藏保鲜质量安全风险评估实验室(北京),北京 100083;2.中国农业大学食品科学与营养工程学院,北京 100083)
摘 要:利用高效液相色谱-串联质谱建立杂粮豆类中11 种真菌毒素(包括黄曲霉毒素B1、B2、G1、G2、赭曲霉毒素A、T-2毒素、脱氧雪腐镰刀菌烯醇、伏马毒素B1、B2和B3、玉米赤霉烯酮)同时检测的方法。实验对提取溶剂、提取时间和净化方式等进行优化,建立双体系联合提取方法,首先采用甲醇-水(70∶30,V/V)体系提取,再以乙腈-水(84∶16,V/V)体系二次提取,提取时间3 min,在此基础上采用C18吸附剂进行净化处理。结果表明,11 种毒素的线性范围良好,相关系数大于0.999,添加回收率为70.0%~108%,相对标准偏差为1.3%~8.6%。所建方法简单、快速、灵敏度高、重复性好,可满足杂粮豆类中11 种真菌毒素的同时检测需要。
关键词:杂粮豆类;真菌毒素;高效液相色谱-串联质谱仪
真菌毒素是一类由丝状真菌在适宜条件下产生的有毒次级代谢产物[1],迄今发现已有400多种真菌毒素[2],是继农药残留、重金属污染后,影响粮食质量安全的又一类关键风险因子。当前发现的主要威胁人类和动物健康的真菌毒素种类有黄曲霉毒素(aflatoxins,AF)、赭曲霉毒素A(ochratoxin,OTA)、伏马毒素(fumonisins,FB)、玉米赤霉烯酮(zearalenone,ZEN)、HT-2毒素、T-2毒素、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)、橘毒素、展青霉素、链格孢霉毒素等[3-4]。大量研究表明,真菌毒素可致DNA损伤,低浓度下即可对人和动物健康造成危害,使肝脏、肾脏和胃肠道发生病变,有些毒素还具有致癌、致畸、致突变等毒性[5-6]。
杂粮豆类是除大豆之外的小宗淀粉质豆类的总称,主要包括绿豆、豌豆、蚕豆、红小豆、扁豆、豇豆、芸豆、鹰嘴豆等[7]。杂粮豆类有一定的营养、保健和药用价值,随着饮食习惯和膳食结构的变化,人们对杂粮豆类的需要越来越多[8]。目前,粮食中真菌毒素的危害已经引起广泛重视,但是对杂粮豆类产品,由于产地分散,产量规模小,其安全问题还未引起足够的重视。但是,已有研究表明,在杂粮豆类的生长过程中易受到豆类根腐病、细菌性叶斑病、灰斑病、锈病、荞麦钩翅蛾等为主的病虫害的危害,从而影响产品产量和质量、埋下食品安全隐患[9]。目前对粮谷的真菌毒素报道很多[10-14],对豆类的研究主要集中在大豆上,在其他杂粮豆类中的研究较少[15-17]。Castillo等[18]研究发现黑豆可能存在链格孢霉毒素、ZEN和单端孢霉烯族毒素的污染风险。Tseng等[19-20]在白豆中检测到蛇形霉素、ZEN、T-2和FB1、AFB1、AFB2、AFG1、AFG2,赤豆和绿豆中检测到了FB1。Iha等[21]则发现不同加工处理过程可以减少黑白斑豆中OTA的污染水平。
真菌毒素的检测方法主要有薄层色谱法、气相色谱法、气相色谱-质谱法、酶联免疫吸附法、高效液相色谱法、高效液相色谱-串联质谱法等[22-30]。目前国家标准中测定真菌毒素的方法多针对某种或某类毒素,样品的前处理方法多采用固相萃取柱、真菌毒素专用净化柱或免疫亲和柱净化,选择性较强[31-34]。由于真菌毒素的种类较多,且同一样品可能污染多种真菌毒素,建立多种毒素同时测定的方法对于全面掌握真菌毒素的污染状况非常必要。高效液相色谱-质谱联用具有高选择性和灵敏度,可以同时检测多种化合物,在真菌毒素检测中的应用越来越广泛。与常见的小麦、稻谷、玉米等粮谷类样品相比,红豆、绿豆、黑豆等杂粮豆类中在色素、蛋白质、脂肪、碳水化合物等的含量有一定的差异,在质谱中基质对毒素离子化效果会产生一定的影响。因此,本实验针对杂粮豆类中易感染的真菌毒素,通过优化提取溶剂、提取时间、净化方式等,建立高效液相色谱-串联质谱同时检测多种真菌毒素的方法,为更好地监控杂粮豆类中真菌毒素的污染状况、实施质量安全监管、指导消费者安全膳食提供参考。
1 材料与方法
1.1 材料与试剂
红豆、绿豆和黑豆等样品分别购自北京市、河北省大型连锁超市,以及北京市及河北省县级农贸市场。
AFB1、AFB2、AFG1、AFG2、OTA、T-2毒素、DON、FB1、FB2、FB3、ZEN、MycoSep 226多功能净化柱美国Romer公司;乙腈、甲醇(均为色谱纯) 北京百灵威科技有限公司;C18吸附剂 安捷伦科技(中国)有限公司;Florisil吸附剂 天津博纳艾杰尔科技有限公司;超纯水(Millpore纯水仪制备)。
1.2 仪器与设备
6460高效液相色谱-串联质谱仪 美国安捷伦科技有限公司;涡旋振荡器 海门市其林贝尔仪器制造有限公司;YP5002电子天平 上海越平科学仪器有限公司;HC-3018离心机 安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 样品前处理
豆类样品混合均匀,用粉碎机粉碎,过40 目筛。
称取研磨好的样品5.0 g(精确到0.01)于50 mL离心管中,加入15.0 mL甲醇-水(70∶30,V/V),涡旋振荡3 min,在8 000 r/min离心5 min,上清液转移至干净容器中,再次向样品中加入10.0 mL乙腈-水(84∶16,V/V),涡旋振荡3 min,8 000 r/min离心5 min,合并上清液,混匀,取1 mL提取液于2 mL离心管中,加入30 mg C18吸附剂,涡旋30 s后离心,上清液过0.22 μm有机滤膜,待测。
1.3.2 色谱条件
色谱柱:Agilent Proshell 120 EC-C18(3.0 mm×100 mm,2.7 μm);流动相:A为0.1%甲酸溶液;B为乙腈;梯度洗脱程序:20% B保持1 min;5 min变为65% B;8 min变为85% B;保持2 min;10.01 min变为20% B保持6 min;柱温30 ℃;流速0.3 mL/min;进样量2.0 µL。
1.3.3 质谱条件
离子源:电喷雾离子源,正负模式切换;检测方式为多反应监测;离子源温度350 ℃;干燥器温度350 ℃;干燥器流速10 L/min;鞘气温度300 ℃;鞘气流速11 L/min;毛细管电压3 500 V;碰撞气为N2。
采用直接进样的方式,将一定浓度的真菌毒素标准溶液注入高效液相色谱-串联质谱中进行质谱条件优化,确定多反应监测参数。
1.4 数据分析
所有实验至少重复3 次,数据以平均值表示,采用Excel 2013软件进行统计分析和绘图。
2 结果与分析
2.1 质谱条件优化
分别在正离子和负离子模式下进行母离子扫描,设置扫描范围为200~800 u,确定不同模式下化合物的响应值。确定母离子后,进行子离子扫描,优化碰撞电压。优化结果表明,ZEN在负模式下灵敏度较高,其他化合物在正模式下灵敏度较高,11 种真菌毒素多反应监测质谱参数见表1,11 种真菌毒素基质标准溶液的总离子流图见图1。
表 1 11 种真菌毒素的多反应监测质谱参数
Table 1 Multiple reaction monitoring parameters for 11 mycotoxins
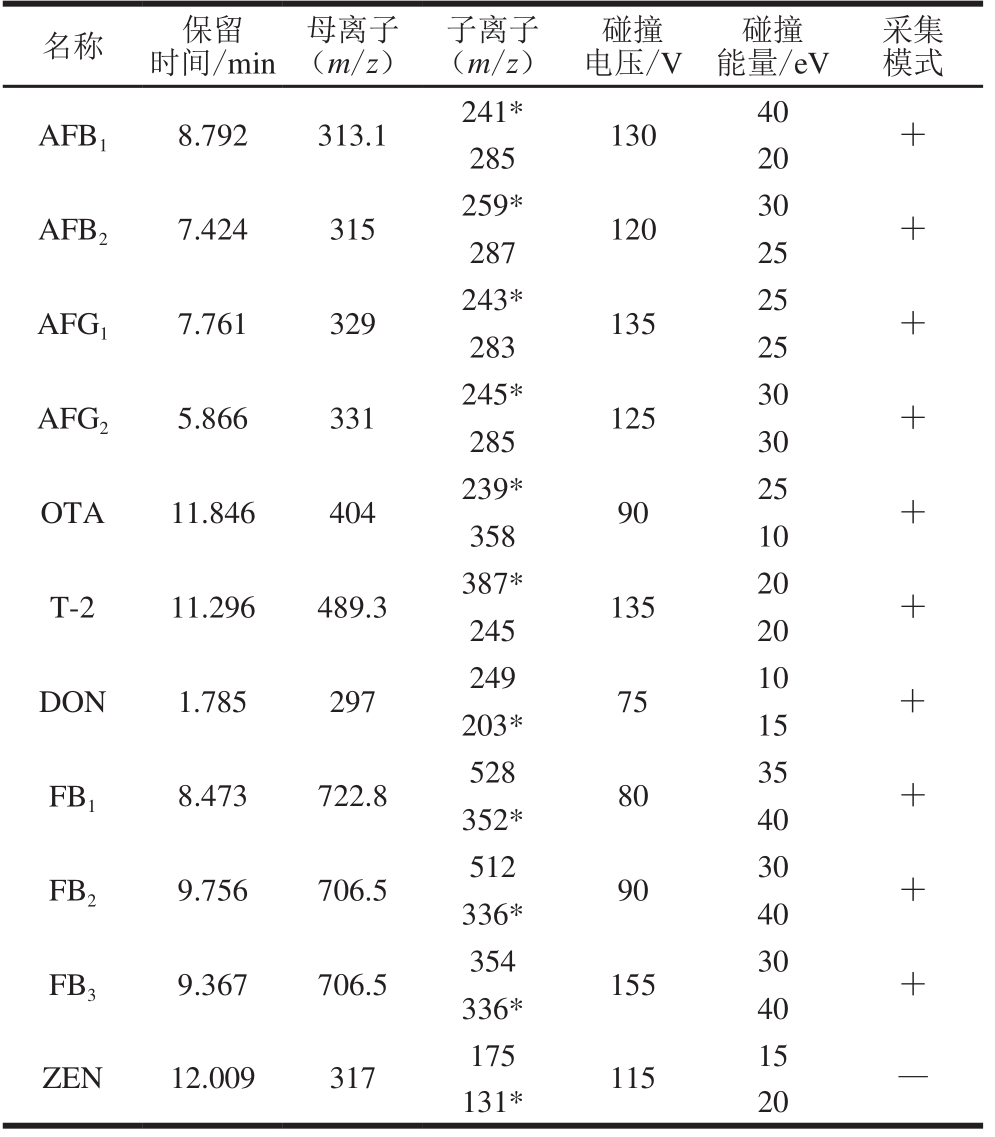
注:*.定量离子。
名称 保留时间/min母离子(m/z)子离子(m/z)碰撞电压/V碰撞能量/eV采集模式AFB1 8.792 313.1 241* 130 40 +285 20 AFB2 7.424 315 259* 120 30 +287 25 AFG1 7.761 329 243* 135 25 +283 25 AFG2 5.866 331 245* 125 30 +285 30 OTA 11.846 404 239* 90 25 +358 10 T-2 11.296 489.3 387* 135 20 +245 20 DON 1.785 297 249 75 10 +203* 15 FB1 8.473 722.8 528 80 35 +352* 40 FB2 9.756 706.5 512 90 30 +336* 40 FB3 9.367 706.5 354 155 30 +336* 40 ZEN 12.009 317 175 115 15 —131* 20
2.2 实验条件优化
2.2.1 提取溶剂优化
实验比较5 种提取溶液的提取效果,提取液分2 次提取,结果见图2。
大多数真菌毒素易溶于有机溶剂。乙腈和甲醇是目前最常用的两种提取溶剂,它们常与一定比例的水组合来提取不同极性的真菌毒素。乙腈-水(84∶16,V/V)是常用的组合,可用于AF、ZEN、DON等毒素的提 取[31,33,35]。 从 图2可 以 看 出 ,利用乙腈-水(84∶16, V/V)提取时,除FB1外,其他真菌毒素的回收率均能达到80%以上,这与B族FB的分子含有羧基基团,极性较强,在该提取溶剂溶解性差有关。在乙腈、甲醇和水3 种溶剂中,极性最大的为水,其次是甲醇,实验发现随着体系中甲醇比例的提高,对FB的提取率逐渐增加,但对其他真菌毒素,特别是AFB1的提取率有所下降。考虑到不同真菌毒素的极性差异,实验采用分步提取的方式进行提取,先用甲醇-水(70∶30,V/V)溶剂体系进行第1次提取,将FB等高极性的化合物提取出来,再用乙腈-水(84∶16,V/V)体系进行第2次提取,将AF等充分提取,从图2可以看出,经过双体系联合提取后,11 种真菌毒素均达到理想的提取效果。
2.2.2 提取时间优化
实验分别比较提取1、2、3、4 min的提取效果,结果表明,提取时间为1 min时DON、FB1、OTA和ZEN的回收率小于60%;提取时间为2 min时,除FB1外,回收率均超过了70%;当提取时间为3 min时,所有真菌毒素的回收率均大于70%,延长提取时间为4 min时,回收率无明显提高,而提取时间的延长可能会使化合物分解或产生变化[13]。因此,实验确定提取时间为3 min。
2.2.3 净化方式优化
在毒素的提取过程中样品中的碳水化合物、蛋白质、脂肪、色素等组分也部分被提取,不仅会影响痕量目标物的检测,也会对色谱、质谱系统造成污染。为降低基质效应,需要对提取液进行净化。MycoSep 226多功能净化柱在多组分真菌毒素的分析中应用较多[35-36],Florisil和C18吸附剂对脂类、非极性干扰物有一定的吸附作用。实验比较MycoSep 226多功能净化柱、Florisil和C18吸附剂的净化效果。结果发现提取液经MycoSep 226多功能净化柱净化后,FB1和OTA被吸附无法检测到,这与刘丹等[36]的研究一致。提取液中加入30 mg吸附剂净化后,Florisil对FB1有一定的吸附,而C18的净化效果良好,除FB1和ZEN的回收率在80%左右外,其他毒素的回收率均达90%以上,净化后效果良好。Sun Juan等[37]在研究谷物中多种毒素的提取方法时也发现C18吸附剂净化后,大多数真菌毒素的回收率为60.0%~101.7%,结果较为满意。实验发现随着C18吸附剂加入量的增加,也会对FB1和ZEN有一定的吸附,因此本实验采取30 mg C18进行净化处理。
2.2.4 线性关系、检出限和定量限测定
分别吸取不同浓度的真菌毒素标准溶液,用空白基质配制标准曲线,按建立好的方法进行质谱分析,以质量浓度为横坐标,定量离子的响应值为纵坐标绘制标准曲线,以3 倍信噪比计算方法的检出限。标准溶液的线性范围、相关系数及检出限见表2。
表 2 11 种真菌毒素的线性范围、相关系数和检出限
Table 2 Linear ranges, correlation coefficients (r) and LODs of 11 mycotoxins
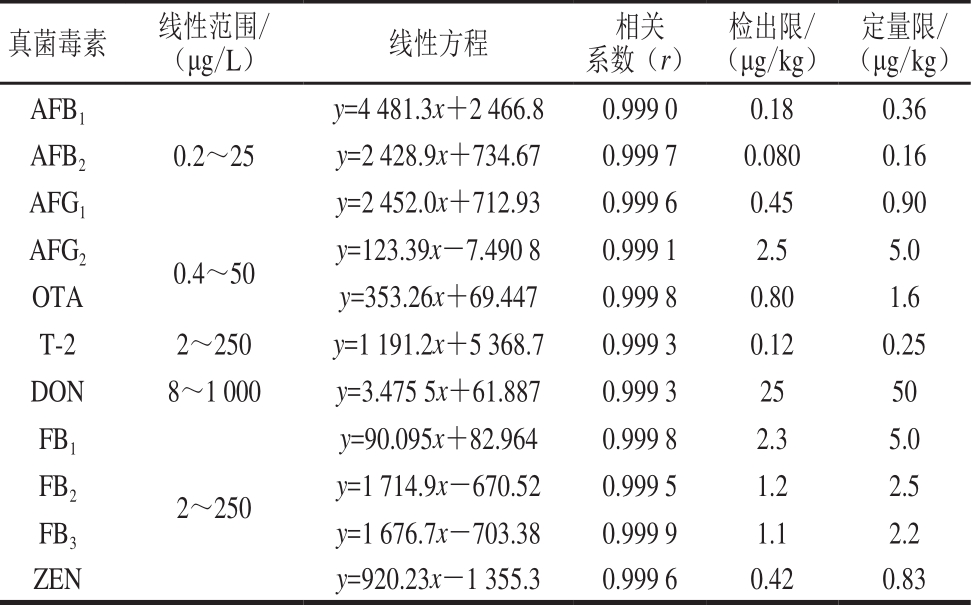
真菌毒素 线性范围/(μg/L) 线性方程 相关系数(r)检出限/(μg/kg)定量限/(μg/kg)AFB1 0.2~25 y=4 481.3x+2 466.8 0.999 0 0.18 0.36 AFB2 y=2 428.9x+734.67 0.999 7 0.080 0.16 AFG1 y=2 452.0x+712.93 0.999 6 0.45 0.90 AFG2 0.4~50 y=123.39x-7.490 8 0.999 1 2.5 5.0 OTA y=353.26x+69.447 0.999 8 0.80 1.6 T-2 2~250 y=1 191.2x+5 368.7 0.999 3 0.12 0.25 DON 8~1 000 y=3.475 5x+61.887 0.999 3 25 50 FB1 2~250 y=90.095x+82.964 0.999 8 2.3 5.0 FB2 y=1 714.9x-670.52 0.999 5 1.2 2.5 FB3 y=1 676.7x-703.38 0.999 9 1.1 2.2 ZEN y=920.23x-1 355.3 0.999 6 0.42 0.83
从表2可以看出,不同真菌毒素标准曲线的质量浓度范围有一定差异,主要考虑了真菌毒素的限量水平、仪器的响应值、实际阳性样品的含量范围等因素。11 种真菌毒素在各种范围内线性关系良好,相关系数在0.999 0~0.999 9之间。GB 2761—2017《食品中真菌毒素限量》中规定了食品中6 种真菌毒素的限量,其中涉及豆类及其制品有AFB1和OTA,其限量均为5 μg/kg;涉及谷物及其制品中有DON和ZEN,限量分别为1 000 μg/kg和60 μg/kg,目前尚未对FB和T-2毒素制定限量标准。欧盟对直接食用的玉米中FB的限量为1 000 μg/kg;对其他谷物中T-2的限量为50 μg/kg[38],从已有的限量看,本实验建立的方法能满足食品中真菌毒素残留限量的测定要求。
2.2.5 方法的准确度和精密度
采用添加回收的方法测定方法的准确度。分别向空白样品中添加不同浓度的真菌毒素标准溶液,按确定好的方法提取、净化、分析,加标回收率实验结果见表3。
表 3 11 种真菌毒素的加标回收率(n= 6)
Table 3 Recoveries and relative standard deviations of 11 mycotoxins from spiked samples (n= 6)

真菌毒素添加量/(μg/kg)测定值/(μg/kg) 回收率/% RSD/% 添加量/(μg/kg)测定值/(μg/kg) 回收率/% RSD/% 添加量/(μg/kg)测定值/(μg/kg) 回收率/% RSD/%AFB1 2.50 2.04 81.6 2.0 5.00 4.35 87.0 3.6 10.0 8.77 87.7 4.4 AFB2 2.50 2.24 89.6 2.5 5.00 4.28 85.6 3.8 10.0 8.77 87.7 1.5 AFG1 2.50 2.34 93.6 2.5 5.00 4.47 89.4 4.2 10.0 8.84 88.4 1.3 AFG2 5.00 5.35 107 7.4 10.0 7.28 72.8 4.8 20.0 20.1 101 3.1 OTA 5.00 5.07 101 5.2 10.0 9.03 90.3 2.2 20.0 20.9 105 2.5 T-2 25.0 21.8 87.2 4.3 50.0 48.2 96.4 2.2 100 97.8 97.8 2.6 DON 100 102 102 8.6 200 197 98.5 4.0 400 392 98.0 3.3 FB1 25.0 17.5 70.0 2.9 50.0 43.1 86.2 6.7 100 74.0 74.0 6.1 FB2 25.0 20.2 80.8 2.1 50.0 39.9 79.8 2.1 100 71.7 71.7 3.7 FB3 25.0 20.2 80.8 3.4 50.0 45.8 91.6 3.9 100 71.8 71.8 4.0 ZEN 25.0 23.9 95.6 4.5 50.0 52.4 105 7.0 100 108 108 1.4
从表3可以看出,11 种真菌毒素在2.50、5.00、25.0 μg/kg三个添加水平的回收率在70.0%~108%之间,相对标准偏差(relative standard deviation,RSD)在1.3%~8.6%之间,符合GB/T 27404—2008《实验室质量控制规范基本信息 食品理化检测》中的相关要求。
2.2.6 杂粮豆类中真菌毒素的检测
利用建立的方法对黑豆(12 份)、绿豆(13 份)、红豆(12 份)共37 份样品进行检测,结果发现6 份样品中检出真菌毒素,阳性率为16.2%,所检测到的真菌毒素均为ZEN残留,其中绿豆样品2 份、红豆样品4 份。
绿豆样品中ZEN检出阳性率为15.4%,平均含量3.4 μg/kg,该含量均低于谷物及其制品中规定的ZEN的限量值。红豆样品中ZEN检出阳性率为33.3%,其中有两份样品含量较高,分别为270 μg/kg和764 μg/kg,超过国家标准中ZEN的限量值(60 μg/kg)4~12 倍,应当引起注意。
3 结 论
本实验建立甲醇-水(70∶30,V/V)、乙腈-水(84∶16,V/V)两种溶剂体系联合提取,C18吸附剂净化,高效液相色谱-串联质谱同时检测杂粮豆类中的11 种真菌毒素的方法。该方法简单、快速、准确度高可用于真菌毒素的快速检测。对杂粮豆类中真菌毒素检测结果表明,该类食品中存在一定的安全隐患,希望相关部门给予重视、进行风险评估,制定相应的政策和措施,以保障餐桌上的食品安全。
参考文献:
[1] ROCHA M E B, FREIRE F C O, MAIA F E F, et al. Mycotoxins and their effects on human and animal health[J]. Food Control, 2014, 36:159-165. DOI:10.1016/j.foodcont.2013.08.021.
[2] 郑翠梅, 张艳, 王雪松, 等. 液相色谱-质谱联用同时检测粮食中多种真菌毒素的应用进展[J]. 粮食科技与经济, 2012, 37(1): 45-49.DOI:10.16465/j.gste.2012.01.001.
[3] FERRE F S. Worldwide occurrence of mycotoxins in rice[J]. Food Control, 2016, 62: 291-298. DOI:/10.1016/j.foodcont.2015.10.051.
[4] 李志霞, 聂继云, 闫震, 等. 果品主要真菌毒素污染检测、风险评估与控制研究进展[J]. 中国农业科学, 2017, 50(2): 332-347.DOI:10.3864/j.issn.0578-1752.2017.02.012.
[5] MARIN S, RAMOS A J, CANO-SANCHO G, et al. Mycotoxins:occurrence, toxicology and exposure assessment[J]. Food and Chemical Toxicology, 2013, 60: 218-237. DOI:10.1016/j.fct.2013.07.047.
[6] HUSSEIN H S, BRASEL J M. Toxicity, metabolism, and impact of mycotoxins on humans and animals[J]. Toxicology, 2001, 167(2): 101-134. DOI:10.1016/S0300-483X(01)00471-1.
[7] 谭斌, 翟小童. 杂豆质量安全问题及对策[J]. 食品科学技术学报,2016, 34(6): 7-11. DOI:10.3969/j.issn.2095-6002.2016.06.002.
[8] 刘尚文. 在农业结构调整中提升杂粮豆类地位[J]. 粮食加工,2004(3): 3-5. DOI:10.3969/j.issn.1007-6395.2004.03.001.
[9] 杨辉, 李绥峰, 张巍. 小杂粮主要病虫害发生规律及防治对策[J].现代园艺, 2010(5): 49-50. DOI:10.14051/j.cnki.xdyy.2010.05.003.
[10] SCOTT P M, WALBEEK W, KENNEDY B, et al. Mycotoxins(ochratoxin A, citrinin, and sterigmatocystin) and toxigenic fungi in grains and other agricultual products[J]. Journal of Agricultural and Food Chemistry, 1972, 20(6): 1103-1109. DOI:10.1021/jf60184a010.
[11] JIN P G, HAN Z, CAI Z X, et al. Simultaneous determination of 10 mycotoxins in grain by ultra-high-performance liquid chromatographytandem mass spectrometry using13C15-deoxynivalenol as internal standard[J]. Food Additives and Contaminants, 2010, 27(12): 1701-1713. DOI:10.1080/19440049.2010.517222.
[12] 马皎洁, 邵兵, 林肖惠, 等. 我国部分地区2010年产谷物及其制品中多组分真菌毒素污染状况研究[J]. 中国食品卫生杂志, 2011, 23(6):481-488. DOI:10.13590/j.cjfh.2011.06.023.
[13] 曹娅, 孙利, 王明林, 等. 粮谷中8 种痕量真菌毒素的定量分析方法[J]. 分析测试学报, 2013, 32(2): 150-155. DOI:10.3969/j.issn.1004-4957.2013.02.002.
[14] 陈慧菲, 朱天仪, 陈凤香, 等. QuEChERS-超高效液相色谱串联质谱法测定谷物中的8 种真菌毒素[J]. 粮食与油脂, 2016, 29(5): 67-70.DOI:10.3969/j.issn.1008-9578.2016.05.019.
[15] OVIEDO M S, RAMIREZ M L, BARROS G G, et al. Influence of water activity and temperature on growth and mycotoxin production by Alternaria alternata on irradiated soya beans[J]. International Journal of Food Microbiology, 2011, 149(2): 127-132. DOI:10.1016/j.ijfoodmicro.2011.06.007.
[16] 杜英秋, 张瑞英, 杨焕春, 等. 国内外真菌毒素检测标准现状及分析[J]. 粮食与油脂, 2014, 27(7): 60-66. DOI:10.3969/j.issn.1008-9578.2014.07.017.
[17] 张亮. T-2毒素与黄曲霉毒素特异性抗体的制备及应用[D]. 北京:中国农业科学院, 2015: 1-4.
[18] CASTILLO M D, GONZÁLEZ H H, MARTÍNEZ E J, et al. Mycoflora and potential for mycotoxin production of freshly harvested black bean from the Argentinean main production area[J]. Mycopathologia, 2004,158(1): 107-112. DOI:10.1023/B:MYCO.0000038426.05215.89.
[19] TSENG T C, TU J C, TZEAN S S. Mycoflora and mycotoxins in dry bean(Phaseolus vulgaris) produced in Taiwan and in Ontario, Canada[J].Botanical Bulletin of Academia Sinica, 1995, 36(4): 229-234.
[20] TSENG T C, TU J C. Mycoflora and mycotoxins in adzuki and mung beans produced in Ontario, Canada[J]. Microbios, 1997, 90: 87-95.
[21] IHA M H, TRUCKSESS M W, TOURNAS V H. Effect of processing on ochratoxin A content in dried beans[J]. Food Additives & Contaminants: Part A, 2009, 26: 1389-1395.DOI:10.1080/02652030903013286.
[22] 马俊, 邱富娜, 刘金娥, 等. ELISA和TLC检测饲料中AFB1含量的比较研究[J]. 畜牧与饲料科学, 2013, 34(2): 19-23. DOI:10.16003/j.cnki.issn1672-5190.2013.02.023.
[23] KINANI S, BOUCHONNET S, BOURCIER S, et al. Study of the chemical derivatization of zearalenone and it metabolites for gas chromatography-mass spectrometry analysis of environmental samples[J]. Journal of Chromatography A, 2008, 1190(1/2): 307-315.DOI:10.1002/rcm.3771.
[24] AMELIN V G, KARASEVA N M, TRETYAKOV A V.Combination of the QuEChERS method with dispersive liquid-liquid microextraction and derivatization in the determination of mycotoxins ingrain and mixed feed by gas-liquid chromatography with an electroncapture detector[J]. Journal of Analytical Chemistry, 2013, 68(6): 552-557. DOI:10.1134/S1061934813060026.
[25] PEI S C, LEE W J, ZHANG G P, et al. Development of antizearalenone monoclonal antibody and detection of zearalenone in corn products from China by ELISA[J]. Food Control, 2013, 31: 65-70.DOI:10.1016/j.foodcont.2012.09.006.
[26] BOWERS E, HELLMICH R, MUNKVOLD G. Comparison of fumonisin contamination using HPLC and ELISA methods in bt and near-isogenic maize hybrids infested with European corn borer or western bean cutworm[J]. Journal of Agriculture and Food Chemistry,2014, 62: 6463-6472. DOI:10.1021/jf5011897.
[27] 黎睿, 谢刚, 王松雪. 高效液相色谱法同时检测粮食中常见8 种真菌毒素的含量[J]. 食品科学, 2015, 36(6): 206-210. DON:10.7506/spkx1002-6630-201506039.
[28] JUAN C, COVARELLI L, BECCARI G, et al. Simultaneous analysis of twenty-six mycotoxins in durum wheat grain from Italy[J]. Food Control, 2016, 62: 322-329. DOI:10.1016/j.foodcont.2015.10.032.
[29] DESMARCHELIER A, TESSIOT S, BESSAIRE T, et al. Combining the quick, easy, cheap, effective, rugged and safe approach and cleanup by immunoaffinity column for the analysis of 15 mycotoxins by isotope dilution liquid chromatography tandem mass spectrometry[J].Journal of Chromatography A, 2014, 1337: 75-84. DOI:10.1016/j.chroma.2014.02.025.
[30] BERTHILLER F, BRERA C, IHA M H, et al. Developments in mycotoxin analysis: an update for 2015-2016[J]. World Mycotoxin Journal, 2017, 10(1): 5-29. DOI:10.3920/WMJ2016.2138.
[31] 国家卫生和计划生育委员会. 食品中黄曲霉毒素B组和G组的测定:GB 5009.22—2016[S]. 北京: 中国标准出版社, 2016.
[32] 国家卫生和计划生育委员会. 食品中赭曲霉毒素A的测定: GB 5009.96—2016[S]. 北京: 中国标准出版社, 2016.
[33] 国家卫生和计划生育委员会. 食品中脱氧雪腐镰刀菌烯醇及其乙酰化衍生物的测定: GB 5009.111—2016[S]. 北京: 中国标准出版社,2016.
[34] 国家卫生和计划生育委员会. 食品中玉米赤霉烯酮的测定: GB 5009.209—2016[S]. 北京: 中国标准出版社, 2016.
[35] 高蓓, 姜德铭, 杨永坛. 同位素内标-液相色谱-串联质谱法同时测定粮食及其制品中的5 种真菌毒素[J]. 色谱, 2017, 35(6): 601-607.DOI:10.3724/SP.J.1123.2016.12028.
[36] 刘丹, 韩小敏, 李凤琴, 等. 花生油和玉米油中多组分真菌毒素高效液相色谱-串联质谱检测方法的建立[J]. 食品科学, 2017, 38(10):297-304. DOI:10.7506/spkx1002-6630-201710048.
[37] SUN J, LI W X, ZHANG Y. QuEChERS purification combined with ultrahigh-performance liquid chromatography tandem mass spectrometry for simultaneous quantification of 25 mycotoxins in cereals[J]. Toxins, 2016, 8(12): 375. DOI:10.3390/toxins8120375.
[38] 刘青, 邹志飞, 余炀炀, 等. 食品中真菌毒素法规限量标准概述[J]. 中国酿造, 2017, 36(1): 12-18. DOI:10.11882/j.issn.0254-5071.2017.01.003.
Simultaneous Determination of 11 Mycotoxins in Minor Food Legumes by High Performance Liquid Chromatography-Tandem Mass Spectrometry (HPLC-MS/MS)
ZHANG Xinna1, MA Liyan1,2,*, PAN Saichao1, ZHANG Chunjiao1, ZHANG Yongxin1, ZHOU Fang1, HUANG Kunlun1,2, DAI Yunqing1,2
(1. Lab of Storage and Preservation, Quality and Safty & Risk Assessment for Agri-Products (Beijing),Ministry of Agriculture, Beijing 100083, China;2. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Abstract: A method was developed for the simultaneous determination of 11 mycotoxins in minor food legumes, including aflatoxins B1, B2, G1, G2, ochratoxins A, T-2, deoxynivalenol, fumonisins B1, B2 and B3 and zearalenone. Sample extraction and purification conditions were optimized. Samples were extracted with methanol-water (70:30, V/V) and acetonitrilewater (84:16, V/V) consecutively (the extraction process took 3 min), and then the extract was purified using C18 sorbent.The results showed that the calibration curves for all mycotoxins were linear with correlation coefficients above 0.999. The average recoveries of spiked samples ranged from 70.0% to 108%, with relative standard deviations (RSDs) from 1.3% to 8.6%.The method was simple and rapid with high sensitivity and repeatability, and it was suitable for simultaneous detection of 11 mycotoxins in minor food legumes.
Keywords: minor food legumes; mycotoxins; high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS)
收稿日期:2017-12-14
基金项目:国家农产品产地收贮运环节质量安全风险评估重大专项(GJFP201701102)
第一作者简介:张新娜(1981—)(ORCID: 0000-0002-4705-2022),女,硕士,研究方向为食品生物技术。E-mail: xinnazh1215@163.com
*通信作者简介:马丽艳(1970—)(ORCID: 0000-0002-5458-0018),女,高级实验师,博士,研究方向为食品安全及其检测技术。E-mail: lyma1203@163.com
DOI:10.7506/spkx1002-6630-20171214-178
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2019)08-0306-05
引文格式:
张新娜, 马丽艳, 潘赛超, 等. 高效液相色谱-串联质谱法测定杂粮豆类中11 种真菌毒素[J]. 食品科学, 2019, 40(8):
306-31 0. DOI:10.7506/spkx1002-6630-20171214-178. http://www.spkx.net.cn
ZHANG Xinna, MA Liyan, PAN Saichao, et al. Simultaneous determination of 11 mycotoxins in minor food legumes
by high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS)[J]. Food Science, 2019, 40(8):306-310. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20171214-178. http://www.spkx.net.cn




