鳕鱼肝油是从高纬度的挪威等国的深海鳕鱼肝脏中提取的油脂,鳕鱼不杂食、干净、无污染,提取的鱼肝油品质优良安全,深受全球消费者青睐。鳕鱼肝油富含天然VA、VD3以及多种陆地上没有的欧米伽-3(omega-3)不饱和脂肪酸,其中二十二碳六烯酸(docosahexaenoic acid,DHA)和二十碳五烯酸(eicosapentaenoic acid,EPA)含量很高,是人体自身不能合成但又不可缺少的重要营养素[1-3]。尤其是DHA,是人体神经系统生长及维持的主要元素,是大脑和视网膜的重要构成成分,对婴幼儿的智力和视力发育至关重要,具有保护视网膜、改善视力、促进婴幼儿智力发育、提高记忆力等作用[4-9]。目前全球药用级和保健级的鳕鱼肝油品牌多达百种,需求量很大,占整个鱼肝油市场的95%以上。纯鳕鱼肝油天然资源短缺,价格昂贵,不法厂商为牟利,在鳕鱼肝油中掺兑一定比例的廉价鱼油以降低成本,严重损害消费者的利益。监管上仅仅依赖测定标志性成分VA、VD3、DHA与EPA含量是不够的,不法厂商可以通过添加合成VA和VD3、乙酯型DHA使掺假鳕鱼肝油中各项标志性成分符合指标要求,但实则为掺假的鳕鱼肝油,真假难以鉴定。本实验通过一种柱前衍生气相色谱技术,对鳕鱼肝油及鱼油样品中的脂肪酸进行相对含量测定,经多样本分析比较,找出具有特征指标的脂肪酸,建立特征脂肪酸二维掺假模型,绘制不同掺假程度的识别分析图,运用该分析图可实现对鳕鱼肝油掺假鱼油的快速鉴定,有效规范鱼肝油市场存在的掺假乱象。
不同品牌鳕鱼肝油样品46 批(包括原料、口服液体和软胶囊),原料由海力生集团有限公司提供,口服液体和软胶囊均来自市售和网购;鱼油软胶囊样品30 批,均来自市售和网购;甲醇、异辛烷(均为色谱纯)美国J.T.Baker公司;氢氧化钠、硫酸、无水硫酸钠(均为分析纯) 国药集团化学试剂有限公司;脂肪酸甲酯标准品(纯度均大于99%) 美国NU-CHEK公司和美国Sigma公司。
7890A气相色谱仪(配有氢火焰离子化检测器)美国Agilent公司;CPA 225D分析天平 德国Sartorius公司;DTK-200干式恒温器 杭州米欧仪器有限公司;MS 3圆周振荡器 德国IKA公司。
1.3.1 样品前处理
鳕鱼肝油中所含脂肪酸是以甘油酯形式存在[10],沸点高,不能直接提取后气相色谱测定,需进行柱前衍生处理[11-14],即将鳕鱼肝油先皂化后甲酯化,转化为低沸点的脂肪酸甲酯,再经有机溶剂提取后进样测定。
准确称取鳕鱼肝油样品100 mg放置于20 mL带螺口反应瓶中,加1.5 mL 2%氢氧化钠-甲醇溶液,旋紧瓶盖,旋涡混合30 s,放置于90 ℃恒温器中加热20 min,冷却。加2 mL 5 g/100 mL硫酸-甲醇溶液,旋紧瓶盖,旋涡混合30 s,放置于100 ℃恒温器中加热10 min,冷却。准确加入2 mL异辛烷,旋紧瓶盖,旋涡混合1 min,立即加5 mL饱和氯化钠溶液,轻摇,静置分层。吸取上清液转移至装有少量无水硫酸钠的具塞试管中,振摇脱水,即得。
1.3.2 标准溶液制备
准确称取棕榈酸甲酯、棕榈油酸甲酯、油酸甲酯、EPA甲酯、DHA甲酯标准品适量放置于20 mL棕色容量瓶中,加异辛烷溶解并定容,制成含棕榈酸甲酯4.97 mg/mL、棕榈油酸甲酯2.94 mg/mL、油酸甲酯6.21 mg/mL、EPA甲酯3.84 mg/mL、DHA甲酯6.05 mg/mL的混合标准溶液。
1.3.3 色谱条件
色谱柱:Agilent DB-23石英毛细管柱(60 m×0.25 mm,0.25 µm);升温程序:起始温度170 ℃,以1 ℃/min速率升温至225 ℃并保持5 min;进样口温度250 ℃;检测器温度280 ℃;载气(N2)流速1.0 mL/min;进样量1 µL;进样方式:分流进样,分流比150∶1。
1.3.4 面积归一化法计算脂肪酸相对含量
样品中各脂肪酸占总脂肪酸的相对含量(Yi)按下式计算(相对峰面积小于0.2%不计):
式中:Ai为各脂肪酸峰面积;Fi为各脂肪酸转换系数。
1.3.5 鳕鱼肝油中掺假鱼油模型的设计
设计鳕鱼肝油中分别掺入质量分数梯度为5%、15%、25%、50%鱼油的掺假样品模型,以掺假样品中的鲸蜡烯酸相对含量为横坐标,DHA/EPA值为纵坐标,绘制掺假识别分析图。
鳕鱼肝油样品中含有二十多种脂肪酸,本研究对15 种典型脂肪酸采用甲酯对照品进行定位确认,各脂肪酸出峰排列顺序见图1。15 种典型脂肪酸中包含3 对同分异构体,分别是油酸(顺-9-十八碳烯酸)/异油酸(顺-11-十八碳烯酸)、顺-9-二十碳烯酸/顺-11-二十碳烯酸、鲸蜡烯酸(顺-11-二十二碳烯酸)/芥酸(顺-13-二十二碳烯酸),这3 对同分异构体结构相近,在色谱中的分离难度很大,想要获得满意的分离度,必须对色谱条件进行优化[15]。气相色谱中影响化合物分离的最重要因素是色谱柱和柱温,脂肪酸甲酯测定通常采用极性色谱柱,同类型色谱柱不同固定相、牌号和规格对脂肪酸的分离性能有较大的差异[16]。实验中采用规格为(30 m×0.25 mm,0.25 µm),不同固定相及牌号(DB-23、DB-WAX、Rtx-WAX)的毛细管柱,结果显示DB-23色谱柱对脂肪酸分离效果最佳,油酸/异油酸异构体能达到基线分离,但另两对异构体的分离效果不佳,分离度小于1.3。改变程序升温条件和流速也无法达到基线分离,故考虑增加色谱柱的长度,采用规格为(60 m×0.25 mm,0.25 µm)的DB-23毛细管柱,两对异构体的分离效果明显改善,分离度均达到1.3以上。通过对不同升温程序对分离度影响考察,最终确定最佳升温程序为起始温度为170 ℃,以1 ℃/min的速率升温至225 ℃并保持5 min。实验中对进样口温度、检测器温度、载气流速、分流比均进行考察,结果显示上述几个因素对脂肪酸分离效果的影响不明显。

图 1 鳕鱼肝油特征色谱图
Fig. 1 GC chromatogram of fatty acids in cod liver oil
甲酯化率是影响脂肪酸测定准确性的关键因素,目前常用的甲酯化方法有碱催化法、酸催化法和三氟化硼催化法[17-20],现行版食品脂肪酸测定标准和欧美药典收载的鱼肝油质量标准均采用三氟化硼甲醇溶液作催化剂[21-23]。本研究分别考察上述3 种方法的催化效率,结果显示鳕鱼肝油甲酯化中碱催化效率仅为酸催化的50%,酸催化法中盐酸催化效率低于硫酸催化,三氟化硼催化效率与硫酸基本一致。考虑到三氟化硼甲醇溶液毒性大、易燃易爆,对实验人员和环境存在较大的安全隐患,且价格昂贵。本研究采用硫酸催化法替代国内外鱼肝油和鱼油脂肪酸测定中最常用的三氟化硼催化法,并对皂化时间、皂化温度、甲酯化时间、甲酯化温度4 个因素采用L16(45)正交试验,以EPA、DHA含量为考察指标进行优选,结果显示当皂化温度90 ℃、皂化时间20 min、甲酯化温度100 ℃、甲酯化时间10 min时,测得样品中脂肪酸含量最高,方法稳定性最好,该法检测成本低,并符合绿色化学的要求。
为考察柱前衍生化方法的准确性,选择鳕鱼肝油中5 种代表性脂肪酸,其中棕榈酸代表饱和脂肪酸、棕榈油酸和油酸代表单不饱和脂肪酸、EPA和DHA代表多不饱和脂肪酸,对5 种脂肪酸进行含量测定重复性和加标回收率实验。
2.3.1 重复性实验结果
准确称取同一批号的鳕鱼肝油样品6 份,每份100 mg,按1.3.1节方法制备样品溶液,按1.3.3节色谱条件操作,混合标准品溶液和样品溶液依次进样测定,外标法计算样品中5 种脂肪酸含量,由表1可见,5 种脂肪酸的相对标准偏差均小于2.0%,表明该柱前衍生化方法重复性良好。
表 1 脂肪酸含量及加标回收率
Table 1 Contents and recoveries of fatty acids from spiked sample

组分含量(n=6) 回收率(n=9)平均值/(mg/g) 相对标准偏差/%平均值/%相对标准偏差/%棕榈酸 91.56 0.84 98.59 1.27棕榈油酸 54.11 1.12 98.22 1.66油酸 116.62 0.77 99.30 1.25 EPA 72.11 1.37 99.54 1.09 DHA 114.98 0.95 98.79 1.37
2.3.2 加标回收率实验结果
准确称取2.3.1节已测知含量的样品50 mg,共9 份,分别置于20 mL带螺口反应瓶中,准确加入混合标准品溶液0.8、1.0、1.2 mL各3 份,制成加标水平为80%、100%、120%的加标样品,按1.3.1节制备样品溶液,按1.3.3节色谱条件进样测定,计算样品中5 种脂肪酸加标回收率,结果见表1,5 种脂肪酸的平均加标回收率在98.22%~99.54%之间,相对标准偏差为均小于2.0%,表明该柱前衍生化方法准确可靠。
鳕鱼肝油是从鳕鱼肝脏提取的脂肪油,鱼油是从鱼类脂肪提取的脂肪油。通过对全部样品中各脂肪酸相对总脂肪酸相对含量的测定和分析,显示两者的脂肪酸种类和数量基本相同,但含量区别明显,与文献[24]报道的基本一致。鳕鱼肝油中各脂肪酸含量因鳕鱼产地和油脂提取工艺的不同有所差异,测得的脂肪酸相对含量在一个相对较窄的波动区间(限度范围)内。鱼油则受鱼种、产地、季节、加工部位以及提取工艺等因素的影响,含量波动区间大于鳕鱼肝油[25-27]。鳕鱼肝油和鱼油样品中测得的典型脂肪酸含量范围见表2,鳕鱼肝油所含脂肪酸相比鱼油呈现两大特征:1)鳕鱼肝油中DHA含量明显高于EPA含量,46 批鳕鱼肝油样品中除2 批疑似掺假样品外,DHA、EPA相对含量比(DHA/EPA)均在1.40~1.68范围内,均值为1.55,而鱼油样品中的DHA含量明显低于EPA含量,DHA/EPA为0.64~0.75,均值为0.69。2)鳕鱼肝油中顺-11-二十碳烯酸和鲸蜡烯酸相对含量明显高于鱼油,两种脂肪酸在鳕鱼肝油和鱼油中的平均比值高达5.0和5.2。当鳕鱼肝油中掺入一定量的鱼油将导致DHA/EPA、顺-11-二十碳烯酸和鲸蜡烯酸相对含量下降,尤其是鲸蜡烯酸,在其他鱼肝油中(鲨鱼肝油、金枪鱼肝油)几乎没有,在鱼油中含量很低,仅在鳕鱼肝油中有较高含量,具有很强的特征性,因此从DHA/EPA和鲸蜡烯酸相对含量的变化规律可以对鳕鱼肝油中掺假鱼油进行判别。
表 2 鳕鱼肝油和鱼油脂肪酸相对含量限度
Table 2 Fatty acid contents of pure cod liver oil and fish oil
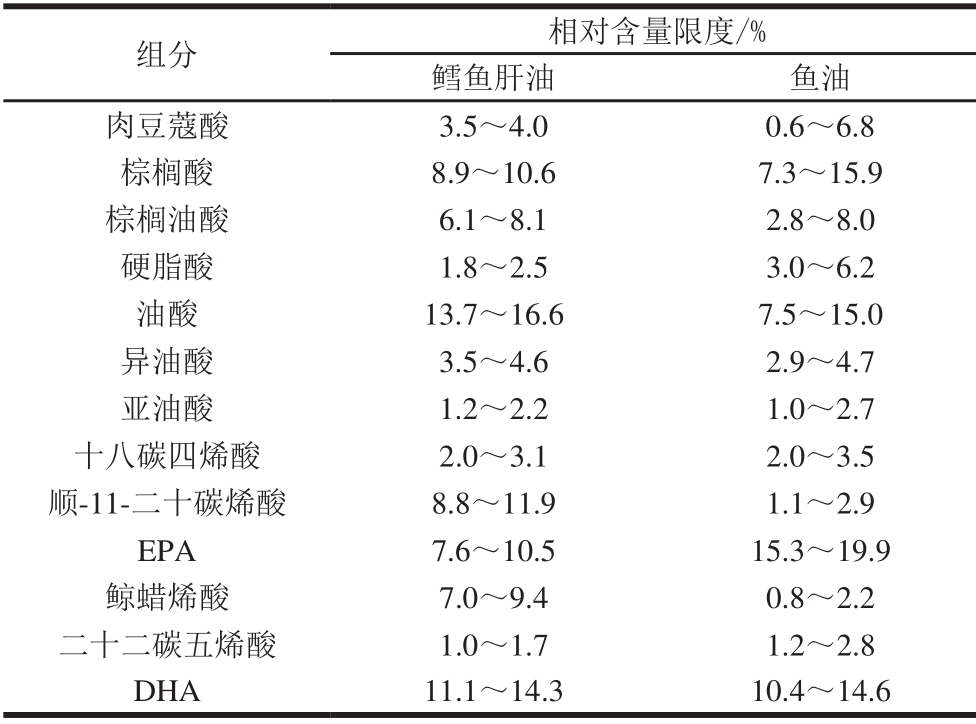
组分 相对含量限度/%鳕鱼肝油 鱼油肉豆蔻酸 3.5~4.0 0.6~6.8棕榈酸 8.9~10.6 7.3~15.9棕榈油酸 6.1~8.1 2.8~8.0硬脂酸 1.8~2.5 3.0~6.2油酸 13.7~16.6 7.5~15.0异油酸 3.5~4.6 2.9~4.7亚油酸 1.2~2.2 1.0~2.7十八碳四烯酸 2.0~3.1 2.0~3.5顺-11-二十碳烯酸 8.8~11.9 1.1~2.9 EPA 7.6~10.5 15.3~19.9鲸蜡烯酸 7.0~9.4 0.8~2.2二十二碳五烯酸 1.0~1.7 1.2~2.8 DHA 11.1~14.3 10.4~14.6
2.5.1 掺假识别分析图的建立
查阅有关文献,目前对鱼油中掺假植物油的分析鉴定方法有过报道[28-30],但鱼肝油中掺假鱼油的研究鲜见报道,本研究根据鳕鱼肝油脂肪酸的特征指标及其变化规律,建立一种比较直观的掺假模型,根据各样品脂肪酸相对含量测定结果,对样品进行分析筛选,选定其中28 批鱼肝油样品、17 批鱼油样品(脂肪酸测定结果基本一致的不同批次样品,仅选其中一批次)的掺假数据用于模型输入,以鲸蜡烯酸相对含量为横坐标,DHA/EPA值为纵坐标,建立掺兑5%、15%、25%和50%鱼油的掺假模型,绘制掺假识别分析图,见图2。当鳕鱼肝油中掺兑不同比例的鱼油时,不同掺假水平呈现一定的分布规律,脂肪酸分布具有较为明显的区域性。
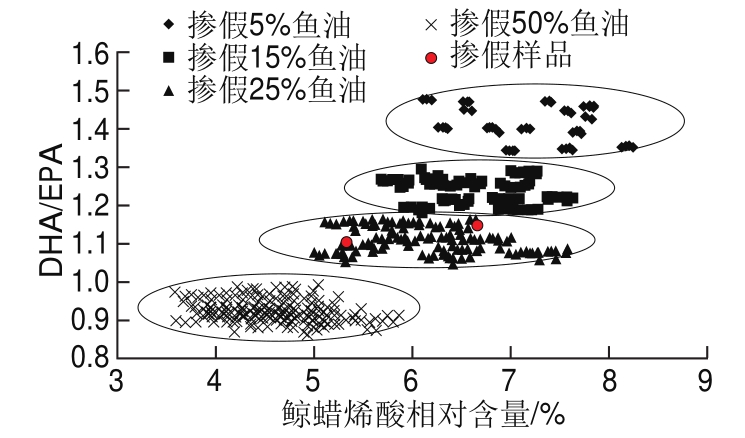
图 2 掺假鳕鱼肝油脂肪酸识别分析
Fig. 2 Discriminant analysis diagram of fatty acid methyl esters from adulterated cod liver oil
2.5.2 掺假样品的判别
待鉴定样品按1.3.1节的方法制备样品溶液,按1.3.3节色谱条件测定各脂肪酸峰面积并计算相对含量,当鲸蜡烯酸相对含量和(或)DHA/EPA值超过限度范围时(DHA/EPA为1.40~1.68),可判定该鳕鱼肝油样品中掺假鱼油,再从识别分析图中找到相应的坐标位置,即可对掺假程度作出直观判别。
2.5.3 掺假案例分析
对46 批鳕鱼肝油样品进行分析时,发现有2批样品中DHA/EPA值和鲸蜡烯酸相对含量均偏离限度,一批DHA/EPA为1.16,鲸蜡烯酸相对含量为6.74%,另一批DHA/EPA为1.13,鲸蜡烯酸相对含量为5.32%,在掺假模型中画出该2 批样品所在坐标点(图中圆点位置),见图2,圆点的位置落在25%的掺假区域内,由此可判定该2批鳕鱼肝油中掺兑了约25%的鱼油。
鳕鱼肝油含多种功效成分,尤其是omega-3不饱和脂肪酸具有多种生理活性作用,目前在保健品市场占有较大的份额。由于优质纯鳕鱼肝油采用深海银鳕鱼肝脏提取而得,产量有限,资源紧缺,其价格远高于普通鱼油,故鳕鱼肝油中掺兑鱼油存在较大的牟利空间。再者现有保健级鳕鱼肝油产品质量控制主要基于对指标成分的定量分析,此质控手段存在较大的片面性,对为达指标而人为添加合成VA、VD3和乙酯型DHA的掺假行为不能进行有效识别,导致鳕鱼肝油掺假现象屡见不鲜。为科学有效打击掺假行为,本研究建立一种简便、准确、环保的脂肪酸测定方法,对鳕鱼肝油和鱼油中的各脂肪酸相对含量进行快速测定。通过对不同来源、不同产地、不同品牌的多样本脂肪酸含量进行分析统计,确定鳕鱼肝油和鱼油中13 种典型脂肪酸的相对含量限度范围,并找出两者中具有鉴定意义的特征性脂肪酸(DHA、EPA和鲸蜡烯酸)及其变化规律,建立以DHA/EPA值和鲸蜡烯酸相对含量为特征指标的掺假判别方法,该法可快速对鳕鱼肝油中掺假鱼油的行为进行准确鉴定,为科学打假提供一种可靠、直观、简便的手段,有效规范鱼肝油市场。
[1] 肖玫, 欧志强. 深海鱼油中两种脂肪酸(EPA和DHA)生理功效及机理的研究进展[J]. 食品科学, 2005, 26(8): 522-526. DOI:10.3321/j.issn:1002-6630.2005.08.135.
[2] 郑秋甫. Omega-3多不饱和脂肪酸的研究进展[J]. 中华保健医学杂志, 2011, 13(5): 357-360. DOI:10.3969/j.issn.1674-3245.2011.05.001.
[3] 韩宏毅, 王刚. 多不饱和脂肪酸及其生理功能[J]. 中国临床医学,2010, 23(6): 523-525.
[4] 刘志国, 王丽梅, 王华林, 等. 多不饱和脂肪酸对大脑功能影响研究进展[J]. 食品科学, 2015, 36(21): 284-290. DOI:10.7506/spkx1002-6630-201521053.
[5] LINDAY L A. Cod liver oil, young children, and upper respiratory tract infections[J]. Journal of the American College of Nutrition, 2010,29(6): 559-562.
[6] KOLETZKO B, LIEN E, AGOSTONI C, et al. The roles of long-chain polyunsaturated fatty acids in pregnancy, lactation and infancy: review of current knowledge and consensus recommendations[J]. Journal of Perinatal Medicine, 2008, 36(1): 5-14.
[7] HENNEBELLE M, CHAMPEIL-POTOKAR G, LAVIALLE M, et al.Omega-3 polyunsaturated fatty acids and chronic stressinduced modulations of glutamatergic neurotransmission in the hippocampus[J]. Nutrition Reviews, 2014, 72(2): 99-112.
[8] GUESNET P, ALESSANDRI J M. Docosahexaenoic acid (DHA) and the developing central nervous system (CNS)-implications for dietary recommendations[J]. Biochimie, 2011, 93(1): 7-12.
[9] 马琳, 王丽梅, 樊永波, 等. DHA提高大鼠学习记忆的分子机制研究[J].食品科学, 2013, 34(17): 246-249. DOI:10.7506/spkx1002-6630-201317052.
[10] 李彩霞, 金瓯, 李煜, 等. 鱼肝油中脂肪酸的气相色谱及气相色谱-质谱分析[J]. 中国现代应用药学, 2017, 34(12): 1734-1739.
[11] 赵先恩, 索有瑞, 王凌云, 等. 深海鱼油中脂肪酸的柱前衍生-高效液相色谱串联质谱分析[J]. 食品科学, 2007, 28(8): 358-362.
[12] DING Y J, ZHAO X E, ZHU F, et al. Identification of long-chain unsaturated fatty acids in deep-sea fish oil by liquid chromatography/mass spectrometry/atmospheric pressure chemical ionization[J].Chinese Journal of Analytical Chemistry, 2007, 35(3): 375-381.
[13] FAN Y W, DENG Z Y, YU Y H, et al. Effect of fatty acid methyl esterification methods on analysis of conjugated linoleic acids[J].China Oils & Fats, 2007, 1: 15.
[14] 李硕, 李莉, 曹进, 等. 气相色谱法测定鱼油软胶囊中二十碳五烯酸和二十二碳六烯酸的柱前衍生化方法改进[J]. 食品安全质量检测学报, 2016, 7(3): 951-957.
[15] 李小佳, 赵志红, 杨扬, 等. 气相色谱法检测食品中脂肪酸的研究进展[J]. 食品安全质量检测学报, 2016, 7(8): 3114-3120.
[16] 陈小燕, 王友升, 李丽萍. 3 种色谱柱对37 种脂肪酸的分离性能比较及鱼油脂肪酸检测[J]. 食品科学, 2011, 32(2): 156-162.
[17] 周文斌, 吕春明, 张宁, 等. 脂肪酸检测方法的研究进展[J]. 中国现代应用药学, 2014, 31(2): 246-252.
[18] 张白曦, 宋宇航, 杨芹, 等. 甲酯化方法对甘油三酯和游离型脂肪酸混合物脂肪酸分析的影响[J]. 中国粮油学报, 2016, 31(9): 95-99.DOI:10.3969/j.issn.1003-0174.2016.09.017.
[19] 刘帅, 王爱武, 李美艳, 等. 脂肪酸甲酯化方法的研究进展[J].中国药房, 2014, 25(2): 3535-3537. DOI:10.6039/j.issn.1001-0408.2014.37.27.
[20] YANG Y T, ZHANG H C, JIE D. Effect of three esterification methods on GC-MS determination of fatty acids among five kinds of bee pollen[J]. Journal of Chinese Institute of Food Science &Technology, 2015, 15(3): 248-254.
[21] 国家食品药品监督管理总局, 国家卫生和计划生育委员会. 食品中脂肪酸的测定: GB 5009.168—2016[S]. 北京: 中国标准出版社,2016: 12-23.
[22] European Pharmacopoeia Commission. European pharmacopoeia 8.0[S]. Council of Europe, 2012: 104-108.
[23] The United States Pharmacopeial Convention. USP(39)[S]. 2016: 110-112.
[24] 胡勤玲, 李珊, 赵昕, 等. 鱼油软胶囊中脂肪酸组成及比率分析[J].中国粮油学报, 2014, 29(9): 73-78.
[25] 谭汝成, 熊善柏, 刘敬科, 等. 提取条件对白鲢鱼油性质的影响及鱼油脂肪酸组成分析[J]. 食品科学, 2008, 29(2): 72-75. DOI:10.3321/j.issn:1002-6630.2008.02.009.
[26] 张红燕, 李晔, 袁贝, 等. 金枪鱼油冬化前后脂肪酸含量和主体风味的解析[J]. 核农学报, 2017, 31(2): 314-324. DOI:10.11869/j.issn.100-8551.2017.02.0314.
[27] 李雪, 曹君, 白新鹏, 等. 微波辅助萃取罗非鱼鱼油工艺优化及脂肪酸分析[J]. 食品工业科技, 2018, 39(4): 159-165.
[28] 楼乔明, 李来好, 陈胜君, 等. 质谱特征离子定性分析海洋鱼油中的脂肪酸组成[J]. 中国食品学报, 2017, 17(12): 193-199.
[29] 张瑜, 谈黎虹, 曹芳, 等. 可见-近红外光谱分析技术对鱼油掺假定量快速无损检测方法研究[J]. 光谱学与光谱分析, 2013, 33(6):1532-1536. DOI:10.3964/j.issn.1000-0593(2013)06-1532-05.
[30] 林虬, 宋永康, 苏德森, 等. 应用脂肪酸特征指标鉴别掺伪鱼油[J]. 福建农业学报, 2006(4): 398-402. DOI:10.3969/j.issn.1008-0384.2006.04.023.
Adulteration Identification of Cod Liver Oils Based on Characteristic Fatty Acids
王琼芬, 郑平安, 刘婷, 等. 基于脂肪酸特征指标的鳕鱼肝油掺假鉴定[J]. 食品科学, 2019, 40(8): 326-330. DOI:10.7506/