
世界卫生组织报告表明,全球每年爆发的食源性疾病中70%是由致病性微生物污染食品造成的,每年引起的死亡人数高达180万[1]。沙门氏菌污染是食品行业中重要的公共卫生问题,沙门氏菌也是最常见的人畜共患病原体之一,主要引起动物和人类胃肠道疾病[2]。感染沙门氏菌病有几种不同的途径,其中95%以上的人类感染病例是由食物引起的[3]。据美国疾病预防控制中心估计,沙门氏菌每年在美国造成约120万 例疾病,其中23 000 例住院治疗,450 例死亡[4]。2015年欧洲食品安全局和欧洲疾病预防控制中心报道称,鼠伤寒沙门氏菌和肠炎沙门氏菌是人类最易感染的血清型,分别占沙门氏菌感染比例的17.4%和44.4%[5]。大多数感染沙门氏菌的人在感染后12~72 h会出现腹泻、发烧和腹部绞痛。这种症状通常持续4~7 d,大多数人在没有治疗的情况下可以康复。但是,某些患者可能腹泻非常严重,需要住院治疗。任何人都有可能感染沙门氏菌,但对于老年人和儿童会造成更严重的后果,甚至引发死亡。
沙门氏菌能在许多食物中存活,如牛肉、鸡肉、鸡蛋、水果、猪肉、豆芽、蔬菜,甚至如坚果、黄油、冷冻火锅、馅饼、鸡块等加工食品[6-9]。受污染的食物通常看起来仍然正常,但是会导致人感染沙门氏菌继而患病,对人体造成损伤。鸡肉和鸡蛋是最常见的人类感染沙门氏菌病的食物载体。沙门氏菌每年造成900多万 人患病和800 人死亡,其中300万 人是由鸡肉引起的食源性疾病[10]。据统计,2017年中国鸡肉产量和消费量分别占全球鸡肉产量和消费量的12.86%和12.15%,居世界第三位[11]。在2009年欧盟爆发的沙门氏菌疫情中,通过鸡肉和鸡蛋使人感染沙门氏菌的案例分别占49.1%和5.25%[12]。Yang Baowei等[13]对中国2 个直辖市和6 个城市的调查结果显示,鸡肉中沙门氏菌检出率高达52.2%。张玉[14]对山东省肉鸡中沙门氏菌进行定量分析,结果表明山东省居民每日因食用肉鸡罹患沙门氏菌病的风险概率平均值为2.2h10-4,感染沙门氏菌病的人数为137万 人/年。
预测微生物学以计算机为基础,描述特定环境条件下微生物的生长、存活和死亡情况,建立数学模型,进而为风险评估提供依据。目前国内外已经有较多关于各类食品中沙门氏菌生长预测模型的研究。Fang Ting等[15]研究了4~43 ℃牡蛎中沙门氏菌及背景菌群的动力学模型,得出Huang平方根模型更适合描述温度对沙门氏菌生长速率的影响,并得出牡蛎中沙门氏菌的最低和最高生长温度分别是4.99 ℃和48.05 ℃;而Ratkowsky平方根模型更适合描述温度对牡蛎中背景菌群生长速率的影响。Huang Lihan等[16]结合动态分析方法研究蛋清中沙门氏菌的生长和存活动力学机制,结果表明沙门氏菌的最低生长温度为7.7 ℃,在低于该温度时沙门氏菌可能会以2.78h10-3(lg(CFU/(mLgh·℃)))的速率死亡。逄海英[17]研究了13、16、25、33 ℃下人工污染的鸡肉中沙门氏菌生长变化,结果表明,Gompertz模型(一级模型)、Arrhenius模型(二级模型)最适合用于拟合沙门氏菌的最大生长速率,其最大生长速率分别为0.072、0.094、0.433、0.527 h-1。美国农业部食品安全检验局进行的一项调查表明,45%的鸡肉样本(25 g)可能被浓度约100.1 MPN/g的沙门氏菌感染[18]。而市面上所售鸡肉并不是无菌的,其含有一定量种类繁多的背景微生物,可能与沙门氏菌产生竞争关系,从而影响沙门氏菌在鸡肉中的生长。本研究通过一级模型和二级模型来描述8~43 ℃下鸡肉中沙门氏菌和背景菌群的生长机制,得到相关生长参数,以期为相关食品监管部门开展鸡肉样品中沙门氏菌的风险评估提供科学依据。
冷鲜鸡胸脯 永辉超市;鼠伤寒沙门氏菌(CICC22956)、肠炎沙门氏菌(CICC21482) 中国工业微生物菌种保藏管理中心。
胰酪大豆胨琼脂(tryptose soya agar,TSA)培养基、脑-心浸出液肉汤、木糖赖氨酸脱氧胆盐琼脂(xylose lysine desoxycholate agar,XLD) 广东环凯微生物科技有限公司;利福平 北京索莱宝科技有限公司;蛋白胨粉 杭州微生物试剂有限公司。
AIRTECH生物安全柜 苏州安泰空气技术有限公司;Bag Mixer-400均质拍打器 法国Interscience公司;H-1850R高速冷冻离心机 湖南相仪实验室仪器有限公司;SHP-250细菌生化培养箱 上海精宏实验设备有限公司;KB115低温恒温箱 德国BINDER公司;Whirl-Pak-207 mL无菌均质袋 美国Nasco公司;VORTEX-5漩涡混合器 上海习仁科学仪器有限公司;DX-200高压灭菌器 德国Systec公司。
1.3.1 细菌培养及接种菌液制备
参照Fang Ting等[15]的方法,活化、培养、诱导和制备沙门氏菌混合接种母液,并通过梯度稀释使沙门氏菌总数达到2~3(lg(CFU/mL)),备用。
1.3.2 鸡肉样品的准备与接种
在无菌条件下将鸡肉分割成(25.0f0.2)g,分装于无菌均质袋中,备用。取上述梯度稀释的菌悬液100 μL接种到每个均质袋内的鸡肉上,密封,经充分混匀后置于一定温度的恒温培养箱中培养。
1.3.3 生长实验与计数
将已接种的样品分别放置于8、12、16、20、25、30、33、37、40、43 ℃的恒温培养箱中培养,按照预设的时间间隔取样,在每个样品中加入20 mL蛋白胨水,用均质拍打器正、反两面分别拍打2 min,用蛋白胨水连续稀释每个样品的液体部分。将适当浓度的样品涂布在TSA/R平板[15]或TSA平板上,放入37 ℃恒温培养箱中培养24 h左右,TSA/R平板用来测定沙门氏菌菌落数,TSA平板用来测定背景菌菌落数,其中每个温度条件设置10~15 个取样点。
1.3.4 一级模型的建立
分别采用Huang模型和Baranyi模型作为一级模型来拟合各个温度下鸡肉中沙门氏菌和背景菌群的生长趋势。其中Huang模型[19]的表达式如式(1)、(2)所示,Baranyi模型[20]表达式如式(3)、(4)所示。

式中:Y(t)为t时刻沙门氏菌、背景菌的数量(lg(CFU/g));Y0、Ymax为初始菌数量和稳定期菌数量(lg(CFU/g));μmax为最大比生长速率/h-1;t为时间/h;λ为延滞期/h;h0反应细菌所处的生理状态,h0=λμmax;α为常数(4),定义细菌生长时由延滞后期向对数期转换。
1.3.5 二级模型的建立
分别采用Huang平方根模型[21]、Ratkowsky平方根模型[22]和Cardinal模型[23]评价温度对鸡肉中沙门氏菌和背景菌群生长速率的影响。其中Huang平方根模型的表达式如式(5)所示,Ratkowsky平方根模型表达式如式(6)所示,Cardinal模型表达式如式(7)所示。

式中:Tmin和Tmax分别为最低生长温度和最高生长温度/℃;T0为理论最低生长温度/℃;T为细菌所处的环境温度/℃;μmax为最大比生长速率/h-1;Topt为最适生长温度/℃;μopt为最适生长温度下的最适比生长速率/h-1;a、b为常数。
本研究采用预测微生物学专用软件IPMP 2013[30]对鸡肉中沙门氏菌及背景菌群的生长数据进行拟合处理,并用Excel软件作图。
实验所用鸡肉未经过消毒灭菌,天然携带一定量的微生物,其菌落数约为4.72(lg(CFU/g))。每次实验时,将未接种沙门氏菌组鸡肉样品稀释,涂布在沙门氏菌选择性培养基XLD平板上,均未检测到沙门氏菌。而抗生素抗性沙门氏菌培养物和抗生素选择性平板(TSA/R)能够更容易地区分沙门氏菌和背景菌群[15]。
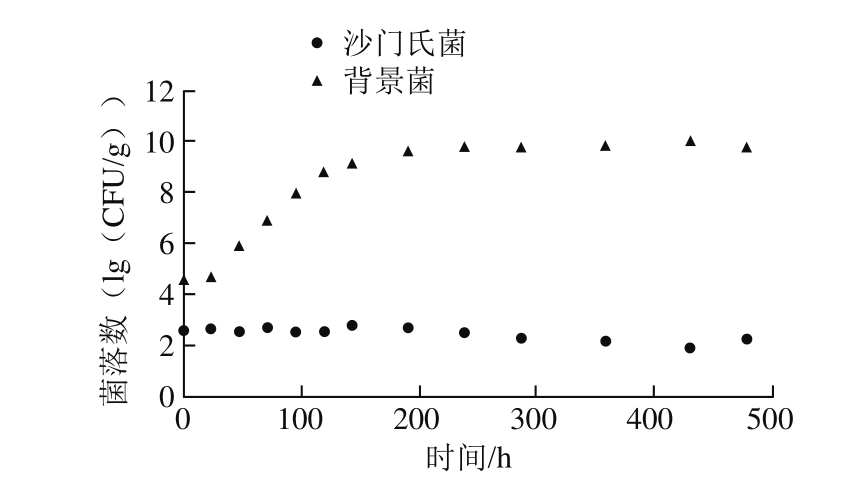
图1 8 ℃时鸡肉样品中沙门氏菌和背景菌群的生长曲线
Fig.1 Growth curves of Salmonella and background microorganisms in chicken at 8 ℃
沙门氏菌作为嗜温菌,在8 ℃时生长速率几乎为零,而背景微生物生长良好并产生完整的生长曲线(图1)。在12~43 ℃之间,沙门氏菌和背景菌在鸡肉中都能正常生长。因此,可以在12~43 ℃之间收集生长数据用于数据分析。接种的鸡肉样品中沙门氏菌的平均初始菌落数为2.75(lg(CFU/g)),而背景菌群的平均初始菌落数为4.72(lg(CFU/g)),比沙门氏菌大约高2 个数量级。沙门氏菌在此温度下会与背景菌群展开良性竞争。

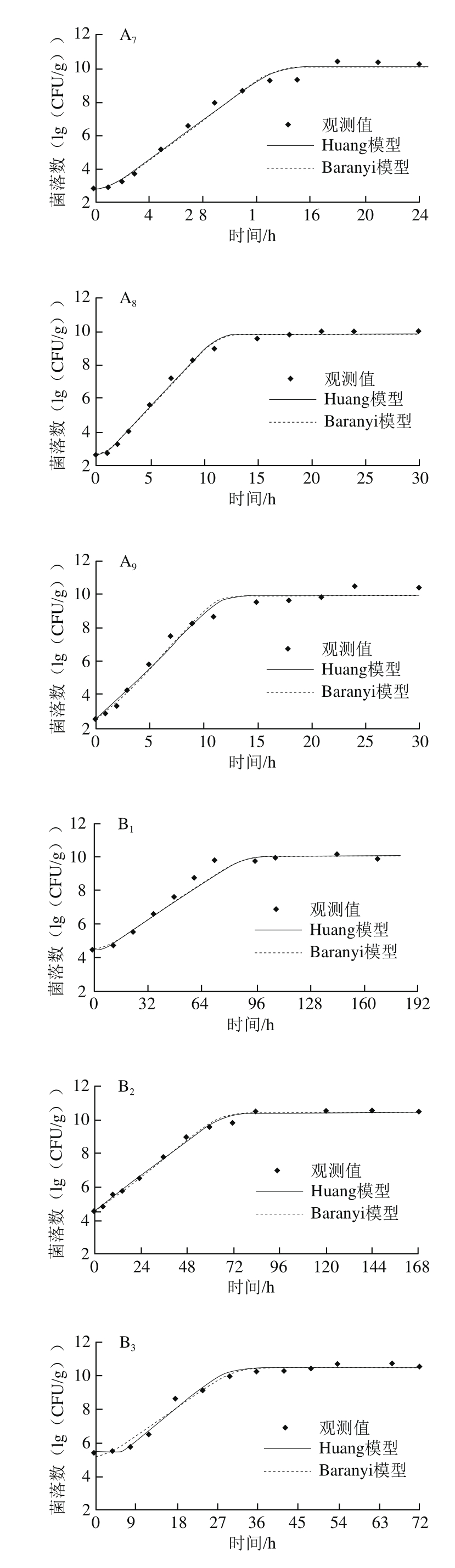
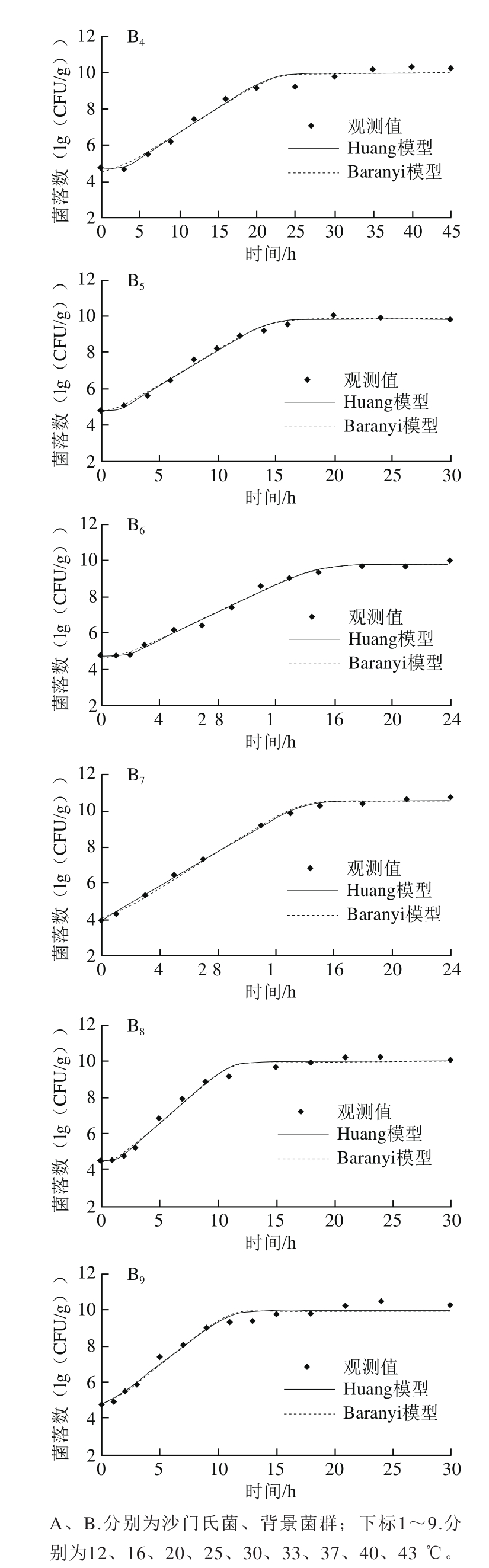
图2 鸡肉样品中沙门氏菌和背景菌群在不同温度下(12~43 ℃)的生长曲线
Fig.2 Growth curves of Salmonella and background microorganisms in chicken at different temperatures (12–43 ℃)
如图2所示,在生长曲线的稳定期期间,背景菌群的平均最大菌落数为10.29(lg(CFU/g)),比沙门氏菌(8.54(lg(CFU/g)))高近2 个数量级。在12~43 ℃下获得的所有生长曲线包括3 个特征阶段:延滞期、对数期和稳定期。随着培养温度的升高,沙门氏菌和背景微生物延滞期总体上逐渐降低,生长速率逐渐增加。
目前,国内外研究沙门氏菌生长的一级模型大多采用Baranyi模型和修正的Gompertz模型[24-27]。修正的Gompertz模型仅从数学角度对细菌生长进行建模,缺乏内在的生物学意义。此外,该方法还可能高估细菌潜伏期的生长。因此,其逐渐被考虑到细菌生长生物学机制的Baranyi模型和Huang模型所取代。如图2所示,除了8 ℃外,其他实验温度所获得的生长数据都可以用Huang模型和Baranyi模型拟合。可以看出,两种模型均能较好地拟合鸡肉中沙门氏菌和背景菌群的生长状况,但相比于Baranyi模型,Huang模型中延滞期向对数期转折点和对数期向稳定期转折点更为明显。统计参数均方根误差(root mean square error,RMSE)、均方差(mean square error,MSE)、赤池信息准则(akaike information criterion,AIC)是衡量模型拟合精确度的重要指标,一般来说,其值越小说明模型拟合精确度越高。表1、2列出了2 种一级模型的RMSE、MSE、AIC,总体来说,Huang模型和Baranyi模型的RMSE、MSE、AIC较为接近,无明显差异,可以认为2 种模型对鸡肉中沙门氏菌和背景菌群的生长曲线均具有良好的拟合精确度。Juneja等[28]研究了10~45 ℃生牛肉中沙门氏菌生长预测模型,结果表明logistic模型、modified Gompertz模型、Baranyi模型和Huang模型均能很好地拟合沙门氏菌的生长,4 个一级模型的拟合精确度并无显著差异。
表1 鸡肉样品中背景菌群一级模型相关参数
Table1 Coeff i cients of primary models for the specif i c growth rate of background microorganisms in chicken
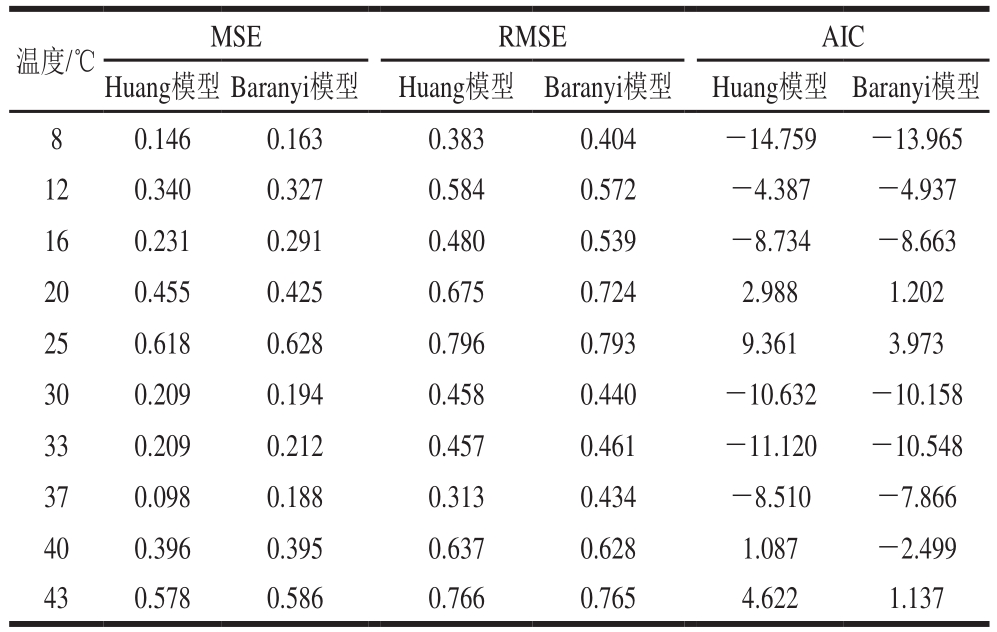
温度/℃ MSE RMSE AIC Huang模型 Baranyi模型 Huang模型 Baranyi模型 Huang模型 Baranyi模型8 0.146 0.163 0.383 0.404 -14.759 -13.965 12 0.340 0.327 0.584 0.572 -4.387 -4.937 16 0.231 0.291 0.480 0.539 -8.734 -8.663 20 0.455 0.425 0.675 0.724 2.988 1.202 25 0.618 0.628 0.796 0.793 9.361 3.973 30 0.209 0.194 0.458 0.440 -10.632 -10.158 33 0.209 0.212 0.457 0.461 -11.120 -10.548 37 0.098 0.188 0.313 0.434 -8.510 -7.866 40 0.396 0.395 0.637 0.628 1.087 -2.499 43 0.578 0.586 0.766 0.765 4.622 1.137
表2 鸡肉样品中沙门氏菌一级模型相关参数
Table2 Coef fi cients of primary models for the speci fi c growth rate of Salmonellain chicken
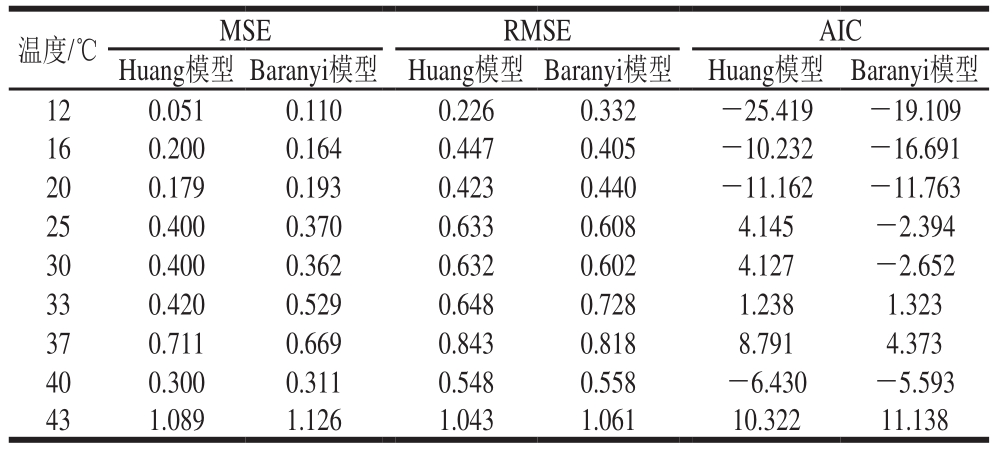
温度/℃ MSE RMSE AIC Huang模型 Baranyi模型 Huang模型 Baranyi模型 Huang模型 Baranyi模型12 0.051 0.110 0.226 0.332 -25.419 -19.109 16 0.200 0.164 0.447 0.405 -10.232 -16.691 20 0.179 0.193 0.423 0.440 -11.162 -11.763 25 0.400 0.370 0.633 0.608 4.145 -2.394 30 0.400 0.362 0.632 0.602 4.127 -2.652 33 0.420 0.529 0.648 0.728 1.238 1.323 37 0.711 0.669 0.843 0.818 8.791 4.373 40 0.300 0.311 0.548 0.558 -6.430 -5.593 43 1.089 1.126 1.043 1.061 10.322 11.138
表 3 两种模型中沙门氏菌和背景菌群的μmax
Table 3μmax ofSalmonellaand background microorganisms obtained from both models
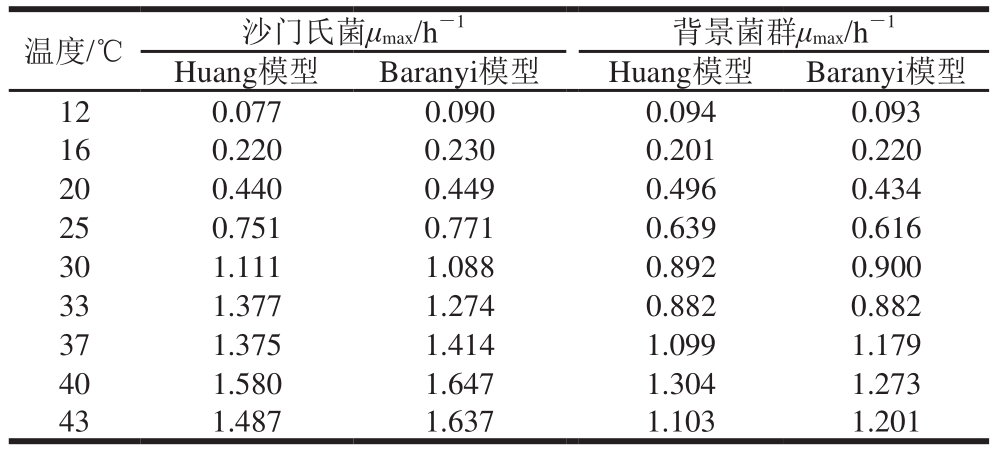
温度/℃ 沙门氏菌μmax/h-1 背景菌群μmax/h-1 Huang模型 Baranyi模型 Huang模型 Baranyi模型12 0.077 0.090 0.094 0.093 16 0.220 0.230 0.201 0.220 20 0.440 0.449 0.496 0.434 25 0.751 0.771 0.639 0.616 30 1.111 1.088 0.892 0.900 33 1.377 1.274 0.882 0.882 37 1.375 1.414 1.099 1.179 40 1.580 1.647 1.304 1.273 43 1.487 1.637 1.103 1.201
如表3所示,在12~40 ℃时,Huang模型中沙门氏菌和背景菌群的μmax随温度的升高由0.077 h-1和0.094 h-1分别增加到1.580 h-1和1.304 h-1,当温度达到43 ℃时沙门氏菌和背景菌群的μmax分别下降了0.093 h-1和0.201h-1;Baranyi模型中沙门氏菌和背景菌群的μmax随温度的升高由0.090 h-1和0.093 h-1分别增加到1.647 h-1和1.273 h-1,当温度达到43 ℃时沙门氏菌和背景菌群的μmax分别下降了0.010 h-1和0.072 h-1。
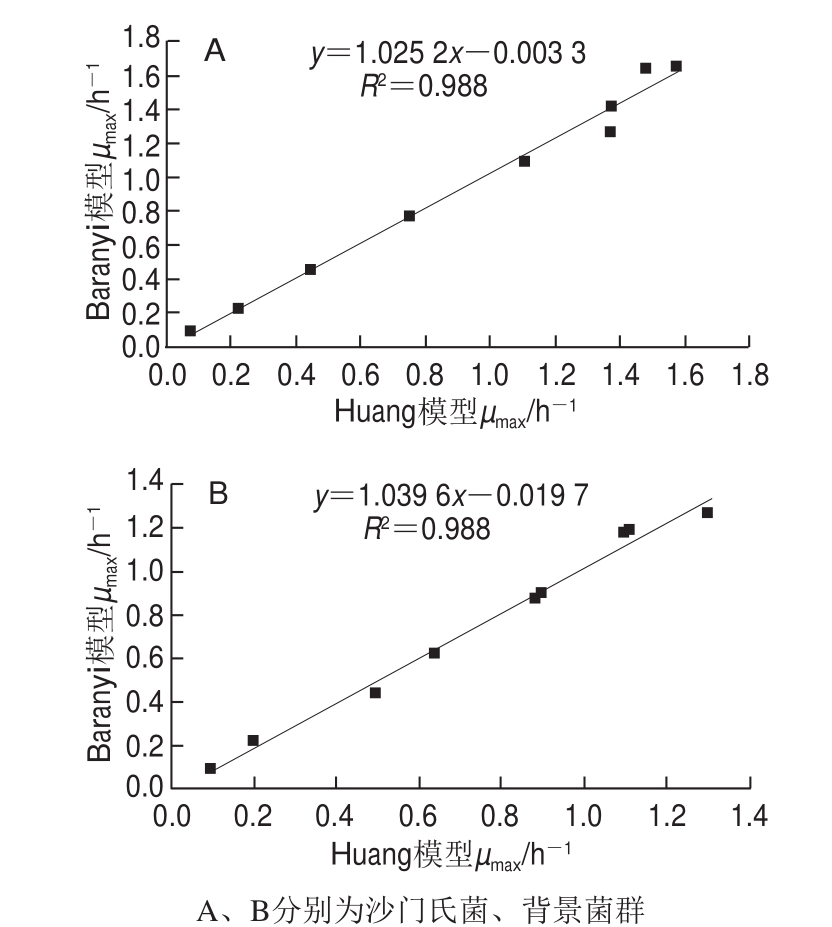
图3 Baranyi模型和Huang模型 μmax的比较
Fig.3 Comparison of μmax between Baranyi model and Huang model
图3A、B分别比较了由Baranyi模型和Huang模型预测得到的沙门氏菌及背景菌群的μmax,其回归方程所代表的直线斜率均接近于1(分别为1.025 2和1.039 6),纵轴截距趋近于0(分别为-0.003 3和-0.019 7),且R2>0.98,表明由两种模型估算的沙门氏菌及背景菌群的μmax无明显差异。这进一步证明了2 种模型对鸡肉中沙门氏菌和背景菌群的生长曲线均具有良好的拟合能力。
Li Changcheng等[29]研究三文鱼鱼籽中单增李斯特菌生长动力学时发现,Huang模型和Baranyi模型描述单增李斯特菌生长速率无显著差异,因此将两种一级模型获得的生长速率结合用于评价温度对沙门氏菌和背景菌群生长的影响。本研究通过两种一级模型推算出鸡肉样品中沙门氏菌和背景菌群的生长速率也无显著性差异,因此,可以将鸡肉样品中沙门氏菌和背景菌的生长速率合并用于评价温度对沙门氏菌和背景菌群生长的影响。图4、5表明,3 种二级模型(Huang平方根模型、Ratkowsky平方根模型、Cardinal模型)均可以用于描述温度对鸡肉样品中沙门氏菌和背景菌群生长速率的影响。

图4 3 种二级模型描述温度对鸡肉样品中沙门氏菌生长速率影响的拟合曲线
Fig.4 Curve fi tting with three secondary models of the effect of temperature on the growth of Salmonella in chicken at selected temperature conditions

图5 3 种二级模型描述温度对鸡肉样品中背景菌群生长速率影响的拟合曲线
Fig.5 Curve fi tting with three secondary models of the effect of temperature on the growth of background microorganisms in chicken at selected temperature conditions
表4 鸡肉样品中沙门氏菌生长速率的3 种二级模型参数
Table4 Coeff i cients of secondary models for the specif i c growth rate of Salmonella in chicken

注:P(>|t|). t检验中双侧检验的P值。下同。
模型 参数 取值 标准误差 t P(>|t|)Ratkowsky平方根模型a 0.042 0.003 14.076 1.18h10-9 b 0.147 0.058 2.547 2.32h10-2 T0 4.618 0.889 5.194 1.36h10-4 Tmax 52.810 3.068 17.213 8.14h10-11 Huang平方根模型a 0.100 0.000 33.400 8.44h10-14 b 0.280 0.120 2.450 2.58h10-2 Tmin 7.810 0.500 15.730 1.15h10-9 Tmax 49.670 2.550 19.450 6.05h10-11 Cardinal模型Tmin 5.918 1.739 3.403 4.29h10-3 Tmax 50.553 3.705 13.644 1.77h10-9 Topt 41.024 0.764 53.696 1.29h10-17 μopt 1.591 0.033 48.153 5.89h10-17
表5 鸡肉样品中背景菌群生长速率的3 种二级模型参数
Table5 Coeff i cients of secondary models for the specif i c growth rate of background microorganisms in chicken
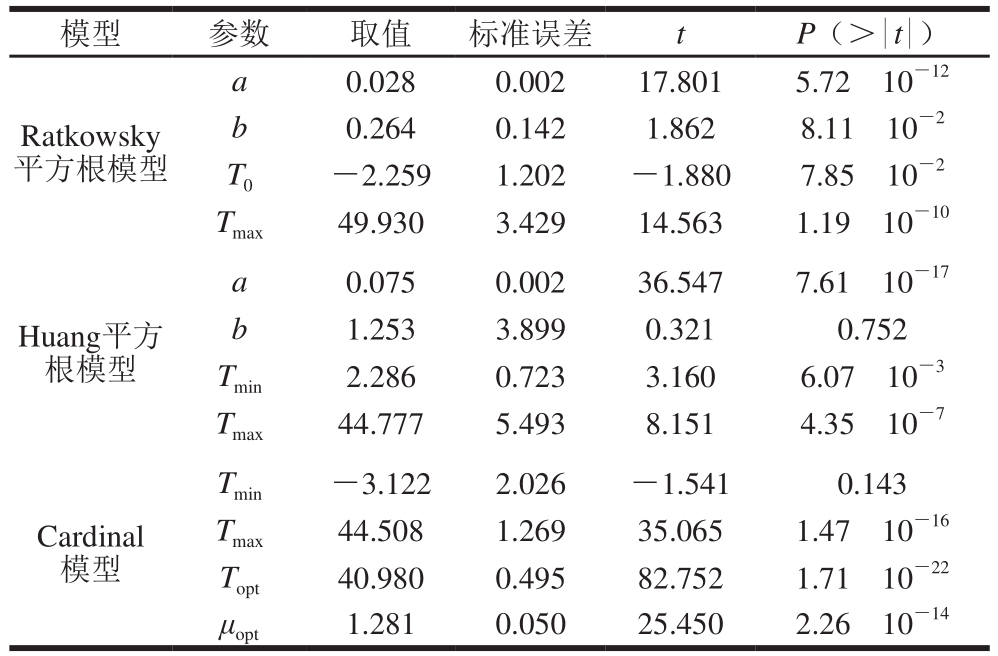
模型 参数 取值 标准误差 t P(>|t|)Ratkowsky平方根模型a 0.028 0.002 17.801 5.72h10-12 b 0.264 0.142 1.862 8.11h10-2 T0 -2.259 1.202 -1.880 7.85h10-2 Tmax 49.930 3.429 14.563 1.19h10-10 Huang平方根模型a 0.075 0.002 36.547 7.61h10-17 b 1.253 3.899 0.321 0.752 Tmin 2.286 0.723 3.160 6.07h10-3 Tmax 44.777 5.493 8.151 4.35h10-7 Cardinal模型Tmin -3.122 2.026 -1.541 0.143 Tmax 44.508 1.269 35.065 1.47h10-16 Topt 40.980 0.495 82.752 1.71h10-22 μopt 1.281 0.050 25.450 2.26h10-14
表4、5分别列出了沙门氏菌和背景菌群的Huang平方根模型、Ratkowsky平方根模型和Cardinal模型的相关参数。根据表4可知,由Huang平方根模型、Ratkowsky平方根模型和Cardinal模型拟合的鸡肉样品中沙门氏菌的最低生长温度和最高生长温度分别是7.810、4.618、5.918 ℃和49.670、52.810、50.553 ℃。Huang Lihan等[16]的研究表明,沙门氏菌最低生长温度为7.7 ℃左右。Fang Ting等[15]研究表明,沙门氏菌最高生长温度为48~49 ℃左右。在本研究中,只有Huang平方根模型拟合出的沙门氏菌最低生长温度和文献非常接近,Ratkowsky平方根模型和Cardinal模型得到的最低生长温度均较低。因此,Huang平方根模型可能更适合描述温度对鸡肉样品中沙门氏菌生长速率的影响。
鸡肉样品中背景菌群的生长也受温度的影响。与沙门氏菌不同,背景微生物可以在较低温度(8 ℃)下生长(图1)。根据表5可知,由Huang平方根模型、Ratkowsky平方根模型和Cardinal模型拟合的鸡肉样品中背景菌群的最低生长温度和最高生长温度分别是2.286、-2.259、-3.122 ℃和44.777、49.930、44.508 ℃。由图5可知,Huang平方根模型、Ratkowsky平方根模型和Cardinal模型3 种二级模型都可以描述温度对背景菌群生长的影响。然而,对于种类复杂的背景菌群来说,Ratkowsky平方根模型可覆盖的温度范围更广。在鸡肉样品中,沙门氏菌和背景菌群的延滞期受温度影响较大。总体上,随温度的升高,延滞期缩短、生长速率增加。Zhou Kang等[25]研究了不同温度和水分活度下鸡肉中沙门氏菌的生长情况,发现随温度升高其最大生长速率增加,延滞期缩短。在Huang模型中,沙门氏菌和背景菌群的延滞期和生长速率之间有如图6、7所示的对数线性关系。

图6 沙门氏菌一级模型(Huang模型)λ和μmax的相互关系
Fig.6 Correlation between λ and μmax of Salmonella evaluated by the Huang square-root primary model
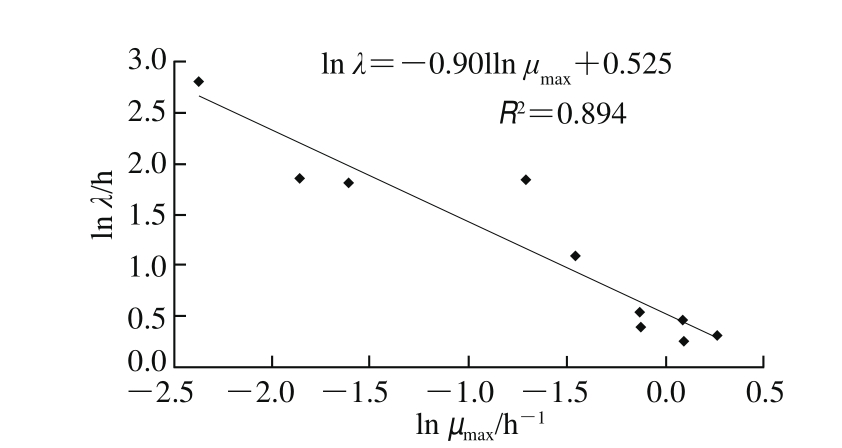
图7 背景菌群一级模型(Huang模型)λ和μmax的相互关系
Fig.7 Correlation between λ and μmax of background microorganisms evaluated by the Huang square-root primary model
本实验研究了8~43 ℃恒温条件下鸡肉样品中沙门氏菌和背景菌群的生长动力学模型。沙门氏菌在8 ℃以下生长速率几乎为零,而背景菌群生长良好。沙门氏菌与背景菌群具有完整的生长曲线,所有曲线都包含延滞期、指数期和稳定期。采用Huang模型和Baranyi模型作为一级模型,综合分析结果表明两种一级模型描述鸡肉样品中沙门氏菌和背景菌群的生长曲线没有显著差异。
使用Huang平方根模型、Ratkowsky平方根模型和Cardinal模型作为二级模型分析温度对沙门氏菌和背景菌群生长速率的影响,结果表明Ratkowsky平方根模型和Cardinal模型都低估了沙门氏菌的最低生长温度。而Huang平方根模型可以较准确地估算出沙门氏菌的最低和最高生长温度(分别为7.810 ℃和49.670 ℃)。在本研究中,当温度低于8 ℃时,鸡肉样品中的背景菌群生长良好,并有完整的生长曲线。超市出售的鸡肉一般放在冰箱里,其背景菌群比较复杂,可能含有嗜冷菌、嗜热菌等,嗜冷菌最适生长温度较低,趋于0 ℃或者低于0 ℃,与Ratkowsky平方根模型拟合出背景菌群最低生长温度(-2.259 ℃)和最高生长温度(49.930 ℃)较为符合,故选择Ratkowsky平方根模型作为背景菌群的二级模型。因此,Huang平方根模型和Ratkowsky平方根模型可以分别作为二级模型描述温度对鸡肉样品中沙门氏菌和背景菌群生长速率的影响。对于沙门氏菌和背景菌群来说,延滞期和生长速率之间存在对数线性关系。
鸡肉样品中的背景菌群可能包括嗜冷菌、嗜温菌、嗜热菌等,甚至可能含有竞争性微生物菌群,使沙门氏菌生长受到抑制。据文献[31-32]报道,在低温下沙门氏菌的生长速率低于竞争性微生物中嗜冷菌的生长速率,快速增长的竞争者在低温下耗尽样品中的营养物质,使沙门氏菌无法达到在无菌条件下观察的最大数量,但在较高温度下,沙门氏菌的生长速率与竞争性微生物相似或者更高,使沙门氏菌生长的最大数量更接近无菌食物。在本研究中,图1、2表明当温度低于20 ℃时,在鸡肉样品中背景菌群比沙门氏菌更适宜生长,温度高于20 ℃时,两者最大数量趋于一致。国外一些学者将一级模型和二级模型结合起来建立三级模型,用来预测食品中竞争性微生物对致病菌生长的影响[33-34]。目前,国内对于单一致病菌在食品中的生长模型研究已经形成一个较为完整的体系,但是较少考虑到预测模型中竞争性背景菌群对沙门氏菌生长的影响,本实验为今后的工作提供了思路。竞争模型是在生长模型的基础上建立起来的,目前的工作为以后更深入研究微生物菌群之间的生长关系提供了依据。本实验研究了温度对鸡肉样品中沙门氏菌和背景菌群生长动力学的影响,并验证了数学模型在预测微生物生长速率方面的应用。食品预测模型的建立能为食品工业和监管机构预测食品货架期以及食品中微生物的定量风险评估提供科学依据。
[1] World Health Organization. Second formal meeting of the Foodborne Disease Burden Epidemiology Reference Group (FERG): appraising the evidence and reviewing initial results[EB/OL]. [2018-08-02].http://www.who.int/foodsafety/publications/fergz/en/(2009).
[2] VARMUZOVA K, MATULOVA M E, GERZOVA L, et al. Curcuma and Scutellaria plant extracts protect chickens against inflammation and Salmonella enteritidis in fection[J]. Poultry Science, 2015, 94(9):2049-2058. DOI:10.3382/ps/pev190.
[3] LESTARI S I, HAN F, WANG F, et al. Prevalence and antimicrobial resistance of Salmonellas erovars in conventional and organic chickens from Louisiana retail stores[J]. Journal of Food Protection, 2009,72(6): 1165-1172. DOI:10.4315/0362-028X-72.6.1165.
[4] Centers for Disease Control and Prevention. CDC estimates: reports of active Salmonella Outbreak Investigations[EB/OL]. [2018-07-23].https://www.cdc.gov/salmonella/index.html.
[5] European Food Safety Authority and European Centre for Disease Prevention and Control. The European Union summary report on trends and sources of zoonoses, zoonotic agents and food-borne outbreaks[J]. European Food Safety Authority Journal, 2015, 13(12):4329. DOI:10.2903/j.efsa.2012.2597.
[6] 钟舒红, 冯世文, 李军, 等. 广西畜禽产品中沙门氏菌血清型、耐药性及耐药基因调查[J]. 中国畜牧兽医, 2018, 45(3): 770-780.DOI:10.16431/j.cnki.1671-7236.2018.03.027.
[7] 侯海燕, 刘靓, 李兵兵, 等. 淮安市2010ü2016年肉及肉制品中沙门氏菌污染状况及耐药性分析[J]. 食品安全质量检测学报, 2018,9(3): 659-663. DOI:10.3969/j.issn.2095-0381.2018.03.034.
[8] HUANG Lihan. Direct construction of predictive models for describing growth of Salmonella, Enteritidis in liquid eggs: a onestep approach[J]. Food Control, 2015, 57: 76-81. DOI:10.1016/j.foodcont.2015.03.051.
[9] LI M Y, HUANG L H, YUAN Q Q. Growth and survival of Salmonella, paratyphi A in roasted marinated chicken during refrigerated storage: effect of temperature abuse and computer simulation for cold chain management[J]. Food Control, 2017, 74: 17-24. DOI:10.1016/j.foodcont.2016.11.023.
[10] 国家食品药品监督管理总局. 解读沙门氏菌食物中毒(二): 关于生鸡肉交叉污染沙门氏菌[EB/OL]. [2018-07-25]. http://samr.cfda.gov.cn/WS01/CL1985/115000.html90(2015).
[11] 中商产业研究院. 中国肉鸡养殖行业市场前景研究报告[J]. 兽药市场指南, 2018(3): 5-9.
[12] 谷悦. 关于生鸡肉交叉污染的沙门氏菌[J]. 中国食品, 2016(4):142-143. DOI:10.3969/j.issn.1000-1085.2016.04.065.
[13] YANG Baowei, XI Meili, WANG Xin, et al. Prevalence of Salmonella on raw poultry at retail markets in China[J]. Journal of Food Protection, 2011, 74(10): 1724-1728. DOI:10.4315/0362-028X.JFP-11-215.
[14] 张玉. 山东省肉鸡中沙门氏菌的定量风险评估[D]. 济南: 山东大学,2015: 9-11.
[15] FANG Ting, HUANG Lihan, LIU Lijun, et al. Mathematical modeling of growth of Salmonella spp. and spoilage microorganisms in raw oysters[J]. Food Control, 2015, 53: 140-146. DOI:10.1016/j.foodcont.2014.12.036.
[16] HUANG Lihan, HWANG Chenan. Dynamic analysis of growth of Salmonella enteritidis in liquid egg whites[J]. Food Control, 2017, 80:125-130. DOI:10.1016/j.foodcont.2017.04.044.
[17] 逄海英. 不同温度下鸡肉中沙门氏菌的生长与次氯酸钠杀菌的微生物预测模型[D]. 杭州: 浙江大学, 2018: 57-60.
[18] U.S. Department of Agriculture. Nationwide raw ground chicken microbiological survey[J]. Food Safety and Inspection Service, 1996, 3: 1-8.
[19] HUANG L H. Optimization of a new mathematical model for bacterial growth[J]. Food Control, 2013, 32: 283-288. DOI:10.1016/j.foodcont.2012.11.019.
[20] BARANYI J, ROBERTST A. Mathematics of predictive food microbiology[J]. International Journal of Food Microbiology, 1995,26(2): 199-218. DOI:10.1016/0168-1605(94)00121-L.
[21] HUANG L H, HWANG C A, PHILLIPS J G. Evaluating the effect of temperature on microbial growth rate: the Ratkowsky and a Bělehrádek-type models[J]. Journal of Food Science, 2011, 76: 547-557. DOI:10.1111/j.1750-3841.2011.02345.x.
[22] RATKOWSKY D A, LOWRY R K, MCMEEKIN T A, et al. Model for bacterial culture growth rate throughout the entire biokinetic temperature range[J]. Journal of Bacteriology, 1983, 154(3): 1222-1226.
[23] ROSSO L, LOBRY J R, FLANDROIS J P. An unexpected correlation between cardinal temperatures of microbial growth highlighted by a new model[J]. Journal of Theoretical Biology, 1993, 162(4): 447-463.DOI:10.1006/jtbi.1993.1099.
[24] BOONYAWANTANG A, MAHAKARNCHANAKUL W,RACHTANAPUN C, et al. Behavior of pathogenic Vibrio parahaemolyticus in prawn in response to temperature in laboratory and factory[J]. Food Control, 2012, 26(2): 479-485. DOI:10.1016/j.foodcont.2012.02.009.
[25] ZHOU Kang, ZHONG Kaicheng, LONG Chao, et al. Developtment and validation of a predictive model for the growth of Salmonella enterica in chicken meat[J]. Journal of Food Safety, 2014, 34(4):326-332. DOI:10.1111/jfs.12131.
[26] VELUGOTI P R, BOHRA L K, JUNEJA V K, et al. Dynamic model for predicting growth of Salmonella spp. in ground sterile pork[J]. Food Microbiology, 2011, 28(4): 796-803. DOI:10.1016/j.fm.2010.05.007.
[27] BRUCKNER, STEFANIE, ALBRECHT, et al. A predictive shelf life model as a tool for the improvement of quality; management in pork and poultry chains[J]. Food Control, 2013, 29(2): 451-460.DOI:10.1016/j.foodcont.2012.05.048.
[28] JUNEJA V K, MELENDRES M V, HUANG L H, et al. Mathematical modeling of growth of Salmonella in raw ground beef under isothermal conditions from 10 to 45 ℃[J]. International Journal of Food Microbiology, 2009, 131(2/3): 106-111. DOI:10.1016/j.ijfoodmicro.2009.01.034.
[29] LI Changcheng, HUANG Lihan, HWANG C A, et al. Growth of Listeria monocytogenes in salmon roe: a kinetic analysis[J]. Food Control, 2016, 59: 538-545. DOI:10.1016/j.foodcont.2015.06.016.
[30] HUANG L H. IPMP 2013: a comprehensive data analysis tool for predictive microbiology[J]. International Journal of Food Microbiology, 2014, 171: 100-107. DOI:10.1016/j.ijfoodmicro.2013.11.019.
[31] THOMAS L V, WIMPENNY J W T. Competition between Salmonella and Pseudomonas species growing in and on agar, as affected by pH, sodium chloride concentration and temperature[J].International Journal of Food Microbiology, 1996, 29(2): 361-370.DOI:10.1016/0168-1605(95)00077-1.
[32] TIWARI N P, MAXCY R B. Comparative growth of salmonellae,coliforms, and other members of the microf l ora of raw and radurized ground beef[J]. Journal of Milk and Food Technology, 1972, 35(8):455-460. DOI:10.4315/0022-2747-35.8.455.
[33] OSCAR T P. Validation of a tertiary model for predicting variation of Salmonella Typhimurium DT104 (ATCC 700408) growth from a low initial density on ground chicken breast meat with a competitive microflora[J]. Journal of Food Protection, 2006, 69(9): 2048-2057.DOI:10.4315/0362-028X-69.9.2048.
[34] LIU B, SCHAFFNER D W. Quantitative analysis of the growth of Salmonella stanley during alfalfa sprouting and evaluation of Enterobacter aerogenes as its surrogate[J]. Journal of Food Protection,2007, 70(2): 316-322. DOI:10.1002/jctb.1660.
Modelling Growth Kinetics of Salmonella and Background Microorganisms in Chicken
方婷(1982—)(ORCID: 0000-0002-4045-773X),女,教授,博士,研究方向为预测微生物学、农产品加工及贮藏工程、非热力加工技术。E-mail: fangting930@163.com
李长城(1986 —)(ORCID: 0000-0003-4738-8092),男,讲师,博士,研究方向为预测微生物学及安全风险评估、非热力加工技术。E-mail: changcheng_li@fafu.edu.cn
PENG Yabo, LI Xiaoting, FANG Ting, et al. Modelling growth kinetics of Salmonella and background microorganisms in chicken[J]. Food Science, 2019, 40(9): 7-15. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180812-117.http://www.spkx.net.cn