两种饲养方式对苏尼特羊肉脂肪酸组成和脂肪代谢相关基因表达的影响
袁 倩,王柏辉,苏 琳,要 铎,王德宝,赵丽华,靳 烨*
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
摘 要:本实验分别选取放牧条件和舍饲条件下饲养12 个月的苏尼特羊各10 只(公母各5 只),利用气相色谱-质谱法和实时荧光定量聚合酶链式反应法测定不同饲养方式下苏尼特羊股二头肌脂肪酸组成和脂肪代谢相关基因表达差异,研究不同饲养方式下脂肪代谢相关基因对脂肪酸组成的影响。结果表明:放牧组羊肉饱和脂肪酸相对含量显著低于舍饲组(P<0.05),单不饱和脂肪酸相对含量显著高于舍饲组(P<0.05),多不饱和脂肪酸中α-亚麻酸、共轭亚油酸、二十碳五烯酸和二十二碳六烯酸相对含量均显著高于舍饲组(P<0.05);放牧条件下股二头肌的固醇调节元件结合蛋白基因表达量显著低于舍饲条件下(P<0.05);放牧条件下股二头肌二酰基甘油酰基转移酶、激素敏感酯酶、脂肪酸脱氢酶2基因表达量均显著高于舍饲组(P<0.05);同时PPARγ基因表达量与饱和脂肪酸含量呈显著负相关(P<0.05)。由此可见,从脂肪酸的角度来讲,放牧组肌肉营养价值更高,今后可通过调控脂肪酸代谢相关基因表达来改善舍饲羊营养品质。
关键词:饲养方式;苏尼特羊;脂肪酸组成;基因表达
肌内脂肪沉积是脂肪代谢氧化分解和合成的动态平衡结果,很大程度上受脂肪代谢相关基因和酶的调控,而肌内脂肪沉积水平又会对羊肉的脂肪酸组成造成影响。研究表明,过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARγ)和固醇调节元件结合蛋白(sterol regulatory element binding protein1-c,SREBP1-c)是脂肪酸代谢中两个重要的调控因子[1-3]。且SREBP1-c和脂肪酸合成酶(fatty acid synthase,FASN)是脂肪酸从头合成的关键酶,表达水平的升高能够显著地增加甘油三酯在体内的沉积[4]。二酰基甘油酰基转移酶(diglyceride acyltransferase,DGAT)控制着合成甘油三酯的最后一步,由甘油二酰加上脂肪酸合成甘油三酰[5]。过军明等[6]研究表明DGAT的高表达可以降低饱和脂肪酸含量,增加单不饱和脂肪酸(monounsaturated fatty acid,MUFA)含量。激素敏感酯酶(hormone-sensitive lipase,HSL)能够显著调控脂肪组织的分解从而成为影响脂肪沉积的关键酶之一[7-8]。脂蛋白脂酶(lipoprotein lipase,LPL)控制着甘油三酯分解,LPL高表达可以促进MUFA积累[9]。脂肪酸脱氢酶(fatty acid desaturase,FADS)是多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)合成途径的关键酶,FADS1和FADS2受不同因素调控,FADS1的表达易受胰高血糖素抑制,FADS2的表达则更易受肾上腺素抑制[10-11]。Khang等[12]研究表明FADS2高表达可以降低n-6/n-3 PUFA的比例。
亚油酸、亚麻酸、花生四烯酸、二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)等不饱和脂肪酸是必需脂肪酸,机体不能自主生成,只能从食物中获取,而这些不饱和脂肪酸是细胞膜、线粒体和其他代谢活跃部位的必需成分;因此,脂肪酸组成与食用健康息息相关。除此之外,肉中挥发性风味物质的形成与脂肪酸组成也有很大关系。脂肪中饱和脂肪酸尤其是长链脂肪酸在冷却降温时容易凝固,直接影响肉的口味[13]。不饱和脂肪酸本身具有很高的营养价值,它比饱和脂肪酸更容易氧化产生肉风味,特别是PUFA,极易被氧化,其氧化产物直接影响风味物质的组成[14]。肌肉中挥发性风味物质大部分为脂肪降解产物,如醛类、醇类、酮类、酸类、烃类等化合物。
苏尼特羊肉肉质细嫩、味道鲜美,具有体质结实、结构匀称、营养丰富的优点,深受广大消费者的欢迎[15]。近年来,草场退化造成的草原载畜力不足和国家退牧还草政策的实施等原因使得很多地区由传统放牧模式向舍饲模式转变。大量研究表明放牧条件下羊肉的风味和脂肪酸组成不同于舍饲条件[16-19]。本实验通过研究不同饲养方式对脂肪酸组成和脂肪代谢相关基因mRNA表达量的影响,分析脂肪酸组成和脂肪代谢相关基因mRNA表达量的相关关系,以期为今后通过调控脂肪代谢相关基因的表达改善舍饲条件下羊肉脂肪酸组成提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
选取来自内蒙古乌拉特中旗育种园区12 月龄健康的放牧和舍饲苏尼特羊各10 只,每组公母各半。放牧组和舍饲组平均体质量分别为41.49 kg和29.39 kg。净肉质量分别为11.06 kg和9.12 kg。放牧组羊白天放牧,晚上不予补饲。牧草种类主要以乌拉特中旗荒漠化草原典型牧草为主(芨芨草、蒙古葱、中间锦鸡儿、沙生冰草、碱韭等十余种)。舍饲组羊以内蒙古限牧政策下的饲养模式为依据,即前9 个月处理同放牧组,后3 个月舍饲育肥。育肥阶段食用农区饲草料(玉米秸秆、葵盘粉、葵花籽皮等,同时补充玉米精料)。两组实验羊在共同放牧9 个月后平均体质量大致相同。屠宰后迅速采集肉样,取股二头肌60 g于-20 ℃保藏待测定脂肪酸组成。其余股二头肌小块分割放入冻存管后投入液氮速冻,采回置于-80 ℃冰箱保存,待测定脂肪代谢相关基因mRNA表达量。
甲醇(色谱纯)、三氯甲烷(分析纯)、正己烷(色谱纯)、三氟化硼-乙醚络合物(分析纯)、氯化钠(分析纯)、氢氧化钠(分析纯)、无水硫酸钠(分析纯)、硫酸(分析纯)、乙醚(分析纯)、37 种脂肪酸甲酯的混标 美国Sigma公司;RNAiso Plus、Premix Taq® Version 2.0(Loading dye mix)、PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)、SYBR® Premix Ex Taq™ II、6hloading buffer、Marker DL2000 大连宝生物工程有限公司;RNase-free水北京天根生物技术有限责任公司;焦碳酸二乙酯 美国Intrivogen公司;核酸染料 无锡百泰克公司。
1.2 仪器与设备
ISQ型气相色谱质谱联用仪 赛默飞世尔科技公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;HJ-6型多头磁力搅拌加热器 江苏荣华仪器制造有限公司;5810R离心机 德国Eppendorf公司;ZHJH-C1112C超净工作台 上海智城分析仪器制造有限公司;BG-power5000型稳压稳流电泳仪、水平电泳槽 北京百晶生物技术有限公司;凝胶成像系统、CFX96™Real-Time PCR Detection System 美国Bio-Rad公司;普通聚合酶链式反应(polymerase chain reaction,PCR)仪美国Applied Biosystems公司。
1.3 方法
1.3.1 脂肪酸的测定
1.3.1.1 总脂肪酸的提取
称取5 g已均质肉样加入氯仿-甲醇混合液(体积比2∶1),振摇2 h、浸泡8 h后用G3漏斗过滤,滤液中加入5 mL质量分数20%氯化钠溶液,静置分层,下层的氯仿层即为脂肪提取液。通过无水硫酸钠脱水后,40 ℃旋转蒸发浓缩得到脂肪。然后加入0.5 mol/L的氢氧化钠-甲醇溶液5 mL,70 ℃下回流5 min,进行脂肪皂化,随后加入5 mL的三氟化硼乙醚溶液,70 ℃下回流2 min,进行脂肪甲酯化。最后加入2 mL色谱纯正己烷,70 ℃下回流1 min后,加入5 mL饱和NaCl溶液,静置10 min,吸取出1 mL正己烷层于进样瓶中,用0.22 μm有机滤膜过滤后,进行气相色谱分析[20]。
1.3.1.2 气相色谱检测
气相色谱条件:反式色谱柱(100 mh0.25 mm,0.20 μm),载气为氦气,载气流速为1 mL/min,进样口温度:240 ℃,进样量为1 μL,分流比为100∶1。采用程序升温:初始温度为60 ℃,保持1 min,然后以20 ℃/min的速率升至120 ℃,保持1 min;然后以5 ℃/min的速率升至240 ℃,保持15 min。
MS条件:离子源温度为300 ℃,传输线温度240 ℃,质量扫描范围m/z 50~500,溶剂延迟时间4 min。
1.3.2 RNA的提取和反转录
采用TRizol法提取总RNA,经琼脂糖凝胶法和紫外分光光度计检测被提取总RNA完整性和含量。cDNA由反转录试剂盒法制备,置于-20 ℃保存、待用。目的基因和管家基因的引物参照美国国立生物技术信息中心中提供的序列进行设计,引物序列如表1所示。引物均由上海生工生物工程有限公司合成。荧光定量PCR程序为预变性:95 ℃ 30 s;变性:95 ℃ 5 s,退火:57 ℃ 30 s,延伸:72 ℃ 30 s,共计35 个循环;延伸:72 ℃ 10 min,4 ℃保存24 h。试剂配制选用SYBR®Premix Ex Taq™ II试剂盒说明书的CFX96™ Real-Time PCR Detection System步骤操作。以FASN、SREBP1-c、DGAT、PPARγ、HSL、LPL、FADS1、FADS2作实验基因,18S RNA作管家基因,分别做3 个平行,两个阴性对照,进行实时荧光定量反应。
表1 荧光定量PCR引物序列
Table1 Primer sequences used for relative quantif i cation of gene expression by real time PCR

基因名称 GenBank登录号 上游引物序列3’-5’ 下游引物序列5’-3’ 长度/bp FASN XM_012109356 GTGTGGTACAGCCCCTCAAG ACGCACCTGAATGACCACTT 110 SREBP1-c XM_015098336 CGCAAAGCCATCGACTACATC TGAGCTTCTGGTTGCTGTGCT 52 DGAT NM_001110164 GACACAGACAAGGACGGAGAC TCAGCATCACCACACACCAAT 142 PPARγ XM_015102097 CACCACCGTTGACTTCTCCA GATACAGGCTCCACTTTGATTGC 141 HSL NM_001128154 ACACCTGCCGCACAAATCG CAATTACCCTCTCATCACCCTCAA 197 LPL NM_001009394 TCATCGTGGTGGACTGGC CATCCGCCATCCAGTTCATA 111 FADS1 NM_001494536 CTGCTGTACCTGCTGCACAT ACGGACAGGTGTCCAAAGTC 161 FADS2 NM_001494536 TGCCAACTGGTGGAACCATCGC GCGGCCCGATCAGGAAGAAGTAC 189 18S RNA XM_012112109 GTGGTGTTGAGGAAAGCGGACA TGATCACACGTTCCACCTCGTC 79
1.4 数据处理与分析
以37 种脂肪酸甲酯混合标准品保留时间为依据,对样品中脂肪酸甲酯定性,依据样品峰面积对样品中的脂肪酸甲酯进行定量,以面积归一法计算各脂肪酸的相对含量[21]。
本实验采用相对表达量,计算方法选用2-ΔΔCt,其中ΔΔCt=(目的基因平均Ct值-内参基因平均Ct值)处理后 -(目的基因平均Ct值-内参基因平均Ct值)处理前
使用Excel和SPSS 19.0软件进行数据差异显著性分析(单因素方差分析)和相关性分析(Pearson相关系数分析),方差分析实验结果用平均值±标准差表示。
2 结果与分析
2.1 不同饲养方式对苏尼特羊脂肪酸组成的影响
不同饲养方式对苏尼特羊股二头肌脂肪酸组成的影响如表2所示。两种饲养模式下苏尼特羊股二头肌均检测出16 种脂肪酸。饱和脂肪酸中棕榈酸、硬脂酸相对含量最高,放牧组棕榈酸和硬脂酸相对含量分别为19.011%和16.744%,舍饲组对应相对含量分别为24.373%和21.933%。不饱和脂肪酸中油酸相对含量最高,放牧组和舍饲组分别为45.577%和36.089%。放牧组饱和脂肪酸相对含量显著低于舍饲组(P<0.05),棕榈酸和硬脂酸相对含量均显著低于舍饲组(P<0.05)。放牧组MUFA相对含量显著高于舍饲组(P<0.05),棕榈油酸相对含量显著低于舍饲组(P<0.05),油酸相对含量显著高于舍饲组(P<0.05)。放牧组PUFA相对含量高于舍饲组,但差异不显著(P>0.05)。PUFA中α-亚麻酸、共轭亚油酸(conjugated linoleic acid,CLA)、EPA和DHA相对含量均显著高于舍饲组(P<0.05)。放牧组的n-3PUFA相对含量显著高于舍饲组(P<0.05),n-6/n-3水平显著低于舍饲组(P<0.05)。
表2 不同饲养方式对苏尼特羊脂肪酸组成的影响
Table2 Effects of different feeding regimens on fatty acid composition in mutton
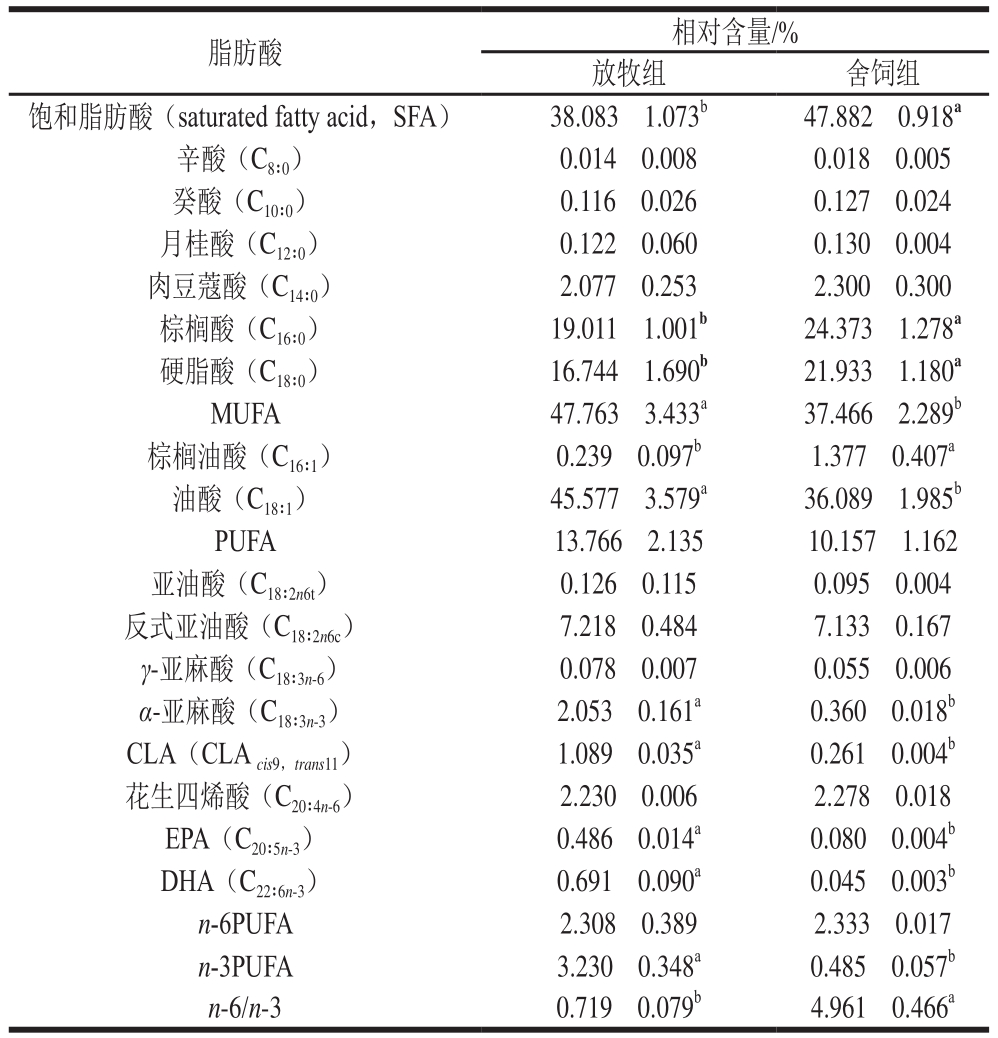
注:同行肩标小写字母不同表示差异显著(P<0.05)。
脂肪酸 相对含量/%放牧组 舍饲组饱和脂肪酸(saturated fatty acid,SFA) 38.083f1.073b 47.882f0.918a辛酸(C8∶0) 0.014f0.008 0.018f0.005癸酸(C10∶0) 0.116f0.026 0.127f0.024月桂酸(C12∶0) 0.122f0.060 0.130f0.004肉豆蔻酸(C14∶0) 2.077f0.253 2.300f0.300棕榈酸(C16∶0) 19.011f1.001b 24.373f1.278a硬脂酸(C18∶0) 16.744f1.690b 21.933f1.180a MUFA 47.763f3.433a 37.466f2.289b棕榈油酸(C16∶1) 0.239f0.097b 1.377f0.407a油酸(C18∶1) 45.577f3.579a 36.089f1.985b PUFA 13.766f2.135 10.157f1.162亚油酸(C18∶2n6t) 0.126f0.115 0.095f0.004反式亚油酸(C18∶2n6c) 7.218f0.484 7.133f0.167 γ-亚麻酸(C18∶3n-6) 0.078f0.007 0.055f0.006 α-亚麻酸(C18∶3n-3) 2.053f0.161a 0.360f0.018b CLA(CLAcis9,trans11) 1.089f0.035a 0.261f0.004b花生四烯酸(C20∶4n-6) 2.230f0.006 2.278f0.018 EPA(C20∶5n-3) 0.486f0.014a 0.080f0.004b DHA(C22∶6n-3) 0.691f0.090a 0.045f0.003b n-6PUFA 2.308f0.389 2.333f0.017 n-3PUFA 3.230f0.348a 0.485f0.057b n-6/n-3 0.719f0.079b 4.961f0.466a
2.2 RNA提取结果
由图1可知,从苏尼特羊股二头肌肌肉中提取的总RNA经质量分数1.5%琼脂糖凝胶电泳检测后,28S、18S处条带清晰明亮,总RNA完整无降解。经TU-1810型紫外-可见分光光度计检测OD值均在1.8~2.1之间,可知RNA纯度高,可用于后续反转录实验。
2.3 不同饲养方式苏尼特羊脂肪代谢相关基因表达的差异
由图2可知,放牧组SREBP1-c在股二头肌的表达量显著低于舍饲条件下(P<0.05)。放牧条件下HSL、DGAT和FADS2基因表达量显著高于舍饲组(P<0.05)。FASN、LPL、PPARγ和FADS1的表达量在不同饲养方式下无显著差异(P>0.05)。
2.4 脂肪酸含量与脂肪代谢相关基因表达量的相关性分析
表3 脂肪酸含量与脂肪代谢相关基因表达量的相关性分析
Table3 Correlation analysis between fatty acids and the expression of genes related to lipid metabolism
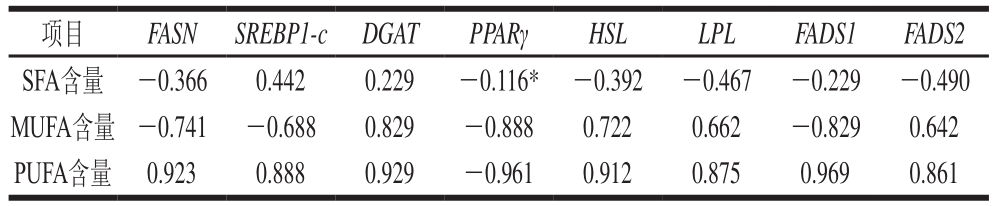
注:*.显著相关(P<0.05)。
项目 FASN SREBP1-c DGAT PPARγ HSL LPL FADS1 FADS2 SFA含量 -0.366 0.442 0.229 -0.116* -0.392 -0.467 -0.229 -0.490 MUFA含量 -0.741 -0.688 0.829 -0.888 0.722 0.662 -0.829 0.642 PUFA含量 0.923 0.888 0.929 -0.961 0.912 0.875 0.969 0.861
由表3可知,PPARγ基因表达量与SFA含量呈显著负相关(P<0.05)。SREBP1-c的表达量与SFA含量呈正相关,HSL和LPL表达量与SFA含量呈负相关,这主要是因为SFA占脂肪酸组成的绝大部分,而SREBP1-c基因主要调节脂肪合成,HSL和LPL基因主要调控脂肪分解。
3 讨 论
不饱和脂肪酸积累受多种因素共同作用,但目前众多研究表明饲养方式是影响不饱和脂肪酸积累的主要因素,已有诸多研究表明放牧羊骨骼肌中不饱和脂肪酸积累显著高于圈养羊[22-23],这与本研究结果一致。研究证明增加牧草摄入量可以刺激瘤胃频繁蠕动,促进瘤胃微生物合成长链MUFA[24]。不饱和脂肪酸种类和含量与牧草种类和牧草成分有关,肌肉中不饱和脂肪酸比例与牧草中不饱和脂肪酸比例规律基本一致[25]。EPA和DHA是两种功能性长链脂肪酸,具有抗氧化、抗衰老作用,对预防记忆力减退、阿尔茨海默病有一定疗效。研究表明CLA(C18∶2cis-9 trans-11)具有抗动脉粥样硬化、抗肿瘤等重要的生理功能。放牧组中CLA的相对含量高于舍饲组,其原因可能是牧草中某些成分有利于肌内脂肪中CLA的沉积,日粮脂肪酸被吸收后大部分不经过代谢就直接沉积,因此羊肉脂肪酸组成与日粮脂肪酸组成密切相关[26]。
放牧组的n-3PUFA相对含量显著高于舍饲组(P<0.05),n-6/n-3水平显著低于舍饲组(P<0.05),这与Sañudo等[27]的研究结果一致,其对不同饲料条件下的育肥羔羊脂肪酸特性进行比较时发现饲喂牧草可获得较高水平n-3系列脂肪酸。营养专家认为合理的n-6/n-3有利于降低血压、抑制不规律心脏跳动等其他慢性疾病的发生以及促进正常的生长发育[28],如何改善饲养模式下羊肉的n-6/n-3比例还需进一步的研究。
由于放牧组所食牧草不饱和脂肪酸含量较高,降低了SREBP1-c的表达量[29]。所以放牧组SREBP1-c在股二头肌的表达量显著低于舍饲条件下的。已有研究表明饲料中添加PUFA喂养大鼠可以降低其肝脏中SREBP1-c的表达量[30]。放牧条件下HSL、DGAT和FADS2表达量显著高于舍饲组(P<0.05)。有研究表明DGAT过表达组细胞中棕榈油酸、油酸和总MUFA相对含量显著高于对照组,而硬脂酸和总饱和脂肪酸相对含量则极显著低于对照组[8],与本实验结果一致。脂肪酸脱氢酶是合成长链PUFA的关键酶,已有研究表明FADS2的表达与EPA的含量呈显著正相关(P<0.05)[11]。还有研究表明FADS2的高表达可以增加n-3PUFA含量多于n-6系列,即FADS2的高表达可以降低n-6/n-3水平,使其更接近营养学家提出的n-6/n-3系列PUFA5∶1的黄金比例[12]。
P PA R γ基因表达量与S FA含量呈显著负相关(P<0.05)。放牧羊和舍饲羊的饱和脂肪酸组成中棕榈酸均占最大比例。研究表明棕榈酸的积累可以抑制PPARγ的表达[31-33]。PPARγ是脂肪细胞基因表达和胰岛素细胞间信号传递的主要调节者,脂肪酸的种类、浓度和作用时间等都是影响胰岛素表达的重要因素,未来可以通过调整膳食中脂肪酸组成来增加胰岛素的基因表达和分泌,发挥其有益作用。
放牧组苏尼特羊肉中调控脂肪分解的基因表达量高于舍饲组,调控脂肪合成的基因表达量低于舍饲组。放牧组SFA含量低于舍饲组,但有益健康的CLA、DHA、EPA等含量高于舍饲组,放牧组羊肉从脂肪酸角度考虑的营养价值高于舍饲组。
参考文献:
[1] SHI H B, LUO J, YAO D W, et al. Peroxisome proliferator-activated receptor-γ stimulates the synthesis of monounsaturated fatty acids in dairy goat mammary epithelial cells via the control of stearoylcoenzyme A desaturase[J]. Journal of Dairy Science, 2013, 97(12):7844-7853. DOI:10.3168/jds.2013-7863.
[2] SHI H B, LUO J, ZHU J J, et al. PPAR-γ regulates genes involved in triacylglycerol synthesis and secretion in mammary gland epithelial cells of dairy goats[J]. PPAR Research, 2013, 2013: 310948.DOI:10.1155/2013/310948.
[3] HARVATINE K J, BAUMAN D E. SREBP1 and thyroid hormone responsive spot 14(S14) are involved in the regulation of bovine mammary lipid synthesis during diet-induced milk fat depression and treatment with CLA[J]. The Journal of Nutrition, 2006, 136(10): 2468-2474. DOI:10.1093/jn/136.10.2468.
[4] YAN X C, WANG Y Z, XU Z R. Regulation of fatty acid synthase(FASN) gene expression in animals[J]. Acta Zoonutrimenta Sinica,2002, 14(2): 1-4.
[5] LIU L, ZHANG Y Y, CHEN N, et al. Upregulation of myocellular DGAT1 augments triglyceride synthesis in skeletal muscle and protects against fat-induced insulin resistance[J]. The Journal of Clinical Investigation, 2007, 117(6): 1679-1689. DOI:10.1172/JCI30565.
[6] 过军明, 束刚, 王松波, 等. DGAT2对3T3-L1成熟脂肪细胞不饱和脂肪酸组成的影响[J]. 畜牧与兽医, 2012, 44(增刊1): 166.
[7] UENTER H, ROBERT Z, RUDOLF Z. Letting lipids go: hormonesensitive lipase[J]. Current Opinion in Lipidology, 2003, 14: 289-297.DOI:10.1097/00041433-200306000-00009.
[8] KAZALA E C, PETRAK J L, LOZEMAN F J, et al. Hormonesensitive lipase activity in relation to fat content of muscle in Wagyu hybrid cattle[J]. Livestock Production Science, 2003, 79(1): 87-96.DOI:10.1016/S0301-6226(02)00141-0.
[9] OH D, LA B, LEE Y, et al. Identif i cation of novel single nucleotide polymorphisms (SNPs) of the lipoprotein lipase (LPL) gene associated with fatty acid composition in Korean cattle[J]. Molecular Biology Reports, 2013, 40(4): 3155-3163. DOI:10.1007/s11033-012-2389-y.
[10] BRENNER R R. Hormonal modulation of delta6 and delta5 desaturases: case of diabetes[J]. Prostaglandins Leukotrienes &Essential Fatty Acids, 2003, 68(2): 151-162. DOI:10.1016/S0952-3278(02)00265-X.
[11] 梅秀丽. 优质鸡不同饲养方式下FADS1、FADS2基因的表达及其对脂肪酸组成的影响[D]. 雅安: 四川农业大学, 2012: 5-11.
[12] KHANG N T, JENNEN D G, THOLEN E, et al. Association of the FADS2 gene with ω-6 and ω-3 PUFA concentration in the egg yolk of Japanese quail[J]. Animal Biotechnology, 2007, 18(3): 189-201.DOI:10.1080/10495390701201390.
[13] WEBB E C, O’NEILL H A. The animal fat paradox and meat quality[J]. Meat Science, 2008, 80: 28-36. DOI:10.1016/j.meatsci.2008.05.029.
[14] ELMORE J S, COOPER S L, ENSER M, et al. Dietary manipulation of fatty acid comPosition in lamb meat and its effect on the volatile aroma comPounds of grilled lamb[J]. Meat Science, 2005, 69(2): 233-242. DOI:10.1016/j.meatsci.2004.07.002.
[15] 莎丽娜, 靳烨, 席棋乐木格, 等. 苏尼特羊肉食用品质的研究[J]. 内蒙古农业大学学报(自然科学版), 2008(1): 106-109.
[16] GOKALP O G, ABDURRAHMAN A. Effect of feeding regime on fatty acid composition and conjugated linoleic acid content of perirenal, omental and tail fat in Akkaraman lambs[J]. African Journal of Biotechnology, 2011, 10(36): 7099-7107. DOI:10.5897/AJB11.023.
[17] ZAPASNIKIENE B. The effects of different housing and feeding systems on the growth and muscularity of weaned lambs[J].Veterinarija ir Zootechnika, 2010, 49(71): 83-87.
[18] VASTA V D, ALESSANDRO A G, PRIOLO A, et al. Volatile compound profile of ewe’s milk and meat of their suckling lambs in relation to pasture vs. indoor feeding system[J]. Small Ruminant Research, 2012, 105(1/2/3): 16-21. DOI:10.1016/j.smallrumres.2012.02.010.
[19] YAKAN A, ATES C T, ALASAHAN S, et al. Damascus kids’slaughter, carcass and meat quality traits in different production systems using antioxidant supplementation[J]. Small Ruminant Research, 2016, 136: 43-53. DOI:10.1016/j.smallrumres.2016.01.002.
[20] 王柏辉, 杨蕾, 罗玉龙, 等. 饲养方式对苏尼特羊肠道菌群与脂肪酸代谢的影响[J]. 食品科学, 2018, 39(17): 1-7. DOI:10.7506/spkx1002-6630-201817001.
[21] 李焕, 陈侨侨, 刘辉, 等. 定量结构-色谱保留相关联方法分析食用植物油中脂肪酸组成[J]. 食品科学, 2014, 35(4): 86-90. DOI:10.7506/spkx1002-6630-201404018.
[22] SCERRA M, LUCIANO G, CAPARRA P, et al. Influence of stall finishing duration of Italian Merino lambs raised on pasture on intramuscular fatty acid composition[J]. Meat Science, 2011, 89(2):238-242. DOI:10.1016/j.meatsci.2011.04.012.
[23] LIND V, BERG J, EIK L O, et al. Meat quality of lamb: pre-slaughter fattening on cultivated or mountainrange pastures[J]. Meat Science,2009, 83(4): 706-712.
[24] 茅慧玲, 刘建新. 反刍动物肌肉脂肪酸营养调控研究进展[J].饲料工业, 2010, 31(23): 30-34. DOI:10.3969/j.issn.1001-991X.2010.23.009.
[25] 冯德庆, 黄勤楼, 黄秀声, 等. 添加黑麦草饲粮对鹅肉脂肪酸组成的影响[J]. 草地学报, 2015, 23(6): 1323-1328. DOI:10.11733/j.issn.1007-0435.2015.06.028.
[26] 尹丽卿, 杨晶, 苏琳, 等. 不同月龄巴寒F2羊和小尾寒羊肌肉中共轭亚油酸含量比较[J]. 中国食品学报, 2017, 17(2): 281-287.
[27] SAÑUDO C, ENSER M E, CAMPO M M, et al. Fatty acid composition and sensory characteristics of lamb carcasses from Britain and Spain[J]. Meat Science, 2000, 54(4): 339-346. DOI:10.1016/S0309-1740(99)00108-4.
[28] ALENTINA T, FREDRIK B. Functional interactions between the gut microbiota and host metabolism[J]. Nature, 2012, 489: 242-249.DOI:10.1038/nature11552.
[29] 吴铁梅. 自然放牧与舍饲育肥条件下阿尔巴斯白绒山羊脂肪与蛋白质代谢的差异比较研究[D]. 呼和浩特: 内蒙古农业大学, 2016: 3-7.
[30] 时皎皎, 糜漫天, 韦娜, 等. 不同脂肪酸构成对大鼠肝脏HMGCoAR、SREBP-1c表达的影响[J]. 西南国防药, 2011, 21(8): 813-816. DOI:10.3969/j.issn.1004-0188.2011.08.001.
[31] 林杰义, 张奕, 罗玮, 等. 不同脂肪酸对脂肪细胞脂联素及PPARγ基因表达影响[J]. 中国公共卫生, 2012, 28(4): 493-495. DOI:10.11847/zgggws2012-28-04-31.
[32] 王柏辉, 靳志敏, 刘夏炜, 等. 影响羊肉中不饱和脂肪酸沉积因素的研究进展[J]. 食品工业, 2014, 35(12): 226-229.
[33] CIVIDINI A, LEVART A, ŽGUR S, et al. Fatty acid composition of lamb meat from the autochthonous breed reared in different production systems[J]. Meat Science, 2014, 97(4): 480-485. DOI:10.1016/j.meatsci.2013.12.012.
Effects of Two Feeding Regimens on Fatty Acid Composition and Lipid Metabolism-Related Gene Expression in Sunit Sheep
YUAN Qian, WANG Bohui, SU Lin, YAO Duo, WANG Debao, ZHAO Lihua, JIN Ye*
(College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010018, China)
Abstract: The effect of different feeding systems on fatty acid composition and lipid metabolism-related gene expression in Biceps femoris from Sunit sheep was investigated. A total of 20 twelve-month-old sheep were allocated to two feeding regimens with 10 animals each (half each gender): grazing and stall feeding. Fatty acid composition was determined by gas chromatography-mass spectrometry. The expression of fatty acid synthase (FASN), sterol regulatory element binding protein1-c (SREBP1-c), diacylglycerol acyltransferase (DGAT), peroxisome proliferators-activated receptors γ(PPARγ), hormone sensitive lipase (HSL), lipoprotein lipase (LPL), fatty acid dehydrogenase 1 (FADS1) and fatty acid dehydrogenase 2 (FADS2) genes was evaluated by real-time quantitative polymerase chain reaction. The results showed that meat from grazing sheep had significantly lower amounts of saturated fatty acids than stall-fed sheep(P < 0.05). The contents of palmioleic acid and oleic acid as monounsaturated fatty acids and the contents of α-linolenic acid, conjugated linoleic acid, eicosapentaenoic acid and docosahexaenoic acid as unsaturated fatty acids were signif i cantly higher than in the stall-fed group (P < 0.05). The expression of SREBP1-c gene was signif i cantly lower in the grazing group(P < 0.05) whereas the expression of DGAT, HSL, and FADS2 genes were signif i cantly higher compared with the stall-fed group (P < 0.05). The expression of PPARγ gene and saturated fatty acid content had a signif i cantly negative correlation with each other (P < 0.05). Thus, in terms of fatty acid composition, meat from grazing animals had a higher nutritional value.Furthermore, the nutritional quality of meat from stall-fed sheep could be improved by regulating the expression of fatty acid metabolism-related genes.
Keywords: feeding regimens; Sunit sheep; fatty acid composition; gene expression
收稿日期:2018-03-27
基金项目:国家自然科学基金地区科学基金项目(31660439);“十三五”国家重点研发计划重点专项(2016YFE0106200)
第一作者简介:袁倩(1988—)(ORCID: 0000-0003-1367-6985),女,博士研究生,研究方向为食品质量与安全。E-mail: 15849323141@163.com
*通信作者简介:靳烨(1964—)(ORCID: 0000-0001-8960-879X),男,教授,博士,研究方向为肉品科学与技术。E-mail: jinyeyc@sohu.com
DOI:10.7506/spkx1002-6630-20180327-369
中图分类号:TS251.1
文献标志码:A
文章编号:1002-6630(2019)09-0029-06
引文格式:袁倩, 王柏辉, 苏琳, 等. 两种饲养方式对苏尼特羊肉脂肪酸组成和脂肪代谢相关基因表达的影响[J]. 食品科学, 2019,40(9): 29-34. DOI:10.7506/spkx1002-6630-20180327-369. http://www.spkx.net.cn
YUAN Qian, WANG Bohui, SU Lin, et al. Effects of two feeding regimens on fatty acid composition and lipid metabolismrelated gene expression in Sunit sheep[J]. Food Science, 2019, 40(9): 29-34. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180327-369. http://www.spkx.net.cn




