
脐橙是甜橙中的优良品种,属芸香科柑橘属甜橙种。脐橙果实无籽,滋味酸甜可口,营养丰富。其果皮富含类胡萝卜素[1]、精油[2]、黄酮类化合物[3]、膳食纤维[4]等;果肉亦含有丰富的维生素和矿物质[5]。脐橙常用于鲜食,其可溶性糖、可滴定酸质量分数和固酸比是考量脐橙品质的重要指标。
黄龙病,也称“青果病”,常表现为成熟期果皮绿色或黄绿不均。黄龙病对作物具有毁灭性危害,作物感染后无法挽救,只能采取清园措施。柑橘是易感作物,与2015年相比,2016年江西省柑橘受黄龙病影响减产50万 t,约占当年柑橘产量的14%。其他柑橘产地也遭到不同程度的病害。而果农处理黄龙病果树的常用方式是将其连同果实一并焚烧,这不仅造成资源的浪费,也造成环境的污染。
柑橘黄龙病的传播途径分两种,人为传播主要通过带病接穗嫁接和带病苗木调运,自然传播是由取食病树后的带菌柑橘木虱再取食健康树来完成的[6]。因此目前关于黄龙病的研究大多集中在生物学[7-8]、植物保护[9-10]等方面。而由于国情的差异,外国学者则更多关注的是果实的榨汁特性及果汁的品质[11-12],着重关注患黄龙病对果实品质影响的报道较少。其中常被检测的果实品质指标有颜色、体积、酸、糖、风味成分组成和含量等[13-14]。果实的颜色和体积直接关系到其作为商品的外观等级;酸、糖含量是评价其口感的重要标准;风味则是从嗅觉角度对果实品质的评估,由此可见对果实品质的要求大多停留在感官层面。本实验以赣州地区主栽品种纽荷尔脐橙为原料,从外观品质、理化品质、活性成分、精油成分等方面系统地研究了患黄龙病对纽荷尔脐橙果实品质的影响,为全面认识黄龙病提供一个新角度,并为患黄龙病脐橙果的综合利用提供理论参考。
患黄龙病脐橙(以下简称患病脐橙)、正常未患黄龙病脐橙(以下简称正常脐橙),2017年10月25日采摘于江西省赣州市于都县,采摘后置于室温下放置1~2 d散去田间热。
标准品橙皮苷(纯度大于98%)、牛血清白蛋白北京Solarbio公司;甲醇、乙腈、乙酸(色谱纯) 美国天地有限公司;抗坏血酸、考马斯亮蓝G-250、半乳糖醛酸、蔗糖、蒽酮、咔唑、浓硫酸、2,6-二氯靛酚钠、无水硫酸钠等均为国产分析纯。
BSA124S电子分析天平 北京赛多利斯科学仪器有限公司;JYL-C020E料理机 九阳股份有限公司;PAL-1手持式折射仪 日本Atago公司;Sp-754PC型紫外-可见分光光度计 上海光谱仪器有限公司;GCMS-QP2010气相色谱-质谱联用仪 日本Shimadzu公司;ColorQuest XE测色仪 美国HunterLab公司;1260高效液相色谱仪 美国安捷伦科技有限公司。
1.3.1 外观品质的测定
遵循随机原则,各取20 个果实进行外观指标的测定。单果质量、果肉质量采用电子分析天平测定,计算可食率(式(1));用游标卡尺测定果实纵径、横径、果皮厚度,计算果形指数(式(2));用榨汁机鲜榨果汁,计算出汁率(式(3));果皮色泽采用测色仪测定,L*值表示果汁亮暗程度,a*值表示果汁红绿程度,b*值表示果汁黄蓝程度;果汁色泽采用比较测色仪测定。

1.3.2 理化品质的测定
水分质量分数采用直接干燥法测定;可溶性糖质量分数采用蒽酮比色法测定;可滴定酸质量分数采用酸碱滴定法测定;可溶性固形物质量分数采用手持式折射仪测定;可溶性蛋白质含量采用考马斯亮蓝法测定;粗纤维素质量分数采用酸性洗涤法测定;可溶性果胶质量分数采用咔唑比色法测定;抗坏血酸含量采用2,6-二氯靛酚滴定法测定;类胡萝卜素含量采用分光光度法测定[15]。
1.3.3 橙皮苷含量的测定
1.3.3.1 样品前处理
脐橙果皮、果肉分离,切成0.5 cm厚的片状,置于60 ℃烘箱中干燥至恒质量。经除杂、粉碎后,过60 目筛,密封,室温下于干燥器中保存。取2~3 g样品粉末于索氏提取器中,加适量石油醚(30~60 ℃),40 ℃回流提取5 h脱脂,滤去石油醚,室温晾干后保存备用。称取已制备好的脱脂粉末各0.1 g于50 mL离心管中,加入10 mL体积分数65%甲醇溶液后充分混匀,于35 ℃、170 W条件下超声40 min。取出后再于4 000 r/min条件下离心10 min,上层清液过滤至25 mL容量瓶中,残渣再重复一次上述操作。合并上清液,用体积分数65%甲醇溶液定容,充分摇匀,溶液过0.22 μm滤膜后上机测定。橙皮苷含量测定的标准曲线为y=17.811x-46.402 0,R2=0.999 5。
1.3.3.2 色谱条件
橙皮苷测定参考张金莲等[16]的方法并略作修改。色谱柱:C18(250 mm h4.6 mm,5 μm)。流动相:A为乙睛、B为2%乙酸水溶液。梯度洗脱条件:0~5 min(V(A)∶V(B)=16∶84),5.0~5.5 min(V(A)∶V(B)=22∶78),5.5~16.5 min(V(A)∶V(B)=22∶78),16.5~18.5 min(V(A)∶V(B)=50∶50),18.5~20.5 min(V(A))=39∶61),20.5~30.0 min(V(A)∶V(B)=39∶61);流速:1.0 mL/min;进样量:10 μL;柱温:40 ℃;检测波长:283 nm。以保留时间定性,根据峰面积采用外标法定量。
1.3.4 挥发油的检测
1.3.4.1 挥发油的提取
将用料理机打碎的脐橙鲜果皮100 g置于500 mL圆底烧瓶中,加水300 mL,用电热管套加热至沸腾后保持微沸。采用水蒸气蒸馏法提取,分离挥发油后加入适量无水硫酸钠脱水,称质量,密封并于4 ℃冰箱贮存。
1.3.4.2 气相色谱-质谱分析条件
气相色谱条件:H P-5石英毛细管柱(30 mmh0.25 mm,0.25 μm);柱温:40~280 ℃;升温程序:初始温度60 ℃,保持2 min,然后再以5 ℃/min的速率升温至240 ℃,并保持30 min;柱流量:1.0 mL/min;进样口温度:300 ℃;柱前压:57.4 kPa;进样量:1 μL;分流比为1∶1;载气:高纯氦气。
质谱条件:电离方式:电子轰击电离;传输线温度:250 ℃;离子源温度:200 ℃;四极杆温度:150 ℃;质量范围m/z 2~1 024。
检索谱库:检索谱库为Nist147.lib,通过计算机检索,并用面积归一法计算出各成分的相对含量。
数据均重复测定3 次,结果以平均值±标准差表示。利用SPSS 22.0统计软件对实验数据进行方差分析,采用Excel 2010和Origin 8.5软件作图,采用Duncan’s新复极差法进行差异显著性检验。
表1 患病脐橙与正常脐橙外观品质的比较
Table1 Appearance quality of HLB-infected navel oranges and normal navel oranges

注:同列肩标大写字母不同表示差异极显著(P<0.01),下同。
品种 单果质量/g 可食率/% 果皮厚度/mm 纵径/mm 横径/mm 果形指数 出汁率/% 果汁色泽正常脐橙 355.74f 45.38A78.27f 2.81A4.79f 0.35B90.96f 6.12A86.50f 2.72A1.05f 0.06A43.39f 0.72A 明黄橙患病脐橙 109.29f 22.42B64.87f 7.12B6.28f 0.16A61.29f 5.42B59.90f 4.83B1.03f 0.09A37.24f 0.06B 黄橙
如表1所示,患黄龙病后,脐橙果实单果质量极显著减小(P<0.01),与此同时可食率也极显著降低(P<0.01)。这表明患黄龙病后果实整体在变小的过程中,果肉减小的幅度比果皮大。这一点也体现在果皮厚度的数据中,患病脐橙果皮的厚度约为正常脐橙果皮的1.3 倍。二者的果形指数并没有统计学上的差异,但横纵径极显著减小(P<0.01),佐证了患病脐橙果实变小这一明显的特点。患病脐橙出汁率极显著降低(P<0.01),可能是由于患病脐橙果实的游离水含量较低。另外,二者的果汁色泽略有差异,正常脐橙果汁颜色较为明亮。王圣通等[17]的研究也表明与健康果实相比,黄龙病果实个体大小、果皮厚度等外观品质指标差异均达到极显著水平。而果皮偏厚也导致患病果实榨汁后残渣较多,若不对其加以利用,将会给环境造成较大的压力。
果皮的颜色也大有不同,如图1所示。其中图1A左侧为正常脐橙,右侧为患病脐橙。正常脐橙的果皮着色均匀,呈鲜艳的橙色;患病脐橙果皮有些黄绿不均,有些全部为绿色。从图1B也可看出,患病脐橙绿色部分果皮亮度最低,a*、b*值也最低;黄色部分果皮由于着色的不均匀性,其色泽差异较大,故较为分散;而正常脐橙果皮的L*、a*、b*值高度集中,在三者之中为最亮、最红、最黄,整体呈现为明亮的橙红色。总地来看,果实的横纵径减小,质量减小,表皮着色不均乃至完全没有转色,感染黄龙病的果实与处于未成熟阶段的果实[18]相似。Rosales等[19]也认为通常情况下,有症状的果实会延迟成熟和过早脱落。而果皮色泽的变化是判断果实是否感染黄龙病的直观条件之一。但在实际情况中,由于柑橘果树在缺乏营养或感染其他病害时,也可能出现与HLB相似症状,故不能仅依据外观症状诊断黄龙病,要结合诸如聚合酶链式反应鉴定技术[20]、拉曼光谱[21]、病原分子检测[22]等其他手段综合判断。
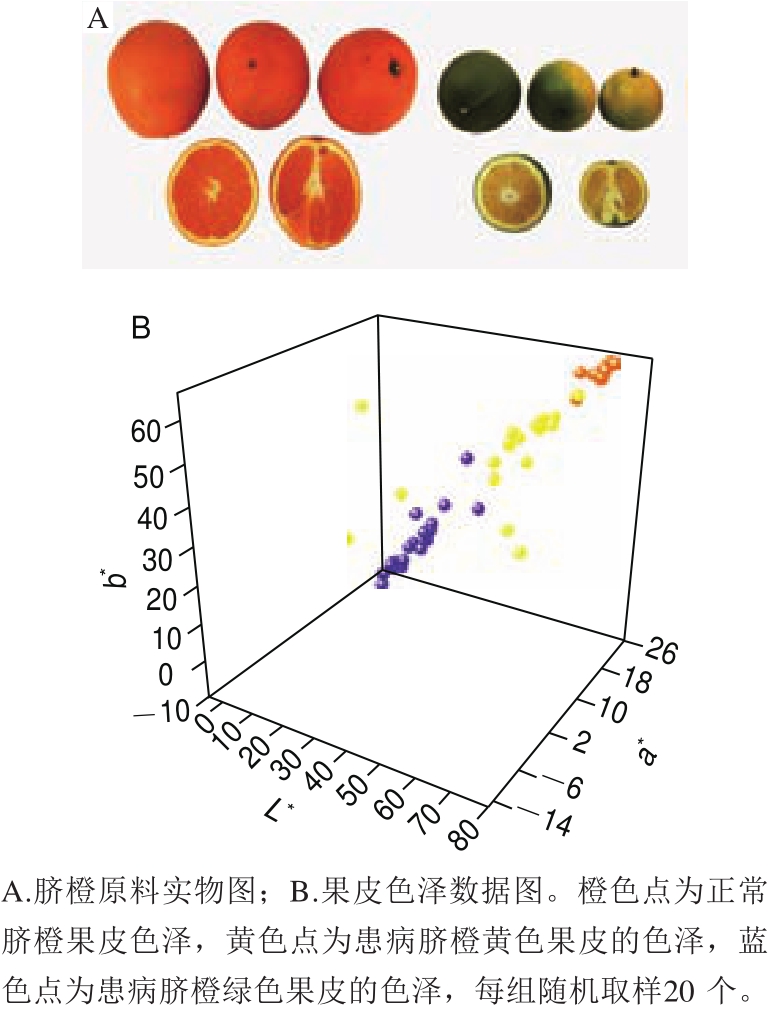
图1 患病脐橙与正常脐橙果皮色泽的比较
Fig.1 Comparison of peel color of HLB-infected navel oranges and normal navel oranges
如表2所示,患病脐橙果皮中水分质量分数、可滴定酸质量分数、可溶性蛋白质含量极显著升高(P<0.01),粗纤维质量分数显著升高(P<0.05),抗坏血酸、类胡萝卜素含量极显著降低(P<0.01),可溶性糖、果胶质量分数无显著差异;果肉中除水分、可滴定酸、可溶性果胶质量分数差异不显著外,pH值、可溶性固形物质量分数、固酸比、可溶性糖质量分数、抗坏血酸含量、可溶性蛋白质含量、类胡萝卜素含量均极显著降低(P<0.01),而粗纤维质量分数极显著升高(P<0.01)。由此可以认为,患黄龙病对果实品质具有不利影响。果肉中可溶性固形物含量降低,固酸比也随之下降,果实的食用品质也相应地变差,此时果实已不能达到良好的食用感官享受。但果皮和果肉中粗纤维含量均明显升高,可考虑就此进行开发利用,患病脐橙果实或可成为提取纤维的良好来源。
总地来看,在理化品质方面,可溶性糖、可溶性固形物质量分数均下降,固酸比降低,这与Bassanezi等[23]的研究结果一致。果实纤维的含量与化渣性密切相关[24],粗纤维含量的升高,使果实的化渣性下降,其食用品质降低。Kiefl等[25]研究发现,来自黄龙病感染的树木的橙果实并不完全成熟,被描述为有刺激性苦涩味、金属味、汁少和果味较淡。而国外众多专家学者更为关注黄龙病对橙汁品质的影响。Raithore等[26]认为,这种疾病不会影响人体健康,但与橙汁的异味有关。他们通过研究确定了将黄龙病果橙汁添加到健康橙汁中而不被察觉到的水平条件。Plotto等[12]也认为在商业加工情况下,果汁品质是根据品种、季节和产地几个因素而决定的,预计异味不会成为主要问题。
如图2所示,正常脐橙果皮橙皮苷含量为34.26 mg/g,果肉橙皮苷含量为8.14 mg/g;患病脐橙果皮中橙皮苷含量为51.04 mg/g,果肉橙皮苷含量为26.28 mg/g。果实感染黄龙病后,橙皮苷含量显著升高,果皮升高48.98%,果肉中的橙皮苷含量更是原来的3 倍有余。此结果与Massenti等[27]的结论一致。与埃及柑橘[28]相比,患病脐橙果皮橙皮苷含量至少高出24%。橙皮苷是一种被大量在柑橘类水果中发现的黄烷酮糖苷,具有抗氧化、降血脂、镇痛和抗高血压等生物活性[29]。由此也可利用感染黄龙病的果实作为原料富集橙皮苷。Cameron等[30]就以患黄龙病果树的大量落果为原料,在中试规模下提取回收黄酮类化合物、柠檬苦素等有价值的副产物。

图2 患病脐橙与正常脐橙橙皮苷含量的比较
Fig.2 Hesperidin contents in HLB-infected navel oranges and normal navel oranges
如表3所示,正常脐橙果皮精油中共鉴定出22 种挥发性成分,患病脐橙果皮精油中共鉴定出42 种挥发性成分,后者被鉴定出的化合物种类数量远大于前者。其中,二者共有的挥发性成分有13 种,分别是2-蒎烯、月桂烯、(+)-3-蒈烯、D-柠檬烯、β-罗勒烯、萜品烯、萜品油烯、壬醛、癸醛、柠檬醛、(-)-α-可巴烯、巴伦西亚橘烯、D-杜松烯,分别占各自相对含量的91.732%、89.828%。在所有的挥发性成分中,D-柠檬烯的相对含量最高,分别为75.757%和74.458%,同之前的大多数研究结果一致。
如表4所示,正常脐橙果皮精油的挥发性成分可分为萜烯烃类、烷烃类、醛类3大类,分别有17、2、3 种,萜烯烃类化合物数量最多,相对含量也最高,为96.974%;患病脐橙精油的挥发性成分有萜烯烃类、醇类、醛类、酮类和酯类,合计5大类,分别有20、7、12、1、2 种,亦是萜烯烃类化合物数量居多,且相对含量最高,为93.165%。果皮果肉精油两相比较发现,萜烯烃类化合物是脐橙精油中占据主要地位的一类化合物,且种类十分丰富。但田维芬等[31]认为,大部分烃类化合物香气较弱或无气味,而患病脐橙果皮精油中特有的酯类化合物如甲酸辛酯,有玫瑰和柑橘样的香韵,也带有果青气,使香味更加丰富。此外,两个样品共有且患病脐橙样品的相对含量更高(0.43%)的醛类挥发性成分——柠檬醛,具有令人愉悦的、强烈的柠檬气息,是抗氧化剂的有效稳定剂[32]。而感染黄龙病的样品中特有的醛类化合物数量亦有9 种。其中,有研究表明,适宜剂量的己醛熏蒸处理能够控制脐橙果实侵染性病害的同时不影响果实的贮藏品质[33],Fritsch等[34]也证明己醛可作为衡量低脂肪食物酸败的指标。精油中丰富的成分有待于日后深入研究和分离利用。
表2 患病脐橙与正常脐橙理化品质的比较
Table2 Physicochemical quality of HLB-infected navel oranges and normal navel oranges
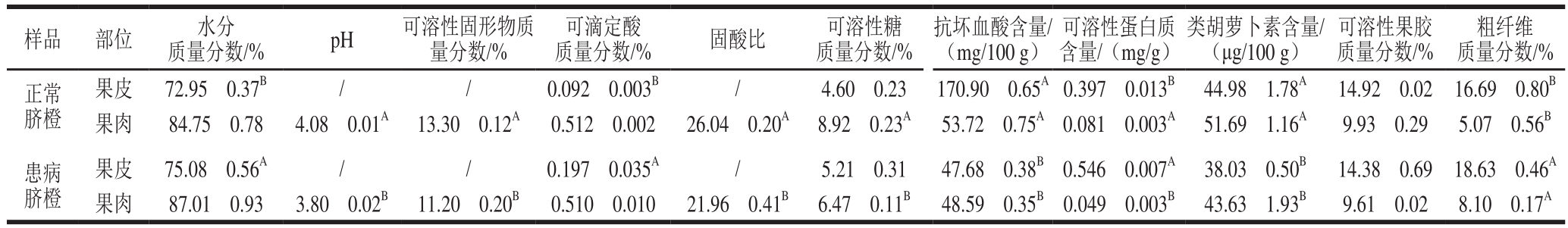
注:不同样品相同部位同列肩标大写字母不同表示差异显著(P<0.05)。/.未测定。
样品 部位 水分质量分数/%pH可溶性固形物质量分数/%可滴定酸质量分数/%固酸比可溶性糖质量分数/%抗坏血酸含量/(mg/100 g)可溶性蛋白质含量/(mg/g)类胡萝卜素含量/(μg/100 g)可溶性果胶质量分数/%粗纤维质量分数/%正常脐橙果皮 72.95f0.37B / / 0.092f0.003B / 4.60f0.23 170.90f0.65A0.397f0.013B 44.98f1.78A 14.92f0.02 16.69f0.80B果肉 84.75f0.78 4.08f0.01A 13.30f0.12A 0.512f0.002 26.04f0.20A 8.92f0.23A 53.72f0.75A 0.081f0.003A 51.69f1.16A 9.93f0.29 5.07f0.56B患病脐橙果皮 75.08f0.56A / / 0.197f0.035A / 5.21f0.31 47.68f0.38B 0.546f0.007A 38.03f0.50B 14.38f0.69 18.63f0.46A果肉 87.01f0.93 3.80f0.02B 11.20f0.20B 0.510f0.010 21.96f0.41B 6.47f0.11B 48.59f0.35B 0.049f0.003B 43.63f1.93B 9.61f0.02 8.10f0.17A
表3 患病脐橙与正常脐橙果皮精油挥发性成分的比较
Table3 Volatile components in essential oils from the peels of HLB-infected navel oranges and normal navel oranges
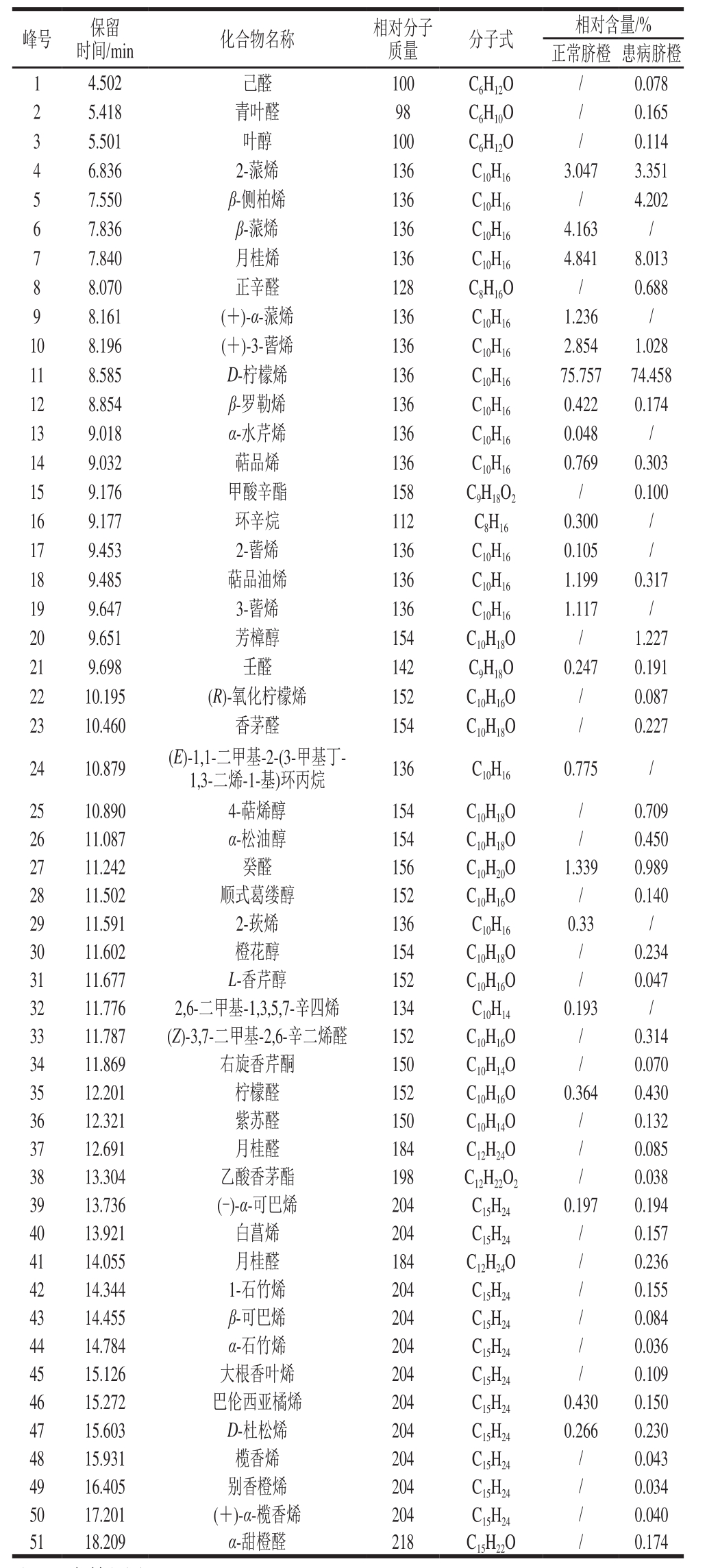
注:/.未检测出。
峰号 保留时间/min 化合物名称 相对分子质量 分子式 相对含量/%正常脐橙 患病脐橙1 4.502 己醛 100 C6H12O / 0.078 2 5.418 青叶醛 98 C6H10O / 0.165 3 5.501 叶醇 100 C6H12O / 0.114 4 6.836 2-蒎烯 136 C10H16 3.047 3.351 5 7.550 β-侧柏烯 136 C10H16 / 4.202 6 7.836 β-蒎烯 136 C10H16 4.163 /7 7.840 月桂烯 136 C10H16 4.841 8.013 8 8.070 正辛醛 128 C8H16O / 0.688 9 8.161 (+)-α-蒎烯 136 C10H16 1.236 /10 8.196 (+)-3-蒈烯 136 C10H16 2.854 1.028 11 8.585 D-柠檬烯 136 C10H16 75.757 74.458 12 8.854 β-罗勒烯 136 C10H16 0.422 0.174 13 9.018 α-水芹烯 136 C10H16 0.048 /14 9.032 萜品烯 136 C10H16 0.769 0.303 15 9.176 甲酸辛酯 158 C9H18O2 / 0.100 16 9.177 环辛烷 112 C8H16 0.300 /17 9.453 2-蒈烯 136 C10H16 0.105 /18 9.485 萜品油烯 136 C10H16 1.199 0.317 19 9.647 3-蒈烯 136 C10H16 1.117 /20 9.651 芳樟醇 154 C10H18O / 1.227 21 9.698 壬醛 142 C9H18O 0.247 0.191 22 10.195 (R)-氧化柠檬烯 152 C10H16O / 0.087 23 10.460 香茅醛 154 C10H18O / 0.227 24 10.879 (E)-1,1-二甲基-2-(3-甲基丁-1,3-二烯-1-基)环丙烷 136 C10H16 0.775 /25 10.890 4-萜烯醇 154 C10H18O / 0.709 26 11.087 α-松油醇 154 C10H18O / 0.450 27 11.242 癸醛 156 C10H20O 1.339 0.989 28 11.502 顺式葛缕醇 152 C10H16O / 0.140 29 11.591 2-莰烯 136 C10H16 0.33 /30 11.602 橙花醇 154 C10H18O / 0.234 31 11.677 L-香芹醇 152 C10H16O / 0.047 32 11.776 2,6-二甲基-1,3,5,7-辛四烯 134 C10H14 0.193 /33 11.787 (Z)-3,7-二甲基-2,6-辛二烯醛 152 C10H16O / 0.314 34 11.869 右旋香芹酮 150 C10H14O / 0.070 35 12.201 柠檬醛 152 C10H16O 0.364 0.430 36 12.321 紫苏醛 150 C10H14O / 0.132 37 12.691 月桂醛 184 C12H24O / 0.085 38 13.304 乙酸香茅酯 198 C12H22O2 / 0.038 39 13.736 (-)-α-可巴烯 204 C15H24 0.197 0.194 40 13.921 白菖烯 204 C15H24 / 0.157 41 14.055 月桂醛 184 C12H24O / 0.236 42 14.344 1-石竹烯 204 C15H24 / 0.155 43 14.455 β-可巴烯 204 C15H24 / 0.084 44 14.784 α-石竹烯 204 C15H24 / 0.036 45 15.126 大根香叶烯 204 C15H24 / 0.109 46 15.272 巴伦西亚橘烯 204 C15H24 0.430 0.150 47 15.603 D-杜松烯 204 C15H24 0.266 0.230 48 15.931 榄香烯 204 C15H24 / 0.043 49 16.405 别香橙烯 204 C15H24 / 0.034 50 17.201 (+)-α-榄香烯 204 C15H24 / 0.040 51 18.209 α-甜橙醛 218 C15H22O / 0.174
D-柠檬烯是甜橙类果皮精油的重要成分,相对含量42.79%~95%[35~37],受原料的品种、成熟度、精油提取方式等的影响而呈现较大的差异。Msaada等[38]的研究认为,精油的成分在不同作物成熟度时会有所变化。孙莹等[39]的研究则表明,成熟度越高的脐橙,其挥发性风味物质的种类越少,而D-柠檬烯的相对含量越高。此与本研究结果相似,由此可以推断,脐橙感染黄龙病后,可能会使果实的生长速度减慢,而使得在采收期时果实的成熟度并未达到可食用的程度,但脐橙品种之间或许存在较大差异。Xu等[14]研究黄龙病对哈姆林橙和巴伦西亚橙冷压橙油的理化性质和挥发性风味物质的影响发现,感染黄龙病对果实的理化品质有显著影响,而对风味物质影响不显著。更加具体的原因有待进一步研究和探索。
表4 患病脐橙与正常脐橙果皮精油挥发性成分种类及相对含量的比较
Table4 Classes and relative contents of volatile components in essential oil from the peels of HLB-infected navel oranges and normal navel oranges
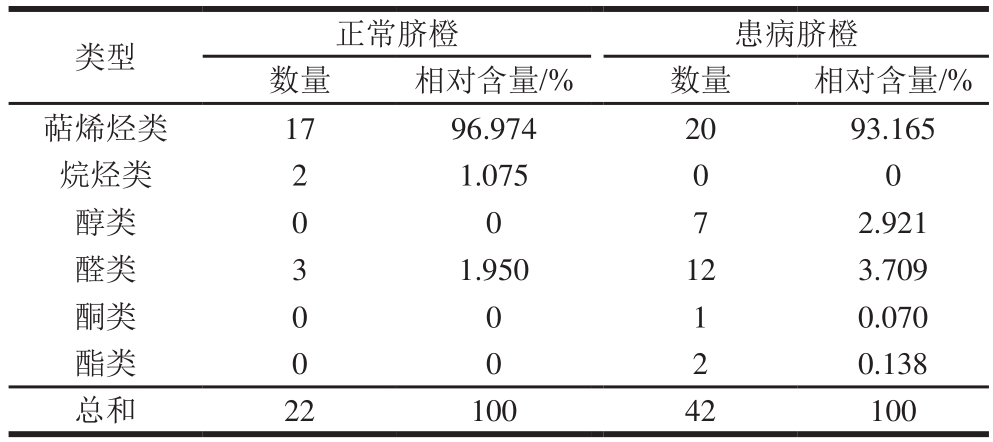
类型 正常脐橙 患病脐橙数量 相对含量/% 数量 相对含量/%萜烯烃类 17 96.974 20 93.165烷烃类 2 1.075 0 0醇类 0 0 7 2.921醛类 3 1.950 12 3.709酮类 0 0 1 0.070酯类 0 0 2 0.138总和 22 100 42 100
纽荷尔脐橙感染黄龙病后,果实质量减小,果皮色泽无法全部顺利转为橙色,果肉的可溶性糖含量、可溶性固形物质量分数等关于成熟度的指标均显著下降,果实的鲜食品质完全丧失。另一方面,纽荷尔脐橙的粗纤维含量、橙皮苷含量、精油挥发性成分均有大幅度提高或增加,为此资源的综合利用提供了可能性。
相较于前人的研究,本研究重点讨论的是感染黄龙病后,脐橙果实各方面品质的变化,包括外观指标、理化指标、活性物质和精油挥发性成分等,期望通过对脐橙果实品质上的变化比较,更加全面地认识黄龙病给果实品质带来的影响。本实验研究了黄龙病对纽荷尔脐橙品质的影响,然而柑橘种类、品种多,黄龙病对不同品种间的影响或许存在较大差异,有待于进一步研究。
[1] LU Qi, HUANG Xingjian, LÜ Siyi, et al. Carotenoid profiling of red navel orange “Cara Cara” harvested from five regions in China[J]. Food Chemistry, 2017, 232: 788-798. DOI:10.1016/j.foodchem.2017.04.064.
[2] YANG C, CHEN H, CHEN H, et al. Antioxidant and anticancer activities of essential oil from gannan navel orange peel[J]. Molecules,2017, 22(8): 1-10. DOI:10.3390/molecules22081391.
[3] 张菊华, 李志坚, 单杨, 等. 柑桔鲜果皮中类黄酮含量比较与分析[J]. 中国食品学报, 2015, 15(5): 233-240. DOI:10.16429/j.1009-7848.2015.05.032.
[4] 吴笑臣, 王科军, 钟金莲, 等. 响应面法优化脐橙渣中水溶性膳食纤维提取工艺[J]. 食品科学, 2012, 33(4): 109-114.
[5] 王芳权. 柑橘食味品质与矿物质元素的分析[J]. 浙江树人大学学报,2002, 2(3): 69-70; 81.
[6] GRAFTON-CARDWELL E E, STELINSKI L L, STANSLY P A. Biology and management of Asian citrus psyllid, vector of the huanglongbing pathogens[J]. Annual Review of Entomology, 2013,58(1): 413-432. DOI:10.1146/annurev-ento-120811-153542.
[7] YU X, KILLINY N. Effect of parental RNA interference of a transformer-2 homologue on female reproduction and offspring sex determination in Asian citrus psyllid[J]. Physiological Entomology,2018, 43(1): 42-50. DOI:10.1111/phen.12223.
[8] ZOU X P, JIANG X Y, XU L Z, et al. Transgenic citrus expressing synthesized cecropin, B genes in the phloem exhibits decreased susceptibility to Huanglongbing[J]. Plant Molecular Biology, 2016,93(4/5): 1-13. DOI:10.1007/s11103-016-0565-5.
[9] BLAUSTEIN R A, LORCA G L, TEPLITSKI M. Challenges for managing Candidatus liberibacter spp. (huanglongbing disease pathogen): current control measures and future directions[J].Phytopathology, 2018, 108(4): 424-435. DOI:10.1094/PHYTO-07-17-0260-RVW.
[10] LI J, TRIVEDI P, WANG N. Field evaluation of plant defense inducers for the control of citrus Huanglongbing[J]. Phytopathology,2016, 106(1): 37-46. DOI:10.1094/PHYTO-08-15-0196-R.
[11] GIL-IZQUIERDO A, GIL M I, FERRERES F, et al. In vitro availability of flavonoids and other phenolics in orange juice[J].Journal of Agricultural and Food Chemistry, 2016, 49(2): 1035-1041.DOI:10.1021/jf0000528.
[12] PLOTTO A, BALDWIN E, MCCOLLUM G, et al. Effect of Liberibacter infection (huanglongbing or “greening” disease) of citrus on orange juice fl avor quality by sensory evaluation[J]. Journal of Food Science, 2010, 75(4): S220-S230. DOI:10.1111/j.1750-3841.2010.01580.x.
[13] BALDWIN E, PLOTTO A, MANTHEY J, et al. Effect of liberibacter infection (huanglongbing disease) of citrus on orange fruit physiology and fruit/fruit juice quality: chemical and physical analyses[J].Journal of Agricultural and Food Chemistry, 2010, 58(2): 1247-1262.DOI:10.1021/jf9031958.
[14] XU B M, SIMS C A, ETXEBERRIA E, et al. Physicochemical and sensory properties of cold pressed oils from Florida hamlin and Valencia oranges affected by huanglongbing[J]. Journal of Food Science, 2017, 82(9): 2158-2166. DOI:10.1111/1750-3841.13814.
[15] 胡建中. 柑橘中类胡萝卜素的提取、分离、鉴定及其稳定性研究[D].武汉: 华中农业大学, 2006: 14-15.
[16] 张金莲, 何敏, 谢一辉, 等. 高效液相色谱法测定枳壳饮片中柚皮苷、橙皮苷和新橙皮苷的含量[J]. 中国试验方剂学杂志, 2010,16(6): 68-70. DOI:10.13422/j.cnki.syfjx.2010.06.048.
[17] 王圣通, 鲍敏丽, 许美容, 等. 黄龙病对纽荷尔脐橙果实品质的影响[J].广东农业科学, 2015, 42(14): 74-77. DOI:10.16768/j.issn.1004-874x.2015.14.011.
[18] ÖZDEMIR A, KAPLANKIRAN M, ÇANDIR E, et al. Fremont ve nova mandarin çeşitlerinin meyve gelişim sürecindeki kalite parametrelerindeki değişimler ve derim olumu[J]. Derim, 2015, 32(1):31-46. DOI:10.16882/derim.2015.09256.
[19] ROSALES R, BURNS J K. Phytohormone changes and carbohydrate status in sweet orange fruit from Huanglongbing-infected trees[J].Journal of Plant Growth Regulation, 2011, 30(3): 312-321.DOI:10.1007/s00344-011-9193-0.
[20] LI W B, HARTUNG J S, LEVY L. Quantitative real-time PCR for detection and identification of Candidatus Liberibacter species associated with citrus huanglongbing[J]. Journal of Microbiological Methods, 2006, 66(1): 104-115. DOI:10.1016/j.mimet.2005.10.018.
[21] PÉREZ M R, MENDOZA M G, ELÍAS M G, et al. Raman spectroscopy an option for the early detection of citrus Huanglongbing[J]. Applied Spectroscopy, 2016, 70(5): 829-839.DOI:10.1177/0003702816638229.
[22] YAQUB M S, KHAN I A, USMAN M, et al. Molecular detection of Candidatus liberibacter asiaticus, the causal organism of huanglongbing (Citrus greening) in Faisalabad, Pakistan for Huanglongbing management[J]. Pakistan Journal of Agricultural Sciences, 2017, 54(1): 21-26. DOI:10.21162/PAKJAS/17.4455.
[23] BASSANEZI R B, MONTESINO L H, STUCHI E S. Effects of huanglongbing on fruit quality of sweet orange cultivars in Brazil[J].European Journal of Plant Pathology, 2009, 125(4): 565-572.DOI:10.1007/s10658-009-9506-3.
[24] 辜青青, 唐红英, 魏清江, 等. 南丰蜜橘果实纤维素代谢与化渣的关系研究[J]. 园艺学报, 2016, 43(5): 867-875. DOI:10.16420/j.issn.0513-353x.2015-0750.
[25] KIEFL J, KOHLENBERG B, HARTMANN A, et al. Investigation on key molecules of HLB induced orange juice off-f l avor[J]. Journal of Agricultural and Food Chemistry, 2017, 66(10): 2370-2377.DOI:10.1021/acs.jafc.7b00892.
[26] RAITHORE S, DEA S, PLOTTO A, et al. Effect of blending huanglongbing (HLB) disease affected orange juice with juice from healthy orange on flavor quality[J]. LWT-Food Science and Technology, 2015, 62(1): 868-874. DOI:10.1016/j.lwt.2014.06.020.
[27] MASSENTI R, LO B R, SANDHU A K, et al. Huanglongbing modifies quality components and flavonoid content of ‘Valencia’oranges[J]. Journal of the Science of Food and Agriculture, 2016,96(1): 73-78. DOI:10.1002/jsfa.7061.
[28] NABIL M, DONIA T, MOHAMED T M. Antioxidant effect of hesperidin isolated from orange peels[J]. International Journal of Applied Science and Technology, 2016, 35: 1-5.
[29] JAVED H, VAIBHAV K, AHMED M E, et al. Effect of hesperidin on neurobehavioral, neuroinflammation, oxidative stress and lipid alteration in intracerebroventricular streptozotocin induced cognitive impairment in mice[J]. Journal of the Neurological Sciences, 2015,348(1/2): 51-59. DOI:10.1016/j.jns.2014.10.044.
[30] CAMERON R G, CHAU H K, HOTCHKISS A T, et al. Recovery of pectic hydrocolloids and phenolics from huanglongbing related dropped citrus fruit[J]. Journal of the Science of Food & Agriculture,2017, 97(13): 4467-4475. DOI:10.1002/jsfa.8310.
[31] 田维芬, 周君, 明庭红, 等. 基于电子鼻和GC-MS的不同品牌橄榄油挥发性风味物质研究[J]. 食品工业科技, 2017, 38(7): 285-292.DOI:10.13386/i.issn1002-0306.2017.07.047.
[32] ZHAO Q, HO C T, HUANG Q. Effect of ubiquinol-10 on citral stability and off-flavor formation in oil-in-water (O/W)nanoemulsions[J]. Journal of Agricultural and Food Chemistry, 2013,61(31): 7462-7469. DOI:10.1021/jf4017527.
[33] 曹琦, 王建军, 邓丽莉, 等. 己醛处理对脐橙果实贮藏品质的影响[J].食品科学, 2015, 36(20): 252-257. DOI:10.7506/spkx1002-6630-201520049.
[34] FRITSCH C W, GALE J A. Hexanal as a measure of rancidity in low fat foods[J]. Journal of the American Oil Chemists’ Society, 1977,54(6): 225-228. DOI:10.1007/BF02655159.
[35] 吴均, 杨德莹, 李抒桐, 等. 甜橙精油的化学成分、抑菌和抗氧化活性研究[J]. 食品工业科技, 2016, 37(14): 148-153. DOI:10.13386/j.ieen1002-0306.2016.14.021.
[36] XHAXHIU K, WENCLAWIAK B. Comparison of supercritical CO2 and ultrasonic extraction of orange peel essential oil from Albanian Moro cultivars[J]. Journal of Essential Oil Bearing Plants, 2015, 18(2):289-299. DOI:10.1080/0972060X.2015.1010603.
[37] ABREU I, DA COSTA N C, VAN ES A, et al. Natural occurrence of aldol condensation products in Valencia orange oil[J]. Journal of Food Science, 2017, 82(12): 2805-2815. DOI:10.1111/1750-3841.13948.
[38] MSAADA K, HOSNI K, TAARIT M B, et al. Changes on essential oil composition of coriander (Coriandrum sativum L.) fruits during three stages of maturity[J]. Food Chemistry, 2007, 102(4): 1131-1134.DOI:10.1016/j.foodchem.2006.06.046.
[39] 孙莹, 陈世珍, 朱丽琴, 等. 不同成熟度赣南“纽荷尔”脐橙香气成分和主要品质指标分析[J]. 江西农业大学学报, 2015, 37(3): 429-434.DOI:10.13836/j.jjau.2015066.
Effect of Huanglongbing on the Quality of Newhall Navel Orange
WANG Qiang, CHEN Jinyin, XU Mingsheng, et al. Effect of huanglongbing on the quality of newhall navel orange[J]. Food Science,2019, 40(9): 48-53. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180329-394. http://www.spkx.net.cn