大黄鱼(Pseudosciaena crocea Richardson)属于硬骨鱼纲、鲈形目、石首鱼科、黄鱼属,又名“黄花鱼”、“长命鱼”等[1],是我国东海四大经济鱼类之一,其肉质细腻鲜美,富含蛋白质、维生素及二十碳五烯酸、二十二碳六烯酸等高不饱和脂肪酸,深受国内外消费者的喜爱[2]。上世纪80年代以来,由于过渡捕捞等原因,东海野生大黄鱼已难以形成渔汛,随着大黄鱼人工育苗技术的突破,大黄鱼现主要依靠人工养殖方式进行生产,我国是养殖大黄鱼重要的出口国,养殖大黄鱼具有较大的出口规模[3]。目前,我国养殖大黄鱼以鲜活销售为主,虽然其产量不断增加,经济效益却未见大幅提升[4]。究其原因,主要是大黄鱼不易保存[5],现阶段缺少良好的加工贮藏方式,大黄鱼加工产品仍以初级加工的冷冻品、罐制品、腌制品等为主,精深加工及高附加值产品少[6]。因此,需要一种更好的加工保鲜处理方式来提高产品品质,提升养殖大黄鱼产品附加值,这对全国养殖大黄鱼产业发展及升级具有重大意义。
超高压技术(high hydrostatic pressure,HHP)是一种新兴食品加工技术,通过一定的液体介质(一般情况下为水),在一定的温度下对样品进行100~1 000 MPa处理[7]。HHP属于纯物理冷加工技术,利用高挤压、高渗透及卸压时的膨胀作用杀灭食品中的微生物,钝化酶或使其部分失活,使蛋白质变性,从而避免热加工的破坏作用,达到延长食品的贮藏期、保持食品原有的营养成分与风味[8-9]的效果,现阶段HHP已在诸多食品领域有所运用[10]。HHP可以破坏维持蛋白空间结构的各种化学键,导致其空间结构改变,甚至使蛋白发生变性。而HHP对养殖大黄鱼鱼肉肌原纤维蛋白质结构的影响鲜有报道。
蛋白质构象复杂,检测方法较多且各有侧重:荧光分光光度法应用于分析其内源荧光性;傅里叶变换红外光谱法应用于测定蛋白官能团结构;圆二色光谱(circular dichroism,CD)法应用于测定蛋白质二级结构;激光拉曼光谱法可快速、无损检测蛋白质结构,定性、定量分析蛋白质功能基团的变化;扫描电子显微镜法用于观察蛋白微观结构。本研究以养殖大黄鱼鱼肉为原料,经过不同压力和保压时间下的HHP处理,通过荧光分光光度测定、傅里叶变换红外光谱分析、CD分析、激光拉曼光谱分析、扫描电子显微镜观察,研究HHP处理对养殖大黄鱼肌原纤维蛋白结构及产品品质的影响,为HHP处理海水鱼类生产加工提供理论支撑,进一步拓宽水产品及相关产品研发思路。
养殖大黄鱼购于宁波路林市场,体质量为(0.5f0.1)kg,冰盒运回实验室,清水冲洗,去头、尾、皮、骨,取肉。鱼肉置于绞肉机中绞碎至肉糜,分装于10 cmh10 cm真空包装袋中,每袋约22 g,真空包装。Beyotime二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度试剂盒购于上海生工生物工程有限公司;其他试剂均为国产分析纯。
HPP.M1 HHP处理设备(0~600 MPa) 天津市华泰森淼生物工程技术有限公司;PL2002电子分析天平、FE20-pH计 梅特勒-托利多仪器(上海)有限公司;DZ-400双室真空包装机 宁波江东明兴包装设备物资有限公司;J-26XP高速冷冻离心机 美国贝克曼库尔特有限公司;ALPHA2-4冷冻干燥仪 上海实维实验仪器技术有限公司;FSH-2A可调高速匀浆机 上海维诚仪器有限公司;F4600荧光分光光度仪、E-1010镀金仪、S-3400N扫描电子显微镜 日本日立公司;Vertex 70傅里叶变换红外光谱仪 德国布鲁克公司;inVia-reflex激光拉曼光谱仪 英国Renishaw公司;J-1500 CD仪 日本JASCO分光株式会社。
1.3.1 HHP处理条件
将真空包装的鱼肉置于0 ℃冰温环境下,分两组进行HHP处理:第1组HHP条件为:压力150、200、250、300、350、400、450、500 MPa,保压时间10 min;第2组HHP条件为:压力300 MPa,保压时间5、10、15、20、25、30 min。水相保压,升压速率15 MPa/s,泄压过程在3 s内完成,内腔温度约4 ℃,以未处理组样品为空白对照组,置于-40 ℃冰箱备用。
1.3.2 肌原纤维蛋白提取
参照Jiang Xinjing[11]和Chin[12]等的方法稍作修改。取适量鱼肉,加4 倍体积4 ℃提取液(20 mmol/L pH 7.5磷酸盐缓冲液),7 500 r/min匀浆60 s,4 ℃下7 000 r/min离心10 min,弃上清液,重复匀浆、离心2 次。匀浆60 s,加4 倍体积冰洗液(0.1 mol/L NaCl溶液),7 000 r/min冷冻离心10 min,弃上清液,重复匀浆、离心1 次。匀浆60 s,加4 倍体积冰洗液,3 层纱布过滤,7 000 r/min 4 ℃冷冻离心10 min,肌原纤维蛋白沉淀称质量后置于塑料培养皿中,包保鲜膜,-40 ℃冷冻48 h,于ALPHA2-4冷冻干燥仪中冷冻干燥24 h,将肌原纤维蛋白用液氮研磨成粉,真空包装,干燥保存。
1.3.3 肌原纤维蛋白质量浓度的测定
称取0.100 g肌原纤维蛋白样品,溶于10 mL质量分数3.5%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液,漩涡混匀5 s,37 ℃水浴30 min。采用Beyotime BCA蛋白浓度试剂盒测定浓度,稀释液为质量分数3.5% SDS,将标准品按0、1、2、4、8、12、16、20 μL加到96 孔板的标准品孔中,加稀释液补足20 μL,即标准品终质量浓度分别为0、0.025、0.050、0.100、0.200、0.300、0.400、0.500 mg/mL;加10 μL样品到96 孔板的样品孔中,加10 μL稀释液补足20 μL并记录样品体积,各孔加入200 μL BCA工作液,37 ℃恒温摇床放置30 min,用酶标仪在593 nm波长处测定OD值,根据标准曲线和样品体积计算出样品蛋白的质量浓度。
1.3.4 肌原纤维蛋白荧光强度测定
参考Xu Yangshun等[13]的方法,精确称取肌原纤维蛋白0.100 g,溶于5 mL质量分数3.5% SDS溶液中,37 ℃水浴2 h,滤纸过滤。设置激发波长为276 nm,发射波长范围280~450 nm,扫描速率12 000 nm/min,以质量分数3.5% SDS作空白。
1.3.5 肌原纤维蛋白傅里叶变换红外光谱测定
取适量样品与100 mg KBr(质量比1∶100)混合,研磨、压片。使用Vertex 70傅里叶变换红外光谱仪于4 000~400 cm-1进行检测,室温25 ℃扫描并记录光谱[14]。
1.3.6 肌原纤维蛋白CD测定
根据Masahiro等[15]的方法,配制0.02~0.20 mg/mL的样品蛋白溶液,以蒸馏水为空白,于190~250 nm范围内进行扫描,选用1 mm比色皿,室温25 ℃,扫描速率为100 nm/min,0.25 s响应,消除本底,每组样品重复扫描3 次。α-螺旋含量计算公式如下。
式中:θ208为样品中残基椭圆度/(deggcm2/dmol)。
1.3.7 肌原纤维蛋白激光拉曼光谱测定
取适量肌原纤维蛋白,采用inVia-reLex激光拉曼光谱仪测定,激发波长785 nm,扫描范围400~3 200 cm-1,激发功率140 mW,曝光10 s/次,扫描3 次取平均值。
1.3.8 肌原纤维蛋白扫描电子显微镜观察
将样品制成2 mmh2 mmh1 mm的薄片,放入质量分数3%戊二酸溶液在4 ℃下固定24 h,倒掉固定液,用0.1 mol/L磷酸盐缓冲液漂洗样品3 次,15 min/次;用质量分数1%锇酸溶液固定样品1 h,倒掉固定液,用0.1 mol/L磷酸盐缓冲液漂洗样品3 次,15 min/次。依次用体积分数30%、50%、70%、80%、90%乙醇溶液对样品进行脱水处理15 min[16],再用无水乙醇处理2 次,每次10 min。依次用无水乙醇-叔丁醇混合液(体积比分别为3∶1、1∶1、1∶3)处理10 min,再用叔丁醇处理样品10 min。加适量叔丁醇,放入-70 ℃冰箱2 h,然后放入冷冻干燥机干燥48 h,取适量样品粘贴在样品铜台,采用E-1010镀金仪镀金,真空度1.32h10-5~1.32h10-6 Pa,电压1.1~1.2 kV,镀膜2~3 min,扫描电子显微镜观察。
使用Off i ce Excel 2003软件进行数据处理及绘图。

图1 不同压力处理肌原纤维蛋白10 min内源荧光强度变化
Fig.1 Endogenous fl uorescence spectra of myof i brillar proteins treated with different pressures for 10 min
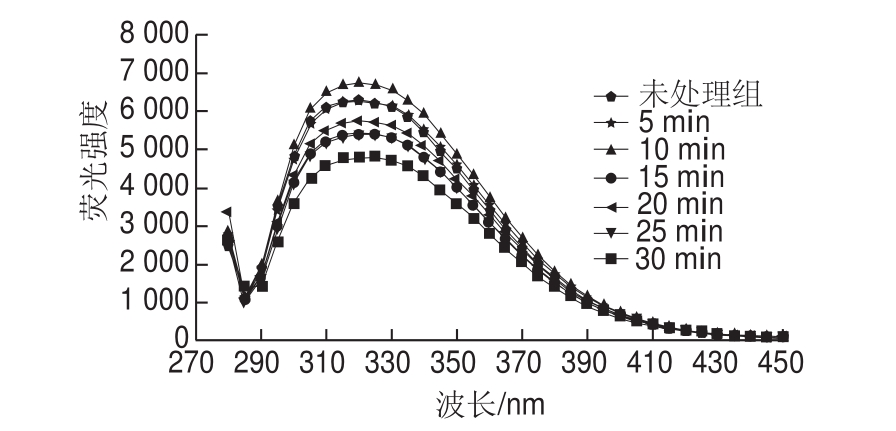
图2 不同保压时间300 MPa处理肌原纤维蛋白内源荧光强度变化
Fig.2 Endogenous fl uorescence spectra of myof i brillar proteins treated for different durations at 300 MPa
如图1、2所示,肌原纤维蛋白的最大吸收波长(λmax)分布在320 nm左右,λmax在保压时间10 min、压力200 MPa时开始出现不同程度的红移(λmax向长波长方向移动),随着压力的增大以及保压时间的延长,红移并没有继续,但荧光强度增强。λmax与色氨酸残基所在的环境有很大的关系,当色氨酸残基在蛋白质分子内部的非极性环境时,λmax小于330 nm;当色氨酸残基在蛋白质分子外部的极性环境时,λmax大于330 nm。本研究中λmax在320 nm附近,表明色氨酸残基大多在蛋白质内部的非极性环境中;λmax出现红移说明经过HHP处理,养殖大黄鱼肌原纤维蛋白色氨酸残基移动到蛋白质的外部,使色氨酸残基暴露在极性环境中,而荧光强度的改变则说明HHP处理使更多的色氨酸残基暴露到蛋白质分子表面更强的极性环境中。HHP处理改变了肌原纤维蛋白中色氨酸残基的微环境[17]。

图3 不同压力处理肌原纤维蛋白10 min傅里叶变换红外光谱
Fig.3 Fourier transform infrared spectra of myof i brillar proteins treated with different pressures for 10 min
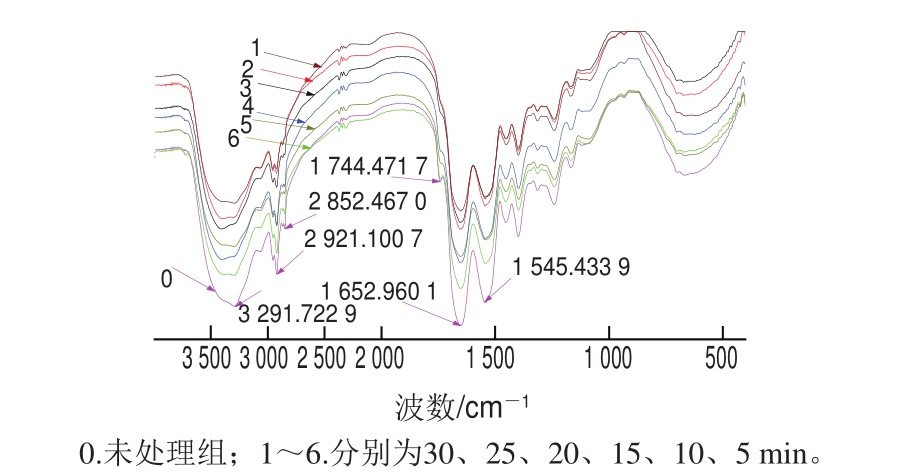
图4 不同保压时间300 MPa处理肌原纤维蛋白傅里叶变换红外光谱
Fig.4 Fourier transform infrared spectra of myof i brillar proteins treated for different durations at 300 MPa
如图3、4所示,样品在红外区出现若干个特征吸收峰,养殖大黄鱼鱼肉的肌原纤维蛋白在酰胺A带(3 300 cm-1左右)、酰胺B带(3 100 cm-1左右)、酰胺I带(1 660 cm-1左右)、酰胺II带(1 570、1 300 cm-1左右)都有吸收峰出现[18]。随着压力的增大,酰胺A带峰值减弱,且随着保压时间的延长发生偏移,说明压力的增大和保压时间的延长使肌原纤维蛋白中的氢键发生变化。随着压力增加,1 742 cm-1处吸收峰消失,1 650 cm-1处吸收峰减弱,这都说明碳氧双键(—C=O)的结构或所处的化学环境发生了改变,可能是因为碳原子周围电负性强的原子增加,使—C=O上面的电子云密度减小,导致吸收峰减弱。在HHP处理过程中,可能是因为水分子在其作用下进入蛋白分子中,使大分子内部结构发生了一系列的变化,使肌原纤维蛋白二级结构改变。
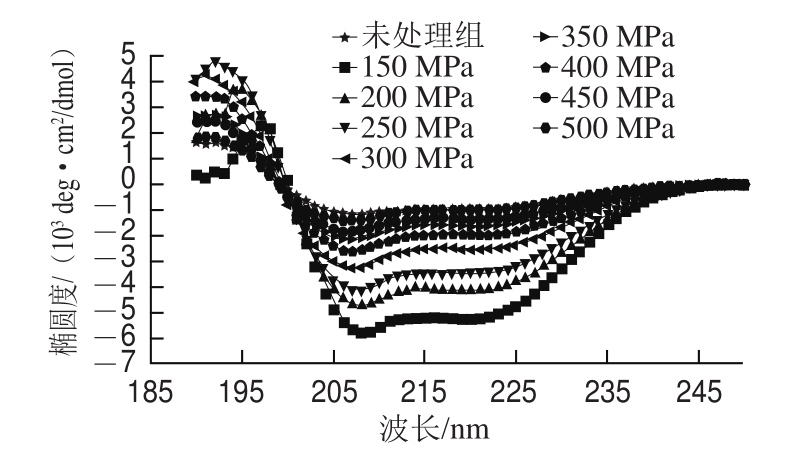
图5 不同压力处理肌原纤维蛋白10 min CD图谱
Fig.5 CD spectra of myof i brillar proteins treated with different pressures for 10 min

图6 不同保压时间300 MPa处理肌原纤维蛋白CD图谱
Fig.6 CD spectra of myof i brillar proteins treated for different durations at 300 MPa
蛋白质CD的190~240 nm为远紫外区,是肽键的吸收范围,同时也包含了主链构象信息。在222~208 nm波长范围内会出现双槽曲线(即负肩峰)是蛋白质结构中的α-螺旋结构的特征吸收峰[19]。由图5、6可知,在208 nm和222 nm处出现两个负凹槽,208 nm处为负肩峰,并且在210~220 nm波长之间存在一个很微弱的正峰。208 nm和222 nm负凹槽的负科顿效应是由于蛋白质α-螺旋结构引起的,220 nm波长处负肩峰的出现表示样品存在β-折叠结构,210~220 nm波长处的微弱正峰表明该样品无规卷曲结构的存在[20]。
150~500 MPa处理10 min时蛋白α-螺旋含量分别为14.66%、11.83%、10.39%、8.17%、5.40%、6.45%、4.61%、3.49%;随着压力的增大峰值逐渐变小,蛋白α-螺旋含量随着压力增加而减小。300 MPa处理5~30 min时蛋白α-螺旋含量分别为7.78%、8.17%、5.20%、5.36%、5.12%、3.48%;随着保压时间的延长峰值逐渐变小,蛋白α-螺旋含量也逐渐变小。150 MPa处理10 min时α-螺旋含量最大,为14.66%;随着压力的增大,α-螺旋含量逐渐降低。蛋白质的二级结构是由多肽链借助氢键沿着某个轴盘旋或折叠形成的规则性和有周期性结构的构象,主要表现为α-螺旋、β-折叠、β-转角及无规卷曲结构[21]。相关研究表明,α-螺旋结构对压力处理比较敏感[22],与本研究结果一致。主要原因是HHP处理影响蛋白质结构氢键的稳定性,氢键又是影响蛋白二级结构构象稳定性的重要因素,蛋白质的α-螺旋结构主要是靠多肽链上羰基(—C=O)和氨基(—NH2)之间的氢键维持[23-24]。

图7 不同压力处理肌原纤维蛋白10 min激光拉曼光谱
Fig.7 Laser Raman spectra of myof i brillar proteins treated with different pressures for 10 min
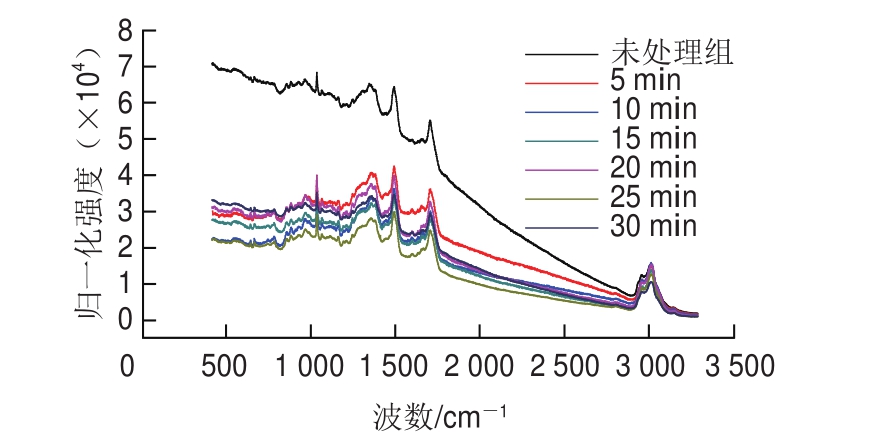
图8 不同保压时间300 MPa处理肌原纤维蛋白激光拉曼光谱
Fig.8 Laser Raman spectra of myof i brillar proteins treated for different durations at 300 MPa
如图7、8所示,酰胺I带集中在约1 650 cm-1处,其是蛋白质二级结构的特殊表征[27]。有研究表明,在1 600~1 700 cm-1处的酰胺I带与蛋白骨架构象类型相关[28]。α-螺旋结构集中在1 650~1 660 cm-1处,β-折叠结构集中在1 665~1 680 cm-1处,无规卷曲集中在1 660~1 665 cm-1处[29]。肌原纤维蛋白激光拉曼光谱的指认见表1。研究表明,随着压力的增加,蛋白α-螺旋结构不断减少,β-折叠或者无规卷曲增加,其二级结构间的转化表明蛋白氢键的重排,CD结果也证明了这一点,与Choi等[30]的研究结果相符。
表1 激光拉曼光谱条带指认[25-26]
Table1 Attribution of Raman bands[25-26]
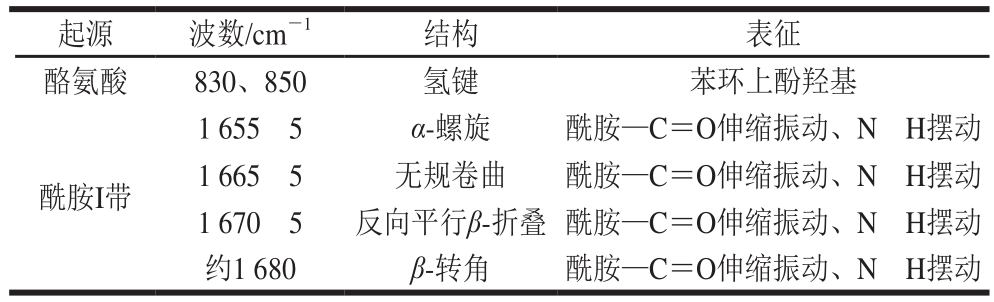
起源 波数/cm-1 结构 表征酪氨酸 830、850 氢键 苯环上酚羟基酰胺I带1 655f5 α-螺旋 酰胺—C=O伸缩振动、NüH摆动1 665f5 无规卷曲 酰胺—C=O伸缩振动、NüH摆动1 670f5 反向平行β-折叠 酰胺—C=O伸缩振动、NüH摆动约1 680 β-转角 酰胺—C=O伸缩振动、NüH摆动

图9 不同压力处理肌原纤维蛋白10 min扫描电子显微镜图
Fig.9 Scanning electron microscopic analysis of myof i brillar proteins treated with different pressures for 10 min
如图9所示,不同压力处理养殖大黄鱼鱼肉肌原纤维蛋白的微观结构存在明显的差别。未处理组蛋白表面没有孔洞,结构平整、致密。经HHP处理后蛋白表面逐渐出现孔洞,300 MPa处理时蛋白表面的孔洞均匀,结构松散、均匀;350 MPa处理时蛋白表面形成较大的孔洞,凝胶组织呈絮状,结构松散、均匀;压力为400 MPa时结构出现坍塌;当压力增大到500 MPa时,蛋白结构呈纤维状。这可能是由于HHP诱导蛋白发生均匀变性,蛋白聚合形成空间立体的凝胶网状结构造成的[31]。蛋白微观结构的变化可能是由于一定的压力条件改变了蛋白分子内和分子间作用力,破坏了蛋白结构[32]。这与傅里叶变换红外光谱、CD、拉曼光谱的分析结果一致,蛋白表面形成的孔洞使水分子与蛋白的接触面积大幅增加,引起大量氨基酸残基的化学环境发生改变,增大了蛋白分子内部疏水性位点的暴露程度,影响了蛋白质结构氢键的稳定性,维持蛋白α-螺旋结构的羰基(—C=O)和氨基(—NH2)之间的氢键被破坏,羰基与水分子形成新的氢键,因此压力对肌原纤维蛋白的结构影响较大[33]。
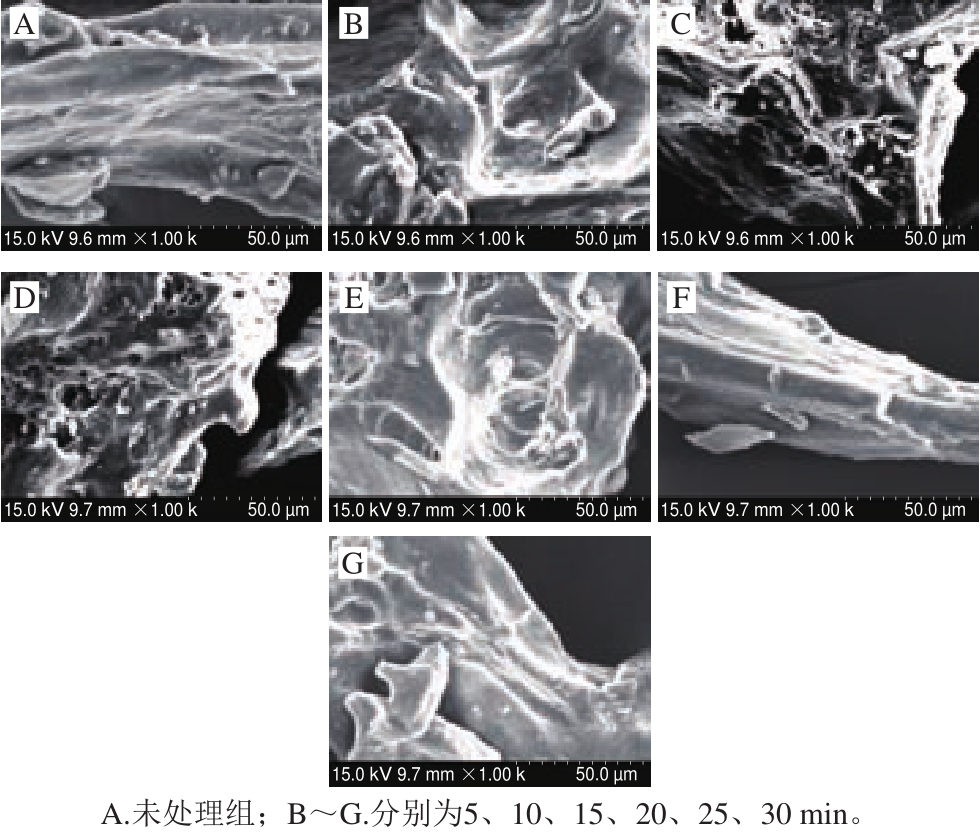
图10 不同保压时间300 MPa处理肌原纤维蛋白扫描电子显微镜图
Fig.10 Scanning electron microscopic images of myof i brillar protein treated for different durations at 300 MPa
如图10所示,蛋白表面的网状结构随着保压时间的改变而改变。随着保压时间的延长,蛋白网状结构更加明显。当保压10 min时,蛋白孔隙均匀,组织呈絮凝状,结构松散、均匀;保压20 min时,蛋白表面孔洞较大,组织呈絮凝状,结构松散、不均匀;之后随着保压时间的延长蛋白表面不再有网状结构,但300 MPa处理30 min蛋白呈较为紧凑的纤维结构。微观结构的改变使蛋白质的表面疏水性变大,溶解性降低,这与表面疏水性的研究结果一致。蛋白微观结构的变化与其保压时间密切相关,压力改变了蛋白分子内和分子间作用力,破坏了蛋白结构,这与付强[34]的研究结果相似。HHP处理促进养殖大黄鱼肌原纤维蛋白的变性,压力越大、保压时间越长其变性程度越大,变性程度直接影响着肌原纤维蛋白的微观结构。
养殖大黄鱼肌原纤维蛋白经HHP处理,蛋白二级结构、三级结构均发生改变。HHP处理使蛋白中色氨酸残基移动并暴露在其外部的极性环境;使水分子进入蛋白分子内部,使大分子内部结构发生一系列变化,其中α-螺旋含量随压力的升高和保压时间的延长而逐渐降低。蛋白质微观结构的变化是导致养殖大黄鱼鱼肉表观特性改变的重要原因,有研究表明,经HHP处理的蛋白质在持水性[35]、溶解性[36]、乳化性[37]、表面疏水性[38]、热稳定性[39]、巯基含量[40]等方面都有显著变化,这可能都与蛋白结构变化有关。
[1] RICHARDSON S J. Report on the ichthyology of the sea of China and Japan[M]. Charleston: Nabu Press, 2014: 20-50.
[2] 肖雄, 林淑琴, 吴雄飞, 等. 三种不同养殖模式下大黄鱼鱼皮、鱼鳞挥发性风味成分分析[J]. 中国水产科学, 2017, 24(2): 341-354.DOI:10.3724/SP.J.1118.2017.16140.
[3] 陈博欧, 杨正勇. 中国养殖大黄鱼国际竞争力分析[J]. 中国渔业经济, 2017, 35(3): 53-59. DOI:10.3969/j.issn.1009-590X.2017.03.008.
[4] 陈世达, 朱艳杰, 张登科, 等. 超高压处理对养殖大黄鱼肉蛋白质特性的影响[J]. 食品安全质量检测学报, 2017, 8(2): 579-586.DOI:10.3969/j.issn.2095-0381.2017.02.036.
[5] 李婷婷. 大黄鱼生物保鲜技术及新鲜度指示蛋白研究[D]. 杭州: 浙江工商大学, 2013: 21-44.
[6] 杨华, 刘斌斌, 娄永江. 养殖大黄鱼脱脂脱腥技术的研究[J]. 食品科技, 2012, 37(6): 154-157. DOI:10.7666/d.d013990.
[7] 周果, 杨文鸽, 崔燕, 等. 超高压处理对三疣梭子蟹感官及其肌原纤维蛋白生化特性的影响[J]. 食品科学, 2017, 38(23): 269-274.DOI:10.7506/spkx1002-6630-201723043.
[8] TRUONG B Q, BUCKOW R, STATHOPOULOS C E, et al. Advances in high-pressure processing of fish muscles[J]. Food Engineering Reviews, 2015, 7(2): 109-129. DOI:10.1007/s12393-014-9084-9.
[9] 刘延奇, 吴史博. 超高压对食品品质的影响[J]. 食品研究与开发,2008(3): 137-141. DOI:10.3969/j.issn.1005-6521.2008.03.045.
[10] ZHOU H, LIU B, YUE W L, et al. Research progress on application of ultra-high pressure technology in the production of pre prepared food[J]. Packaging & Food Machinery, 2017, 2: 47-51.DOI:10.1002/9781119962045.ch12.
[11] JIANG Xinjing, ZHANG Zhijun, CAI Huinong, et al. The effect of soybean trypsin inhibitor on the degradation of myof i brillar proteins by an endogenous serine proteinase of crucian carp[J]. Food Chemistry,2006, 94(4): 498-503. DOI:10.1016/j.foodchem.2004.11.046.
[12] CHIN K B, GO M Y, XIONG Youling L.. Konjac flour improved textural and water retention properties of transglutaminase-mediated,heat-induced porcine myof i brillar protein gel: effect of salt level and transglutaminase incubation[J]. Meat Science, 2009, 81(3): 565-572.DOI:10.1016/j.meatsci.2008.10.012.
[13] XU Yangshun, XIA Wenshui, JIANG Qixing. Aggregation and structural changes of silver carp actomyosin as affected by mild acidif i cation with D-gluconic acid δ-lactone[J]. Food Chemistry, 2012,134(2): 1005-1010. DOI:10.1016/j.foodchem.2012.02.216.
[14] WELLS J A, WERBER M M, LEGG J I, et al. Inactivation of myosin subfragment one by cobalt (II)/cobalt (III) phenanthroline complexes.I.incorporation of Co(III) by in situ oxidation of Co(II)[J]. Biochemistry,1979, 18(22): 4793-4799. DOI:10.1021/bi00589a005.
[15] MASAHIRO O, SOICHIRO N, YASUMI H, et al. Raman spectroscopic study of changes in fi sh Actomyosin during setting[J].Journal of Agricultural and Food Chemistry, 1999, 47(8): 3309-3318.DOI:10.1021/jf9813079.
[16] 张延会, 吴良平, 孙真荣. 拉曼光谱技术应用进展[J]. 化学教学,2006, 4: 32-35. DOI:10.3969/j.issn.1005-6629.2006.04.014.
[17] LEFEVRE F, FAUCONNEAU B, THOMPSON J W, et al. Thermal denaturation and aggregation properties of atlantic salmon myof i brils and myosin from white and red muscles[J]. Journal of Agricultural and Food Chemistry, 2007, 55(12): 4761-4770. DOI:10.1021/jf063045d.
[18] 孔继烈, 吴性良. 分析化学原理[M]. 北京: 化学工业出版社, 2010:10-80.
[19] GREENFIELD N J. Using circular dichroism spectra to estimate protein secondary structure[J]. Nature Protocols, 2005, 1(6): 2876-2890. DOI:10.1038/nprot.2006.202.
[20] SREERAMA N, VENYAMINOV S Y U, WOODY R W. Estimation of the number of alpha-helical and beta-strand segments in proteins using circular dichroism spectroscopy[J]. Protein Science, 1999, 8(2):370-380. DOI:10.1110/ps.8.2.370.
[21] ROBERT T, KUMOSINSKI T F, SERGE N T, et al. The circular dichroism of the β structure of poly-L-lysine[J]. Biochemical and Biophysical Research Communications, 1966, 23(2): 163-169.DOI:10.1016/0006-291x(66)90522-5.
[22] MOZHAEV V V, LANGE R, KUDRYASHOVA E V, et al.Application of high hydrostatic pressure for increasing activity and stability of enzymes[J]. Biotechnology and Bioengineering, 1996, 52(2): 320-331. DOI:10.1002/(sici)1097-0290(19961020)52:2<320::aid-bit12>3.0.co;2-n.
[23] TAKESHI S, OHNO T, OTSUKA-FUCHINO H, et al. Carp natural actomyosin: thermal denaturation mechanism[J]. Journal of Food Science, 1994, 59(5): 1002-1008. DOI:10.1111/j.1365-2621.1994.tb08177.x.
[24] LI L K, SPECTOR A. Circular dichroism of beta-poly-L-lysine[J].Journal of the American Chemical Society, 1969, 91(1): 220-222.DOI:10.1021/ja01029a058.
[25] KATO A, TSUTSUI N, MATSUDOMI N, et al. Effects of partial denaturation on surface properties of ovalbumin and lysozyme[J].Journal of the Agricultural and Biological Chemistry, 1981, 45(12):2755-2760. DOI:10.1080/00021369.1981.10864964.
[26] 伍林, 欧阳兆辉, 曹淑超, 等. 拉曼光谱技术的应用及研究进展[J]. 光散射学报, 2005, 17(2): 180-186. DOI:10.3969/j.issn.1004-5929.2005.02.013.
[27] HERRERO A M. Raman spectroscopy a promising technique for quality assessment of meat and fish: a review[J]. Food Chemistry,2008, 107(4): 1642-1651. DOI:10.1016/j.foodchem.2007.10.014.
[28] CARECHE M, GARCIA M L, HERRERO A, et al. Structural properties of aggregates from frozen stored hake muscle proteins[J].Journal of Food Science, 2002, 67(8): 2827-2832. DOI:10.1111/j.1365-2621.2002.tb08823.x.
[29] HERRERO A M. Raman spectroscopy for monitoring protein structure in muscle food systems[J]. Critical Reviews in Food Science and Nutrition, 2008, 48(6): 512-523. DOI:10.1080/10408390701537385.
[30] CHOI S M, MA C Y. Structural characterization of globulin from common buckwheat (Fagopyrum esculentum Moench) using circular dichroism and Raman spectroscopy[J]. Food Chemistry, 2007, 102(1):150-160. DOI:10.1016/j.foodchem.2006.05.011.
[31] 胡飞华. 梅鱼鱼糜超高压凝胶化工艺及凝胶机理的研究[D]. 杭州:浙江工商大学, 2010: 22-40.
[32] ONWULATA C I, ISOBE S, TOMASULA P M, et al. Properties of whey protein isolates extruded under acidic and alkaline conditions[J].Journal of Dairy Science, 2006, 89(1): 71-81. DOI:10.3168/jds.s0022-0302(06)72070-7.
[33] 杨华, 陆森超, 张慧恩, 等. 超高压处理对养殖大黄鱼风味及品质的影响[J]. 食品科学, 2014, 35(16): 244-249. DOI:10.7506/spkx1002-6630-201416047.
[34] 付强. 超高压处理对鲢鱼鱼糜品质特性的影响[D]. 上海: 上海海洋大学, 2015: 21-80.
[35] 仪淑敏, 马兴胜, 励建荣, 等. 超高压诱导鱼糜凝胶形成中水分特性及凝胶强度的相关性研究[J]. 中国食品学报, 2015, 15(7): 26-31.DOI:10.16429/j.1009-7848.2015.07.004.
[36] 刘坚, 李艳红, 缪铭, 等. 超高压对不同缓冲体系中鹰嘴豆分离蛋白溶解性的影响[J]. 食品工业科技, 2007(11): 90-92. DOI:10.13386/j.issn1002-0306.2007.11.017.
[37] 王喜波, 王健, 张泽宇, 等. 物理改性对大豆蛋白柔性与乳化性的影响及其相关性分析[J]. 农业机械学报, 2017, 48(7): 339-344.DOI:10.6041/j.issn.1000-1298.2017.07.043.
[38] 郑捷, 尚校兰, 刘安军. 超高压处理对海鲈鱼鱼肉凝胶形成作用[J]. 食品科学, 2013, 34(19): 88-92. DOI:10.7506/spkx1002-6630-201319020.
[39] 刘书成, 邓倩琳, 黄万有, 等. 超高压处理对凡纳滨对虾虾仁蛋白质和微观结构的影响[J]. 水产学报, 2017, 41(6): 877-887.DOI:10.11964/jfc.20170110674.
[40] 周敏, 陆维克, 陆金金, 等. 超高压处理对副溶血性弧菌胞内蛋白质的影响[J]. 食品科学, 2017, 38(1): 99-104. DOI:10.7506/spkx1002-6630-201701016.
Effect of High Hydrostatic Pressure Treatment on Myof i brillar Protein Structure of Cultured Large Yellow Croaker
杨华(1978—)(ORCID: 0000-0002-5709-3952),男,教授,博士,研究方向为水产品加工。E-mail: 24825973@qq.com
娄永江(1965—)(ORCID: 0000-0003-4054-8479),男,教授,硕士,研究方向为水产品加工。E-mail: louyongjiang@nbu.edu.cn
ZHANG Dengke, ZHANG Huien, ZHU Yanjie, et al. Effect of high hydrostatic pressure treatment on myofibrillar protein structure of cultured large yellow croaker[J]. Food Science, 2019, 40(9): 61-67. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20180409-113. http://www.spkx.net.cn