蛋清液中约含有88%的水分,干物质中有着丰富的蛋白质,占干基质量的90%以上,其余为极少的脂质、维生素及矿物质等。蛋清液中蛋白质的氨基酸组成模式最接近合成人体组织蛋白质所需的氨基酸模式,吸收利用率高达99.6%,是食品中最理想的蛋白质资源[1-2]。同时,蛋清液的起泡性质广泛应用于冷饮和焙烤等食品中,能有效改善食品的质地[3],是重要的食品原辅料[4]。
为拓展蛋清液在食品工业中的应用范围并提高含蛋清产品的品质,常用一些方法来改善其起泡性,但蛋清液具有热敏性较强[5]、易受外来添加物质的污染且不易去除等特点,制约了其发展。因此,采用适宜的物理方法如超声波[6]、高压脉冲[7]和超高压[8]等改性蛋清液的研究受到了国内外学者的青睐。其中超声波处理以环保及耗能低的优点而被广泛关注[9]。应用超声波技术一般分为频率100 kHz~1 MHz、场强低于1 W/cm2的高频率低场强和频率20~100 kHz、场强10~1 000 W/cm2的低频率高场强两种[10],其中高频率低场强的声学特征多用于食品的无损检测,通常用低频率高场强的超声作用对食品的蛋白质分子进行修饰[11]。当采用超声改性蛋白质时,特别是超声波在液体介质中传播时,能够产生空穴效应、机械剪切和湍流等,从而形成局部瞬时的高压和高温[12],影响氢键和疏水相互作用,改变蛋白质分子构象[13]。王一博[14]的研究发现,在360 W处理10 min时,蛋清液的起泡性显著提高。Jambrak等[15]的研究发现,对质量分数10%乳清蛋白溶液超声处理10~30 min能够显著改善其起泡性。目前,国内外对于超声作用于蛋清液改善其起泡性的研究多停留在工艺与现象上,而对于不同超声作用下起泡性质与结构理化性质变化关系的研究却鲜有报道。
目前,国内外对超声作用改变蛋白质起泡性质已有一定的研究,为进一步揭示超声作用下蛋清液的起泡性质与结构理化性质的变化关系,本研究采用脉冲式超声处理(脉冲式超声处理可以降低超声作用期间产热致使蛋清蛋白直接变性或聚集而带来的不利影响)蛋清液,探讨不同超声时间对蛋清液的起泡性、泡沫微观结构、静态流变学、热力学及结构性质的变化及其关系,以期为超声技术在蛋清液上的应用提供一定的理论依据,从而促进中国蛋品行业的发展。
鸡蛋市售;邻苯二甲醛、十二烷基磺酸钠、DL-二硫苏糖醇、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid,EDTA)、5,5’-二硫双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid),DNTB)、8-苯胺-1-萘磺酸(8-(phenylamino)naphthylamine-1-sulfonic acid,ANS) 美国Sigma公司;氢氧化钠、硼酸、四硼酸钠、无水乙醇磷酸氢二钠和磷酸二氢钠均为国产分析纯。
JJ-1精密增力电动搅拌机 上海浦东物理化学仪器厂;JY92-IIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;Ni-U荧光显微镜 日本Nikon公司;JJ-2B高速组织捣碎机 江苏省金坛市荣华仪器制造有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;inVia显微拉曼光谱仪 英国雷尼绍公司;DSC 204-F型差示扫描量热仪(differential scanning calorimetry,DSC) 德国Netzsch公司;F-4500荧光分光光度计 日本Hitachi公司;Bohlin Gemini 2旋转流变仪、Mastersizer 2000激光粒度仪英国马尔文公司。
1.3.1 超声处理蛋清液样品的制备
取新鲜鸡蛋清洗,打蛋、分蛋取蛋清,于室温下对蛋清进行剪切稀释,用纱布过滤得到新鲜蛋清液。取适量的新鲜蛋清液,将超声设备的钛探头插入到蛋清液样品液面以下2/3处[16],在超声频率20 kHz、输出功率580 W条件下分别处理0、5、10、15、20、25、30 min。
1.3.2 拉曼光谱的测定
参照Chang Cuihua等[17]的方法,将不同超声时间下的蛋清液样品平铺在载玻片上进行拉曼光谱的测定,设定激发波长532 nm,激发功率25 mW,扫描范围400~2 000 cm-1,每次扫描60 s,积分10 次,扫描4 次累加。运用OMNIC软件进行基线校正和谱峰归属,以苯丙氨酸(1 002f1)cm-1的谱峰强度作为归一化因子对数据进行处理。
1.3.3 内源性荧光光谱的测定
取适量不同超声时间的蛋清液样品,用0.02 mol/L pH 7.0磷酸盐缓冲液将样品稀释200 倍体积,用荧光分光光度计在激发波长280 nm、扫描范围300~470 nm、狭缝宽度5 nm下扫描。
1.3.4 静态流变学性质的测定
参照Nesterenko等[18]的方法并略有修改。对不同超声时间下的蛋清液样品进行静态流变学性质的测定。测试前样品在室温(25 ℃)下放置1 h。样品置于流变仪感应板上,使用C60平板进行测定,设定剪切速率范围0.01~100 s-1,板间距为1 000 nm,平板边缘过量的样品用塑料刮铲除去。运用Power Law模型(方程)对剪切速率和剪切应力进行回归拟合。以剪切速率为横坐标,表观黏度(η)为纵坐标,绘制剪切速率与表观黏度的关系图。运用Ostwald-de Waele幂次定律模型(公式(1))[19]对关系图进行回归拟合。
式中:K为黏稠系数;γ为剪切速率/s-1;n为流体指数。
1.3.5 粒径的测定
参照Tang等[20]的方法稍作修改,将样品稀释至蛋白质量浓度1 mg/mL以下,放入台式离心机中以5 000 r/min离心15 min,用激光粒度仪测定。设置蛋白折射率1.46,吸收参数1.33。
1.3.6 巯基含量的测定
使用Ellman’s法[21]测定不同超声时间处理蛋清液的巯基含量。
表面巯基含量的测定:取适量样品用pH 8.0 Tris-Gly缓冲液(含4 mmol/L EDTA)稀释至100 mL,取5 mL稀释液,加入0.1 mL Ellman’s试剂。室温避光振荡1 h,充分反应后于6 000 r/min离心10 min,取上清液用紫外-可见分光光度计在412 nm处测定吸光度。以Ellman’s试剂为空白对照。
总巯基含量的测定:取适量样品用pH 8.0 Tris-Gly缓冲液(含4 mmol/L EDTA、8 mol/L尿素)稀释至100 mL,余下步骤与表面巯基含量的测定方法一致。
巯基含量按公式(2)计算。
式中:A412 nm为样品在412 nm波长处的吸光度;D为样品的稀释倍数;ρ为干物质质量浓度/(mg/mL)。
1.3.7 表面疏水性的测定
参照Voutsinas等[22]的ANS探针法并稍作修改。将蛋清液样品稀释至蛋白质量浓度0.062 5~0.800 0 mg/mL之间,并制成5 个不同质量浓度梯度,各取4 mL分别加入20 μL ANS溶液(含8 mmol/L ANS、20 mmol/L pH 7.0磷酸盐缓冲液),混合,用荧光分光光度计在激发波长370 nm、发射波长470 nm、狭缝宽度5 nm条件下测其荧光强度。以蛋白质量浓度为横坐标,荧光强度为纵坐标,作图得出斜率即为样品表面疏水性。
1.3.8 DSC的测定
参照Yin Shouwei等[23]的方法稍作修改。准确称取10 μL待测样品置于铝盒中,密封,以空铝盒为对照进行基线校正。在温度区间20~120 ℃、扫描速率10 ℃/min下测定。由DSC图得出变性温度(Td)和热变性焓(ΔH)。
1.3.9 起泡性和泡沫稳定性的测定
采用机械搅打法[24],略有修改。取适量的蛋清液用pH 9.0硼酸-氢氧化钠缓冲液稀释10 倍体积,记录此时的体积(V0);用高速组织捣碎机在室温下以12 000 r/min搅拌1 min,移至量筒中,立刻记录下泡沫的体积(V1);室温下静置25 min后,记录下泡沫的体积(V2)。
起泡性与泡沫稳定性计算公式如式(3)、(4)所示。

1.3.10 泡沫微观结构观察
取未超声处理与分别超声处理15 min和30 min的蛋清液样品用高速组织捣碎机搅打起泡,取适量泡沫平铺在载玻片上形成薄层,将载玻片置于荧光正置显微镜下,观察其微观结构。
每个实验重复3~5 次,结果用fs表示,利用SPSS Statistics 22.0软件对结果进行差异显著性分析(单因素方差分析法),P<0.05为显著性差异;采用Origin Pro 8.6软件对数据进行分析和图谱处理。
2.1.1 蛋清蛋白主链构象分析
拉曼光谱下的蛋白质主链构象复杂多变,主要是由肽键(—COüNH—)和CüC、CüN骨架引起的,肽键引起不同类型的振动谱带,例如酰胺A、B带和酰胺I、II、III、IV、V、VI、VII带[25],其特征拉曼光谱范围和指认见表1。
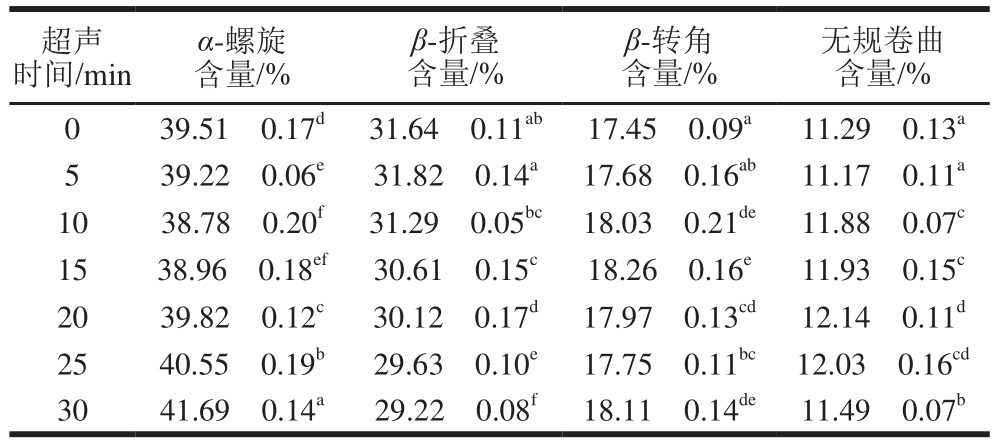
通常情况下,通过对酰胺I带进行定量分析,解析蛋白质二级结构[26]。由表2可知,随着超声时间的延长,蛋清蛋白质的α-螺旋结构含量先降低后增加,β-折叠结构含量持续减少,而无规卷曲和β-转角结构含量的变化相对不规律。这可能是由于前期的超声处理条件使蛋白质结构展开,蛋清蛋白趋于无序的状态,同时β-折叠含量的降低有利于蛋清液表面疏水性的增加[27]。后期的超声作用使α-螺旋含量增加,β-折叠含量继续减少,这可能是长时间的超声作用使分散的蛋白质分子再次发生聚集[28],或者高强度的超声作用改变了蛋白质氢键的取向,使蛋清蛋白质结构中β-折叠结构向α-螺旋结构转变。Chandrapala等[29]报道了在较强的超声强度下,蛋白质结构中发生β-折叠结构向α-螺旋结构转变的现象,与本研究结果一致。蛋白质的二级结构中,α-螺旋和β-折叠结构含有较多的氢键,无规卷曲和β-转角结构中不含有氢键;氢键能够影响蛋白质分子的刚性和柔性,α-螺旋和β-折叠含量因超声作用而降低,说明超声能够增加蛋白质分子的柔性结构。
表1 酰胺谱带的特征拉曼光谱频率的初步指认
Table1 Characteristic Raman frequency of amide bands and tentative attribution

注:STR.伸缩振动;DEF.变性振动;TOR.扭摆。
谱带 波数/cm-1 指认酰胺A带 3 300 NüH酰胺B带 3 100 NüH(STR)酰胺I带 1 597~1 680 C=O(STR)、NüH(DEF)、CüN(STR)酰胺II带 1 480~1 575 CüN(STR)、NüH(DEF)酰胺III带 1 229~1 305 CüN(STR)、NüH(DEF)酰胺IV带 625~767 O=CüN(DEF)酰胺V带 640~800 NüH(DEF)酰胺VI带 537~606 C=O(DEF)酰胺VII带 200 CüN(TOR)
表2 不同超声时间下蛋清蛋白质的二级结构含量
Table2 Secondary structure contents in EWP at different ultrasonic treatment times
注:同列肩标小写字母不同表示差异显著(P<0.05)。下同。
超声时间/min α-螺旋含量/%β-折叠含量/%β-转角含量/%无规卷曲含量/%0 39.51f0.17d 31.64f0.11ab 17.45f0.09a 11.29f0.13a 5 39.22f0.06e 31.82f0.14a 17.68f0.16ab 11.17f0.11a 10 38.78f0.20f 31.29f0.05bc 18.03f0.21de 11.88f0.07c 15 38.96f0.18ef 30.61f0.15c 18.26f0.16e 11.93f0.15c 20 39.82f0.12c 30.12f0.17d 17.97f0.13cd 12.14f0.11d 25 40.55f0.19b 29.63f0.10e 17.75f0.11bc 12.03f0.16cd 30 41.69f0.14a 29.22f0.08f 18.11f0.14de 11.49f0.07b
2.1.2 蛋清蛋白侧链构象分析
2.1.2.1 二硫键含量分析
蛋白质和多肽的二硫键通常有3 种构象,在(510f5)cm-1附近的谱线属于扭曲-扭曲-扭曲构象(g-g-g),在(525f5)cm-1附近的谱线属于扭曲-扭曲-反式构象(g-g-t),在(540f5)cm-1附近的谱线属于反式-扭曲-反式构象(t-g-t)[30]。由图1和表3可知,超声时间在5 min时,在500~550 cm-1处谱线主要在520 cm-1以内,与未超声处理的蛋清蛋白的二硫键构象相同,均为g-g-g构象。而随着超声时间的延长,二硫键逐渐向g-g-t构象转变。因此,5~30 min超声处理能够改变蛋清蛋白质的二硫键构象。
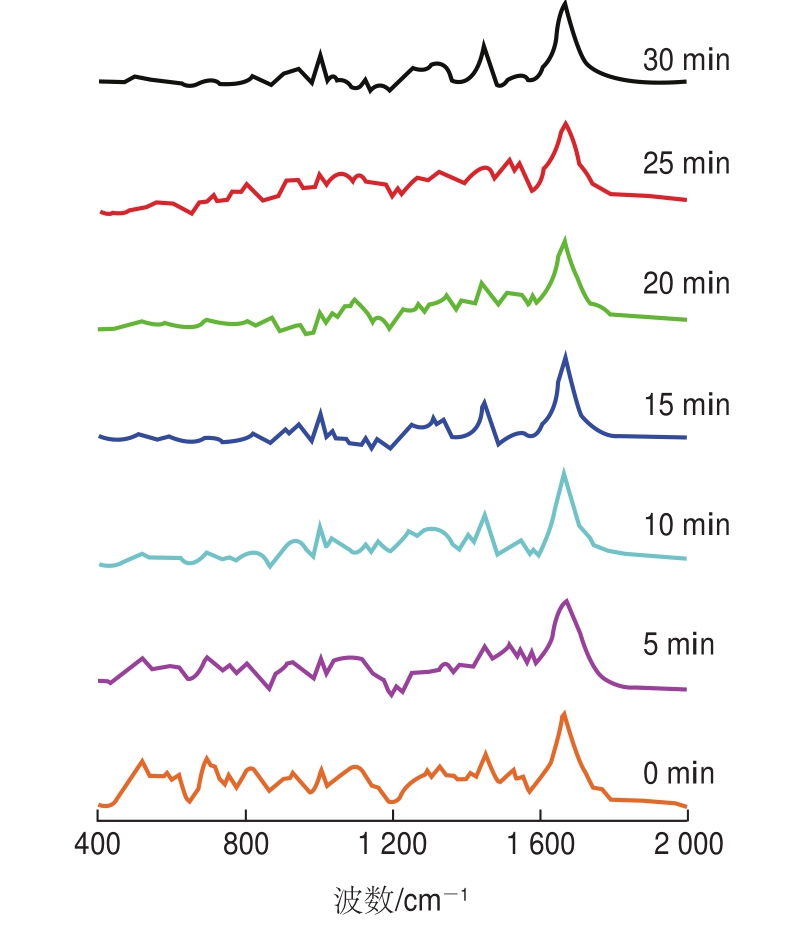
图1 不同超声时间下蛋清蛋白质的拉曼光谱
Fig.1 Roman spectra of EWP at different ultrasonic treatment times
表3 不同超声时间下蛋清蛋白质的特征峰归属
Table3 Attribution of characteristic bands in Raman spectra of EWP at different ultrasonic treatment times
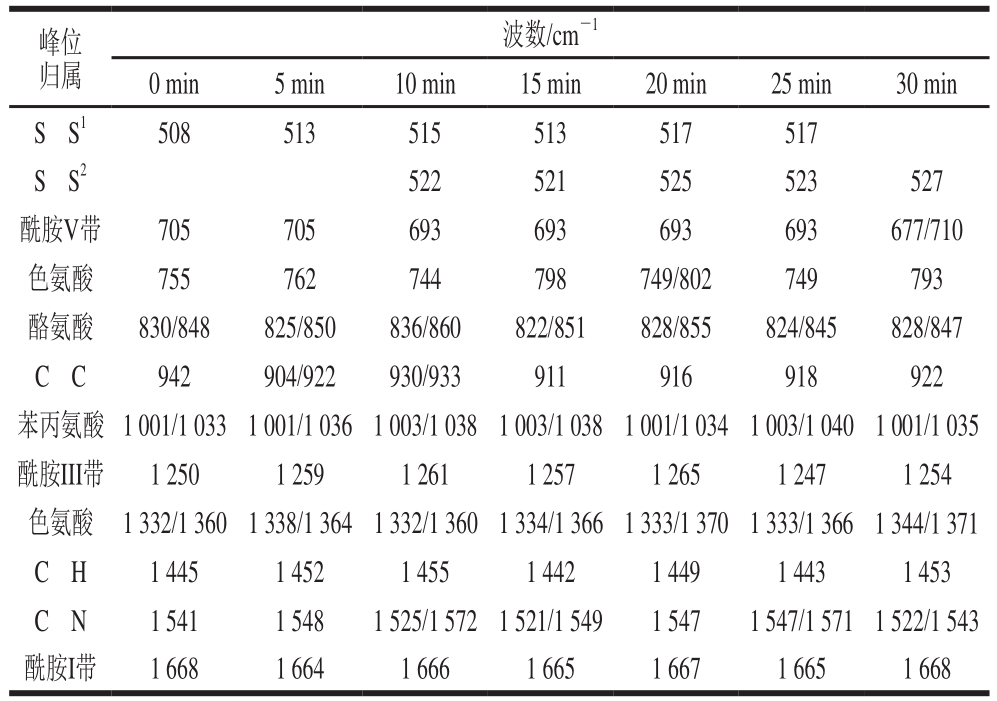
注:上标1、2.二硫键构象不同。
峰位归属波数/cm-1 0 min 5 min 10 min 15 min 20 min 25 min 30 min SüS1 508 513 515 513 517 517 SüS2 522 521 525 523 527酰胺V带 705 705 693 693 693 693 677/710色氨酸 755 762 744 798 749/802 749 793酪氨酸 830/848 825/850 836/860 822/851 828/855 824/845 828/847 CüC 942 904/922 930/933 911 916 918 922苯丙氨酸 1 001/1 033 1 001/1 036 1 003/1 038 1 003/1 038 1 001/1 034 1 003/1 040 1 001/1 035酰胺III带 1 250 1 259 1 261 1 257 1 265 1 247 1 254色氨酸 1 332/1 360 1 338/1 364 1 332/1 360 1 334/1 366 1 333/1 370 1 333/1 366 1 344/1 371 CüH 1 445 1 452 1 455 1 442 1 449 1 443 1 453 CüN 1 541 1 548 1 525/1 572 1 521/1 549 1 547 1 547/1 571 1 522/1 543酰胺I带 1 668 1 664 1 666 1 665 1 667 1 665 1 668
2.1.2.2 酪氨酸残基与色氨酸残基分析

图2 不同超声时间下I850/I830和I1 363/I1 338
Fig.2 I1 363/I1 338 and I850/I830 ratio of EWP at different ultrasonic treatment times
酪氨酸与色氨酸对于微环境和聚集状态的变化非常敏感,通常用酪氨酸对羟苯基环的呼吸振动(830 cm-1)和环平面外弯曲振动(850 cm-1)的费米共振谱线强度比(I850/I830)以及色氨酸费米共振谱线(1 338 cm-1和1 363 cm-1)强度比(I1 363/I1 338)分别表征酪氨酸残基和色氨酸残基的变化[31]。
由图2可知,随着超声时间的延长,I850/I830变化规律不明显,均处于0.90~1.20范围之内,表明酪氨酸残基暴露在极性环境中或者作为弱氢键的供体和受体。经过超声处理后,I850/I830均高于未超声处理的样品,说明超声作用可能使酪氨酸残基暴露,或作为弱氢键的受体增加。I1 363/I1 338随超声时间的延长呈先升高后降低的趋势,表明在超声15 min之内色氨酸残基趋向于“暴露的”展开形式,导致周围环境疏水性增加[32];而20 min后色氨酸残基趋向于“埋藏的”微环境,因而疏水性降低。Stefanovic等[33]在研究超声作用对蛋清粉功能性质的影响时也发现高强度的超声作用使蛋清蛋白疏水性降低。这说明适当时间的超声可以使色氨酸残基趋于“暴露的”展开形式,从而增加蛋清液的疏水性,有利于提高其起泡性。
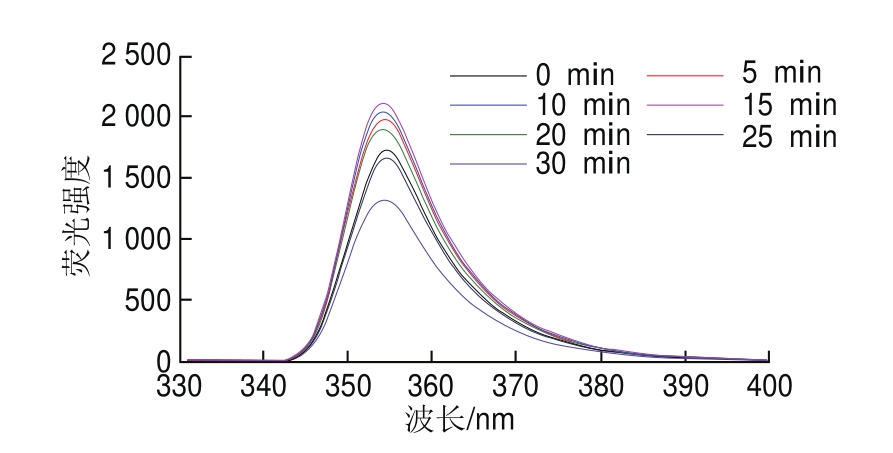
图3 不同超声时间下蛋清液内源性荧光光谱
Fig.3 Effect of ultrasonic treatment time on fl uorescence spectrum of EWP
当激发波长为280 nm或295 nm时,蛋清蛋白中所含芳香族氨基酸,如苯丙氨酸、酪氨酸和色氨酸残基产生荧光,即内源性荧光[34]。由图3可知,超声处理蛋清液的内源性荧光光谱的峰位并没有发生明显的红移或者蓝移现象,均在355 nm左右,而荧光强度因超声作用时间不同而改变。通常情况下,可以通过荧光强度的改变判断蛋清蛋白分子的伸展程度或芳香族氨基酸能量的传递[35]。由图3可知,荧光强度随超声时间的延长而增强,并在超声处理15 min时达到最高;随着超声时间继续延长,蛋清液的荧光开始猝灭,并在25 min和30 min的超声处理中较未超声处理组荧光强度更弱。这是由于超声产生的空穴效应作用于蛋清液,使蛋白结构松散,蛋清蛋白分子伸展,暴露出芳香族氨基酸特别是色氨酸残基[36],使荧光强度增大;超声时间的继续延长导致分散的蛋白质分子再次聚集,从而将色氨酸残基埋藏于蛋白质分子内部而使荧光猝灭,降低荧光强度,这与拉曼光谱的分析结果一致。
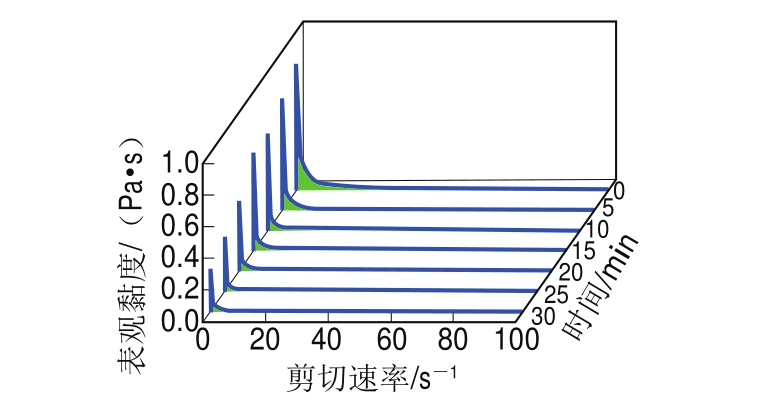
图4 超声时间对蛋清液表观黏度的影响
Fig.4 Effect of ultrasonic treatment time on apparent viscosity of LEW
表4 不同超声时间的蛋清液流变学拟合参数
Table4 Rheological parameters of LEW at different ultrasonic treatment times

超声时间/min K/(Pagsn) n R2 0 0.206 0.202 0.981 5 0.132 0.041 0.983 10 0.114 0.172 0.988 15 0.109 0.280 0.980 20 0.084 0.268 0.983 25 0.060 0.282 0.980 30 0.050 0.039 0.983
从表4可知,R2>0.98,表示图4能较好地反映表观黏度和剪切应力的变化关系。所有样品的n<1,表示超声处理并没有改变蛋清液的流体性质,均表现出了剪切稀释的现象,且呈现出假塑性流体的性质。因此,可对图4中的曲线进行Ostwald-de Waele幂次定律模型的回归拟合,其中K值越大表示蛋清液表观黏度越大[19]。从表4
中可以看出,经超声处理的蛋清液的黏度降低,且随着超声时间的延长,蛋清液黏度呈逐渐下降趋势,在超声处理30 min时,蛋清液的K值与未超声处理组相比降低了
75.7%。这是由于超声所引起的空穴效应与机械振荡使蛋清液的体系分散,降低了蛋白质分子间的凝集,超声时间越长效果越明显;从拉曼光谱的分析中也可以看出超声导致了蛋白质二硫键构象改变,从而减少了流动阻力。n变化不规律,这可能是由于蛋清液中包含多种蛋白质,各种蛋白质在超声作用下有不同的变化,这影响了蛋清液整体n的变化。
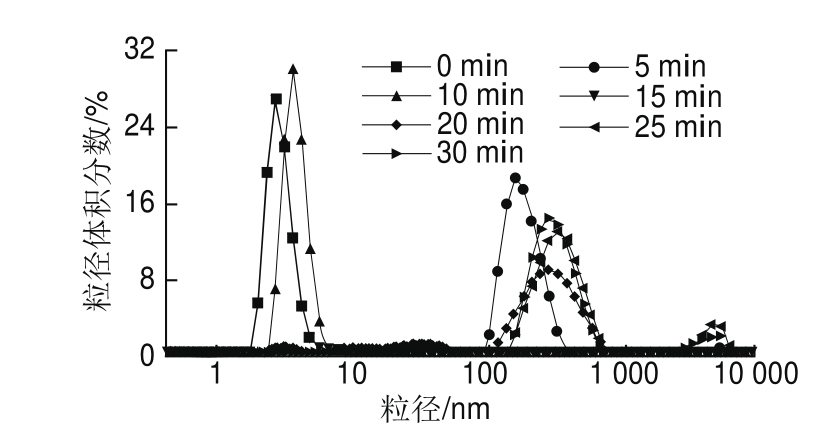
图5 超声时间对蛋清液粒径分布的影响
Fig.5 Effect of ultrasonic treatment time on particle size distribution of LEW
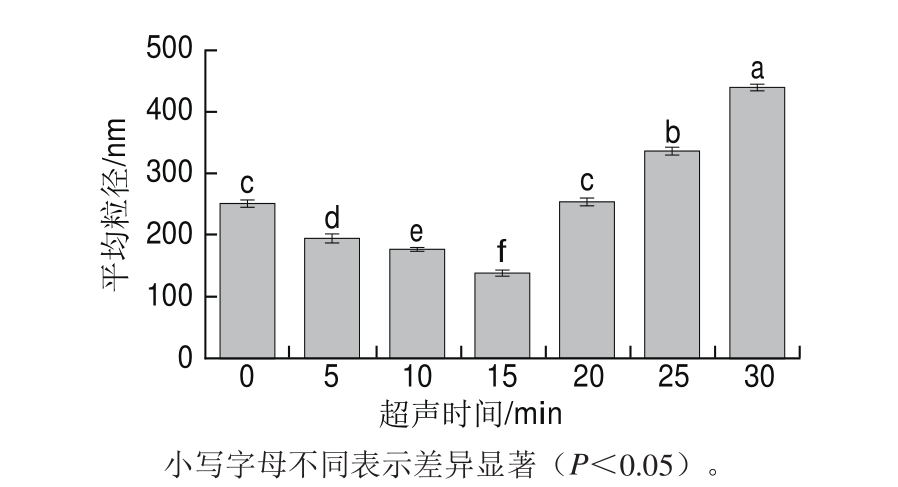
图6 超声时间对蛋清液平均粒径的影响
Fig.6 Effect of ultrasonic treatment time on average particle size of LEW
粒径能够反映蛋白质分子间的分散和聚集等变化。由图5、6可知,在超声15 min内,蛋清液的粒径逐渐向小粒径方向移动且分布变窄,平均粒径显著下降(P<0.05)。这可能是由于超声产生的机械剪切和空穴效应减弱了蛋清蛋白分子间的非共价相互作用,阻碍了蛋白的聚集,从而使其粒径减小。而随着超声时间的延长,20、25 min和30 min超声处理的蛋清液粒径向大粒径方向移动,且分布变宽,平均粒径显著增大,这是由于高强度超声作用使分散的蛋白质分子重新聚集,增大了蛋清液粒径。Gülseren等[37]在超声处理牛血清白蛋白的研究中发现过长时间的超声作用增大了牛血清白蛋白的平均粒径。
表5 超声时间对蛋清液各理化指标的影响
Table5 Effect of ultrasonic treatment time on physicochemical properties of LEW
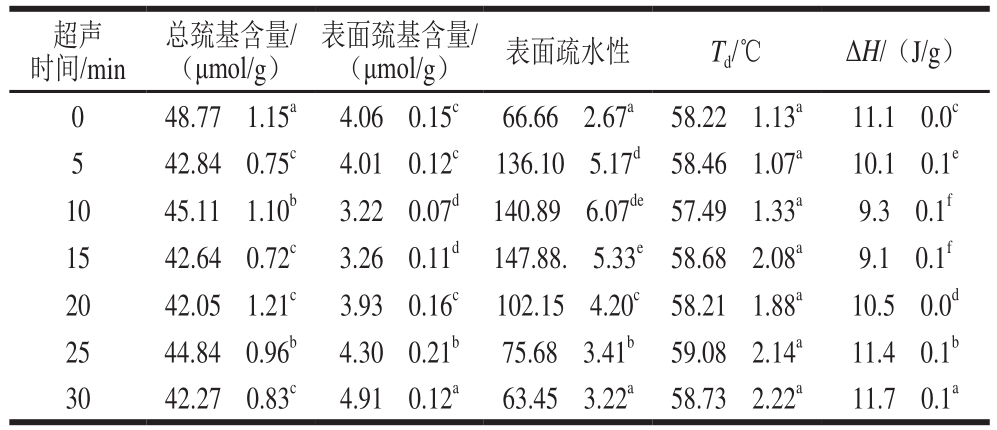
超声时间/min总巯基含量/(μmol/g)表面巯基含量/(μmol/g) 表面疏水性 Td/℃ ΔH/(J/g)0 48.77f1.15a 4.06f0.15c 66.66f2.67a 58.22f1.13a 11.1f0.0c 5 42.84f0.75c 4.01f0.12c 136.10f5.17d 58.46f1.07a 10.1f0.1e 10 45.11f1.10b 3.22f0.07d 140.89f6.07de 57.49f1.33a 9.3f0.1f 15 42.64f0.72c 3.26f0.11d 147.88.f5.33e 58.68f2.08a 9.1f0.1f 20 42.05f1.21c 3.93f0.16c 102.15f4.20c 58.21f1.88a 10.5f0.0d 25 44.84f0.96b 4.30f0.21b 75.68f3.41b 59.08f2.14a 11.4f0.1b 30 42.27f0.83c 4.91f0.12a 63.45f3.22a 58.73f2.22a 11.7f0.1a
由表5可知,随着超声时间的延长,蛋清液的表面疏水性呈先升高后降低的趋势,当蛋白质内部的疏水基团暴露时,蛋清液的疏水性就会提高,从蛋清液粒径的分析中可以看出超声能够改变蛋白质分子的聚集和分散,从而改变疏水基团的暴露状况,进而改变蛋清液的疏水性。这与Chandrapala等[38]研究超声作用于乳清浓缩蛋白时的结论一致。同时,蛋清液的表面疏水性与拉曼光谱分析中I1 363/I1 338的结果一致,表明超声作用下I1 363/I1 338可以反映蛋清液疏水性的变化。表面巯基含量先降低后在超声20 min时有增加的趋势,这可能是由于超声导致巯基暴露被氧化而含量降低,而长时间的超声作用改变了蛋清蛋白的二硫键构象,有可能发生了二硫键断裂,转变成表面巯基[37],从而使表面巯基含量增加。Arzeni等[39]在研究超声处理蛋白粉时发现,超声对蛋清蛋白的表面巯基含量没有显著影响,与本实验结果有所不同。这可能是由于蛋清蛋白所处的溶液体系不同,本研究中超声直接作用于蛋清液体系,而Arzeni等将超声作用于蛋白粉溶液。总巯基含量的变化无明显趋势,但超声作用使总巯基含量降低,这可能是发生了除二硫键与表面巯基转化外其他的转变,Hu Hao等[11]也发现超声使大豆蛋白的总巯基含量降低。随超声时间的延长,Td没有显著变化(P>0.05),这说明超声作用没有引起蛋清液变性温度的改变。这与Arzeni等[40]的研究结果一致。ΔH能够反映蛋白质有序结构所占的比例,15 min内的超声处理降低了ΔH,这是由于超声处理降低了α-螺旋含量,破坏了蛋清蛋白的有序结构;而随着超声时间的延长,ΔH增加,这是由于超声强度的增加使蛋白质发生聚集,增加了α-螺旋含量。这在拉曼光谱的分析结果中有所体现。
蛋白质的起泡性和泡沫稳定性是由两类不同的分子性质决定:起泡性是由蛋白质分子的扩散、界面张力和疏水基团的分布等性质决定;而泡沫稳定性主要由蛋白质膜的流变学性质决定,如吸附膜中的蛋白质水合程度、膜的厚度等。
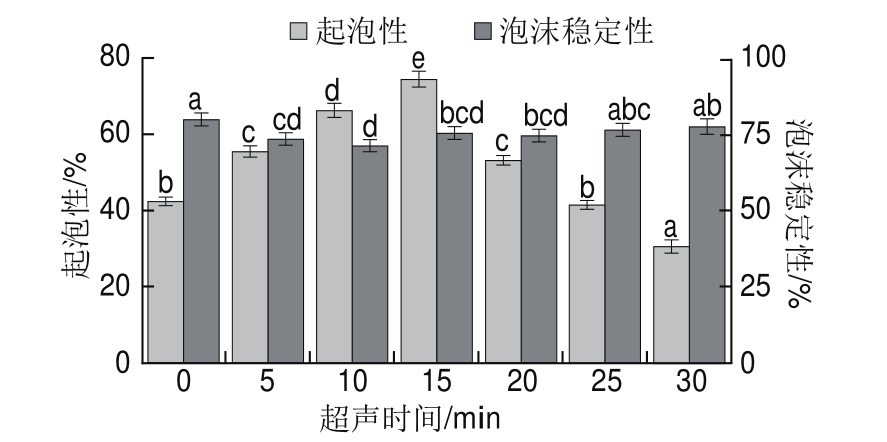
图7 超声时间对蛋清液起泡性和泡沫稳定性的影响
Fig.7 Effect of ultrasonic treatment time on foaming properties and foam stability of LEW
由图7可知,起泡性随超声时间的延长呈先增大后减小的变化趋势(P<0.05),且在15 min时达到最大,30 min时小于未超声处理的蛋清液,达到最低。

图8 未超声处理(a)、超声15 min(b)、超声30 min(c)蛋清液泡沫在荧光正置显微镜下微观图像(×100)
Fig.8 Microscopic images of LEW foams without ultrasonic treatment (a)and with ultrasonic treatment for 15 min (b) and 30 min (c) (× 100)
从图8中发现,未进行超声处理的样品泡沫较为疏散,体积大小不一。当超声15 min时,泡沫分布致密有序,体积趋向均一化,泡沫较多。而超声30 min时的泡沫体积较大,并且出现大面积空隙。这说明适当的超声作用能够提高蛋清液起泡性的原因是其使蛋清蛋白质变得更加分散,折叠蛋白打开的更多,疏水基团暴露,界面张力降低。而超声30 min时起泡性比未超声样品低的原因可能是长时间超声作用下的空穴效应过强,产生的机械效应和高压破环了蛋清液的发泡体系,使分散的蛋白质再次聚集,将疏水基团藏于蛋白质内部,同时减弱了蛋白质多肽链之间的相互作用,降低了起泡性。这与拉曼光谱中I1 363/I1 338的变化一致,说明色氨酸的暴露情况影响超声处理蛋清液起泡性的变化。
泡沫稳定性随着超声时间的延长变化幅度不大,超声处理0~10 min的蛋清液泡沫稳定性显著下降(P<0.05),15 min后泡沫稳定性呈上升趋势,但总体上超声处理降低了蛋清液泡沫稳定性。这是由于黏度的变化影响着泡沫重力排液的松弛时间、气体扩散松弛时间和泡沫的半衰期。蛋清液黏度的降低致使蛋清蛋白质分子间不能形成稳定的网状结构,导致泡沫稳定性降低。随着超声处理时间的延长,黏度持续降低,泡沫稳定性却增加,这是因为超声处理将分散的蛋白质聚集成较小的蛋白质聚集体,产生的天然粒子效应有助于泡沫稳定性的改善[41]。起泡性的降低和后期表面巯基含量的增加也是泡沫稳定性升高的原因之一。
通过色阶相关性分析表可以直观地反映超声处理蛋清液体系中起泡性、各理化结构性质的相关关系,同时可以验证上述的理论分析。
表6 色阶相关性分析表
Table6 Color rank correlation analysis

注:红色.正相关;绿色.负相关;颜色越深代表相关性越大。






 指标 起泡性 泡沫稳定性 K 表面疏水性总巯基含量表面巯基含量 Td △H 平均粒径起泡性 1.000 -0.662 0.203 0.938 -0.174 -0.955 -0.421 -0.986 -0.926泡沫稳定性 -0.662 1.000 0.219 -0.810 0.435 0.594 0.523 0.708 0.533 K 0.203 0.219 1.000 0.098 0.731 -0.351 -0.430-0.227 -0.525表面疏水性 0.938 -0.810 0.098 1.000 -0.347 -0.833 -0.400 -0.959 -0.856总巯基含量 -0.174 0.435 0.731 -0.347 1.000 -0.088 -0.267 0.178 -0.087表面巯基含量 -0.955 0.594 -0.351 -0.833 -0.088 1.000 0.566 0.939 0.932 Td -0.421 0.523 -0.43 -0.400 -0.267 0.566 1.000 0.511 0.483△H -0.986 0.708 -0.227 -0.959 0.178 0.939 0.511 1.000 0.913平均粒径 -0.926 0.533 -0.525 -0.856 -0.087 0.932 0.483 0.913 1.000 α-螺旋含量 -0.228 0.867 0.982 β-折叠含量 -0.268 0.862 -0.526 -0.746 β-转角含量 -0.385 -0.428 -0.059无规卷曲含量 0.326 -0.293 -0.547 0.158 -0.303 -0.342 0.012 -0.226 -0.081 I850/I830 -0.386 -0.655 0.217 -0.473 0.037 0.030 -0.147 0.239 I1 363/I1 338 0.994 -0.688 0.185 0.95 -0.206 -0.942 -0.464 -0.996 -0.904
指标 起泡性 泡沫稳定性 K 表面疏水性总巯基含量表面巯基含量 Td △H 平均粒径起泡性 1.000 -0.662 0.203 0.938 -0.174 -0.955 -0.421 -0.986 -0.926泡沫稳定性 -0.662 1.000 0.219 -0.810 0.435 0.594 0.523 0.708 0.533 K 0.203 0.219 1.000 0.098 0.731 -0.351 -0.430-0.227 -0.525表面疏水性 0.938 -0.810 0.098 1.000 -0.347 -0.833 -0.400 -0.959 -0.856总巯基含量 -0.174 0.435 0.731 -0.347 1.000 -0.088 -0.267 0.178 -0.087表面巯基含量 -0.955 0.594 -0.351 -0.833 -0.088 1.000 0.566 0.939 0.932 Td -0.421 0.523 -0.43 -0.400 -0.267 0.566 1.000 0.511 0.483△H -0.986 0.708 -0.227 -0.959 0.178 0.939 0.511 1.000 0.913平均粒径 -0.926 0.533 -0.525 -0.856 -0.087 0.932 0.483 0.913 1.000 α-螺旋含量 -0.228 0.867 0.982 β-折叠含量 -0.268 0.862 -0.526 -0.746 β-转角含量 -0.385 -0.428 -0.059无规卷曲含量 0.326 -0.293 -0.547 0.158 -0.303 -0.342 0.012 -0.226 -0.081 I850/I830 -0.386 -0.655 0.217 -0.473 0.037 0.030 -0.147 0.239 I1 363/I1 338 0.994 -0.688 0.185 0.95 -0.206 -0.942 -0.464 -0.996 -0.904
由表6的色阶相关性分析可知,起泡性与表面疏水性、I1 363/I1 338的红色块较深,说明与其正相关性较大;与α-螺旋含量、ΔH、平均粒径和表面巯基含量的绿色块较深,说明与其负相关性较大。同理,泡沫稳定性与表面疏水性负相关性较大;K值与β-折叠含量正相关性较大;表面疏水性与I1 363/I1 338正相关性较大,与表面巯基含量、ΔH、平均粒径和α-螺旋含量负相关较大;表面巯基含量与ΔH、平均粒径、α-螺旋含量正相关性较大,与I1 363/I1 338负相关性较大;ΔH与平均粒径和α-螺旋含量正相关性较大,与I1 363/I1 338负相关性较大;平均粒径与α-螺旋正相关性较大,与I1 363/I1 338负相关性较大。
采用脉冲式超声设备处理蛋清液,在降低超声期间产热所带来不利影响的同时能显著提高蛋清液的起泡性,当超声处理15 min时起泡性较佳,为74.4%,泡沫稳定性为75.5%,泡沫微观图像分布均匀、紧密。此时蛋清液表面疏水性增大,表面巯基含量减小,ΔH和
α-螺旋结构、β-折叠结构含量减少,I1 363/I1 338增大,内源性荧光强度增大。因此,超声是通过改变以上结构性质来影响起泡性的。泡沫稳定性先小幅降低后上升,且不随黏度的持续降低而降低,这与Żmudziński等[42]对黏度对蛋清蛋白泡沫稳定性影响的研究结果不一致,属于超声处理蛋清液特有的性质。粒径分析结果显示,蛋白质分子在蛋清液中先分散后聚集,这影响着蛋清液的泡沫稳定性。相关性分析验证了上述起泡性与各理化结构性质的关系。由静态流变学分析可知,超声时间的变化并没有改变蛋清液的流体性质,其依旧表现出假塑性流体的性质。但超声时间的延长改变了蛋清蛋白质的二硫键构象,导致蛋清蛋白质的结构松散不稳定,致使蛋清液黏度降低。I850/I830在0.90~1.20之间变化不规律,说明
30 min的超声处理对酪氨酸残基的影响较小。本研究对超声处理蛋清液的起泡性和结构理化性质的分析为脉冲式超声设备在蛋清液和其他天然混合蛋白质方面的运用和研究提供了一定的参考依据。
[1] CHEN Chen, CHI Yujie. Antioxidant, ACE inhibitory activities and functional properties of egg white protein hydrolysate[J]. Journal of Food Biochemistry, 2012, 36(4): 383-394. DOI:10.1111/j.1745-4514.2011.00555.x.
[2] LUNOW D, KAISER S, BRÜCKNER S, et al. Selective release of ACE-inhibiting tryptophan-containing dipeptides from food proteins by enzymatic hydrolysis[J]. European Food Research and Technology,2013, 237(1): 27-37. DOI:10.1007/s00217-013-2014-x.
[3] 迟玉杰. 蛋制品加工技术[M]. 北京: 中国轻工业出版社, 2018: 100-102.
[4] 王欢, 迟玉杰, 王晓莹, 等. 蛋清粉起泡性对戚风蛋糕品质的影响[J].中国家禽, 2014, 36(20): 34-38.
[5] KATO A, OSAKO Y, MATSUDOMI N, et al. Changes in the emulsifying and foaming properties of proteins during heat denaturation[J]. Journal of the Agricultural Chemical Society of Japan,2014, 47(1): 33-37. DOI:10.1080/00021369.1983.10865579.
[6] 邓涵, 祖琴琴, 朱杰瑞, 等. 超声处理对大豆7S蛋白潜在致敏性的影响[J]. 食品科学, 2017, 38(5): 32-37. DOI:10.7506/spkx1002-6630-201705006.
[7] MONFORT S, MAÑAS P, CONDÓN S, et al. Physicochemical and functional properties of liquid whole egg treated by the application of pulsed electric fields followed by heat in the presence of triethyl citrate[J]. Food Research International, 2012, 48(2): 484-490.DOI:10.1016/j.foodres.2012.04.015.
[8] KNEŽEVIĆ-JUGOVIĆ Z D, STEFANOVIĆ A B, ŽUŽA M G, et al.Effects of sonication and high-pressure carbon dioxide processing on enzymatic hydrolysis of egg white proteins[J]. Acta Periodica Technologica, 2012(43): 33-41. DOI:10.2298/apt1243033.
[9] KENTISH S, ASHOKKUMAR M. The physical and chemical effects of ultrasound[M]// FENG H, BARBOSA-CÁNOVAS G V, WEISS J.Ultrasound technologies for food and bioprocessing. New York:Springer, 2011: 1-12.
[10] SORIA A C, VILLAMIEL M. Effect of ultrasound on the technological properties and bioactivity of food: a review[J]. Trends in Food Science & Technology, 2010, 21(7): 323-331. DOI:10.1016/j.tifs.2010.04.003.
[11] HU Hao, LI-CHAN E C Y, WAN Li, et al. The effect of high intensity ultrasonic pre-treatment on the properties of soybean protein isolate gel induced by calcium sulfate[J]. Food Hydrocolloids, 2013, 32(2):303-311. DOI:10.1016/j.foodhyd.2013.01.016.
[12] O’DONNELL C P, TIWARI B K, BOURKE P, et al. Effect of ultrasonic processing on food enzymes of industrial importance[J].Trends in Food Science & Technology, 2010, 21(7): 358-367.DOI:10.1016/j.tifs.2010.04.007.
[13] O’SULLIVAN J, MURRAY B, FLYNN C, et al. The effect of ultrasound treatment on the structural, physical and emulsifying properties of animal and vegetable proteins[J]. Food Hydrocolloids,2016, 53: 141-154. DOI:10.1016/j.foodhyd.2015.02.009.
[14] 王一博. 高起泡性蛋清液制备与应用研究[D]. 武汉: 华中农业大学,2016: 26-30.
[15] JAMBRAK A R, MASON T J, LELAS V, et al. Effect of ultrasound treatment on solubility and foaming properties of whey protein suspensions[J]. Journal of Food Engineering, 2008, 86(2): 281-287.DOI:10.1016/j.jfoodeng.2007.10.004.
[16] 黄六容, 马海乐, 穆丽君, 等. 超声波对木瓜蛋白酶的活性及动力学和热力学参数的影响[J]. 高校化学工程学报, 2012, 26(1): 89-92.
[17] CHANG Cuihua, NIU Fuge, SU Yujie, et al. Characteristics and emulsifying properties of acid and acid-heat induced egg white protein[J]. Food Hydrocolloids, 2016, 54: 342-350. DOI:10.1016/j.foodhyd.2015.09.026.
[18] NESTERENKO A, ALRIC I, SILVESTRE F, et al. Influence of soy protein’s structural modifications on their microencapsulation properties: α-tocopherol microparticle preparation[J]. Food Research International, 2012, 48(2): 387-396. DOI:10.1016/j.foodres.2012.04.023.
[19] KUMBÁR V, TRNKA J, ŠÁRKA N, et al. On the influence of storage duration on rheological properties of liquid egg products and response of eggs to impact loading: Japanese quail eggs[J].Journal of Food Engineering, 2015, 166(1): 86-94. DOI:10.1016/j.jfoodeng.2015.05.030.
[20] TANG C H, CHOI S M, MA C Y. Study of thermal properties and heat-induced denaturation and aggregation of soy proteins by modulated differential scanning calorimetry[J]. International Journal of Biological Macromolecules, 2007, 40(2): 96-104. DOI:10.1016/j.ijbiomac.2006.06.013.
[21] MAFORIMBO E, SKURRAY G R, NGUYEN M. Evaluation of L-ascorbic acid oxidation on SH concentration in soy-wheat composite dough during resting period[J]. LWT-Food Science and Technology,2007, 40(2): 338-343. DOI:10.1016/j.lwt.2005.09.008.
[22] VOUTSINAS L P, CHEUNG E, NAKAI S. Relationships of hydrophobicity to emulsifying properties of heat denatured proteins[J].Journal of Food Science, 1983, 48(1): 26-32. DOI:10.1111/j.1365-2621.1983.tb14781.x.
[23] YIN Shouwei, TANG Chuanhe, YANG Xiaoquan, et al.Conformational study of red kidney bean (Phaseolus vulgaris L.)protein isolate (KPI) by tryptophan fluorescence and differential scanning calorimetry[J]. Journal of Agricultural and Food Chemistry,2010, 59(1): 241-248. DOI:10.1021/jf1027608.
[24] CHURCH F C, SWAISGOOD H E, PORTER D H, et al.Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins[J]. Journal of Dairy Science, 1983, 66(6): 1219-1227. DOI:10.3168/jds.S0022-0302(83)81926-2.
[25] J. C. A.. Infrared and raman spectroscopy of biological molecules.edited by T.M. Theophanides, D. Reidel, Holland, in co-operation with NATO Scientif i c Affairs Division, pp. ix + 372, price 90 Df l[J].Journal of Molecular Structure, 1978, 67: 332. DOI:10.1016/0022-2860(80)80386-3.
[26] WONG H W, CHOI S M, PHILLIPS D L, et al. Raman spectroscopic study of deamidated food proteins[J]. Food Chemistry, 2009, 113(2):363-370. DOI:10.1016/j.foodchem.2008.09.027.
[27] WANG X S, TANG C H, LI B S, et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J]. Food Hydrocolloids, 2008, 22(4): 560-567.DOI:10.1016/j.foodhyd.2007.01.027.
[28] HU H, WU J, LI-CHAN E C Y, et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI)dispersions[J]. Food Hydrocolloids, 2013, 30(2): 647-655.DOI:10.1016/j.foodhyd.2012.08.001.
[29] CHANDRAPALA J, OLIVER C, KENTISH S, et al. Ultrasonics in food processing[J]. Ultrasonics Sonochemistry, 2012, 19(5): 975-983.DOI:10.1016/j.ultsonch.2012.01.010.
[30] 许以明. 拉曼光谱及其在结构生物学中的应用[M]. 北京: 化学工业出版社教材出版中心, 2005: 11-12.
[31] TU A T. Raman spectroscopy in biology: principles and applications[M]. New York: John Wiley and Sons, 1982: 165.
[32] MATEMU A O, KAYAHARA H, MURASAWA H, et al. Improved emulsifying properties of soy proteins by acylation with saturated fatty acids[J]. Food Chemistry, 2011, 124(2): 596-602. DOI:10.1016/j.foodchem.2010.06.081.
[33] STEFANOVIC A, JOVANOVIĆ J, DOJČINOVIĆ M, et al. Impact of high-intensity ultrasound probe on the functionality of egg white proteins[J]. Journal of Hygienic Engineering & Design, 2014, 6: 215-224.
[34] LIU J H, RU Q M, DING Y T. Glycation a promising method for food protein modif i cation: physicochemical properties and structure,a review[J]. Food Research International, 2012, 49(1): 170-183.DOI:10.1016/j.foodres.2012.07.034.
[35] 黄群, 金永国, 马美湖, 等. 超高压处理对S-卵白蛋白构象与功能特性的影响[J]. 农业机械学报, 2013, 44(3): 161-166.
[36] HUANG Q, MA M H, HUANG X, et al. Effect of S-configuration transformation of ovalbumin on its molecular characteristics and emulsifying properties[J]. Asian Journal of Chemistry, 2012, 24(4):1675-1679.
[37] GÜLSEREN I, GÜZEY D, BRUCE B D, et al. Structural and functional changes in ultrasonicated bovine serum albumin solutions[J]. Ultrasonics Sonochemistry, 2007, 14(2): 173-183.DOI:10.1016/j.ultsonch.2005.07.006.
[38] CHANDRAPALA J, ZISU B, PALMER M, et al. Effects of ultrasound on the thermal and structural characteristics of proteins in reconstituted whey protein concentrate[J]. Ultrasonics Sonochemistry, 2011, 18(5):951-957. DOI:10.1016/j.ultsonch.2010.12.016.
[39] ARZENI C, PÉREZ O E, PILOSOF A M R. Functionality of egg white proteins as affected by high intensity ultrasound[J]. Food Hydrocolloids,2012, 29(2): 308-316. DOI:10.1016/j.foodhyd.2012.03.009.
[40] ARZENI C, MARTÍNEZ K, ZEMA P, et al. Comparative study of high intensity ultrasound effects on food proteins functionality[J].Journal of Food Engineering, 2012, 108(3): 463-472. DOI:10.1016/j.jfoodeng.2011.08.018.
[41] MURRAY B S, DURGA K, YUSOFF A, et al. Stabilization of foams and emulsions by mixtures of surface active food-grade particles and proteins[J]. Food Hydrocolloids, 2011, 25(4): 627-638. DOI:10.1016/j.foodhyd.2010.07.025.
[42] ŻMUDZIŃSKI D, PTASZEK P, KRUK J, et al. The role of hydrocolloids in mechanical properties of fresh foams based on egg white proteins[J]. Journal of Food Engineering, 2014, 121(1): 128-134.DOI:10.1016/j.jfoodeng.2013.08.020.
Effect of Ultrasonic Treatment on Protein Structure and Physicochemical and Foaming Properties of Liquid Egg White
LI Gongzhong, ZHAO Ying, WANG Juntong, et al. Effect of ultrasonic treatment on protein structure and physicochemical and foaming properties of liquid egg white[J]. Food Science, 2019, 40(9): 68-75. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20180419-248. http://www.spkx.net.cn