表1 实时荧光定量PCR引物序列
Table1 Sequences of the primers used in real-time PCR
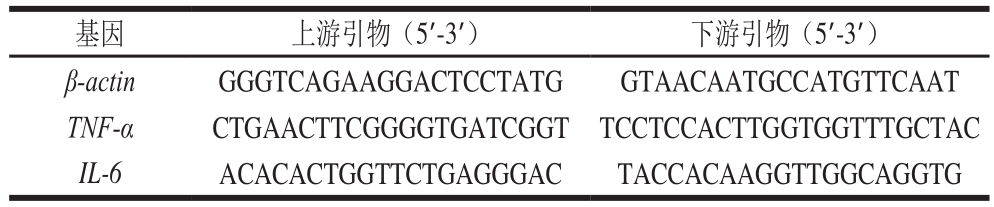
基因 上游引物(5’-3’) 下游引物(5’-3’)β-actin GGGTCAGAAGGACTCCTATG GTAACAATGCCATGTTCAAT TNF-α CTGAACTTCGGGGTGATCGGT TCCTCCACTTGGTGGTTTGCTAC IL-6 ACACACTGGTTCTGAGGGAC TACCACAAGGTTGGCAGGTG
近年来,随着经济的飞速发展,我国膳食营养模式已逐渐从低脂的植物性食物为主转向与高脂的动植物性食物并重[1],这种高脂饮食模式会增加肥胖发生的几率[2-3],导致血脂异常[4]、诱发心血管疾病[5]、引起慢性炎症反应[6]和肠道氧化应激[7]等。肠道氧化应激可能导致肠道功能损伤,甚至引起炎症性肠道疾病[8],对肠道产生不可逆损伤。有研究报道了肠道损伤会引起肠道菌群结构失调[9];也有研究证明了肠道菌群与肥胖的发生密切相关[10];肠道菌群是动物发生肥胖的前提,无菌小鼠即使吃高脂饲料也不会肥胖[11];接受肥胖鼠粪菌移植的无菌小鼠体质量增加量显著高于接受瘦鼠粪菌移植的[12]。目前我国超重和肥胖人群已接近总人口的1/4,肥胖的防治工作迫在眉睫[13]。因此,研究如何改善高脂饮食诱导的肠道氧化应激和肠道菌群结构失调对肥胖的预防和控制具有非常重要的意义。
Orentreich等[14]首次发现饮食蛋氨酸限制(methionine restriction,MR)对健康产生有益影响,他们发现将饮食中蛋氨酸的含量从0.86%限制至0.17%能够使大鼠寿命延长30%~40%而不会影响其正常生长;后续研究陆续发现饮食MR能在不限制能量摄入的情况下减轻动物体质量[15],还产生诸多有益于机体健康的影响,如延长动物寿命[16]、改善机体代谢状态、延缓癌症恶化进程[17]等。此外,Sanz等[18]还发现饮食MR可以减少肝脏和心脏线粒体活性氧自由基的产生,提示MR可能具有缓解机体氧化应激的作用。然而MR对高脂饮食小鼠肠道氧化还原状态和肠道菌群结构的影响鲜有报道。
因此,本实验以高脂饮食的C57BL/6小鼠为研究对象,来探究饮食MR对高脂饮食小鼠肠道氧化还原状态以及肠道菌群结构的影响,为肥胖诱导肠道氧化应激和肠道菌群结构失衡的预防和控制提供参考依据。
SP F级雄性C 57 BL/6小鼠(4 周龄,体质量18~20 g)购自南京生物医药研究院,许可证号:SCXK(苏)2015-0001。
蛋氨酸(食品级,蛋氨酸质量分数99.93%)为市售;总抗氧化能力(total antioxidant capacity,T-AOC)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)、还原型谷胱甘肽(glutathione,GSH)、氧化型谷胱甘肽(oxidizided glutathione,GSSG)检测试剂盒 南京建成生物工程研究所;甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)检测试剂盒 上海丰汇医学科技股份有限公司;脂多糖(lipopolysaccharide,LPS)、LPS结合蛋白(LPS-binding protein,LBP)酶联免疫吸附检测试剂盒 厦门慧嘉生物科技有限公司;细菌基因组DNA快速提取试剂盒(离心柱型)、基因引物 上海捷瑞生物工程有限公司;2hTaq PCR Master Mix 上海睿迪生物科技有限公司;聚合酶链式反应(polymerase chain reaction,PCR)产物纯化试剂盒、琼脂糖凝胶DNA回收试剂盒 上海生工生物工程有限公司;糖原核酸助沉剂、去离子甲酰胺 上海江莱生物;快速内切酶HhaI、MspI和BCA试剂盒 美国Thermo Scientif i c公司。
Epoch微孔板分光光度计 美国BioTek公司;5804R台式高速冷冻离心机 德国Eppendorf公司;R686VLT超低温冷冻冰箱 美国Invetro公司;ETC811 PCR扩增仪 东胜兴业科学仪器有限公司;Precellys 24-Dual多功能生物样品均质机 法国Bertin公司;7900HT Fast Real-Time PCR仪 美国ABI公司。
1.3.1 动物分组与饲养
27 只SPF级雄性C57BL/6小鼠用正常饲料预饲喂一周后,按体质量随机分为3 组,每组9 只:1)低脂正常饮食组(C组:4%(质量分数,下同)猪油、0.86%蛋氨酸);2)高脂正常蛋氨酸饮食组(HM组:20%猪油、0.86%蛋氨酸);3)高脂蛋氨酸限制饮食组(LM组:20%猪油、0.17%蛋氨酸)。每周称量并记录体质量,12 周末处死小鼠。饲料配方参考文献[19]。
实验期间小鼠饲养于SPF级动物房,每笼3 只,饲养温度(23f2)℃、相对湿度60%,12 h昼夜循环光照。
1.3.2 实验样本收集
在麻醉状态下以摘眼球方式取血于抗凝管中,4 ℃、3 000 r/min离心10 min,取上层血浆,-80 ℃保存备用。断颈处死小鼠,迅速取出回肠、盲肠和结肠。取部分回肠和部分结肠,用于抗氧化指标检测,盲肠内容物和结肠内容物用于提取菌群DNA。取100 mg回肠组织置于Trizol试剂中,-80 ℃保存用于提取总RNA。
1.3.3 指标检测
血清TG、TC、HDL-C、LDL-C、LPS和LBP水平均严格依照试剂盒说明书检测。回肠和结肠组织T-AOC、GSH-Px、MDA、GSH和GSSG水平均严格依照试剂盒说明书检测。
1.3.4 盲肠内容物及结肠内容物DNA提取
内容物处理参照Wang Panpan等[20]的方法,后续步骤按照细菌基因组DNA快速提取试剂盒说明书操作。
1.3.5 实时荧光定量PCR
采用Trizol法提取回肠组织的总RNA,然后加入适量焦碳酸二乙酯水稀释,通过测定溶液中吸光度比值(A260 nm/A280 nm)确定提取的RNA纯度,测得吸光度在1.8~2.0时可用于下一步实验。
以β-actin为内标,测定回肠组织TNF-α、IL-6 mRNA的表达水平,引物如表1所示。使用7900 HT Fast Real-Time PCR仪检测各模板的Ct值,通过2-ΔΔCt法计算,进行相对定量,反应体系:0.5 μL cDNA模板、10 μmol/L上下游引物各0.4 μL、5.0 μL SYBR Green Master Mix和3.7 μL无菌水。扩增条件:95 ℃预变性5 min;95 ℃变性20 s,62 ℃退火30 s,72 ℃延伸20 s,循环40 次;72 ℃终末延伸2 min;4 ℃冷却恒定。
表1 实时荧光定量PCR引物序列
Table1 Sequences of the primers used in real-time PCR

基因 上游引物(5’-3’) 下游引物(5’-3’)β-actin GGGTCAGAAGGACTCCTATG GTAACAATGCCATGTTCAAT TNF-α CTGAACTTCGGGGTGATCGGT TCCTCCACTTGGTGGTTTGCTAC IL-6 ACACACTGGTTCTGAGGGAC TACCACAAGGTTGGCAGGTG
1.3.6 限制性末端酶切
限制性末端酶切(terminal restriction fragment length polymorphism,T-RFLP)参照Wang Panpan等[20]的方法对DNA进行PCR扩增,荧光标记的通用引物为8F(5’-AGAGTTTGATCCTGGCTAG-3’,5’端标记FAM)和1492R(5’-GGTTACCTTGTTACGACTT-3’,5’端标记HEX),扩增体系包括2hTaq PCR Master Mix 12.5 μL、10 μmol/L上下游引物各0.5 μL、20 ng/μL DNA 3 μL、ddH2O加至25 μL。扩增产物用PCR产物纯化试剂盒纯化,纯化产物用快速内切酶HhaI、MspI酶切,内切酶消化体系包括灭酶水17 μL、10hFastDigest 2 μL、DNA 10 μL、FastDigest enzyme 1 μL,消化完成后立即放入70 ℃的水浴锅内灭活内切酶。对得到的酶切产物脱盐纯化,脱盐步骤参照Wang Panpan等[20]的方法,脱盐产物委托上海生工生物工程有限公司进行分析。
1.3.7 结肠内容物高通量测序分析
将样本寄送至华大基因公司(每组随机取4 个),采用Illumina(HiSeq 2500/4000)测序平台,通过分析菌基因的16S rRNA v4区域基因序列来分析小鼠结肠菌群。
使用SPSS 17.0统计学软件进行分析,One-way ANOVA和Duncan’s test分析差异显著性,P<0.05时被认为差异具有统计学意义,统计结果采用平均值±标准差表示。
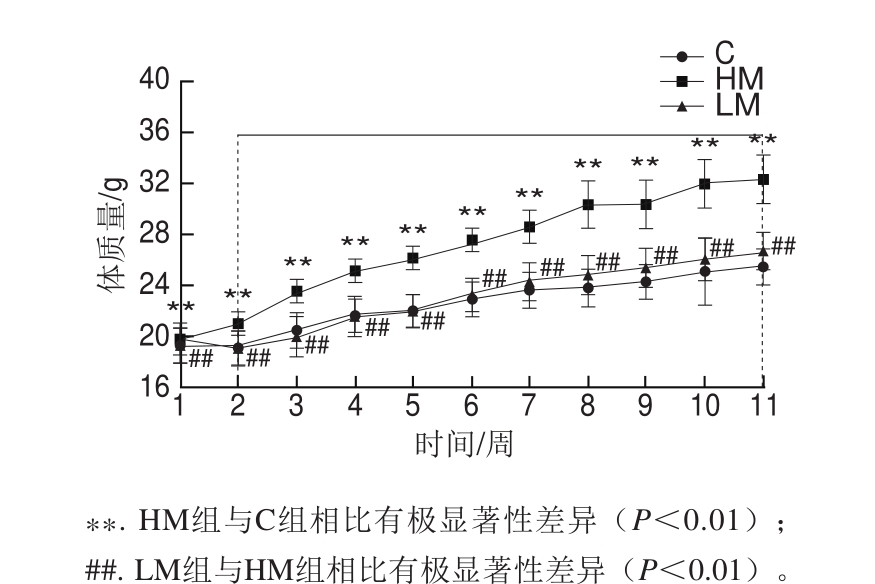
图1 蛋氨酸限制对高脂饮食小鼠体质量和体质量增加的影响(n= 9)
Fig.1 Effect of MR on body mass and mass gain of HFD-fed mice (n = 9)
由图1可见,各组小鼠初始体质量基本相同(P>0.05);至宰杀前第11周时,HM小鼠体质量极显著高于对照组(P<0.01),LM小鼠体质量极显著低于HM小鼠(P<0.01)。
表2 蛋氨酸限制对高脂饮食小鼠血脂的影响
Table2 Effect of MR on lipid pro fi le of HFD-fed mice mmol/L

注:*. HM组与C组相比有显著性差异(P<0.05);**. HM组与C组相比有极显著性差异(P<0.01);#. LM组与HM组相比有显著性差异(P<0.05);##. LM组与HM组相比有极显著性差异(P<0.01)。
指标 C组 HM组 LM组TG浓度 0.94f0.11 1.37f0.15** 0.83f0.09##TC浓度 3.37f0.24 3.98f0.49* 3.43f0.28#HDL-C浓度 1.07f0.09 0.68f0.12** 1.06f0.07##LDL-C浓度 0.47f0.09 1.59f0.19** 0.59f0.14##
由表2可见,与C组相比,HM组小鼠极显著升高血浆TG和LDL-C浓度(P<0.01),显著升高TC浓度(P<0.05),极显著降低HDL-C浓度(P<0.01);与HM小鼠相比,LM极显著降低血浆TG和LDL-C浓度(P<0.01),显著降低TC浓度(P<0.05),极显著升高HDL-C浓度(P<0.01)。
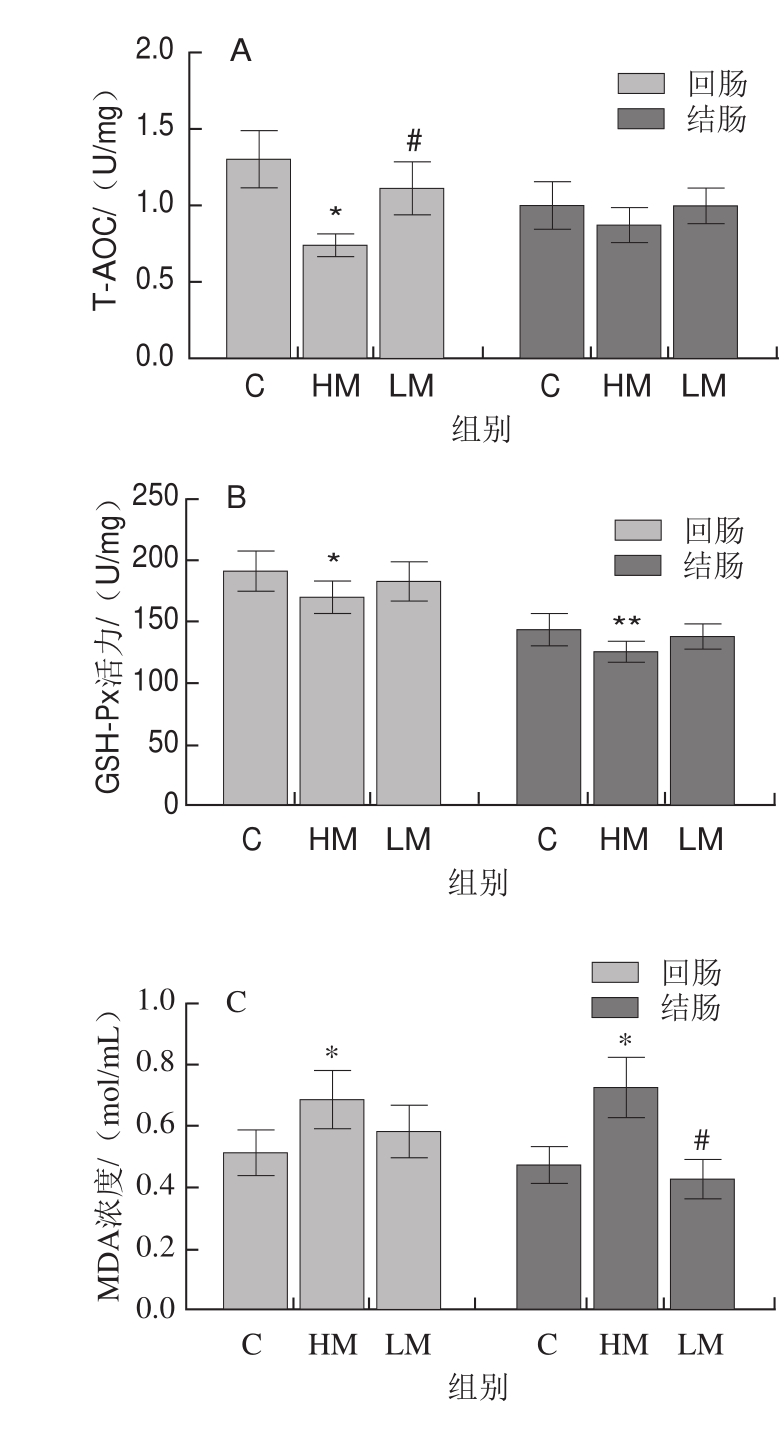

图2 蛋氨酸限制对高脂饮食小鼠回肠和结肠组织氧化还原状态的影响
Fig.2 Effect of MR on redox homeostasis of ileum and colon in HFD-fed mice
由图2可见,与对照组相比,HM显著降低回肠T-AOC和GSH-Px活力(P<0.05),显著增加回肠MDA浓度(P<0.05),极显著降低结肠GSH-Px活力(P<0.01),显著增加结肠MDA浓度(P<0.05),显著降低结肠GSH/GSSG(P<0.05);与HM相比,LM显著增加回肠T-AOC和GSH/GSSG(P<0.05),显著降低结肠MDA浓度(P<0.05),显著增加结肠GSH/GSSG(P<0.05)。
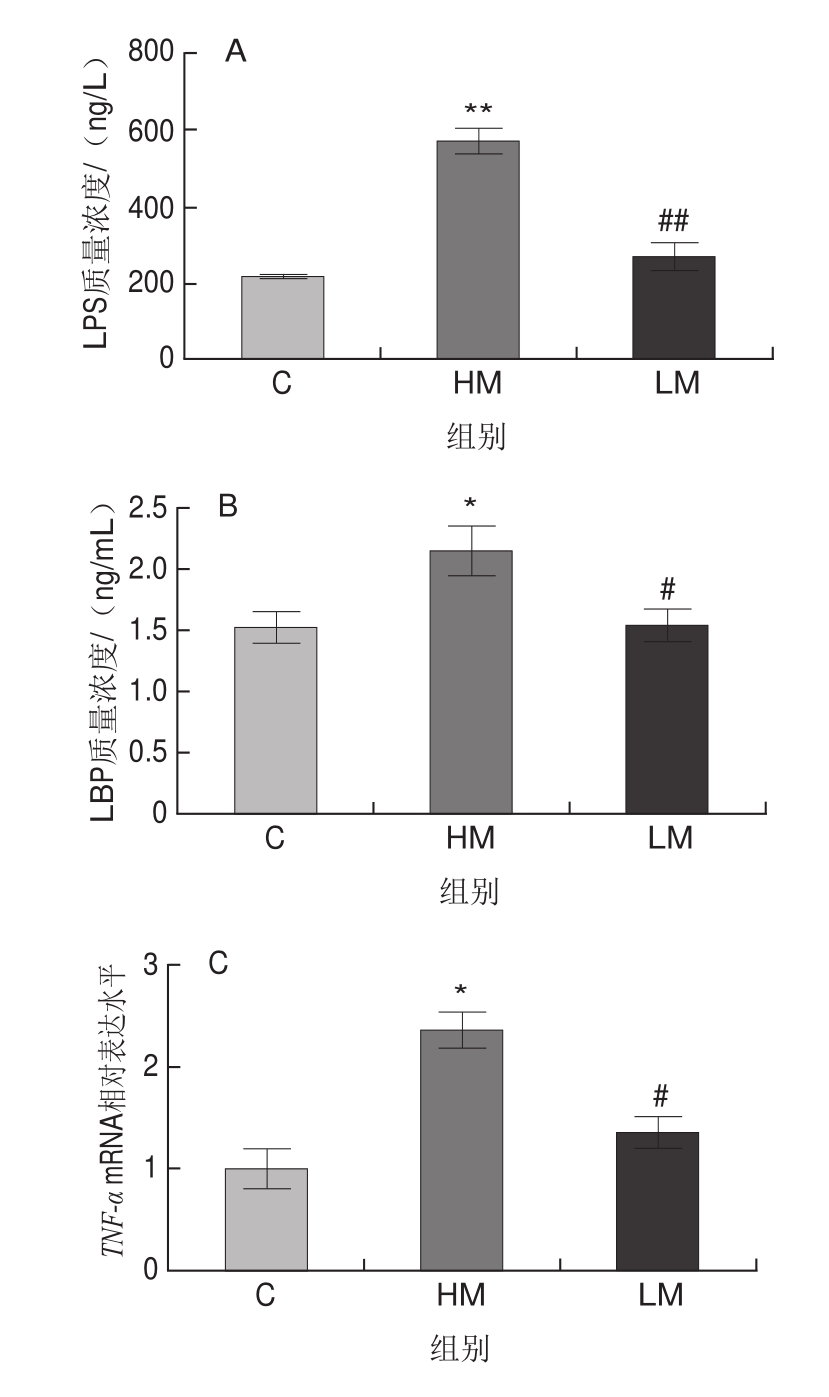
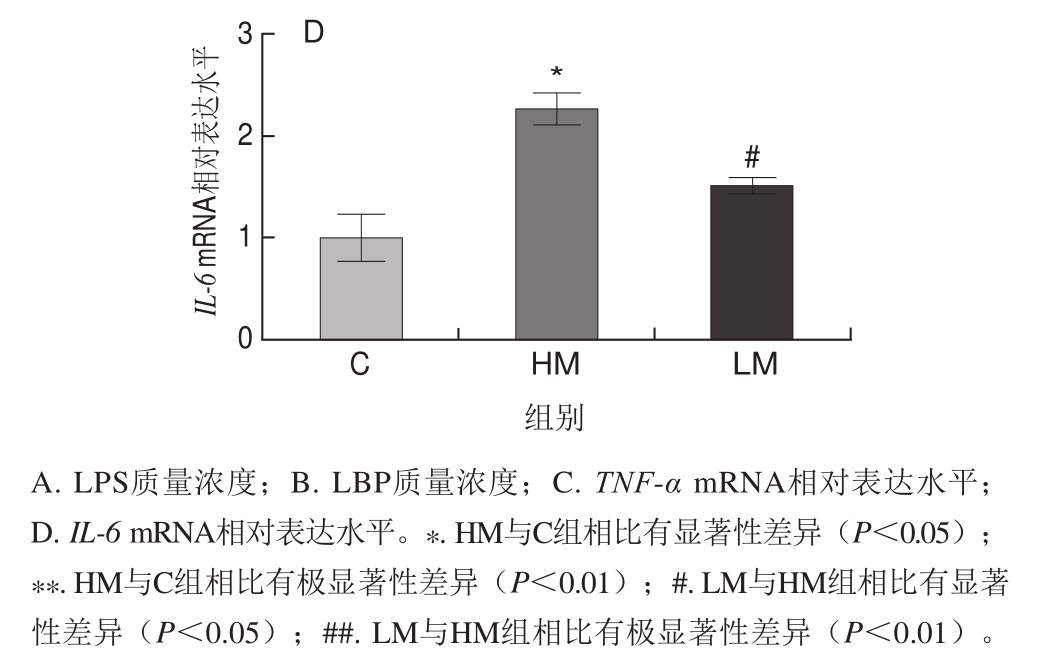
图3 蛋氨酸限制对高脂饮食小鼠血浆LPS、LBP和回肠炎症反应的影响
Fig.3 Effect of MR on the plasma levels of LPS and LBP and ileum inf l ammation in HFD-fed mice
由图3可见,与对照组相比,HM极显著升高血浆LPS质量浓度(P<0.01),显著升高血浆LBP质量浓度(P<0.05),显著上调回肠炎症基因TNF-α和IL-6 mRNA的相对表达水平(P<0.05);与HM组相比,LM组极显著降低血浆LPS质量浓度(P<0.01),显著降低LBP质量浓度(P<0.05),显著下调回肠炎症基因TNF-α和IL-6 mRNA的相对表达水平(P<0.05)。
由图4A可见,HM组与C组及LM两组区域明显区分开,说明C、HM和LM 3 组小鼠盲肠菌群结构均有显著性差异。图4B中,与对照组相比,HM组Shannon-Weiner指数与均匀度指数显著降低(P<0.05);与HM组相比,LM组Shannon-Weiner指数与均匀度指数显著升高(P<0.05)。依次观察图4C结果发现,HM组的优势片段有MH126.3,LM组的优势片段有HH393.9和HH270.5,C组与LM组共有的优势片段有MH74.1、MF81.6、MH84.5、HH132.2和HF188.0,说明各组小鼠盲肠内容物中都有其特有的优势菌群。
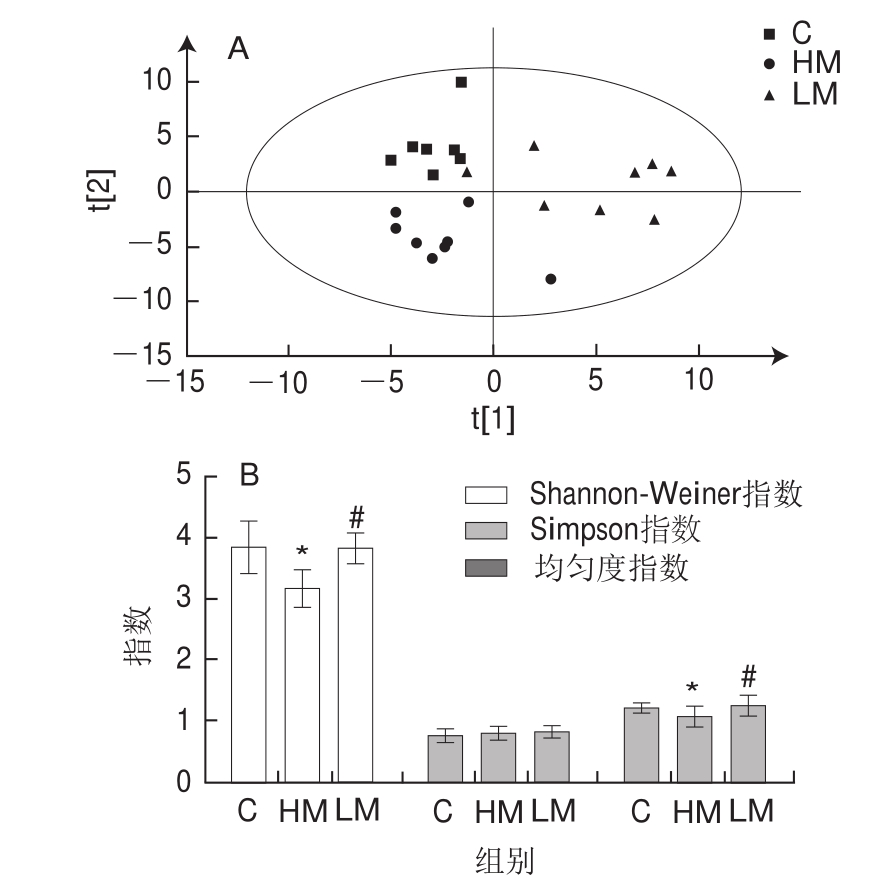
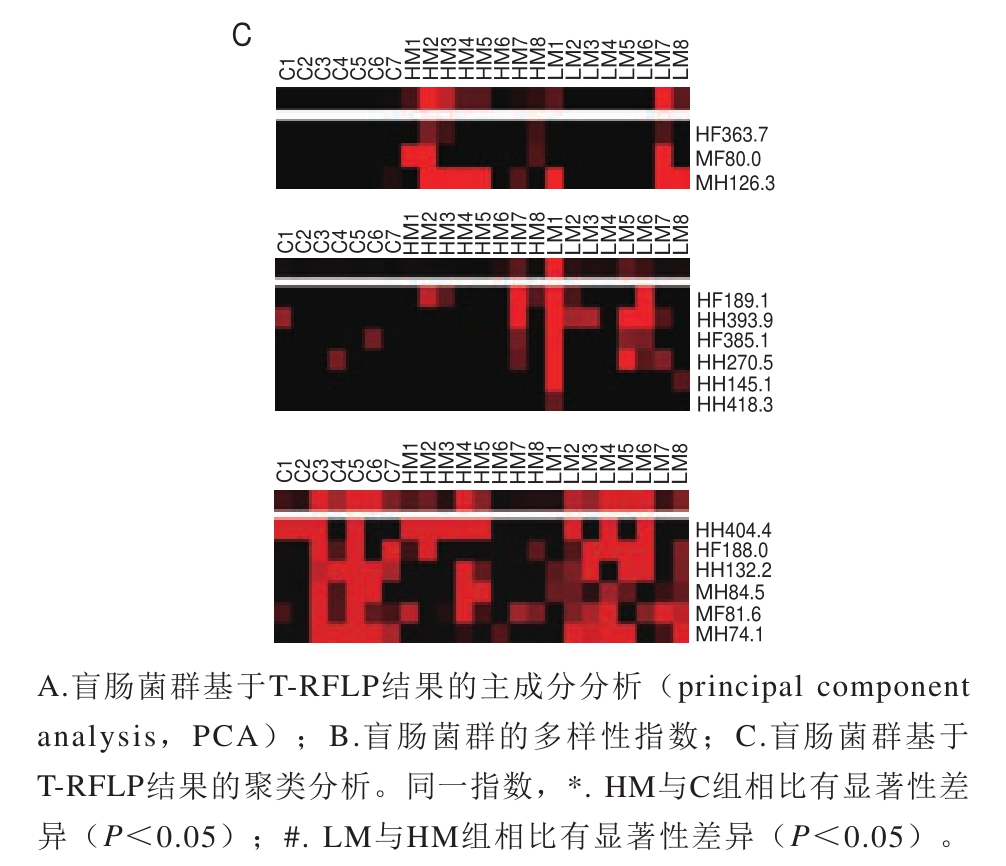
图4 T-RFLP分析盲肠菌群
Fig.4 Analysis of cecal microbiota by terminal restriction fragment length polymorphism
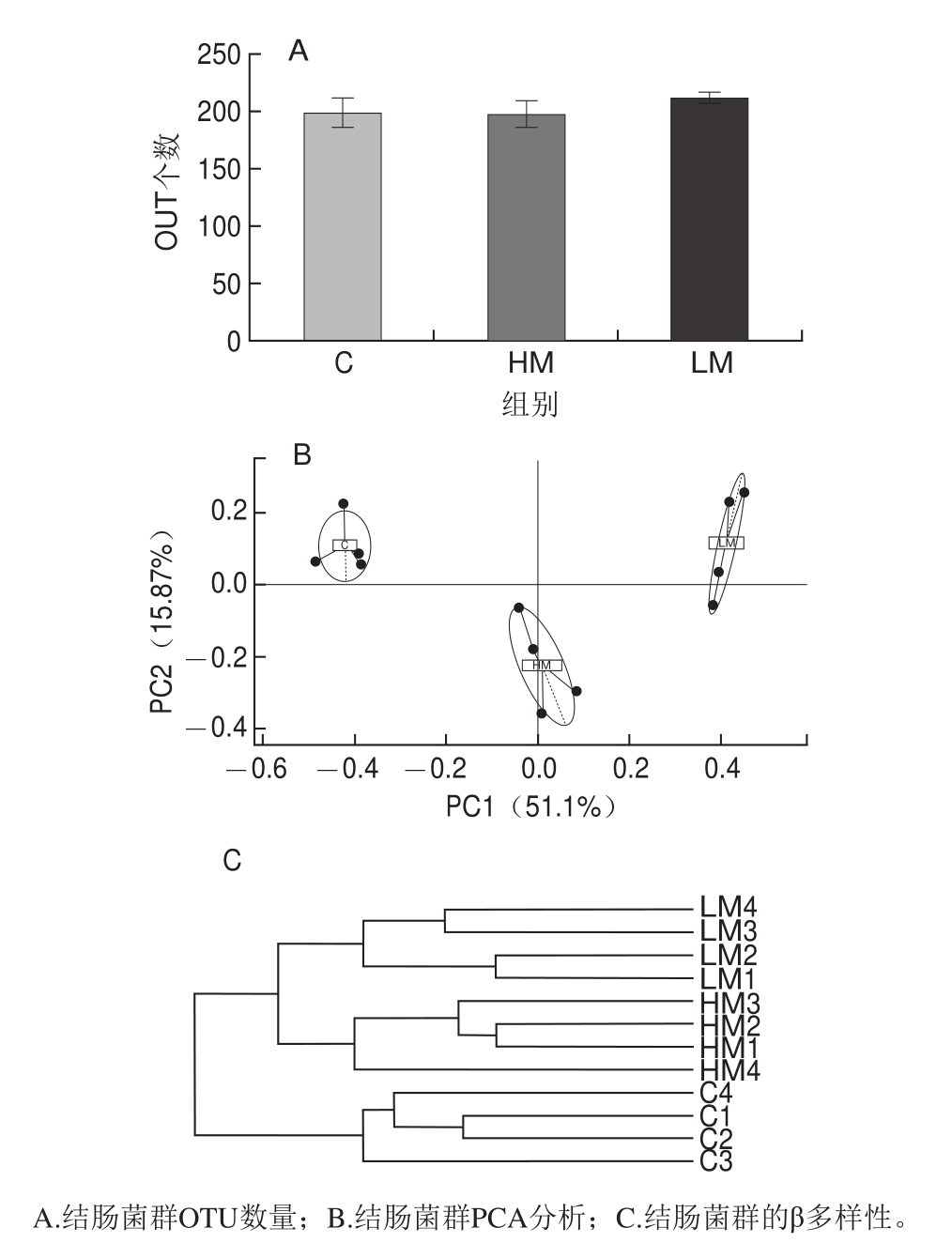
图5 结肠菌群OTU数量、PCA和β多样性
Fig.5 Analysis of colonic microbiota by high throughput sequencing
将获得的Tags拼接和优化后,在97%相似度下将其聚类为用于物种分类的操作分类单元(operational taxonomic units,OTU),共产生338 个OTU。由图5可见,LM组的OTU数量最多(图5A),根据每个样品OTU的丰度文件计算出每个OTU在每个样品的相对丰度,利用该丰度信息进行PCA分析,结果表明各组结肠菌群组成有明显差异(图5B);对样品进行聚类分析并计算样品间距离,以判断各样品物种组成的相似性,样品越靠近、枝长越短,说明两个样品的物种组成越相似,结果表明各组结肠菌群组成比较相似,组间差异明显(图5C)。
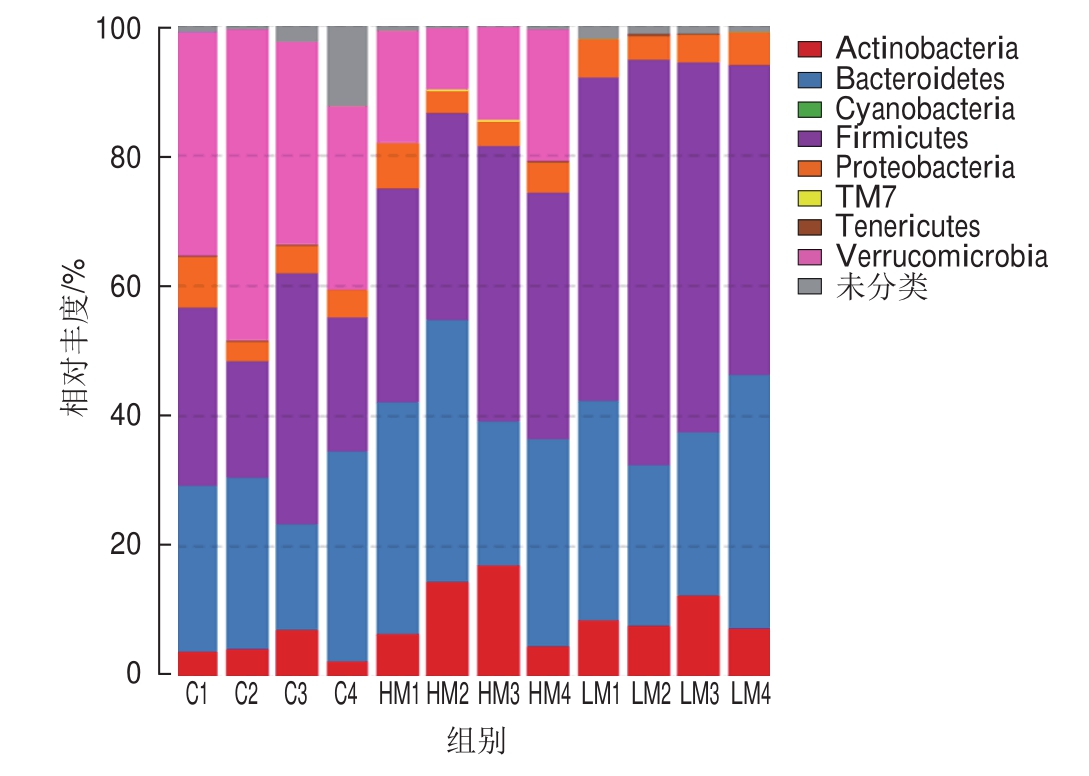
图6 基于门水平的菌群丰度
Fig.6 Taxonomic composition distribution in samples at the phylum level
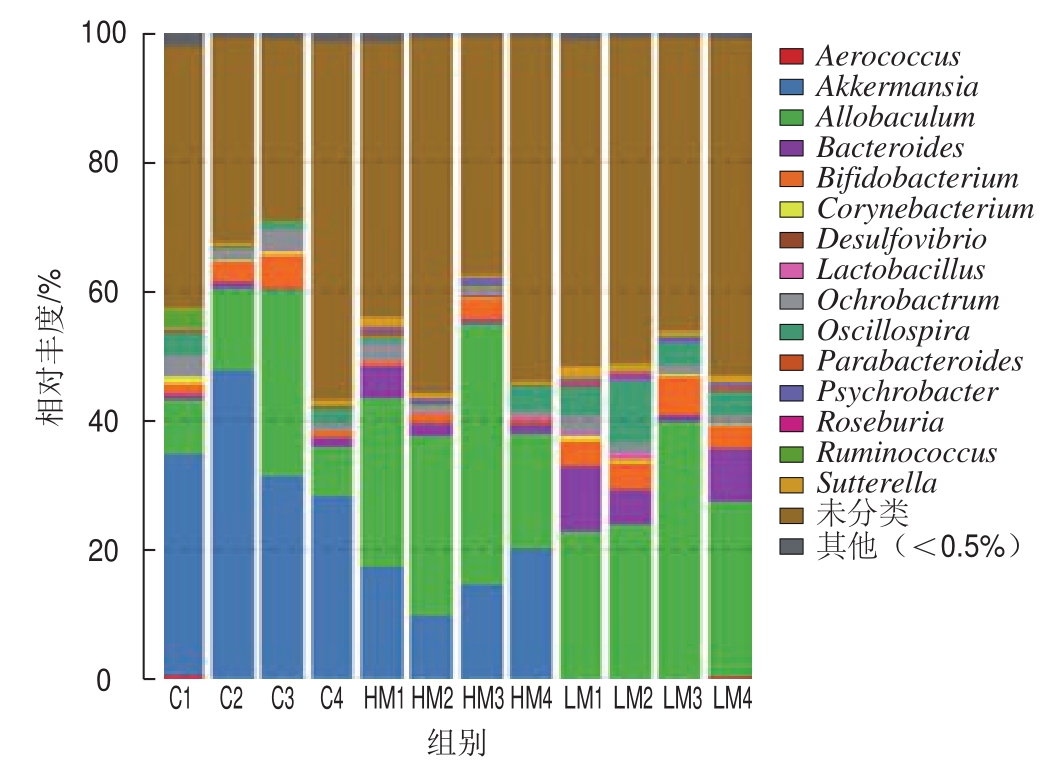
图7 基于属水平的菌群丰度
Fig. 7 Taxonomic composition distribution in samples at the genus level
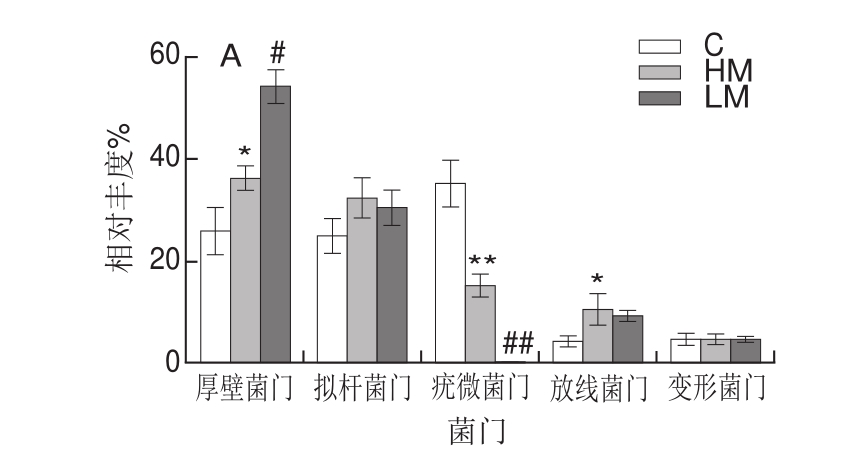
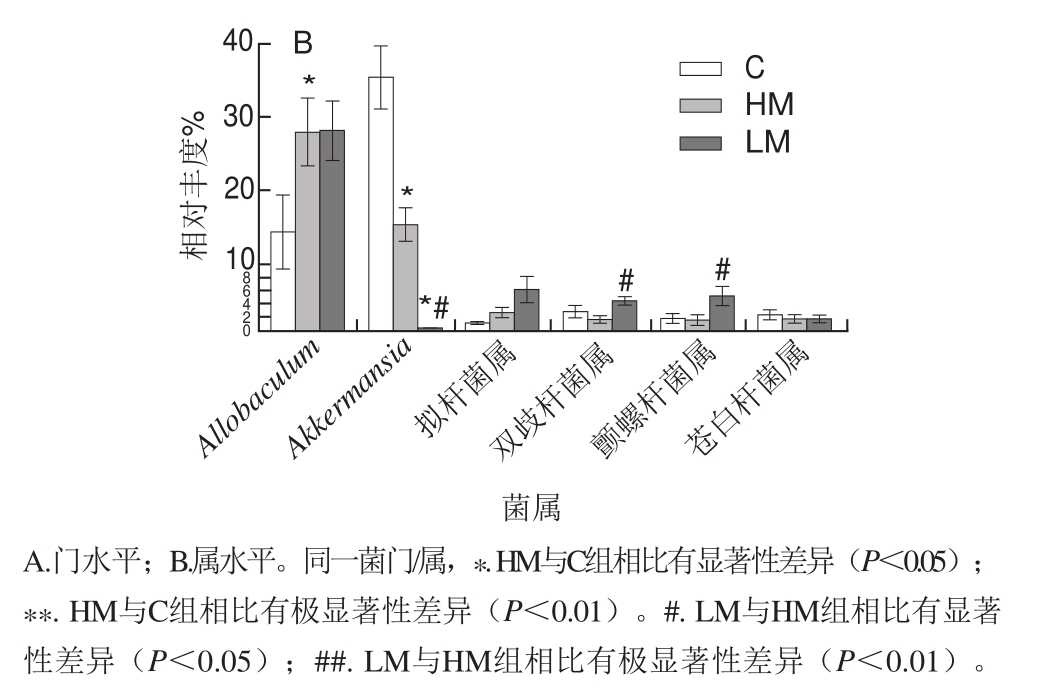
图8 基于门和属水平的结肠菌群丰度
Fig.8 Taxonomic composition distribution in samples at the phylum and genus level
由图6~8可见,基于门、属水平分析各组小鼠结肠菌群结构:在门水平上,各组优势菌群有厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria)(图6、图8A);其中与对照组相比,HM组显著升高厚壁菌门及放线菌门丰度(P<0.05),极显著降低疣微菌门丰度(P<0.01),与HM组相比,LM组显著升高厚壁菌门丰度(P<0.05),显著降低疣微菌门丰度(P<0.05)(图8 A);在属水平上,各组优势菌群主要有Allobaculum、Akkermansia、拟杆菌属(Bacteroides)、双歧杆菌属(B i f i dobacterium)、颤螺杆菌属(Oscillosporia)和苍白杆菌属(Ochrobactrum)(图7、8B);其中与对照组相比,HM组降低双歧杆菌、颤螺杆菌属与Akkermansia丰度,显著升高Allobaculum丰度,与HM组相比,LM组显著升高Allobaculum、双歧杆菌和颤螺杆菌属丰度(P<0.05),显著降低Akkermansia丰度(P<0.05)(图8B)。
饮食MR能减轻高脂饮食引起的体质量增加[21],本实验中LM组体质量显著低于HM组,与文献报道的结果是一致的。高脂饮食能够引起高血脂[3,23],有研究报道饮食蛋氨酸限制能够降低血脂水平[24],本研究中饮食MR显著降低了高脂饮食小鼠血浆中TC、TG和LDL-C浓度,显著升高HDL-C浓度,与其研究结果一致。
高脂饮食是肥胖产生的主要原因之一,肥胖会诱导氧化应激[25]。MDA是脂质过氧化的产物,可间接反映细胞氧化损伤程度。T-AOC能反映机体总抗氧化能力,可清除机体产生的自由基,使机体氧化还原状态保持平衡。GSH清除自由基后转化为GSSG,也可反映机体氧化还原状态。Qiao Yi等[7]发现高脂饮食显著增加肠组织MDA浓度,产生严重的肠道氧化应激损伤。本研究发现饮食MR显著增加回肠T-AOC,显著降低结肠MDA浓度,显著增加回肠与结肠GSH与GSSG的比值,说明饮食MR能够显著改善高脂饮食引起的小鼠肠道氧化应激。
高脂饮食诱导的肥胖往往伴随着炎症反应[6],包括肠道组织炎症反应[26],主要表现为机体LPS水平升高,LPS与LBP结合进一步刺激单核巨噬细胞分泌TNF-α、IL-6等促炎症因子。本实验中饮食MR显著降低血浆LPS、LBP质量浓度,显著降低回肠基因TNF-α、IL-6 mRNA表达,说明饮食MR能够显著减轻高脂饮食诱导的小鼠肠道炎症反应。
肠道菌群能够调节动物的脂肪积累,是动物肥胖发生的必要条件[27]。研究发现膳食因素能够显著影响肠道菌群结构[28]。Shannon-Weiner指数用于评价肠道菌群多样性,值越大表明肠道菌群多样性越高;均匀度指数反映肠道菌群中全部细菌分配的均匀程度,值越大表明肠道菌群均匀度越高。通过T-RFLP分析小鼠盲肠菌群,饮食MR显著增加Shannon-Weiner指数和均匀度指数,说明饮食MR能够增加高脂饮食小鼠盲肠菌群的多样性和菌群的均匀度。
相比于T-RFLP,高通量测序能够更加准确、深入地分析小鼠肠道菌群的组成。因此,本实验通过Illumina测序平台分析了小鼠结肠内容物的菌群,结果分析表明饮食MR显著增加双歧杆菌和颤螺杆菌属丰度,显著降低Akkermansia丰度。双歧杆菌作为益生菌,具有增强肠道屏障[29]、抗LPS诱导肠道炎症的作用[30]。本实验中饮食MR减轻炎症的作用可能与双歧杆菌丰度升高有关。颤螺杆菌属在炎症性疾病如克罗恩病、非酒精性脂肪肝炎患者体内的丰度显著下降[31],其丰度与人的身体质量指数呈负相关[32]。本实验发现高脂饮食引起的小鼠炎症反应加剧和体质量增加与这些研究结果是一致的;饮食MR能够减轻高脂饮食小鼠肠道炎症反应和降低体质量与其增加颤螺杆菌属丰度的结果是一致的。这些结果说明了饮食MR可能通过增加肠道双歧杆菌和颤螺杆菌属丰度来缓解高脂饮食诱导的小鼠肠道氧化应激和炎症反应。黏液层作为肠道屏障具有阻止肠道细菌入侵的免疫功能,而Akkermansia能够降解黏液层蛋白[33],在一定条件下能损害机体健康。Ganesh等[34]研究发现Akkermansia可加剧鼠伤寒沙门氏菌感染的无菌小鼠的肠道炎症。因此,推测可能是高脂饮食时Akkermansia过度分解黏液层,破坏肠道屏障,在饮食MR时机体降低其丰度以防黏液层被过度分解而影响肠道黏膜屏障,但其具体机制仍需深入研究。
综上所述,本研究探究了饮食MR对高脂饮食小鼠肠道氧化应激、炎症反应以及肠道菌群结构的影响,结果表明饮食MR具有显著改善高脂饮食小鼠肠道组织氧化还原状态、炎症反应和肠道菌群结构的作用。
[1] 李哲敏. 近50 年中国居民食物消费与营养发展的变化特点[J]. 资源科学, 2007, 29(1): 27-35. DOI:10.3969/j.issn.1672-173X.2004.05.028.
[2] LEIBEL R L, ROSENBAUM M, HIRSCH J. Changes in energy expenditure resulting from altered body weight[J]. New England Journal of Medicine, 1995, 332(10): 621-628. DOI:10.1056/NEJM199503093321001.
[3] AKIYAMA T, TACHIBANA I, SHIROHARA H, et al. Highfat hypercaloric diet induces obesity, glucose intolerance and hyperlipidemia in normal adult male Wistar rat[J]. Diabetes Research and Clinical Practice, 1996, 31(1/2/3): 27-35. DOI:10.1016/0168-8227(96)01205-3.
[4] SASATOMI Y, TADA M, UESUGI N, et al. Obesity associated with hypertension or hyperlipidemia accelerates renal damage[J].Pathobiology, 2001, 69(2): 113-118. DOI:10.1159/000048764.
[5] 冉兴无, 李晓松, 童南伟, 等. 中国肥胖人群体脂分布特点及其与心血管危险因素的关系[J]. 四川大学学报(医学版), 2004, 35(5): 699-703. DOI:10.3760/j:issn:0253-9624.2005.05.006.
[6] BASTARD J P, MAACHI M, LAGATHU C, et al. Recent advances in the relationship between obesity, inflammation, and insulin resistance[J]. European Cytokine Network, 2006, 1(17): 4-12.
[7] QIAO Yi, SUN Jin, DING Yinyi, et al. Alterations of the gut microbiota in high-fat diet mice is strongly linked to oxidative stress[J]. Applied Microbiology & Biotechnology, 2013, 97(4): 1689-1697. DOI:10.1007/s00253-012-4323-6.
[8] LUTGENDORFF F, AKKERMANS L M, SODERHOLM J D. The role of microbiota and probiotics in stress-induced gastro-intestinal damage[J]. Current Molecular Medicine, 2008, 8(4): 282-298.DOI:10.2174/156652408784533779.
[9] CUCCHIARA S, STRONATI L, ALOI M. Interactions between intestinal microbiota and innate immune system in pediatric inf l ammatory bowel disease[J]. Journal of Clinical Gastroenterology,2012, 46(9): 64-66. DOI:10.1097/MCG.0b013e31826a857f.
[10] LEY R E, TURNBAUGH P J, KLEIN S, et al. Microbial ecology:human gut microbes associated with obesity[J]. Nature, 2006, 444:1022-1023. DOI:10.1038/4441022a.
[11] BÄCKHED F, MANCHESTER J K, SEMENKOVICH C F, et al.Mechanisms underlying the resistance to diet-induced obesity in germfree mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(3): 979-984. DOI:10.1073/pnas.0605374104.
[12] TURNBAUGH P J, LEY R E, MAHOWALD M A, et al. An obesityassociated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444: 1027-1031. DOI:10.1038/nature05414.
[13] 武阳丰, 马冠生, 胡永华, 等. 中国居民的超重和肥胖流行现状[J]. 中华预防医学杂志, 2005, 39(5): 316-320. DOI:10.3760/j:issn:0253-9624.2005.05.006.
[14] ORENTREICH N, MATIAS J R, DEFELICE A, et al. Low methionine ingestion by rats extends life span[J]. Journal of Nutrition, 1993,123(2): 269-274.
[15] ABLES G P, PERRONE C E, ORENTREICH D, et al. Methioninerestricted C57BL/6J mice are resistant to diet-induced obesity and insulin resistance but have low bone density[J]. PLoS ONE, 2012,7(12): e51357. DOI:10.1371/journal.pone.0051357.
[16] SUN L, SADIGHI AKHA A A, MILLER R A, et al. Life-span extension in mice by preweaning food restriction and by methionine restriction in middle age[J]. The Journals of Gerontology, Series A:Biological Sciences and Medical Sciences, 2009, 64(7): 711-722.DOI:10.1093/gerona/glp051.
[17] CAVUOTO P, FENECH M F. A review of methionine dependency and the role of methionine restriction in cancer growth control and lifespan extension[J]. Cancer Treatment Reviews, 2012, 38(6): 726-736.DOI:10.1016/j.ctrv.2012.01.004.
[18] SANZ A, CARO P, AYALA V, et al. Methionine restriction decreases mitochondrial oxygen radical generation and leak as well as oxidative damage to mitochondrial DNA and proteins[J]. FASEB Journal, 2006,20(8): 1064-1073. DOI:10.1096/fj.05-5568com.
[19] 王雅楠, 张佳红, 郭海涛, 等. 蛋氨酸限制和胶原蛋白肽对高脂饮食小鼠脂代谢和氧化应激的联合作用[J]. 食品科学, 2018, 39(9): 108-115. DOI:10.7506/spkx1002-6630-201809017.
[20] WANG Panpan, LI Ya, XIAO Hang, et al. Isolation of lactobacillus reuteri from Peyer’s patches and their effects on sIgA production and gut microbiota diversity[J]. Molecular Nutrition & Food Research,2016, 60(9): 2020-2030. DOI:10.1002/mnfr.201501065.
[21] LEES E K, KROL E, GRANT L, et al. Methionine restriction restores a younger metabolic phenotype in adult mice with alterations in fibroblast growth factor 21[J]. Aging Cell, 2014, 13(5): 817-827.DOI:10.1111/acel.12238.
[22] ELSHORBAGY A K, VALDIVIA-GARCIA M, MATTOCKS D A, et al.Cysteine supplementation reverses methionine restriction effects on rat adiposity: signif i cance of stearoyl-coenzyme A desaturase[J]. Journal of Lipid Research, 2011, 52(1): 104-112. DOI:10.1194/jlr.M010215.
[23] BALAMURUGAN G, SHANTHA A. Effect of Erythrina variegata seed extract on hyperlipidemia elicited by high-fat diet in Wistar rats[J]. Journal of Pharmacy and Bioallied Sciences, 2010, 2(4): 350-355. DOI:10.4103/0975-7406.72139.
[24] CABREIRO F, AU C, LEUNG K Y, et al. Metformin retards aging in C. elegans by altering microbial folate and methionine metabolism[J].Cell, 2013, 153(1): 228-239. DOI:10.1016/j.cell.2013.02.035.
[25] ZHANG Y, FISCHER K E, SOTO V, et al. Obesity-induced oxidative stress, accelerated functional decline with age and increased mortality in mice[J]. Archives of Biochemistry & Biophysics, 2015, 576: 39-48.DOI:10.1016/j.abb.2014.12.018.
[26] DE LA SERRE, ELLIS C L, LEE J, et al. Propensity to high-fat diet-induced obesity in rats is associated with changes in the gut microbiota and gut inf l ammation[J]. American Journal of Physiology Gastrointestinal & Liver Physiology, 2010, 299(2): G440-G448.DOI:10.1152/ajpgi.00098.2010.
[27] BÄCKHED F, DING H, WANG T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004,101(44): 15718-15723. DOI:10.1073/pnas.0407076101.
[28] WU G D, CHEN J, HOFFMANN C, et al. Linking long-term dietary patterns with gut microbial enterotypes[J]. Science, 2011, 334: 105-158. DOI:10.1080/19490976.2016.1270809.
[29] KOZÁKOVÁ H, REHÁKOVÁ Z, KOLÁNSKÁ J. Bifidobacterium bifidum monoassociation of gnotobiotic mice: effect on enterocyte brush-border enzymes[J]. Folia Microbiologica, 2001, 46(6): 573-576.
[30] OKADA Y, TSUZUKI Y, R, KOMOTO S, et al. Anti-inflammatory effects of the genus Bif i dobacterium on macrophages by modif i cation of phospho-I kappaB and SOCS gene expression[J]. International Journal of Experimental Pathology, 2010, 90(2): 131-140.DOI:10.1111/j.1365-2613.2008.00632.x.
[31] KONIKOFF T, GOPHNA U. Oscillospira: a central, enigmatic component of the human gut microbiota[J]. Trends in Microbiology,2016, 24(7): 523-524. DOI:10.1016/j.tim.2016.02.015.
[32] TIMS S, DEROM C, JONKERS D M, et al. Microbiota conservation and BMI signatures in adult monozygotic twins[J]. ISME Journal,2013, 7(4): 707-717. DOI:10.1038/ismej.2012.146.
[33] DERRIEN M, COLLADO M C, BENAMOR K, et al. The Mucin degrader Akkermansia muciniphila is an abundant resident of the human intestinal tract[J]. Applied & Environmental Microbiology,2008, 74(5): 1646-1648. DOI:10.1128/AEM.01226-07.
[34] GANESH B P, KLOPFLEISCH R, LOH G, et al. Commensal Akkermansia muciniphila exacerbates gut inf l ammation in Salmonella Typhimurium-infected gnotobiotic mice[J]. PLoS ONE, 2013, 8(9):e74963. DOI:10.1371/journal.pone.0074963.
Effect of Methionine Restriction on Gut Redox Status, Inf l ammation and Microbiota in High-Fat Diet-Fed Mice
ZHANG Yuanhong, YANG Yuhui, WANG Yanan, et al. Effect of methionine restriction on gut redox status, inf l ammation and microbiota in high-fat diet-fed mice[J]. Food Science, 2019, 40(9): 99-106. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20171226-333. http://www.spkx.net.cn