葡萄籽是葡萄汁、葡萄酒生产加工工艺中形成的主要的副产品。作为原花青素的有效来源之一,葡萄籽中富含原花青素二聚体、三聚体以及低聚合度的表儿茶酸[1]。葡萄籽原花青素(grape seed proanthocyanidins extract,GSPE)是有效的自由基清除剂,在人体、动物或细胞中都具有较强的抗氧化能力[2-4];另外研究也发现葡萄籽原花青素可以拮抗砷所致肺组织的炎性改变[5],近年来原花青素抗食管癌(esophageal carcinoma,EC)的作用也屡有报道[6-8],但其机制尚不明确。
细胞凋亡的抑制被认为是癌症发生发展的重要原因[9],许多化学预防药物已被证明是通过诱导细胞凋亡从而起到抗癌的作用;而细胞凋亡主要通过Bax活性改变引起的线粒体凋亡途径调控,有大量的文献研究证实在不同癌组织中均有Bax的低表达和Bcl-2的高表达发生[10-13]。Caspase-3作为Bax/Bcl-2的下游信号通路,其激活与细胞凋亡密不可分。在多项关于抗癌作用的研究中都发现通过Caspase-3的活化诱导癌细胞凋亡是化学预防药物抗癌的主要机制之一[14-16]。然而,Bax/Bcl-2和Caspase-3在GSPE诱导食管癌细胞中的作用鲜有报道。因此本研究通过GSPE干预人食管癌细胞ECA109 24 h,探讨GSPE诱导ECA109细胞凋亡的潜在机制,以期为食管癌的膳食疗法提供参考。
ECA109细胞由新疆石河子大学新疆地方病与民族高发病重点实验室提供,用含体积分数10%胎牛血清的DMEM培养液混匀,在透气型细胞培养瓶中于5% CO2、37 ℃、饱和湿度条件下培养。细胞贴壁后24 h换液一次,细胞长满培养瓶80%以上时传代。取对数生长期细胞用于实验。
葡萄籽原花青素(原花青素质量分数>95%) 天津尖峰生物公司;核因子κB(nuclear factor-kappa B,NF-κB)抑制剂BAY11-7082(BAY)、兔多抗IKK抗体、兔多抗NF-κB(p65)抗体、兔多抗Caspase-3抗体 英国Abcam公司;鼠单抗NF-κB抑制蛋白(inhibitor of NF-κB,IκB)抗体、鼠单抗p-IκB抗体、兔单抗NF-κB抗体(p50) 美国Cell Signaling公司;DMEM、胰蛋白酶、胎牛血清、青霉素-链霉素混合液 美国Hyclone公司。
流式细胞仪 美国Thermo Fisher公司;680型酶标仪美国Bio-Rad公司;B1650001型电泳仪 迪申生物技术(上海)有限公司;ETC 811型聚合酶链式反应(polymerase chain reaction,PCR)仪 北京爱尚阳光科技有限公司。
1.3.1 噻唑蓝法检测GSPE对ECA109的抑制率
将生长状态良好的ECA109细胞用胰蛋白酶消化,用含体积分数10%胎牛血清的DMEM制成细胞悬液。稀释细胞浓度至2h104 个/mL,按每孔100 μL接种于96 孔板(每孔约2h103 个),培养24 h待细胞贴壁后弃去培养液,磷酸盐缓冲液洗板后每孔加DMEM,并分别加入GSPE(0、25、50、100、200、400 μg/mL)和NF-κB信号通路特异性抑制剂BAY11-7082(0、2.5、5、10、15、20 μmol/L),空白对照组加入等体积DMEM,培养24 h后各孔加50 μL噻唑蓝,37 ℃继续培养8 h,弃去孔内液体,每孔加200 μL二甲基亚砜,37 ℃孵育,摇匀,待结晶充分溶解后于490 nm波长处测定OD值。细胞抑制率按如下公式计算。
1.3.2 流式细胞技术检测ECA109细胞的凋亡
GSPE(0、25、50、80 μg/mL)+BAY干预24 h的ECA109细胞培养至对数生长期,胰酶消化后用磷酸盐缓冲液洗涤3 次,使用无血清培养基悬浮细胞并计数,调整细胞浓度为2h106 个/mL,收集细胞,用Annexin V-FITC/PI Apoptosis Kit试剂盒说明书所给的步骤进行处理,每组重复3 次,最后用流式细胞仪检测各组细胞凋亡率。
1.3.3 酶联免疫吸附检测炎性因子及细胞凋亡相关因子
对各组ECA109细胞的C型反应蛋白(C reactive protein,CRP)、前列腺素E2(prostaglandin E2,PGE2)及Bax/Bcl-2的在细胞培养上清液中的分泌水平按照相应的酶联免疫吸附检测试剂盒说明书所给的步骤进行检测,每组重复3 次。
1.3.4 qPCR检测NF-κB相关因子细胞内mRNA水平和Caspase-3 mRNA水平
实时荧光定量PCR(real-time PCR,qPCR)的引物设计如表1所示,其余步骤参考Zhao Boxin等[17]的方法。
表1 qPCR检测NF-κB相关因子和Caspase-3 mRNA所用引物
Table1 Primer sequences used for PCR ampli fi cation ofcaspase-3 and NF-κB related factors

引物 序列(5’-3’)Homo GAPDH F:TCAAGAAGGTGGTGAAGCAGG R:TCAAAGGTGGAGGAGTGGGT Homo IKKa F:TGTACCAGCATCGGGAACTT R:TCAGGAACATCACAGGCCTT Homo IKB F:ACTCCCGACACCAACCATAC R:CTCCGGTTTGTCAAGGTCAG Homo NFKBP65 F:ACCGGATTGAGGAGAAACGT R:ACGTAAAGGGATAGGGCTGG Homo NFKBP50 F:TCGTTTCCGTTATGTATGTGAAGG R:TGTCCTTGGGTCCAGCAGTT Homo Caspase3 F:ACTGGACTGTGGCATTGAGA R:GCACAAAGCGACTGGATGAA
1.3.5 Western blot检测细胞内NF-κB相关因子和Caspase-3蛋白表达水平
ECA109细胞无血清DMEM配制的0、25、50、80 μg/mL GSPE+BAY溶液处理24 h,用磷酸盐缓冲液冰浴洗细胞两次,加入混合蛋白酶抑制剂细胞提取液,12 000 r/min离心10 min。在质量分数12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳中分离细胞抽提物,将所取得的蛋白转移到硝酸纤维素膜。脱脂牛奶室温封闭过夜并添加下列抗体:IKK、IκB、p-IκB、p50、p65、Caspase-3、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)。最后充分洗膜,二抗孵育1 h后再次洗膜,最后显影。每组重复3 次。
实验数据以平均值±标准差表示,用SPSS 20.0软件进行统计学分析。对于多组的均数比较用方差分析;最小显著性差异法分析各组间差异。检验水准α=0.05。
BAY和GSPE均可抑制ECA109细胞的增殖。相比于空白对照组,随着BAY浓度的升高,BAY对ECA109细胞的增殖率抑制效果显著(图1A)。同样的,分别用0、25、50、100、200、400 μg/mL GSPE干预ECA109细胞24 h后,GSPE对ECA109细胞增值率的改变趋势和BAY相似(图1B)。进一步计算得到BAY对EAC109细胞干预24 h的半数抑制浓度(9.71 μmol/L);GSPE对ECA109细胞干预24 h的半数抑制浓度(51.73 μg/mL)。因此,后续实验中选择BAY干预剂量为10 μmol/L;GSPE干预剂量分别为25、50、80 μg/mL。

图 1 BAY(A)和GSPE(B)对ECA109细胞增殖的影响
Fig.1 Effects of BAY (A) and GSPE (B) on cell proliferation in ECA109 cells


图 2 GSPE和BAY诱导ECA109细胞凋亡
Fig.2 GSPE and BAY induce cell apoptosis in ECA109 cells
用流式细胞技术检测BAY和GSPE对ECA109细胞凋亡的影响,发现GSPE单独干预24 h,相比于空白对照组,ECA109细胞凋亡率上升到54.44%,而当25、50、80 μg/mL GSPE与BAY同时干预24 h后,ECA109细胞的凋亡率分别为43.42%、74.60%、82.80%,各组差异均显著(P<0.05)。本实验采用了FITC和PI混合双染。在流式细胞结果图中,Q2象限代表晚期凋亡,而Q4象限代表早期凋亡。BAY+GSPE干预24 h,ECA109细胞早期凋亡量和晚期凋亡量均升高(P<0.05),并呈现剂量依赖关系(图2F)。
由图3可知,空白对照组中,ECA109细胞中PGE2、CRP的分泌处于较高的水平,而施加GSPE对细胞中PGE2、CRP的分泌有抑制作用(P<0.05)。此外,观察了不同剂量GSPE和BAY同时作用24 h后PGE2和CRP的分泌情况,相比于50 μg/mL GSPE组,50 μg/mL GSPE+BAY对PGE2和CRP的抑制作用更强,且随着GSPE质量浓度的增加,PGE2和CRP的分泌量显著降低(P<0.05)。
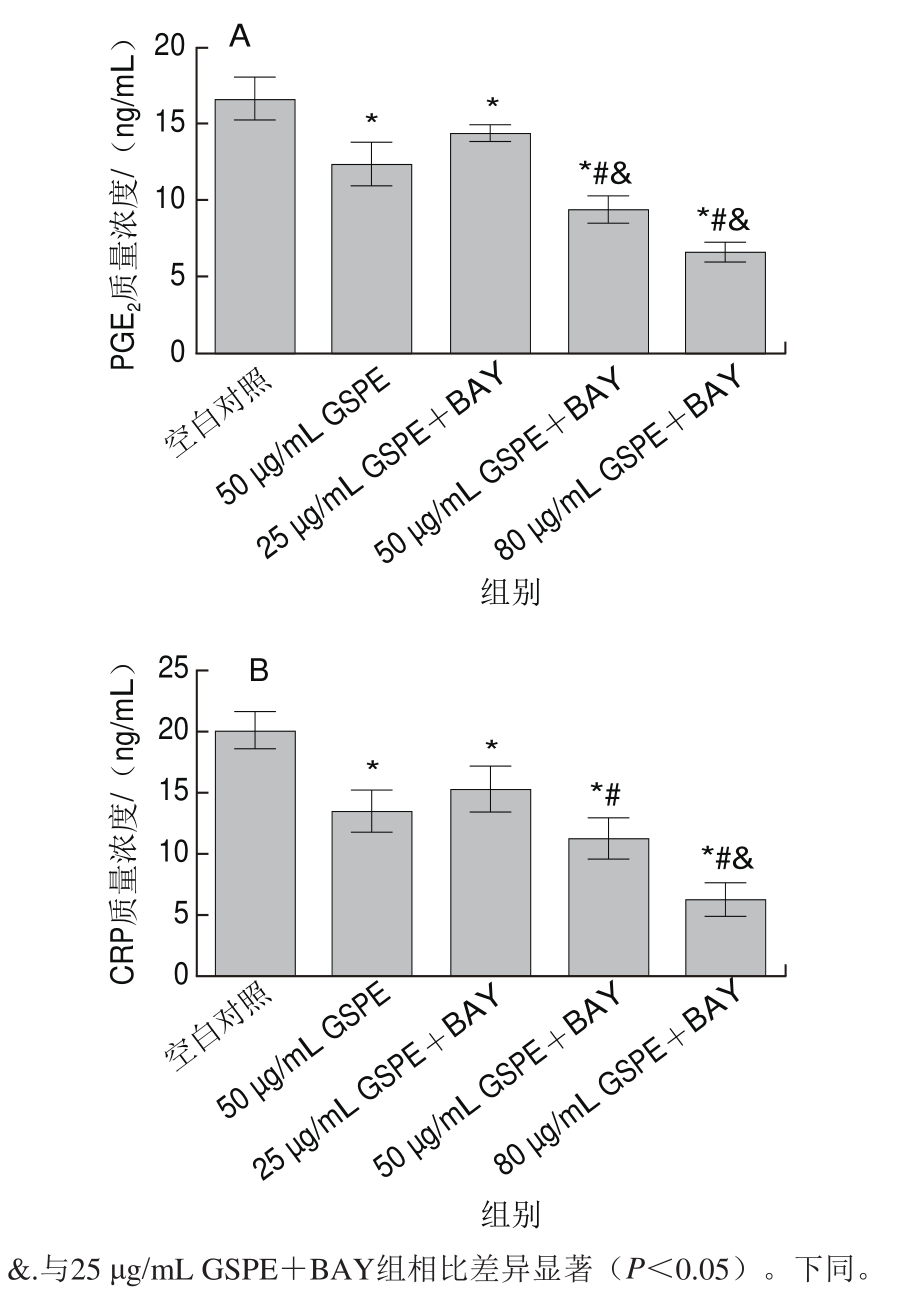
图3 BAY和GSPE对ECA109细胞中PGE2(A)和CRP(B)分泌的影响
Fig.3 Inhibitory effect of BAY and GSPE on secretion of PGE2 and CRP (B) in ECA109 cells
由图4可知,在未施加任何干预处理的ECA109细胞中,Bax表达水平较低而Bcl-2高表达。50 μg/mL GSPE干预24 h可以促进Bax的表达而抑制Bcl-2(P<0.05);进一步观察了不同剂量GSPE和BAY同时作用24 h后Bax和Bcl-2的分泌情况。相比于50 μg/mL GSPE组,50 μg/mL GSPE+BAY对Bax的促进表达作用更强,且GSPE质量浓度越高,Bax的表达量越高(图4A),Bcl-2的表达量越被抑制(图4B)。


图4 BAY和GSPE对ECA109细胞中Bax(A)和Bcl-2(B)蛋白表达的影响
Fig.4 Effects of BAY and GSPE on the protein expression of Bax (A)and Bcl-2 (B) in ECA109 cells
表2 BAY和GSPE对Caspase-3和NF-κB信号通路mRNA表达的影响(n=3)
Table2 Effects of BAY and GSPE on the mRNA expression of Caspase-3and NF-κB signaling (n= 3)

注:a.与空白对照组相比差异显著(P<0.05);b.与50 μg/mL GSPE组相比差异显著(P<0.05);c.与25 μg/mL GSPE+BAY组相比差异显著(P<0.05)。下同。
组别 Caspase-3表达水平IKK表达水平IκB表达水平p65表达水平p50表达水平空白对照 0.67f0.04 1.19f0.15 1.24f0.29 2.11f0.23 2.01f0.06 50 μg/mL GSPE 1.18f0.14a 0.83f0.05a 1.10f0.15 1.08f0.17a 1.26f0.22a 25 μg/mL GSPE+BAY 1.05f0.08ab 1.08f0.13a 0.97f0.13a 1.34f0.11a 1.42f0.05a 50 μg/mL GSPE+BAY 1.23f0.10ab 0.76f0.07ac 0.94f0.05a 0.78f0.09abc 1.08f0.12ab 80 μg/mL GSPE+BAY 1.77f0.26abc 0.49f0.11abc 0.83f0.08ab 0.64f0.06abc 0.81f0.11abc
在正常的ECA109细胞中Caspase-3 mRNA的表达量低,NF-κB通路上IKK、IκB、p65、p50 mRNA的表达量高。当单纯施加BAY干预24 h后,Caspase-3的mRNA表达水平上升,p65、p50和IKK的mRNA表达水平下降,而IκB的mRNA表达水平并没有改变。而在BAY和GSPE同时干预组中,GSPE增强了BAY对Caspase-3、p65、p50 mRNA表达的作用,并使得IKK、IκB的mRNA表达下降。且随GSPE质量浓度的增加,效果越明显(表2)。
用Western blot分别检测了BAY单独干预和BAY+GSPE同时干预24 h后ECA109细胞中Caspase-3和NF-κB信号通路上IKK、IκB蛋白表达的改变,发现了与Caspase-3及NF-κB相关因子mRNA表达相似的改变(图5、表3)。
表 3 BAY和GSPE对Caspase-3和NF-κB信号通路蛋白表达的影响(n=3)
Table3 Effects of BAY and GSPE on protein expression of Caspase-3 and NF-κB signaling (n= 3)
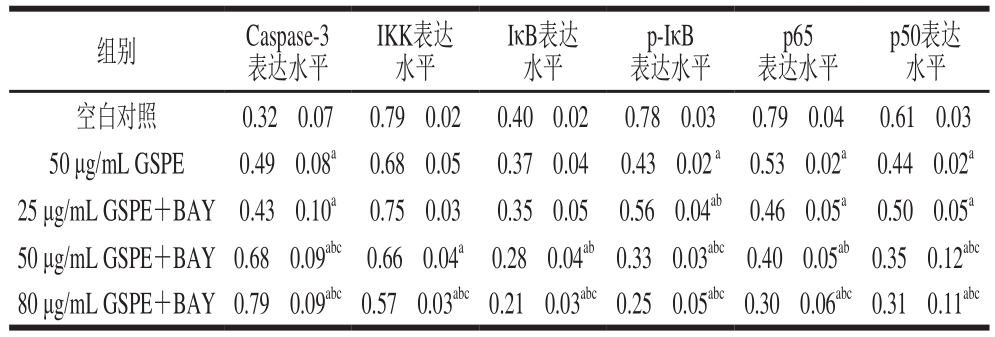
组别 Caspase-3表达水平IKK表达水平IκB表达水平p-IκB表达水平p65表达水平p50表达水平空白对照 0.32f0.07 0.79f0.02 0.40f0.02 0.78f0.03 0.79f0.04 0.61f0.03 50 μg/mL GSPE 0.49f0.08a 0.68f0.05 0.37f0.04 0.43f0.02a 0.53f0.02a 0.44f0.02a 25 μg/mL GSPE+BAY 0.43f0.10a 0.75f0.03 0.35f0.05 0.56f0.04ab 0.46f0.05a 0.50f0.05a 50 μg/mL GSPE+BAY 0.68f0.09abc 0.66f0.04a 0.28f0.04ab0.33f0.03abc0.40f0.05ab0.35f0.12abc 80 μg/mL GSPE+BAY 0.79f0.09abc0.57f0.03abc0.21f0.03abc0.25f0.05abc0.30f0.06abc0.31f0.11abc
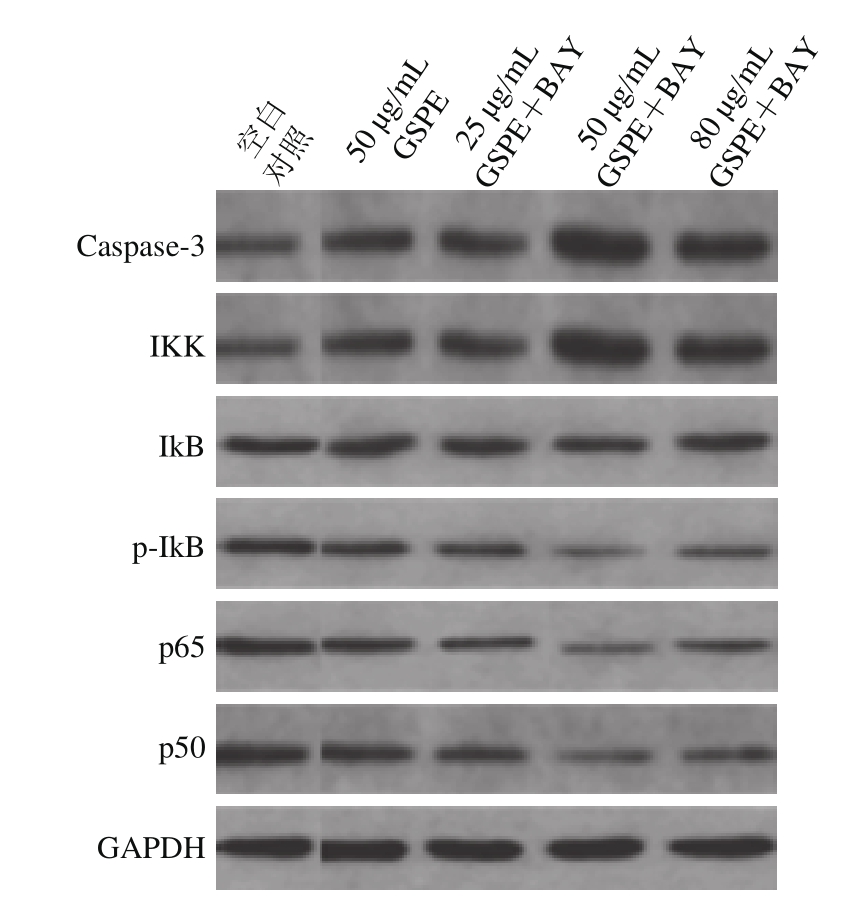
图 5 BAY和GSPE干预对Caspase-3、IKK、IκB、p-IκB、p65、p50蛋白表达的影响
Fig.5 Effects of GSPE and BAY11-7082 on protein expression of Caspase-3 and NF-κB related factors in ECA109 cells
多种植物或膳食补充剂已被证明具有抗癌作用[18-20]。GSPE是这类膳食植物补充剂之一,已被证明具有抗炎[21]、抗肿瘤[22]活性。本次研究测定了不同质量浓度GSPE和BAY作用于ECA109细胞24 h后ECA109细胞的活性,发现GSPE和BAY可以抑制ECA109的增殖和侵袭能力,诱导ECA109细胞凋亡。这些改变都伴随着PGE2、CRP水平降低,Bax和Caspase-3活性增强以及NF-κB信号通路的抑制。
诱导细胞凋亡可能是GSPE抗癌的机制之一。有多个途径介导细胞凋亡[23-24],其中包括Bax蛋白。Bax是Bcl-2蛋白家族成员之一,Bcl-2蛋白家族包括了具有抗凋亡活性的Bcl-2和促凋亡的Bax。正常状态下,Bax与Bcl-2结合,以平衡状态存在于细胞线粒体内,而Bax的激活可使线粒体膜通透性升高,释放出凋亡因子进而使细胞凋亡。BAY和GSPE使细胞中Bax蛋白浓度升高,Bcl-2蛋白浓度下降,这就意味着BAY和GSPE活化了Bax,同时抑制了Bcl-2,使得Bax/Bcl-2的平衡被打破,促进了细胞的凋亡。有证据表明,癌细胞中炎性因子PGE2、CRP水平升高可抑制Bax活性而增强Bcl-2活性,使得细胞无限增殖[25]。同时,GSPE和BAY对PGE2、CRP有明显的抑制作用。为了进一步证明BAY和GSPE介导Bax活性增加,Bcl-2活性减弱,进而引起了ECA109细胞凋亡,本实验检测了Caspase-3的mRNA和Caspase-3蛋白表达的变化。Caspase-3是细胞凋亡的关键因子之一,当Bax/Bcl-2平衡打破,使线粒体膜电位降低,从而凋亡因子被释放到细胞质中,与Caspase结合区结合从而激活Caspase-3引起细胞凋亡。BAY和GSPE促进了Caspase-3的mRNA和Caspase-3蛋白表达,并且BAY和GSPE对Caspase-3的激活有协同作用,这就意味着GSPE和BAY通过活化Bax,抑制Bcl-2的活性,促进了Caspase-3的激活从而诱导了食管癌细胞的凋亡。
NF-κB信号通路参与了多种恶性肿瘤的发生和发展[26]。NF-κB主要是通过影响其下游的多种炎性因子和效应分子Bax/Bcl-2的表达而发挥抗凋亡作用。本研究发现,GSPE和BAY抑制了ECA109细胞中p-IκB的蛋白表达,这意味着GSPE对NF-κB活性的抑制可能是通过抑制IκB的磷酸化实现的。BAY是NF-κB信号通路的特异性抑制剂,同时也被证明为一种有效的癌细胞凋亡诱导剂。通过对比单纯的GSPE干预组,发现GSPE和BAY11-7082同时作用更能够抑制IκB的磷酸化水平。为了证明GSPE通过抑制NF-κB信号通路活性诱导ECA109细胞的凋亡,在单独施加GSPE的基础上设计了BAY与GSPE同时作用的实验,发现GSPE和BAY联合效果好于GSPE单独实验,具有协同作用。这提示了GSPE对NF-κB的抑制是通过抑制IκB的磷酸化实现的,具有与BAY相近的作用,且GSPE和BAY同时作用于ECA109时对NF-κB可能有协同抑制作用。另外,GSPE抑制了细胞中NF-κB p50/p65的mRNA和p50/p65蛋白表达。NF-κB p50/p65是NF-κB信号通路中最常见的异源二聚体,也是NF-κB发挥活性功能的重要蛋白。GSPE抑制NF-κB p50/p65可能由于GSPE抑制了IκB的磷酸化实现的,这与Mackenzie等的研究结果一致[27]。而另外一些研究认为,原花青素对于NF-κB p50/p65表达的抑制可能是由于原花青素的异二聚体可以通过模仿NF-κB p50/p65序列上的精氨酸残基建立氢键从而抑制了p50/p65的表达[28-29]。而本研究尚不能说明GSPE的化学构像是否与NF-κB p50/p65的表达有联系。
综上可知,GSPE对ECA109细胞具有促进凋亡的作用。GSPE通过抑制NF-κB,调控PGE2、CRP的表达,进而活化Bax蛋白,抑制Bcl-2,从而使Caspase-3激活,诱导了细胞凋亡。
本研究阐释了GSPE抗癌的可能的分子机制,但是癌症的发生发展以及癌细胞的迁移和侵袭是多因素多途径的复杂的过程,因此其具体的机制仍需要大量的研究,为进一步探讨原花青素的抗癌作用和原花青素的有效利用提供依据。
[1] ROY A M, BALIGA M S, ELMTS C A, et al. Grape seed proanthocyanidins induce apoptosis through p53, Bax, and caspase 3 pathways[J]. Neoplasia, 2005, 7(1): 24-36. DOI:10.1593/neo.04412.
[2] XU M C, RUI D S, YAN Y Z, et al. Oxidative damage induced by arsenic in mice or rats: a systematic review and meta-analysis[J].Biological Trace Element Research, 2016, 173(2): 1-22. DOI:10.1007/s12011-016-0810-4.
[3] LI S, XU M, NIU Q, et al. Efficacy of procyanidins against in vivo cellular oxidative damage: a systematic review and meta-analysis[J].PLoS ONE, 2015, 10(10): e0139455. DOI:10.1371/journal.pone.0139455.
[4] 徐孟川, 齐燕, 何芳, 等. 原花青素抗氧化损伤作用动物实验研究系统评价[J]. 营养学报, 2016, 38(1): 96-98.
[5] WEI M, GUO F M, RUI D S, et al. Alleviation of arsenic-induced pulmonary oxidative damage by GSPE as shown during in vivo and in vitro experiments[J]. Biological Trace Element Research, 2017(5):1-12. DOI:10.1007/s12011-016-0810-4.
[6] 宓伟, 练武, 尹淑英, 等. 山楂原花青素调节环氧合酶-2表达诱导Eca109食管癌细胞凋亡[J]. 食品科学, 2016, 37(1): 176-181.DOI:10.7506/spkx1002-6630-201601031.
[7] CONNER C A, ADRIANS M, PIERINI R, et al. Procyanidin induces apoptosis of esophageal adenocarcinoma cells via JNK activation of c-Jun[J]. Nutrition & Cancer, 2014, 66(2): 335-341. DOI:10.1007/s12011-016-0810-4.
[8] PIERINI R, KROON P A, GUYOT S, et al. The procyanidinmediated induction of apoptosis and cell-cycle arrest in esophageal adenocarcinoma cells is not dependent on p21(Cip1/WAF1)[J]. Cancer Letters, 2008, 270(2): 234-241. DOI:10.1016/j.canlet.2008.05.004.
[9] WRIGTH S C, ZHONG J, LARRICK J W. Inhibition of apoptosis as a mechanism of tumor promotion[J]. FASEB Journal, 1994, 8(9):654-660. DOI:10.1096/fasebj.8.9.8005393.
[10] 朱玉侠, 赵明星, 姜登鸽, 等. 抑癌基因p53、凋亡抑制基因Bcl-2、促凋亡基因Bax在胃癌及癌前病变中的表达[J]. 胃肠病学和肝病学杂志, 2016, 25(9): 1040-1043. DOI:10.3969/j.issn.1006-5709.2016.09.019.
[11] 于泽奇, 程世翔, 涂悦, 等. Ki-67、Bcl-2、Bax和Caspase-3在脑胶质瘤组织中的表达及临床意义[J]. 中国医药导报, 2017, 14(5): 9-12.
[12] GIOTAKIS A I, KONTOS C K, MANOLOPOULOS L D, et al. High BAX/BCL2 mRNA ratio predicts favorable prognosis in laryngeal squamous cell carcinoma, particularly in patients with negative lymph nodes at the time of diagnosis[J]. Clinical Biochemistry, 2016, 49(12):890-896. DOI:10.1016/j.clinbiochem.2016.04.010.
[13] GAO M, LI Y, JI X, et al. Disturbance of Bcl-2, Bax, Caspase-3,Ki-67 and C-myc expression in acute and subchronic exposure to benzo(a)pyrene in cervix[J]. Acta Histochemica, 2016, 118(2): 63-73.DOI:10.1016/j.acthis.2015.11.002.
[14] KHAZAEI S, RAMACHANDRAN V, ABDUL H R, et al. Flower extract of Allium atroviolaceum triggered apoptosis, activated caspase-3 and down-regulated antiapoptotic Bcl-2 gene in HeLa cancer cell line[J]. Biomedicine & Pharmacotherapy, 2017, 89: 1216-1226.DOI:10.1016/j.biopha.2017.02.082.
[15] SERGEEVA T F, SHIRMANOVA M V, ZLOBOVSKAYA O A, et al.Relationship between intracellular pH, metabolic co-factors and caspase-3 activation in cancer cells during apoptosis[J]. Biochimica et Biophysica Acta-Molecular Cell Research, 2017, 1864(3): 604-611.DOI:10.1016/j.bbamcr.2016.12.022.
[16] 任丽平, 李先佳, 金少举. 基于Caspase-3/Bcl-2/Bax信号通路的槐定碱诱导胰腺癌细胞株capan-1凋亡机制研究[J]. 中国现代应用药学,2017, 16(3): 325-328.
[17] ZHAO Boxin, SUN Yabin, WANG Shegnqi, et al. Grape seed procyanidin reversal of P-glycoprotein associated multi-drug resistance via down-regulation of NF-κB and MAPK/ERK mediated YB-1 activity in A2780/T cells[J]. PLoS ONE, 2013, 8(8): e71071.DOI:10.1371/journal.pone.0071071.
[18] 赵博琛. 当归有效组分配伍应用的结直肠癌化学预防效果评价及机理研究[D]. 北京: 北京中医药大学, 2015: 36-42.
[19] BODE A, 董子钢. 发现癌症化学预防分子靶标的策略[J]. 化学进展, 2013, 25(9): 1501-1516. DOI:10.7536/PC130716.
[20] 许斌斌, 李达周, 王雯. 家族性腺瘤性息肉病及其癌变的化学预防[J]. 临床消化病杂志, 2015(2): 119-123. DOI:10.3870/lcxh.j.issn.1005-541X.2015.02.21.
[21] LEE J W, KIM Y I, KIM Y, et al. Grape seed proanthocyanidin inhibits inf l ammatory responses in hepatic stellate cells by modulating the MAPK, Akt and NF-κB signaling pathways[J]. International Journal of Molecular Medicine, 2017, 40(1): 226-234. DOI:10.3892/ijmm.2017.2997.
[22] 王华, 刘霞, 杨继红, 等. 葡萄籽原花青素抗癌活性及其机制研究进展[J]. 安徽大学学报(自然科学版), 2012, 36(4): 101-108.DOI:10.3969/j.issn.1000-2162.2012.04.019.
[23] CHEN M S, CHIEN Y C, LU T T, et al. A novel benzofuran derivative, ACDB, induces apoptosis of human chondrosarcoma cells through mitochondrial dysfunction and endoplasmic reticulum stress[J]. Oncotarget, 2016, 7(50): 83530-83543. DOI:10.18632/oncotarget.13171.
[24] 李敏, 林俊. 细胞凋亡途径及其机制[J]. 国际妇产科学杂志, 2014,41(2): 103-107.
[25] LALIER L, CARTRON P F, PEDELABORDE F, et al. Increase in PGE2 biosynthesis induces a Bax dependent apoptosis correlated to patients survival in glioblastoma multiforme[J]. Oncogene, 2007,26(34): 4999-5009. DOI:10.1038/sj.onc.1210303.
[26] LI F, ZHANG J, ARFUSO F, et al. NF-κB in cancer therapy[J].Archives of Toxicology, 2015, 89(5): 711-31. DOI:10.1007/s00204-015-1470-4.
[27] MACKENZIE G G, ADAMO M, DEKER N P, et al. Dimeric procyanidin B2 inhibits constitutively active NF-κB in Hodgkin’s lymphoma cells independently of the presence of IkB mutations[J].Biochemical Pharmacology, 2008, 75: 1461-1471. DOI:10.1016/j.bcp.2007.12.013.
[28] FRAGA C G, OTEIZA P I, VERSTRAETEN S V, et al. Antioxidant and membrane effects of procyanidin dimers and trimers isolated from peanut and cocoa[J]. Journal of Agricultural and Food Chemistry,2005, 53: 5041-5048. DOI:10.1021/jf058018m.
[29] FRAGA C G, OTEIZA P I. Dietary flavonoids: role of(-)-epicatechin and related procyanidins in cell signaling[J]. Free Radical Biology and Medicine, 2011, 51: 813-823. DOI:10.1016/j.freeradbiomed.2011.06.002.
Effect of Grape Seed Proanthocyanidins Extract on Apoptosis Induction in Human Esophageal Cancer Cells ECA109
GUO Fangming, LI Shugang, SONG Guanling, et al. Effect of grape seed proanthocyanidins extract on apoptosis induction in human esophageal cancer cells ECA109[J]. Food Science, 2019, 40(9): 115-121. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20180202-024. http://www.spkx.net.cn