IFN-γ/IL-4随着致敏性的增强而减小。因此,推测虾制品激发过敏豚鼠的Th1/Th2细胞平衡向Th2细胞偏移。
食物过敏是机体免疫系统对机体摄入的食物产生的、由免疫介导的不良反应,又称为食物超敏反应[1]。多数食物过敏是由免疫球蛋白(immunoglobulin,Ig)E介导的I型过敏反应,主要包括致敏阶段和效应阶段。
致敏阶段即机体初次摄入食物后,过敏原穿过肠黏膜,被肠黏膜抗原递呈细胞(antigen-presenting cell,APC)捕获,通过受体介导的吞噬作用进入APC细胞中,与APC中的泛素共价连接而被激活,这些泛素化的过敏原移至蛋白体复合物并被降解为多肽片段。含有抗原决定簇的已降解的多肽片段与主要组织相容性复合物II(major histocompatibility complex II,MHC-II)类分子结合,然后表达于细胞表面被未经修饰的CD4+T细胞识别[2],有效地激活幼稚CD4+T细胞增殖分化成辅助性T(helper T,Th)细胞亚群,Th细胞可分成Th1或Th2两大类[3]。Th1细胞主要介导机体细胞免疫应答,在抗感染、急性排斥反应、器官移植排斥反应和自身免疫病的诱导过程中起重要作用[4-6]。Th2细胞主要介导机体体液免疫应答,辅助抗体生成,在过敏反应中起主导作用,使抗原特异B细胞分泌IgG和IgE抗体[4-6]。Th2细胞分泌的白细胞介素(interleukin,IL)-4、IL-5、IL-6、IL-10等细胞因子诱导B细胞类别转换以及分泌过敏原特异性IgE,特异性IgE可与肥大细胞和嗜碱性粒细胞表面高亲和力受体FcεRI结合,成为致敏肥大细胞和嗜碱性粒细胞,致使机体处于致敏状态。而IgE可以促进肥大细胞表面FcεRI的表达以及其他介质的释放[7]。同时Th1细胞分泌的IL-2、干扰素-γ(interferon-γ,IFN-γ)也可以促进B细胞增殖分化。IL-3和IL-4可以协同刺激肥大细胞的增殖。
过敏反应的效应阶段即机体再次接触过敏原时,B细胞迅速分泌大量的特异性IgE抗体并扩散至全身,FcεRI与IgE-过敏原复合物相交联,引发肥大细胞、嗜碱性粒细胞活化脱颗粒,释放出组胺(histamine,HIS)、白三烯、5-羟色胺等活性物质,使机体的平滑肌收缩、毛细血管扩张、血管通透性增强,导致机体的组织液渗出,引起水肿,作用于皮肤、肠道、呼吸道甚至全身,从而引起荨麻疹、过敏性胃肠炎、哮喘、变应性鼻炎、过敏性休克等一系列症状[8]。
虾制品主要包括虾仁[9-10]、虾肉及其制品[11-12]、虾蛋白[13-14]等,除了加工研究外,对海虾过敏原及其致敏性研究[15-18]较多,但对其致敏性消减前后相关细胞因子的变化研究较少。Schiavi等[19]用虾原肌球蛋白建立过敏小鼠动物模型,研究了8 种肠道益生菌对小鼠过敏反应的影响。结果显示,益生菌处理组血清中转化生长因子-β、IL-10和IFN-γ质量浓度相比对照组增加,IgE含量,IL-4、IL-5、IL-13等细胞因子质量浓度,HIS质量浓度,过敏反应评分相比对照组有所降低。因此,益生菌处理可以缓解小鼠过敏反应,使得小鼠体内的免疫应答由Th细胞向Th2细胞偏移并逐渐恢复平衡状态。
本研究采用超高压酶法消减致敏性,以致敏性消减程度不同的南美白对虾的虾仁、虾肉和虾蛋白为原料,以豚鼠为受试动物,建立食物过敏模型。检测过敏豚鼠血清中IgE、HIS和相关细胞因子(IL-1、IL-2、IL-3、IL-4、IL-6、IL-10、IFN-γ、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α))的变化情况,观察细胞因子与食物过敏的相关性,并推断食物过敏对Th细胞平衡的影响。
英国种Hartly豚鼠(体质量为220~240 g)购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2014-0004。
南美白对虾 天津市韩家墅水产批发市场;海虾过敏豚鼠血清 天津商业大学食品毒理实验室制备;胰蛋白酶、二硫苏糖醇、牛血清白蛋白、吐温20、辣根过氧化物酶(horseradish peroxidase,HRP)标记的兔抗豚鼠IgG抗体 美国Sigma公司;丙酮(分析纯)天津市凯通化学试剂有限公司;氯化钾(分析纯)、盐酸(分析纯)、双氧水(体积分数30%) 天津市赢达稀贵化学试剂厂;邻苯二胺(分析纯) 天津市科密欧化学试剂有限公司;豚鼠IgE、HIS、IL-1β、IL-2、IL-3、IL-4、IL-6、IL-10、IFN-γ、TNF-α的酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 北京博奥拓达科技有限公司。
DC-2030节能型智能恒温槽、Scientz-50N冷冻干燥机宁波新芝生物科技股份有限公司;UV-2100紫外-可见分光光度计 上海尤尼柯仪器有限公司;HPPL2-800/2.5型超高压设备 华泰森淼生物工程技术有限公司;JJ-2型组织捣碎匀浆机 常州国华电器有限公司;FE20型pH计 梅特勒-托利多仪器(上海)有限公司;L535-1型低速离心机 湘仪离心机仪器有限公司;VELP漩涡振荡器 德祥科技有限公司;SpectraMax 190型酶标分析仪 深圳市山特科技有限公司。
1.3.1 高压结合酶法制备低致敏性虾制品
根据文献[20]确定的高压结合酶法消减虾仁致敏性的条件,制备低致敏性虾制品,方法略有改变。
低致敏性虾蛋白的制备:将新鲜的南美白对虾与生理盐水1∶1(m/V)混合匀浆,预冷5 min后加入冷丙酮(-20 ℃预冷过夜)脱脂肪,低温离心后收集沉淀物移至干净滤纸上,分散自然风干,即为丙酮粉。将丙酮粉与1 mol/L KCl抽提液(含有5 mmol/L二硫苏糖醇)按1∶15(m/V)的比例4 ℃条件下抽提过夜(12~17 h)后于4 000 r/min、4 ℃条件下离心30 min,收集上清液,沉淀物与抽提液按1∶15(m/V)比例继续在4 ℃下静置提取4 h,按上述条件离心后收集上清液,两次上清液合并即为蛋白粗提取液,蛋白粗提取液经透析后冷冻干燥获得虾仁蛋白。将获得的虾仁蛋白在冰温下加酶溶液混匀,真空密封后在超高压下加酶水解。
低致敏性虾肉制备:将新鲜虾仁用组织捣碎匀浆机处理,在冰温下将虾肉与酶液按比例混匀,真空密封后在高压下加酶水解。
低致敏性虾仁制备:将新鲜虾仁称质量,按照1 孔/cm2的密度对虾仁进行打孔,在冰温下将虾仁与胰蛋白酶溶液按照比例混合,真空密封后,在高压下进行酶解。
超高压处理条件为40 ℃、压力200 MPa、保压时间40 min;处理虾蛋白时,加酶量为2 000 U/g底物、蛋白质量分数为3%;处理虾肉时,加酶量为3 000 U/g虾肉、虾肉与酶溶液质量比为150∶100;处理虾仁时,加酶量为3 000 U/g虾仁、虾仁与酶溶液的质量比为150∶100。经超高压下酶解处理的虾肉和虾仁,分别制备丙酮粉,提取虾蛋白。用ELISA法检测其致敏性,对照组为磷酸盐缓冲液(phosphate buffered saline,PBS),各组均在492 nm波长处测定OD值,根据下式计算致敏性的消减率。
1.3.2 过敏豚鼠血清的制备
参考文献[21]的方法,将英国种Hartly豚鼠随机分为7 组,每组8 只,雌雄各半。其中包括阴性对照组(pH 7.5 PBS)、阳性对照组(未处理虾蛋白)、实验组(经处理的3 种样品,即消减致敏性的虾蛋白、消减致敏性后虾肉和虾仁的提取蛋白);另外,设置两组只致敏不激发的实验组(一组是PBS致敏不激发;另一组为未处理虾蛋白致敏不激发),直接取血清备用。
将以上7 组豚鼠进行致敏处理,阴性对照组用PBS腹腔注射、阳性对照组和实验样品组腹腔注射未处理的虾蛋白溶液(pH 7.5的PBS溶解,蛋白质量浓度为0.1 g/100 mL)进行致敏。腹腔注射用量均为每只每次1.0 mL,隔日注射1 次,共计3 次。在致敏期间,每天两次观察记录豚鼠的反应,其中包括一般状态、进食、排泄物、有无过敏反应表现等。
在末次致敏后第10天将实验组豚鼠进行激发(不包括只致敏不激发的实验组)。阴性对照组静脉注射PBS,阳性对照组注射未处理的虾蛋白,样品组注射高压结合酶处理后样品(处理的虾蛋白和处理后虾肉、虾仁提取的蛋白均用PBS溶解,质量浓度为0.1 g/100 mL)。静脉注射用量均为每只每次2.0 mL。激发后立即观察豚鼠在60 min内的反应。然后,将包括只致敏不激发实验组在内的豚鼠,分别颈动脉取血,静置10~20 min后离心收集血清,-80 ℃保存备用。
1.3.3 豚鼠血清中IgE的检测
标准品的稀释:先将标准品冻干粉用标准品稀释液定容到150 μL,然后混匀即为标准品原液。取5 支干净的Eppendorf管,分别标记上120、60、30、15、7.5 U/mL,每管加150 μL的标准品稀释液,取150 μL标准品原液加入标记120 U/mL的管中,混匀后同样取出150 μL,加入下一管,以此类推直至最后一管。
加样:将试剂盒在室温下平衡0.5 h再加样。空白孔用于调零不加样(只加显色剂A、B和终止液);标准品孔每孔加入稀释好的标准品50 μL,零孔加入标准品稀释液50 μL,然后加入生物素抗原工作液50 μL(零孔作为标准曲线的最后一个点);样品孔加入样品50 μL,然后加入生物素抗原工作液50 μL。轻轻摇晃,盖上封板膜,37 ℃培养箱中保温30 min。
洗涤:揭掉封板膜,弃去试剂盒各孔中的液体并甩干,然后向每孔加满洗涤液(将25 倍浓缩洗涤液用蒸馏水25 倍稀释),静置30 s后弃去,如此重复5 次,拍干。
加样:标准品孔和样品孔中加入50 μL亲和素-HRP,轻轻摇晃,盖上封板膜,37 ℃培养箱中保温30 min。
洗涤:揭掉封板膜,弃去试剂盒各孔中的液体并甩干,然后向每孔加满洗涤液(将25 倍浓缩洗涤液用蒸馏水稀释25 倍),静置30 s后弃去,如此重复5 次,拍干。
显色:每孔先加入50 μL显色剂A,再加入50 μL显色剂B,轻轻振荡混匀,37 ℃避光显色10 min。
终止:每孔加入50 μL终止液终止反应(此时蓝色立转黄色)。
测定:加入终止液后,立即用空白孔调零,依序测量各孔的光密度值(OD450 nm)。
计算:根据浓度和OD450 nm算出标准曲线的回归方程,使用ELISAcalc软件进行计算,拟合模型选用Logistic曲线。
1.3.4 豚鼠血清中HIS的检测
标准品的稀释:先将标准品冻干粉用标准品稀释液定容到150 μL,然后混匀即为标准品原液。取5 支干净的Eppendorf管,分别标记120、60、30、15、7.5 μg/mL,每管加150 μL的标准品稀释液,取150 μL标准品原液加入标记为120 μg/mL的管中,混匀后同样取出150 μL,加入下一管,以此类推直至最后一管。其他操作同1.3.3节。
1.3.5 豚鼠血清中相关细胞因子检测
1.3.5.1 IL-1的检测
标准品的稀释:先将标准品冻干粉用标准品稀释液定容到150 μL,然后混匀即为标准品原液。取5 支干净的Eppendorf管,分别标记上120、60、30、15、7.5 ng/L,每管加150 μL的标准品稀释液,取150 μL标准品原液加入标记120 ng/L的管中,混匀后同样取出150 μL,加入下一管,以此类推直至最后一管。其他操作同1.3.3节。
1.3.5.2 IL-2的检测
标准品的稀释:先将标准品冻干粉用标准品稀释液定容到150 μL,然后混匀即为标准品原液。取5 支干净的Eppendorf管,分别标记上320、160、80、40、20 ng/L,每管加150 μL的标准品稀释液,取150 μL标准品原液加入标记320 ng/L的管中,混匀后同样取出150 μL,加入下一管,以此类推直至最后一管。其他操作同1.3.3节。
1.3.5.3 IL-3的检测
标准品的稀释:先将标准品冻干粉用标准品稀释液定容到150 μL,然后混匀即为标准品原液。取5 支干净的Eppendorf管,分别标记上400、200、100、50、25 ng/L,每管加150 μL的标准品稀释液,取150 μL标准品原液加入标记400 ng/L的管中,混匀后同样取出150 μL,加入下一管,以此类推直至最后一管。其他操作同1.3.3节。
1.3.5.4 IL-4的检测
标准品的稀释:先将标准品冻干粉用标准品稀释液定容到150 μL,然后混匀即为标准品原液。取5 支干净的Eppendorf管,分别标记上160、80、40、20、10 ng/L,每管加150 μL的标准品稀释液,取150 μL标准品原液加入标记160 ng/L的管中,混匀后同样取出150 μL,加入下一管,以此类推直至最后一管。其他操作同1.3.3节。
1.3.5.5 IL-6的检测
IL-6的检测操作与IL-2的检测相同。
1.3.5.6 IL-10的检测
标准品的稀释:先将标准品冻干粉用标准品稀释液定容到150 μL,然后混匀即为标准品原液。取5 支干净的Eppendorf管,分别标记上640、320、160、80、40 ng/L,每管加150 μL的标准品稀释液,取150 μL标准品原液加入标记640 ng/L的管中,混匀后同样取出150 μL,加入下一管,以此类推直至最后一管。其他操作同1.3.3节。
1.3.5.7 IFN-γ的检测
标准品的稀释:先将标准品冻干粉用标准品稀释液定容到150 μL,然后混匀即为标准品原液。取5 支干净的Eppendorf管,分别标记上800、400、200、100、50 ng/L,每管加150 μL的标准品稀释液,取150 μL标准品原液加入标记800 ng/L的管中,混匀后同样取出150 μL,加入下一管,以此类推直至最后一管。其他操作同1.3.3节。
1.3.5.8 TNF-α的检测
标准品的稀释:先将标准品冻干粉用标准品稀释液定容到150 μL,然后混匀即为标准品原液。取5 支干净的Eppendorf管,分别标记640、320、160、80、40 ng/L,每管加150 μL的标准品稀释液,取150 μL标准品原液加入标记640 ng/L的管中,混匀后同样取出150 μL,加入下一管,以此类推直至最后一管。其他操作同1.3.3节。
所有实验数据采用SPSS 16.0统计软件对结果进行显著性分析,处理结果均以平均值±标准差表示,图表制作利用Origin 8和Excel 2007软件。
用未处理虾蛋白进行致敏,分别用未处理虾蛋白、处理后的虾蛋白、处理后虾肉和虾仁提取的蛋白激发豚鼠,然后收集各组豚鼠血清,用ELISA试剂盒测定血清中IgE的含量,血清中IgE含量的变化见图1。
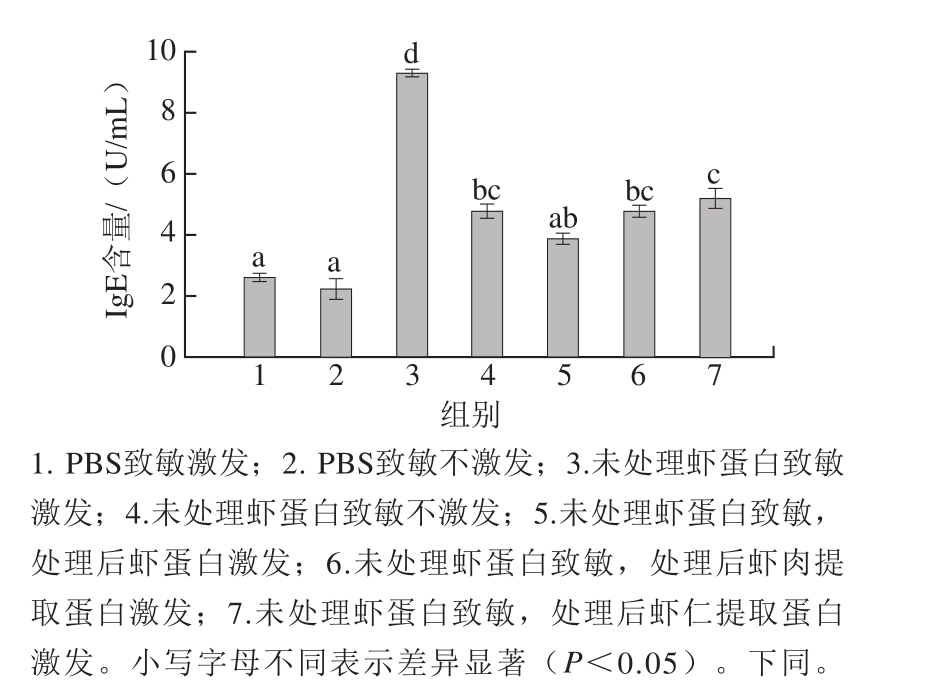
图1 豚鼠血清中IgE的含量
Fig.1 IgE levels in serum of guinea pigs
阴性对照组(组1)血清中I g E的含量为(2.639f0.154)U/mL,阳性对照组(组3)血清中IgE的含量为(9.314f0.120)U/mL。因此,虾蛋白引起的过敏反应能够引发IgE分泌量的增加。另外,用未处理的虾蛋白致敏不激发(组4),豚鼠血清中IgE的含量为(4.781f0.230)U/mL,说明初次致敏也会使血液中IgE的分泌量显著增加。
阳性对照组(组3)与样品组(组5~7)血清中IgE的含量均有显著性差异(P<0.05)。高压结合酶处理后的虾蛋白组(组5)与阴性对照组(组1)血清中IgE含量无显著性差异(P>0.05)。而高压结合酶处理后的虾仁组(组7)、高压结合酶处理后的虾肉组(组6)与阴性对照组存在显著差异(P<0.05);与阳性对照未激发组(组4)IgE含量无显著性差异(P>0.05)。因此,高压结合酶处理后的虾仁、虾肉、虾蛋白致敏性均得到了有效改善,其中高压结合酶处理后的虾蛋白致敏性消减效果要优于虾仁及虾肉组。另外,比较组5~7的结果也可发现,处理的样品基质环境(溶解的虾蛋白、虾肉、整体虾仁)对致敏性消减效果存在影响;处理样品组与组4的结果相比,说明致敏性虽然不能完全消减,但能够达到或优于初次致敏的水平。
傅玲琳等[22]研究了乳酸菌对虾原肌球蛋白致敏性的消减作用,检测过敏后小鼠血清中特异性抗体IgE含量增加。Zhang Lili等[23]通过用卵清蛋白致敏的小鼠模型研究双歧杆菌对小鼠过敏反应的抑制作用,发现食物过敏小鼠血清中IL-4、IgE含量增加,双歧杆菌可以抑制过敏小鼠体内IL-4、IgE的产生,并抑制小肠中Th2反应。张浩等[24]通过卵白蛋白建立致敏的小鼠模型研究食物过敏小鼠血清中特异性抗体IgE的变化,结果表明过敏小鼠血清中IgE含量明显增加。

图2 豚鼠血清中HIS的质量浓度
Fig.2 HIS levels in serum of guinea pigs
由图2可知,阴性对照组(组1)HIS的质量浓度为(7.153f0.804)μg/mL,阳性对照组(组3)HIS的质量浓度为(33.097f1.513)μg/mL。因此,虾蛋白引发的食物过敏会导致更多的HIS释放。另外,用未处理的虾蛋白致敏不激发(组4),豚鼠血清中HIS质量浓度为(18.014f1.055)μg/mL,说明初次致敏也会使得血清中HIS质量浓度发生显著性变化。
阳性对照组(组3)与样品组(组5~7)血清中HIS质量浓度均有显著性差异(P<0.05);阴性对照组(组1)与样品组(组5~7)血清中HIS质量浓度均有显著性差异(P<0.05);高压结合酶处理后的虾蛋白(组5)、高压结合酶处理后的虾肉(组6)和虾仁(组7)与阳性对照未激发组(组4)血清中HIS质量浓度无显著性差异。这表明,过敏使得HIS释放量增加,过敏性越强,HIS的释放量越多;高压结合酶处理后的虾仁及其制品的致敏性均得到了有效改善,其中高压结合酶处理后的虾蛋白致敏性消减效果要优于虾仁及虾肉组,该结果与ELISA检测结果的趋势一致;但ELISA检测(处理虾蛋白的致敏性消减率为97.04%、虾肉的致敏性消减率为95.00%、虾仁的致敏性消减率为94.50%)结果与体内检测相比,在致敏强度方面还存在差异。但处理的样品组与组4相比,处理样品虽然不能完全消除致敏性,但可达到初次致敏的水平。
HIS主要是由过敏反应效应阶段致敏的肥大细胞和嗜碱性粒细胞分泌的一种化学递质。它在过敏反应中起到重要的作用,可使机体的平滑肌收缩、毛细血管扩张、血管通透性增强,导致机体的组织液渗出,引起水肿,作用于皮肤、肠道、呼吸道甚至全身,从而引起荨麻疹、过敏性胃肠炎、哮喘、变应性鼻炎、过敏性休克等一系列症状[8]。HIS是肥大细胞脱颗粒标志物,是过敏反应中基本的病理和生理反应[25]。李洁等[26]检测了不同季节过敏性鼻炎患者血清中HIS的含量,发现冬季是鼻炎的高发季,过敏性鼻炎患者血清中HIS含量升高,本研究的结果与其研究结果一致。
2.3.1 IL-1的变化

图3 豚鼠血清中IL-1质量浓度
Fig.3 IL-1 levels in serum of guinea pigs
正常情况下体内IL-1含量很少,绝大多数是外来的抗原刺激巨噬细胞、单核细胞、内皮细胞等细胞合成和分泌的,主要可以发挥免疫调节的作用:可以与抗原协同刺激APC,增强APC递呈抗原的能力;促进T细胞活化,促进T细胞产生IL-2;促进B细胞增殖分化、促进抗体的分泌;募集中性粒细胞,参与炎症反应;还可以诱导机体产生IL-6[27]。
由图3可知,阴性对照组I L-1质量浓度为(4.074f0.383)ng/L,阳性对照组IL-1质量浓度为(21.147f0.339)ng/L,表明过敏原可以刺激豚鼠体内IL-1的合成与分泌。
高压结合酶处理后的虾蛋白(组5)、虾肉(组6)、虾仁(组7)与阳性对照组(组3)血清中IL-1质量浓度均有显著性差异(P<0.05);其变化趋势与3 种制品致敏性消减的趋势(处理后虾蛋白、虾肉、虾仁的致敏性消减率分别为97.04%、95.00%、94.50%)一致,致敏性消减率越高,IL-1分泌越少;同时,该结果与血清中IgE(图1)和HIS(图2)水平的变化趋势相同。因此,IL-1与食物过敏具有相关性。
Park等[28]通过观察大鼠肥大细胞脱颗粒以及测定IL-1、IL-6、TNF-α等炎症细胞因子的变化评价南非天竺葵(Pelargonium sidoides,PS)和黄连在体外和体内的抗炎作用,证明了PS和黄连可以有效的抑制肥大细胞脱颗粒,并抑制IL-1、IL-6、TNF-α等炎症细胞因子的分泌,其结果与本实验结果一致。
2.3.2 IL-2的变化
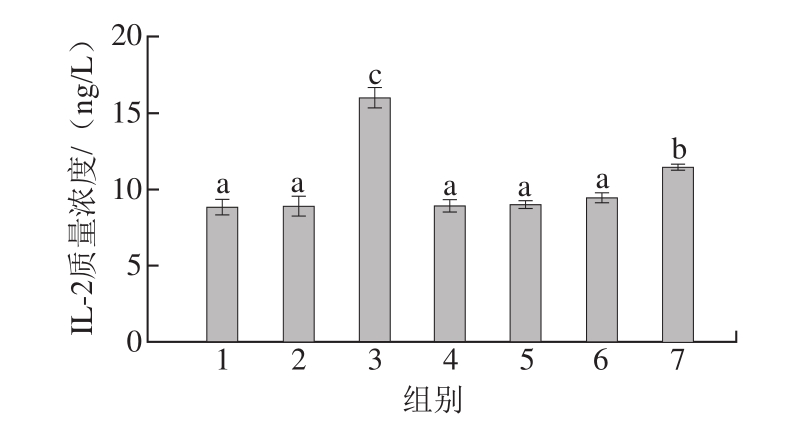
图4 豚鼠血清中IL-2质量浓度
Fig.4 IL-2 levels in serum of guinea pigs
由图4可知,阴性对照组I L-2质量浓度为(8.829f0.564)ng/L,阳性对照组IL-2质量浓度为(16.029f0.671)ng/L。因此,过敏原可以刺激豚鼠体内IL-2的合成与分泌。
高压结合酶处理后的虾蛋白(组5)、虾肉(组6)、虾仁(组7)与阳性对照组(组3)血清中IL-2质量浓度均有显著性差异(P<0.05);处理后的虾蛋白(组5)、虾肉(组6)与阴性对照组(组1)无显著差异(P>0.05)。因此,过敏原致敏性消减率越高,豚鼠体内IL-2质量浓度越低;各样品组血清中IL-2的变化趋势与血清中IgE(图1)和HIS(图2)水平的变化趋势基本一致。因此,IL-2与食物过敏具有相关性。
IL-2主要是由活化的Th1细胞产生,作为Th1细胞的自分泌细胞因子,不仅可以刺激Th1细胞产生干扰素γ(interferon-γ,IFN-γ)、IL-12,增强自然杀伤(natural killer,NK)细胞、巨噬细胞的作用和细胞毒性[29-31];还可以促进Th2细胞的活化[32]。刘志昂等[33]通过检测过敏性鼻炎患者在治疗前后血清中IL-2、IL-6水平的变化发现,与正常对照组相比,过敏性鼻炎患者血清中IL-2、IL-6水平显著升高,其结果与本实验结果一致。
2.3.3 IL-3的变化
IL-3主要是Th2细胞分泌的多效性细胞因子[34-35],但在一定的条件下肥大细胞、嗜碱性粒细胞、肺巨噬细胞等也产生IL-3。IL-3主要参与T、B淋巴细胞发育,调节Th1/Th2细胞功能,促进IgE的合成、诱导嗜酸性粒细胞游走,在哮喘的发病中发挥重要作用[36-37]。
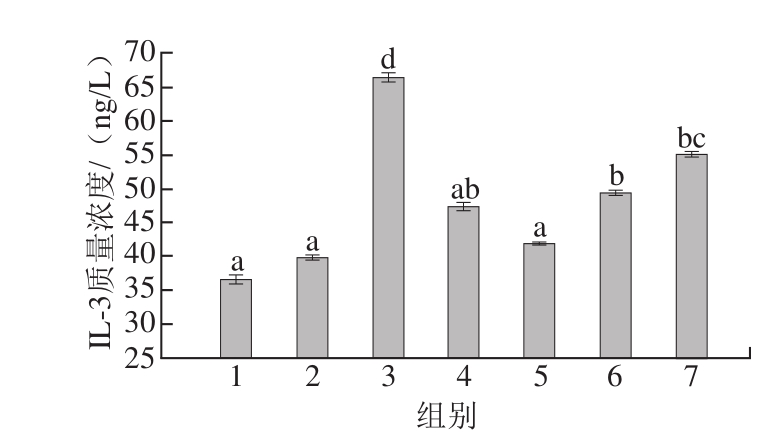
图5 豚鼠血清中IL-3质量浓度
Fig.5 IL-3 levels in serum of guinea pigs
由图5可知,阴性对照组(组1)IL-3质量浓度为(36.502f0.687)ng/L,阳性对照组(组3)IL-3质量浓度为(63.305f0.635)ng/L。阳性对照组IL-3质量浓度与其他组(组4~7)均有显著性差异(P<0.05),表明过敏原可以刺激豚鼠体内IL-3的合成与分泌;高压结合酶处理后虾蛋白(组5)与阴性对照组(组1)、阴性对照未激发组(组2)、阳性对照未激发组(组4)血清中IL-3质量浓度无显著性差异(P>0.05);高压结合酶处理后的虾肉(组6)、虾仁组(组7)血清中IL-3质量浓度无显著性差异(P>0.05),但与阴性对照组存在显著差异(P<0.05)。该结果与ELISA检测的结果虽然存在差异,但趋势是一致的,即过敏原消减效果越好,IL-3的分泌量越少。另外,各样品组的血清中IL-3变化趋势与血清中IgE(图1)和HIS(图2)水平的变化趋势相同。因此,IL-3与食物过敏具有相关性。
江茵等[38]在黄芪多糖对哮喘大鼠气道炎症及IL-3表达影响的研究中发现,哮喘模型组的肺组织中IL-3的表达最强,通过黄芪多糖治疗后,其IL-3的表达量显著减少,推测其是通过抑制IL-3的表达来实现抑制哮喘大鼠的气道炎症。邓辉雨[39]在过敏性哮喘儿童血清IgE、IL-3、IL-4的影响研究中发现,IL-3、IL-4在支气管哮喘患儿中的水平明显高于对照组患者,经布地奈德治疗后,其IL-3的水平明显降低。上述文献的研究结果与本研究的结果一致。
2.3.4 IL-4的变化
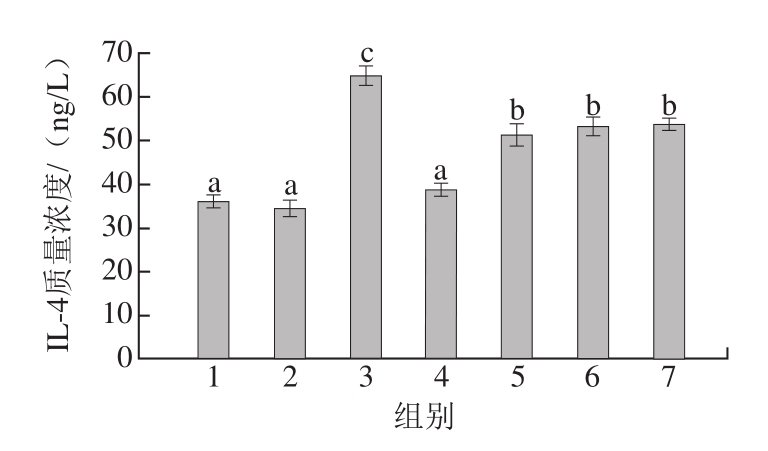
图6 豚鼠血清中IL-4质量浓度
Fig.6 IL-4 levels in serum of guinea pigs
由图6可知,阴性对照组I L-4质量浓度为(35.996f1.451)ng/L,阳性对照组IL-4质量浓度为(64.692f2.327)ng/L,二者存在显著差异(P<0.05)。因此,过敏原可以刺激豚鼠体内IL-4的合成与分泌,致敏性越高,IL-4质量浓度增加越多。高压结合酶处理后的虾蛋白(组5)、虾肉(组6)、虾仁(组7)激发的豚鼠血清与阳性对照组血清中IL-4质量浓度均有显著性差异(P<0.05),表明高压结合酶处理虾仁、虾肉和虾蛋白能够较好地消减其致敏性;但3 组样品激发的豚鼠血清中IL-4的分泌量无显著差异,该结果与虾致敏性消减(ELISA检测)的结果一致。因此,IL-4与食物过敏具有相关性。
IL-4是由Th2、肥大细胞、嗜碱性粒细胞分泌的,具有多种生物学活性:如促进B细胞的增殖、分化,促进抗体的分泌;促进Th0细胞向Th2细胞分化,抑制Th1细胞活化及分泌细胞因子;协同IL-3共同刺激肥大细胞的增殖[40]。IL-4在调节体液免疫中起到关键的作用。IL-4诱导B细胞转换成可以分泌IgE抗体的浆细胞和记忆B细胞,同时IL-4可以刺激MHC-II类分子的产生,而MHC-II类分子对T细胞识别抗原有限制作用;同时IL-4可以刺激MHC-II类分子的表达,而MHC-II类分子大多数表达于APC上,可以根据MHC-II类分子的表达评价APC抗原递呈能力,因而MHC-II类分子对T细胞识别抗原有限制作用[41]。
傅玲琳等[22]在研究乳酸菌对虾原肌球蛋白致敏性的消减作用时发现过敏小鼠体内IL-4质量浓度增加。Liu Mengyun等[42]通过用卵清蛋白致敏的小鼠模型,研究婴儿双歧杆菌CGMCC33-2对小鼠过敏反应的抑制作用,结果表明食物过敏小鼠血清中细胞因子IL-4质量浓度增加,婴儿双歧杆菌CGMCC33-2可以抑制过敏小鼠体内IL-4等细胞因子的产生。这些文献的研究结果与本实验的结果一致。
2.3.5 IL-6的变化
由图7可知,阴性对照组(组1)IL-6质量浓度为(35.214f0.467)ng/L,阳性对照组(组3)IL-6质量浓度为(43.664f0.933)ng/L。阴性对照组、高压结合酶处理后虾蛋白(组5)、虾肉(组6)、虾仁组(组7)的IL-6质量浓度无显著性差异(P>0.05),与阳性对照组血清中IL-6质量浓度差异显著(P<0.05)。因此,过敏原可以刺激豚鼠体内IL-6的合成与分泌,高压结合酶处理后的虾仁及其制品致敏性得到消减,该结果与虾致敏性消减(ELISA检测)的结果一致。因此,IL-6与食物过敏具有相关性。
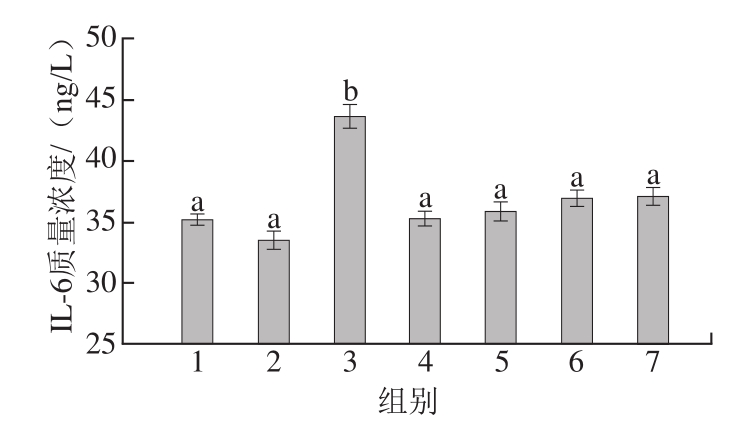
图7 豚鼠血清中IL-6质量浓度
Fig.7 IL-6 levels in serum of guinea pigs
IL-6是由T细胞、B细胞、巨噬细胞等细胞产生的,IL-1、TNF-a等细胞因子也可诱导正常的细胞产生IL-6[32]。IL-6可以刺激T细胞增殖、分化;刺激B细胞增殖、分化以及分泌抗体;参与炎症反应,诱导急性期蛋白合成及释放,引起机体的发热[43]。张宁[44]用卵清蛋白建立了小鼠过敏性鼻炎模型,研究姜黄素对过敏性疾病的治疗效果,发现与卵清蛋白组相比,姜黄素组小鼠血清中细胞因子IL-1β、TNF-α、IL-6、IL-8的释放量明显降低。表明姜黄素可以通过抑制与过敏反应相关的炎症因子而发挥抗炎作用。Park等[28]通过观察大鼠肥大细胞脱颗粒以及测定IL-1、IL-6、TNF-α等炎症细胞因子的变化,评价狭花天竺葵和黄莲在体外和体内的抗炎作用,结果表明,狭花天竺葵和黄连可以有效抑制肥大细胞脱颗粒,并抑制IL-1、IL-6、TNF-α等炎症细胞因子的分泌。上述文献报道的过敏反应中IL-6等炎症细胞因子质量浓度增加与本实验的结果一致。
2.3.6 IL-10的变化
IL-10是一种重要的抗炎和免疫调节因子[45],可由CD4+T、CD8+T、Th1、Th2、B细胞、树突状细胞、NK细胞、肥大细胞、中性粒细胞等分泌产生[46]。IL-10在免疫调节中发挥重要作用,通过降低树突状细胞、巨噬细胞表面MHC-II类分子的表达,削弱抗原提呈细胞的功能,抑制T细胞的增殖等多种途径,有效抑制细胞介导的免疫反应[47]。

图8 豚鼠血清中IL-10质量浓度
Fig.8 IL-10 levels in serum of guinea pigs
由图8可知,阴性对照组I L-1 0质量浓度为(258.681f1.841)ng/L,阳性对照组IL-10质量浓度为(209.072f2.175)ng/L,两组存在显著性差异(P<0.05)。阴性对照组(组1)、阴性对照未激发组(组2)、阳性对照未激发组(组4)、高压结合酶处理后虾蛋白组(组5)IL-10质量浓度无显著性差异(P>0.05),高压结合酶处理后的虾肉(组6)及虾仁(组7)与阳性对照组血清中IL-10无显著性差异(P>0.05),该结果表明过敏原可抑制豚鼠体内IL-10的合成与分泌。因此,IL-10与食物过敏具有相关性。
Zhang Lili等[23]通过用卵清蛋白致敏的小鼠模型研究双歧杆菌对小鼠过敏反应的抑制作用,结果表明食物过敏小鼠血清中IL-4、IgE质量浓度增加,双歧杆菌可以抑制过敏小鼠体内IL-4、IgE的产生,并抑制小肠中Th2反应,增加可以分泌IL-10的细胞数量。Fu Linglin等[48]通过研究对虾原肌球蛋白致敏的小鼠模型,研究Bacillus coagulans 09.712对小鼠过敏反应的抑制作用,结果表明过敏小鼠血清中IL-10质量浓度降低,Bacillus coagulans 09.712可以促进IL-10的产生,调节Th1/Th2/Treg细胞平衡,改善过敏反应。
2.3.7 IFN-γ的变化
IFN-γ是由活化的Th1细胞、NK细胞产生、分泌的。IFN-γ有多种生物活性:如促进巨噬细胞活化;促进MHC-II类分子的表达,提高APC抗原递呈能力;促进MHC-I类分子的表达,增强NK细胞的杀伤活性;促进B细胞的分化、增殖;抑制Th2细胞分化及细胞因子合成[49-50]。
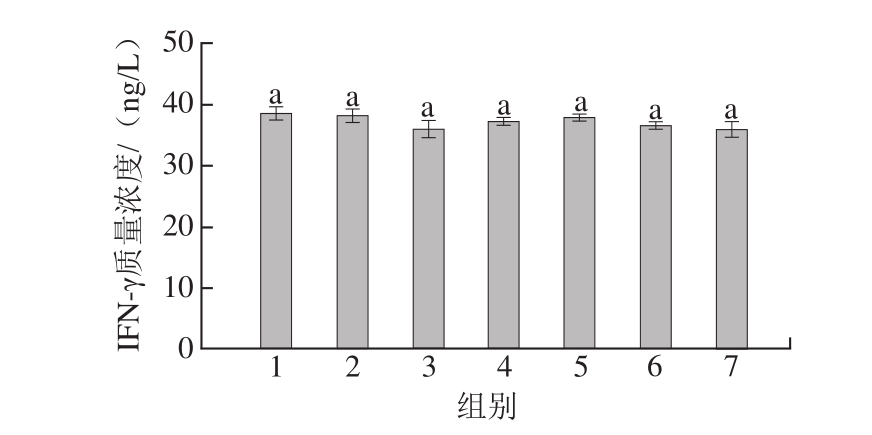
图9 豚鼠血清中IFN-γ质量浓度
Fig.9 IFN-γ levels in serum of guinea pigs
由图9可知,各组豚鼠血清中IFN-γ质量浓度无显著性差异(P>0.05)。阴性对照组IFN-γ质量浓度为(38.461f1.173)ng/L,阳性对照组IFN-γ质量浓度为(36.027f1.408)ng/L。IFN-γ是Th1细胞具有代表性的细胞因子。由2.3.3节结果可知,IL-4质量浓度明显升高,表明Th0细胞主要向Th2细胞分化,Th1细胞量减少。但NK细胞也可以产生IFN-γ,而IL-2、TNF-α等细胞因子都可以上调NK细胞分化并促进其活化,因此使得IFN-γ质量浓度维持在一个稳定的水平,未发生明显的降低[32]。因此,IFN-γ与食物过敏相关性较小。张浩等[24]通过卵白蛋白建立致敏的小鼠模型,研究食物过敏小鼠血清中细胞因子的变化,结果表明过敏小鼠血清中IFN-γ质量浓度没有明显变化。
2.3.8 TNF-α的变化
TNF-α是由巨噬细胞和T细胞产生、分泌的。TNF-α可以激活血管内皮、增加血管通透性、使白细胞聚集在炎症的部位;会引起机体发热,诱导急性期蛋白合成及释放,参与炎症反应;可以刺激巨噬细胞的合成以及细胞因子的分泌;增强吞噬细胞的作用[49-50]。

图10 豚鼠血清中TNF-α质量浓度
Fig.10 TNF-α levels in serum of guinea pigs
由图10可知,阳性对照组与其他组血清中TNF-α质量浓度均有显著性差异(P<0.05),其他各组血清中TNF-α质量浓度无显著性差异(P>0.05)。该结果表明,高压结合酶处理后的虾仁及制品其致敏性的消减有显著效果。因此,TNF-α与食物过敏具有相关性。
在TH细胞中,Th1细胞主要分泌IL-2、IFN-γ、TNF-α等,主要介导机体细胞免疫应答;Th2细胞主要分泌IL-4、IL-5、IL-6、IL-10等,主要介导机体体液免疫应答,辅助抗体生成,在过敏反应中起主导作用[4-6]。Th1细胞分泌的IFN-γ和Th2细胞分泌的IL-4、IL-10不仅可促进自身的分化成熟,还可抑制对方的分化成熟,Th1分泌的IFN-γ可以抑制Th0向Th2分化;而Th2分泌的IL-4、IL-10可以增强Th2细胞而抑制Th1细胞的生成,同时与其他各种因素形成一个调节网络。过敏个体T细胞发生变化的直接结果就是影响Th1和Th2细胞对细胞因子的分泌,从而对机体的免疫起作用[32]。
IFN-γ和IL-4可以分别代表Th1和Th2免疫应答的水平,目前研究中也多采用IFN-γ/IL-4动态来反映Th1/Th2免疫平衡的状况[51-52]。IFN-γ/IL-4变化情况如图11所示。
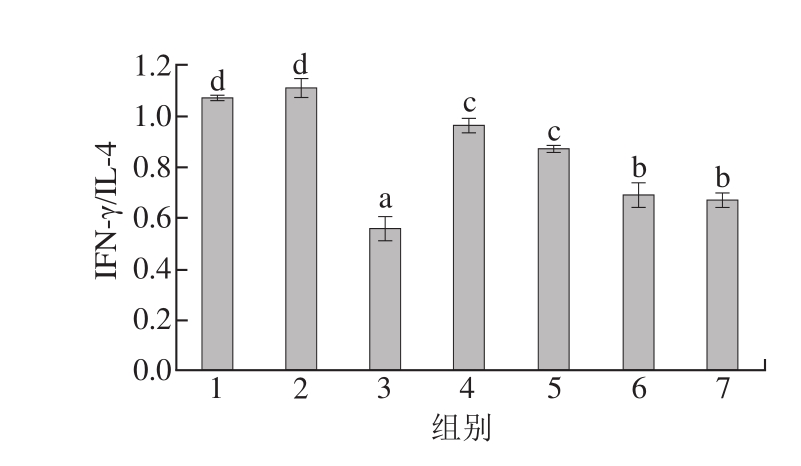
图11 豚鼠血清中IFN-γ/IL-4
Fig.11 IFN-γ/IL-4 ratio in serum of guinea pigs
由图11可知,阴性对照组IFN-γ/IL-4为1.069f0.012,阳性对照组IFN-γ/IL-4为0.557f0.046,二者存在显著性差异(P<0.05)。随着虾过敏原的消减(组5样品致敏性消减率为97.04%、组6样品致敏性消减率为95.00%、组7样品致敏性消减率为94.50%),各样品组血清中IFN-γ/IL-4也呈现规律性变化,且与阳性对照组呈现显著性差异(P<0.05)。该结果表明,食物过敏反应是以Th2型淋巴细胞占优势的过敏性疾病,食物过敏豚鼠的Th1/Th2细胞平衡向Th2细胞偏移。
方栓锋等[53]通过用卵清蛋白致敏的小鼠模型,研究鼠李糖乳杆菌对小鼠食物过敏反应的抑制作用,发现鼠李糖乳杆菌可以有效的改善小鼠的过敏症状,小鼠血清中IL-4/IFN-γ降低,即抑制了Th1/Th2细胞平衡向Th2细胞偏移,调节了小鼠体内Th1/Th2细胞平衡。Zhang Lili等[23]在研究双歧杆菌对小鼠过敏反应的抑制作用时,发现双歧杆菌可以增加分泌IL-10的细胞数量。张秋香等[54]研究了L. casei Zhang对食物过敏的抑制作用,发现口服L. casei Zhang的实验组小鼠血清特异性IgE、粪便HIS和IL-4含量明显降低,L. casei Zhang可以抑制食物过敏反应,促使Th2优势反应向Th1方向转变,从而起到预防和治疗花生过敏的作用。
通过食物过敏豚鼠血清中IgE和HIS质量浓度变化,及血清中部分细胞因子的检测,发现初次致敏和致敏后激发能够引发豚鼠体内IgE和HIS分泌量的增加;IL-1、IL-2、IL-3、IL-4、IL-6、TNF-α等细胞因子质量浓度与食物的致敏性强弱呈正相关,IL-10质量浓度与食物致敏性强弱呈负相关。食物过敏豚鼠血清IFN-γ/IL-4与致敏性强弱呈负相关,显示出食物过敏豚鼠的Th1/Th2细胞平衡向Th2细胞偏移。
[1] 陈颖. 食物过敏与食品过敏原[J]. 食品安全质量检测学报, 2012,3(4): 233-234.
[2] KUMAR S, VERMA A K, DAS M, et al. Molecular mechanisms of IgE mediated food allergy[J]. International Immunopharmacology,2012, 13(4): 432-439. DOI:10.1016/j.intimp.2012.05.018.
[3] FERREBEE J W. Mechanisms of food allergy[J]. Pediatric Allergy & Immunology, 2009, 20(1): 5-11. DOI:10.1111/j.1399-3038.2008.00847.x.
[4] 胥传来. 食品免疫学[M]. 北京: 化学工业出版社, 2007: 141-143.
[5] 周光炎. 免疫学原理[M]. 北京: 科学出版社, 2013: 142-147.
[6] LYDYARD P M, WHELAN A, FANGER M W. 免疫学[M]. 林慰慈,魏雪涛, 薛彬, 等译. 2版. 北京: 科学出版社, 2010: 149-154.
[7] 沈柱, 刘玉峰. I型超敏反应的迟发相[J]. 国际皮肤性病 学杂志, 2003, 29(4): 238-240. DOI:10.3760/cma.j.issn.1673-4173.2003.04.014.
[8] 傅玲琳, 宋金宇, 王彦波. 海产品过敏及肠道黏膜免疫的关键调控机制[J]. 中国食品学报, 2016, 16(2): 189-199. DOI:10.16429/j.1009-7848.2016.02.027.
[9] 陈少华, 胡志和. 超高压技术生产即食南美白对虾虾仁条件的研究[J].食品工业科技, 2015, 36(9): 65-71.
[10] 李心悦. 李南美白对虾即食虾仁加工关键技术研究[D]. 保定: 河北农业大学, 2014: 15-40.
[11] 王冰冰. 虾肉糜的微波加热特性研究[D]. 上海: 上海海洋大学,2016: 23-49.
[12] 袁莉莉. 凡纳滨对虾肉糜凝胶特性研究及虾肉肠的研发[D]. 湛江:广东海洋大学, 2013: 12-31.
[13] 赵利, 李婷, 汪清, 等. 克氏原螯虾蛋白肽的制备及其抗氧化性的研究[J]. 中国调味品, 2017, 42(6): 22-28. DOI:10.3969/j.issn.1000-9973.2017.06.005.
[14] 戚亭, 陈雪忠, 刘志东, 等. 响应面优化的南极磷虾蛋白磷酸化改性工艺[J]. 食品与发酵工业, 2018, 44(1): 204-210. DOI:10.13995/j.cnki.11-1802/ts.014638.
[15] MOTOYAMA K, ISHIZAKI S, NAGASHIMA Y, et al. Cephalopod tropomyosins: identification as major allergens and molecular cloning[J]. Food and Chemical Toxicology, 2006, 44(12): 1997-2002.DOI:10.1016/j.fct.2006.06.018.
[16] 李振兴, 林洪, 李明华, 等. 不同虾类的过敏原及其过敏原性[J]. 水产学报, 2006, 30(2): 281-284. DOI:10.3321/j.issn:1000-0615.2006.02.024.
[17] SHIMAKURA K, TONOMURA Y, HAMADA Y, et al.Allergenicity of crustacean extractives and its reduction by protease digestion[J]. Food Chemistry, 2005, 91(2): 247-253. DOI:10.1016/j.foodchem.2003.11.010.
[18] YU C J, LIN Y F, CHIANG B L, et al. Proteomics and immunological analysis of a novel shrimp allergen, Pen m 2[J].Journal of Immunology, 2003, 170(1): 445-453. DOI:10.4049/jimmunol.170.1.445.
[19] SCHIAVI E, BARLETTA B, BUTTERONI C, et al. Oral therapeutic administration of a probiotic mixture suppresses established Th2 responses and systemic anaphylaxis in a murine model of food allergy[J]. Allergy, 2011, 66(4): 499-508. DOI:10.1111/j.1398-9995.2010.02501.x.
[20] 贾莹, 胡志和. 超高压结合酶法消减南美白对虾虾仁的致敏性[J]. 食品科学, 2016, 37(24): 16-20. DOI:10.7506/spkx1002-6630-201624003.
[21] 王丽娟, 胡志和, 周汛, 等. 南美白对虾蛋白质酶解产物过敏原消减效果研究[J]. 食品科学, 2010, 31(17): 263-266.
[22] 傅玲琳, 赵淑淑, 王彦波. 具有缓解对虾原肌球蛋白致敏性乳酸菌的筛选及其免疫调节作用[J]. 中国食品学报, 2018, 18(2): 15-21.DOI:10.16429/j.1009-7848.2018.02.002.
[23] ZHANG Lili, XIAO Chen, ZHENG Pengyuan, et al. Oral Bifidobacterium modulates intestinal immune inflammation in mice with food allergy[J]. Journal of Gastroenterology & Hepatology, 2010,25(5): 928-934. DOI:10.1111/j.1440-1746.2009.06193.x.
[24] 张浩, 胡志和. 免疫低下和食物过敏小鼠外周血中细胞因子的变化[J].食品科学, 2012, 33(5): 263-267. DOI:10.7506/spkx1002-6630-201205056.
[25] 蒋红玲, 向军俭. 食物过敏中肥大细胞释放组胺的研究进展[J].医学理论与实践, 2007, 20(3): 269-271. DOI:10.3969/j.issn.1001-7585.2007.03.009.
[26] 李洁, 张波, 郭雁冰, 等. 季节变化对过敏性鼻炎患者组胺分泌的影响[J]. 中医药导报, 2013, 19(6): 101-103. DOI:10.3969/j.issn.1672-951X.2013.06.051.
[27] DINARELLO C A, MIER J W. Interleukins[J]. Annual Review of Medicine, 1986, 37: 173-178. DOI:10.1146/annurev.me.37.020186.001133.
[28] PARK S M, MIN B G, JUNG J Y, et al. Combination of Pelargonium sidoides and Coptis chinensis root inhibits nuclear factor kappa B-mediated inflammatory response in vitro and in vivo[J]. BMC Complementary & Alternative Medicine, 2018, 18(1): 20.DOI:10.1186/s12906-018-2088-x.
[29] AULITZKY D W E, SCHULER M, PESCHEL C, et al.Interleukins[J]. Drugs, 1994, 48(5): 667-677. DOI:10.2165/00003495-199448050-00002.
[30] UMINO K, FUJIWARA S, IKEDA T, et al. Prognostic value of the soluble interleukin-2 receptor level after patients with follicular lymphoma achieve a response to R-CHOP[J]. Hematology, 2017,22(9): 521-526. DOI:10.1080/10245332.2017.1312204.
[31] 郑建华. 白介素-2研究进展[J]. 海峡药学, 2006, 18(3): 1-3.DOI:10.3969/j.issn.1006-3765.2006.03.001.
[32] 庞广昌. 食品免疫论[M]. 北京: 科学出版社, 2008: 549.
[33] 刘志昂, 阳丽华, 高慧. cAMP、cGMP、IL-2、IL-6检测在过敏性鼻炎治疗中的临床意义[J]. 西北国防医学杂志, 2008, 29(6): 463-464.DOI:10.16021/j.cnki.1007-8622.2008.06.042.
[34] 张耀洲, 吴祥甫. 白介素-3研究进展[J]. 生物技术通报, 2005, 3(5):31-34; 62.
[35] FERRARI S, GRANDE A, MANFREDINI R, et al. Expression of interleukins 1, 3, 6, stem cell factor and their receptors in acute leukemia blast cells and in normal peripheral lymphocytes and monocytes[J]. European Journal of Haematology, 1993, 50(3): 141-148. DOI:10.1111/j.1600-0609.1993.tb00082.x.
[36] 孙明芳, 江米足. 儿童嗜酸细胞性食管炎的临床研究进展[J]. 中华儿科杂志, 2017, 55(7): 550-553.
[37] 李鹤, 沈惠风, 胡雅儿, 等. 哮喘发病机制与受体、免疫细胞的关系[J].安徽中医学院学报, 2002, 21(1): 54-58.
[38] 江茵, 黎东明, 陈敏. 黄芪多糖对哮喘大鼠气道炎症及IL-3表达的影响[J]. 中国现代医学杂志, 2009, 19(12): 1779-1781.
[39] 邓辉雨. 吸入布地奈德对哮喘儿童血清IgE、IL-3、IL-4的影响[J].亚太传统医药, 2013, 9(11): 175-176.
[40] HSIEH C S, HEIMBERGER A B, GOLD J S, et al. Differential regulation of T helper phenotype development by interleukins 4 and 10 in an alpha beta T-cell-receptor transgenic system[J]. PNAS, 1992,89(13): 6065-6069. DOI:10.1073/pnas.89.13.6065.
[41] 卢巍. 白介素-4与支气管哮喘[J]. 国际呼吸杂志, 2001, 21(3): 125-126. DOI:10.3969/j.issn.1674-7593.2011.03.010.
[42] LIU Mengyun, YANG Zhenyu, DAI Wenkui, et al. Protective effect of Bif i dobacterium infantis CGMCC313-2 on ovalbumin-induced airway asthma and beta-lactoglobulin-induced intestinal food allergy mouse models[J]. World Journal of Gastroenterology, 2017, 23(12): 2149-2158. DOI:10.3748/wjg.v23.i12.2149.
[43] 白庆峰, 潘凯丽, 黄莹, 等. 过敏性紫癜患儿血清白介素6、白介素8及肿瘤坏死因子α水平和免疫球蛋白的变化[J]. 中国小儿血液与肿瘤杂志, 2008, 13(2): 53-56. DOI:10.3969/j.issn.1673-5323.2008.02.002.
[44] 张宁. 姜黄素在治疗过敏性鼻炎小鼠模型中的作用机制研究[D].济南: 山东大学, 2016: 22-28.
[45] RAJASEKARAN A, SHIVAKUMAR V, KALMADY S V, et al.The impact of IL10 polymorphisms and sHLA-G levels on the risk of schizophrenia[J]. Asian Journal of Psychiatry, 2016, 23(2): 39-43.
[46] PALMER V L, NGANGA V K, ROTHERMUND M E, et al. CD1d regulates B cell development but not B cell accumulation and IL10 production in mice with pathologic CD5+ B cell expansion[J]. BMC Immunology, 2015, 16: 66-67. DOI:10.1186/s12865-015-0130-z.
[47] KAPELSKI P, SKIBINSKA M, MACIUKIEWICZ M, et al. Familybased association study of interleukin 10 (IL10) and interleukin 10 receptor alpha (IL10RA) functional polymorphisms in schizophrenia in Polish population[J]. Journal of Neuroimmunology, 2016, 297(11):92-97. DOI:10.1016/j.jneuroim.2016.05.010.
[48] FU Linglin, PENG Jixiang, ZHAO Shushu, et al. Lactic acid bacteria-specif i c induction of CD4+Foxp3+T cells ameliorates shrimp tropomyosin-induced allergic response in mice via suppression of mTOR signaling[J]. Scientific Reports, 2017, 7: 1987-2001.DOI:10.1038/s41598-017-02260-8.
[49] 李立科, 罗启慧, 黄超, 等. 大豆异黄酮对雄性大鼠脾脏IL-2、IL-4、TNF-α、INF-γ蛋白表达的影响[J]. 浙江农业学报, 2017,29(9): 1458-1464. DOI:10.3969/j.issn.1001524.2017.09.06.
[50] MANCHA-AGRESTI P, DE CASTRO C P, DOS SANTOS J S C, et al. Recombinant invasive Lactococcus lactis carrying a DNA vaccine coding the Ag85A antigen increases INF-γ, IL-6, and TNF-α cytokines after intranasal immunization[J]. Frontiers in Microbiology, 2017,8(11): 1-12. DOI:10.3389/fmicb.2017.01263.
[51] 吴群, 邵洁, 俞善昌, 等. 食物过敏动物模型中辅助性T淋巴细胞1/辅助性T淋巴细胞2相关细胞因子变化[J]. 实用儿科临床杂志, 2007, 22(21): 1642-1643; 1661. DOI:10.3969/j.issn.1003-515X.2007.21.020.
[52] KAREN C L T, WALDEREZ O D, KENNETH J G. Endogenous IL-4 and IFN-γ are essential for expression of Th2, but not Th1 cytokine message during the early differentiation of human CD4+T helper cells[J]. Human Immunology, 2004, 65(11): 1328-1335. DOI:10.1016/j.humimm.2004.06.007.
[53] 方拴锋, 张煜, 张赟, 等. 鼠李糖乳杆菌改善卵清蛋白诱导的食物过敏小鼠症状及其机制[J]. 细胞与分子免疫学杂志, 2017, 33(5): 597-600. DOI:10.13423/j.cnki.cjcmi.008129.
[54] 张秋香, 胡梦莎, 任晟诚, 等. 干酪乳杆菌干预对花生过敏小鼠模型的免疫调节作用[J]. 微生物学报, 2018(1): 73-82. DOI:10.13343/j.cnki.wsxb.20170029.
Change in Cytokines and Th1/Th2 Cell Balance in Guinea Pigs Induced by Shrimp Products with Reduced Allergenicity
HU Zhihe, WANG Xingxuan, WANG Lijuan, et al. Change in cytokines and Th1/Th2 cell balance in guinea pigs induced by shrimp products with reduced allergenicity[J]. Food Science, 2019, 40(9): 122-131. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20180624-449. http://www.spkx.net.cn