高脂血症表现为体内血浆一种或数种脂质成分的含量超过正常最高限值的状态,在营养代谢性疾病中占有重要的地位,是导致动脉粥样硬化的主要因素之一[1],与高血压、心脑血管病[2-3]和肾脏病的发生关系密切[4]。在我国,此症并不罕见,根据中国居民营养与健康状况报告的调查结果[5],我国成人高脂血症的患病率为20%,血脂异常者约有1.6亿,近年来其患病率及死亡率还有逐年增高的趋势,尤其多见于中、老年人。研究表明,高脂血症与胰岛素抵抗(insulin resistance,IR)有着密切的关系[6-7],IR是指血液中胰岛素的生物效应降低,即机体对胰岛素生物调节作用的反应性降低的一种状态,具体表现为机体对胰岛素的敏感性下降以及对葡萄糖的利用产生障碍[8]。胰岛素抵抗不仅是一种代谢疾病,而且是高血脂、高血压、动脉粥样硬化、冠心病等代谢疾病之间的纽带[9],更是II型糖尿病的发病基础和伴随性状[10]。近几年,胰岛素抵抗患者人数呈指数增加,因此防治胰岛素抵抗显得尤为重要。
柠檬酸(citricacid,CA)又名枸橼酸,在自然界中分布广泛,存在于植物的果实和动物的骨骼、肌肉、血液中,无色或白色晶体、无臭、味酸,易溶于水和乙醇,其应用非常广泛,在食品、饲料、日化、化工制药和纺织业等领域有着重要的应用[11],如作为酸性调味剂[12]、抗氧化剂[13]、化学分析用试剂,实验试剂、色谱分析试剂及生化试剂、络合剂、掩蔽剂,还可用以配制缓冲溶液。柠檬酸是三羧酸循环的重要中间产物,三羧酸循环又是三大营养素(糖类、脂类、氨基酸)的最终代谢通路,也是糖类、脂类、氨基酸代谢联系的枢纽。本项目组对新疆野山杏果肉总有机酸成分的研究结果显示,柠檬酸占野山杏果肉总有机酸含量的70%以上,是野山杏果肉总有机酸成分中的主酸[14]。针对野山杏果肉的总有机酸,本项目组前期已进行了分离纯化[15]、体外抗脂质过氧化活性[16]、对高脂血症大鼠血脂及抗氧化指标的影响[17]以及对高脂血症小鼠血脂和肝脏的影响[18]等方面的研究,但对于野山杏果肉总有机酸成分中的柠檬酸相关研究却很少。本实验通过建立高脂血症实验小鼠模型,考察柠檬酸调节血脂的作用和对高脂血症小鼠胰岛素敏感性的改善作用,以期为后续野山杏果肉总有机酸成分的研究提供一定科学依据。
KM小鼠,60 只,雌雄各半,体质量(20f2)g,由新疆医科大学实验动物中心提供,许可证号:SCXK(新)2016-0003。
柠檬酸(质量分数≥99.5%) 天津市致远化学试剂有限公司;血脂康胶囊 北京北大维信生物科技有限公司;小鼠胰岛素酶联免疫吸附检测试剂盒 伊莱瑞特生物科技股份有限公司;Prime Script II 1st Strand cDNA Synthesis Kit、SYBR Premix Ex Taq(Tli RNaseH Plus)宝生物工程(大连)有限公司;总RNA提取试剂TRIzol、AL2000 DNA Marker(100、250、500、750、1 000、2 000 bp) 南京钟鼎生物技术有限公司;凝胶染色试剂 北京全式金生物技术有限公司;DEPC美国Sigma公司;总胆固醇(total cholesterol,TC)测定试剂盒、总胆固醇(total cholesterol,TG)测定试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)测定试剂盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)测定试剂盒 南京建成生物工程研究所;羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)、丙基硫氧嘧啶、1,2-丙二醇、胆固醇、胆酸钠、吐温-80均为国产分析纯。
血糖仪 德国罗氏诊断有限公司;实时荧光定量聚合酶链式反应(real-time polymerase chain reaction,qPCR)仪 瑞士Roche公司;台式高速冷冻离心机美国Beckman公司;电子天平 美国Ahoms公司;恒温水浴锅、紫外透射仪 美国Amersham Pharmacia公司;雪花状制冰机 日本Sanyo公司;移液器 德国Eppendorf公司;xMark-10593酶标仪 美国Bio-Rad公司。
1.3.1 试剂配制
实验前将柠檬酸和血脂康用质量分数0.5% CMC-Na配成实验所需质量浓度。
高脂乳剂的配制[19]:将1 g丙硫氧嘧啶于研钵中研细,存放备用。取20 g猪油于60 ℃水浴中加热融化,置于研钵中,加入10 g胆固醇、1 g丙硫氧嘧啶,充分搅拌,溶解。再分别加入20 mL吐温-80、丙二醇,研磨混匀,然后缓慢加入20 mL体积分数10%胆酸钠水溶液,研磨乳化,加蒸馏水至100 mL,装入密闭容器中,冷藏,使用时先于37 ℃水浴中融化。
1.3.2 动物分组及给药
KM小鼠适应性饲养1 周后,随机分为6 组,每组10 只,即空白对照组、高脂模型组(hyperlipidemia model,HM)、阳性对照组、高剂量柠檬酸组(CA+HM(H))、中剂量柠檬酸组(CA+HM(M))及低剂量柠檬酸组(CA+HM(L))。
空白对照组每天灌胃生理盐水,其余5 组均于每天上午灌胃高脂乳剂,每天下午阳性对照组灌胃0.2 g/kg的血脂康,CA+HM(H)、CA+HM(M)、CA+HM(L)组分别灌胃0.4、0.2、0.1 g/kg的柠檬酸(灌胃量按10 mL/kg mb计算)。
1.3.3 口服糖耐量测定
于实验第30天,小鼠禁食12 h,尾部采血测血糖值,空白对照组灌胃生理盐水、HM组灌胃高脂乳剂、阳性对照组灌胃血脂康及CA+HM组灌胃不同剂量的CA,20 min后给予各组小鼠灌胃2.0 g/kg葡萄糖(灌胃量按10 mL/kg mb计算),测定0、15、30、60、120 min的血糖浓度,并按照公式(1)计算各组在0~120 min内的血糖曲线下面积(area under the curve of blood glucose,GAUC)[20]。
1.3.4 动物的处理和生化指标的测定
于实验第30天,禁食12 h,尾部采血测空腹血糖(fasting blood glucose,FBG)浓度,眼眶采血,制备血清,脱臼处死小鼠,解剖,快速摘取肝脏和四肢骨骼肌,并放入液氮中,用于测定肝脏6-磷酸葡萄糖酶(glucose-6-phosphatase,G-6-Pase)mRNA和四肢骨骼肌葡萄糖转运体4(glucose transporter-4,GLUT-4)mRNA表达量;按照试剂盒说明分别测定血清中TC、TG、HDL-C、LDL-C浓度和胰岛素水平,并分别按式(2)、(3)计算胰岛素敏感指数(insulin sensitive index,ISI)及胰岛素抵抗指数(homeostatic model assessment for insulin resistance,HOMA-IR)[21]。

式中:FIN为空腹胰岛素(fasting insulin)。
1.3.5 肝脏G-6-Pase mRNA和四肢骨骼肌GLUT-4 mRNA的提取及测定
取出上述放入液氮中的肝脏和四肢骨骼肌,用TRIzol分别提取肝脏和四肢骨骼肌的总RNA;采用反转录PCR(reverse transcription PCR,RT-PCR)法,通过Oligo(dT)Primer或dNTP Mixture将RNA反转录成cDNA,根据基因序列设计特异性引物,运用qPCR,采用SYBR Green染料法,以β-actin为内参基因,做相对定量检测,并用2-△△Ct法对数据进行相对定量分析,引物的设计见表1。
表1 PCR扩增基因引物序列
Table1 Primer sequences used for PCR amplif i cation of genes

基因 上游引物(5’-3’) 下游引物(5’-3’) 片段长度/bp G-6-Pase TCAATCTCCTCTGGGTGGC GTTGCTGTAGTAGTCGGTGTCC 113 GLUT-4 CCCCATTCCCTGGTTCAT CCCATAGCATCCGCAACA 138 β-actin ATGTGGATCAGCAAGCAGGA AAGGGTGTAAAACGCAGCTCA 99
采用SPSS 22.0软件进行统计学分析,实验结果以fs表示,组间差异的比较采用t检验,P<0.05为差异有统计学意义,并利用GraphPad作图。
表2 小鼠血清血脂水平(n=10)
Table2 Serum lipid levels in mice (n= 10)mmol/L
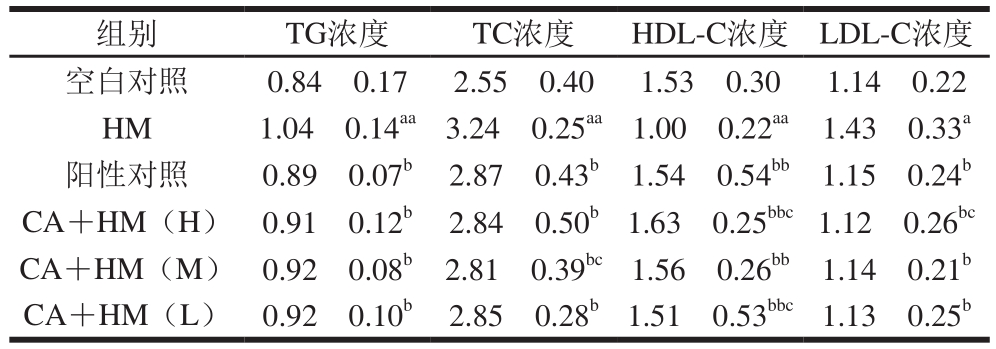
注:对于相同指标,与空白对照组相比,a.差异显著(P<0.05),aa.差异极显著(P<0.01);与HM组相比,b.差异显著(P<0.05),bb.差异极显著(P<0.01);c.与阳性对照组相比差异显著(P<0.05)。下同。
组别 TG浓度 TC浓度 HDL-C浓度 LDL-C浓度空白对照 0.84f0.17 2.55f0.40 1.53f0.30 1.14f0.22 HM 1.04f0.14aa 3.24f0.25aa 1.00f0.22aa 1.43f0.33a阳性对照 0.89f0.07b 2.87f0.43b 1.54f0.54bb 1.15f0.24b CA+HM(H) 0.91f0.12b 2.84f0.50b1.63f0.25bbc1.12f0.26bc CA+HM(M) 0.92f0.08b 2.81f0.39bc1.56f0.26bb 1.14f0.21b CA+HM(L) 0.92f0.10b 2.85f0.28b1.51f0.53bbc1.13f0.25b
由表2可见,与空白对照组相比,HM组血清的TG和TC浓度极显著升高(P<0.01),HDL-C浓度极显著降低(P<0.01),LDL-C浓度显著升高(P<0.05),说明高脂血症模型造模成功;与HM组相比,CA+HM组和阳性对照组血清TG、TC、HDL-C和LDL-C的浓度有不同程度的升高或降低,其中TG、TC和LDL-C浓度显著降低(P<0.05),HDL-C浓度极显著升高(P<0.01),但与空白对照组相比无显著差异(P>0.05);与阳性对照组相比,CA+HM(M)组血清TC的浓度有显著差异(P<0.05),CA+HM(H)组血清HDL-C和LDL-C的浓度有显著差异(P<0.05),CA+HM(L)组血清HDL-C的浓度有显著差异(P<0.05),CA+HM组血清TG的浓度虽比阳性对照组高,但无显著差异(P>0.05);不同剂量的CA+HM组之间均无显著差异(P>0.05),且无剂量依赖性。说明柠檬酸能够调节高脂血症小鼠的血清血脂水平。
表3 柠檬酸对小鼠糖耐量的影响(n=10)
Table3 Effect of citric acid on oral glucose tolerance (n= 10)
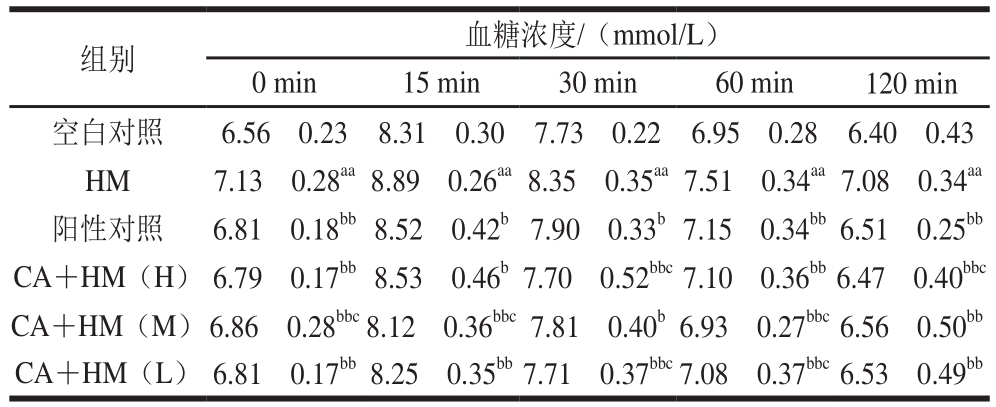
组别 血糖浓度/(mmol/L)0 min 15 min 30 min 60 min 120 min空白对照 6.56f0.23 8.31f0.30 7.73f0.22 6.95f0.28 6.40f0.43 HM 7.13f0.28aa8.89f0.26aa8.35f0.35aa7.51f0.34aa7.08f0.34aa阳性对照 6.81f0.18bb8.52f0.42b7.90f0.33b7.15f0.34bb6.51f0.25bb CA+HM(H) 6.79f0.17bb8.53f0.46b7.70f0.52bbc7.10f0.36bb6.47f0.40bbc CA+HM(M)6.86f0.28bbc8.12f0.36bbc7.81f0.40b6.93f0.27bbc6.56f0.50bb CA+HM(L) 6.81f0.17bb8.25f0.35bb7.71f0.37bbc7.08f0.37bbc6.53f0.49bb
由表3可见,与空白对照组相比,HM组空腹及灌糖2 h后的血糖浓度极显著升高(P<0.01);与HM组相比,CA+HM组和阳性对照组的血糖浓度有不同程度降低,其中0、60 min和120 min的CA+HM组和阳性对照组血糖浓度极显著降低(P<0.01),与空白对照组相比,血糖浓度虽有所下降但无显著差异(P>0.05);与阳性对照组相比,0、15 min和60 min的CA+HM(M)组血糖浓度有显著差异(P<0.05),30 min和120 min的CA+HM(H)组血糖浓度有显著差异(P<0.05);30 min的CA+HM(L)组血糖浓度有显著差异(P<0.05);不同剂量的CA+HM组之间均无显著差异(P>0.05)且无剂量依赖性。说明高脂血症小鼠机体对糖的利用率降低,糖代谢存在异常,柠檬酸能够干预高脂血症小鼠的糖代谢过程,并能够调节使之趋于正常。
表4 各组小鼠血糖曲线下面积(n=10)
Table4 Comparison of area under the curve of blood glucose in six groups (n= 10)
组别 空白对照 HM 阳性对照 CA+HM(H) CA+HM(M) CA+HM(L)血糖曲线下面积 14.17f 0.38 15.44f 0.51aa 14.49f 0.29b 14.25f 0.60b 14.47f 0.58b 14.31f 0.58b
由表4可见,与空白对照组相比,HM组的血糖曲线下面积差异极显著(P<0.01);与HM组相比,CA+HM各剂量组和阳性对照组的血糖曲线下面积差异显著(P<0.05);与空白对照组相比,CA+HM组和阳性对照组血糖曲线下面积均无显著差异(P>0.05);与阳性对照组相比,CA+HM组的血糖曲线下面积均无显著差异(P>0.05);不同剂量的CA+HM组之间也均无显著差异(P>0.05)且无剂量依赖性。进一步说明HM组的糖代谢存在异常,柠檬酸能够干预高脂血症小鼠的糖代谢过程,提高高脂血症小鼠机体对糖的利用率,并调节糖代谢。
表5 柠檬酸对高脂血症小鼠胰岛素敏感性的影响(n=10)
Table5 Effect of citric acid on insulin sensitivity in hyperlipidemic mice (n= 10)

组别 FIN含量/(mlU/L) ISI HOMA-IR空白对照 7.13f0.25 -3.86f0.06 2.11f0.07 HM 7.63f0.30aa -3.99f0.08aa 2.34f0.24aa阳性对照 7.27f0.33b -3.86f0.09bb 2.15f0.14bb CA+HM(H) 7.21f0.41bb -3.87f0.09bb 2.17f0.12b CA+HM(M) 7.30f0.46b -3.89f0.13b 2.17f0.15b CA+HM(L) 7.21f0.30bb -3.88f0.06b 2.18f0.10bc
由表5可见,与空白对照组相比,HM组的FIN含量和HOMA-IR极显著升高(P<0.01),ISI极显著降低(P<0.01),说明高脂血症小鼠机体产生了胰岛素抵抗,对胰岛素的敏感性降低;与HM组相比,CA+HM各剂量组和阳性对照组的FIN含量、ISI和HOMA-IR有不同程度的升高或降低,其中CA+HM(H)组ISI极显著升高(P<0.01),FIN含量极显著降低(P<0.01),HOMA-IR显著降低(P<0.05),CA+HM(M)组ISI显著升高(P<0.05),FIN含量和HOMA-IR显著降低(P<0.05),CA+HM(L)组ISI显著升高(P<0.05),FIN含量极显著降低(P<0.01),HOMA-IR显著降低(P<0.05),但与空白对照组相比无显著差异(P>0.05),阳性对照组ISI极显著升高(P<0.01),FIN含量显著降低(P<0.05),HOMA-IR极显著降低(P<0.01);与阳性对照组相比,CA+HM(L)组HOMA-IR有显著差异(P<0.05);不同剂量的CA+HM组之间均无显著差异(P>0.05)且无剂量依赖性。说明高脂血症小鼠经柠檬酸干预后,提高了机体对胰岛素的敏感性,并减弱了高脂血症小鼠的胰岛素抵抗。

图1 肝脏及四肢骨骼肌总RNA的RT-PCR结果
Fig.1 Electrophoretic detection of RT-PCR-amplif i ed total RNA from liver and skeletal muscle
由图1A可知,与空白对照组相比,HM组肝脏总RNA条带亮度明显升高;与HM组相比,CA+HM组和阳性对照组的肝脏总RNA条带亮度明显降低,但与空白对照组相比无明显差异;与阳性对照组相比,CA+HM(H)组肝脏总RNA条带亮度升高;不同剂量的CA+HM组之间无明显差异。由图1B可知,与空白对照组相比,HM组四肢骨骼肌总RNA条带亮度明显降低;与HM组相比,CA+HM组和阳性对照组四肢骨骼肌总RNA条带亮度升高;与阳性对照组相比,CA+HM(H)组四肢骨骼肌总RNA条带亮度升高;CA+HM(H)组四肢骨骼肌总RNA条带亮度高于CA+HM(M)和CA+HM(L)组。

图2 肝脏G-6-Pase mRNA表达量的改变
Fig.2 Comparison of G-6-Pase mRNA expressions in liver in six groups
由图2可见,与空白对照组相比,HM组肝脏G-6-Pase mRNA的表达量极显著升高(P<0.01),说明高脂血症小鼠对糖的利用率降低;与HM组相比,CA+HM组和阳性对照组肝脏G-6-Pase mRNA的表达量显著下调(P<0.05),但与空白对照组相比无显著差异(P>0.05);与阳性对照组相比,CA+HM(H)组G-6-Pase mRNA的表达量有显著差异(P<0.05);不同剂量的CA+HM组之间均无显著差异(P>0.05)且无剂量依赖性。说明柠檬酸增加了高脂血症小鼠机体对肝糖的利用率,同时有效地抑制了肝脏G-6-Pase mRNA的表达。

图 3 四肢骨骼肌GLUT-4 mRNA表达量的变化
Fig.3 Comparison of GLUT-4 mRNA expressions in skeletal muscle in six groups
由图3可见,与空白对照组相比,HM组四肢骨骼肌GLUT-4 mRNA的表达量极显著降低(P<0.01),再次说明高脂血症小鼠机体对糖的利用率降低;与HM组相比,CA+HM组和阳性对照组四肢骨骼肌GLUT-4 mRNA的表达量显著上调(P<0.05),但与空白对照组相比无显著差异(P>0.05);与阳性对照组相比,CA+HM组四肢骨骼肌GLUT-4 mRNA的表达量无显著差异(P>0.05),即经柠檬酸干预后效果与血脂康持平;不同剂量的CA+HM组之间均无显著差异(P>0.05)且无剂量依赖性。说明柠檬酸增加了高脂血症小鼠机体对糖的利用率,同时有效地提高了骨骼肌GLUT-4 mRNA的表达。
本实验中,与正常对照组相比,高脂模型组的小鼠血清TC、TG和LDL-C浓度升高,HDL-C浓度降低,血糖浓度升高,降糖能力减弱,FIN含量和HOMA-IR明显升高,ISI明显降低,说明高脂血症小鼠已经出现了胰岛素抵抗的基本性状,且对胰岛素的敏感性下降;与高脂模型组相比,柠檬酸干预组小鼠的血清血脂水平和胰岛素水平各项指标差异显著,说明即使灌胃了高脂乳剂,但在柠檬酸的干预下,高脂血症小鼠血清中的TC、TG和LDL-C浓度降低,HDL-C浓度升高,血糖浓度降低,降糖能力提高,FIN含量和HOMA-IR明显下调,ISI明显上调,肝脏G-6-Pase mRNA表达量下调,骨骼肌GLUT-4 mRNA表达量上调。实验结果表明,柠檬酸可以调节高脂血症小鼠的血清血脂水平,并能够有效调节糖代谢过程,提高机体对胰岛素的敏感性,减弱高脂血症小鼠的胰岛素抵抗,增加葡萄糖在机体中的利用率。本实验中3 个不同剂量的柠檬酸组之间无剂量依赖性,为后续野山杏果肉总有机酸成分中柠檬酸的研究提供了实验依据。
目前的研究表明,脂代谢紊乱是诱发高脂血症的关键原因,血清中TG、TC、HDL-C和LDL-C的浓度可在一定程度反映机体脂代谢状况,是监测血脂变化的重要指标[22],本实验选择测定血清TG、TC、HDL-C和LDL-C浓度4 个指标,以反映模型组小鼠血脂的异常情况。高血脂在大多数情况下可诱发胰岛素抵抗[23],降低机体对胰岛素的敏感性,本实验中柠檬酸调节了高脂血症小鼠的血脂水平,改善了胰岛素的敏感性,但柠檬酸通过调节血脂水平从而改善胰岛素的敏感性,还是调节血脂水平的同时改善胰岛素的敏感性,尚待进一步的研究。发生胰岛素抵抗的主要部位是依赖胰岛素的葡萄糖利用器官,如骨骼肌、肝脏、脂肪组织等[24],肝脏G-6-Pase mRNA表达量的异常升高和四肢骨骼肌GLUT-4 mRNA表达量的降低是胰岛素抵抗的重要标志[25-26],胰岛素抵抗的发生机制与胰岛素受体有关,在胰岛素作用的受体前水平、受体水平及受体后水平的任何一个阶段都可导致胰岛素抵抗[27-28],胰岛素受体对葡萄糖在体内的转运代谢是由胰岛素受体依赖性葡萄糖运载体及许多关键酶活化的结果[29]。本实验中,柠檬酸提高机体对胰岛素的敏感性,减弱高脂血症小鼠胰岛素抵抗,增加葡萄糖在机体中的利用率,可能的机制是:柠檬酸抑制了受体后水平的胰岛素抵抗,具体机制还需进行细胞水平的研究。柠檬酸在三羧酸循环中扮演着非常重要的角色,连接着三大物质代谢的基础(糖、脂类、氨基酸),更直接关系着机体的健康。柠檬酸在体内的代谢过程为:柠檬酸→异柠檬酸→α-酮戊二酸→琥珀酰辅酶A→琥珀酸→延胡索酸→L-苹果酸→草酰乙酸+乙酰辅酶A→柠檬酸循环[30]。本实验中,外源性补充的柠檬酸进入机体后参与了三羧酸循环,调节了高脂血症小鼠的血脂水平,改善了胰岛素的敏感性,但发挥功效的成分主要是柠檬酸,还是以其代谢产物发挥的作用,还需进一步的研究。
[1] 许子华, 刘惠英, 孙宝清. 高脂血症与动脉粥样硬化的关系[J]. 中华医学实践杂志, 2003, 2(12): 1086-1088.
[2] 朱绍玲. 高血脂症的社区预防与用药指导[J]. 中国社区医师, 2013,15(3): 149-151.
[3] NARA M, SUMINO H, NARA M, et al. Impaired blood rheology and elevated remnant lipoprotein particle cholesterol in hypercholesterolaemic subjects[J]. Journal of International Medical Research, 2009, 37(2): 308-310. DOI:10.1177/147323000903700204.
[4] 何莲, 陈邵燕, 唐雯, 等. 慢性肾脏病与高脂血症关系的研究[J].中国实用内科杂志, 2008, 28(5): 355-357.
[5] 陈娟, 邓军, 张宇燕, 等. 丹参素对高脂血症大鼠脂代谢调节机制研究[J]. 中国中药杂志, 2015, 40(2): 313-317.
[6] 海静如. 胰岛素抵抗与高脂血症[J]. 广西医学, 2000, 22(6): 1253-1256.
[7] 袁红, 袁芳. 单纯高脂血症与胰岛素抵抗指数的关系研究[J]. 中国实用内科杂志, 2007, 27(5): 246-247.
[8] GRUNDY S M, HANSEN B, SMITH S C. Clinical management of metabolic syndrome: report of the American heart association national heart, lung, and blood institute American diabetes association conference on seientif i e issues related to management[J]. Circulation,2004, 10(9): 551-556. DOI:10.1161/01.cir.0000112379.88385.67.
[9] 孔树佳, 付继华. 胰岛素抵抗与糖脂代谢紊乱[J]. 中国老年学杂志,2009, 29(18): 2403-2405.
[10] 梁秀慈, 孟文, 钟英丽, 等. 绿原酸对高脂乳诱导小鼠胰岛素抵抗形成的影响[J]. 中国药理学通报, 2013, 29(5): 654-658.
[11] 冯志合, 卢涛. 中国柠檬酸行业概况[J]. 中国食品添加剂, 2011, 5(3):158-163.
[12] 唐茂妍, 陈旭东. 饲用柠檬酸的应用研究进展[J]. 饲料与畜牧, 2015,10(3): 46-51.
[13] 吕祥娟, 刘强, 宋雷, 等. 柠檬酸及其在猪料中的应用[J]. 山东畜牧兽医, 2015, 36(10): 57-59.
[14] 李珊, 阿依姑丽·艾合麦提, 孙鹏, 等. RP-HPLC法同时测定新疆野山杏果肉中10 种有机酸成分[J]. 食品工业科技, 2017, 38(20): 250-255.
[15] 阿依姑丽·艾合麦提, 李珊, 英提扎尔·艾孜木江, 等. 野山杏果肉总有机酸的分离纯化及其清除自由基能力的研究[J]. 食品科技, 2017,42(5): 219-224.
[16] 阿依姑丽·艾合麦提, 李珊, 英提扎尔·艾孜木江, 等. 野山杏果肉总有机酸体外抑制脂质过氧化活性研究[J]. 西北药学杂志, 2017,32(4): 426-430.
[17] 李珊, 阿依姑丽·艾合麦提, 英提扎尔·艾孜木江, 等. 新疆野山杏果肉总有机酸对高血脂症大鼠血清中脂质水平及抗氧化指标的影响[J].食品工业科技, 2018, 39(13): 301-305; 324.
[18] 阿依姑丽·艾合麦提, 英提扎尔·艾孜木江, 李珊, 等. 野山杏果肉总有机酸对高脂血症小鼠血脂及肝脏的影响[J]. 华西药学杂志,2017, 32(4): 385-387.
[19] 熊静悦, 周桢昊, 赵璐, 等. 脂肪乳剂建立高脂血症模型小鼠的比较研究[J]. 中医药学刊, 2006, 24(8): 1507-1508.
[20] 郑铁生, 王亚娜, 宗爱萍. 龙虾壳聚糖干预后糖尿病小鼠血糖和糖耐量的变化[J]. 中国临床康复, 2006, 10(31): 67-69.
[21] 李晓月, 张晶晶, 张红建, 等. 菊粉对反式脂肪酸致小鼠胰岛素抵抗的影响[J]. 食品科学, 2015, 36(1): 201-204. DOI:10.7506/spkx1002-6630-201501038.
[22] RODOMAN G V, SHALAEVA T I, DOBRETSOV G E. Blood fatty acid transporters in acute pancreatitis[J]. Voprosy Meditsinskoi Khimii,2001, 47(6): 63-66. DOI:10.1007/978-3-540-38918-7_223.
[23] JURAJ K, LIZETTE L, KAREN D, et al. Effect of liraglutide on dietary lipid induced insulin resistance in humans[J]. Diabetes Obesity &Metabolism, 2018, 3(20): 69-76. DOI:10.1111/dom.13037.
[24] 韩佳彤, 丁传波, 顾效瑜, 等. 脱落酸对果糖诱导的胰岛素抵抗小鼠的影响[J]. 食品科学, 2015, 36(15): 195-198. DOI:10.7506/spkx1002-6630-201515036.
[25] LI Y, HE J, LI F P, et al. The role of resistin in hepatic insulin resistance and the underlying mechanism[J]. Chinese Pharmacological Bulletin, 2009, 25(2): 190-193. DOI:10.11569/wcjd.v22.i9.1241.
[26] RALPH A, DEFRONZO D T. Skeletal muscle insulin resistance is the primay defect in type 2 diabetes[J]. Diabetes Care, 2009, 32(2): 157-160. DOI:10.2337/dc09-s302.
[27] GRUNDYS M, BREWERH B, CLEEMANJ I, et al. Definition of metabolic syndrome: report of the national heart, lung, and blood institute American heart association conference on scientific issues related to def i nition[J]. Arteriosclerosis Thrombosis and Vascular Biology,2004, 24(2): 13-18. DOI:10.1161/01.atv.0000111245.75752.c6.
[28] 张世卿, 佟丽. 胰岛素抵抗作用发生机制及实验模型的研究进展[J].中药新药与临床药理, 2012, 23(3): 364-368.
[29] KOBAYASHI H, GAO Y H, UETAC, et al. Multilineage differentiation of cbfal def i cient calvarial cells in vitro[J]. Biochemical and Biophysical Research Communications, 2000, 273(2): 630-636.DOI:10.1006/bbrc.2000.2981.
[30] 姚文兵, 杨红. 生物化学[M]. 7版. 北京: 人民卫生出版社, 2014: 277-278.
Effect of Citric Acid on Insulin Sensitivity in Hyperlipidemic Mice
WANG Miaoying, Aygul·AHMAT, CAO Mengli, et al. Effect of citric acid on insulin sensitivity in hyperlipidemic mice[J].Food Science, 2019, 40(9): 132-138. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180203-039.http://www.spkx.net.cn