海参脑苷脂对前脂肪细胞分化的抑制作用及机制
王美玲,刘亚轩,黎晨曼,刘媛媛,符 萌,王静凤*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
摘 要:目的:探究海参脑苷脂在3T3-L1小鼠脂肪细胞增殖以及分化过程中发挥的作用,并研究其具体机理。方法:运用噻唑蓝法探究海参脑苷脂在3T3-L1细胞正常生长过程中发挥的作用;并通过乳酸脱氢酶实验探究海参脑苷脂对前脂肪细胞是否存在毒性作用;诱导3T3-L1细胞为成熟细胞,采用油红O染色法以及测定成熟脂肪细胞中甘油三酯的含量来探究海参脑苷脂是否会改变脂肪细胞的脂质积累情况;反转录荧光实时定量聚合酶链式反应(reverse transcription real-time polymerase chain reaction,qRT-PCR)测定过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor gamma,PPARγ)、CCAAT/增强子结合蛋白α(CCAAT/enhancer binding protein alpha,C/EBPα)以及Wnt/β-catenin通路相关基因的表达水平。通过Western blotting法测定β-catenin蛋白向核内转移的情况。结果:海参脑苷脂能极显著抑制3T3-L1细胞的增殖以及分化(P<0.01),且对细胞无毒性作用。qRT-PCR结果显示,海参脑苷脂可极显著抑制脂肪细胞PPARγ和C/EBPα以及Wnt/β-catenin通路相关基因的表达(P<0.01)。Western blotting结果表明,海参脑苷脂可以极显著提高脂肪细胞核内β-catenin蛋白的表达水平(P<0.01)。结论:海参脑苷脂可以明显地抑制3T3-L1细胞的增殖以及分化,产生这种效果的机理和转录因子PPARγ、C/EBPα以及Wnt/β-catenin通路相关。
关键词:海参脑苷脂;3T3-L1细胞;分化;Wnt/β-catenin
随着人们生活质量的不断提高,肥胖已经成为常见的代谢综合征之一[1],可引发心血管疾病、II型糖尿病等一系列慢性疾病[2],已经变成全世界重要的社会问题。如今,肥胖人群的数量不断上涨,肥胖及其代谢综合征的发病率也在不断升高[3-4]。越来越多的研究发现,脂肪组织中存在的一些炎症可能和肥胖有关的机体代谢紊乱存在一定的关联[2,5]。因此,对于可有效控制肥胖的活性物质研究对人类发展存在重要的意义。研究证实,肥胖与前脂肪细胞的增殖和分化密切相关[6],前脂肪细胞中脂肪酸的过多积累以及脂肪细胞的肥大均可诱导肥胖的发生[7]。脂肪细胞的肥大以及增生会导致组织缺氧,从而诱发一些其他的组织炎症[8]。在人的一生中,脂肪细胞数量增加主要发生在胚胎发生期和青春期早期,成人体内脂肪细胞数量维持恒定,但是脂肪细胞却在逐渐增大[9],Kwan等指出增加脂肪细胞的脂肪分解可能是一种治疗肥胖的有效策略,其研究发现降低脂肪细胞中甘油三酯(triglyceride,TG)的含量会使小鼠体质量下降[10]。所以,调节前脂肪细胞的增殖以及分化有助于某些慢性疾病的改善。
脑苷脂是一种中性鞘糖脂,由神经酰胺和单糖组成;其中,神经酰胺是由长链脂肪酸中的羧基与长链碱的氨基经脱水以酰氨键相连形成的一类酰胺类化合物。人们于19世纪开始关注海洋生物中的脑苷脂,其作用温和,适合慢性疾病的治疗[11],研究表明脑苷脂可以抗病毒、抗肿瘤,在免疫调节等方面扮演着重要的角色。海参具有很多的食疗以及营养价值,同时体内存在很多具备多种活性的成分,其中就包含脑苷脂。脑苷脂的生物活性与其在体内代谢产生的神经酰胺及长链碱密切相关,而海参脑苷脂中存在独特的、不饱和程度更高的长链碱。研究表明,海参脑苷脂具有神经保护作用,可以改善阿尔茨海默病;海参脑苷脂可以调节糖代谢和脂质代谢,从而改善机体的能量代谢[12]。本实验采用3T3-L1小鼠脂肪细胞研究海参脑苷脂对其增殖、分化的阻抑作用及机理,以期为研究功能性海洋活性物质提供理论参考。
1 材料与方法
1.1 材料与试剂
海参购于青岛水产市场;3T3-L1细胞株购自美国模式培养物研究所。
DMEM培养基 美国Gibco公司;胎牛血清(fetal bovine serum,FBS) 美国Hyclone公司;二甲基亚砜、3-异丁基-1-甲基黄嘌呤、胰蛋白酶、地塞米松、胰岛素、油红O染料 美国Sigma公司;TRIzol试剂美国Invitrogen公司;SRBP Green荧光染料 瑞士Roche公司;M-MLV逆转录酶 日本Takara公司;CCAAT/增强子结合蛋白(CCAAT/enhancer binding protein alpha,C/EBPα)、过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor gamma,PPARγ)、β-actin抗体 英国Abcam公司;丙烯酰胺、牛血清白蛋白、RIPA裂解液 北京索莱宝科技公司产品;脱脂牛奶美国BD公司;其他试剂为国产分析纯。
1.2 仪器与设备
2711型CO2培养箱 德国Heraeus公司;倒置显微镜日本Olympus公司;Neofuge 13R型离心机 上海力申科学仪器公司;酶标仪、荧光实时定量聚合酶链式反应(real-time polymerase chain reaction,qPCR)仪 美国Bio-Rad公司;PVDF膜 美国Milipore公司;脱色摇床北京六一生物科技有限公司;全自动凝胶成像分析仪上海培清科技公司。
1.3 方法
1.3.1 海参脑苷脂的制备
将海参磨碎后称取2 kg粉末,用9 L氯仿-甲醇溶液(体积比2∶1)体系浸提12 h后过滤。重复浸提3 次,收集多次提取所得的浸提液,后旋转蒸发至其干燥,得脂质粗提物。然后采用正相硅胶柱层析法分离所得脂质粗提物,用三氯甲烷-甲醇溶液(体积比95∶5)进行梯度洗脱并收集洗脱液,采用薄层层析法测定洗脱液的成分,并合并其中比移值相同的组分。将这些组分浓缩使其干燥,得到海参脑苷脂。经高效液相色谱法分析后,海参脑苷脂纯度为99%。
1.3.2 3T3-L1细胞的培养和分化
3T3-L1细胞用含10% FBS(体积分数,下同)的DMEM完全培养液,在5% CO2、37 ℃培养箱中培养。细胞融合至90%左右时进行传代。调整细胞的浓度并将其加入24 孔板中,使每孔细胞数为2h104 个。待细胞长满并且接触抑制48 h后,换为含有FBS(10%)、3-异丁基-1-甲基黄嘌呤(0.5 mmol/L)、地塞米松(1 μmol/L)、胰岛素(10 μg/mL)的完全培养液中继续培养。48 h后,换为含有胰岛素(10 μg/mL)和FBS(10%)的高糖DMEM培养基。之后每2 d换为血清体积分数为10%的高糖DMEM完全培养液。
1.3.3 3T3-L1细胞增殖情况测定
调整细胞浓度并将其接种于96 孔板中,使每孔细胞数为2h103 个。24 h后,更换含有不同质量浓度海参脑苷脂的完全培养液,每组设置3 个平行孔。根据前期与脑苷脂相关的细胞实验以及预实验结果,最终将质量浓度设为62.5、125、250 μg/mL,继续培养相应时间后,加入噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT),孵育4 h,在570 nm波长处测定不同组细胞的吸光度。
1.3.4 3T3-L1细胞LDH活力测定
细胞接种及加样方法同1.3.3节。不同质量浓度海参脑苷脂处理3T3-L1细胞4 d后,采用试剂盒测定乳酸脱氢酶(lactate dehydrogenase,LDH)的活力。
1.3.5 3T3-L1细胞分化过程脂质蓄积情况测定
3T3-L1细胞诱导分化的方法同1.3.2节。分别于分化第0、2、4天加入含不同质量浓度海参脑苷脂(0、62.5、125、250 μg/mL)的培养液。细胞分化至第8天时,脂肪细胞用体积分数10%多聚甲醛固定20 min后,用体积分数0.5%油红O染液染色30 min,用体积分数60%异丙醇清洗后拍照。每孔加入异丙醇溶解油红O染液,调整酶标仪于490 nm波长处检测吸光度。半定量检测已分化细胞中含有脂质的含量。
1.3.6 反转录qPCR法检测Wnt/β-catenin通路关键基因mRNA的表达
调整细胞浓度并将其加入24 孔板中,使每孔最终的细胞量为2h104 个。按1.3.2节方法诱导3T3-L1细胞分化。在细胞分化第0、2、4、8天时,用RNA提取试剂盒收集细胞中总RNA。将所提总RNA逆转录为cDNA。将cDNA 5 倍体积稀释后进行扩增,总体系为25 μL,其中SYBR 12.5 μL、稀释后cDNA 5 μL、上下游引物各0.75 μL、双蒸水6 μL。PCR条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火10 s,72 ℃延伸45 s,循环45 次。所用引物序列如表1所示。以β-actin为内参,所测基因的相对表达量以与β-actin表达量的比值表示。1.3.7 Western blotting法检测β-catenin总蛋白以及核蛋白的表达
表1 PCR扩增关键基因的引物序列
Table1 Primer sequences used for PCR amplif i cation of key factors

目的基因 引物序列C/EBPα F:5’-GAACAGCAACGAGTACCGGGTA-3’R:5’-GCCATGGCCTTGACCAAGGAG-3’PPARγ F:5’-GTGGACCTCTCTGTGATGGATG-3’R:5’-GCTCTTGTGAACGGGATGTCT-3’FZ1 F:5’-CAGCAGTACAACGGCGAAC-3’R:5’-GTCCTCCTGATTCGTGTGGC-3’LRP5 F:5’-ACCTCAATGCGATTTGTTCC-3’R:5’-CAGGCAAGGCAGATAGCGAACT-3’β-catenin F:5’-GATTTCAAGGTGGACGAGGA-3’R:5’-CACTGTGCTTGGCAAGTTGT-3’β-actin F:5’-TGTCCACCTTCCAGCAGATGT-3’R:5’-AGCTCAGTAACAGTCCGCCTAGA-3’
调整细胞浓度并将其加入24 孔板中,使每孔最终细胞数为2h104 个。按1.3.2节方法诱导3T3-L1细胞分化,在细胞分化到第0、2天时加入250 μg/mL的海参脑苷脂,每组4 个平行孔。待细胞分化到第4天后,用D-Hanks液冲洗2~3 次,然后每组加入相应裂解液,于低温条件下使细胞裂解5~10 min,然后离心取上清液。BCA试剂盒测定蛋白质量浓度,按需要补充4×上样缓冲液,100 ℃水温下孵育10 min,得到总蛋白。于分化第4天时收集细胞,按照试剂盒所述方法收集细胞核内蛋白。取上述所提样品用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,将目的蛋白条带进行转膜,然后进行封闭。一抗孵育后,用含有标记的二抗孵育2 h。充分洗涤后和超敏发光液作用,暗室曝光后扫描。细胞总β-catenin和核β-catenin分别以β-actin和TATA结合蛋白(TATA-binding protein,TBP)为内参。
1.4 数据统计与分析
实验结果以fs表示,应用SPSS软件完成统计分析,并进行最小显著性差异法两两比较,P<0.05为具有统计学差异。
2 结果与分析
2.1 海参脑苷脂在3T3-L1细胞增殖过程中的作用
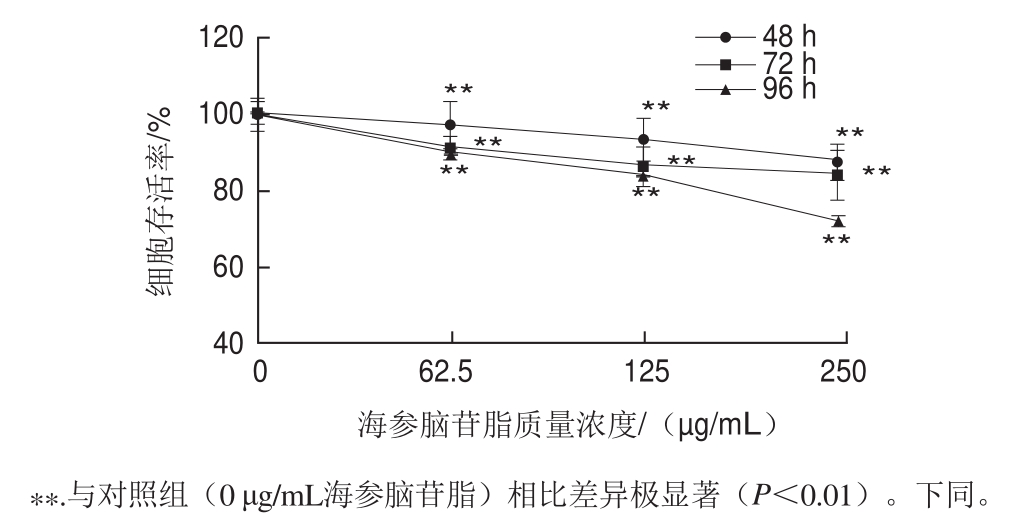
正常增殖细胞中的琥珀酸脱氢酶能与MTT结合产生不溶于水的结晶紫甲瓒,而失去增殖能力的细胞则无法和MTT相结合,因此根据这一原理可反映细胞的数目。同时,可根据MTT实验来探究受试物对细胞是否具有毒性作用。
由图1可知,与对照组相比,各质量浓度海参脑苷脂处理过的3T3-L1细胞数目均有下降趋势,而且具有时间剂量效应。其中250 μg/mL海参脑苷脂对前脂肪细胞生长的抑制率较高,作用96 h后,抑制率达到27.52%。
2.2 海参脑苷脂对3T3-L1细胞LDH分泌情况的影响
LDH广泛分布于各种组织内。若细胞受到毒性作用,则会分泌释放过多LDH。由图1可知,各质量浓度的海参脑苷脂可以不同程度地抑制3T3-L1细胞的增殖,为进一步验证海参脑苷脂是否存在毒性作用,收集了海参脑苷脂作用96 h后的细胞上清液。
由图2可知,各质量浓度海参脑苷脂对培养上清液中LDH活力均无显著影响,说明海参脑苷脂对3T3-L1细胞没有毒性作用。
2.3 海参脑苷脂对3T3-L1细胞分化过程脂质蓄积的影响
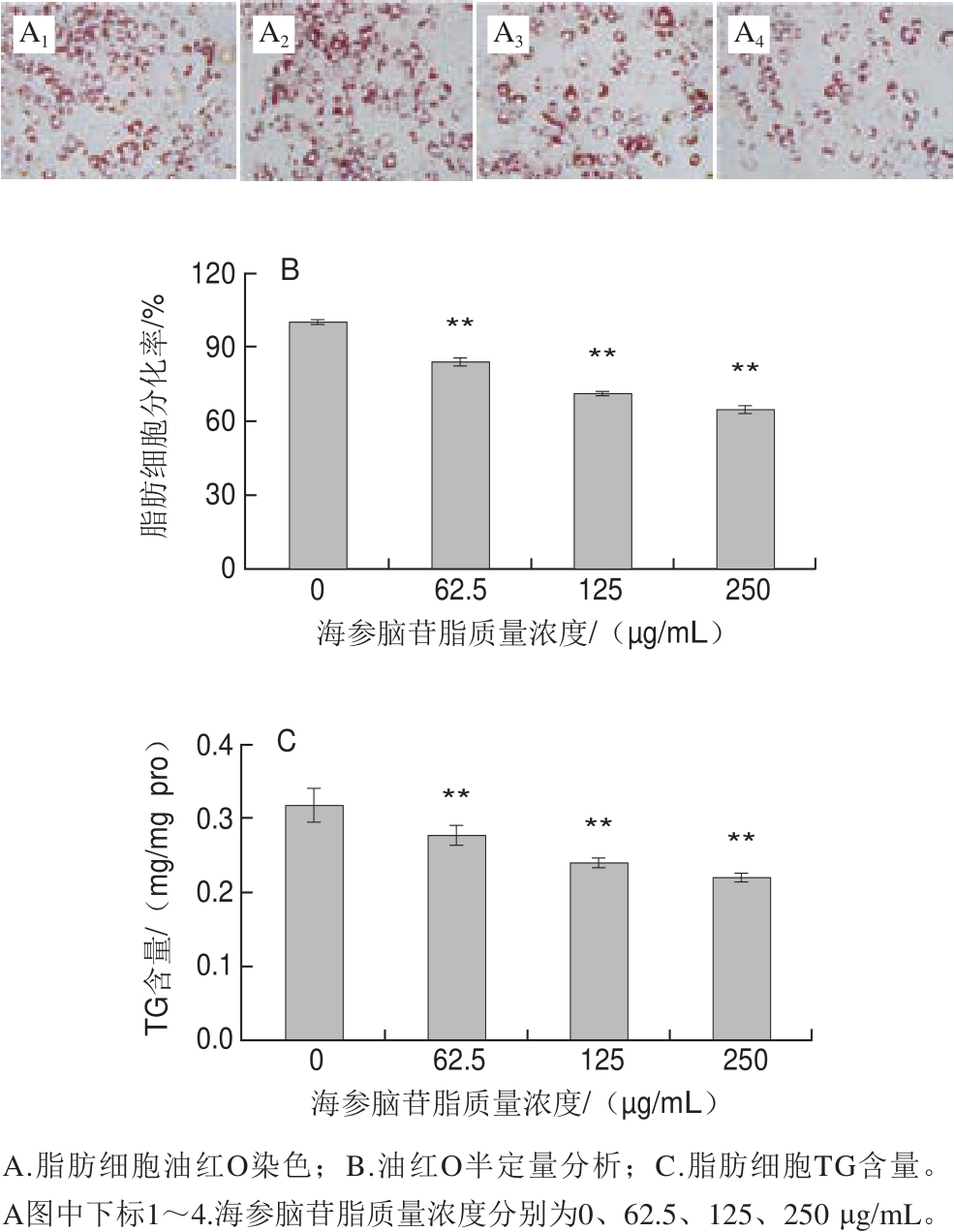
3T3-L1细胞进入分化后,细胞回缩变圆并开始出现脂滴,随着时间的推移,细胞内的脂滴会慢慢增多。如图3A所示,对照组脂肪细胞大部分具有脂滴,而且所含脂滴比较饱满,而添加不同质量浓度海参脑苷脂的脂肪细胞脂滴相应减少,并且抑制作用具有剂量效应。油红O染色实验进一步表明,海参脑苷脂可以明显阻抑3T3-L1细胞的分化,且抑制效果随质量浓度升高而加强。其中,250 μg/mL海参脑苷脂的作用最明显(图3B)。同时,测定了海参脑苷脂处理后脂肪细胞中TG含量的变化。如图3C所示,经不同质量浓度的海参脑苷脂处理后,TG含量极显著下降(P<0.01),且抑制效果随质量浓度升高而加强。其中,250 μg/mL海参脑苷脂作用最明显,相比于对照组,TG含量降低了30.67%。
2.4 海参脑苷脂对3T3-L1细胞C/EBPα和PPARγ mRNA表达的影响
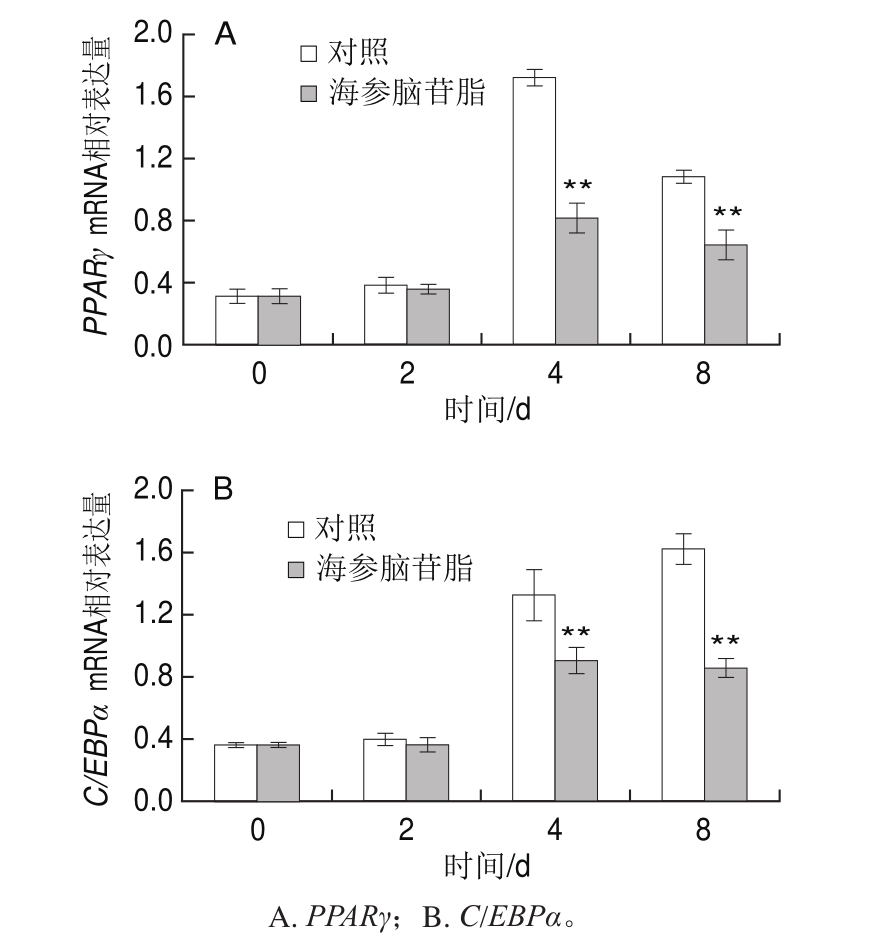
PPARγ、C/EBPα是脂肪细胞在分化过程中的关键转录调控因子,在脂肪细胞分化过程中有十分重要的作用,能够启动脂肪细胞分化有关基因的转录表达[13]。PPARγ以及C/EBPα共同作用,使脂肪特异性基因表达启动,从而促进长链脂肪酸的生成和累积[14]。
由图4可知,与对照组相比,海参脑苷脂可以极显著降低脂肪细胞分化过程中第4、8天时C/EBPα和PPARγ的mRNA表达量(P<0.01)。
2.5 海参脑苷脂对3T3-L1细胞Wnt/β-catenin通路基因mRNA表达的影响
Wnt/β-catenin通路在脂肪细胞的分化过程中扮演着非常重要的角色[15]。研究表明,FZ1作为Wnt/β-catenin通路中不可或缺的一员,是Wnt蛋白在细胞中的重要受体[16]。LRP5为LRP家族的一员,该家族在Wnt/β-catenin通路中作为辅助受体也占据着不可或缺的角色[17]。而β-catenin和脂肪细胞的分化密切相关,当其表达量升高时可以降低脂肪细胞的分化水平。
由图5可知,与对照组相比,海参脑苷脂可极显著升高3T3-L1细胞分化第2、4、8天LRP5 mRNA的表达量(P<0.01),可极显著提高细胞分化第4、8天FZ1 mRNA的表达量(P<0.01)。同时,海参脑苷脂可以显著升高3T3-L1细胞分化第4、8天的β-catenin mRNA的表达水平,与对照组相比,第4天时β-catenin mRNA的表达量升高了64.7%,第8天时升高了141.2%(P<0.01)。
2.6 海参脑苷脂对β-catenin表达及向核内转移的影响
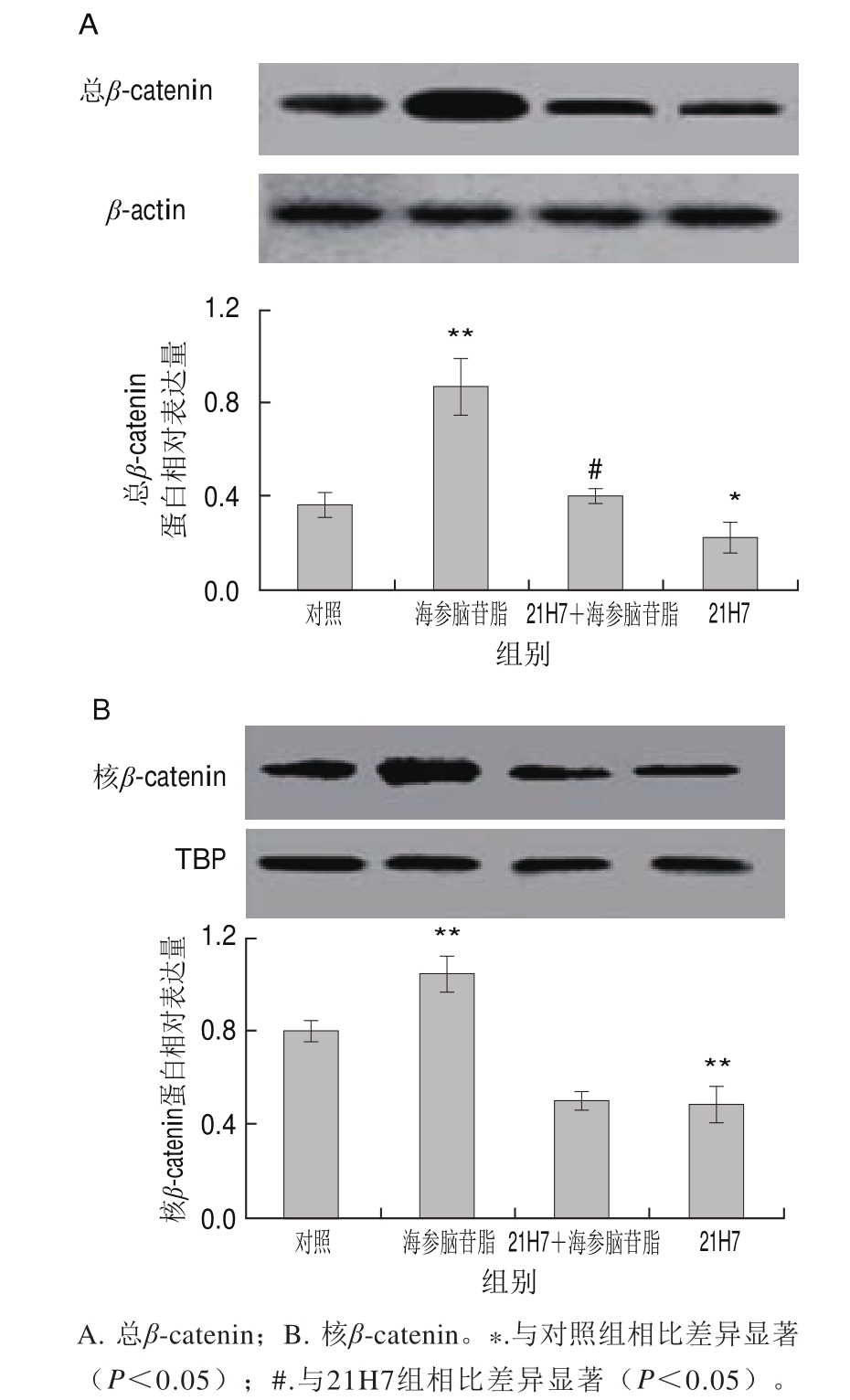
Wnt/β-catenin通路启动之后,细胞质内β-catenin的积累逐渐增加,并转移至细胞核中调控脂肪细胞分化[18]。21H7可以抑制β-catenin的表达。上述实验结果已经证明海参脑苷脂可以通过Wnt/β-catenin通路抑制脂肪细胞的分化,所以进一步通过蛋白实验研究海参脑苷脂对β-catenin向核内转移的影响。
由图6可知,与对照组相比,海参脑苷脂可升高β-catenin蛋白的表达量,并且可以极显著促进其在核内的表达(P<0.01)。21H7作用之后,细胞总β-catenin和核β-catenin的蛋白表达量显著降低(P<0.05,P<0.01);海参脑苷脂对β-catenin蛋白表达的促进作用也受到抑制,但是其可以显著改善21H7对总β-catenin的抑制作用(P<0.0 5)。综上所述,海参脑苷脂可以通过Wnt/β-catenin信号通路抑制3T3-L1细胞分化。
3 讨 论
脂肪细胞在进入分化这一进程后,首先经历细胞的扩增,同时体积变大,细胞质中开始出现载有脂质的液滴,经过一段时间后,脂滴会慢慢增大,并且聚结成一个或几个脂滴[19]。脂肪细胞数量的增加以及体积的增大伴随着更多TG的累积,Kim等研究发现,抑制TG合成酶相关基因的表达可以显著降低脂质积累[20]。Huang等研究表明,上调脂肪生成相关基因导致TG含量的增加[21]。本实验利用3T3-L1细胞研究了脑苷脂在前脂肪细胞增殖以及分化中发挥的作用,结果发现,海参脑苷脂可以明显地阻抑前脂肪细胞的增殖,并且LDH实验证明海参脑苷脂对前脂肪细胞没有毒性作用;同时海参脑苷脂可以显著降低脂肪细胞脂滴的聚集,降低脂肪细胞TG含量。以上研究说明海参脑苷脂可能具有降低脂质累积以达到减肥的目的。
脂肪细胞分化时很多转录因子会发挥各自的作用,这是一个精密复杂的转录级联调节过程,目前研究认为调节脂肪形成的主要转录因子包括PPARγ、C/EBPα[22-24]。PPARγ属于核内受体转录因子超家族,是重要的核心调节因子,具有调节脂肪形成、糖脂代谢和细胞增殖分化等生物学功能[25]。Rosen等证明PPARγ缺失的胚胎干细胞丧失脂肪细胞分化功能,说明PPARγ是脂肪细胞胚胎干细胞或胚胎成纤维细胞体外分化所必需的[26]。C/EBPα是碱性亮氨酸拉链蛋白家族的一个亚家族成,在脂肪细胞分化、发育等诸多过程扮演着重要的角色[27],并可激活众多脂肪细胞分化相关基因的转录表达,同时促进细胞中脂肪的累积[28]。本研究表明,海参脑苷脂作用后,PPARγ mRNA和C/EBPα mRNA的表达水平明显下降。说明海参脑苷脂可以通过降低PPARγ以及C/EBPα mRNA的表达水平,阻抑3T3-L1细胞的分化,从而减少脂质的积累。
Wnt/β-catenin这一通路被认为是前脂肪细胞分化最主要的负调控因子,Wnt/β-catenin通路启动时,前脂肪细胞的分化受到抑制,而当信号关闭时,前脂肪细胞就会开始进行分化[29]。研究证明当Wnt信号通路激活时,Wnt与跨膜受体Frizzled(FZD)和LRP5/6相结合引发一系列反应,激活细胞内相关的蛋白,从而引起细胞核内β-catenin蛋白表达水平的改变[30]。Kennell等的研究也表明,Wnt抑制脂肪细胞的分化也可能是通过Fzd1介导的,激活Fzd1增加了β-catenin的稳定性,抑制了脂肪形成[31]。LRP5是一个单次跨膜蛋白,具有一个相对小的胞内区域以及一个包含了多个蛋白的大的胞外区域,其胞外区域介导Wnt与FZD的结合,从而形成三元复合物[32]。此外,LRP5还存在多个独立的Wnt结合位点,可与多个Wnt同时结合,进而与FZD结合[33]。本研究结果表明,海参脑苷脂可以显著降低LRP5和FZD mRNA的表达水平,通过Wnt/β-catenin信号通路抑制脂肪细胞的分化。而β-catenin作为Wnt/β-catenin通路的核心因子,它的积累量可直接影响Wnt/β-catenin通路发挥功能。研究发现,海参脑苷脂可以显著升高β-catenin向核内转移的情况。
综上所述,海参脑苷脂可以显著抑制3T3-L1细胞的增殖以及分化过程。其机制和脂肪细胞分化关键转录因子PPARγ、C/EBPα有关。并且可以通过增加FZD和LRP5的表达激活Wnt/β-catenin通路。同时,海参脑苷脂可以使β-catenin更加稳定,促进其向核内的移动来启动Wnt/β-catenin通路。最终抑制前脂肪细胞的分化。
参考文献:
[1] RAO Y, LIU H, GAO L, et al. Discovery of natural alkaloid bouchardatine as a novel inhibitor of adipogenesis/lipogenesis in 3T3-L1 adipocytes[J]. Bioorganic & Medicinal Chemistry, 2015, 23(15): 4719-4727. DOI:10.1016/j.bmc.2015.05.057.
[2] HURSTING S D, DUNLAP S M. Obesity, metabolic dysregulation,and cancer: a growing concern and an inflammatory (and microenvironmental) issue[J]. Annals of the New York Academy of Sciences, 2012, 1271(4): 82-87. DOI:10.1111/j.1749-6632.2012.06737.x.
[3] JUNG U J, CHOI M S. Obesity and its metabolic complications: the role of adipokines and the relationship between obesity, inf l ammation,insulin resistance, dyslipidemia and nonalcoholic fatty liver disease[J].International Journal of Molecular Sciences, 2014, 15(4): 6184-6223.DOI:10.3390/ijms15046184.
[4] LIU Y Q, LUO B W, SHI R C, et al. Nonerythropoietic erythropoietinderived peptide suppresses adipogenesis, inflammation, obesity and insulin resistance[J]. Scientif i c Reports, 2015, 5: 15134. DOI:10.1038/srep15134.
[5] PEJNOVIC N N, PANTIC J M, JOVANOVIC I P, et al. Galectin-3 deficiency accelerates high-fat diet-induced obesity and amplifies inf l ammation in adipose tissue and pancreatic islets[J]. Diabetes, 2013,62(6): 1932-1944. DOI:10.2337/db12-0222.Epub2013Jan 24.
[6] KIM H J, HWANG J T, KIM M J, et al. The inhibitory effect of saponin derived from Cheonggukjang on adipocyte differentiation in vitro[J]. Food Science and Biotechnology, 2014, 23(4): 1273-1278.DOI:10.1007/s10068-014-0175-4.
[7] MOON J, DO H J, KIM O Y, et al. Antiobesity effects of quercetinrich onion peel extract on the differentiation of 3T3-L1 preadipocytes and the adipogenesis in high fat-fed rats[J]. Food & Chemical Toxicology, 2013, 58(2): 347-354. DOI:10.1016/j.fct.2013.05.006.
[8] ODEGAARD J I, CHAWLA A. Pleiotropic actions of insulin resistance and inflammation in metabolic homeostasis[J]. Science,2013, 7(1): 1-12. DOI:10.1038/s41598-017-10385-z.
[9] GAO Y, LI J, XU X, et al. Embelin attenuates adipogenesis and lipogenesis through activating canonical Wnt signaling and inhibits high-fat diet-induced obesity[J]. International Journal of Obesity,2017, 41(5): 729-738. DOI:10.1038/ijo.2017.35.
[10] KWAN H Y, WU J H, SU T, et al. Schisandrin B regulates lipid metabolism in subcutaneous adipocytes[J]. Scientif i c Reports, 2017,7(1): 10266. DOI:10.1038/s41598-017-10385-z.
[11] 桑已曙, 闵知大. 脑苷脂类化合物研究进展[J]. 中国生化药物杂志,2000, 21(4): 211-213.
[12] 张蓓, 薛长湖, 冯婷玉. 等. 海参脑苷脂对脂肪肝大鼠脂肪代谢的调节作用[J]. 浙江大学学报(医学版), 2010, 39(5): 493-498.DOI:10.3785//j.issn1008-9292.2010.05.009.
[13] JANG B C. Artesunate inhibits adipogeneis in 3T3-L1 preadipocytes by reducing the expression and/or phosphorylation levels of C/EBP-α, PPAR-γ, FAS, perilipin A, and STAT-3[J]. Biochemical and Biophysical Research Communications, 2016, 474(1): 220-225.DOI:10.1016/j.bbrc.2016.04.109.
[14] 盘道兴, 王振, 杨茂林, 等. 不同品种猪PPARγ和C/EBPα基因表达规律与肌内脂肪含量的相关[J]. 中国农业科学, 2017, 50(1): 171-182.DOI:10.3864/j.issn.0578-1752.2017.01.015.
[15] RAHMAN N, JEON M, KIM Y S. Delphinidin, a major anthocyanin,inhibits 3T3-L1 pre-adipocyte differentiation through activation of Wnt/β-catenin signaling[J]. BioFactors, 2016, 42(1): 49-59.DOI:10.1002/biof.1251.
[16] WANG Q, CHOU X, GUAN F, et al. Enhanced Wnt signalling in hepatocytes is associated with Schistosoma japonicum infection and contributes to liver fibrosis[J]. Scientific Reports, 2017, 7(1): 230.DOI:10.1038/s41598-017-00377-4.
[17] ESEN E, CHEN J, KARNER C, et al. WNT-LRP5 signaling induces warburg effect through mTORC2 activation during osteoblast differentiation[J]. Cell Metabolism, 2013, 17(5): 745-755.DOI:10.1016/j.cmet.2013.03.017.
[18] YEGANEH A, TAYLOR C G, POOLE J, et al. Trans10, cis12 conjugated linoleic acid inhibits 3T3-L1 adipocyte adipogenesis by elevating β-catenin levels[J]. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids, 2016, 1861(4): 363-370.DOI:10.1016/j.bbalip.2016.01.004.
[19] MOTA D S P, RICHARD A J, HANG H, et al. Transcriptional regulation of adipogenesis[J]. Comprehensive Physiology, 2017, 7(2):635-674. DOI:10.1002/cphy.c160022.
[20] KIM M B, SONG Y, KIM C, et al. Kirenol inhibits adipogenesis through activation of the Wnt/β-catenin signaling pathway in 3T3-L1 adipocytes[J]. Biochemical and Biophysical Research Communications,2014, 445: 433-438. DOI:10.1016/j.bbrc.2014.02.017.
[21] HUANG C W, CHEN Y J, YANG J T, et al. Docosahexaenoic acid increases accumulation of adipocyte triacylglycerol through upregulation of lipogenic gene expression in pigs[J]. Lipids in Health and Disease, 2017, 16(1): 33. DOI:10.1186/s12944-017-0428-3.
[22] GUO Liang, LI Xi, TANG Qiqun. Transcriptional regulation of adipocyte differentiation: a central role for CCAAT/enhancer-binding protein (C/EBP)β[J]. Journal of Biological Chemistry, 2015, 290(2):755-761. DOI:10.1074/jbc.R114.619957.
[23] YU K F, MO D L, WU M, et al. Activating transcription factor 4 regulates adipocyte differentiation via altering the coordinate expression of CCATT/enhancer binding protein β and peroxisome proliferator-activaated receptor γ[J]. FEBS Journal, 2014, 281(10):2399-2409. DOI:10.1111/febs.12792.
[24] KYUNGOH C, BASSEL G, COLBY M, et al. Analysis of transcription factor network underlying 3T3-L1 adipocyte differentiation[J]. PLoS ONE, 2014, 9(7): 1-17. DOI:10.1371/journal.pone.0100177.
[25] WHITE U A, STEPHENS J M. Transcriptional factors that promote formation of white adipose tissue[J]. Molecular and Cellular Endocrinology, 2010, 318(1/2): 10-14. DOI:10.1016/j.mce.2009.08.023.
[26] ROSEN E D, SARRAF P, TROY A E, et al. PPAR gamma is required for the differentiation of adipose tissue in vivo and in vitro[J]. Molecular Cell, 1999, 4: 611-617. DOI:10.1016/S1097-2765(00)80211-7.
[27] OHLSSON E, HASEMANN M S, WILLER A, et al. Initiation of MLL-rearranged AML is dependent on C/EBPα[J]. Journal of Experimental Medicine, 2014, 211(1): 5-13. DOI:10.1084/jem.20130932.
[28] WANG H, ZAN L S, WANG H B, et al. Cloning, expression analysis and sequence prediction of the CCAAT/enhancer-binding protein alpha gene of Qinchuan cattle[J]. Genetics & Molecular Research,2012, 11(2): 1651-1661. DOI:10.4238/2012.June.15.14.
[29] KIM D M, CHOI H R, PARK A, et al. Retinoic acid inhibits adipogenesis via activation of Wnt signaling pathway in 3T3-L1 preadipocytes[J]. Biochemical and Biophysical Research Communications, 2013, 434(3): 455-459. DOI:10.1016/j.bbrc.2013.03.095.
[30] MACDONALD B T, HE Xi. Frizzled and LRP5/6 receptors for Wnt/β-catenin signaling[J]. Cold Spring Harbor Perspectives in Biology, 2012, 4(12): a007880. DOI:10.1101/cshperspect.a007880.
[31] KENNELL J A, MACDOUGALD O A. Wnt signaling inhibits adipogenesis through beta-catenin-dependent and -independent mechanisms[J]. Journal of Biological Chemistry, 2005, 280(25):24004-24010. DOI:10.1074/jbc.M501080200.
[32] NIEHRS C. The complex world of WNT receptor signalling[J].Nature Reviews Molecular Cell Biology, 2012, 13(12): 767-779.DOI:10.1038/nrm3470.
[33] BOURHIS E, TAM C, FRANKE Y, et al. Reconstitution of a Frizzled8·Wnt3a·LRP6 signaling complex reveals multiple Wnt and Dkk1 binding sites on LRP6[J]. Journal of Biological Chemistry,2010, 285(12): 9172-9179. DOI:10.1074/jbc.M109.092130.
Inhibitory Effect and Mechanism of Sea Cucumber Cerebroside on the Differentiation of Preadipocytes
WANG Meiling, LIU Yaxuan, LI Chenman, LIU Yuanyuan, FU Meng, WANG Jingfeng*
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Abstract: This study aimed to observe the effect of sea cucumber cerebroside on the proliferation and differentiation of 3T3-L1 preadipocytes and to explore the underlying mechanism. The 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide assay was used to explore the effect of cerebroside on the proliferation of preadipocytes. 3T3-L1 preadipocytes were induced into mature adipocytes by the traditional cocktail method, and oil red O staining and triglyceride content of mature adipocytes were used to evaluate whether sea cucumber cerebroside could change lipid accumulation in adipocytes.The mRNA expression levels of peroxisome proliferator-activated receptor gamma (PPARγ) and CCAAT/enhancer binding protein alpha (C/EBPα) genes and those associated with the Wnt/β-catenin signaling pathway were measured by reverse transcription real-time polymerase chain reaction (qRT-PCR). The transfer of β-catenin protein to the nucleus was measured by Western blotting. Sea cucumber cerebroside could significantly inhibit the proliferation and differentiation of 3T3-L1 preadipocytes without cytotoxicity (P < 0.01). The results of qRT-PCR showed that the expression of PPARγ and C/EBPα genes and those associated with the Wnt/β-catenin signaling pathway were significantly inhibited by sea cucumber cerebroside. Western blotting results showed that sea cucumber cerebroside could significantly increase the content of β-catenin protein in nuclei (P < 0.01). In conclusion, sea cucumber cerebroside can inhibit the proliferation and differentiation of 3T3-L1 preadipocytes. The mechanism is related to the transcription factors PPARγ, C/EBPα and the Wnt/β-catenin signaling pathway.
Keywords: sea cucumber cerebroside; 3T3-L1 preadipocyte; differentiation; Wnt/β-catenin
收稿日期:2018-01-20
基金项目:“十三五”国家重点研发计划重点专项(2018YFC0311203);山东省重点研发项目(2016YYSP017)
第一作者简介:王美玲(1992—)(ORCID: 0000-0002-4262-4167),女,硕士研究生,研究方向为海洋食品营养。E-mail: 1126356751@qq.com
*通信作者简介:王静凤(1964—)(ORCID: 0000-0002-8503-4394),女,教授,博士,研究方向为海洋食品营养。E-mail: jfwang@ouc.edu.cn
DOI:10.7506/spkx1002-6630-20180120-279
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2019)09-0152-07
引文格式:王美玲, 刘亚轩, 黎晨曼, 等. 海参脑苷脂对前脂肪细胞分化的抑制作用及机制[J]. 食品科学, 2019, 40(9): 152-158.DOI:10.7506/spkx1002-6630-20180120-279. http://www.spkx.net.cn
WANG Meiling, LIU Yaxuan, LI Chenman, et al. Inhibitory effect and mechanism of sea cucumber cerebroside on the differentiation of preadipocytes[J]. Food Science, 2019, 40(9): 152-158. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180120-279. http://www.spkx.net.cn