随着社会环境和饮食习惯的改变,肥胖、高血糖和高血脂等发病率逐年上升,这些疾病已严重危害人类健康[1]。许多药食同源的中药材因含多种具有治疗疾病和预防保健作用(如降糖、降脂、增强免疫力、抗衰老等[2-3])的活性成分而受到人们青睐。从植物资源中开发一些适用一般人群的食品来调节机体功能、减少疾病发生的风险成为近年研究热点。
桑叶、苦瓜均是药食两用植物。大量研究证明,桑叶富含多糖、生物碱、黄酮等功能成分[4],具有降糖[5-6]、降脂[7-9]、抗氧化[10]等诸多生理功能;苦瓜富含多糖、皂苷和多肽等活性成分,具有降糖[11-12]、降脂[13-14]、抗氧化[15]、抗菌[16]等作用。目前关于桑叶、苦瓜及其提取物降糖、降脂、抗氧化效果的研究已有诸多报道,如Ahmed等[17]报道苦瓜提取物对链脲佐菌素(streptozotocin,STZ)诱导的糖尿病大鼠具有降脂、降糖作用;杭悦宇等[18]报道,苦瓜冻干粉对四氧嘧啶诱导的高血糖小鼠具有良好的降糖作用;Andallu等[19]在STZ诱导的糖尿病大鼠的食物中添加25%(质量分数)干桑叶粉,发现其能抑制糖尿病大鼠肝组织脂质过氧化和过氧化氢酶的活性,提高超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等抗氧化酶的活性;Jeszka-Skowron等[6]用桑叶干粉的乙醇提取物灌胃STZ诱导的非肥胖II型糖尿病大鼠,结果表明桑叶具有降血糖、提高胰岛素水平及抗氧化功能。
近几年,本实验室也进行了相关的研究,如邹莉芳等[20]发现桑叶水提物(主要含桑叶生物碱)对高脂饮食小鼠有显著降血脂作用,能有效减少脂肪积累,促进胆固醇代谢;方太松等[21]研究了不同剂量桑叶超微粉奶茶灌胃alloxan诱导的糖尿病小鼠,能显著降低实验小鼠总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)和低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)浓度,升高高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)浓度;李玲等[22]研究了桑叶-苦瓜混合粉的体外抗氧化能力,结果表明桑叶-苦瓜在体外抗氧化有协同增效作用;杨敏等[23]报道桑叶-苦瓜混合粉可显著降低糖尿病小鼠TC、TG和LDL-C浓度,升高HDL-C浓度;彭晓蝶等[24]对糖尿病小鼠灌胃不同质量浓度的桑叶-苦瓜混合粉,发现当质量浓度为0.20 g/mL,灌胃30 d后,与模型组相比,糖尿病小鼠体质量下降受到显著抑制,血糖浓度下降率超过40%,肝糖原浓度增加1 倍以上。
桑叶、苦瓜无论是单独还是混合喂饲都对糖尿病实验动物、高脂饮食实验动物均有显著的降糖、降脂、抗氧化作用,特别是混合喂饲能极显著降低糖尿病小鼠血糖,对肝糖原储存能力的增强作用优于二甲双胍(降血糖药物)[23-24]。但长期摄入桑叶-混合苦瓜粉对正常实验动物的血糖、血脂、抗氧化能力是否有调节作用,是否会造成正常动物低血糖等还鲜见报道。为了验证桑叶、苦瓜混合粉对正常实验动物无不利影响,本实验利用桑叶-苦瓜混合粉喂饲正常小鼠,测定其血糖、血脂水平及抗氧化指标并进行分析,以期为桑叶、苦瓜混合粉相关功能保健食品的开发提供参考。
昆明种清洁级小鼠,体质量25~30 g,购自重庆滕鑫有限责任公司,许可证号:SCXK(渝)2007-006。基础饲料购自重庆滕鑫有限责任公司。
桑叶品种为胜利大叶,由重庆市蚕业科学技术研究院提供,75 ℃热风干燥60 min,粉碎备用[25](干燥桑叶粉中水分4.45%(质量分数,下同)、DNJ含量227.47 mg/100 g、黄酮含量49.51 mg/g、多糖11.29%);苦瓜品种为绿玉,购于北碚雄风超市,60 ℃热风干燥8 h,粉碎备用[26](干燥苦瓜粉中含水分1.22%、皂苷2.31%、多糖7.43%、多肽0.11%)。
稳捷型血糖试纸 美国LifeScan公司;糖原测定试剂盒、SOD测定试剂盒(WST-1法)、GSH-Px测定试剂盒、MDA测定试剂盒 南京建成生物工程研究所;TC测定试剂盒、TG测定试剂盒、LDL-C测定试剂盒、HDL-C测定试剂盒 四川迈克生物科技股份有限公司;羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)(分析纯) 成都市科龙化工试剂厂。
7020型全自动生化分析仪 日本日立公司;Model680型酶标仪 美国Bio-Rad公司;ONE TOUCHTM BasicTM Plus稳捷基础倍加型血糖监测仪 美国LifeScan公司;S22可见分光光度计 上海棱光技术有限公司;5810型台式高速离心机 德国Eppendorf公司。
1.3.1 桑叶-苦瓜混合粉的制备
根据前期实验结果[24],将桑叶粉、苦瓜粉按3∶1的质量比混合后,各取5、10、15、20 g混合粉分别溶入100 mL 0.01g/mL的CMC-Na水溶液中,得到质量浓度分别为0.05、0.10、0.15、0.20 g/mL的桑叶-苦瓜混合液。
1.3.2 小鼠的分组与喂养
实验小鼠于西南大学食品科学学院动物实验房内饲养,室温(23f1)℃,相对湿度约60%,12 h光暗交替处理(7∶00ü19∶00)。实验用正常小鼠100 只,随机分为5 组,每组20 只,雌雄各半,自由进食饮水,适应性喂养1 周。各组小鼠均给予基础饲料喂养,LD组(低剂量组)、MD组(中剂量组)、HD组(高剂量组1)、GD组(高剂量组2)小鼠分别灌胃质量浓度为0.05、0.10、0.15、0.20 g/mL桑叶-苦瓜混合粉0.5 mL/d,连续灌胃30 d;NC组(对照组)灌胃同等体积的0.01 g/mL CMC-Na。
1.3.3 实验样品采集
1.3.3.1 血清采集与制备
实验小鼠灌胃30 d后,禁食不禁水12 h,完成尾静脉采血测定血糖值后,摘眼球取血,参照Tsuduki等[27]的方法制备血清,收集上清液,分装后于-80 ℃冰箱保存备用。
1.3.3.2 肝匀浆的制备
采血完毕后的小鼠颈椎脱臼处死,打开胸、腹腔,取出肝脏,用冷生理盐水漂洗除去表面血液,滤纸拭干,称质量。准确称取一定量的肝脏样品,加入9 倍体积的生理盐水,在冰浴上研磨制备肝匀浆,于3 000 r/min离心10 min,取上清液,分装后于-80 ℃冰箱保存备用。
1.3.4 指标测定
1.3.4.1 小鼠的体质量测定
在小鼠灌胃前及灌胃后的第6、12、18、24、30天分别测定小鼠的体质量,按公式(1)计算体质量增长率[28]。
式中:m0为小鼠初始体质量/g;m1为喂饲一定时间后小鼠体质量增加量/g。
1.3.4.2 血糖浓度测定
实验小鼠灌胃前和灌胃第15、30天禁食不禁水12 h,用血糖仪测定小鼠空腹血糖浓度。按公式(2)计算血糖下降率[29]。
式中:I1为灌胃前血糖浓度;I2为灌胃后血糖浓度。
1.3.4.3 糖耐量测定
各组小鼠在末次灌胃前禁食不禁水12 h后,尾静脉取血测定血糖作为空腹血糖浓度;灌胃3 h后经口给予葡萄糖2.5 g/kg mb,分别于注射后0.5、1.0、2.0 h尾静脉采血测血糖浓度。参考《保健食品检验与评价技术规范》(2003年版)[30],按公式(3)计算血糖曲线下面积(area under the curve,AUC)。
式中:cA为空腹血糖浓度/(mmol/L);cB、cC、cD分别为腹腔注射葡萄糖0.5、1.0、2.0 h后血糖浓度/(mmol/L)。
1.3.4.4 血清及肝匀浆肝糖原、血脂、抗氧化指标测定
采用全自动生化分析仪按照试剂盒说明书测定血清中TC、TG、HDL-C、LDL-C浓度;采用酶标仪按照试剂盒说明书测定肝匀浆中肝糖原含量、SOD、GSH-Px活力及MDA含量。
采用SPSS 20.0统计学软件进行统计分析,实验结果以fs表示,采用Duncan显著性差异检验进行单因素方差分析,P<0.05为差异显著,P<0.01为差异极显著,P<0.001为差异高度显著。
体质量能衡量动物包括人的健康状况,超重、肥胖或体质量过轻都不是健康的表现。以小鼠体质量增长率为指标,考察用桑叶-苦瓜混合粉喂饲一定时间对小鼠体质量的影响。
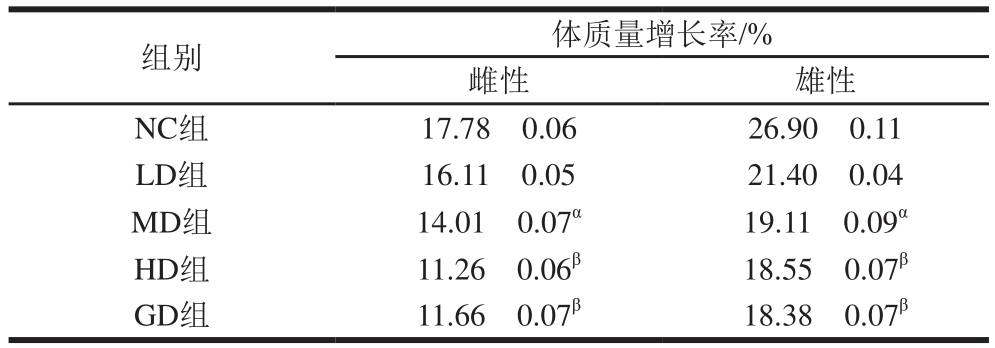
表1 桑叶-苦瓜混合粉对正常小鼠体质量增长率的影响
Table1 Effect of mulberry leaf and bitter melon powder blend on body mass gain in normal mice
注:与NC组比较,α.差异显著(P<0.05);β.差异极显著(P<0.01);下同。
组别 体质量增长率/%雌性 雄性NC组 17.78f0.06 26.90f0.11 LD组 16.11f0.05 21.40f0.04 MD组 14.01f0.07α 19.11f0.09α HD组 11.26f0.06β 18.55f0.07β GD组 11.66f0.07β 18.38f0.07β
由表1可知,在实验过程中,所有小鼠体质量均有增加且雄鼠的增长率高于雌鼠,随着桑叶-苦瓜混合粉灌胃质量浓度的增加,正常小鼠体质量增长率逐渐减小并趋于平缓。当灌胃质量浓度为0.15 g/mL,雌、雄鼠的体质量增长率分别为11.26%、18.55%,与NC组相比差异极显著(P<0.01),说明桑叶-苦瓜混合粉对雌雄小鼠的体质量有显著抑制作用;当质量浓度增加到0.20 g/mL时,抑制作用趋于稳定,与HD组(0.15 g/mL)的体质量增长率无显著差异(P>0.05)。结果表明,桑叶-苦瓜混合粉对正常雌雄小鼠的体质量增加有较好的控制作用。
血糖值反应了胰岛β细胞对胰岛素的分泌功能。桑叶、苦瓜均具有降血糖的作用,为考察桑叶-苦瓜混合粉是否会引起正常小鼠血糖浓度过多降低,测定了不同质量浓度桑叶-苦瓜混合粉灌胃30 d对正常小鼠血糖浓度的影响。
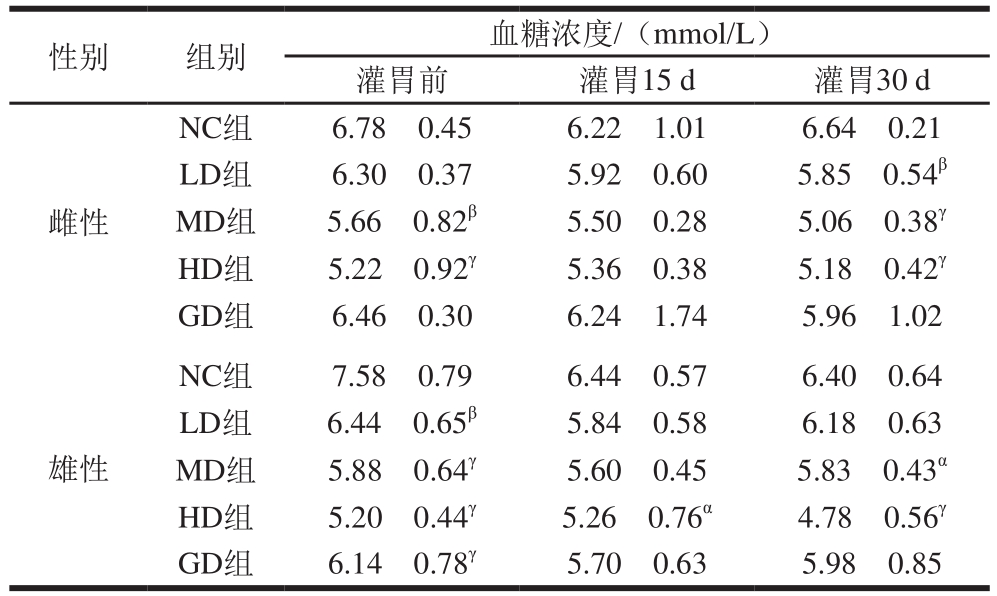
表2 桑叶-苦瓜混合粉对正常小鼠血糖浓度的影响
Table2 Effect of mulberry leaf and bitter melon powder blend on blood glucose in normal mice
注:与NC组比较,γ.差异高度显著(P<0.001)。下同。
性别 组别 血糖浓度/(mmol/L)灌胃前 灌胃15 d 灌胃30 d雌性NC组 6.78f0.45 6.22f1.01 6.64f0.21 LD组 6.30f0.37 5.92f0.60 5.85f0.54β MD组 5.66f0.82β 5.50f0.28 5.06f0.38γ HD组 5.22f0.92γ 5.36f0.38 5.18f0.42γ GD组 6.46f0.30 6.24f1.74 5.96f1.02雄性NC组 7.58f0.79 6.44f0.57 6.40f0.64 LD组 6.44f0.65β 5.84f0.58 6.18f0.63 MD组 5.88f0.64γ 5.60f0.45 5.83f0.43α HD组 5.20f0.44γ 5.26f0.76α 4.78f0.56γ GD组 6.14f0.78γ 5.70f0.63 5.98f0.85
由表2可知,NC组小鼠的血糖浓度一直维持在6.22~7.58 mmol/L范围内,相对稳定。与NC组相比,随着灌胃桑叶-苦瓜混合粉时间的延长和质量浓度的增加,各组小鼠血糖浓度有一定下降,但也维持在4.78~6.46 mmol/L范围内,本实验结果与董英[31]、玄光善[32]等研究中昆明种正常小鼠血糖浓度分别为(5.56f1.21)、(5.05f2.37)mmol/L)接近。结果表明,正常小鼠长时间服用桑叶-苦瓜混合粉,血糖浓度仍维持在正常范围,不会出现低血糖。
糖耐量即对葡萄糖的耐受能力。正常人服用一定量葡萄糖后,血糖浓度先升高,经过一段时间的代谢,葡萄糖在机体合成糖原并加以贮存,血糖浓度恢复到空腹水平。若服糖2 h后血糖浓度仍然保持较高水平,说明糖耐量能力降低,即机体对糖的吸收利用低于正常人[33]。此外,AUC反映葡萄糖被人体利用程度和清除情况,其值增大说明机体糖耐量能力下降,反之则糖耐量能力升高[24]。
表3 桑叶-苦瓜混合粉对正常小鼠糖耐量的影响
Table3 Effect of mulberry leaf and bitter melon powder blend on glucose tolerance in normal mice
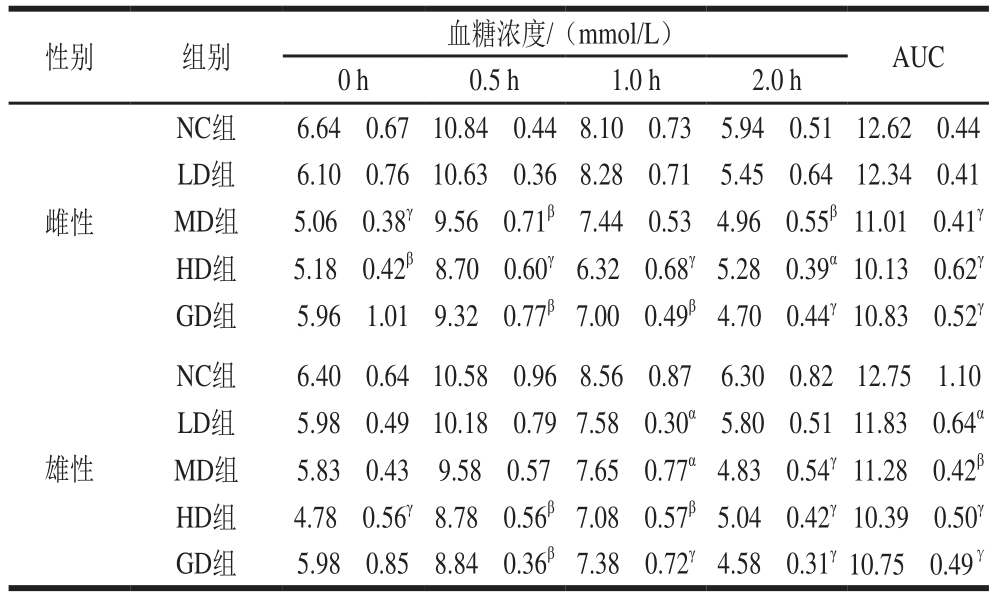
性别 组别 血糖浓度/(mmol/L) AUC 0 h 0.5 h 1.0 h 2.0 h雌性NC组 6.64f0.6710.84f0.448.10f0.73 5.94f0.5112.62f0.44 LD组 6.10f0.7610.63f0.368.28f0.71 5.45f0.6412.34f0.41 MD组 5.06f0.38γ 9.56f0.71β 7.44f0.53 4.96f0.55β 11.01f0.41γ HD组 5.18f0.42β 8.70f0.60γ 6.32f0.68γ 5.28f0.39α 10.13f0.62γ GD组 5.96f1.01 9.32f0.77β 7.00f0.49β 4.70f0.44γ 10.83f0.52γ雄性NC组 6.40f0.6410.58f0.968.56f0.87 6.30f0.8212.75f1.10 LD组 5.98f0.49 10.18f0.79 7.58f0.30α 5.80f0.51 11.83f0.64α MD组 5.83f0.43 9.58f0.57 7.65f0.77α 4.83f0.54γ 11.28f0.42β HD组 4.78f0.56γ 8.78f0.56β 7.08f0.57β 5.04f0.42γ 10.39f0.50γ GD组 5.98f0.85 8.84f0.36β 7.38f0.72γ 4.58f0.31γ10.75f0.49γ
由表3可知,N C组小鼠0 h血糖浓度为(6.64f0.67)mmol/L,注射葡萄糖后2 h其血糖浓度为(5.94f0.51)mmol/L,与空腹血糖浓度比差异无显著性(P>0.05),AUC为12.62f0.44,表明NC组小鼠对糖吸收和利用正常。喂饲不同质量浓度桑叶-苦瓜混合粉均能不同程度地降低正常小鼠葡萄糖负荷后的血糖浓度,降低AUC,提高正常小鼠糖耐量。与NC组比较,HD组雌、雄鼠餐后AUC别为10.13f0.62、10.39f0.50(P<0.001),达到最低,下降率分别为19.73%、18.51%。结果表明,不同质量浓度桑叶-苦瓜混合粉均能显著降低小鼠餐后2 h血糖浓度,具有提高正常小鼠糖耐量的作用。
当血糖升高时可在肝脏合成糖原,血糖降低,肝糖原将分解为葡萄糖以补充血糖。因此,肝糖原对维持血糖稳定十分重要[34]。正常饮食能不断补充肝糖原,减少糖原的异生作用。肝糖原的合成和降解受到胰岛素的控制,当胰岛素控制失调,肝糖原的合成也会失调[35]。
表4 桑叶-苦瓜混合粉对正常小鼠肝糖原含量的影响
Table4 Effect of mulberry leaf and bitter melon powder blend on hepatic glycogen level in normal mice
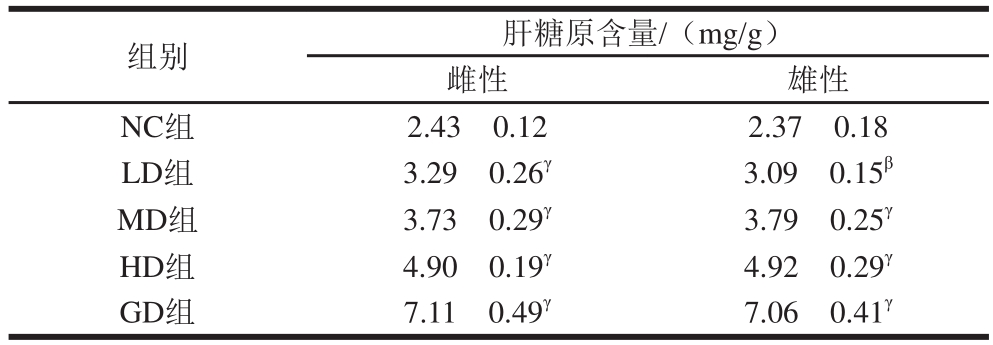
组别 肝糖原含量/(mg/g)雌性 雄性NC组 2.43f0.12 2.37f0.18 LD组 3.29f0.26γ 3.09f0.15β MD组 3.73f0.29γ 3.79f0.25γ HD组 4.90f0.19γ 4.92f0.29γ GD组 7.11f0.49γ 7.06f0.41γ
由表4可知,N C组小鼠肝糖原含量维持在2.37~2.43 mg/g。随着灌胃桑叶-苦瓜混合粉质量浓度的增加,小鼠肝糖原含量随之增加,呈现明显的剂量-效应关系。与NC组相比,GD组雌、雄小鼠肝糖原含量分别增长了1.93、1.98 倍。结果表明,桑叶-苦瓜混合粉能增加正常小鼠肝糖原的合成,有助于实验小鼠血糖浓度保持在稳定水平。
血脂是血浆中所含脂类的总称,主要包括胆固醇和甘油三酯,血脂变化可反映体内脂质代谢的情况。血脂水平的升高与动脉粥样硬化的发生有关,尤其是当LDL-C浓度过高,其沉积于动脉血管壁形成粥样斑块;HDL-C可把动脉壁上的胆固醇逆向转运到肝脏中进行代谢后排出体外,从而减少胆固醇在动脉壁上的沉积[36]。在一定程度上降低LDL-C、升高HDL-C浓度有助于预防动脉粥样硬化[37]。
表5 桑叶-苦瓜混合粉对正常小鼠血脂浓度的影响
Table5 Effect of mulberry leaf and bitter melon powder blend on blood lipids in normal mice mmol/L
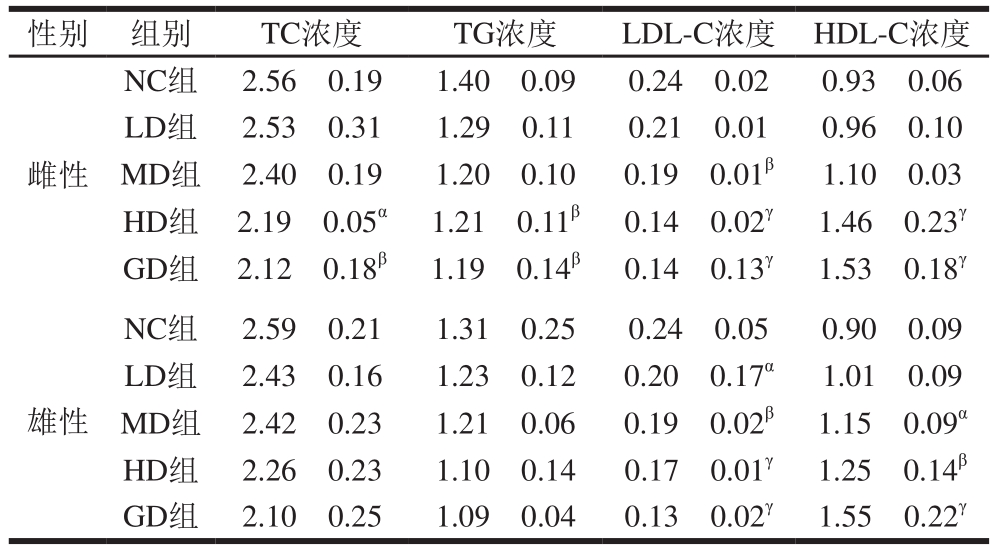
性别 组别 TC浓度 TG浓度 LDL-C浓度 HDL-C浓度雌性NC组 2.56f0.19 1.40f0.09 0.24f0.02 0.93f0.06 LD组 2.53f0.31 1.29f0.11 0.21f0.01 0.96f0.10 MD组 2.40f0.19 1.20f0.10 0.19f0.01β 1.10f0.03 HD组 2.19f0.05α 1.21f0.11β 0.14f0.02γ 1.46f0.23γ GD组 2.12f0.18β 1.19f0.14β 0.14f0.13γ 1.53f0.18γ雄性NC组 2.59f0.21 1.31f0.25 0.24f0.05 0.90f0.09 LD组 2.43f0.16 1.23f0.12 0.20f0.17α 1.01f0.09 MD组 2.42f0.23 1.21f0.06 0.19f0.02β 1.15f0.09α HD组 2.26f0.23 1.10f0.14 0.17f0.01γ 1.25f0.14β GD组 2.10f0.25 1.09f0.04 0.13f0.02γ 1.55f0.22γ
由表5可知,与NC组相比,随着桑叶-苦瓜混合粉灌胃质量浓度的增加,正常小鼠血清TC、TG、LDL-C浓度下降,HDL-C浓度上升。各组之间的LDL-C、HDL-C浓度存在高度显著差异(P<0.001),呈现剂量-效应关系。与NC组相比,GD组雌鼠TC、TG、LDL-C浓度分别下降17.19%、15.00%、41.67%(P<0.01,P<0.001),雄鼠TC、TG浓度无显著变化,LDL-C浓度下降45.83%(P<0.001);雌、雄鼠HDL-C浓度分别上升64.52%、72.22%(P<0.001)。结果表明,桑叶-苦瓜混合粉对正常小鼠TC、TG、LDL-C、HDL-C浓度有调节作用,特别是对LDL-C、HDL-C浓度影响明显。
抗氧化物质可减少机体自由基的产生,降低自由基的副作用。SOD、GSH-Px、MDA是常用的反映组织抗氧化能力和氧化损害程度的指标,其中MDA是脂质过氧化反应的主要代谢产物,可严重破坏细胞膜结构;而SOD、GSH-Px等构成了机体重要的抗氧化酶系统,可减少氧自由基的产生,防止脂质过氧化及其中间代谢产物对机体的损害[38-39]。研究表明,桑叶、苦瓜单独使用均能增强糖尿病鼠的抗氧化能力[40-41]。桑叶-苦瓜混合粉对正常小鼠肝脏抗氧化能力影响的结果如表6所示。
表6 桑叶-苦瓜混合粉对正常小鼠抗氧化指标的影响
Table6 Effect of mulberry leaf and bitter melon powder blend on hepatic antioxidant parameters in normal mice

性别 组别 SOD活力/(U/mg pro)GSH-Px活力/(U/mg pro)MDA含量/(nmol/mg pro)雌性NC组 170.33f16.88 278.25f34.06 3.16f0.34 LD组 175.30f15.66 300.62f9.47 3.08f0.64 MD组 187.87f8.42β 309.68f30.07 2.91f0.10 HD组 219.86f18.52γ 344.45f17.47β 2.70f0.32 GD组 241.48f8.14γ 359.04f26.18γ 2.00f0.25γ雄性NC组 164.31f15.24 281.93f22.65 3.26f0.27 LD组 174.63f21.39 294.68f8.16 2.95f0.13 MD组 192.28f7.81γ 316.11f32.33 2.55f0.26β HD组 217.63f24.07γ 339.74f15.68β 2.42f0.38γ GD组 243.86f5.54γ 358.65f22.84γ 2.03f0.30γ
由表6可知,与NC组相比,随着桑叶-苦瓜混合粉灌胃质量浓度的增加,正常小鼠肝脏SOD、GSH-Px活力随之增强,MDA含量逐渐减少。各组之间的SOD、G S H-P x活力、M D A含量存在高度显著差异(P<0.001),呈现明显的剂量-效应关系。与NC组相比,GD组雌鼠SOD、GSH-Px活力分别上升41.77%、29.04%(P<0.001),MDA含量下降36.71%(P<0.001);雄鼠SOD、GSH-Px活力分别上升48.41%、27.21%(P<0.001),MDA含量下降37.73%(P<0.001)。结果表明,一定剂量的桑叶-苦瓜混合粉可增强正常小鼠的抗氧化能力,减少脂质过氧化物的产生,保护细胞免受氧化损伤,保证肝脏脂质代谢正常。
本实验室前期研究表明,桑叶-苦瓜联合作用对糖尿病小鼠具有很强的降糖、降脂功能[23-24]。桑叶主要活性成分多糖、生物碱对α-葡萄糖苷酶均有抑制作用,在高质量浓度下具有协同作用[42],进而发挥降血糖的作用。桑叶中的黄酮类物质一方面可作为α-葡萄糖苷酶抑制剂[43],另一方面可作为胰岛素促分泌剂来降低血糖水平[44]。苦瓜皂苷对α-葡萄糖苷酶虽无抑制,但能显著提高正常小鼠糖耐量,恢复胰岛β细胞的活力,刺激肝糖原合成同时抑制肝糖原释放,提高机体肝糖原的贮存能力[45]。苦瓜皂苷还能够增强巨噬细胞分泌肿瘤坏死因子-α,诱导和增强SOD和GSH-Px的活力。此外,桑叶和苦瓜均富含多酚类物质,因其具有清除自由基、增强抗氧化能力的作用,可保护机体免受氧化应激的伤害,能有效预防动脉粥样硬化等心血管疾病的发生[46]。
鉴于桑叶、苦瓜两种药食同源植物对糖尿病及高脂血症小鼠均具有降糖、降脂、抗氧化的功效,为了验证桑叶、苦瓜混合使用对正常实验动物无不利影响,本实验采用桑叶-苦瓜混合粉喂饲正常小鼠,实验结果显示,随着灌胃质量浓度增加和时间延长,桑叶-苦瓜混合粉能有效地控制小鼠的体质量增长;不会引起正常小鼠低血糖,同时还能提高正常小鼠血糖调节能力,促进肝糖原合成;此外,一定质量浓度的桑叶-苦瓜混合粉可调节小鼠血脂浓度,有效预防高血脂症,增强抗氧化能力,保护肝脏细胞免受氧化损伤,保证肝脏脂代谢的稳定性。这些结果均表明桑叶和苦瓜混合饲喂对正常实验动物并无不利影响,这为桑叶、苦瓜混合粉开发相关功能保健食品的适用性提供了参考依据。
[1] 国家卫生和计划生育委员会. 中国居民营养与慢性病状况报告[R].北京: 国家卫生和计划生育委员会, 2015. [2017-12-15]. http://www.nhc.gov.cn/jkj/s5879/201506/4505528e65f3460fb88685081ff158a2.shtml.
[2] 薛立英, 高丽, 秦雪梅, 等. 药食同源中药抗衰老研究进展[J]. 食品科学, 2017, 38(15): 302-309. DOI:10.7506/spkx1002-6630-201715047.
[3] 张家瑜. 2型糖尿病药食同源营养干预研究[D]. 北京: 北京协和医学院, 2016: 50-56.
[4] 张欧, 谭志平, 李颜屏. 中药桑叶的药理作用及其临床应用分析[J]. 中国医药指南, 2013, 11(6): 265-266. DOI:10.3969/j.issn.1671-8194.2013.06.211.
[5] DEVI D V, UROOJ A. Antihyperglycemic and hypolipidemic effect of Morus indica L. in streptozotocin induced diabetic rats[J]. Annals of Phytomedicine, 2014, 3(2): 55-59.
[6] JESZKA-SKOWRON M, FLACZYK E, JESZKA J, et al. Mulberry leaf extract intake reduces hyperglycaemia in streptozotocin (STZ)-induced diabetic rats fed high-fat diet[J]. Journal of Functional Foods,2014, 8: 9-17. DOI:10.1016/j.jff.2014.02.018.
[7] TOND S B, FALLAH S, SALEMI Z, et al. Inf l uence of mulberry leaf extract on serum adiponectin, visfatin and lipid prof i le levels in type 2 diabetic rats[J]. Brazilian Archives of Biology and Technology, 2016,59: 1-8. DOI:10.1590/1678-4324-2016160297.
[8] KOJIMA Y, KIMURA T, NAKAGAWA K, et al. Effects of mulberry leaf extract rich in 1-deoxynojirimycin on blood lipid profiles in humans[J]. Journal of Clinical Biochemistry and Nutrition, 2010,47(2): 155-161. DOI:10.3164/jcbn.10-53.
[9] PENG C H, LIU L K, CHUANG C M, et al. Mulberry water extracts possess an anti-obesity effect and ability to inhibit hepatic lipogenesis and promote lipolysis[J]. Journal of Agricultural and Food Chemistry,2011, 59(6): 2663-2671. DOI:10.1021/jf1043508.
[10] KATSUBE T, YAMASAKI M, SHIWAKU K, et al. Effect of fl avonol glycoside in mulberry (Morus alba L.) leaf on glucose metabolism and oxidative stress in liver in diet-induced obese mice[J]. Journal of the Science of Food and Agriculture, 2010, 90(14): 2386-2392.DOI:10.1002/jsfa.4096.
[11] MOMOH J, AKORO S M, GODONU K G. Hypoglycemic and hepatoprotective effects of Vernonia amygdalina (bitter leaf) and its effect on some biochemical parameters in alloxan-induced diabetic male albino rats[J]. Science Journal of Biochemistry, 2014, 2014: 1-7.DOI:10.7237/sjbt/194.
[12] RAHMAN I U, RAHMAN K U, BASHIR M, et al. Lower hypoglycemic but higher antiatherogenic effects of bitter melon than glibenclamide in type 2 diabetic patients[J]. Nutrition Journal, 2015,14: 1-7. DOI:10.1186/1475-2891-14-13.
[13] SAEED F M, ARSHAD M S, NISA M U, et al. Hypoglycemic and hypolipidemic effects of different parts and formulations of bitter gourd (Momordica charantia)[J]. Lipids in Health and Disease, 2017,16(1): 211. DOI:10.1186/s12944-017-0602-7.
[14] SANI F A, ATIKU M K, IMAM A A. Effect of oral administration of aqueous leaf extract of Momordica charantia (bitter melon) on serum glucose, and lipid profile in alloxan-induced diabetic rats[J].Bayero Journal of Pure and Applied Sciences, 2015, 8(2): 170-174.DOI:10.4314/bajopas.v8i2.28.
[15] WU S J, NG L T. Antioxidant and free radical scavenging activities of wild bitter melon (Momordica charantia Linn. var. abbreviata Ser.) in Taiwan[J]. LWT-Food Science and Technology, 2008, 41(2): 323-330.DOI:10.1016/j.lwt.2007.03.003.
[16] BAI J, ZHU Y, DONG Y. Response of gut microbiota and inf l ammatory status to bitter melon (Momordica charantia L.) in high fat diet induced obese rats[J]. Journal of Ethnopharmacology, 2016,194: 717-726. DOI:10.1016/j.jep.2016.10.043.
[17] AHMED I, LAKHANI M S, GILLETT M, et al. Hypotriglyceridemic and hypocholesterolemic effects of anti-diabetic Momordica charantia(karela) fruit extract in streptozotocin-induced diabetic rats[J]. Diabetes Research and Clinical Practice, 2001, 51(3): 155-161. DOI:10.1016/S0168-8227(00)00224-2.
[18] 杭悦宇, 周义锋, 陈重明, 等. 苦瓜冻干粉对动物的降血糖作用及急性毒性[J]. 植物资源与环境学报, 2000(3): 19-21. DOI:10.3969/j.issn.1674-7895.2000.03.006.
[19] ANDALLU B, KUMAR A V V, VARADACHARYULU N C.Oxidative stress in streptozocin-diabetic rats: amelioration by mulberry(Morus indica L.) leaves[J]. Chinese Journal of Integrative Medicine,2012, 32(12): 1-6. DOI:10.1007/s11655-012-1234-4.
[20] 邹莉芳, 王玲, 丁晓雯, 等. 桑叶水提物预防小鼠高脂血症的作用研究[J]. 食品安全质量检测学报, 2016, 7(8): 3039-3045.
[21] 方太松, 朱帅, 丁晓雯, 等. 桑叶超微粉奶茶降脂功效的评价[J]. 现代食品科技, 2017, 33(12): 23-28.
[22] 李玲, 秦樱瑞, 丁晓雯, 等. 桑叶-苦瓜混合提取液的体外抗氧化性研究[J]. 食品科技, 2016, 41(12): 194-198. DOI:10.136684/j.cnki.spkj.2016.12.039.
[23] 杨敏, 丁晓雯, 秦樱瑞, 等. 桑叶-苦瓜混合粉对糖尿病小鼠血脂的影响[J]. 现代食品科技, 2017, 33(8): 12-17; 40. DOI:10.13982/j.mfst.1673-9078.2017.8.003.
[24] 彭晓蝶, 秦樱瑞, 黄先智, 等. 桑叶-苦瓜混合粉对糖尿病小鼠的降糖作用[J]. 现代食品科技, 2017, 33(4): 31-37. DOI:10.13982/j.mfst.1673-9078.2017.4.006.
[25] 秦樱瑞, 曾艺涛, 杨娟, 等. 干燥方式对桑叶降糖活性成分含量的影响[J]. 食品科学, 2015, 36(17): 71-76. DOI:10.7506/spkx1002-6630-201517014.
[26] 秦樱瑞, 黄先智, 曾艺涛, 等. 干燥方法对苦瓜降糖成分含量的影响[J]. 食品科学, 2015, 36(15): 56-61. DOI:10.7506/spkx1002-6630-201515012.
[27] TSUDUKI T, NAKAMURA Y, HONMA T, et al. Intake of 1-deoxynojirimycin suppresses lipid accumulation through activation of the β-oxidation system in rat liver[J]. Journal of Agricultural and Food Chemistry, 2009, 57(22): 11024-11029. DOI:10.1021/jf903132r.
[28] 潘士佳. 桑叶和苦瓜降糖成分的提取及药理活性考察[D]. 青岛: 青岛科技大学, 2011: 58-65. DOI:10.7666/d.y2039949.
[29] 陈福君, 卢军, 张永煜. 桑的药理研究(I): 桑叶降血糖有效组分对糖尿病动物糖代谢的影响[J]. 沈阳药科大学学报, 1996(1): 24-27.DOI:10.14066/j.cnki.cn21-1349/r.1996.01.006.
[30] 卫生部. 保健食品检验与评价技术规范(2003年版)[S]. 北京: 中国标准出版社, 2003.
[31] 董英, 张慧慧. 苦瓜多糖降血糖活性成分的研究[J]. 营养学报,2008(1): 54-56. DOI:10.3321/j.issn:0512-7955.2008.01.011.
[32] 玄光善, 潘士佳, 南姬. 桑叶有效成分降糖作用研究[J]. 食品科学,2011, 32(7): 323-326.
[33] 邓子玄, 周健, 贾伟平. 2014年美国糖尿病学会糖尿病医学诊治标准更新内容解读[J]. 中国医学前沿杂志(电子版), 2014, 6(1): 66-73.DOI:10.3969/j.issn.1674-7372.2014.01.025.
[34] 朱大年, 王庭槐. 生理学[M]. 北京: 人民卫生出版社, 2013: 210.
[35] 陈小萍, 林国斌, 郑丽红. 影响动物肝糖原测定因素的分析[J]. 中国卫生检验杂志, 1999(4): 281-282.
[36] 庄瑞丰. 中药降血脂作用研究进展[J]. 河北医药, 2009, 31(9): 1119-1121. DOI:10.3969/j.issn.1002-7386.2009.09.054.
[37] 胡军. LDL-C、HDL-C和IMT与动脉粥样硬化的关系[J]. 中国实用医药, 2013, 8(16): 85-86. DOI:10.3969/j.issn.1673-7555.2013.16.048.
[38] 林勇, 刘仲华, 林海燕, 等. 茯砖茶水提物对高脂血症小鼠脂质代谢的影响及其抗氧化作用的研究[J]. 食品安全质量检测学报, 2015,6(5): 1561-1566.
[39] HUSSAIN H E M A. Hypoglycemic, hypolipidemic and antioxidant properties of combination of Curcumin from Curcuma longa,Linn, and partially purified product from Abroma augusta, Linn.in streptozotocin induced diabetes[J]. Indian Journal of Clinical Biochemistry, 2002, 17(2): 33-43. DOI:10.1007/BF02867969.
[40] SATHISHSEKAR D, SUBRAMANIAN S. Antioxidant properties of Momordica Charantia (bitter gourd) seeds on streptozotocin induced diabetic rats[J]. Asia Pacif i c Journal of Clinical Nutrition, 2005, 14(2):153-158.
[41] ANDALLU B, VARADACHARYULU N C. Antioxidant role of mulberry (Morus indica L. cv. Anantha) leaves in streptozotocindiabetic rats[J]. Clinica Chimica Acta, 2003, 338(1): 3-10.DOI:10.1016/S0009-8981(03)00322-X.
[42] 郝蒙蒙, 崔汉钊, 韩爱芝, 等. 药桑叶中活性物质的提取及对α-葡萄糖苷酶的抑制作用[J]. 食品科学, 2018, 39(19): 19-23. DOI:10.7506/spkx1002-6630-201819004.
[43] HONG H C, LI S L, ZHANG X Q, et al. Flavonoids with α-glucosidase inhibitory activities and their contents in the leaves of Morus atropurpurea[J]. Chinese Medicine, 2013, 8(1): 19. DOI:10.1186/1749-8546-8-19.
[44] 陈玲玲, 刘炜, 陈建国, 等. 桑叶黄酮对糖尿病小鼠调节血糖的作用机制研究[J]. 中国临床药理学杂志, 2010, 26(11): 835-838.DOI:10.3969/j.issn.1001-6821.2010.11.009.
[45] 石雪萍, 姚惠源. 苦瓜皂甙降糖机理研究[J]. 食品科学, 2008, 29(2):366-368. DOI:10.3321/j.issn:1002-6630.2008.02.080.
[46] FENG R Z, WANG Q, TONG W Z, et al. Extraction and antioxidant activity of flavonoids of Morus nigra[J]. International Journal of Clinical and Experimental Medicine, 2015, 8(12): 22328-22336.
Effect of Mulberry Leaf and Bitter Melon Powder Blend on Blood Glucose, Blood Lipid and Antioxidant Status in Mice
WANG Zuwen, QIN Yingrui, HUANG Xianzhi, et al. Effect of mulberry leaf and bitter melon powder blend on blood glucose, blood lipid and antioxidant status in mice[J]. Food Science, 2019, 40(9): 166-172. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20180119-272. http://www.spkx.net.cn