黄酒通过肠肌间神经丛抑制大鼠离体小肠的收缩
王 聪,赵 盼,周亚男,王天霞,孙海基*
(山东师范大学生命科学学院,山东 济南 250014)
摘 要:目的:观察不同剂量的黄酒对大鼠离体小肠平滑肌收缩的影响并探究其可能的机制。方法:用低、中、高剂量的黄酒,乙醇,去多酚黄酒分别刺激大鼠离体小肠,RM6240多道生理信号采集系统记录大鼠离体小肠各节段加药前1 min和加药后第2分钟的收缩曲线,用肠道全层铺片免疫组织化学和Western blot技术检测大鼠肠肌间神经丛乙酰胆碱转移酶(choline acetyltransferase,ChAT)和一氧化氮合成酶(nitric oxide synthase,NOS)的表达。结果:与黄酒处理前相比较,中、高剂量(黄酒体积分数分别为3.5%、10.0%)的黄酒能明显抑制大鼠离体小肠的收缩幅度,抑制率分别为58%和100%;而中剂量的乙醇对离体小肠的收缩无明显的影响,高剂量的乙醇能显著抑制离体小肠的收缩幅度(抑制率为47.5%)。与处理前比较,经中、高剂量去多酚黄酒处理后,离体小肠运动幅度明显降低(P<0.05),抑制率分别为48%和67%。黄酒组肠肌间神经丛ChAT蛋白的表达量显著减少,而NOS蛋白的表达量显著增加。结论:黄酒对离体小肠收缩有明显的抑制作用,其作用与黄酒中的乙醇和多酚成分有关。黄酒可能通过抑制肌间神经丛中兴奋性神经递质乙酰胆碱的释放,促进抑制性神经递质一氧化氮的释放,而导致离体小肠的收缩受到抑制。黄酒能通过影响肌间神经丛内神经元的活性,抑制小肠运动,减缓胃肠机能亢进,为黄酒的保健功能研究及推广提供了理论依据。
关键词:黄酒;小肠运动;肌间神经丛;乙酰胆碱;一氧化氮
黄酒是我国历史悠久的传统酿造酒,其以独特的复式发酵工艺酿造,与啤酒、葡萄酒并列成为世界三大酿造酒。黄酒内含有丰富的碳水化合物、氨基酸、维生素、微量元素、酚类、黄酮类、生物活性肽等多种活性物质,适量常饮有助于血液循环,有促进新陈代谢、舒筋活血、强身健体、延年益寿等功效[1-3]。黄酒的保健功能历来倍受推崇,但是与红酒、葡萄酒、清酒相比,对黄酒的研究大多集中在理化检测和发酵工艺等方面,对黄酒的保健功效缺乏深入科学的研究。谢广发的研究认为黄酒具有排铅、增强学习记忆能力、增强免疫能力、延缓衰老、抗氧化、提高耐缺氧能力等多种保健功能[3]。沈赤通过研究免疫缺陷小鼠发现,黄酒可以有效提高免疫缺陷小鼠的免疫功能[4]。中医认为,适量饮用黄酒具有通曲脉、厚肠胃、养脾气、扶肝、除风等多种保健生理功能。本课题组通过小鼠游泳和亚急性衰老小鼠模型实验分别探讨了黄酒对抗疲劳能力以及亚急性衰老小鼠免疫器官的作用,结果表明黄酒能提高小鼠的抗疲劳能力,增强衰老小鼠的免疫能力[5]。但黄酒对胃肠生理功效的影响,还鲜有报道。本研究用低、中、高剂量的黄酒和去多酚黄酒分别处理大鼠离体的小肠,观察黄酒对小肠收缩的影响,用免疫组化和Western blot技术检测大鼠肠肌间神经丛乙酰胆碱转移酶(choline acetyltransferase,ChAT)和一氧化氮合成酶(nitric oxide synthase,NOS)蛋白的表达,探讨其可能的影响机制,进一步明确黄酒保健养生的功效和机制,为黄酒价值的提升和黄酒的推广提供科学依据。
1 材料与方法
1.1 动物、材料与试剂
雄性Wistar大鼠,体质量200~220 g,由山东大学实验动物中心提供,许可证号:SCXK(鲁)2013-0009,控制室温(20f5)℃饲养,动物自由饮水和摄食。
黄酒(乙醇体积分数为8%)由河北省农林科学院谷子研究所提供;小米筛选除杂、浸渍、沥水、蒸煮、冷却,添加酒曲化酵母发酵,最后压榨、澄清、过滤获得产品[6]。
免疫组化检测试剂盒 北京中杉金桥生物技术有限公司。
1.2 仪器与设备
WD-9405B型水平摇床 北京市六一仪器厂;HW-200S恒温平滑肌实验系统 成都泰盟软件有限公司;RM6240多道生理信号采集处理系统、HH-S2型数显恒温水浴锅 江苏省金坛市医疗仪器厂;SartoriusAG BS200S-WE1精密电子天平、BS型电子天平 德国塞多利斯公司;光学显微镜、YM200数字摄像机 德国Leica公司。
1.3 方法
1.3.1 黄酒对大鼠离体小肠收缩的影响
大鼠经饥饿处理后,颈椎脱臼法处死,迅速沿腹正中线剖开腹部,取小肠,用预冷的台氏液洗净肠段内容物,剪成约1.5 cm长的肠段备用。小肠段两端用细线结扎,一端的结扎线固定于进气支架上,肠段的另一端结扎线与张力换能器相连,适当调节换能器的位置与高度,使离体小肠段垂直悬浮于实验管中央,避免与管壁内侧接触而影响实验结果,让肠段在实验管内稳定15 min后记录小肠的收缩曲线。先记录5 min的正常收缩曲线,分别用低(1.5%(体积分数,下同))、中(3.5%)、高(10.0%)剂量的黄酒,乙醇溶液和去多酚黄酒处理,记录给药后5 min的收缩曲线。收缩曲线离开基线,上升达峰顶后下降回到基线的过程称为一次收缩,峰顶和基线之间的幅度即为该收缩波的收缩幅度,完成一次收缩所用的时间即为收缩时程。统计加药前1 min和加药后第2分钟的收缩曲线的幅度和频率。
1.3.2 小肠肌间神经丛ChAT和NOS阳性神经元的表达
1.3.2.1 免疫组织化学技术检测肌间神经丛蛋白的表达
取台氏液组和低、中、高剂量黄酒组的肠段,向肠管中灌入固定液(体积分数4%多聚甲醛和0.1 mol/L pH 7.4磷酸盐缓冲溶液(phosphate buffered saline,PBS)配制)充盈肠段,4 ℃固定6~8 h,随后用质量分数20%的蔗糖溶液(PBS溶解)4 ℃脱水至肠管下沉,撕片法剥离肠段纵肌层,置于盛有0.01 mol/L pH 7.4 PBS中,备用。
用PBS冲洗肠片置于体积分数3%过氧化氢-甲醇溶液中室温孵育后,用0.01 mol/L PBS洗涤,加封闭液(0.01 mol/L PBS、正常山羊血清原液、质量分数10% Triton X-100)封闭,用1∶500兔抗ChAT抗体和1∶300兔抗NOS一抗、二抗处理。显色,贴片,自然风干,经脱水、透明后封片。晾干后的装片物用互动实验室数字显微图像处理系统软件(配有YM200数字摄像机、MiE3.1显微图像处理软件)10h10 倍观察并拍照。
1.3.2.2 Western blot检测小肠肌间神经丛蛋白表达
取小肠段,4 ℃台氏液清洗,滤纸吸去水分,将组织放入预冷的1.5 mL离心管里,加入适量RIPA裂解液,用电动研磨器裂解蛋白,裂解充分后,12 000 r/min、4 ℃离心15 min,吸上清液,根据实验需要取适量蛋白样本,再加入一定比例的5×蛋白上样缓冲液,漩涡振荡,沸水煮5~10 min,进行蛋白定量。实验时,取20 μg的总蛋白加入到质量分数10%十二烷基硫酸钠-聚丙烯酰胺凝胶中进行垂直凝胶电泳,电转移至聚偏二氟乙烯膜,室温封闭洗膜后加ChAT和NOS一抗、二抗处理,ECL化学发光试剂盒曝光显影,以GAPDH为对照。用凝胶成像系统及Image J v1.42图像分析软件进行灰度分析,以目的蛋白与对照蛋白条带灰度比值表示目的蛋白表达量。
1.4 数据统计分析
采用SPSS 19.0统计软件对各项指标进行统计,各组间比较用单因素方差分析,实验数据用fs表示,P<0.05为差异有统计学意义。
2 结果与分析
2.1 黄酒对大鼠离体小肠运动的影响
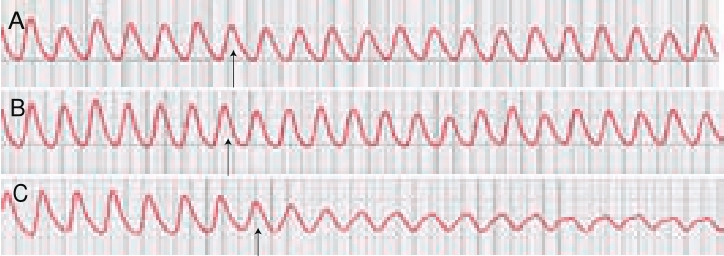
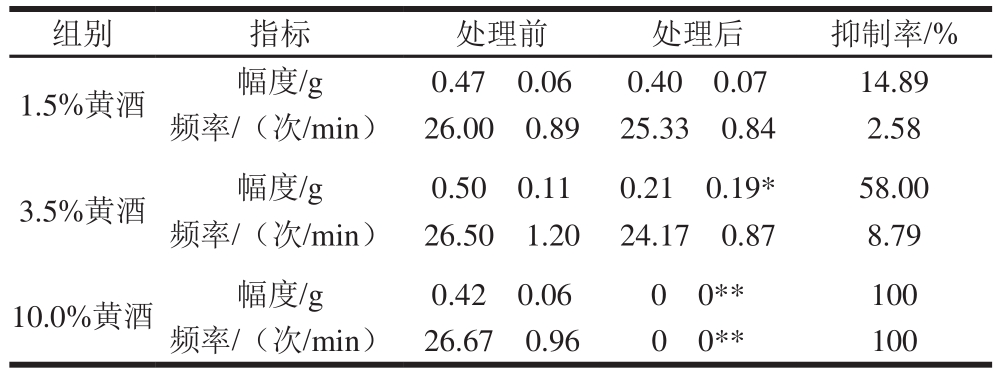
表1 黄酒对大鼠离体小肠收缩性的影响(n=5)
Table1 Effect of CRW on the contractility of the isolated small intestine (n= 5)
注:与处理前相比,*.差异显著(P<0.05);**.差异极显著(P<0.01)。下同。
组别 指标 处理前 处理后 抑制率/%1.5%黄酒 幅度/g 0.47f0.06 0.40f0.07 14.89频率/(次/min) 26.00f0.89 25.33f0.84 2.58 3.5%黄酒 幅度/g 0.50f0.11 0.21f0.19* 58.00频率/(次/min) 26.50f1.20 24.17f0.87 8.79 10.0%黄酒 幅度/g 0.42f0.06 0f0** 100频率/(次/min) 26.67f0.96 0f0** 100
由表1和图1A可见,低剂量的黄酒能降低大鼠离体小肠的收缩幅度和收缩频率,但与处理前相比较,无显著性差异。中剂量的黄酒处理后,小肠的收缩幅度明显降低,抑制率为58%,但对小肠的收缩频率无明显影响(表1、图1B);而高剂量的黄酒处理完全抑制了大鼠离体小肠的收缩,抑制率为100%(表1、图1C),这些结果暗示黄酒能明显抑制大鼠离体小肠收缩。
2.2 乙醇对大鼠离体小肠收缩的影响
表2 乙醇对大鼠离体小肠收缩性的影响(n=5)
Table2 Effect of alcohol on contractility of the isolated rat small intestine (n= 5)
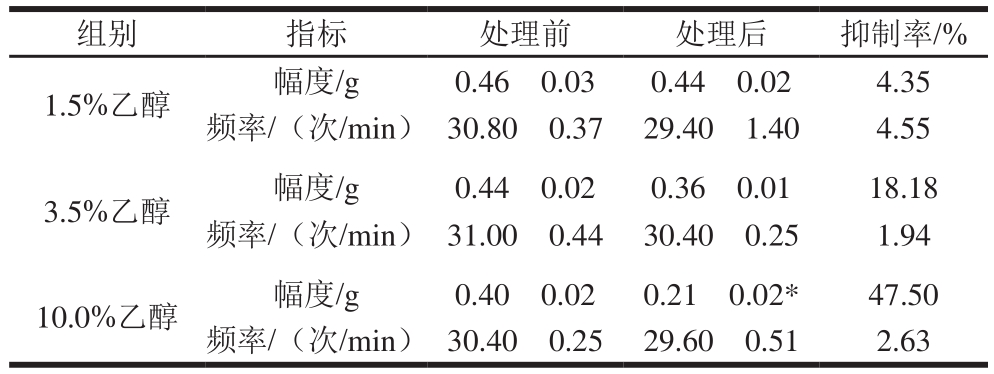
组别 指标 处理前 处理后 抑制率/%1.5%乙醇 幅度/g 0.46f0.03 0.44f0.02 4.35频率/(次/min) 30.80f0.37 29.40f1.40 4.55 3.5%乙醇 幅度/g 0.44f0.02 0.36f0.01 18.18频率/(次/min) 31.00f0.44 30.40f0.25 1.94 10.0%乙醇 幅度/g 0.40f0.02 0.21f0.02* 47.50频率/(次/min) 30.40f0.25 29.60f0.51 2.63
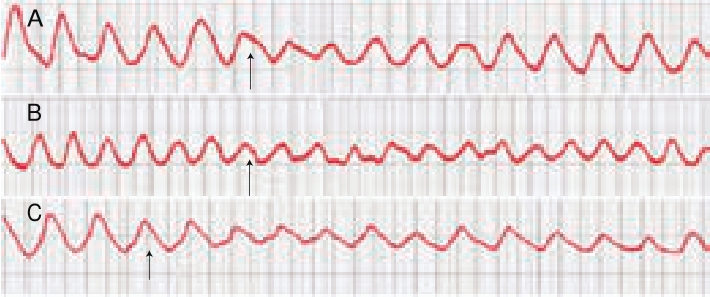
由表2和图2A、B可见,低和中剂量的乙醇虽能降低离体小肠的收缩幅度和收缩频率,但与处理前相比较,无显著性差异。高剂量的乙醇处理后,小肠的收缩幅度明显降低,抑制率为47.5%,但对小肠的收缩频率无明显影响(表2、图2C)。暗示黄酒中的乙醇可能参与了对离体小肠收缩幅度的抑制作用。
2.3 去多酚黄酒对大鼠离体小肠收缩的影响
表3 去多酚黄酒对大鼠离体小肠收缩性的影响(n=5)
Table3 Effect of CRW without polyphenols on the contractility of the isolated rat small intestine (n= 5)

组别 指标 处理前 处理后 抑制率/%1.5%去多酚黄酒幅度/g 0.51f0.16 0.46f0.01 9.80频率/(次/min) 25.20f0.49 24.80f0.49 1.59 3.5%去多酚黄酒幅度/g 0.50f0.05 0.27f0.07* 46.00频率/(次/min) 26.80f0.74 25.20f0.74 5.97 10.0%去多酚黄酒幅度/g 0.41f0.04 0.18f0.09* 56.10频率/(次/min) 25.80f0.58 17.60f1.47** 31.78
由表3、图3A可见,低剂量的去多酚黄酒能降低离体小肠的收缩幅度和收缩频率,但与处理前相比较无明显差异。中、高剂量的黄酒处理后,小肠的收缩幅度明显降低,抑制率分别为46.00%和56.10%。高剂量的去多酚黄酒能显著降低小肠的收缩频率和幅度(表3、图3C),而中剂量的去多酚黄酒对小肠收缩频率无明显影响(表3、图3B)。结果表明去除黄酒中的多酚后,黄酒仍能明显抑制小肠的收缩幅度,但抑制作用降低。
2.4 黄酒对大鼠离体小肠肌间神经丛内ChA T蛋白表达的影响
ChAT为胆碱能神经元释放的乙酰胆碱神经递质的标志酶。为了检测黄酒处理后对肠肌间神经丛胆碱能神经元活性的影响,本研究用全层肠道肌间神经丛免疫组化和Western blot技术检测了ChAT蛋白的变化。
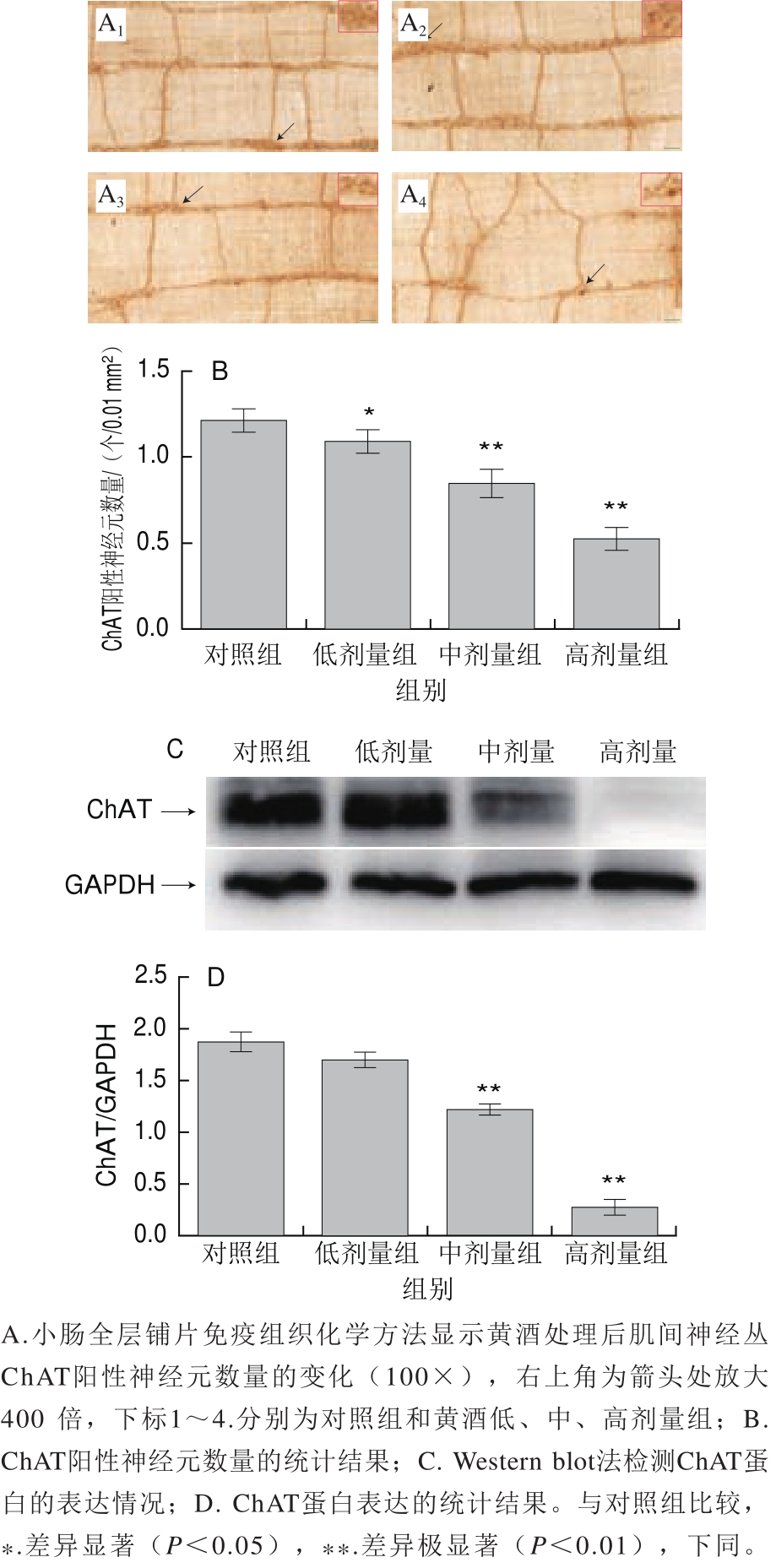
在肠肌间神经丛中,AChE阳性神经元多聚集在一起构成神经节,神经元胞浆为淡黄色(图4A1~A4)。与对照组相比较,黄酒处理后,小肠肌间神经丛ChAT阳性神经元数量显著减少(图4B)。为了进一步确定黄酒对ChAT蛋白表达的影响,采用Western blot技术检测了ChAT蛋白表达量的变化,与免疫组化的结果一致,黄酒处理后,与对照组比较,小肠肌间神经丛ChAT蛋白的表达明显降低(图4C、D)。
2.5 黄酒对大鼠离体小肠肌间神经丛内NOS蛋白表达的影响
NOS为神经递质一氧化氮的标志酶。在肠肌间神经丛中,免疫组织化学染色显示大鼠肠肌间NOS阳性神经元大小不一,胞质染色呈强度不等的棕黄色(图5A1~A4)。与对照组相比较,黄酒处理后,小肠肌间神经丛NOS阳性神经元数量极显著增加(图5B)。为了进一步确定黄酒对NOS蛋白表达的影响,采用Western blot技术检测了NOS蛋白量的变化,与免疫组化的结果一致,黄酒处理后,与对照组比较,小肠肌间神经丛NOS蛋白的表达明显升高(图5C、D)。
3 讨 论
黄酒营养成分丰富,而黄酒中的γ-氨基丁酸、多酚和无机元素等可能影响心脏和胃肠的生理功能。本研究用记录大鼠离体小肠平滑肌收缩的方法,观察了黄酒对大鼠离体小肠的收缩频率、幅度的影响,结果发现中、高剂量的黄酒能明显抑制离体小肠的收缩运动。孙晖等报道乙醇可使家兔小肠平滑肌收缩活动的幅度、频率明显减小[7]。本课题组前期研究发现石榴皮多酚可以明显抑制胃的排空,抑制小肠推进运动和大鼠的排便[8-9]。为了进一步探讨黄酒对离体小肠的抑制作用是否与黄酒中的乙醇及多酚有关,本研究设计了相同剂量乙醇以及去多酚黄酒处理离体小肠的实验方案,结果发现高剂量乙醇和去多酚黄酒能明显抑制离体小肠的运动,但对小肠收缩的抑制率分别为47.50%和56.10%,明显低于高剂量黄酒对小肠收缩的抑制作用(抑制率为100%)。表明黄酒中的乙醇及多酚类参与黄酒对离体小肠收缩的抑制作用,但黄酒中是否还有其他成分也参与对离体小肠运动的抑制作用,有待进一步研究。肠易激综合征(irritable bowel syndrome,IBS)等胃肠道疾病常常表现为腹痛或腹部不适、腹泻等症状[10-11],IBS的产生主要是因为肠道动力异常,腹泻的产生通常与肠运动功能异常、吸收异常以及分泌异常有关[8],IBS严重影响人们的正常工作、学习和生活,目前尚无完全控制该疾病的有效治疗方法[12]。而各种生理刺激(如炎症、过敏等)和非生理刺激导致的胃动力反应增强一直被认为是IBS症状发生的重要病理生理学基础[13-14]。本课题组前期研究发现石榴皮多酚可以通过抑制束缚-浸水应激导致胃运动加强、应激性胃黏膜损伤减轻和结肠运动加强[8]。本研究发现黄酒可明显抑制小肠收缩运动,因此黄酒可能通过降低胃肠运动亢进而减弱胃黏膜损伤、肠痉挛和腹痛等症状,而对冷刺激等导致的胃肠道功能紊乱起到一定的保护作用。
肠神经系统(enteric nervous system,ENS)是由位于胃肠道壁内的神经元、肠胶质细胞和神经递质等组成的网状结构系统,是具有与脑和脊髓类似的整合和处理信息功能机制的神经系统,以就近控制和调节分布于数米长的胃肠道中的平滑肌、黏膜上皮和血管效应系统[15]。离体肠段的壁内神经丛仍然存在,在适宜的条件下,仍可以保持平滑肌的收缩特性和肠壁神经丛的作用[16]。肠壁内有完整的反射通路,各种神经元相互联系,形成
与脑和脊髓类似的独立的“神经系统”,胃肠道接受外源和胃肠壁内固有的神经节(丛)调节[17],ENS异常会导致胃肠功能紊乱[18]。将离体肠段置于模拟大鼠体内环境的溶液中,在一定的时间内仍能保持消化道平滑肌的生理特性[19]。ENS内有许多小分子神经递质,如乙酰胆碱[20-22]、5-羟色胺[23]、一氧化氮[24]等。支配平滑肌的运动神经元包括兴奋性和抑制性运动神经元,兴奋性运动神经元可以释放乙酰胆碱(acetylcholine,ACh)、P物质等兴奋性递质引起胃肠平滑肌的收缩,而抑制性运动神经元可以释放一氧化氮、血管活性肠肽等抑制性递质导致平滑肌的舒张,二者之间存在复杂而精细的平衡[25-26],ACh是肠动力的兴奋性神经递质,能强烈地刺激胃肠收缩和蠕动,ChAT催化胆碱和乙酰辅酶A合成ACh[27],ChAT被认为是胆碱能神经元的特异性标记物,1986年Furchgott等证实,一氧化氮作为气体信号分子具有介导引起血管平滑肌松弛的作用,在胃肠道内广泛分部[28]。本实验发现黄酒能明显抑制离体小肠段的收缩,那么,黄酒是否通过调节肠肌间神经丛的运动神经元而影响了小肠平滑肌的收缩运动?通过肠全层铺片免疫组化和Western blot技术,探究了黄酒对肠道肌间神经丛兴奋性递质和抑制性递质释放的影响,结果发现,经不同剂量的黄酒(黄酒体积分数分别为1.5%、3.5%、10.0%)处理后,肌间神经丛中ChAT阳性神经元数量减少,ChAT蛋白表达下降,而肌间神经丛中NOS阳性神经元数量和NOS蛋白表达增强,表明黄酒可能通过抑制兴奋性递质ACh的释放以及促进抑制性递质一氧化氮的释放,而抑制离体小肠段平滑肌的收缩。研究结果进一步明确了黄酒保健养生的功效和机制,为黄酒价值的提升和黄酒的推广提供了科学依据。
参考文献:
[1] 倪莉, 吕旭聪, 黄志清, 等. 黄酒的生理功效及其生理活性物质研究进展[J]. 中国食品学报, 2012, 12(3): 1-7. DOI:10.3969/j.issn.1009-7848.2012.03.001.
[2] 王家林, 张颖, 于秦峰. 黄酒中生物活性成分的探讨[J]. 酿酒科技,2011(7): 47-50.
[3] 谢广发. 黄酒的功能性成分与保健功能[J]. 酿酒, 2008, 35(5): 14-16.DOI:10.3969/j.issn.1002-8110.2008.05.007.
[4] 沈赤. 绍兴黄酒多糖的分离提取、生物活性及其对肠道微生物的影响[D]. 无锡: 江南大学, 2014: 43-53.
[5] 王璟, 秦雪, 仝令印, 等. 黄酒对小鼠抗疲劳能力和衰老小鼠免疫器官的影响[J]. 食品科学, 2016, 37(21): 224-228. DOI:10.7506/spkx1002-6630-201621038.
[6] 刘敬科, 赵巍, 付会期, 等. 小米黄酒酿造工艺的研究[J].粮食与饲料工业, 2009(12): 22-23; 27. DOI:10.3969/j.issn.1003-6202.2009.12.008.
[7] 孙晖, 田伟, 张慧, 等. 葛根素对酒精中毒后家兔离体小肠平滑肌活动的影响[J]. 滨州医学院学报, 2009, 32(5): 338-339; 342.DOI:10.3969/j.issn.1001-9510.2009.05.006.
[8] 张爱丽, 刘姗姗, 崔希云, 等. 石榴皮水提物对束缚浸水应激大鼠胃肠运动机能的影响[J]. 中国临床药理学杂志, 2012, 28(11): 828-830.DOI:10.3969/j.issn.1001-6821.2012.11.009.
[9] 赵梦杰, 李春燕, 李鹏飞, 等. 石榴皮水提物对大鼠离体结肠运动的影响及其机制的研究[J]. 生物医学工程研究, 2010, 29(2): 109-112.DOI:10.3969/j.issn.1672-6278.2010.02.009.
[10] CAMILLERI M, FORD A C. Pharmacotherapy for irritable bowel syndrome[J]. Journal of Clinical Medicine, 2017, 6(11): 1-16.DOI:10.3390/jcm6110101.
[11] HERZLINGER M, CEREZO C. Functional abdominal pain and related syndromes[J]. Child and Adolescent Psychiatric Clinics of North America, 2018, 27(1): 15-26. DOI:10.1016/j.chc.2017.08.006.
[12] 曾之晅, 汪欢, 杨新, 等. 肠易激综合征治疗研究进展[J].中华内科杂志, 2017, 56(2): 140-143. DOI:10.3760/cma.j.issn.0578-1426.2017.02.014.
[13] DEFREES D N, BAILEY J. Irritable bowel syndrome: epidemiology,pathophysiology, diagnosis, and treatment[J]. Primary Care, 2017,44(4): 655-671. DOI:10.1016/j.pop.2017.07.009.
[14] KUŁAK-BEJDA A, BEJDA G, WASZKIEWICZ N. Antidepressants for irritable bowel syndrome: a systematic review[J]. Pharmacological Reports, 2017, 69(6): 1366-1379. DOI:10.1016/j.pharep.2017.05.014.
[15] HOLZER P, SCHICHO R, HOLZER-PETSCHE U, et al. The gut as a neurological organ[J]. Wiener Klinische Wochenschrift, 2001,113(17/18): 647-660.
[16] 吕锦芳, 陈燕. 不同处理因素对离体兔小肠平滑肌运动的影响[J].安徽技术师范学院学报, 2002, 16(1): 17-22; 28. DOI:10.3969/j.issn.1673-8772.2002.01.007.
[17] 李林. 乙酰胆碱酯酶阳性神经在大鼠小肠壁丛内分布的研究: 酶组织化学法[J]. 江汉大学学报(自然科学版), 1998(3): 1-2.
[18] 姜迎娅, 陈忠. 动物肠道主要神经递质及其受体分布与功能的研究进展[J]. 家畜生态学报, 2013, 34(9): 1-7.
[19] 王婧, 潘盛武, 杨盛昌. 银杏叶提取物对小鼠离体小肠平滑肌收缩特性的影响[J]. 四川动物, 2009, 28(3): 382-385. DOI:10.3969/j.issn.1000-7083.2009.03.015.
[20] FURNESS J B. Types of neurons in the enteric nervous system[J].Journal of the Autonomic Nervous System, 2000, 81(1): 87-96.
[21] STEELE P A, BROOKES S J, COSTA M. Immunohistochemical identification of cholinergic neurons in the myenteric plexus of guinea-pig small intestine[J]. Neuroscience, 1991, 45(1): 227-239.DOI:10.1016/0306-4522(91)90119-9.
[22] FURNESS J B, CALLAGHAN B P, RIVERA L R, et al. The enteric nervous system and gastrointestinal innervation: integrated local and central control[J]. Oxygen Transport to Tissue, 2014, 817: 39-71.DOI:10.1007/978-1-4939-0897-4_3.
[23] 张朝佑. 人体解剖学(上册)[M]. 北京: 人民卫生出版社, 2009: 1372-1381.
[24] 彭曦, 冯晋斌, 汪仕良. 大鼠消化道肌间神经丛中一氧化氮合酶的分布[J]. 世界华人消化杂志, 1998(3): 250-252.
[25] FURNESS J B. Integrated neural and endocrine control of gastrointestinal function[M]// The enteric nervous system. Berlin: Springer International Publishing, 2016: 1-15. DOI:10.1007/978-3-319-27592-5_16.
[26] 袁园, 林中, 李小玲, 等. 肠神经系统重塑的研究进展[J]. 山东医药,2011, 51(49): 115-116.
[27] 赵东芹, 艾洪滨. 束缚-浸水应激对大鼠迷走背核胆碱能神经元活动的影响[J]. 山东大学学报(医学版), 2011, 49(3): 13-17.
[28] 严海密, 高锦孝, 胡佩琪, 等. 消化性溃疡患者血清、胃液一氧化氮含量[J]. 世界华人消化杂志, 1999, 7(7): 627-628.
Chinese Rice Wine Inhibits Contraction Activity of the Isolated Rat Small Intestine through Intestinal Myenteric Plexus
WANG Cong, ZHAO Pan, ZHOU Yanan, WANG Tianxia, SUN Haiji*
(School of Life Science, Shandong Normal University, Jinan 250014, China)
Abstract: Objective: The aim is to explore the effect and mechanism of Chinese rice wine (CRW) on the contraction activity of the isolated small intestine of rats. Methods: The isolated small intestine was treated separately with low, medium, high concentrations of CRW, alcohol and CRW without polyphenols. A RM6240 multi-channel physiological signal acquisition system was used to record intestinal motility. The protein expression of choline acetyltransferase (ChAT) and nitric oxide synthase (NOS) in intestinal myenteric plexus was measured by immunohistochemistry and Western blot. Results:Compared with the control group, medium and high-dose CRW (3.5% and 10.0%, V/V) obviously inhibited the amplitude of intestinal contraction with percentage inhibition of 58% and 100%, respectively. Medium-dose ethanol had no signif i cant impact on intestinal contraction, but high-dose ethanol signif i cantly inhibited the amplitude of intestinal contraction with a percentage inhibition of 47.5%. Medium and high-dose CRW without polyphenols signif i cantly inhibited the contractile amplitude of the isolated small intestine by 48% and 67%, respectively, but the efficacy was inferior to that of CRW.Compared with the control group, the expression of ChAT in intestinal myenteric plexus in the CRW group signif i cantly decreased, while the expression of NOS signif i cantly increased. Conclusion: The effect of CRW on contraction of isolated small intestine is related to its ingredient ethanol and polyphenols, by inhibiting the release of acetylcholine (ACh) as an excitatory neurotransmitter and enhancing the release of NO as an inhibitory neurotransmitter from intestinal myenteric plexus. CRW can affect the activity of neurons in the myenteric plexus, inhibit the movement of small intestine, and slow down the hyperactivity of gastrointestinal function, which will provide new clues to the health-benef i ting effects of CRW.
Keywords: Chinese rice wine; contractile activity of small intestine; myenteric plexus; acetylcholine; nitric oxide
收稿日期:2018-01-04
基金项目:公益性行业(农业)科研专项(201303069-07);国家自然科学基金面上项目(31672286)
第一作者简介:王聪(1992—)(ORCID: 0000-0003-3355-7799),女,硕士研究生,研究方向为动物生理学。E-mail: 1160189262@qq.com
*通信作者简介:孙海基(1970—)(ORCID: 0000-0003-3958-4712),男,副教授,博士,研究方向为神经消化生理学。E-mail: sunhj5018@126.com
DOI:10.7506/spkx1002-6630-20180104-043
中图分类号:R151.1
文献标志码:A
文章编号:1002-6630(2019)09-0173-06
引文格式:王聪, 赵盼, 周亚男, 等. 黄酒通过肠肌间神经丛抑制大鼠离体小肠的收缩[J]. 食品科学, 2019, 40(9): 173-178.DOI:10.7506/spkx1002-6630-20180104-043. http://www.spkx.net.cn
WANG Cong, ZHAO Pan, ZHOU Yanan, et al. Chinese rice wine inhibits contraction activity of the isolated rat small intestine through intestinal myenteric plexus[J]. Food Science, 2019, 40(9): 173-178. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20180104-043. http://www.spkx.net.cn