糖尿病是全球威胁人类健康的一种慢性非传染性疾病[1],世界卫生组织(2011年发表的《全球非传染性疾病报告》显示,目前全球的糖尿病患者人数已经达到了3.46 亿。糖尿病主要特点表现为胰岛素绝对或相对不足引起血糖水平升高,同时常伴有脂肪代谢紊乱,进而出现高血脂[2-3]。因此预防和治疗高血脂是防治糖尿病的关键措施[4],现有的大多降脂药物如血脂康和辛伐他汀等能有效降低高脂血症发病的危险性[5],但此类药物会产生恶心、腹泻等胃肠道疾病的副作用[6],不宜长期服用。因此,寻求疗效显著、安全可靠的调血脂膳食一直是科研发展方向之一。
乳酸菌作为一种益生菌具有许多重要的生理功能[7],可以调节胃肠道菌群、提高免疫、消除人体自由基、预防癌症等[8],除此之外还具有降低食物及人体血清中胆固醇含量、降低心血管病发病率的作用[9-12]。有研究证明在高脂饮食诱导的肥胖大鼠模型中,通过给予双歧杆菌和乳杆菌可以有效降低血清胆固醇和甘油三酯水平[13]。近年来,乳酸菌作为一种安全的膳食补充剂,研究其对糖尿病引发的糖脂代谢异常及对机体炎症反应的影响已经在国内外引起极大的重视[14-16]。本研究利用高糖高脂联合链脲佐菌素(streptozotocin,STZ)诱导小鼠患糖尿病,并对其进行乳酸菌菌液的灌胃,分析与血脂代谢相关指标水平的变化,旨在揭示乳酸菌对2型糖尿病小鼠糖脂代谢的干预作用。
4~5 周龄雄性BALB/c小鼠,来自中国医学科学院药用植物研究所,许可证号:SYXK(京)2013-0023。
菌株Lactobacillus casei D6、L. casei D36、L. casei D18、L. casei D30、L. casei SY13(均分离自传统发酵乳制品)L. rhamnosus LGG均由本实验室保藏。
MRS培养基 北京路桥技术股份有限公司;STZ美国Sigma公司;胆固醇、牛胆盐、总胆固醇检测试剂盒北京大宏利辉生物科技中心;胰岛素、内毒素、肝糖原、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、糖化血红蛋白、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-6、IL-10、谷胱甘肽过氧化物酶(glutathione peroxidase,GSHPx)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、过氧化氢酶(catalase,CAT)的酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 南京建成生物工程研究所;Trizol总RNA提取试剂盒 天根生化科技有限公司;PrimeScript™ RT reagent及SYBR® Premix Ex Taq™试剂盒 宝生物有限公司。引物由北京Invitrogen公司合成。
QL-902漩涡振荡仪 海门市其林贝尔仪器制造有限公司;Centrifuge 5415D高速冷冻离心机 德国Eppendorf公司;NanoDrop 2000分光光度计 美国Thermo Scientif i c公司;RM 2235石蜡切片机 德国Leica公司;1600凝胶成像系统 上海天能科技有限公司;ABI7500荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Applied Biosystems公司。
1.3.1 降胆固醇乳酸菌初筛
将实验室保藏的6 株乳酸菌活化培养,按体积分数1%接种量接种于MRS肉汤培养基,37 ℃恒温培养18 h备用。胆盐水解酶(bile salt hydrolase,BSH)活性被认为是降低胆固醇的关键因素[17-19],利用胆盐解离结合高效液相色谱法检测乳酸菌BSH活力,得到胆盐出峰面积图,出峰总面积对应胆盐浓度,利用空白对照计算出菌体胆盐浓度,根据蛋白标准曲线计算出菌体蛋白浓度。一个BSH活力单位被定义为每分钟催化1 mol底物水解所需的酶量[20]。
1.3.2 降胆固醇乳酸菌的复筛
1.3.2.1 菌株耐酸性筛选
参考郭均[21]的方法将初筛得到的具有较强BSH活性的菌株按体积分数4%接种于MRS液体培养基中,37 ℃培养12 h,3 000hg、4 ℃离心10 min收集菌体,将菌体分别悬浮于pH 2.0、4.0、6.0的MRS液体培养基中,于37 ℃培养 3 h后取样测定OD600 nm,以固有pH 7.3的MRS培养基作为对照,按式(1)计算菌株耐酸存活率。
式中:Nt为低pH值MRS培养3 h 后的存活菌数;No为固有pH 7.3的MRS培养3 h后的存活菌数。
1.3.2.2 菌株耐胆盐筛选
参考Dunne等[22]的方法将初筛得到的具有较强BSH活性的菌株按体积分数4%接种量接种于含0.3 g/100 mL胆盐的MRS培养基中,37 ℃厌氧培养12 h,以未添加胆盐的MRS培养基为对照组。倾注平板于37 ℃厌氧培养48 h,按式(2)计算菌株的耐胆盐存活率。
式中:Nt为添加胆盐样品的菌落数;No为未添加胆盐样品的菌落数。
1.3.3 菌液制备及计数
将上述筛选出的两株乳酸菌进行批量发酵,以体积分数5%接种于MRS液体培养基中,于37 ℃培养18 h,培养完成后先取少量菌液进行镜检,确定无杂菌污染后于3 000hg、4 ℃离心20 min收集菌体,用质量分数1.0%L-谷氨酸-脱脂乳进行冷冻干燥,然后将菌粉进行活菌计数,灌胃小鼠前用0.85%生理盐水重悬菌粉使其浓度为1h1010 CFU/mL。
1.3.4 实验动物模型建立及分组
4~5 周龄雄性BALB/c小鼠100 只,饲养于中国医学科学院药用植物研究所SPF级动物房,室内温度(22f2)℃、相对湿度60%,昼夜明暗交替12 h/12 h,自由饮水取食。
实验采用预防性饲喂,即造模同时饲喂菌液,造模方式采用高脂饲料联用小剂量STZ注射,STZ溶于柠檬酸缓冲液,现用现配,注射剂量为40 mg/kg,每天1 次,连续3 d,正常对照组用质量分数0.85%的生理盐水代替。用基础饲料(12%(质量分数,下同)脂肪、65%碳水化合物、22%蛋白质)将上述Balb/c小鼠适应性喂养1周后随机分为4 组(每组25 只):正常对照组(N)、模型组(M)、SY13菌组(SY13)、36号菌组(D36),除正常对照组饲喂基础饲料外,其余各组每天饲喂高脂饲料(46%脂肪、38%碳水化合物、16%蛋白质),菌液灌胃组饲喂菌液(剂量为1h1010 CFU/只),模型组用生理盐水代替(表1)。造模从第2周开始,连续造模6 周。实验期间所有小鼠自由饮水取食,每周定时称量体质量和采食量。
表1 实验动物分组
Table1 Grouping of experimental animals

组别 第2~3周 第4周 第5~14周N 基础饲料+250 μL生理盐水基础饲料+腹腔注射生理盐水+250 μL生理盐水基础饲料+250 μL生理盐水M 高脂饲料+250 μL生理盐水高脂饲料+腹腔注射STZ+250 μL生理盐水高脂饲料+250 μL生理盐水SY13 高脂饲料+250 μL SY13高脂饲料+腹腔注射STZ+250 μL SY13高脂饲料+250 μL SY13 D36 高脂饲料+250 μL D36高脂饲料+腹腔注射STZ+250 μL D36高脂饲料+250 μL D36
1.3.5 组织取材及处理
组织取材及处理参考文献[23]。分别在喂养第6、10周和14周时,处死每组中一定数量的小鼠(第6、10周分别处死8 只,第14周处死9 只)。处死小鼠隔夜禁食,自由饮水,摘眼球取血,全血静置后于4 ℃、3 500 r/min离心10 min,分离血清并冻存于-80 ℃备用。脱颈处死小鼠后,分别摘取肝脏、胰腺及附睾脂肪组织,取出部分肝脏组织加入预冷的生理盐水制备成质量分数10%的肝脏匀浆液,4 ℃、3 500 r/min离心10 min,取上清液置于-80 ℃保存备用,胰腺组织用体积分数4%的甲醛溶液固定保存备检,附睾脂肪组织冻存于-80 ℃备用。
1.3.6 指标测定
1.3.6.1 体质量与空腹血糖浓度
实验期间,每周测一次小鼠体质量,空腹血糖浓度每2 周测定一次,于小鼠禁食不禁水12 h后测定。
1.3.6.2 口服葡萄糖耐量
实验结束时(第14周)将小鼠隔夜禁食,随后灌胃葡萄糖溶液(2 g/kg mb),分别于0、30、60、90、120 min后检测小鼠血糖含量[24]。
1.3.6.3 糖尿病相关生化指标的测定
使用ELISA试剂盒检测血清糖化血红蛋白、胰岛素、内毒素和肝匀浆中肝糖原的含量,操作按说明书进行。
1.3.6.4 血脂水平检测
使用ELISA试剂盒检测小鼠血清中TC、TG、HDL-C和LDL-C水平,操作按说明书进行。
1.3.6.5 血清炎症因子
使用ELISA试剂盒检测血清中炎症因子TNF-α、IL-1β、IL-6和IL-10的含量,操作按说明书进行。
1.3.6.6 肝脏匀浆液氧化指标
将制备好放于-80 ℃的肝脏匀浆液取出,按ELISA试剂盒说明书测定其中GSH-Px、SOD、MDA和CAT的水平。
1.3.6.7 胰腺病理切片的观察
胰腺组织经甲醛固定后,修块水洗,梯度乙醇溶液脱水至透明,浸蜡包埋,经组织切片机处理后得到厚度约为5 μm的切片,通过苏木精-伊红(hematoxylineosin,HE)染色,置于光学显微镜下观察。
1.3.6.8 附睾脂肪组织中IL-10、Adipoq mRNA表达
以冻存的附睾脂肪组织为材料,检测小鼠抗炎因子IL-10及脂联素基因Adipoq mRNA的表达。具体步骤如下[25]:采用Trizol提取组织总RNA(按Trizol说明书操作),获得的总RNA经过浓度测定和完整性验证,再根据PrimeScript™ RT reagent试剂盒进行cDNA反转录,SYBR® Premix Ex Taq™试剂盒进行反转录实时荧光定量聚合酶链式反应(reverse transcription quantitative realtime polymerase chain reaction,RT-qPCR),以β-actin基因作内参。反应体系采用20 µL体系:1 µL cDNA模板,10 µL SYBR® Premix,正、反引物各0.5 μL,加灭菌双蒸水至20 µL。反应程序为:95 ℃、30 s预变性;95 ℃、5 s变性,60 ℃、40 s退火延伸,循环40 次。基因相对表达量采用2-△△Ct方法计算[26]。引物设计见表2。
表2 RT-qPCR引物序列
Table2 Primer sequences used in RT-qPCR analysis

引物名称 引物序列(5′-3′) 产物长度/bp IL-10 F:CTGGACAACATACTGCTAACCGACTC 86 R:AACTGGATCATTTCCGATAAGGC Adipoq F:GAATCATTATGACGGCAGCACT R:ACATTCTTTTCCTGATACTGGTCG 162 β-actin F:CGTTGACATCCGTAAAGACCTC 159 R:ACAGAGTACTTGCGCTCAGGAG
实验数据均以fs表示,采用SPSS 17.0软件包对结果进行分析,采用Origin 8.0、Excel软件进行绘图分析,不同组间结果比较用单因素方差的最小显著性差异分析,统计结果P<0.05认为差异显著,病理学资料采用对比描述分析。
表3 6 株乳酸菌的BSH活力
Table3 BSH activity in six Lactobacillus strains

注:同列肩标不同小写字母表示组间有显著性差异(P<0.05)。下同。
株系 BSH活力/(U/mg pro)L. casei D6 0.97f0.01ab L. casei D36 4.21f0.81c L. casei D18 1.85f0.01b L. casei D30 1.19f0.11abc L. casei SY13 1.91f0.08bc L. rhamnosus LGG 0.88f0.04a
如表3所示,通过BSH活力分析可以看出,在6 株菌中D36号菌降胆固醇能力显著高于其他菌株,其次是SY13菌。
乳酸菌在经过胃液、胆汁环境时,大部分会因为胃液的低pH值、消化酶及胆汁盐等因素被杀死,因此,在灌胃前筛选存活率较高的菌株以适应胃肠道环境很有必要。从表4可以看出,在pH 4.0时,D36、D18、SY13菌均有较高的存活率,随着pH值的降低菌株存活率明显下降,当pH值降低到2.0时,还保持一定耐酸优势的3 株菌分别是D6、D36和SY13菌;因此,综合3 个pH值梯度可以看出D36和SY13菌耐酸性较好。
表4 6 株乳酸菌的耐酸性
Table4 Acid tolerance of six Lactobacillus strains
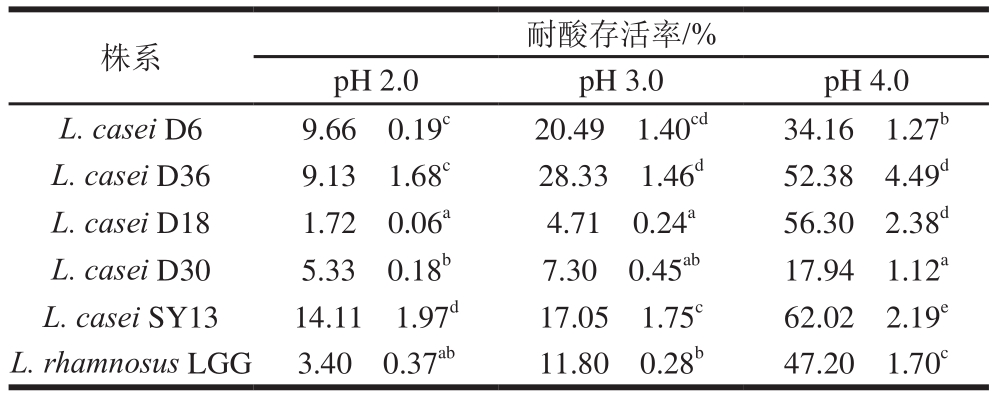
株系 耐酸存活率/%pH 2.0 pH 3.0 pH 4.0 L. casei D6 9.66f0.19c 20.49f1.40cd 34.16f1.27b L. casei D36 9.13f1.68c 28.33f1.46d 52.38f4.49d L. casei D18 1.72f0.06a 4.71f0.24a 56.30f2.38d L. casei D30 5.33f0.18b 7.30f0.45ab 17.94f1.12a L. casei SY13 14.11f1.97d 17.05f1.75c 62.02f2.19e L. rhamnosus LGG 3.40f0.37ab 11.80f0.28b 47.20f1.70c
如表5所示,在质量分数0.3%胆盐条件下,37 ℃厌氧培养12 h后,除D6之外,其他5 株菌存活率都在30%以上,有较强的胆盐耐受能力。有研究表明,在高胆盐刺激下,产胞外多糖的增加以及外膜强度的增加可能是乳酸菌耐胆盐机理[27]。
表5 6 株乳酸菌的耐胆盐能力
Table5 Bile salt tolerance of six Lactobacillus strains

株系 耐胆盐存活率/%L. casei D6 23.94f0.15a L. casei D36 37.81f1.50c L. casei D18 39.57f1.54c L. casei D30 45.52f0.98d L. casei SY13 30.20f2.43b L. rhamnosus LGG 53.45f3.41e
综合BSH活力、耐酸性、胆盐耐受性,筛选出D36菌和SY13菌作为灌胃小鼠菌株。

图1 两株乳酸菌对糖尿病小鼠体质量的影响
Fig.1 Effects of two Lactobacillus strains on body mass in diabetic mice
如图1所示,各组小鼠因是随机分组,初始体质量基本一致。经过14 周的喂养,小鼠体质量均有增加,但增长幅度不同。N组小鼠体质量增长幅度最大,增长率最高,M组增长幅度较N组明显降低,可能是因为长时间高糖高脂饲料的饲喂使小鼠出现一些病变,摄食量减少,而灌胃SY13菌与36号菌显著改善了小鼠的健康状况,体质量增长率较高,与N组之间无显著性差异(P>0.05)。
表6 两株乳酸菌对糖尿病小鼠空腹血糖浓度的影响
Table6 Effects of two Lactobacillus strains on fasting blood glucose in diabetic mice
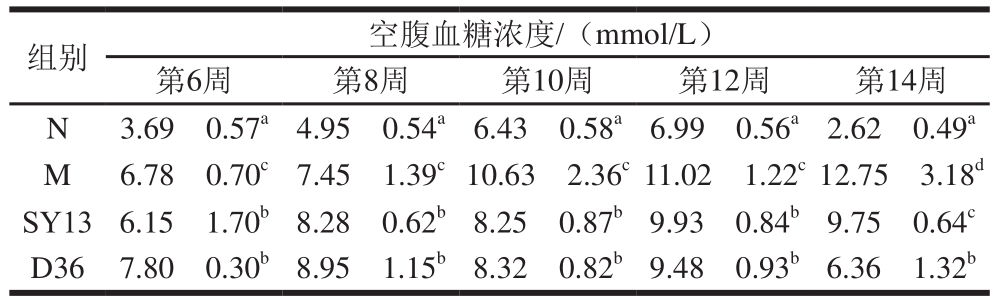
组别 空腹血糖浓度/(mmol/L)第6周 第8周 第10周 第12周 第14周N 3.69f0.57a4.95f0.54a6.43f0.58a6.99f0.56a2.62f0.49a M 6.78f0.70c7.45f1.39c10.63f2.36c11.02f1.22c12.75f3.18d SY13 6.15f1.70b8.28f0.62b8.25f0.87b9.93f0.84b9.75f0.64c D36 7.80f0.30b8.95f1.15b8.32f0.82b9.48f0.93b6.36f1.32b
如表6所示,高糖高脂饮食使小鼠空腹血糖浓度一直在升高,到第14周时,M组小鼠空腹血糖浓度(12.75 mmol/L)显著高于N组(2.62 mmol/L)(P<0.05)。经过菌液的灌胃,小鼠空腹血糖浓度呈下降趋势,从第10周开始时得到明显抑制,到第14周时SY13菌组空腹血糖浓度下降到9.75 mmol/L,D36菌组下降到6.36 mmol/L,与M组相比差异显著(P<0.05)。结果表明乳酸菌能明显降低2型糖尿病小鼠的空腹血糖浓度,对高血糖症有一定疗效。
由表7可知,M组小鼠空腹血糖浓度为12.17 mmol/L,显著高于N组小鼠空腹血糖浓度(7.95 mmol/L),显示高糖高脂饮食加速诱导动物患糖尿病的模型造模获得成功。各组小鼠在给予葡萄糖(2 g/kg mb)30 min后,血糖浓度均急剧升高并达到顶峰,然后随着时间延长血糖浓度下降,但M组仍处在较高的水平上。120 min后,N组血糖浓度基本回到灌胃前的水平,说明N组小鼠口服葡萄糖耐量正常[28]。而M组的血糖浓度(22.77 mmol/L)远高于0 min(12.17 mmol/L),说明M组小鼠已基本丧失了调节血糖的能力,而SY13菌组与D36菌组120 min后的血糖浓度只略高于0 min时,与M组相比有显著差异(P<0.05),说明灌胃菌液可以有效减缓小鼠餐后血糖浓度升高,并改善其调控血糖的能力。
表7 两株乳酸菌对糖尿病小鼠口服葡萄糖耐量的影响
Table7 Effects of two Lactobacillus strains on oral glucose tolerance in diabetic mice
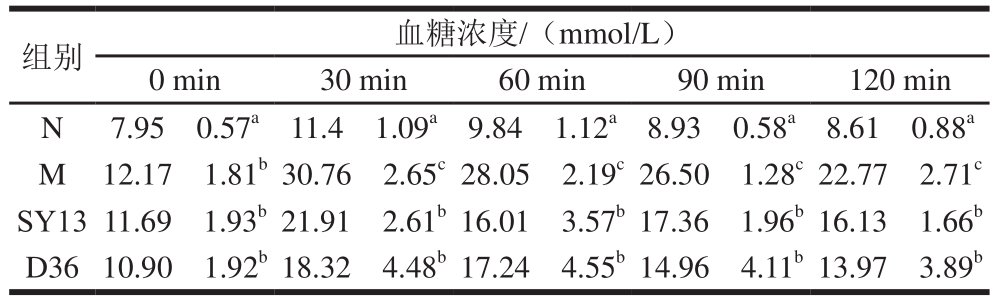
组别 血糖浓度/(mmol/L)0 min 30 min 60 min 90 min 120 min N 7.95f0.57a 11.4f1.09a 9.84f1.12a8.93f0.58a8.61f0.88a M 12.17f1.81b30.76f2.65c28.05f2.19c26.50f1.28c22.77f2.71c SY13 11.69f1.93b21.91f2.61b16.01f3.57b17.36f1.96b16.13f1.66b D36 10.90f1.92b18.32f4.48b17.24f4.55b14.96f4.11b13.97f3.89b
表8 两株乳酸菌对小鼠糖尿病相关指标的影响
Table8 Effects of two Lactobacillus strains on biochemical indexes in diabetic mice
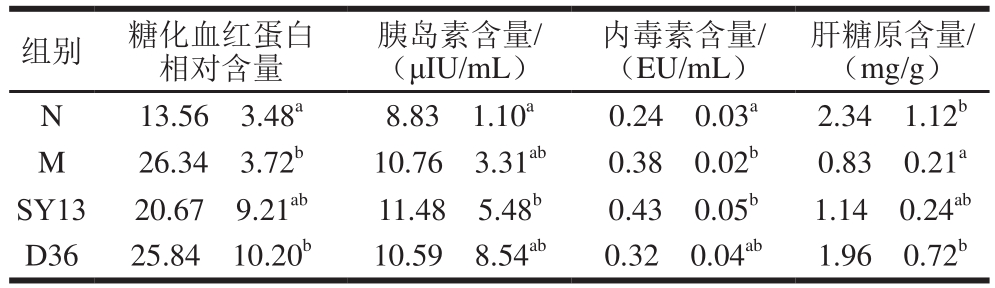
组别 糖化血红蛋白相对含量胰岛素含量/(μIU/mL)内毒素含量/(EU/mL)肝糖原含量/(mg/g)N 13.56f3.48a 8.83f1.10a 0.24f0.03a 2.34f1.12b M 26.34f3.72b 10.76f3.31ab 0.38f0.02b 0.83f0.21a SY13 20.67f9.21ab 11.48f5.48b 0.43f0.05b 1.14f0.24ab D36 25.84f10.20b 10.59f8.54ab 0.32f0.04ab 1.96f0.72b
糖化血红蛋白是红细胞内的血红蛋白与血糖结合的产物,可以表征一段时间内的血糖控制水平,与胰岛素共同是衡量糖尿病的金指标。血糖浓度越高,糖化血红蛋白含量含量就越高[29]。由表8可知,M组糖化血红蛋白相对含量(26.34f3.72)显著高于N组(13.56f3.48)(P<0.05),在这种高血糖状态时,M组内毒素含量的升高(M组显著高于N组)使糖代谢发生紊乱,导致胰岛素抵抗的发生,使胰岛素含量异常升高(M组显著高于N组),加速了机体对储存糖原的消耗,使肝糖原含量显著下降(M组显著低于N组),从而进一步加重糖代谢的紊乱。但是相对M组,通过一段时间菌液的灌胃,SY13组糖化血红蛋白含量显著下降(P<0.05),D36组含量下降不显著(P>0.05),但肝糖原含量却明显增加(1.96 mg/g),高于M组(0.83 mg/g),说明两株菌液的灌胃在糖尿病相关生化指标上有一定改善作用,均在一定程度上降低了小鼠的血糖水平,缓解了小鼠糖代谢紊乱状况。
从图2可以看出,第6、10周和第14周时M组的TC、TG、HDL-C、LDL-C水平均高于N组,第10周时两组间差异最为显著(P<0.05),TG水平除外,说明长期高糖高脂饮食导致了小鼠脂质代谢的紊乱,到第10周时极为严重。而灌胃SY13菌组与D36菌组,TC、LDL-C指标相较M组明显降低,在第14周时降低最显著(P<0.05),HDL-C水平则在第14周时高于M组但差异不显著(P>0.05)。结果表明,两株乳酸菌对2型糖尿病小鼠的血脂水平均有明显改善,且D36菌改善效果优于SY13菌。
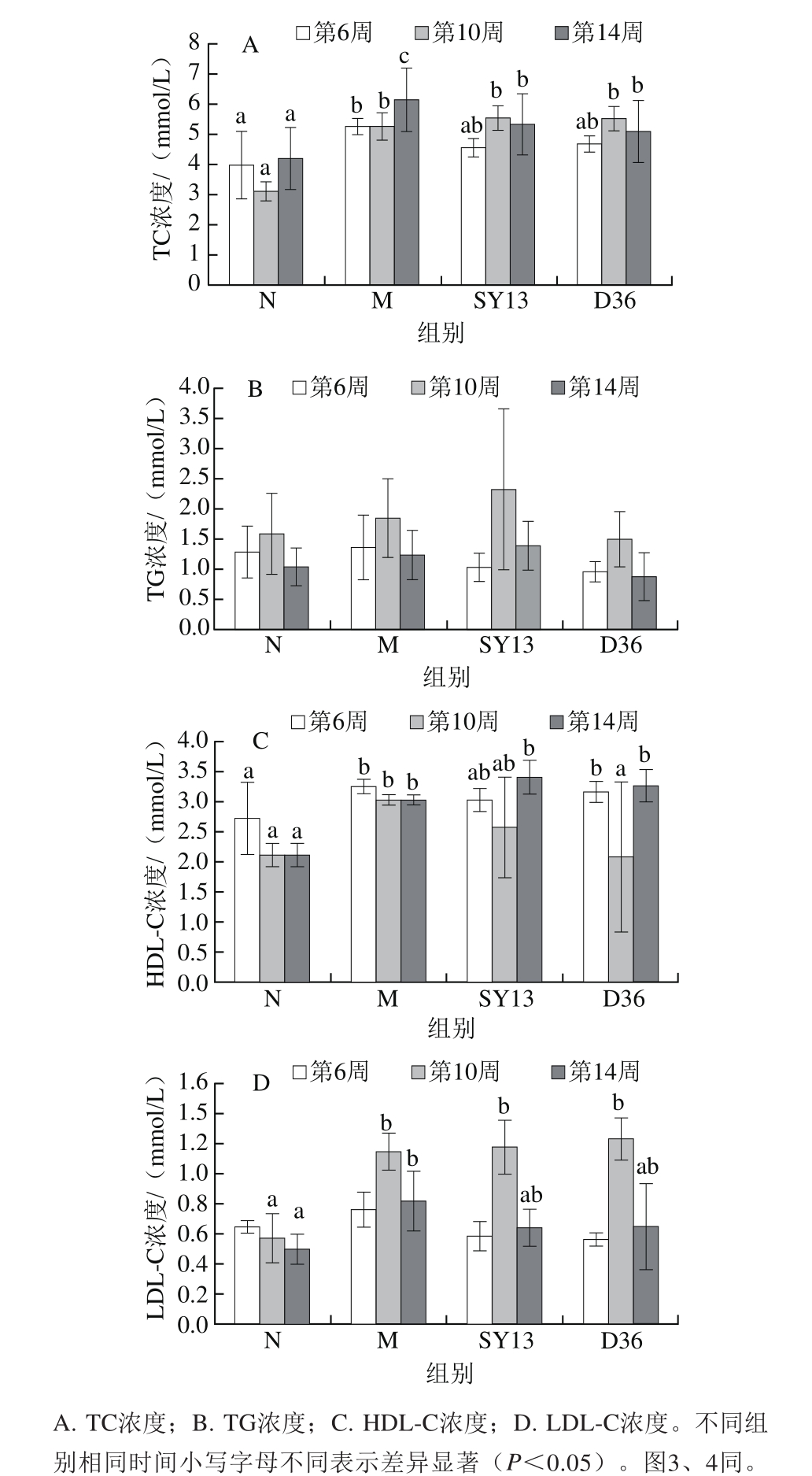
图2 两株乳酸菌对糖尿病小鼠血脂各项指标的影响
Fig.2 Effects of two Lactobacillus strains on blood lipids in diabetic mice
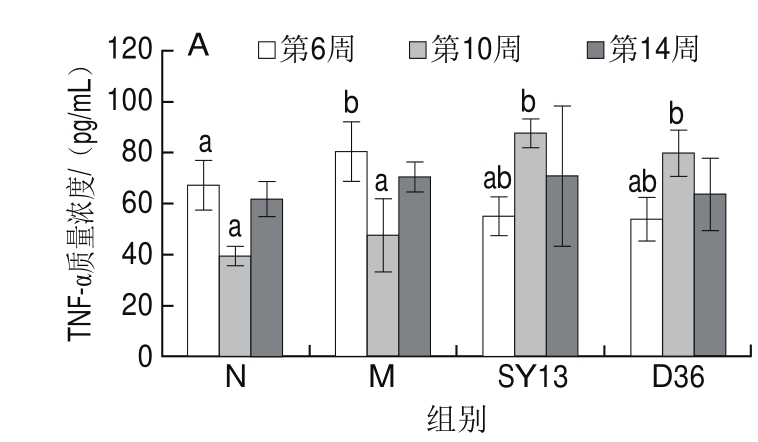
图3 两株乳酸菌对糖尿病小鼠血清炎症因子的影响
Fig.3 Effects of two Lactobacillus strains on serum inf l ammatory factors in diabetic mice
从图3可知,第6、10周和第14周M组小鼠血清促炎因子TNF-α、IL-1β和IL-6质量浓度总体高于N组,且第6周时二者差异显著(P<0.05),IL-1β除外,其在第14周时差异显著(P<0.05)。M组抗炎因子IL-10质量浓度则在3 个时间点均低于N组。与M组相比较,灌胃SY13菌组与D36菌组的小鼠血清促炎因子TNF-α和IL-6质量浓度在第6周时有所下降,第10周时质量浓度异常升高,但到第14周时可以看出比第10周又有所下降,而抗炎因子IL-10的含量则从第6、10周到第14周3 个时间节点呈现一个逐渐上升的趋势,并且在第14周时两个菌液灌胃组IL-10质量浓度均显著高于M组(P<0.05),说明灌胃菌液促进了机体对高脂血症引发的一系列炎症反应做出积极的抗炎反应。
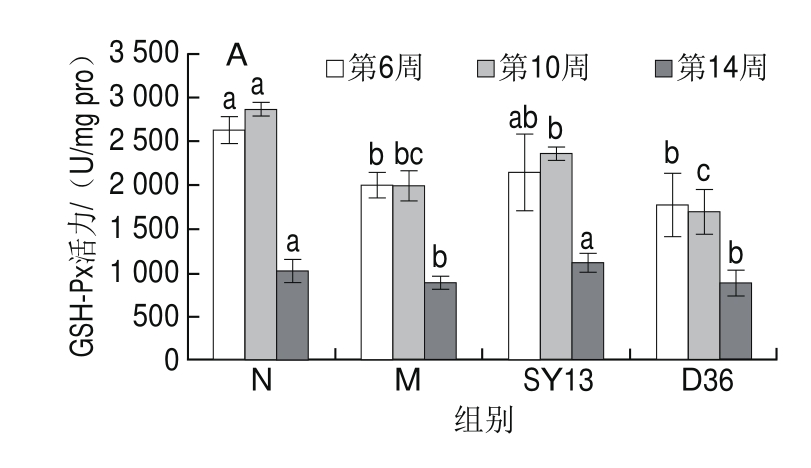
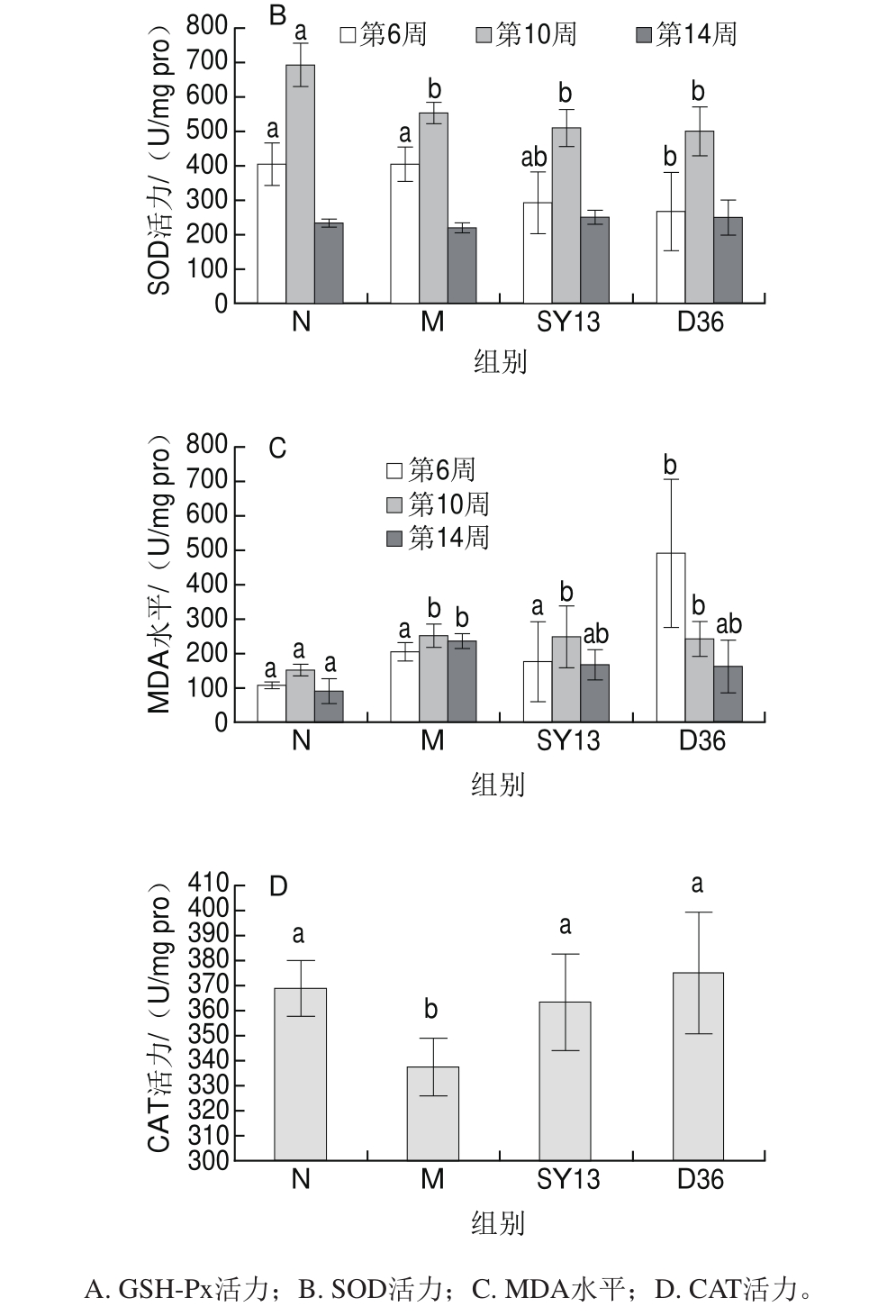
图4 两株乳酸菌对糖尿病小鼠肝匀浆液抗氧化活性的影响
Fig.4 Effects of two Lactobacillus strains on antioxidant defense status in liver homogenate of diabetic mice
从图4可以看出,相对N组,摄食高糖高脂饲料后,M组小鼠肝脏MDA水平显著上升,在第14周时二者差异显著(P<0.05),GSH-Px和SOD活力则下降,在第10周时的差异最显著(P<0.05)。第16周SY13菌组和D36菌组的CAT活力(第6、10周数据未显示)有所下降,但与N组差异不显著,表明长期高脂饲料的摄入加重了肝脏的负担,使肝脏组织发生了严重的氧化损伤。而菌液灌胃使小鼠肝脏的抗氧化活性均有不同程度提高,其中GSH-Px活力提高最为明显,且SY13菌优于D36菌,其在3 个时间节点上GSH-Px活力均高于M组;而SOD活力则从第6周时低于M组逐渐提高到14周时高于M组,但与M组之间差异不显著;SY13菌组与D36菌组CAT活力在第14周时显著高于M组(P<0.05)。与M组相比,两个菌液灌胃组小鼠MDA水平均有不同程度降低,且在第14周时MDA水平降低最显著(P<0.05)。结果表明,灌胃乳酸菌可以减轻2型糖尿病小鼠的肝脏过氧化,提高机体的抗氧化活性。
图5的HE结果显示,第6周时M组小鼠部分胰岛细胞变性,变性的胰岛细胞胞浆肿胀,胞浆内可见泡状结构。SY13菌组小鼠病变较轻,D36菌组局部胰岛细胞变性,变性细胞胞浆肿胀,红染颗粒状物质团块明显可见。

图5 HE染色分析各组小鼠胰腺病理变化(200×)
Fig.5 Pathological changes of pancreatic tissues in mice from different groups evaluated by HE staining (200 ×)
第10周时M组小鼠病变加重,胞核偏位,变性的胰岛细胞增多,胞浆内泡状结构增加,SY13菌组小鼠出现病变,胞浆内可见泡状结构,D36菌组小鼠腺泡细胞空泡变性,红染颗粒状物质团块现象加重。
到第14周时M组小鼠胰岛萎缩,数量减少,面积缩小,胰岛细胞排列紊乱,局灶性腺泡细胞空泡变性,胞浆内可见嗜酸性颗粒状物质的泡状结构。与M组相比,SY13菌组局灶性腺泡细胞空泡病变减轻,变性胰岛细胞数量减少,而D36菌组胰岛细胞排列整齐,细胞胞浆丰富均匀,腺泡细胞空泡变性消失,病变程度明显得到改善。
上述结果表明,长期高糖高脂饮食严重损坏了小鼠胰腺组织,两种乳酸菌的灌胃能明显改善小鼠胰岛细胞病变情况,极大减轻腺泡细胞空泡变性程度。
IL-10是一种积极的抗炎细胞因子。Adipoq是一种在脂肪组织中产生和分泌的脂肪细胞因子,通过抑制炎症反应来影响外周组织中脂肪酸的代谢,与肥胖、胰岛素抵抗和2型糖尿病等疾病密切相关,这些疾病患者很多脂肪细胞因子的血浆浓度明显上升,但脂联素水平却显著下降[30]。
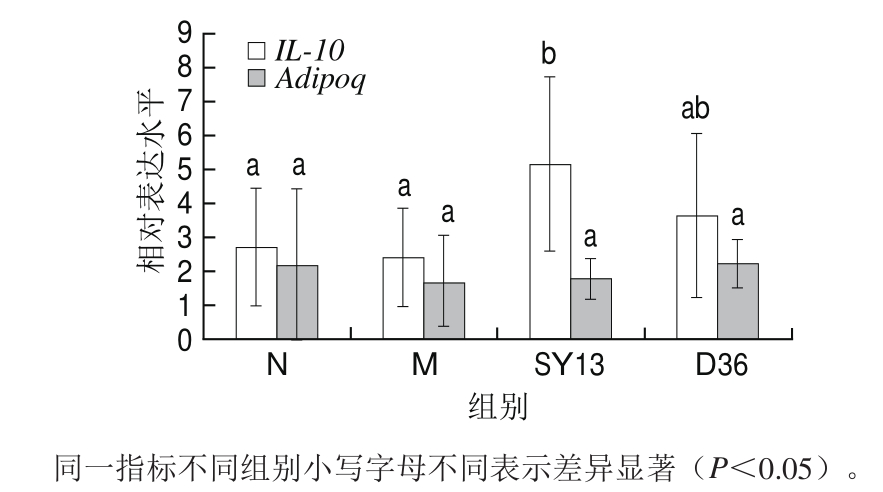
图6 两株乳酸菌对糖尿病小鼠IL-10、Adipoq mRNA表达的影响
Fig.6 Effects of two Lactobacillus strains on mRNA expression of IL-10 and Adipoq in diabetic mice
实验检测了各处理组小鼠附睾脂肪组织中二者的表达情况,结果如图6所示。高糖高脂饮食处理使IL-10和Adipoq的表达有所降低,但与N组差异不显著。与M组相比,灌胃D36菌与SY13菌液显著提高了IL-10基因的表达水平(P<0.05),这一结果与前述的炎症因子的影响一致,Adipoq基因表达变化则不显著。结果表明,菌液可能通过调节脂质代谢与炎症因子相关基因的表达,进而改善机体脂代谢紊乱。
许多研究表明高脂饲料喂养和STZ注射是形成2型糖尿病模型的2 个重要条件[31-32],本研究在前人对大鼠造模的基础上,采用高糖高脂饲料饲喂Balb/c小鼠诱导胰岛素抵抗,然后分次注射亚致病剂量STZ破坏胰腺功能,使胰岛β细胞对糖反应性下降,最后诱发出高血糖症及脂代谢紊乱等一系列糖尿病表现。通过一段时间乳酸菌的灌胃,测定各组小鼠血脂水平、血清炎性因子水平、肝脏抗氧化活性、糖尿病相关指标、胰腺病理切片及附睾脂肪组织基因表达情况,评估了两株乳酸菌对改善糖尿病小鼠糖脂代谢的作用。
实验结果表明,长期高糖高脂饲料的喂养使小鼠出现了血糖浓度上升、胰岛素水平增加及血脂水平上升等现象,表明小鼠出现了严重的胰岛素抵抗[33]。口服葡萄糖耐量结果显示,小鼠空腹注射葡萄糖120 min后,N组血糖浓度基本回到灌胃前的水平,但M组外周血糖仍不能降至正常水平,说明小鼠糖耐量受损,胰腺组织HE染色结果进一步说明小鼠胰岛细胞受损。经过14周菌液的灌胃,小鼠糖化血红蛋白含量、胰岛素水平及血脂TG、TC、LDL-C水平均显著下降,说明乳酸菌具有降糖降脂的功效。炎性因子和肝脏抗氧化活性结果表明,随着菌液灌胃时间的延长,血清中致炎因子TNF-α、IL-1β和IL-6含量逐渐下降,抗炎因子IL-10含量显著上升高于M组(P<0.05),肝脏MDA水平明显降低,GSH-Px和SOD水平显著上升,说明乳酸菌能够提高机体对高脂饮食诱发的脂代谢紊乱做出积极的抗炎反应和氧化应激能力。
Adipoq是脂肪细胞分泌的一种内源性生物活性多肽或蛋白质,可以促进骨骼肌细胞的脂肪酸氧化和糖吸收,明显加强胰岛素的抑制糖原异生作用,抑制肝脏的糖生成,是机体脂质代谢和血糖稳态调控网络中的重要调节因子。另外Adipoq是一种胰岛素增敏激素,能改善小鼠的胰岛素抗性,抑制TNF的生成与释放,具有一定的抗炎症作用。本研究表明,与M组相比,乳酸菌的灌胃能刺激糖尿病小鼠Adipoq mRNA使其表达量增加,显著降低TC和LDL-C水平,这与实验性动脉粥样硬化模型中,血浆Adipoq水平与TC和LDL-C呈负相关关系,与HDL-C呈正相关关系结论一致。
[1] NASCIMENTO F A M, BARBOSA-DA-SILVA S, FERNANDESSANTOS C, et al. Adipose tissue, liver and pancreas structural alterations in C57BL/6 mice fed high-fat-high-sucrose diet supplemented with fish oil (n-3 fatty acid rich oil)[J]. Experimental and Toxicologic Pathology, 2010, 62(1): 17-25. DOI:10.1016/j.etp.2008.12.008.
[2] 马晖, 谢春光. 参芪复方降血糖实验研究[J]. 四川省卫生管理干部学院学报, 2006(2): 87-89.
[3] 王芬, 何华亮, 张红敏, 等. 参芪复方对GK大鼠脂代谢异常的实验研究[J]. 天津中医药, 2007(6): 507-508.
[4] JEMIL I, ABDELHEDI O, NASRI R, et al. Hypolipidemic,antiobesity and cardioprotective effects of sardinelle meat flour and its hydrolysates in high-fat and fructose diet fed Wistar rats[J]. Life Science, 2017, 176: 54-66. DOI:10.1016/j.lfs.2016.07.012.
[5] 孙康悦, 李颖, 李悦琪, 等. 国内降血脂药物研究进展[J]. 西北药学杂志, 2017, 32(1): 122-124.
[6] 陈大卫. 辅助降血脂益生乳酸菌的筛选及其对高血脂大鼠肠道菌群的影响[D]. 扬州: 扬州大学, 2015: 9-11. DOI:10.7666/d.Y2908625.
[7] 李幼筠. 泡菜与乳酸菌[J]. 中国酿造, 2001, 20(4): 7-9.
[8] 罗冬英, 尹传武. 乳酸菌制剂对人体保健功效的机理探讨[J]. 鄂州大学学报, 2002(4): 53-54.
[9] SMET I D, BOEVER P D, VERSTRAETE W. Cholesterol lowering in pigs through enhanced bacterial bile salt hydrolase activity[J]. British Journal of Nutrition, 2007, 79(2): 185-194. DOI:10.1079/bjn19980030.
[10] HUANG Y, ZHENG Y C. The probiotic Lactobacillus acidophilus reduces cholesterol absorption through the down-regulation of Niemann-Pick C1-like 1 in Caco-2 cells[J]. British Journal of Nutrition, 2009, 103(4): 473-478. DOI:10.1017/s0007114509991991.
[11] ALSHERAJI S H, ISMAIL A, MANAP M Y, et al.Hypocholesterolaemic effect of yoghurt containing Bifidobacterium pseudocatenulatum G4 or Bifidobacterium longum BB536[J].Food Chemistry, 2012, 135(2): 356-361. DOI:10.1016/j.foodchem.2012.04.120.
[12] JONES M L, MARTONI C J, PARENT M, et al. Cholesterol-lowering eff i cacy of a microencapsulated bile salt hydrolase-active Lactobacillus reuteri NCIMB 30242 yoghurt formulation in hypercholesterolaemic adults[J]. British Journal of Nutrition, 2012, 107(10): 1505-1513.DOI:10.1017/S0007114511004703.
[13] 俞筱琦, 施志冲, 郑勇英, 等. 微生态类制剂调节血脂和润肠通便作用[J]. 上海实验动物科学, 2001(2): 109-110; 112.
[14] VILAHUR G, LÓPEZ-BERNAL S, CAMINO S, et al. Lactobacillus plantarum CECT 7315/7316 intake modulates the acute and chronic innate inf l ammatory response[J]. European Journal of Nutrition, 2015,54(7): 1161-1171. DOI:10.1007/s00394-014-0794-9.
[15] 李向菲. 产胞外多糖乳酸菌对2型糖尿病的干预及其机制研究[D].无锡: 江南大学, 2016: 1-7.
[16] LI X F, WANG N, YIN B X, et al. Lactobacillus plantarum X1 with α-glucosidase inhibitory activity ameliorates type 2 diabetes in mice[J]. RSC Advances, 2016, 6(68): 63536-63547. DOI:10.1039/C6RA10858J.
[17] LIONG M T, SHAH N P. Acid and bile tolerance and cholesterol removal ability of lactobacilli strains[J]. Journal of Dairy Science,2005, 88(1): 55-66. DOI:10.3168/S0022-0302(05)72662-X.
[18] GRILL J P, CAYUELA C, ANTOINE J M, et al. Effects of Lactobacillus amylovorus and Bif i dobacterium breve on cholesterol[J].Letters in Applied Microbiology, 2000, 31(2): 154-156.
[19] KUMAR R, GROVER S, BATISH V K. Hypocholesterolaemic effect of dietary inclusion of two putative probiotic bile salt hydrolaseproducing Lactobacillus plantarum strains in Sprague-Dawley rats[J].British Journal of Nutrition, 2011, 105(4): 561-73. DOI:10.1017/S0007114510003740.
[20] FUKUSHIMA M, NAKANO M. Effects of a mixture of organisms,Lactobacillus acidophilus or Streptococcus faecalis on cholesterol metabolism in rats fed on a fat- and cholesterol-enriched diet[J].British Journal of Nutrition, 2007, 76(6): 857-867. DOI:10.1079/bjn19960092.
[21] 郭均. 降胆固醇乳酸菌的筛选及其体内降胆固醇作用[D]. 广州: 华南理工大学, 2016: 17-18.
[22] DUNNE C, OMAHONY L, MURPHY L, et al. In vitro selection criteria for probiotic bacteria of human origin: correlation with in vivo fi ndings[J]. American Journal of Clinical Nutrition, 2001, 73(Suppl 2):386-392.
[23] 于金慧, 王瑜, 彭振英, 等. 裂壶藻油DHA对高脂饮食诱导肥胖小鼠的影响[J]. 微生物学通报, 2017, 44(11): 2679-2688. DOI:10.13344/j.microbiol.china.170355.
[24] 谷豪, 夏毅伟, 韦莉萍, 等. 桃胶多糖、抗性淀粉、低聚果糖对糖耐量受损大鼠血糖的影响比较研究[J]. 热带医学杂志, 2013, 13(3):288-290.
[25] 廖素凤, 刘江洪, 杨志坚, 等. 茶树新品系CFT-1提取物的降脂作用及其机制研究[J]. 天然产物研究与开发, 2017, 29(11): 1831-1840; 1857.
[26] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J].Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262.
[27] ALP G, ASLIM B. Relationship between the resistance to bile salts and low pH with exopolysaccharide (EPS) production of Bif i dobacterium spp. isolated from infants feces and breast milk[J]. Anaerobe, 2010,16(2): 101-105. DOI:10.1016/j.anaerobe.2009.06.006.
[28] 温贺, 肖凤艳, 段翠翠, 等. 植物乳杆菌Sc52益生特性评价及其在降血糖产品中的应用[J]. 食品科学, 2018, 39(6): 148-154.DOI:10.7506/spkx1002-6630-201806024.
[29] 李培培, 黄庆德, 许继取, 等. 部分脱脂亚麻籽粉对高脂高糖饮食大鼠血糖的影响[J]. 食品科学, 2018, 39(21): 183-188. DOI:10.7506/spkx1002-6630-201821028.
[30] CAO H. Adipocytokines in obesity and metabolic disease[J]. Journal of Endocrinology, 2014, 220(2): 47-59. DOI:10.1530/JOE-13-0339.
[31] 周敏. 实验性2型糖尿病动物模型研究及其进展[J]. 浙江中医学院学报, 2001(5): 79-81.
[32] BOLLINGE S S, WELTMAN N Y, GERDES A M, et al. T3 supplementation affects ventilatory timing & glucose levels in type 2 diabetes mellitus model[J]. Respiratory Physiology & Neurobiology,2015, 205: 92-98. DOI:10.1016/j.resp.2014.10.020.
[33] DANDONA P, ALJADA A, CHAUDHURI A, et al. Metabolic syndrome: a comprehensive perspective based on interactions between obesity, diabetes, and inflammation[J]. Circulation, 2005, 111(11):1448-1454. DOI:10.1161/01.CIR.0000158483.13093.9D.
Effect of Lactobacillus on Blood Lipids in Type 2 Diabetic Mice Fed High-Glucose and High-Fat Diet
段江燕(1966—)(ORCID: 0000-0002-0997-1204),女,教授,硕士,研究方向为植物信号转导和生物化学。E-mail: duanjiangyan123@163.com
吕加平(1963—)(ORCID: 0000-0001-9338-723X),男,研究员,博士,研究方向为乳品加工及微生物。E-mail: lvgp586@vip.sina.com
GAO Weihua, LIU Lu, WANG Fen, et al. Effect of Lactobacillus on blood lipids in type 2 diabetic mice fed high-glucose and high-fat diet[J]. Food Science, 2019, 40(9): 179-187. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180122-296. http://www.spkx.net.cn