免疫调节作用一直是保健食品领域研究的热点之一。作为免疫细胞的一员,巨噬细胞无论在先天免疫还是在适应性免疫应答中都发挥着重要的作用[1]。众所周知,巨噬细胞通过分泌生物因子间接抵抗外来的病原体和刺激物,例如炎性介质一氧化氮(nitric oxide,NO)、白介素(interleukin,IL)-6、IL-1β和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)[2]。然而,巨噬细胞释放这些生物因子的分子机制仍需不断地探究,根据先前的报道,巨噬细胞表面存在众多的模式识别受体(pattern recognition receptors,PRRs),例如Toll样受体家族(Toll-like receptors,TLRs),中最经典的Toll样受体4(Toll-like receptors 4,TLR4)、甘露糖受体(mannose receptor,MR)和补体受体3(complement receptor 3,CR3)[3-4],这些PRRs的功能是识别外来病原体,启动细胞内信号级联反应[5]。在免疫调节信号通路中,丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路是最重要和进化保守的机制之一。MAPK途径激活后会导致不同转录因子的激活,激活的转录因子对生物因子的基因表达进行调节,从而调节它们的分泌水平[6]。巨噬细胞能够识别多种外来刺激物,除致病性的病原体外,还有很多调节巨噬细胞免疫活性的天然产物,如多糖、蛋白、苷类化合物等[7]。近年来,关于真菌多糖调节巨噬细胞免疫应答的报道逐渐增加,真菌多糖的免疫调节活性也逐渐受到了广泛的重视[8]。
蛹虫草(Cordyceps militaris)是一种珍贵的食药用真菌,具有多种生物活性物质,包括虫草素、虫草酸、虫草多糖和虫草多肽等。蛹虫草具有广泛的生物活性,包括抗氧化、抗衰老、免疫调节、降血糖和保肝等作用[9-10]。近年来关于虫草多糖对小鼠腹腔巨噬细胞的研究日益广泛,王米等研究发现蛹虫草多糖(Cordyceps militaris polysaccharides,CMP)能够促进小鼠腹腔巨噬细胞分泌NO,增强免疫功能[11];Lee等发现蛹虫草发酵液多糖刺激小鼠腹腔巨噬细胞,激活TLR2/4,进而活化下游MAPKs/核因子-кB信号通路诱导NO的产生[12];蛹虫草菌丝体中分离的多糖具有良好的免疫调节活性,它能够上调小鼠腹腔巨噬细胞中的NO、活性氧和TNF-α的分泌和细胞吞噬能力[13]。本研究主要针对CMP对小鼠单核巨噬细胞RAW264.7免疫活性的调节机制进行初步研究,以期为蛹虫草保健食品开发提供一定的理论依据。
小鼠腹腔巨噬细胞RAW264.7由东北师范大学生命科学学院馈赠;CMP从蛹虫草子实体粉末中经水提醇沉法获得,经除蛋白后用于本实验。
DMEM高糖培养基 美国Hyclone公司;胎牛血清杭州四季青公司;脂多糖(lipopolysaccharides,LPS)、甘露聚糖 美国Sigma公司;NO检测试剂盒、MAPK抑制剂(PD98059、SP600125、SB203580) 上海碧云天生物公司;TNF-α、IL-1β酶联免疫吸附检测(enzymelinked immunosorbent assay,ELISA)试剂盒 武汉博士德生物公司;VGX-1027 英国Abcam公司;抗体p38、p-p38、ERK1/2、p-ERK1/2、JNK、p-JNK和β-actin美国CST公司。
CO2培养箱 美国NUAIRE公司;酶标仪 北京普朗新技术有限公司;倒置显微镜 日本Nikon公司;电泳仪、凝胶成像仪 美国Bio-Rad公司。
1.3.1 RAW264.7细胞活性和细胞形态检测
将小鼠巨噬细胞RAW264.7细胞密度调整为5h105 个/mL,接种到96 孔板中,每孔100 μL,设置阴性对照组、阳性对照组和CMP实验组。阴性对照组仅加入细胞培养基;阳性对照组加入终质量浓度为1 μg/mL的LPS;CMP实验组加入不同质量浓度的CMP(终质量浓度分别为12.5、25、50、100、200、400 μg/mL)100 μL;各组均与细胞共培养24 h。培养结束后,加入10 μL噻唑蓝继续孵育4 h,弃去培养基,每孔加入150 μL二甲基亚砜,以单独加入150 μL二甲基亚砜孔为空白组。使用酶标仪在490 nm波长处检测各孔OD值。细胞存活率按式(1)计算。
式中:OD1、OD2、OD3分别为CMP实验组、阳性对照组、空白组的光密度值。
将RAW264.7细胞密度调整为5h105 个/mL,接种到6 孔板中,每孔1 mL,设置阴性对照组、阳性对照组和CMP实验组。阴性对照组仅加入细胞培养基;阳性对照组加入终质量浓度为1 μg/mL的LPS;CMP实验组加入不同质量浓度的CMP(终质量浓度分别为25、50、100、200 μg/mL)1 mL;各组均与细胞共培养24 h。培养结束后,使用倒置显微镜观察细胞形态。
1.3.2 RAW264.7细胞吞噬活性测定
RAW264.7细胞的处理方法同1.3.1节,细胞培养结束后,弃去培养基,向每孔加入100 μL质量分数0.075%中性红溶液继续培养1 h,弃去中性红,用磷酸盐缓冲液洗两次,向每孔加入150 μL细胞裂解液,以单独加入150 μL细胞裂解液孔为空白组。使用酶标仪在540 nm波长处检测各孔OD值。吞噬率按式(2)计算。
式中:OD1、OD2、OD3分别为CMP实验组、阳性对照组、空白组的光密度值。
1.3.3 RAW264.7细胞分泌NO、TNF-α和IL-1β检测
RAW264.7细胞的处理方法同1.3.1节,细胞培养结束后,收取细胞培养上清液,使用试剂盒检测培养上清液中NO、TNF-α和IL-1β的水平。
1.3.4 抑制剂中和实验
将RAW264.7细胞密度调整为5h105 个/mL,接种到96 孔板中,每孔100 μL,设置对照组、CMP单独处理组、MR和TLR4抑制剂单独处理组和实验组。其中,对照组加入100 μL培养基;CMP单独处理组加入100 μL CMP(终质量浓度为200 μg/mL);抑制剂单独处理组加入甘露聚糖(终质量浓度为0.625 mg/mL)或VGX-1027(终质量浓度为0.5 μg/mL)100 μL;实验组先用抑制剂预处理1 h,弃去培养基,再加入200 μL质量浓度为200 μg/mL的CMP。各组细胞培养24 h后,使用试剂盒检测培养上清液中NO、TNF-α和IL-1β的水平;细胞吞噬活性的测定方法同1.3.2节。
将RAW264.7细胞密度调整为5h105 个/mL,接种到96 孔板中,每孔100 μL,设置对照组、CMP单独处理组、MAPK抑制剂单独处理组和实验组。其中,对照组加入100 μL培养基;CMP单独处理组加入100 μL CMP(终质量浓度为200 μg/mL);MAPK抑制剂单独处理组加入PD98059、SP600125和SB203580(终浓度20 μmol/L)100 μL;实验组先用抑制剂预处理1 h,弃去培养基,再加入200 μL质量浓度为200 μg/mL的CMP。各组细胞培养24 h后,使用试剂盒检测培养上清液中NO、TNF-α和IL-1β的水平。
1.3.5 Western blot检测MAPKs激活
使用不同终质量浓度的CMP(0、25、50、100、200 μg/mL)处理RAW264.7细胞24 h。使用裂解液提取细胞总蛋白。Western blot方法检测MAPKs各亚基的表达水平,包括ERK1/2、phosphor-ERK1/2、JNK、phosphor-JNK、p38、phosphor-p38。使用β-actin作为内参。
数据以平均值±标准差表示。使用Graphpad 6.05软件进行绘图。使用SPSS 22软件处理数据,差异显著性采用单因素方差分析法分析。P<0.05表示差异显著,P<0.01表示差异极显著。
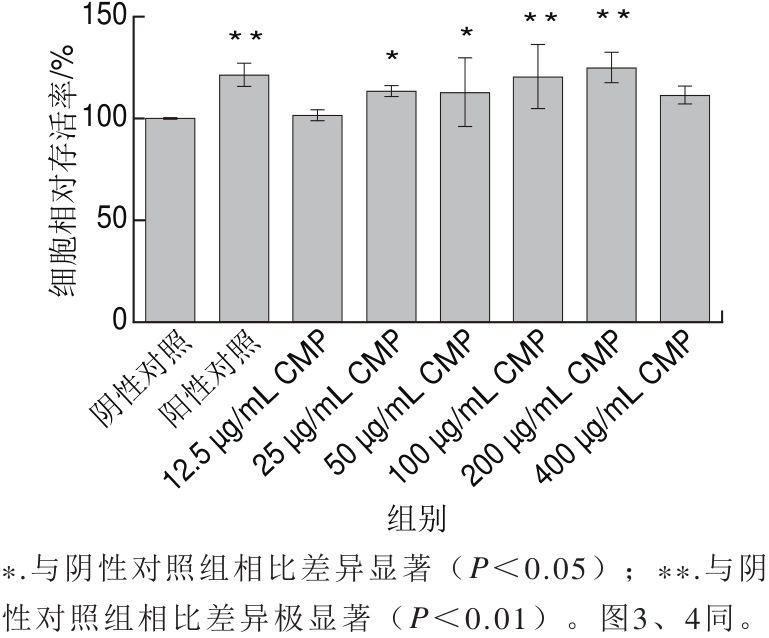
图 1 CMP对RAW264.7细胞增殖的影响
Fig.1 Effect of CMP on the proliferation of RAW264.7 cells
如图1所示,与阴性对照组相比,阳性对照组细胞活性明显增强(P<0.01),在CMP 12.5~400 μg/mL质量浓度范围内,RAW264.7细胞活性先升高后降低,当CMP质量浓度为100、200 μg/mL时,细胞相对存活率为120.31%和124.89%,与阴性对照组相比有极显著差异(P<0.01),与LPS组相比无明显差异(P>0.05)。当CMP质量浓度达到400 μg/mL时,RAW264.7细胞活性有所下降,并且与对照组相比无统计学差异(P>0.05)。表明25~200 μg/mL质量浓度范围内的CMP可以增强RAW264.7细胞活性。因此,选择质量浓度范围为25~200 μg/mL的CMP进行后续实验。
在显微镜下观察到LPS和CMP处理的细胞发生了形态改变。对照组细胞体积较小,大部分呈圆形,LPS和CMP处理组细胞体积增大,由圆形变成了长梭形,部分细胞长出了伪足,且细胞变化随CMP质量浓度的升高而逐渐明显(图2),200 μg/mL CMP处理组细胞形态与阳性对照组相似。结果表明CMP可以刺激RAW264.7细胞形态由正常状态变为激活状态。


图2 CMP对RAW264.7细胞形态的影响
Fig.2 Effect of CMP on RAW264.7 cell morphology
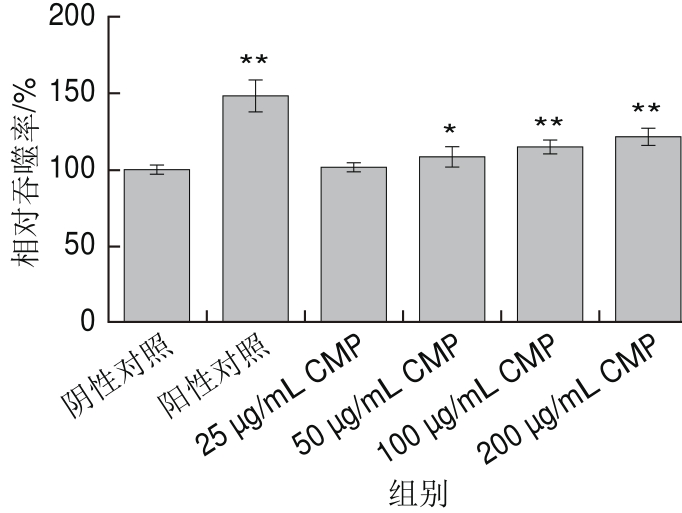
图3 CMP对RAW264.7细胞吞噬活性的影响
Fig.3 Effect of CMP on phagocytosis activity of RAW264.7 cells
如图3所示,CMP处理组RAW264.7细胞的吞噬活性随CMP质量浓度的增加而增强,当CMP质量浓度为50、100、200 μg/mL时RAW264.7细胞的相对吞噬率分别为108.28%、115.13%和121.92%,与阴性对照组相比有显著差异(P<0.05,P<0.01),与阳性对照组刺激作用无显著差异(P>0.05)。结果证明CMP可以增强RAW 264.7细胞的吞噬活性。
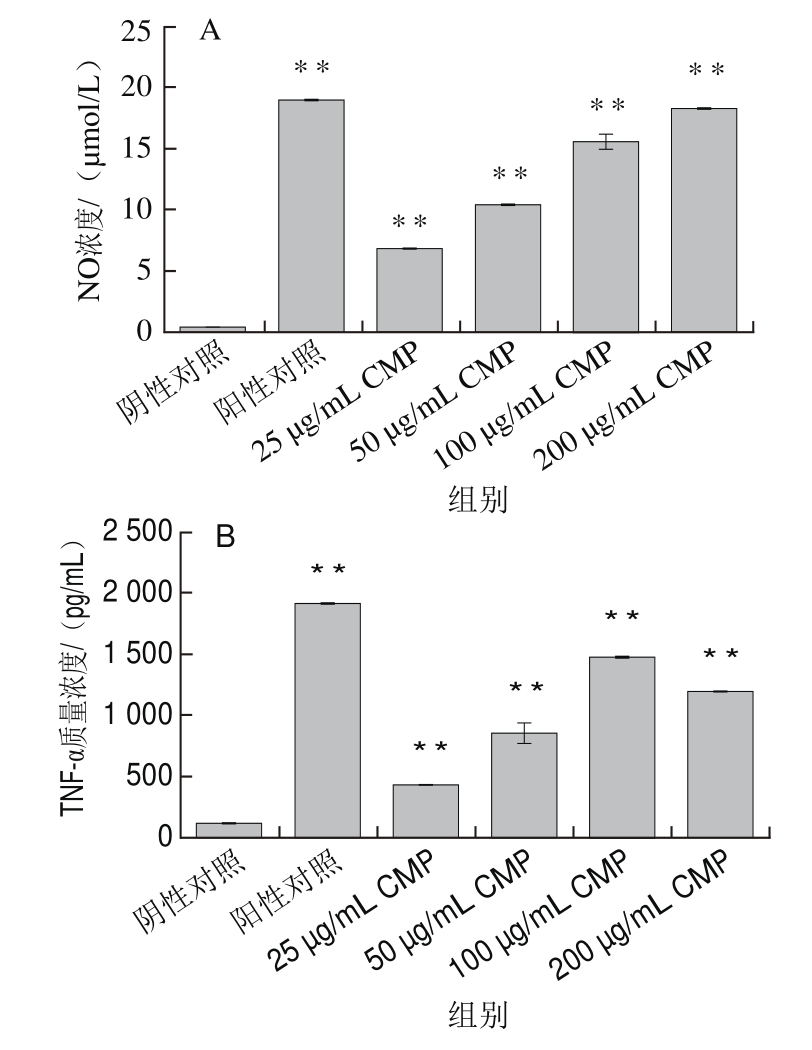

图 4 CMP对RAW264.7细胞分泌NO(A)、TNF-α(B)和IL-1β(C)的影响
Fig.4 Effect of CMP on the secretion of NO (A), TNF-α (B) and IL-1β (C) in RAW264.7 cells
检测CMP是否能促进RAW264.7细胞分泌炎性介质NO和细胞因子TNF-α和IL-1β。结果如图4所示,与阴性对照组相比,在实验质量浓度范围内,CMP均能够明显刺激RAW264.7细胞分泌NO和IL-1β,具有剂量依赖性,且差异具有统计学意义(P<0.01)(图4A、C)。各实验质量浓度的CMP均能够刺激RAW264.7分泌TNF-α,与对照组相比具有极显著差异(P<0.01),与NO和IL-1β结果不同的是,TNF-α的分泌量呈现先升高后下降的趋势,在CMP为100 μg/mL时达到最高值,约为1 478 pg/mL(图4B)。


图 5 TLR4和MR抑制剂对CMP刺激RAW264.7细胞产生免疫应答的影响
Fig.5 Effects of TLR4 and MR inhibitors on CMP-induced immune response in RAW264.7 cells
为了验证TLR4和MR受体是否参与CMP对RAW264.7细胞的激活作用,本实验分别采用TLR4和MR的抑制剂VGX-1027和甘露聚糖预处理RAW264.7细胞。结果如图5所示,抑制剂单独处理组NO、TNF-α和IL-1β的分泌量与对照组相比无明显差异(P>0.05);VGX-1027和甘露聚糖预处理的细胞在CMP刺激后,培养上清液中NO、TNF-α和IL-1β含量降低,与CMP单独处理组相比有极显著差异(P<0.01)(图5A~C)。结果表明TLR4和MR能够参与CMP刺激RAW264.7细胞产生免疫反应,TLR4和MR均为RAW264.7细胞上CMP受体。

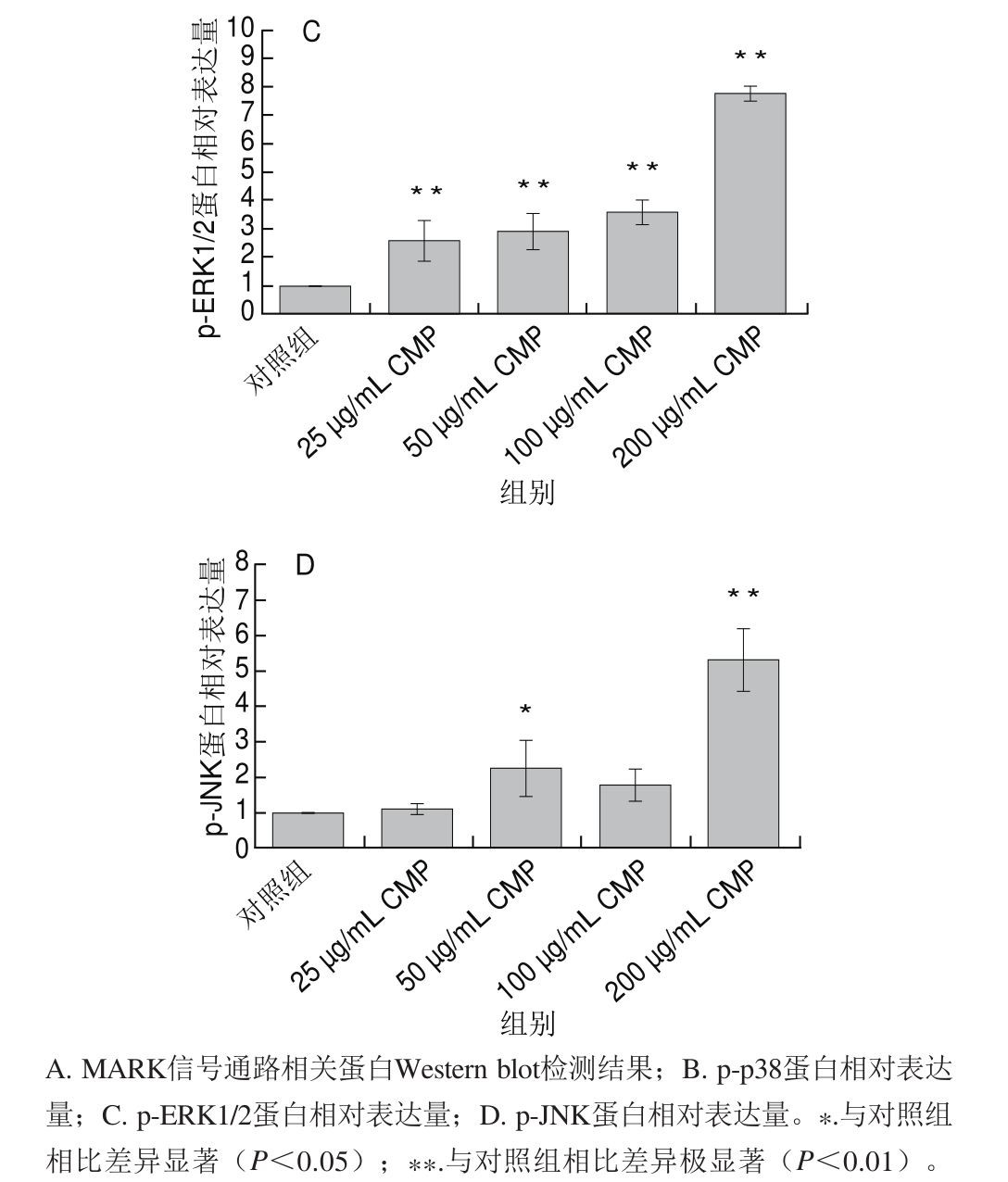
图 6 CMP对RAW 264.7细胞MAPK通路激活的影响
Fig.6 Effect of CMP on MAPK pathway activation in RAW 264.7 cells
使用Western blot方法检测MAPK 3 个亚基ERK1/2、JNK和p38磷酸化水平(图6A)。如图6B、C所示,p-p38和p-ERK1/2蛋白相对表达量随CMP的质量浓度增加而增加,与对照组相比,200 μg/mL CMP处理组相对表达量约为4.53和7.77,与对照组相比有极显著差异(P<0.01);JNK的磷酸化水平虽不呈剂量依赖趋势,但在200 μg/mL时达到了最高水平,约为对照组的5.35 倍,与对照组相比有极显著差异(P<0.01)(图6D)。结果证明CMP能够激活巨噬细胞RAW264.7中的MAPK信号通路。
探究CMP激活MAPK通路在RAW264.7发挥免疫调节中的作用,分别使用MAPK的3 个亚基抑制剂,包括p-38抑制剂SB203580、JNK抑制剂SP600125和ERK1/2抑制剂PD98059预处理细胞,再与CMP共培养。如图7所示,3 种抑制剂单独处理组NO、TNF-α和IL-1β的分泌量与对照组相比无显著差异(P>0.05);与CMP单独处理立组相比,3 种抑制剂均能够抑制RAW264.7细胞分泌NO、TNF-α和IL-1β,有极显著差异(P<0.01),其中,SP600125对NO和IL-1β分泌抑制效果最明显,SB203580对TNF-α分泌抑制作用最强,PD98059的抑制作用相对于其他两种抑制剂较弱。以上结果证明MAPK通路参与CMP诱导的RAW264.7细胞部分免疫应答。
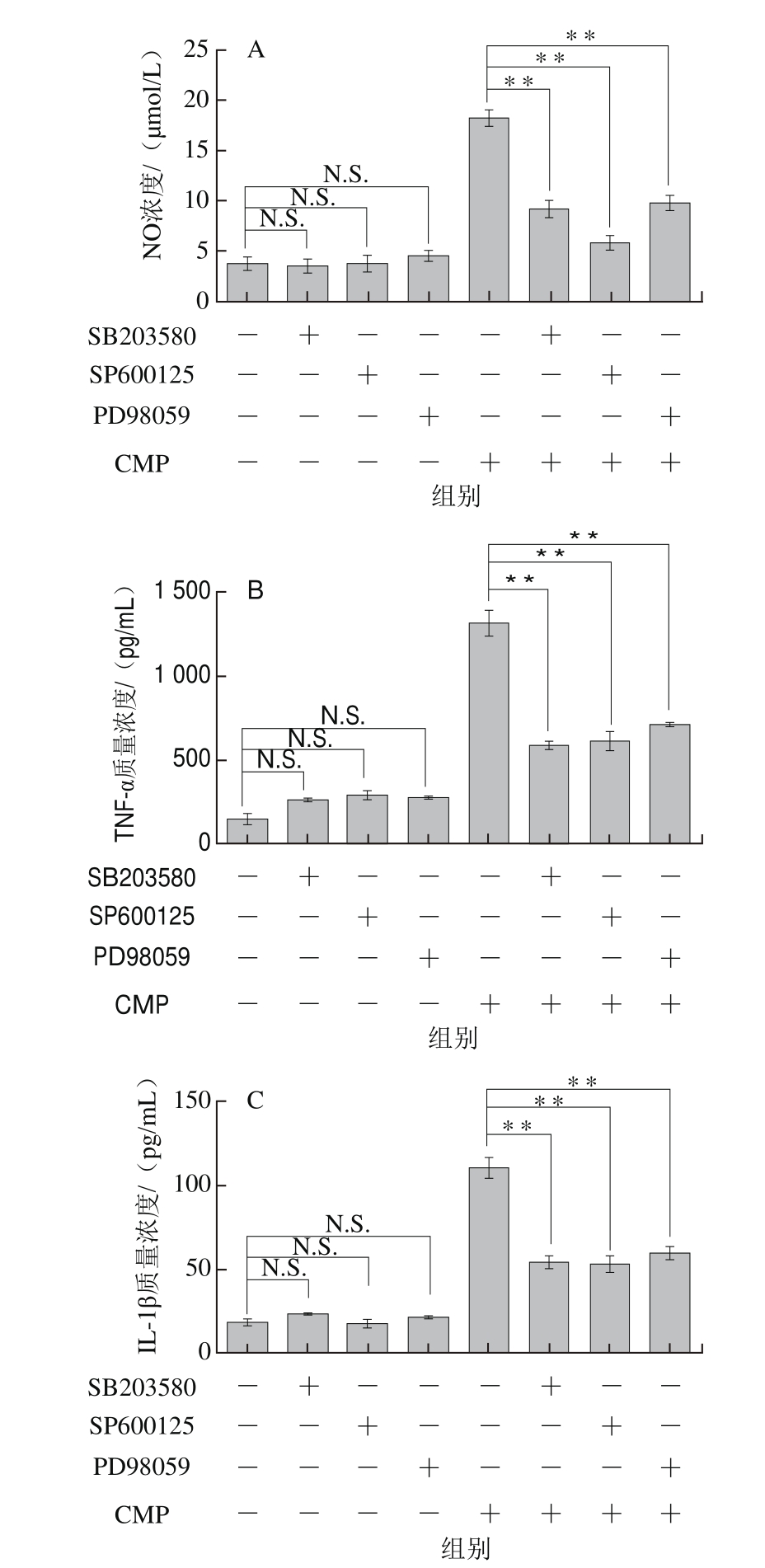
图 7 MAPK抑制剂对CMP诱导RAW264.7分泌NO(A)、TNF-α(B)和IL-1β(C)的影响
Fig.7 Effects of MAPK inhibitors on the secretion of NO (A),TNF-α (B) and IL-1β (C) induced by CMP in RAW264.7 cells
巨噬细胞是机体免疫细胞中最重要类型之一。当机体受到病原体的侵害时,活化的巨噬细胞不仅能够吞噬病原体,还分泌调节免疫反应的细胞信使,如炎性介质NO、PEG2和细胞因子IL-6、TNF-α和IL-1β[14]。有研究报道,真菌多糖可以诱导巨噬细胞中IL-1β、IL-6和TNF-α等细胞因子的分泌[15],增强巨噬细胞的吞噬活性[16]。本研究结果表明,CMP可以促进RAW264.7细胞增殖,增强细胞吞噬能力,显著增加NO、TNF-α和IL-1β的产生。这表明CMP可以激活正常状态下的巨噬细胞,在体外具有较强的免疫调节作用。
当巨噬细胞被激活产生免疫反应时,其表面的免疫相关受体首先被激活,继而引发细胞中一系列紧密的信号级联反应,各种免疫相关的信号传导途径被协同激活,最终做出一系列的免疫应答[17]。机体的先天性免疫系统通常通过PRRs识别病原体和刺激物,研究最普遍的PRRs是TLRs[18-19]。TLR4是最重要的TLRs之一,主要存在于巨噬细胞,单核细胞,中性粒细胞和树突状细胞[20]。最近有研究发现TLR4是一种重要的真菌多糖受体[21]。真菌多糖具有多种生物学活性,免疫调节是其最重要的活性之一。但由于真菌多糖分子质量较高,不能穿透细胞,所以多糖调节免疫活性的第一步是与细胞受体结合[22-23]。据报道,灵芝多糖[24],猪苓多糖[25]可以与巨噬细胞表面TLR4发生结合。根据这些报道,本实验研究TLR4是否为CMP的受体。本研究中,TLR4受体抑制剂VGX-1027能显著阻断CMP诱导的NO、TNF-α和IL-1β的分泌,从而抑制CMP刺激的巨噬细胞免疫应答。说明TLR4为CMP的受体之一,并且TLR4参与细胞因子产生的信号途径。本研究还发现,TLR4抑制剂不能完全抑制TNF-α、IL-1β和NO的产生,这说明巨噬细胞上存在其他可识别CMP的受体,所以本研究进行了相同的实验来检测其他膜受体。
近年来的研究表明,巨噬细胞表面PRRs MR也与免疫密切相关。巨噬细胞上MR的表达受病原体及其产物、皮质类固醇、前列腺素和细胞因子调控[26]。Wang Changlu等从杏鲍菇分离得到的多糖含有甘露糖组分,这在一定程度上解释了MR在杏鲍菇多糖刺激巨噬细胞产生细胞因子中的重要作用[27]。Li Wenjuan等用黑灵芝多糖对巨噬细胞进行刺激,实验结果表明,MR与巨噬细胞的吞噬能力增强和TNF-α和IL-1β的分泌增加有关[26]。因此推测巨噬细胞上CMP的许多受体中存在MR。本实验采用了与TLR4相同的检测方法,最终证明MR同样能够参与CMP对巨噬细胞的免疫调节。
然而,受体的激活只是免疫应答的第一步。在细胞中,有许多下游信号转导通路负责调节细胞功能,包括细胞增殖、基因表达、免疫应答和细胞凋亡[28]。TLRs下游信号通路主要包括调节细胞功能的MAPK,如c-Jun N端激酶(c-Jun N-terminal kinase,JNK)、p38和细胞外信号调节激酶(extracellular regulated protein kinases,ERK)[29]。Xu Duoduo等从杏鲍菇中提取的多糖EPA-1能够诱导RAW264.7细胞分泌NO和TNF-α、IL-1和IL-6等细胞因子,并且EPA-1以剂量依赖性方式促进p38,ERK1/2和JNK磷酸化,从而通过MAPK途径参与巨噬细胞免疫调节过程[30]。竹荪多糖通过MAPK/NF-kB信号通路调节NO和TNF-α等活性因子的产生[31]。本研究结果显示,用CMP处理RAW264.7细胞能够激活MAPK通路,且MAPK通路的激活参与CMP诱导的RAW264.7细胞分泌NO、TNF-α和IL-1β。
总之,CMP表现出较强的免疫调节活性,能够激活RAW264.7细胞,增强RAW264.7细胞吞噬活性并诱导细胞因子产生。TLR4和MR是RAW264.7细胞膜上的CMP受体,此外,MAPK信号通路也参与CMP诱导RAW264.7细胞分泌NO、TNF-α和IL-1β。因此,本实验证明了CMP通过TLR4、MR/MAPK信号传导途径诱导RAW264.7细胞产生免疫应答,这有助于初步理解CMP活化RAW264.7细胞的分子机制,为蛹虫草保健品的合理开发和应用提供新的视角。但CMP调节巨噬细胞免疫反应具体的分子机制仍需进一步研究,在巨噬细胞上仍存在其他CMP的受体有待于发现,未来仍需不断地开拓新思路,将真菌多糖作为免疫佐剂广泛地应用到保健品的开发和生产中。
[1] LI Y, MENG T, HAO N, et al. Immune regulation mechanism of Astragaloside IV on RAW264.7 cells through activating the NF-kappaB/MAPK signaling pathway[J]. International Immunopharmacology, 2017,49: 38-49. DOI:10.1016/j.intimp.2017.05.017.
[2] LEE S B, LEE W S, SHIN J S, et al. Xanthotoxin suppresses LPS-induced expression of iNOS, COX-2, TNF-alpha, and IL-6 via AP-1, NF-kappaB, and JAK-STAT inactivation in RAW 264.7 macrophages[J]. International Immunopharmacology, 2017, 49: 21-29.DOI:10.1016/j.intimp.2017.05.021.
[3] ZHENG X, ZOU S, XU H, et al. The linear structure of beta-glucan from baker’s yeast and its activation of macrophage-like RAW264.7 cells[J]. Carbohydrate Polymers, 2016, 148: 61-68. DOI:10.1016/j.carbpol.2016.04.097.
[4] DU Y Q, LIU Y, WANG J H. Polysaccharides from Umbilicaria esculenta cultivated in Huangshan Mountain and immunomodulatory activity[J]. International Journal of Biological Macromolecules, 2015,72: 1272-1276. DOI:10.1016/j.ijbiomac.2014.09.057.
[5] ZHANG X, QI C, GUO Y, et al. Toll-like receptor 4-related immunostimulatory polysaccharides: Primary structure, activity relationships, and possible interaction models[J]. Carbohydrate Polymers, 2016, 149: 186-206. DOI:10.1016/j.carbpol.2016.04.097.
[6] MARTINEZ-SOTO D, RUIZ-HERRERA J. Functional analysis of the MAPK pathways in fungi[J]. Revista Iberoamericana de Micologia,2017, 34(4): 192-202. DOI:10.1016/j.riam.2017.02.006.
[7] 李倩, 李顺, 陈善泽. 巨噬细胞极化与炎症性疾病[J]. 国外医药抗生素分册, 2018, 39(1): 80-85. DOI:10.13461/j.cnki.wna.005106.
[8] 李婧文, 周长林. 多糖的免疫调节作用及多糖药物的研究进展[J]. 中国生化药物杂志, 2016, 36(4): 24-28. DOI:10.3969/j.issn.1005-1678.2016.04.06.
[9] YOON J Y, KIM J H, BAEK K S, et al. A direct protein kinase B-targeted anti-inf l ammatory activity of cordycepin from artif i cially cultured fruit body of Cordyceps militaris[J]. Pharmacognosy Magazine, 2015, 11(43): 477-485. DOI:10.4103/0973-1296.160454.
[10] 钟文, 郭丽新, 齐彦. 蛹虫草多糖提取及其生物活性研究进展[J]. 辽宁中医药大学学报, 2017, 19(9): 219-221. DOI:10.13194/j.issn.1673-842x.2017.09.062.
[11] 王米, 张丽芳, 费陈忠, 等. 蛹虫草多糖对小鼠腹腔巨噬细胞免疫功能的影响[J]. 中国生化药物杂志, 2015, 35(4): 10-12. DOI:1005-1678(2015)04-0010-03.
[12] LEE J S, KWON D S, LEE K R, et al. Mechanism of macrophage activation induced by polysaccharide from Cordyceps militaris culture broth[J]. Carbohydrate Polymers, 2015, 120: 29-37. DOI:10.1016/j.carbpol.2014.11.059.
[13] LEE J S, HONG E K. Immunostimulating activity of the polysaccharides isolated from Cordyceps militaris[J]. International immunopharmacology, 2011, 11(9): 1226-1233. DOI:10.1016/j.intimp.2011.04.001.
[14] ZONG A, CAO H, WANG F. Anticancer polysaccharides from natural resources: a review of recent research[J]. Carbohydrate Polymers,2012, 90(4): 1395-1410. DOI:10.1016/j.carbpol.2012.07.026.
[15] ZHAO L H, MA Z X, ZHU J, et al. Characterization of polysaccharide from Astragalus radix as the macrophage stimulator[J].Cellular Immunology, 2011, 271(2): 329-334. DOI:10.1016/j.cellimm.2011.07.011.
[16] 许海林, 吴小勇, 聂少平, 等. 黑木耳多糖提取工艺优化及其对小鼠巨噬细胞功能的影响[J]. 食品科学, 2016, 37(10): 100-104.DOI:10.7506/spkx1002-6630-201610017.
[17] HAN C, YANG J, SONG P, et al. Effects of Salvia miltiorrhiza polysaccharides on lipopolysaccharide-induced inflammatory factor release in RAW264.7 cells[J]. Journal of Interferon & Cytokine Research, 2018, 38(1): 29-37. DOI:10.1089/jir.2017.0087.
[18] VIDYA M K, KUMAR V G, SEJIAN V, et al. Toll-like receptors:significance, ligands, signaling pathways, and functions in mammals[J]. International Reviews of Immunology, 2017, 37(1): 1-17.DOI:10.1080/08830185.2017.1380200.
[19] SHIRJIANG S, MANSOORI B, SOLALI S, et al. Toll-like receptors as a key regulator of mesenchymal stem cell function: an up-to-date review[J]. Cellular Immunology, 2017, 315: 1-10. DOI:10.1016/j.cellimm.2016.12.005.
[20] 黄蓉, 吴青, 李茂军, 等. Toll样受体4在免疫相关细胞中的作用[J].中华临床医师杂志(电子版), 2016, 10(8): 1178-1182. DOI:10.3877/cma.j.issn.1674-0785.2016.08.029.
[21] YU Q, NIE S P, WANG J Q, et al. Toll-like receptor 4-mediated ROS signaling pathway involved in Ganoderma atrum polysaccharideinduced tumor necrosis factor-alpha secretion during macrophage activation[J]. Food and Chemical Toxicology, 2014, 66: 14-22.DOI:10.1016/j.fct.2014.01.018.
[22] XIE S Z, HAO R, ZHA X Q, et al. Polysaccharide of Dendrobium huoshanense activates macrophages via toll-like receptor 4-mediated signaling pathways[J]. Carbohydrate Polymers, 2016, 146: 292-300.DOI:10.1016/j.carbpol.2016.03.059.
[23] WANG Z, DONG B, FENG Z, et al. A study on immunomodulatory mechanism of polysaccharopeptide mediated by TLR4 signaling pathway[J]. BMC Immunology, 2015, 16: 1-9. DOI:10.1186/s12865-015-0100-5.
[24] ZHANG S, NIE S, HUANG D, et al. Polysaccharide from Ganoderma atrum evokes antitumor activity via Toll-like receptor 4-mediated NF-kappaB and mitogen-activated protein kinase signaling pathways[J].Journal of Agricultural and Food Chemistry, 2013, 61(15): 3676-3682.DOI:10.1021/jf4004225.
[25] LI X, XU W. TLR4-mediated activation of macrophages by the polysaccharide fraction from Polyporus umbellatus (pers.) Fries[J].Journal of Ethnopharmacology, 2011, 135(1): 1-6. DOI:10.1016/j.jep.2010.06.028.
[26] LI Wenjuan, TANG Xiaofang, SHUAI Xiaoxue, et al. Mannose receptor mediates the immune response to Ganoderma atrum polysaccharides in macrophages[J]. Journal of Agricultural and Food Chemistry, 2017, 65(2): 348-357. DOI:10.1021/acs.jafc.6b04888.
[27] WANG Changlu, CUI Haiyan, WANG Yurong, et al. Bidirectional immunomodulatory activities of polysaccharides purified from Pleurotus nebrodensis[J]. Inflammation, 2014, 37(1): 83-93.DOI:10.1007/s10753-013-9714-z.
[28] VARFOLOMEEV E, GONCHAROV T, MAECKER H, et al. Cellular inhibitors of apoptosis are global regulators of NF-kappaB and MAPK activation by members of the TNF family of receptors[J]. Science Signaling, 2012, 5(216): ra22. DOI:10.1126/scisignal.2001878.
[29] FANG Q, WANG J F, ZHA X Q, et al. Immunomodulatory activity on macrophage of a purif i ed polysaccharide extracted from Laminaria japonica[J]. Carbohydrate Polymers, 2015, 134: 66-73. DOI:10.1016/j.carbpol.2015.07.070.
[30] XU Duoduo, WANG Haiyang, ZHENG Wei, et al. Charaterization and immunomodulatory activities of polysaccharide isolated from Pleurotus eryngii[J]. International Journal of Biological Macromolecules, 2016,92: 30-36. DOI:10.1016/j.ijbiomac.2016.07.016.
[31] LIAO W, LUO Z, LIU D, et al. Structure characterization of a novel polysaccharide from Dictyophora indusiata and its macrophage immunomodulatory activities[J]. Journal of Agricultural and Food Chemistry, 2015, 63(2): 535-544. DOI:10.1021/jf504677r.
Molecular Mechanism of Cordyceps militaris Polysaccharides in Regulating the Immune Function of Macrophage RAW264.7 Cells
MIAO Yue, REN Guihong, ZHEN Dong, et al. Molecular mechanism of Cordyceps militaris polysaccharides in regulating the immune function of macrophage RAW264.7 cells[J]. Food Science, 2019, 40(9): 188-194. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180122-294. http://www.spkx.net.cn