辣椒贮藏过程中易遭受病原菌侵染,采后主要病害有根霉病、炭疽病等。目前化学防腐剂在控制辣椒采后病害方面应用广泛,但其在果实上残留可能危害人体健康,并可能使病原菌产生抗药性且造成环境污染等问题[1-2]。我国植物资源丰富、种类繁多,植物提取物作为抑菌剂具有污染程度低、对人体无毒副作用且不易产生耐药性等优点,具有广阔的应用前景[3]。Fallik等[4]发现桧木提取物在体外可抑制采后辣椒灰霉和链格孢菌的菌丝生长,可减少辣椒采后病害进而延长其贮藏期。闫师杰等[5]发现丁香、大黄提取液可有效降低辣椒采后的腐烂率,抑制呼吸作用和失水,从而有利于延缓果实衰老。余东坡等[6]从21 种植物材料中通过抑制病原菌菌丝生长和孢子萌发实验,将筛选出的丁香、高良姜、乌梅按一定比例复配后对青椒进行保鲜,能有效降低其果实贮藏中的腐烂率,抑制其呼吸强度,减缓VC损失。由根霉菌(Rhizopus spp.)引起的腐烂是辣椒采后贮藏期间腐烂的主要原因之一。研究发现,植物对病原菌侵染有天然的防御反应,在遭受侵害时将诱发机体内一系列生理生化反应来抵御病原菌侵染,通过生物或非生物因素诱导植物自身产生抗病性[7-9]。
本研究通过分离、纯化及致病性实验测定辣椒采后贮藏期的病原菌,采用生长速率法从丁香、肉桂、花椒等9 种传统药食同源植物中筛选出抑菌效果好的植物材料,并测定其最小抑菌浓度(minimum inhibitory concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC),并研究复合涂膜剂诱导辣椒对根霉病的抗性作用,检测防御相关酶(苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)、过氧化物酶(peroxldase,POD)、多酚氧化酶(polyphenol oxidase,PPO))活力和总酚、类黄酮含量,旨在为探讨丁香、肉桂提取液复合涂膜剂防腐保鲜机理提供理论依据。
丁香、肉桂、花椒、蒲公英、鱼腥草、金银花、乌梅、陈皮、八角均购于湖南农业大学养天和大药房。辣椒采摘于湖南农业大学实验基地,品种为‘湘研15号’,选取大小、成熟度基本一致,无机械损伤、无病虫害的果实。
聚乙二醇6000、聚乙烯吡咯烷酮、愈创木酚(化学纯)、β-巯基乙醇、TritonX-100、邻苯二酚(分析纯)国药集团化学试剂有限公司;羧甲基纤维素钠、普鲁兰多糖、海藻酸钠、刺槐豆胶、瓜尔豆胶 郑州市食代添骄化工产品有限公司;魔芋精粉(纯度95%) 成都市圣特蒙魔芋精粉有限责任公司;黄原胶 郑州市博研生物科技有限公司。
SW-CJ-DFD超净工作台 苏州苏洁净化设备有限公司;GZ-400-GS智能人工气候箱 韶关市广智科技有限公司;BCD-197K冰箱 河南新飞电器有限公司;QL-866漩涡混合器 海门市其林贝尔仪器制造有限公司;HR/T16M台式高速冷冻离 湖南赫西仪器装备有限公司;光学显微镜 上海仪圆仪器有限公司。
1.3.1 辣椒采后病原菌分离纯化
采集具有典型症状的辣椒果实,采用2 种方法进行分离:1)直接挑取病原菌菌丝接种至马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基,28 ℃恒温培养;2)切取具典型症状的果肉,75%(体积分数,下同)乙醇中浸泡30 s后,用无菌水冲洗2 次,置于PDA培养基中28 ℃、相对湿度75%培养4 d后,挑取组织旁菌丝反复纯化,直至分离出单一菌落。
1.3.2 辣椒采后病原菌致病性观察
待病原菌在PDA培养基中生长8 d后洗脱孢子,用纱布过滤,制成孢子悬浮液(在10h40 倍光学显微镜下每个视野30~40 个孢子)备用。
选取无损伤、无病害的辣椒果实,立即带回实验室,用75%乙醇表面消毒后用无菌水冲洗3 次,以10 mL灭菌针头刺伤果实,吸取20 μL孢子悬浮液注入伤口,并以20 μL无菌水作为对照,每个处理组10 个果实,做3 组平行,每隔2 d查看刺伤处的致病情况和症状表现,在发病处再次分离病原菌,与原接种菌进行对比。
1.3.3 辣椒采后病原菌形态学鉴定
挑取分离纯化的病原菌菌丝于PDA中,28 ℃下培养,观察菌落形态特征,然后挑取病原菌菌丝或吸取孢子悬浮液于显微镜下,观察菌丝及孢子形态并拍照记录。根据对孢子、孢子囊、假根等形态的观察,参照《真菌鉴定手册》[10]进行鉴定。
1.3.4 植物提取液制备
称量50 g过40 目筛的植物材料,加入250 mL无水乙醇,60 ℃恒温1.0 h,减压抽滤,收集滤液,10 000 r/min离心10 min,收集上清液,40 ℃蒸发浓缩至稀膏状,清水润洗定容至25 mL,制成2 g/mL植物提取液,4 ℃保藏备用。
1.3.5 植物提取液抑菌率测定
取0.50 mL植物提取液与经灭菌的24.50 mL PDA(冷却至50 ℃左右)充分混合,配制成40 mg/mL培养基,以清水为对照,3 次重复。用10 mm打孔器打取菌饼后移至培养基中心,置于28 ℃培养,每隔24 h观察生长情况。当对照组菌丝基本长满培养皿时,用十字交叉法测量并记录菌落直径。按式(1)计算抑菌率。
1.3.6 MIC和MBC的测定
采用平板梯度稀释法将筛选出的植物提取液分别配制成40.00、20.00、10.00、5.00、2.50、1.25、0.625 mg/mL的培养基,倒平板。取10 mm打孔菌饼至培养基中央,以清水为对照,置于28 ℃培养,每个处理设3 次重复,以无病原菌长出的最低植物提取液质量浓度为MIC[11]。继续培养1 周,以无病原菌生长的最低植物提取液质量浓度为MBC[12]。
1.3.7 植物提取液复合涂膜剂制备
称取1.88 g瓜尔豆胶和0.62 g普鲁兰多糖,使其溶于450 mL蒸馏水中,80 ℃恒温加热1 h,利用搅拌器300 r/min不断搅拌,待其溶解完全后,分别加入4.16 mL丁香提取液和8.34 mL肉桂提取液,搅拌均匀后定容至500 mL备用,即得质量分数0.5%复合涂膜剂(瓜尔豆胶-普鲁兰多糖(质量比3∶1)+丁香-肉桂提取液(体积比1∶2))。
1.3.8 诱抗辣椒处理
辣椒果实用体积分数75%乙醇擦洗后,无菌水冲洗3 次,各组均浸泡30 s,待果实表面水分自然风干后,用10 mL无菌注射器针头刺伤果实,以加入20 μL无菌水为CK1组;以接种20 μL根霉菌孢子悬浮液为CK2组;将果实于丁香、肉桂提取液复合涂膜剂中浸泡30 s,待表面水分风干后,刺伤并接种20 μL根霉菌孢子悬浮液为复合涂膜剂组。接种后用聚乙烯保鲜袋密封,在20 ℃、相对湿度90%下贮藏,每隔2 d测定发病率和病斑直径,取病斑周围1.5 mm处果肉进行各项指标的测定,每组20 个果实,3 组平行。
1.3.9 诱抗辣椒对根霉病抗性相关指标的测定
病斑直径采用十字交叉法测定,3 次重复取平均值,以不小于0.4 mm为发病。发病率按式(2)计算。
总酚、类黄酮含量和PAL活力采用紫外吸收法[13]测定,总酚、类黄酮含量与吸光度呈正相关;POD活力采用愈创木酚法[14]测定;PPO活力采用邻苯二酚比色法[15]测定。
数据采用SPSS 18.0软件进行单因素方差分析,差异显著性采用Duncan法,P<0.05为差异显著;采用Origin 8.0软件作图。

图1 分离辣椒病原菌致病性观察结果
Fig.1 Pathogenic observation of isolated strains
选取具有典型发病症状的辣椒果实为供试材料,经过分离纯化,得到4 株引起辣椒腐烂的病原菌,分别编号为P1、P2、P3、P4。由图1可知,辣椒果实损伤接种P1、P2、P3、P4菌株孢子均可引起辣椒果实发病,并表现出相应致病菌症状。辣椒果实损伤接种P1菌株孢子后第8天,损伤部位组织开始变褐,并呈水浸状凹陷,后期凹陷处伴有白色绒毛状菌丝长出。辣椒果实损伤接种P2菌株孢子后第10天开始产生病斑,并呈水浸状圆形凹陷,后期病斑周围呈同心环状并有黑色小点长出。辣椒果实损伤接种P3菌株孢子后第8天开始产生病斑,并呈水浸状圆斑凹陷,后期病斑周围呈同心环状,并伴有红色小点长出。辣椒果实损伤接种P4菌株孢子后第4天开始产生病斑,并呈水浸状凹陷,接着病斑继续扩大,辣椒果实腐烂严重并伴有汁液流出,后期接种部位有菌丝及黑色小球状孢子囊出现。
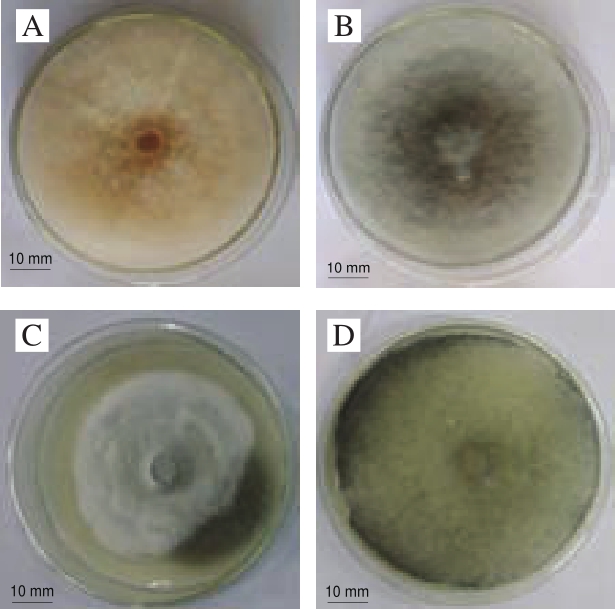
图2 辣椒病原菌菌落形态
Fig.2 Colonial morphology of pathogenic strains
如图2所示,P1菌株菌丝呈白色蓬松状,生长速度较快,5 d左右即可长满培养皿;菌落反面在生长开始阶段为白色,4 d左右呈现粉色或粉红色。P2菌株菌丝生长开始阶段为白色,菌落较密,生长速度较慢,8 d左右才可长满培养皿;反面菌丝生长开始阶段为白色,培养6 d后渐渐变黑。P3菌株菌落呈圆形,菌丝生长开始阶段为白色,生长后期阶段转变为灰色或黑色,生长速度较慢,10 d左右才可长满培养皿;菌落反面生长开始阶段为白色,6 d后则渐渐变黑。P4菌株菌丝生长开始阶段为白色,呈蓬松状,生长速度极快,2 d左右便可长满培养皿;后期阶段会有黑色小球状孢子囊产生。
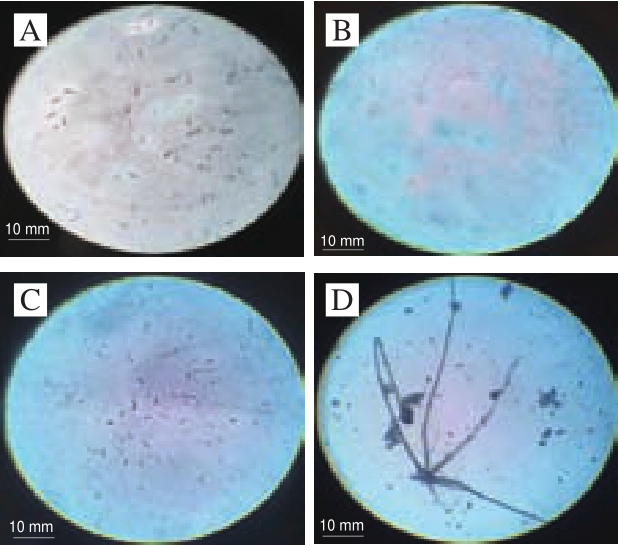
图3 病原菌显微形态
Fig.3 Microscopic morphology of pathogenic strains
由图3可知,P1菌株小型分生孢子多呈椭圆状,大型分生孢子呈镰刀状,有2~4 个隔膜;P2菌株分生孢子呈短圆柱形;P3菌株分生孢子呈长椭圆形或椭圆形;P4菌株具有假根和黑色孢子囊,分生孢子近似球形,为黑色。
根据菌株在PDA上的菌落形态、果实上的致病症状及分生孢子、孢子囊、假根等显微形态观察结果,将P1菌株鉴定为尖孢镰刀菌(Fusarium oxysporum),P2菌株鉴定为黑色炭疽菌(Colletotrichum nigrum),P3菌株鉴定为红色炭疽菌(Colletotrichum gloeosporioides),P4菌株鉴定为根霉菌(Rhizopus spp.)。
表1 植物提取液对辣椒病原菌的抑制作用
Table1 Inhibitory effects of plant extracts on pathogens

注:同列肩标小写字母不同表示差异显著(P<0.05)。
植物提取液 抑菌率/%尖孢镰刀菌 黑根霉菌 红色炭疽病菌黑色炭疽病菌丁香 100f0a 100f0a 100f0a 100f0a蒲公英 0e 0b 0e 0e鱼腥草 0e 0b 0e 0e金银花 0e 0b 0e 0e乌梅 0e 0b 62.48f3.42b 58.98f2.82b陈皮 67.33f3.18c 0b 23.63f0.58d 26.64f0.88d八角 60.53f2.71d 0b 30.05f2.74c 51.36f3.93c肉桂 100f0a 100f0a 100f0a 100f0a花椒 85.18f1.65b 100f0a 66.28f0.18b 55.89f3.09b
以生长速率法测定了9 种植物提取液对辣椒尖孢镰刀菌、黑色炭疽菌、红色炭疽菌和根霉菌菌丝的抑制作用。由表1可知,添加40 mg/mL植物提取液时,丁香、肉桂提取液对4 种病原菌的抑菌率均为100%。而蒲公英、鱼腥草、金银花提取液对4 种病原菌均无抑制作用,八角提取液对尖孢镰刀菌、黑色炭疽菌、红色炭疽菌的抑菌率分别为60.53%、30.05%、51.36%,但对黑根霉菌无抑制作用。表明丁香、肉桂提取液抑菌作用最强,抑菌谱最广。
丁香和肉桂提取液对尖孢镰刀菌、黑色炭疽菌、红色炭疽菌和根霉菌的MIC均分别为1.25、2.50、2.50、5.00 mg/mL,表明低质量浓度丁香与肉桂提取液对尖孢镰刀菌、黑色炭疽菌、红色炭疽菌和根霉菌的生长有抑制作用;对4 种病原菌的MBC均分别2.50、5.00、5.00、10.00 mg/mL,表明较低质量浓度的丁香、肉桂提取液只能抑制尖孢镰刀菌、黑色炭疽菌、红色炭疽菌和根霉菌的生长,但要完全杀灭病原菌还需进一步提高其质量浓度。
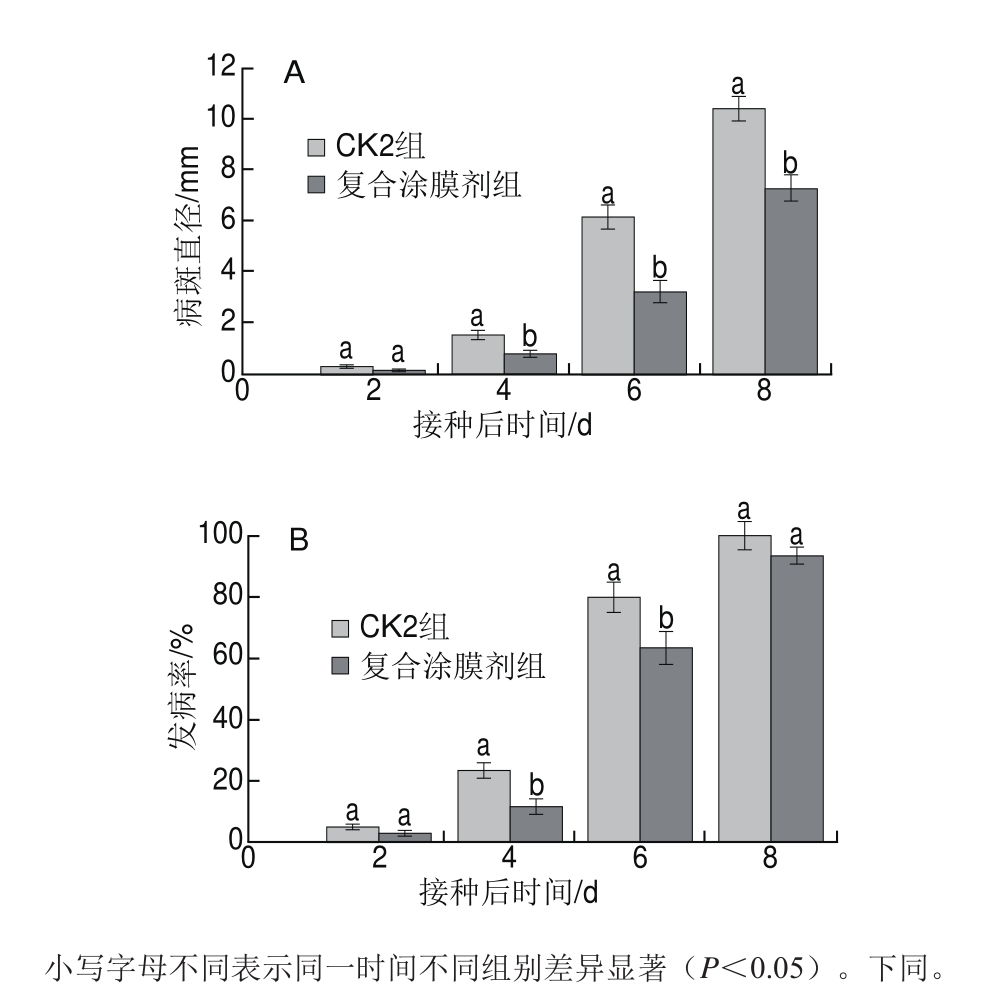
图4 丁香、肉桂提取液复合涂膜剂对辣椒病斑直径(A)与发病率(B)的影响
Fig.4 Effects of composite coating on lesion diameter (A) and disease incidence (B) in hot peppers
由图4可知,丁香、肉桂提取液复合涂膜剂能降低接种根霉菌孢子的辣椒发病率,在第2天辣椒果实出现感病症状,复合涂膜剂组和CK2组的病斑直径均在0.5 mm以内,且差异不显著(P>0.05)。接种后第4天,复合涂膜剂组和CK2组的辣椒果实发病率呈显著性差异(P<0.05),之后发病率急剧上升。接种第6天时,CK2组发病率上升至80.00%,而复合涂膜剂组的发病率为63.33%,较CK2组降低了20.84%,并呈显著性差异(P<0.05);复合涂膜剂组病斑直径扩大至3.21 mm,与CK2组相比降低了47.46%,并呈显著性差异(P<0.05)。接种第8天时,CK2组的辣椒果实发病率达100%,与复合涂膜剂组的发病率差异不显著(P>0.0 5);复合涂膜剂组的病斑直径上升至7.23 mm,与CK2组(10.38 mm)相比降低了30.35%,并呈显著性差异(P<0.05)。在接种后的8 d内CK1组均未发病,即发病率为0。表明丁香、肉桂提取液复合涂膜剂能增强辣椒果实的抗病性,并显著抑制辣椒果实的病斑扩展,但接种后期其抗病性逐渐下降。
2.6.1 诱抗对辣椒总酚含量的影响

图5 丁香、肉桂提取液复合涂膜剂对辣椒总酚含量的影响
Fig.5 Effect of composite coating on total phenolic content in hot peppers
酚类物质作为重要的植物次级代谢产物之一,与果蔬采后的品质(外观、风味等)密切相关[13]。由图5可知,各组辣椒中总酚含量总体呈上升趋势。在整个贮藏期间复合涂膜剂组的总酚含量均高于CK1组和CK2组。贮藏至第2天时,各组总酚含量上升缓慢,复合涂膜剂组的总酚含量和CK1组、CK2组相差不显著(P>0.05)。贮藏第4天时,复合涂膜剂组的总酚含量显著高于CK2组(P<0.05),而CK2组显著高于CK1组(P<0.05)。贮藏第6天时,复合涂膜剂组、CK1组和CK2组的总酚含量分别比开始时高3.5、1.7 倍和2.7 倍。贮藏第8天时,复合涂膜剂组的总酚含量分别比CK1组和CK2组高60.00%和43.74%,并呈显著性差异(P<0.05),但CK1组和CK2组差异不显著(P>0.05)。表明接种根霉菌孢子能诱导辣椒果实中总酚含量提高,但在辣椒果实发病后期,这种诱导作用趋于消失;在接种病原菌的基础上,丁香、肉桂提取液复合涂膜剂在整个贮藏期内能进一步诱导辣椒果实中总酚含量的升高,从而增强其抗病性。
2.6.2 诱抗对辣椒类黄酮含量的影响
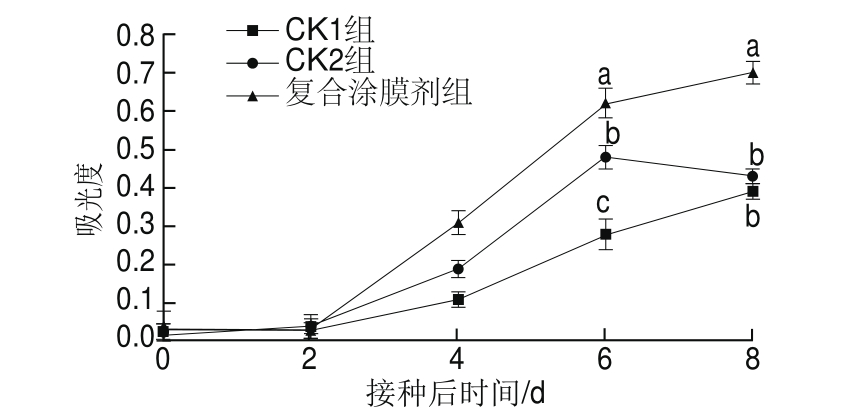
图6 丁香、肉桂提取液复合涂膜剂对辣椒类黄酮含量的影响
Fig.6 Effect of composite coating on total fl avonoid content in hot peppers
由图6可知,各组辣椒果实中类黄酮含量呈上升趋势,但开始阶段升高缓慢。在整个贮藏期间,复合涂膜剂组的类黄酮含量均高于CK1组和CK2组;贮藏2 d后,各组辣椒果实中类黄酮含量急剧上升;贮藏第6天时,复合涂膜剂组类黄酮含量显著高于CK2组,且CK2组显著高于CK1组(P<0.05);贮藏第8天时,复合涂膜剂组类黄酮含量分别比CK1组和CK2组高82.05%和61.36%,并呈显著性差异(P<0.05),但CK1组和CK2组差异不显著(P>0.05)。表明接种根霉菌孢子能诱导辣椒果实中类黄酮含量的升高,但后期这种诱导作用逐渐消失;在接种根霉菌孢子的基础上,复合涂膜剂在整个贮藏期内能进一步诱导辣椒果实中类黄酮含量的升高,从而增强其抗病性。
2.6.3 诱抗对辣椒PAL活力的影响
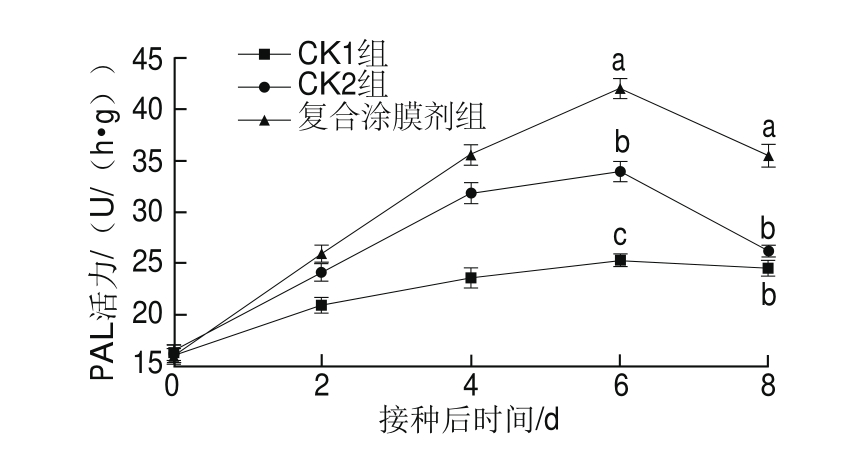
图7 丁香、肉桂提取液复合涂膜剂对PAL活力的影响
Fig.7 Effect of composite coating on PAL activity in hot peppers
PAL是催化苯丙烷类代谢途径的第1步反应,是苯丙烷类代谢途径的限速酶,与植物的抗病性密切相关[16]。由图7可知,各组PAL活力总体呈先上升后下降的变化趋势,在整个贮藏期间,复合涂膜剂组的PAL活力上升幅度均高于CK1组和CK2组。贮藏第2天时各组的PAL活力差异不显著(P>0.05)。贮藏第6天时各组的PAL活力均达到峰值,复合涂膜剂组显著高于CK2组,且CK2组显著高于CK1组(P<0.05),3 组分别比开始时升高1.65、1.23 倍和0.60 倍。贮藏6 d后,各组辣椒果实中PAL活力逐渐下降。贮藏第8天时,复合涂膜剂组的PAL活力为35.53 U/(hgg),分别比CK1组和CK2组高45.91%和24.54%,并呈显著性差异(P<0.05);但CK1组和CK2组无显著性差异(P>0.05)。表明在贮藏期间,刺伤后接种根霉菌孢子能诱导辣椒果实中PAL活力的升高,但后期诱导作用基本消失;在刺伤后接种根霉菌孢子的基础上,丁香、肉桂提取液复合涂膜剂能进一步诱导PAL活力的提高,并一直持续至第8天,从而增强其抗病性。
2.6.4 诱抗对辣椒POD活力的影响
POD是果蔬组织内重要的氧化还原酶,参与果蔬组织木质素合成,木质化可抑制病原菌的侵染[17]。由图8可知,各组辣椒果实中POD活力总体呈先升高后降低的变化趋势,均在贮藏第6天时达到峰值;在整个贮藏期间,丁香、肉桂提取液复合涂膜剂处理辣椒果实的POD活力上升幅度均高于CK1组和CK2组。贮藏6 d期间,复合涂膜剂组的POD活力显著高于CK2组(P<0.05),且CK2组高于CK1组。贮藏第6天时,复合涂膜剂组的POD活力分别比CK1组和CK2组高60.80%和32.69%,并呈显著性差异(P<0.05)。贮藏6 d后,各组辣椒果实的POD活力呈下降趋势,CK1组和CK2组差异不显著(P>0.05),但复合涂膜剂组与CK1组呈显著性差异(P<0.05)。表明刺伤接种根霉菌孢子能诱导辣椒果实中POD活力的升高,在此基础上添加丁香、肉桂复合涂膜剂能进一步诱导辣椒果实中POD活力的提高,从而增强其抗病性。

图8 丁香、肉桂提取液复合涂膜剂对辣椒POD活力的影响
Fig.8 Effect of composite coating on POD activity in hot peppers
2.6.5 诱抗对辣椒PPO活力的影响

图9 丁香、肉桂提取液复合涂膜剂对辣椒PPO活力的影响
Fig.9 Effect of composite coating on PPO activity in hot peppers
PPO在植物体内可催化多种酚类化合物氧化形成相应的醌(如咖啡酸、绿原酸等),能强烈抑制果胶分解酶和纤维分解酶,并可在一定程度上抑制病原菌的生长[18]。由图9可知,各组的PPO活力总体呈先升高后降低的变化趋势,均在贮藏第6天时达到峰值。在整个贮藏期间,复合涂膜剂组PPO活力上升幅度均高于CK1组和CK2组。贮藏第6天时,复合涂膜剂组的PPO活力显著高于CK2组(P<0.05),且CK2组显著高于CK1组(P<0.05)。贮藏6 d后,各组辣椒果实中PPO活力均呈下降趋势。贮藏第8天时,复合涂膜剂组的PPO活力为0.53 U/(ggmin),比CK1组和CK2组分别高80.00%和28.57%,且呈显著性差异(P<0.05)。说明刺伤接种根霉菌孢子能诱导辣椒果实中PPO活力升高,丁香、肉桂复合涂膜剂在此基础上能进一步诱导辣椒果实PPO活力的提高,从而增强其抗病性。
本研究分离、纯化出4 种辣椒采后主要病原菌,分别鉴定为尖孢镰刀菌、黑色炭疽菌、红色炭疽菌和根霉菌。罗永兰等[19]发现发病辣椒果柄中均含有镰刀菌,并证明镰刀菌为辣椒采后主要侵染病菌之一。肖晶等[20]发现炭疽病菌为辣椒采后主要病原菌,辣椒贮藏第5、10、15天时,炭疽病菌的发病率分别为7.0%、15.8%和33.2%,这与本研究结果基本一致。此外,张志元等[21]的研究结果也表明镰刀菌、炭疽病菌是辣椒采后主要病原菌之一。本研究分离鉴定出另一种辣椒主要病原菌——根霉菌,其在空气中分布广泛,发病率较高,极易造成果实相互侵染,与余东坡[22]的研究结果类似。
本研究结果表明,丁香、肉桂提取液对尖孢镰刀菌、黑色炭疽菌、红色炭疽菌和根霉菌的抑菌率均为100%,这可能是由于丁香、肉桂提取液中分别含有丁香酚、肉桂醛等成分,其具有广谱抑菌性[23]。丁香、肉桂提取液对尖孢镰刀菌、炭疽菌[24]和根霉菌[25]具有较强的抑制作用,这与本研究结果一致。贮藏第8天时,复合涂膜剂处理的辣椒果实发病率与CK2组差异不显著(P>0.05),而病斑直径差异显著(P<0.05),这可能是由于丁香、肉桂提取液对根霉菌孢子具有直接抑制作用,能有效抑制病斑扩展。在整个贮藏期间,复合涂膜剂组PAL、POD、PPO活力均高于CK1组和CK2组;贮藏第6天时,复合涂膜剂组的PAL、POD、PPO活力显著高于CK2组,且CK2组显著高于CK1组(P<0.05)。复合涂膜剂组辣椒果实的发病率和病斑直径均显著低于CK2组(P<0.05),表明刺伤接种根霉菌孢子能诱导果实中PAL、POD、PPO活力升高,在此基础上,丁香、肉桂提取液复合涂膜剂组能进一步诱导其活力的升高,有利于总酚、类黄酮和木质素的积累和辣椒果实抗病性的增强,这与张美丽等[26]的研究结果基本一致。由此推测丁香、肉桂提取液复合涂膜剂能够降低辣椒果实的发病率并抑制病斑直径扩展[27],这一方面是由于对辣椒果实自身抗病性的诱导,另一方面是由于其能够直接抑制根霉菌菌丝和孢子的生长[28]。
[1] KISSINGER M, TUVIA-ALKALAI S, SHALOM Y, et al.Characterization of physiological and biochemical factors associated with postharvest water loss in ripe pepper fruit during storage[J].Journal of the American Society for Horticultural Science, 2005,130(5): 735-741. DOI:10.21273/jashs.130.5.735.
[2] ALI A, NOH N M, MUSTAFA M A. Antimicrobial activity of chitosan enriched with lemongrass oil against anthracnose of bell pepper[J].Food Packaging and Shelf Life, 2015, 3: 56-61. DOI:10.1016/j.fpsl.2014.10.003.
[3] DIAZ-PEREZ J C, MUY-RANGEL M D, MASCORRO A G. Fruit size and stage of ripeness affect postharvest water loss in bell pepper fruit (Capsicum annuum L.)[J]. Journal of the Science of Food and Agriculture, 2007, 87(1): 68-73. DOI:10.21273/hortsci.41.3.504a.
[4] FALLIK E, GRINBERG S. Hinokitiol: a natural substance that controls postharvest diseases in eggplant and pepper fruits[J]. Postharvest Biology and Technology, 1992, 2(2): 137-144. DOI:10.1016/0925-5214(92)90016-i.
[5] 闫师杰, 梁丽雅, 郑伟. 中草药提取液贮藏青椒实验[J]. 食品科学,2002, 23(3): 138-140. DOI:10.3321/j.issn:1002-6630.2002.03.038.
[6] 余东坡, 王兰菊, 司芳, 等. 21 种中草药醇提物抑菌活性研究[J].安徽农业科学, 2008, 36(3): 1086-1087. DOI:10.3969/j.issn.0517-6611.2008.03.103.
[7] EDIRISINGHE M, ALI A, MAQBOOL M, et al. Chitosan controls postharvest anthracnose in bell pepper by activating defense-related enzymes[J]. Journal of Food Science and Technology, 2014, 51(12):4078-4083. DOI:10.1007/s13197-012-0907-5.
[8] POVERENOV E, ZAISEV Y, AMON H, et al. Effects of a composite chitosan-gelatin edible coating on postharvest quality and storability of red bell peppers[J]. Postharvest Biology and Technology, 2014, 96:106-109. DOI:10.1016/j.postharvbio.2014.05.015.
[9] ILIC Z S, TRAJKOVIC R, PERZELAN Y, et al. Influence of 1-methylcyclopropene (1-MCP) on postharvest storage quality in green bell pepper fruit[J]. Food and Bioprocess Technology, 2012,5(7): 2758-2767. DOI:10.1007/s11947-011-0614-7.
[10] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术文献出版社,1979: 2-15.
[11] 侯田莹, 王福东, 寇文丽, 等. 温度变化和1-MCP处理对青椒贮藏品质的影响[J]. 保鲜与加工, 2012, 12(5): 8-13. DOI:10.3969/j.issn.1009-6221.2012.05.002.
[12] 哈斯格根, 艾启俊, 魏月琴, 等. 中草药提取物对蔬菜两种采后病原真菌的抑菌活性研究[J]. 北京农学院学报, 2009, 24(1): 20-23.DOI:10.3969/j.issn.1002-3186.2009.01.005.
[13] 罗程印, 李高阳, 柏连阳, 等. 植物源活性成分诱导果蔬的抗病性研究[J]. 食品工业, 2016, 37(10): 237-242. DOI:10.3969/j.issn.1025-45371.2016.10.331.
[14] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 21-22.
[15] 吕明珠, 于爽, 朱恩俊. 肉桂精油对红提葡萄保鲜效果的影响[J].食品科学, 2016, 37(6): 272-277. DOI:10.7506/spkx1002-6630-201606049.
[16] 蓬桂华, 杨万荣, 苏丹, 等. 中草药处理对辣椒贮藏特性的影响[J].安徽农业科学, 2014, 42(13): 4036-4040. DOI:10.3969/j.issn.0517-6611.2014.13.098.
[17] 曾荣, 张阿珊, 陈金印. 植物源防腐剂在果蔬保鲜中应用研究进展[J]. 中国食品学报, 2011, 11(4): 161-167. DOI:10.3969/j.issn.1009-7848.2011.04.024.
[18] 赵恭文, 吴建挺, 李长松, 等. 中草药对植物病原真菌的抑菌活性筛选研究[C]//中国植物病理学会2011年学术年会论文集. 宜昌: 中国农业科学技术出版社, 2011: 10-15.
[19] 罗永兰, 张志元, 张翼. 辣椒果柄表面附生菌与贮藏期病害的关系[J]. 湖北农业科学, 2004(5): 93-95. DOI:10.3969/j.issn.0439-8114.2004.05.034.
[20] 肖晶, 陈维信, 刘爱媛, 等. 辣椒采后病害发生情况[J]. 中国蔬菜,2008(6): 13-16. DOI:10.3249/j.issn.0439-8114.2008.06.018.
[21] 张志元, 官春云. 不同栽培方式对辣椒采后病害的影响[J]. 植物病理学报, 2003, 33(2): 183-186. DOI:10.3321/j.issn:0412-0914.2003.02.018
[22] 余东坡. 中草药醇提物抑菌活性筛选及其在青椒保鲜上的应用[D].郑州: 河南农业大学, 2008: 41-48.
[23] 王博宇. 青椒采后黑斑病的诱导抗病性研究[D]. 天津: 天津科技大学, 2009: 24-29.
[24] 余辰. γ-氨基丁酸对梨果实青霉病抗性的诱导作用及相关机理研究[D].杭州: 浙江大学, 2014: 32-38.
[25] CHEN S, NUSSINOVITCH A. Galactomannans in disturbances of structured wax-hydrocolloid-based coatings of citrus fruit (easypeelers)[J]. Food Hydrocolloids, 2000, 14(6): 561-568. DOI:10.1016/s0268-005x(00)00036-9.
[26] 张美丽, 何玲, 苑希蕊, 等. 银杏叶提取液诱导采后猕猴桃对青霉病的抗性机制[J]. 食品科学, 2016, 37(6): 242-247. DOI:10.7506/spkx1002-6630-201606044.
[27] CHLEBOWSKA-SMIGIEL A, GNIEWOSZ M, SWICZAK E. An attempt to apply a pullulan and pullulan-protein coatings to prolong apples shelf-life stability[J]. Acta Scientiarum Polonorum Technologia Alimentaria, 2007, 6(1): 49-56. DOI:10.1016/b978-0-08-100596-5.21129-3.
[28] NANTAWANIT N, CHANCHAICHAOVIVAT A, PANIPAN B, et al.Induction of defense response against Colletotrichum capsici in chili fruit by the yeast Pichia guilliermondii strain R13[J]. Biological Control, 2010, 52(2): 145-152. DOI:10.1016/j.biocontrol.2009.10.011.
Plant Extracts Inhibit Postharvest Pathogens on Hot Pepper and Induces Rhizopus Resistance
易有金(1968—)(ORCID: 0000-0002-9133-0501),女,教授,博士,研究方向为微生物活性物质。E-mail: yiyoujin@163.com
夏菠(1980—)(ORCID: 0000-0002-4041-9151),男,教授,博士,研究方向为微生物活性物质。E-mail: 48176554@qq.com
胡光耀, 李滨丞, 罗程印, 等. 植物提取液对辣椒采后病原菌抑制及对根霉病抗性诱导作用[J]. 食品科学, 2019, 40(9):234-240. DOI:10.7506/spkx1002-6630-20180425-332. http://www.spkx.net.cn
HU Guangyao, LI Bincheng, LUO Chengyin, et al. Plant extracts inhibit postharvest pathogens on hot pepper and induces Rhizopus resistance[J]. Food Science, 2019, 40(9): 234-240. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180425-332. http://www.spkx.net.cn