低温肉制品是采用较低温度(68~85 ℃)进行热加工使其中心温度达到68~72 ℃并保持30 min,在严格的低温车间(0~4 ℃)中生产,低温冷链下运输、销售,最大限度地保留了肉制品原有风味的一类熟肉制品[1]。这类产品因加工温度低导致杀菌不彻底,且后续的切片工艺中可能存在二次污染,使得产品货架期短[2]。近年来,超高压杀菌在肉制品中的应用研究越来越多。超高压杀菌技术在延长肉制品货架期的同时,能最大程度保持产品原有风味、营养价值、感官品质及质构特性[3-4]。 但是韩衍青[5]研究发现,即使在经过600 MPa超高压处理的低温切片火腿中,仍然有部分细菌存活,成为制约其货架期的优势菌群,绿色魏斯氏菌(Weissella viridescens)即为其中一种。Patterson等[6]从超高压处理后的鸡肉制品中分离到的优势腐败菌主要为绿色魏斯氏菌。Diez等[7]应用变性梯度凝胶电泳技术分析了超高压处理后血肠中的微生物多样性变化,确定绿色魏斯氏菌和肠膜明串珠菌是优势耐压腐败菌。因此该菌已成为目前证实的超高压低温肉制品中的典型腐败菌。
绿色魏斯氏菌除能够耐受超高压处理外,其他不利条件如有机酸处理也无法彻底将其杀灭[8-9]。当仅使用超高压处理时,一些耐压微生物在1 000 MPa压力下仍能存活,而超高压结合一定的温度(high pressure thermal sterilization,HPTS)处理后使其很快失活[10]。
高芳[11]采用40~50 ℃结合300~500 MPa对接种绿色魏斯氏菌(106~107 CFU/g)的烟熏火腿超高压处理5~20 min,通过建立热压结合处理对耐压腐败菌的失活动力学模型,最终确定热压结合处理参数为压力350 MPa、温度50 ℃、保压时间10 min。韩衍青[5]研究了超高压处理和热处理后绿色魏斯氏菌的生理状态变化,探索了两种灭菌方法对微生物抑制机制的不同之处。高瑀珑等[12]用荧光偏振技术测定大肠杆菌细胞膜经超高压作用后荧光偏振度和微黏度的变化,研究了超高压处理对大肠杆菌细胞膜的损伤情况和超高压灭活细菌的机制。陆海霞等[13]通过3 种分光光度法测定超高压处理对细菌细胞膜通透性的影响,明确了超高压处理对细菌细胞膜损伤作用和致死机理。对于超高压致死细菌和热处理致死细菌的机理已有一定的研究,但是关于热压结合处理对绿色魏斯氏菌的致死机制的研究鲜见报道。
本研究以前人实验为基础,在高芳[11]优化出的最优热压结合处理(350 MPa、50 ℃)条件的前提下,对绿色魏斯氏菌进行超高压处理和热压结合处理,从细菌存活率、细胞形态、细胞膜通透性改变等方面探究最优的热压结合处理在致死细菌过程中发挥的作用,以期为耐压腐败菌失活模型的商业化进一步提供理论依据。
1 材料与方法
1.1 材料与试剂
绿色魏斯氏菌从低温火腿中分离,经生理生化及 16S rDNA鉴定。
平板计数琼脂、M R S 琼脂、M R S 肉汤培养基 北京陆桥生物技术有限责任公司;1,2-丙二醇(分析纯) 国药集团化学制剂有限公司。
1.2 仪器与设备
FR-400A型手压式塑料薄膜封口机 上海森和包装器材有限公司;SPF-S-1L-100-850-9-W型超高压处理 装置 英国Stansted Fluid Power公司;Scan 1200自动影像分析菌落计数器 法国Interscience公司;FP1100-C全自动细菌生长记录仪 芬兰Bioscreen公司;3000N扫描电子显微镜 日本日立公司;JEM-1011透射电子显微镜 日本JEOL公司;EM UC7超薄切片机 德国徕卡公司;M2e多功能酶标仪 德国MD公司;Accuri C6流式细 胞仪 美国BD公司。
1.3 方法
1.3.1 菌悬液的制备
挑取绿色魏斯氏菌单菌落接种于5 mL MRS肉汤中,30 ℃培养箱中培养24 h,取1 mL活化好的菌悬液接种于50 mL MRS肉汤中,30 ℃培养至稳定期。取培养好的菌悬液8 000h g、4 ℃离心5 min,弃上清液,用pH 7.0磷酸盐缓冲液(phosphate buffered saline,PBS)重复洗涤菌体3 次,调整菌悬液浓度至108~109 CFU/mL。
1.3.2 菌悬液超高压及热处理
超高压处理[14]:将装有菌悬液的包装袋置于超高压加压釜中,放入超高压仪器中,处理介质为体积分数30% 1,2-丙二醇,压力为350 MPa,处理温度为25 ℃,保压处理10 min,处理时间不包括升压和卸压所需时间,每个样品平行3 次。
热压结合处理[11]:同超高压处理步骤,设置处理温度为50 ℃。
1.3.3 复苏生长曲线的测定
吸取100 μL超高压处理及热压结合处理的菌悬液于5 mL MRS肉汤中混匀,吸取200 μL菌悬液于96 孔板内,每组3 个平行孔。将96 孔板置于全自动细菌生长记录仪中,设置温度为30 ℃,每隔2 h测一次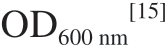 。未处理组为未经过处理的菌悬液,以MRS培养基为空白。
。未处理组为未经过处理的菌悬液,以MRS培养基为空白。
1.3.4 绿色魏斯氏菌存活率测定
将经过1.3.2节处理后的菌悬液(两重复),各无菌取样0.5 mL进行梯度稀释,选择3 个合适的稀释度,未处理样品用MRS培养基,超高压处理样品和热压结合处理后样品采用薄层平板培养基[16]。采用平板涂布法进行乳酸菌菌落总数的计数[17],检测限为1 CFU/mL。绿色魏斯氏菌数量以lg(CFU/mL)表示。存活率表示 为lg(N/N0),其中N0和N分别代表处理前和处理后的菌落数(CFU/mL)[18]。对数存活率为负值,数值越小,表示菌的失活率越高。
1.3.5 扫描电子显微镜和透射电子显微镜观察
扫描电子显微镜观察参考钱天乐[19]和莘似韵[20]等的处理方法,样品经过固定、干燥、脱水、置换、冷冻干燥后离子溅射镀金,电子显微镜观察菌体结构。透射电子显微镜观察参考高瑀珑等[21]的处理方法,上述脱水样品进行包埋、切片、染色后用透射电子显微镜观察菌体结构。设置未处理的菌悬液和经90 ℃加热10 min的菌悬液为未处理组,以对比确定实验组菌体的结构变化。
1.3.6 流式细胞术分析
荧光染色标记:染色方法参考孔晓雪等[22]对大肠杆菌的染色方法。吸取超高压处理、热压结合处理的菌悬液各1 mL,8 000h g,4 ℃离心5 min,弃上清液,用PBS重新悬浮至106 CFU/mL菌悬液,分别进行碘化丙啶(propidium iodide,PI)单染、细胞增殖示踪荧光探针(carboxyflourescein diacetate-succinimidyl ester,CFDA-SE) 单染及PI和CFDA-SE双染。每个样品重复3 次。染色在避光条件下进行,染色结束后,8 000h g、4 ℃离心5 min,用PBS洗涤2 次去除过量的染色剂,重新悬浮,放置冰上备流式细胞分析。样品从染色完成到流式细胞仪上机检测时间间隔控制在1 h之内。
流式细胞仪检测[23]:CFDA-SE绿色荧光信号采集通过(530f 30)nm的带通滤光片,在FL-1通道被收集,PI红色荧光信号采集通过(650f 13)nm的带通滤光片,在FL-3通道被收集。CFDA-SE和PI荧光信号的强度分别以荧光FL-1和FL-3表示。
1.3.7 菌体细胞内核酸和蛋白质类物质泄漏量的测定
将超高压处理和热压结合处理的菌悬液于4 ℃、6 000h g离心15 min,收集上清液,使用紫外分光光度计测定260 nm(核酸)和280 nm(蛋白质)波长处的吸光度[24],每组设置3 个平行,未处理的菌悬液为未处理组。
1.4 数据统计分析
采用SPSS 20.0软件进行数据分析处理,结果以平均值±标准差表示,采用单因素方差分析、Duncan’s多重比较检验和t检验进行差异显著性分析。
2 结果与分析
2.1 超高压处理和热压结合处理对细菌生长特性的影响
通过测量绿色魏斯氏菌热压结合处理前后的生长曲线来研究细菌的生长情况。图1中当吸光度达到最大并保持稳定时,表明菌体进入稳定期,图2的一阶导数图中当纵坐标达到最大时表明菌体生长进入对数期。由图2可看出,绿色魏斯氏菌未经处理的正常菌株从6 h开始进入对数期,在12~14 h后进入稳定期,OD600 nm为1.16;超高压处理(350 MPa、25 ℃)后菌株从10 h进入对数期,稳定期在16~18 h,此时OD600 nm为1.07;热压结合处理(350 MPa、50 ℃)后菌株从22 h进入对数期,稳定期在28~30 h,此时OD600 nm为0.94。
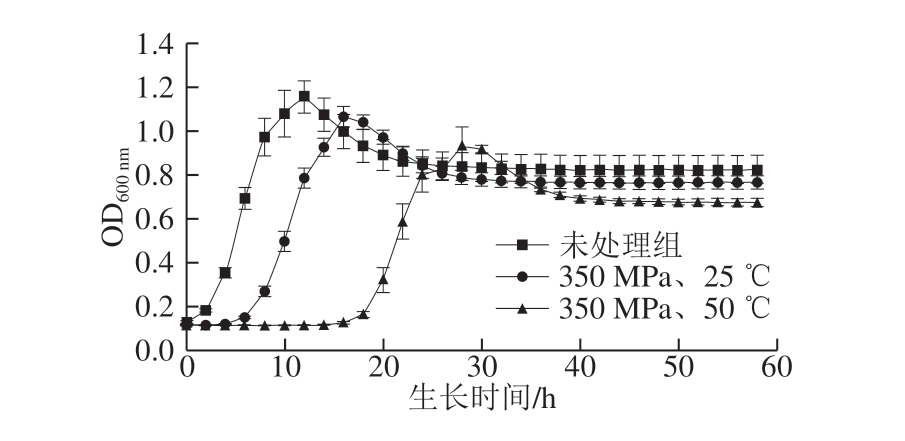
图 1 超高压和热压结合处理前后绿色魏斯氏菌的生长曲线
Fig. 1 Growth curves of W. viridescens treated or not treated by UHP or HPTS
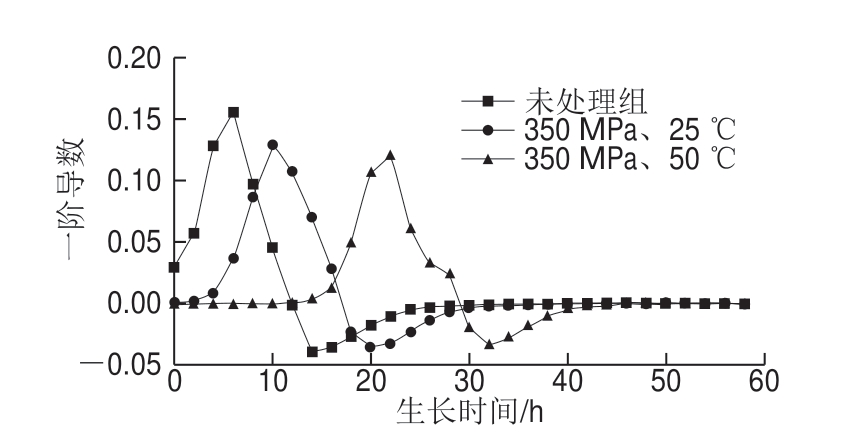
图 2 超高压和热压结合处理前后绿色魏斯氏菌生长曲线的一阶导数图
Fig. 2 First derivative of the growth curves of W. viridescens treated or not treated by UHP or HPTS
在超高压处理(350 MPa、25 ℃)和热压结合处理(350 MPa、50 ℃)后,绿色魏斯氏菌到达稳定期的时间均延后。超高压处理(350 MPa、25 ℃)后,菌种进入对数期的时间延迟4 h,且达到稳定期的时间也延后4~6 h,但是经历过这段时间的恢复后其吸光度可以达到之前的水平(P>0.05)。但热压结合(350 MPa、50 ℃)处理后绿色魏斯氏菌在前12 h内的生长速率为0,进入对数期的时间比超高压处理(350 MPa、25 ℃)延后12 h,且菌株的最大生长浓度也不能达到未处理或超高压处理时的水平(P<0.05)。结果表明,绿色魏斯氏菌可以耐受350 MPa的超高压,在后续适宜的培养环境中,菌种的生长在迟滞一段时间后可以恢复到原来的状态。但是经过热压结合处理(350 MPa、50 ℃)后,细菌的迟滞期延长,并且其生长的浓度不能恢复到原来的水平。因此,超高压协同热处理对部分的绿色魏斯氏菌造成了不可逆的损伤,即使在适宜的环境及充足的营养条件下,也不能恢复生长。
2.2 超高压处理和热压结合处理对细菌存活率的影响
表 1 绿色魏斯氏菌的存活率
Table 1 Survival rates of W. viridescens
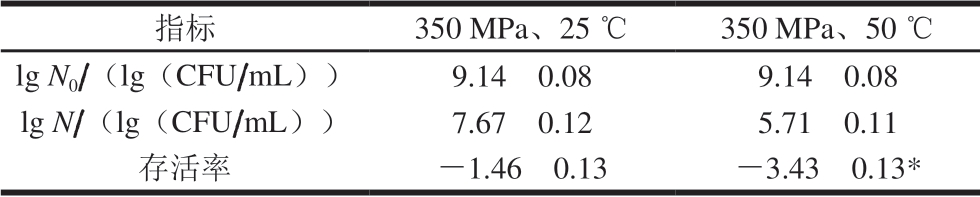
注:*.与超高压处理相比有显著性差异(P<0.05)。
指标 350 MPa、25 ℃ 350 MPa、50 ℃lg N0/(lg(CFU/mL)) 9.14f 0.08 9.14f 0.08 lg N/(lg(CFU/mL)) 7.67f 0.12 5.71f 0.11存活率 -1.46f 0.13 -3.43f 0.13*
通过测定绿色魏斯氏菌的存活率来探究热压结合处理杀菌的效果。由表1 可以看出,经热压结合处理(350 MPa、50 ℃)后菌体数量由超高压处理(350 MPa、25 ℃)时的7.67(lg(CFU/mL))显著下降到5.71(lg(CFU/mL))(P<0.05),热压结合处理(350 MPa、50 ℃)后绿色魏斯氏菌的存活率较经过超高压处理(350 MPa、25 ℃)后存活率显著下降 (P<0.05),说明热压结合处理能显著降低绿色魏斯氏菌的存活率。因此,热压结合处理使细胞处于死亡状态或亚致死状态而不可计数。
2.3 扫描电子显微镜和透射电子显微镜结果

图 3 绿色魏斯氏菌扫描电子显微镜图
Fig. 3 Scanning electron microscopic examination of W. viridescens
通过扫描电子显微镜可直观的观察细菌形态的变化。以未经任何处理和热处理(90 ℃、10 min)的绿色魏斯氏菌为未处理组,确定细菌外观的变形程度。由图3可看出,绿色魏斯氏菌未经处理组样品细胞具有典型的杆状外型,胞体表面光滑规整,菌体饱满,边缘线条流畅,未见细胞破损情况。热处理后,部分细胞表面结构破损、缺失和凹陷,少部分细胞外部结构发生严重变形。超高压处理(350 MPa、25 ℃)与未处理组外观基本相似,绝大部分菌体饱满,菌体表面有不同程度的轻微凹陷,细胞膜、壁完整,少部分菌体出现井喷现象(图3B中箭头指出),细胞膜破裂,表面有黏附物。热压结合处理(350 MPa、50 ℃)后,菌体外观和表面结构有显著变化,大部分细胞外部结构发生严重变形,表面出现褶皱,细胞边缘粗糙,无饱满感。细胞膜本身具有一定的流动性和弹性[25],但是超高压处理和热压结合处理后细菌细胞表面的凹陷并没有恢复,说明热压结合处理的协同作用会破坏细胞膜的弹性,使大部分绿色魏斯氏菌外部形态发生了显著性变化,其结构变形加剧,从而表面出现严重褶皱。

图 4 绿色魏斯氏菌透射电子显微镜图
Fig. 4 Transmission electron microscopic examination of W. viridescens
通过透射电子显微镜可直观地观察细菌内部结构的变化。由图4可看出,未处理组绿色魏斯氏菌显示菌体细胞结构完整、清晰。细胞壁边缘整齐,表面光滑,呈现较规则的杆状,菌体细胞质分布均匀。热处理后细胞发生严重变形,且细胞内的白色不透明聚集增多。超高压处理(350 MPa、25 ℃)后的绿色魏斯氏菌菌体细胞开始变形,但是能基本维持正常形状,大部分菌体细胞质均匀分布,部分细胞开始出现白色不透明聚集。经热压结合处理(350 MPa、50 ℃)的菌体细胞严重变形,大部分菌体已无正常菌体细胞的杆状,细胞壁和细胞质膜层次模糊,极少数菌体细胞质均匀分布。部分菌体细胞中心出现大面积透电子区[19](图4C中箭头指出),同时也出现了大面积的白色不透明区域,可能与细胞质蛋白变性有关,这与Moussa等[26]的研究结果相一致。说明热压结合处理使绿色魏斯氏菌的内部蛋白质变性并产生大面积的透电子区,使菌体失去正常的生理功能。
2.4 流式细胞术分析结果
2.4.1 单染分析结果
绿色魏斯氏菌经超高压处理(350 MPa、25 ℃)和热压结合处理(350 MPa、50 ℃)后流式细胞仪检测结果见图5和表2,未处理组绿色魏斯氏菌也有极少部分菌体被PI染色和不被CFDA-SE染色。热处理(95 ℃、30 min)后,绝大多数绿色魏斯氏菌均能被PI染色。由表2可知,在经过热压结合处理(350 MPa、50 ℃)之后,被PI染色的绿色魏斯氏菌数量较超高压处理(350 MPa、25 ℃)显著增加(P<0.05)。PI染色可反映菌体细胞膜完整性,CFDA-SE染色可反映胞内酯酶活性。说明热压结合处理使菌体细胞膜破坏严重,菌体受损程度加剧,死亡细胞和膜受损严重的细胞显著增加 (P<0.05)。未处理组绿色魏斯氏菌均为CFDA-SE染色阳性;热处理(95 ℃、30 min)后,80%左右绿色魏斯氏菌都为CFDA-SE染色阴性。但是绿色魏斯氏菌经超高压处理(350 MPa、25 ℃)和热压结合处理(350 MPa、50 ℃)后,细胞仍然表现为CFDA-SE染色阳性,表明绿色魏斯氏菌的胞内酯酶活性对350 MPa的超高压并不敏感,这与韩衍青[5]的研究结果一致,而且热压结合处理中的热处理也对酯酶活性无显著影响(P>0.05)。
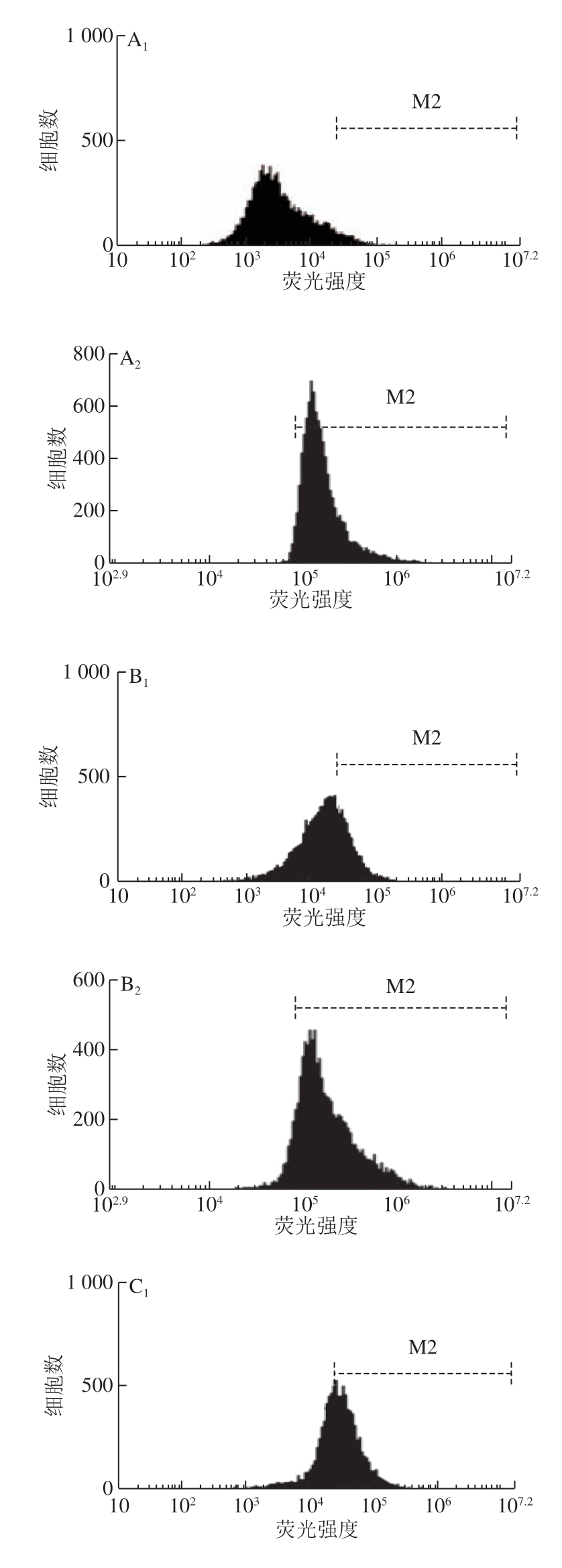
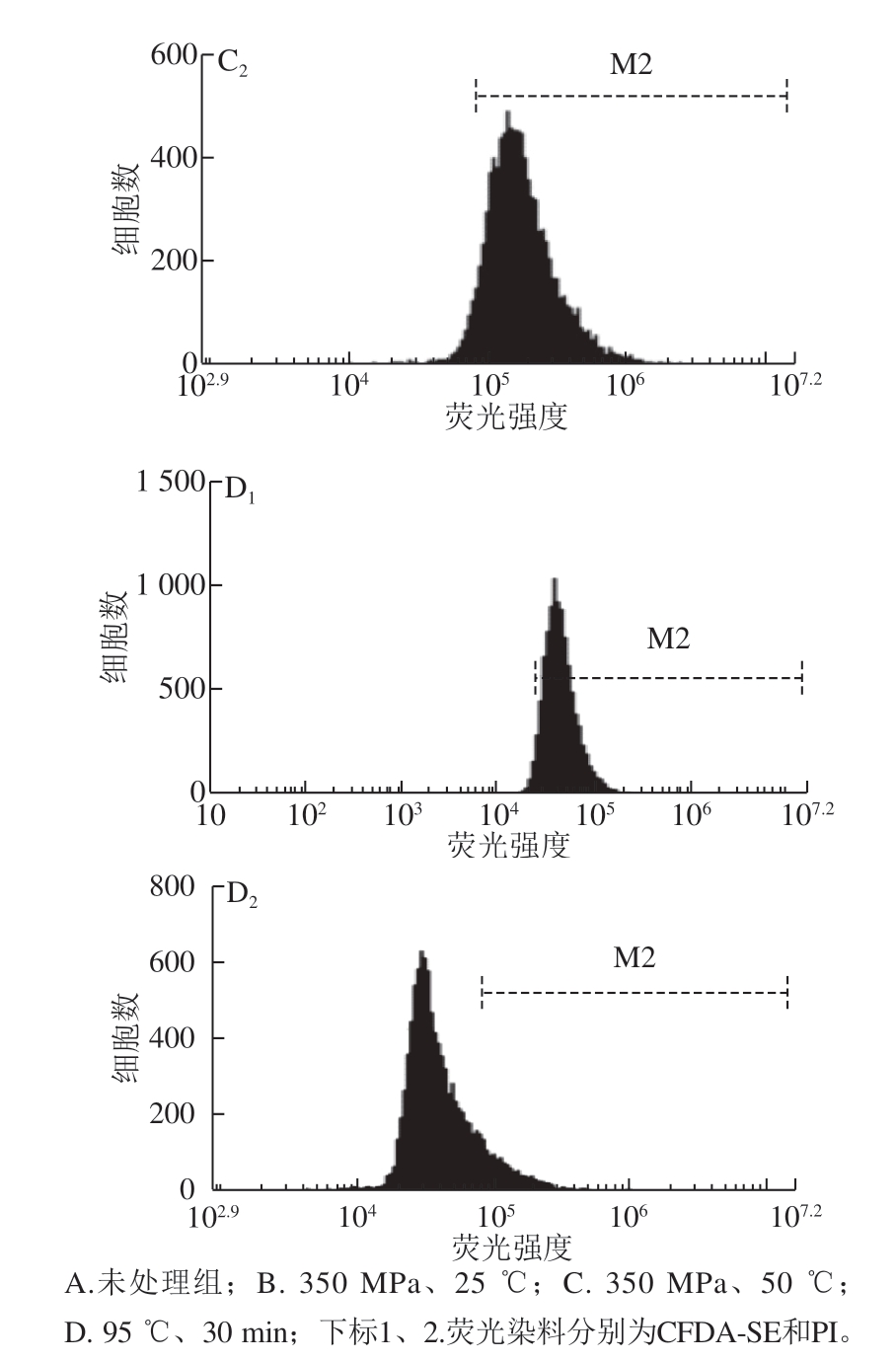
图 5 绿色魏斯氏菌经超高压处理后的CFDA-SE和PI荧光单参数直方图
Fig. 5 Fluorescence histograms of FL1 (CFDA-SE fluorescence) and FL3 (PI fluorescence) of W. viridescens cell suspensions after UHP and HPTS stained with CFDA-SE or PI
表 2 经CFDA-SE和PI荧光染色后M2区域中绿色魏斯氏菌比例
Table 2 Proportion of W. viridescens cell counts in M2 region through staining with CFDA-SE or PI
注:同列不同肩标小写字母表示差异显著(P<0.05)。表4同。
组别 M2区域中细胞比例/%PI CFDA-SE未处理组 8.40f 1.31d 96.70f 3.33a 350 MPa、25 ℃ 33.73f 5.73c 83.43f 11.63a 350 MPa、50 ℃ 55.30f 7.31b 90.37f 7.60a 95 ℃、30 min 98.23f 0.55a 22.63f 7.61b
2.4.2 多参数流式细胞双染色分析结果
采用PI和CFDA-SE双染可以通过流式细胞二维图谱获取关于菌体的生理生化信息[27-28]。各门代表的细胞生理生化状态见表3。图6和表4描述了设门分析后经PI和CFDA-SE 双染色的绿色魏斯氏菌在各门中的数量分布情况。
表 3 各门中代表的微生物生理生化状态
Table 3 Gate designation of cells stained with CFDA-SE and PI

门 染色特性 微生物物理状态LL cF-,PI- 酯酶活性丧失,完整的细胞膜或膜严重受损的细胞碎片LR cF+,PI- 酯酶活性存在,细胞膜完整UR cF+,PI+ 酯酶活性存在,细胞膜受到破坏或损伤细胞UL cF-,PI+ 酶活性丧失,细胞膜被破坏

图 6 超高压处理后绿色魏斯氏菌经CFDA-SE和PI双染设门分析的 流式细胞二维点图
Fig. 6 Flow cytometric fluorescence dot plots of W. viridescens with UHP and HPTS in response to CFDA-SE/PI stained cells
表 4 门“LR”和门“UR”中绿色魏斯氏菌的比较
Table 4 Comparison of percent cell counts in Gate “LR” and “UR” by flow cytometry

组别 细胞比例/%门“LR 门“UR 未处理组 88.60f 2.05a 9.93f 1.78c 350 MPa、25 ℃ 48.20f 11.31b 50.30f 11.87b 350 MPa、50 ℃ 22.83f 2.99c 74.70f 3.35a
如图6所示,未处理组绝大多数绿色魏斯氏菌存在于“LR”门,少部分细胞膜轻微损伤存在于“UR”门,还有极少部分细胞未被染料染色存在于“LL”门中。经过超高压处理(350 MPa、25 ℃)后,细胞膜完整的菌体减少,细胞膜受损或者细胞破碎的数量显著增多 (P<0.05),表现为门“LR”中的绿色魏斯氏菌数量逐渐向“UR”门迁移,表明在酯酶活性不改变的情况下,细胞膜破损的菌体数量增多(P<0.05)。经热压结合处理(350 MPa、50 ℃)后,“UR”门中的菌体数量比超高压处理(350 MPa、25 ℃)组显著增加(P<0.05),而且与超高压处理(350 MPa、25 ℃)相比,“UR”门中增加的菌体数量基本等于与超高压处理(350 MPa、25 ℃)相比“LR”门减少的菌数量,说明热压结合处理中的热处理不会改变绿色魏斯氏菌的酯酶活性,但是会使细胞膜损伤。
2.4.3 热压结合处理对细胞生理状态的影响
计算超高压处理(350 MPa、25 ℃)和热压处理(350 MPa、50 ℃)后绿色魏斯氏菌的正常菌数占未处理组正常菌数的比例,其中传统平板计数法的结果是指不同处理组的TAL平板计数结果与未处理组的MRS平板计数结果的比值,设定未处理组为100%;流式细胞检测法的结果是指不同处理组“LR”门菌体比例与未处理组“LR”门菌体比例的比值,同样设定未处理组为100%。
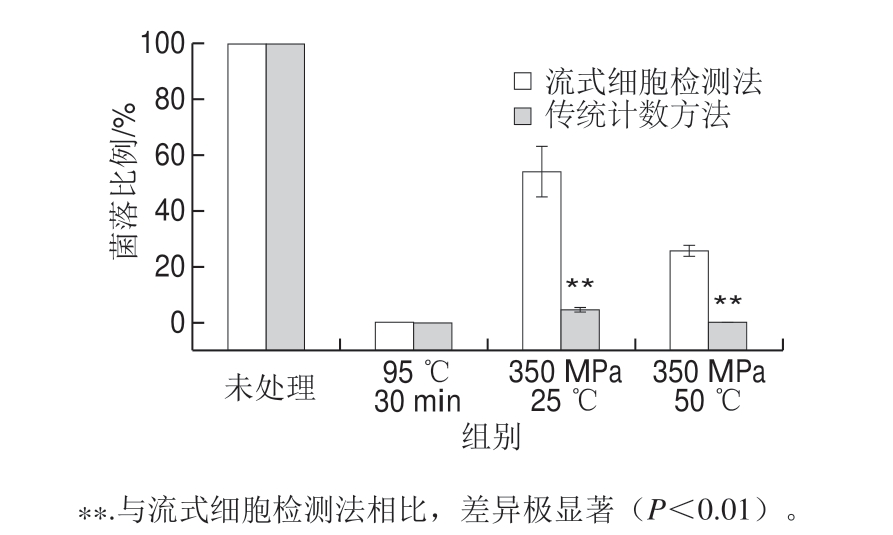
图 7 绿色魏斯氏菌流式细胞法和传统培养计数法的比较结果
Fig. 7 Viability assessment of W. viridescens using flow cytometry versus plate count method
由图7 可知, 绿色魏斯氏菌经超高压处理(350 MPa、25 ℃)和热压处理(350 MPa、50 ℃)之后,由流式细胞方法得出的计数结果均极显著高于传统计数(P<0.01)。对比超高压处理(350 MPa、25 ℃)、热压处理(350 MPa、50 ℃)后流式细胞检测方法与传统计数存活率结果的差值更小,说明温度的处理会进一步破坏细胞膜,促进PI的染色。结果表明,流式细胞方法检测到的正常菌显著高于传统平板计数法,原因是一部分处于亚致死状态的细菌细胞膜受损不严重,PI染料未能结合染色,呈现正常菌的状态,但是不能培养计数。从而进入“有活力但不可培养”状态[29]。
2.5 细胞内核酸、蛋白质类物质泄漏量的变化

图 8 不同处理绿色魏斯氏菌细胞紫外吸收物质的泄漏量
Fig. 8 Leakage of UV-absorbing substances out from W. viridescens cells with different treatments
细胞内紫外吸收物质泄漏量的变化:由于核酸中含有嘌呤、嘧啶碱基,蛋白质中含酪氨酸和色氨酸残基的苯环,这些结构都具有共轭双键(—Cü C=Cü C=C—), 所以在紫外光区有强烈的光吸收作用,核酸和蛋白质的最大吸收峰分别在260 nm和280 nm附近。因此采用最大吸收峰的强度来确定细胞内核酸和蛋白质物质的泄漏情况。
由于高温热处理使细胞膜被破坏,呈全透性,胞内核酸、蛋白物质基本完全流出,故选用90 ℃处理30 min的绿色魏斯氏菌作为阳性对照,检测膜通透性[24]。 由图8可以看出,超高压处理(350 MPa、25 ℃)后绿色魏斯氏菌上清液中核酸(260 nm)的泄漏量与未处理组相比没有显著性差异(P>0.05),说明350 MPa的超高压处理对细胞膜通透性影响不显著(P>0.05)。而当绿色魏斯氏菌经热压结合处理(350 MPa、50 ℃)后,上清液中核酸、蛋白的泄漏量与未处理组和超高压处理组(350 MPa、25 ℃)都显著增加(P<0.05),说明热压结合处理增加了细胞膜的通透性,使更多的核酸蛋白物质流出到细胞外,从而导致细菌的死亡。但经热压处理(350 MPa、50 ℃)后上清液中的泄漏程度仍与热处理(90 ℃、30 min)相比存在显著差异(P<0.05),说明热压结合处理(350 MPa、50 ℃)对细胞膜的通透性影响并未达到热处理的程度,杀灭机理与热处理的杀灭机制不完全相同[30]。结果表明,协同热处理能够增大细胞膜的通透性,使得更多的细胞内核酸、蛋白物质流出细胞外,从而导致细菌的死亡,这与周敏等[31]的研究结果一致。
3 结 论
本实验通过对细菌生长特性、形态特征、细胞膜通透性等生理指标的检测,探讨了超高压处理(350 MPa、25 ℃)和热压结合处理(350 MPa、50 ℃)对绿色魏斯氏菌细胞膜的损伤和细胞膜通透性的不同影响,明确了热压结合处理在(350 MPa、50 ℃)灭菌过程中所起的作用。
热压结合处理能显著降低绿色魏斯氏菌的存活率,并且使绿色魏斯氏菌在后续营养充足的培养条件下无法完全恢复;在形态结构变化方面,热压结合处理会使菌体表面出现严重褶皱,使细胞内白色不透明聚集增多,协助热处理引起的细胞膜损伤及内含物质变性凝固是导致微生物死亡的关键原因;在细胞膜结构方面,热压结合处理可以通过改变细胞膜的通透性显著提高受伤菌或死亡菌比例(P<0.05),通过比较流式细胞检测结果确定了温度的升高使菌体的死亡率增加,细胞膜通透性增大导致细胞内核酸、蛋白质等大分子物质流出细胞外,可能影响细胞的正常代谢。
综上所述,热压结合处理使细胞形态结构的变化、细菌细胞膜通透性增大和核酸蛋白质的流失是绿色魏斯氏菌致死致伤的重要原因,其中细胞膜通透性的改变和菌体内含物变性凝固是主要原因。
[1] BECKER A, BOULAABA A, PINGEN S, et al. Low temperature cooking of pork meat: physicochemical and sensory aspects[J]. Meat Science, 2016, 118: 82-88. DOI:10.1016/j.meatsci.2016.03.026.
[2] 徐雅梦, 姜晓冰, 于涛, 等. 真空包装低温熟牛肉中腐败菌的分离与鉴定[J]. 肉类研究, 2017, 31(8): 23-27. DOI:10.7506/rlyj1001-8123-201708005.
[3] 冯郁蔺, 孙仪, 赵颖, 等. 2 种耐压菌对盐水鸭货架期的影响[J]. 南京农业大学学报, 2014, 37(2): 127-132. DOI:10.7685/j.issn.1000-2030.2014.02.021.
[4] 孙新生, 杨凌寒. 超高压在低温肉制品中的应用[J]. 安徽农业科学, 2015, 43(9): 280-282. DOI:10.3969/j.issn.0517-6611.2015.09.097.
[5] 韩衍青. 应用超高压技术延长低温火腿的货架期[D]. 南京: 南京农业大学, 2011: 56; 78-80.
[6] PATTERSON M F, MCKAY A M, CONNOLLY M, et al. Effect of high pressure on the microbiological quality of cooked chicken during storage at normal and abuse refrigeration temperatures[J]. Food Microbiology, 2010, 27: 266-273. DOI:10.1016/j.fm.2009.10.007.
[7] DIEZ A M, URSO R, RANTSIOU K, et al. Spoilage of blood sausages morcilla de Burgos treated with high hydrostatic pressure[J]. International Journal of Food Microbiology, 2008, 123(3): 246-253. DOI:10.1016/j.ijfoodmicro.2008.02.017.
[8] BORCH E, NERBRINK E, SVENSSON P. Identification of major contamination sources during processing of emulsion sausage[J]. International Journal of Food Microbiology, 1988, 7(4): 317-330. DOI:10.1016/0168-1605(88)90058-X.
[9] HAN Yanqing, XU Xinlian, ZHOU Guanghong, et al. Effect of high pressure treatment on microbial population of sliced vacuum-packed cooked ham[J]. Meat Science, 2011, 88(4): 682-688. DOI:10.1016/j.meatsci.2011.02.029.
[10] 郭丽萍. 超高压结合热处理对猪肉蛋白质氧化、结构及特性的影响[D]. 绵阳: 西南科技大学, 2016: 2.
[11] 高芳. 热压结合处理对肉品中耐压腐败菌的失活动力学研究[D]. 北京: 中国农业大学, 2017: 53-54.
[12] 高瑀珑, 鞠兴荣, 邱伟芬, 等. 超高压对大肠杆菌细胞膜流动性的影响[J]. 中国农业科学, 2009, 42(4): 1365-1371. DOI:10.3864/j.issn.0578-1752.2009.04.029.
[13] 陆海霞, 黄小鸣, 朱军莉, 等. 超高压对单增李斯特菌细胞膜的损伤和致死机理[J]. 微生物学报, 2014, 54(7): 746-753. DOI:10.13343/j.cnki.wsxb.2014.07.004.
[14] BALASUBRAMANIAM V M, MARTÍNEZ-MONTEAGUDO S I, GUPTA R. Principles and application of high pressure-based technologies in the food industry[J]. Annual Review of Food Science & Technology, 2015, 6(1): 435-462. DOI:10.1146/annurevfood-022814-015539.
[15] 陈婵娟, 宁喜斌. 亚致死热损伤和复苏状态的副溶血性弧菌特性[J]. 食品工业科技, 2013, 34(14): 160-165.
[16] 韩衍青, 孔晓雪, 王赟, 等. 超高压处理后存活细菌培养计数方法的比较性研究[J]. 食品工业, 2014, 35(7): 174-177.
[17] 沈萍, 范秀容, 李广武. 微生物学实验[M]. 北京: 高等教育出版社, 2000: 92-94.
[18] 姚春艳, 刘美凤, 付瑞东, 等. 加压CO2对大肠杆菌细胞膜的损伤作用[J]. 微生物学通报, 2013, 40(2): 256-265.
[19] 钱天乐, 周逸卿, 邹珍友, 等. 微生物扫描电镜样品清洗方法的改进与固定干燥方法比较[J]. 安徽农业科学, 2009, 37(23): 10886-10888. DOI:10.3969/j.issn.0517-6611.2009.23.025.
[20] 莘似韵, 孙晓红, 徐忆宁, 等. 超高压对单增李斯特菌生物被膜形成的影响[J]. 上海海洋大学学报, 2017, 26(2): 294-300. DOI:10.12024/jsou.20160401731.
[21] 高瑀珑, 鞠兴荣, 邱伟芬, 等. 超高压对单核细胞增生李斯特氏菌细胞膜损伤及其氧化磷酸化的影响[J]. 中国农业科学, 2011, 44(11): 2325-2333. DOI:10.3864/j.issn.0578-1752.2011.11.015.
[22] 孔晓雪, 付勇, 姬赛赛, 等. 超高压对大肠杆菌O157:H7细胞膜的损伤效应[J]. 食品科学, 2017, 38(8): 1-5. DOI:10.7506/spkx1002-6630-201708001.
[23] 孔晓雪, 韩衍青, 付勇, 等. 流式细胞术在超高压诱导大肠杆菌O157:H7亚致死研究中的应用[J]. 食品科学, 2018, 39(3): 135-141. DOI:10.7506/spkx1002-6630-201803021.
[24] 童钰, 陆海霞, 励建荣, 等. 超高压处理对副溶血性弧菌细胞膜组成成分的影响[J]. 微生物学报, 2012, 52(10): 1244-1250.
[25] LEE K, DANILINA A V, KINUNEN M, et al. Probing the red blood cells agreeing force with option tweezers[J]. IEEE Journal of Selected Topic in Quantum Electronics, 2015, 22(3): 365-370. DOI:10.1109/JSTQE.2015.2477396.
[26] MOUSSA M, PERRIER-CORNET J M, GERVAIS P. Damage in Escherichia coli cells treated with a combination of high hydrostatic pressure and subzero temperature[J]. Applied and Environment Microbiology, 2007, 73(20): 6508-6518. DOI:10.1128/AEM.01212-07.
[27] ANANTA E, HEINZ V, KNORR D. Assessment of high pressure induced damage on Lactobacillus rhamnosus GG by flow cytometry[J]. Food Microbiology, 2004, 21(5): 567-577. DOI:10.1016/j.fm.2003.11.008.
[28] SUBRIES A, YUSTE J, CAPELLAS M. Flow cytometry immunodetection and membrane integrity assessment of Escherichia coli O157:H7 in ready-to-eat pasta salad during refrigerated storage[J]. International Journal of Food Microbiology, 2014, 168/169: 47-56. DOI:10.1016/j.ijfoodmicro.2013.10.013.
[29] 邸聪聪, 胡平, 胡章立, 等. 细菌活的非可培养(VBNC)状态及其机理研究进展[J]. 应用与环境生物学报, 2014, 20(6): 1124-1131. DOI:10.3724/SPJ.1145.2014.02029.
[30] RITZ M, FREULET M, ORANGE N, et al. Effects of high hydrostatic pressure on membrane proteins of Salmonella typhimurium[J]. International Journal of Food Microbiology, 2000, 55(1): 115-119. DOI:10.1016/S0168-1605(00)00165-3.
[31] 周敏, 陆维克, 陆金金, 等. 超高压处理对副溶血性弧菌胞内蛋白质的影响[J]. 食品科学, 2017, 38(1): 99-104. DOI:10.7506/spkx1002-6630-201701016.