乳酸菌(lactic acid bacteria,LAB)胞外多糖(exopolysaccharides,EPS)是乳酸菌在生长代谢过程中分泌到细胞壁外的一种天然高分子聚合物,具有分子质量大、黏度大、结构复杂多样等特点[1]。乳酸菌具有公认安全无毒的特性,广泛用于食品、医药、化工等领域[2]。 乳酸菌EPS具有抗炎、抗氧化、抗肿瘤、免疫调节和降血糖等功能,具有开发成益生元的潜力,还可以作为增稠剂、稳定剂等改善或增强乳制品的口感和流变学特性[3]。
根据合成位置不同,乳酸菌EPS可以分为荚膜多糖(capsular polysaccharides,CPS)和黏多糖(slime polysaccharides,SPS),但这两种多糖因为结合在一起很难区分而统称为EPS。从化学组成上,乳酸菌EPS可分为同型多糖(homopolysaccharides,HoPS)和异型多糖(heteropolysaccharides,HePS)[4]。能够产EPS的乳酸菌主要包括:链球菌属(Streptococcus)、乳杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)和明串珠菌属(Leuconostoc)等[5]。研究表明,由于菌种来源、培养条件和分离纯化方法等不同,使得EPS的分子质量、单糖组成、结构产生较大差异,进而影响EPS的功能特性。此外,由于乳酸菌EPS的产量较低,提取成本相对较高,无法满足大规模工业生产的需求。目前高产乳酸菌EPS菌种资源相对匮乏,从而限制其广泛的开发和应用。传统发酵食品被认为是分离具有特殊功能特性物质最好的来源[6]。因此,分离筛选能够稳定产生EPS的乳酸菌,并通过优化提高EPS的产量,进而分离纯化EPS,明确其理化性质和分子结构,为解析EPS结构与功能的关系及进一步开发EPS产品提供参考,具有重要的意义。本实验利用微生物学方法从自制发酵水果中分离筛选高产EPS的乳酸菌,并对EPS进行分离纯化,研究其部分理化性质,其结果不仅丰富了EPS菌株来源,还可以为EPS的功能特性研究提供理论依据。
1 材料与方法
1.1 材料与试剂
东北甜瓜购自哈尔滨南岗哈达批发市场。
质粒小量提取试剂盒、细菌基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒 TIANGAN股份有限公司;API 50 CHL鉴定试剂条 法国生物梅里埃公司。
MRS培养基(100 mL):葡萄糖2 g、酵母提取物0.5 g、牛肉膏1 g、胰蛋白胨1 g、K2HPO4 0.2 g、柠檬酸铵0.2 g、无水乙酸钠0.5 g、MnSO4g H2O 0.025 g、MgSO4g 7H2O 0.058 g、吐温-80 0.1 mL,用于乳酸菌的的活化及培养;产糖培养基(MRS-S):用蔗糖取代MRS培养基中的葡萄糖。
1.2 仪器与设备
Alpha-1900Plus紫外-可见分光光度计 上海谱元仪器有限公司;BX43生物显微镜 奥林巴斯(深圳)工业有限公司;SM20+3140B体视镜 北京泰克仪器有限公司。
1.3 方法
1.3.1 样品制备
将200 g东北甜瓜切成小块装入无菌500 mL三角瓶中,向其加入300 mL无菌水,密封,于30 ℃条件下静置5 d。
1.3.2 产EPS乳酸菌的分离
取2 mL水果发酵液,采用稀释倒平板法[7]利用涂布棒将稀释液均匀涂布于含CaCO3的MRS平板上,于30 ℃培养箱中倒置培养48 h后。挑取具有溶钙圈的单菌落接种于30 mL MRS-S液体培养基中,30 ℃静置培养36 h后,利用苯酚-硫酸法测定EPS质量浓度,筛选得到高产EPS乳酸菌。
1.3.3 高产EPS乳酸菌的鉴定
利用体视镜和显微镜观察高产EPS乳酸菌的菌落和菌体形态特征。利用API 50 CHL鉴定试剂条鉴定菌株的糖发酵特性。以模式菌株Weissella hellenica NCFB 2973(CGMCC 1.2513)为阳性对照,鉴定高产EPS乳酸菌的生理生化特性[8],如葡萄糖产酸产气实验、氧化酶实验、过氧化氢酶实验、酯酶和脲酶实验、明胶液化实验、淀粉水解实验、精氨酸水解实验。
根据细菌基因组DNA提取试剂盒说明书的方法,提取高产EPS乳酸菌基因组DNA。以DNA为模板,按照Du Renpeng等[7]的方法,利用引物5’-TAC GGY TAC CTT GTT ACG ACT T-3’和5’-AGA GTT TGA TCM TGG CTC AG-3’[9],进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR产物经质量分数1.0%琼脂糖凝胶电泳后,利用DNA纯化回收试剂盒回收目的片段并测序。测序所得的16S rDNA序列校对后,与美国国家生物信息中心(National Center for Biotechnology Information,NCBI)的GenBank数据库进行BLAST分析,根据序列同源性,选取不同的菌株,采用MEGA 5.0软件的UPGMA法构建系统发育树,确定菌株的种属关系。
1.3.4 EPS的分离及纯化
将种子液以体积分数2%的接种量接种于300 mL产糖培养基中,30 ℃静止培养48 h后,将发酵液于4 ℃、4 000h g条件下离心60 min,取上清液。根据Du Renpeng等[10]的方法,向上清液中加入3 倍体积预冷的体积分数95%乙醇溶液,4 ℃过夜沉淀后,12 000h g离心收集沉淀,之后溶于50 mL去离子中,并加入10 g/100 mL三氯乙酸(50 mL),4 ℃充分搅拌4 h后,4 ℃、12 000h g离心40 min,去除蛋白沉淀。取上清液,向其中再次加入3 倍体积预冷的体积分数95%乙醇溶液,过夜沉淀后,4 ℃、12 000h g离心40 min收集EPS沉淀,并溶于50 mL去离子中,将多糖溶液装入截留分子质量为14 000 Da的透析袋中,4 ℃透析2 d,每8 h换一次水。利用Sephadex G-100凝胶过滤层析柱对透析后的样品进一步纯化,上样后,用流速为1 mL/min的去离子水在室温下洗脱EPS,每5 mL收集一管,利用苯酚-硫酸法[11]测定EPS质量浓度,合并含EPS的试管,冷冻干燥处理24 h,得到EPS纯品。
1.3.5 总糖、蛋白质、糖醛酸质量分数的测定
总糖质量分数的测定根据苯酚-硫酸法;蛋白质量分数测定根据Bradford蛋白质染料结合法[12];糖醛酸质量分数测定根据硫酸-咔唑法[13]。
1.3.6 EPS溶解性和持水力的测定
EPS溶解度的测定参照Wang Zhaomei等[14]的方法并作适当的改动。称取45 mg EPS置于2 mL离心管中,加入0.5 mL超纯水,在漩涡振荡器上振荡2 h使EPS充分溶解。12 000h g离心40 min沉降未溶解部分,收集沉淀冷冻干燥,称质量。
多糖持水率(water holding capacity,WHC)参照Wang Ji等[15]的方法,并稍作改动。将EPS研磨成粉末置于95 ℃烘箱中烘干4 h。准确称取45 mg EPS置于2 mL离心管中,加入0.5 mL去离子水,充分溶解EPS。12 000h g离心40 min沉降未溶解部分,收集未溶解部分用滤纸小心擦掉表面水分称质量,记为m1。将沉淀冷冻干燥后称质量,记为m2。WHC根据式(1)计算。
1.3.7 EPS乳化能力测定
根据Kanamarlapudi等[16]的方法,分别取2.5 mL汽油、柴油、煤油、椰子油、橄榄油、葵花油、大豆油、苯和己烷与2.5 mL 50 mg/mL的EPS溶液振荡混匀,于4 ℃条件下静置12 h后,利用游标卡尺测定乳化层的高度,根据式(2)计算乳化率。
1.3.8 EPS抑菌能力测定
根据牛津杯实验[17],以大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella)、金黄色葡萄球菌(Staphylococcus aureus)、志贺氏菌(Shigella castellani)和铜绿假单胞杆菌(Pseudomonas aeruginosa)为指示菌,取100 μL质量浓度为50 mg/mL和100 mg/mL的EPS溶液分别加入到抑菌孔中,在最适温度下培养12 h后,利用游标卡尺量取抑菌圈直径。
1.3.9 抗氧化活性的测定
1.3.9.1 总还原力的测定
将不同质量浓度的EPS溶液1 mL与磷酸盐缓冲液2.5 mL和铁氰化钾溶液2.5 mL充分混合,50 ℃反应20 min后,随即加入三氯乙酸2.5 mL,4 000h g离心30 min。取上清液2.5 mL与FeCl3溶液0.5 mL和去离子水2.5 mL充分混匀,反应10 min后,以VC为阳性对照,测定反应混合物的OD700 nm,以OD700 nm表示总还原力[18]。
1.3.9.2 超氧阴离子自由基清除能力的测定
将不同质量浓度EPS溶液1 mL与Tris-HCl缓冲液3 mL充分混匀,25 ℃静置20 min后,加入邻苯三酚溶液0.3 mL,充分混匀,25 ℃反应5 min后,随即加入浓盐酸1 mL,混匀后,以VC为阳性对照,测定反应混合物的O 。根据公式(3)计算超氧阴离子自由基(
。根据公式(3)计算超氧阴离子自由基( )的清除能力。
)的清除能力。

式中:A0为加入邻苯三酚后的吸光度;A1为终反应吸光度;A2为只加入Tris-HCl缓冲液的吸光度。
1.3.9.3 羟自由基清除能力的测定
将不同质量浓度EPS溶液1 mL和水杨酸-乙醇溶液1 mL以及FeSO4溶液1 mL充分混匀,之后再加入H2O2溶液1 mL,37 ℃静置反应40 min后,以VC为阳性对照,测定混合物的 。根据公式(4)计算羟自由基(•OH)的清除能力。
。根据公式(4)计算羟自由基(•OH)的清除能力。
式中:A0为以水为对照的吸光度;A1为与•OH反应后的吸光度;A2为以水代替H2O2溶液的吸光度。
1.3.9.4 DPPH自由基清除能力的测定
将不同质量浓度的EPS溶液2 mL和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)-乙醇溶液2 mL充分混匀,于暗处反应30 min后,以VC为阳性对照,测定反应物的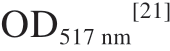 。根据公式(5)计算DPPH自由基的清除率。
。根据公式(5)计算DPPH自由基的清除率。
式中:A0为以水为对照的吸光度;A1为与DPPH自由基反应后的吸光度;A2为样品溶液的吸光度,即以水代替DPPH溶液,排除样品本身吸光度对结果的影响。
1.4 数据统计与分析
每个实验处理均设置3 个重复,数据以平均值±标准差形式表示。利用JMP(Version 9.0.2)软件进行方差分析及多重比较,统计检验的显著水平设定为0.05。
2 结果与分析
2.1 高产EPS乳酸菌的分离与鉴定
本研究从水果发酵液中共分离得到6 株利用蔗糖产生EPS的乳酸菌,其中菌株H2产EPS的质量浓度高于其他5 株菌,在发酵液中的质量浓度为(40.21f 3.63)g/L,并显著高于W. confuse KR780676 EPS(17.2 g/L)[22]。在MRS培养基上,菌株H2的菌落为乳白色、不透明、凸起、近圆形、边缘整齐、表面光滑。在MRS-S培养基上,菌落较大,表面附着大量黏性液体。显微镜下,该菌体呈串珠状、无鞭毛、不运动、不产芽孢、革兰氏染色阳性。同模式菌株W. hellenica NCFB 2973(CGMCC 1.2513)一样,菌株H2能够利用葡萄糖产酸产气,氧化酶实验、过氧化氢酶实验、酯酶和脲酶实验、精氨酸水解实验、明胶液化、淀粉水解实验均呈阴性。API 50 CHL实验结果如表1所示,通过对49 种碳水化合物的代谢情况分析,可以对细菌在种水平进行鉴定,结果表明该菌株的发酵特征与Weissella保持一致。16S rDNA序列分析表明,菌株H2部分序列长为1 436 bp,与该序列相似性较高的相关菌株均为Weissella细菌。将菌株序列与NCBI数据库进行比对,结果表明该菌株与多株W. confuse基因序列的亲缘关系最近,相似性达到99%(图1)。结合H2生物学特性和生理生化结果分析,将H2鉴定为 W. confusa,并命名为W. confusa H2。将序列提交NCBI,获得登录号为MG560152.1。
表 1 菌株H2 API 50 CHL发酵实验结果
Table 1 API 50 CHL fermentation profiles of strain H2

注:+.呈阳性。-.呈阴性。
?

图 1 利用16S rDNA序列对菌株H2进行构建系统发育树
Fig. 1 Phylogenetic tree for H2 based on 16S rDNA sequences
2.2 EPS的分离纯化及化学组成分析结果
表 2 H2 EPS纯化结果
Table 2 Purification of EPS from strain H2
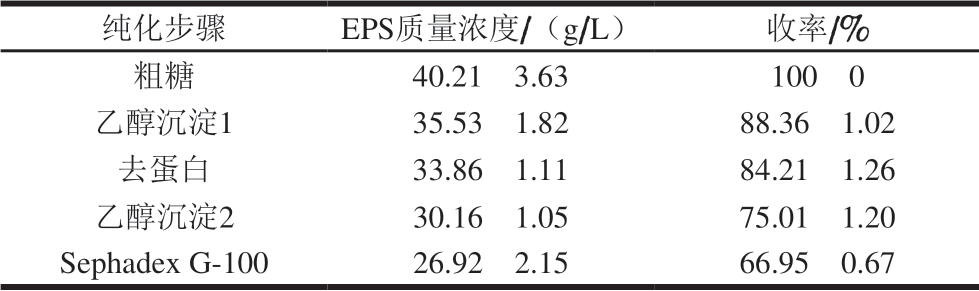
纯化步骤 EPS质量浓度/(g/L) 收率/%粗糖 40.21f 3.63 100f 0乙醇沉淀1 35.53f 1.82 88.36f 1.02去蛋白 33.86f 1.11 84.21f 1.26乙醇沉淀2 30.16f 1.05 75.01f 1.20 Sephadex G-100 26.92f 2.15 66.95f 0.67
H2发酵液经离心除菌体、三氯乙酸去蛋白、乙醇沉淀EPS等步骤后,葡聚糖凝胶Sephadex G-100层析柱对粗EPS进行纯化,得到纯EPS样品,样品洗脱图展现出单一对称峰,表明H2 EPS是一种分子质量相对均一的组分,纯度较高。如表2所示,经纯化后,H2 EPS的质量浓度为(26.92f 2.15)g/L,得率为(66.95f 0.67)%。该EPS样品在水中呈半透明黏稠状,经冷冻干燥后,呈现白色棉花状固体。
总糖、蛋白质、糖醛酸质量分数分别为(93.67f 2.08)%、 (0.32f 0.01)%和(6.01f 0.34)%。其中糖醛酸质量分数高于Leu. mesenteroides DRP105 EPS[17],蛋白质量分数低于Leu. pseudomesenteroides GX-3 EPS[23]。
2.3 EPS溶解性、持水率及乳化性
表 3 H2 EPS对油类和烃类化合物的乳化能力
Table 3 Emulsifying activity of H2 EPS with different vegetable oils and hydrocarbons

有机相 乳化率/%1 h 12 h 24 h汽油 50.92f 3.23 58.72f 3.28 59.91f 3.40柴油 42.34f 2.87 48.87f 1.87 52.76f 3.71煤油 55.38f 3.76 63.34f 2.85 69.75f 1.53椰子油 57.96f 5.00 55.45f 2.30 53.89f 2.10橄榄油 22.40f 1.83 34.71f 2.52 45.48f 3.72葵花油 61.48f 2.57 69.31f 3.24 69.64f 2.02大豆油 66.04f 2.73 69.92f 1.82 73.23f 2.40苯56.71f 0.26 63.67f 3.63 69.55f 3.24己烷 70.36f 3.21 74.27f 2.35 78.28f 1.73
H2 EPS的溶解率和持水率分别为(98.78f 1.37)%和(426.03f 7.26)%,显著高于Leu. pseudomesenteroides YF32 EPS[24]和Leu. citreum B2 EPS[25]。持水率高通常溶解度也高,较高的吸水率和持水率是由于多糖复杂的结构,以及EPS中含有大量羟基的葡萄糖单元。
乳化剂能够将两种不相溶解的液相体系在一定程度上进行分散,更好地保持两种溶剂间的稳定性,在化学、食品、医药及石油等领域有十分广泛的应用[26]。如表3所示,随着时间延长,H2 EPS对有机溶剂的乳化作用增强,在24 h时,乳化率从大到小分别为己烷>大豆油>煤油>葵花油>苯>汽油>椰子油>柴油>橄榄油,其中对己烷和大豆油的乳化率分别为(78.28f 1.73)%和(73.23f 2.40)%。此结果与Streptococcus thermophilus CC30 EPS[16]和Lactobacillus rhamnosus EPS[27]一样,均展现出良好的乳化能力。
2.4 EPS抑菌能力分析
表 4 H2 EPS的抑菌能力
Table 4 Antibacterial activity of H2 EPS

指示菌 抑菌圈直径/cm 50 mg/mL 100 mg/mL E. coli 1.04f 0.03 1.38f 0.09 Salmonella 0 0 St. aureus 0.76f 0.04 0.98f 0.02 S. castellani 0.93f 0.02 1.22f 0.03 P. aeruginosa 1.10f 0.02 1.39f 0.04
以E. coli、Salmonella、St. aureus、S. castellani和P. aeruginosa为指示菌,考察H2 EPS的抑菌活性。如表4所示,H2 EPS具有良好的抑菌活性,对指示菌的抑制能力从大到小依次为P. aeruginosa>E. coli>S. castellani> St. aureus,不能抑制Salmonella,且抑制能力随着H2 EPS质量浓度的升高而逐渐增强。Yu Youjin等[28]研究 W. cibaria 27 EPS的抑菌能力发现,该EPS同样可以有效抑制P. aeruginosa、E. coli和St. aureus。研究表明,由于来源、分子质量及结构不同,使得EPS具有不同的抑菌特性,尤其是EPS中含有的硫酸盐离子可以通过螯合作用吸附培养基中的金属离子、微量元素及营养物质,使得指示菌因营养条件匮乏而死亡[29]。因此可以看出,HD2 EPS具有良好的抑菌活性,具有开发成生物防腐剂的潜力。在接下来的研究中,应重点考察HD2 EPS的结构,探究其抑菌机理。
2.5 H2 EPS的抗氧化活性
2.5.1 总还原力

图 2 H2 EPS总还原力
Fig. 2 Reducing power of H2 EPS
如图2所示,随着质量浓度的升高,H2 EPS和VC的总还原力呈现先急速上升后稳定的趋势,但H2 EPS的总还原力始终低于VC。在质量浓度为5 mg/mL时,H2 EPS的总还原力为1.32f 0.13,显著高于Leu. mesenteroides GX-3 EPS[23]和Pediococcus pentosaceus SR2-2 EPS[30]。研究表明,具有还原力的化学物质可以提供氢原子来阻断过氧化物的形成,进而破坏自由基反应链,展现抗氧化能力[31]。
2.5.2 对 的清除作用
的清除作用

图 3 H2 EPS对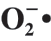 的清除作用
的清除作用
Fig. 3 Superoxide anion radical scavenging capacity of H2 EPS
由图3可知,清除率随着H2 EPS和VC质量浓度的增大,呈现先急速升高后保持平稳的变化趋势,在质量浓度为5 mg/mL时,H2 EPS和VC对 的清除率达到最大,分别为(97.34f 2.31)%和(58.46f 1.72)%。叶广彬等[23] 研究EPS对
的清除率达到最大,分别为(97.34f 2.31)%和(58.46f 1.72)%。叶广彬等[23] 研究EPS对 清除能力发现,在质量浓度为5 mg/mL 时,
清除能力发现,在质量浓度为5 mg/mL 时, 清除率大于70%,高于本研究中的EPS清除效率。
清除率大于70%,高于本研究中的EPS清除效率。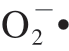 能够与大量生物活性分子发生化学反应,使得DNA、蛋白质、脂质等发生氧化损伤。因此可以看出,H2 EPS对
能够与大量生物活性分子发生化学反应,使得DNA、蛋白质、脂质等发生氧化损伤。因此可以看出,H2 EPS对 具有显著的清除活性,可以作为添加剂减小对机体的损伤程度。
具有显著的清除活性,可以作为添加剂减小对机体的损伤程度。
2.5.3 对•OH的清除作用

图 4 H2 EPS对•OH的清除作用
Fig. 4 Hydroxyl radical scavenging capacity of H2 EPS
如图4所示,清除率随质量浓度的增加呈现先升高后趋于稳定的趋势,当质量浓度为5.0 mg/mL时, H2 EPS和VC对•OH的清除率分别为(42.56f 2.16)%和(94.34f 5.67)%。Ye Guangbin等[31]研究W. cibaria YB-1 EPS的抗氧化能力发现,EPS的抗氧化能力随着质量浓度的增加而不断升高,在质量浓度4 mg/mL时,•OH清除率为80%。此外,本研究结果与崔静等[32]结果相一致,EPS6对•OH具有良好的清除作用。
2.5.4 对DPPH自由基的清除作用
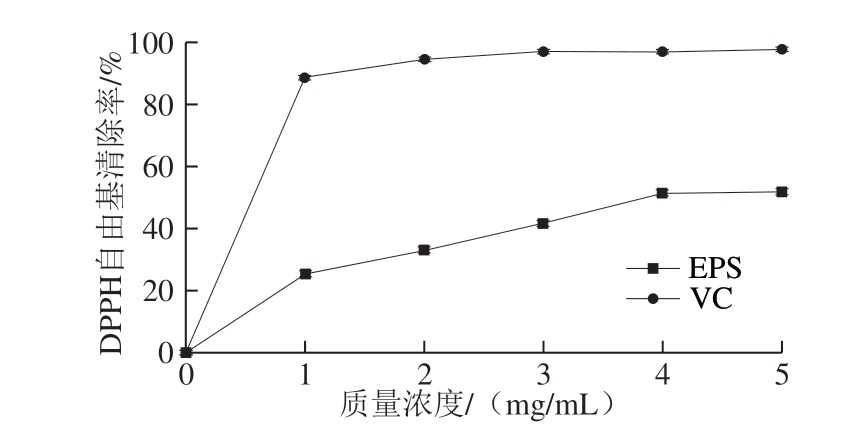
图 5 H2 EPS对DPPH自由基的清除作用
Fig. 5 1,1-Diphenyl-2-picrylhydrazyl radical scavenging capacity of H2 EPS
如图5所示,随着H2 EPS质量浓度的增加,DPPH自由基清除率逐渐增大,但始终低于VC的清除率。当质量浓度为5 mg/mL时,H2 EPS对DPPH自由基的清除率为(48.45f 2.47)%。DPPH自由基是一类较为稳定的合成自由基,可以将其清除的化学物质具有较强的自由基清除能力。Ye Guangbin等[31]研究W. cibaria YB-1 EPS的抗氧化能力,结果表明,该EPS随着质量浓度的增加,DPPH自由基清除能力逐渐升高,在5 mg/mL的时候,DPPH自由基清除率达到50%,与本研究中EPS对DPPH自由基清除率相似。
3 结 论
本实验从自制水果发酵液中分离得到一株高产EPS的乳酸菌,经形态学鉴定、生理生化实验和分子生物学实验鉴定该菌株为W. confusa,并命名为W. confusa H2。以该菌株为出发菌株,进行发酵产EPS,并分离纯化,得到高纯度EPS,其产量为(40.21f 3.63)g/L。H2 EPS的溶解率和持水率分别为(98.78f 1.37)%和(426.03f 7.26)%。此外,H2 EPS具有良好的乳化性、抑菌性能和较高的抗氧化活性,且随着质量浓度的增加而增强。因此,W. confusa H2发酵得到的EPS作为天然食品添加剂或抗氧化剂具有广阔的应用和开发前景。
[1] 牛萌萌, 王坤, 鹿保鑫. 乳酸菌胞外多糖的研究进展[J]. 黑龙江八一农垦大学学报, 2018, 30(3): 40-45; 64. DOI:10.3969/j.issn.1002-2090.2018.03.008.
[2] 邸维, 张兰威, 易华西, 等. 乳酸菌胞外多糖结构及其功能多样性的研究进展[J]. 中国乳品工业, 2017, 45(5): 32-37.
[3] 杨晨璐, 马林, 周蕊, 等. 植物乳杆菌胞外多糖的分离纯化及其抗氧化性研究[J]. 中国乳品工业, 2018, 46(5): 9-13.
[4] 黄承敏, 肖茜, 王蓉蓉, 等. 一株高产胞外多糖乳酸菌的分离鉴定及其产胞外多糖的研究[J]. 中国酿造, 2019, 38(1): 80-83. DOI:10.11882/j.issn.0254-5071.2019.01.016.
[5] 孟凡岭, 万姝含, 胡风庆. 乳酸菌胞外多糖生物活性研究进展[J]. 辽宁大学学报(自然科学版), 2018, 45(4): 379-384. DOI:10.16197/j.cnki.lnunse.2018.04.014.
[6] 杨同香, 仲玉备, 吴孔阳. 高产胞外多糖乳酸菌的筛选及其在发酵乳中的应用[J]. 食品科技, 2016, 41(2): 26-30. DOI:10.13684/j.cnki.spkj.2016.02.005.
[7] DU Renpeng, XING Hanwen, ZHOU Zhijiang, et al. Isolation, characterisation and fermentation optimisation of glucansucraseproducing Leuconostoc mesenteroides DRP105 from sauerkraut with improved preservation stability[J]. International Journal of Food Science & Technology, 2017, 52(12): 2522-2530. DOI:10.1111/ijfs.13537.
[8] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 253-298.
[9] 张书光, 张云娟, 代卫东, 等. Viili乳制品中干酪乳杆菌的分离鉴定[J]. 微生物学杂志, 2012, 32(3): 47-52.
[10] DU Renpeng, XING Hanwen, YANG Yanping, et al. Optimization, purification and structural characterization of a dextran produced by L. mesenteroides isolated from Chinese sauerkraut[J]. Carbohydrate Polymers, 2017, 174: 409-416. DOI:10.1016/j.carbpol.2017.06.084.
[11] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356.
[12] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[13] BITTER T, MUIR H M. A modified uronic acid carbazole reaction[J]. Analytical Biochemistry, 1962, 4(4): 330-334.
[14] WANG Zhaomei, CHEUNG Y C, LEUNG P H, et al. Ultrasonic treatment for improved solution properties of a high-molecular weight exopolysaccharide produced by a medicinal fungus[J]. Bioresource Technology, 2010, 101(14): 5517-5522. DOI:10.1016/j.biortech.2010.01.134.
[15] WANG Ji, ZHAO Xiao, TIAN Zheng, et al. Characterization of an exopolysaccharide produced by Lactobacillus plantarum YW11 isolated from Tibet Kefir[J]. Carbohydrate Polymers, 2015, 125: 16-25. DOI:10.1016/j.ijbiomac.2019.05.010.
[16] KANAMARLAPUDI S L R K, MUDDADA S. Characterization of exopolysaccharide produced by Streptococcus thermophilus CC30[J]. BioMed Research International, 2017, 2017: 1-11. DOI:10.1155/2017/4201809.
[17] 赵丹, 杜仁鹏, 王瑶, 等. 副干酪乳杆菌HD1.7发酵酸菜与商品酸菜代谢物比较与品质评价[J]. 食品科学, 2017, 38(10): 6-11. DOI:10.7506/spkx1002-6630-201710002.
[18] XING H W, DU R P, ZHAO F K, et al. Optimization, chain conformation and characterization of exopolysaccharide isolated from Leuconostoc mesenteroides DRP105[J]. International Journal of Biological Macromolecules, 2018, 112: 1208-1216. DOI:10.1016/j.ijbiomac.2018.02.068.
[19] CHEN Y X, LIU X Y, XIAO Z, et al. Antioxidant activities of polysaccharides obtained from Chlorella pyrenoidosa via different ethanol concentrations[J]. International Journal of Biological Macromolecules, 2016, 91: 505-509. DOI:10.1016/j.ijbiomac.2016.05.086.
[20] LIU Y, DU Y Q, WANG J H, et al. Structural analysis and antioxidant activities of polysaccharide isolated from Jinqian mushroom[J]. International Journal of Biological Macromolecules, 2014, 64: 63-68. DOI:10.1016/j.carbpol.2018.05.037.
[21] SHEN S A, CHEN D J, LI X, et al. Optimization of extraction process and antioxidant activity of polysaccharides from leaves of Paris polyphylla[J]. Carbohydrate Polymers, 2014, 104: 80-86. DOI:10.1016/j.carbpol.2014.01.006.
[22] ROSCA I, PETROVICI A R, PEPTANARIU D, et al. Biosynthesis of dextran by Weissella confusa and its in vitro functional characteristics[J]. International Journal of Biological Macromolecules, 2018, 107: 1765-1772. DOI:10.1016/j.ijbiomac.2017.10.048.
[23] 叶广彬, 陈源红, 王长丽, 等. 假肠膜明串珠菌胞外多糖的分离纯化及其抗氧化特性研究[J]. 食品研究与开发, 2019, 40(3): 31-37. DOI:10.3969/j.issn.1005-6521.2019.03.006.
[24] YANG Y F, FENG F, ZHOU Q Q, et al. Isolation, purification and characterization of exopolysaccharide produced by Leuconostoc pseudomesenteroides YF32 from soybean paste[J]. International Journal of Biological Macromolecules, 2018, 114: 529-535. DOI:10.1016/j.ijbiomac.2018.03.162.
[25] FENG F, ZHOU Q Q, YANG Y F, et al. Characterization of highly branched dextran produced by Leuconostoc citreum B-2 from pineapple fermented product[J]. International Journal of Biological Macromolecules, 2018, 113: 45-50. DOI:10.1016/j.ijbiomac.2018.02.119.
[26] YANG Y F, FENG F, ZHOU Q Q, et al. Isolation, purification, and characterization of exopolysaccharide produced by Leuconostoc citreum N21 from dried milk cake[J]. Transactions of Tianjin University, 2019, 25(2): 161-168. DOI:10.1007/s12209-018-0143-9.
[27] RAJOKA M S R, JIN M, HAOBIN Z, et al. Functional characterization and biotechnological potential of exopolysaccharide produced by Lactobacillus rhamnosus strains isolated from human breast milk[J]. LWT, 2018, 89: 638-647. DOI:10.1016/j.lwt.2017.11.034.
[28] YU Youjin, CHEN Zhiyang, CHEN Poting, et al. Production, characterization and antibacterial activity of exopolysaccharide from a newly isolated Weissella cibaria under sucrose effect[J]. Journal of Bioscience and Bioengineering, 2018, 126(6): 769-777. DOI:10.1016/j.jbiosc.2018.05.028.
[29] SKALICKA-WOŹNIAK K, SZYPOWSKI J, LOS R, et al. Evaluation of polysaccharides content in fruit bodies and their antimicrobial activity of four Ganoderma lucidum (W Curt.: Fr.) P. Karst. strains cultivated on different wood type substrates[J]. Acta Societatis Botanicorum Poloniae, 2012, 81(1): 17-21. DOI:10.5586/asbp.2012.001.
[30] 张玉龙, 胡萍, 王金龙, 等. 产胞外多糖乳酸菌的筛选及抗氧化特性研究[J]. 中国酿造, 2015, 34(10): 37-42. DOI:10.11882/j.issn.0254-5071.2015.10.009.
[31] YE Guangbin, CHEN Yuanhong, WANG Changli, et al. Purification and characterization of exopolysaccharide produced by Weissella cibaria YB-1 from pickle Chinese cabbage[J]. International Journal of Biological macromolecules, 2018, 120: 1315-1321. DOI:10.1016/j.ijbiomac.2018.09.019.
[32] 崔静, 李成, 孙晓萌, 等. 海参肠道酵母菌产胞外多糖的抗氧化性[J]. 大连工业大学学报, 2016, 35(2): 84-87.