短小芽孢杆菌(Bacillus pumilus)是导致食物腐败和食源性疾病爆发的原因之一[1-3]。Song Jianghua等[4]首次报道甜瓜的细菌性腐烂与短小芽孢杆菌密切相关。到目前为止,已从众多产品中分离得到短小芽孢杆菌,如:碱性发酵的Ntoba Mbodi[5]、乳胶乳[6]、奶粉和可可粉[7]、商业骆驼奶[8]、马铃薯[9]等。除此之外,短小芽孢杆菌还可引起蔬菜的软腐病[10];有的菌株甚至还可产生具有致病性的pumilacidin,有患者因食用未加热的大米而产生急性中毒症状,经检测该大米中含有大量的短小芽孢杆菌(105 CFU/g)[11]。因而,寻找一种新型的抗菌剂来控制短小芽孢杆菌的污染和感染是至关重要的。
近年来,具有广谱抗菌性、高效性、安全性和稳定性的天然食品添加剂受到越来越多的关注。且研究发现生物表面活性剂有较好的抑菌活性,特别是糖脂类生物表面活性剂,如鼠李糖脂[12]、脂肪酸糖脂[13-14]和槐糖脂[15]都表现出抗菌活性。
甘油糖脂是糖脂的一种,由一个或多个糖残基通过糖基键连接到含有甘油残基的脂质部分[16],是蓝细菌和植物叶绿体的类囊体膜的常见成分[17]。糖脂的主要类型是单半乳糖二酰基甘油(monogalactosyl diacylglycerol,MGDG)、二半乳糖基二酰基甘油(digalactosyl diacylglycerol,DGDG)和磺酸基二酰基甘油(sulfonic acid diacylglycerol,SQDG)[18]。 这些糖脂中的每一种都具有不同的生物活性,例如抗真菌、抗病毒、抗肿瘤、抗炎和抗菌特性[19-20]。Cateni等[21]合成了具有中长脂肪酸酰基链的单半乳糖基甘油二酯,并检测了它们对革兰氏阳性、革兰氏阴性细菌和真菌的抑菌活性,结果发现含有1,2-二取代和辛酰链结构的糖酯生物活性是最好的。Martins等[22]从Carpobrotus edulis中分离出一种单半乳糖二酰基甘油,对耐甲氧西林金黄色葡萄球菌COLOXA和金黄色葡萄球菌HPV107具有良好的抗菌活性。El Baroty等[23]研究了5 种海藻中糖脂的抗菌活性,发现所有藻类的糖脂均具有中等的抗菌活性。其中,由于Taonia atomaria中含有大量的生育三烯酸,故其糖脂对所有测试微生物均表现出较高的抑制活性。Pongmuangmul等[24]发现来自Clinacanthus nutans的MGDG和DGDG显示出抗单纯疱疹病毒活性,半抑制浓度为36~43 μg/mL。Ahamed等[25]发现来自Oscillatoria acuminata NTAPC05的棕榈酰(MGDG-棕榈酰)单半乳糖二酰基甘油显示出对3 种超广谱β-内酰胺酶(extendedspectrum β-lactamases,ESBL)产生细菌(大肠杆菌U655、嗜麦芽寡养单胞菌B929和肠杆菌B938)的杀菌活性,最小抑菌浓度(minimum inhibitory concentration,MIC)为100 μg/mL。
据了解,目前缺乏有关糖基甘油酯介导的抑制短小芽孢杆菌生物活性及作用机制的报道。在之前的研究中,合成了一系列3-O-β-D-吡喃半乳糖基-sn-甘油,并对其抗菌活性进行了初步探索。研究发现,3-O-β-D-吡 喃半乳糖基-sn-甘油的单月桂酸酯(1-O-月桂基-3-Oβ-D-吡喃半乳糖基-sn-甘油和6’-O-月桂基-3-O-β-D-吡喃半乳糖-sn-甘油的混合物)显示出良好的抗菌活性[26]。本实验旨在评价半乳糖基月桂酸单甘酯(monogalactosyl monolaurate,MGML)对短小芽孢杆菌的抗菌活性,并研究其作用机制。通过生长抑制曲线、细胞膜的通透性及完整性、DNA和蛋白的变化等指标来评价MGML对短小芽孢杆菌的影响。
1 材料与方法
1.1 菌株、材料与试剂
短小芽孢杆菌(B. pumilus)ATCC7061,保存于南京农业大学酶工程实验室。将斜面培养的菌株挑取1~2 环接种至NB培养基中,37 ℃、180 r/min下培养12 h,以2%的接种量接种至新鲜的营养肉汤(nutrient broth,NB)培养基中,37 ℃、180 r/min培养至12 h,以获取细菌悬液。NB培养基:蛋白胨10 g/L、牛肉浸膏3 g/L、氯化钠5 g/L,pH(7.2f 0.2),121 ℃灭菌20 min。
MGML是1-O-月桂基-3-O-β-D-吡喃半乳糖基-sn-甘油和6’-O-月桂基-3-O-β-D-吡喃半乳糖-sn-甘油的混合物(物质的量比为1∶1),在实验室中合成及纯化(纯 度≥98%);MGML工作溶液在甲醇中制备。
细菌基因组DNA提取试剂盒、K+和Ca2+浓度测定试剂盒 南京建成生物工程研究所;化学试剂均为分析纯,购自国药化学试剂有限公司。
1.2 仪器与设备
UV-2450紫外-可见分光光度计 日本Shimadzu公司;扫描电子显微镜 日本日立公司。
1.3 方法
1.3.1 MIC的测定
通过肉汤微量稀释法[27]测定MGML对短小芽孢杆菌的MIC。将100 μL新鲜NB培养基与系列稀释的不同质量浓度的MGML在96 孔板中混合均匀,然后加入100 μL细菌悬浮液(OD600 nm=0.5),使MGML的终质量浓度分别为5、2.5、1.25、0.625、0.313、0.156、0.078、 0.039 mg/mL。以相同体积甲醇(体积分数小于1%)作为对照。将96 孔板放置于37 ℃培养箱培养24 h,用酶标仪测定600 nm波长处的吸光度。MIC定义为在培养后未观察到可见生长的MGML的最低质量浓度。
1.3.2 MGML对短小芽孢杆菌生长曲线的影响
根据Wu Yanping等[28]的方法略作修改测定MGML对短小芽孢杆菌生长曲线的影响。取培养至对数期的短小芽孢杆菌(2 mL)和不同质量浓度的MGML溶液,加入到100 mL新鲜的NB培养基中,使MGML的终质量浓度为156.5 μg/mL和0.313 μg/mL(即0.5 MIC和1 MIC)。以相同体积的甲醇(体积分数小于1%)作为对照。置于37 ℃、180 r/min恒温摇床中培养,分别于0、2、4、6、8、10、12、14、16、18、20、22、24 h取样,测定OD600 nm。通过时间与OD600 nm的关系来绘制生长曲线。
1.3.3 MGML对细胞膜渗透性的影响
为了确定MGML对短小芽孢杆菌细胞膜渗透性的影响,测定了细胞外K+和Ca2+的浓度。向培养至对数期的短小芽孢杆菌(1h 107 CFU/mL)加入MGML(0、156.5 μg/mL和313.0 μg/mL即0、0.5 MIC和1.0 MIC),37 ℃、180 r/min培养,分别于0、30、60、120、180 min取样。以相同体积的甲醇作对照。将取出的样品于4 ℃、5 000 r/min离心5 min,收集上清液,用相应的试剂盒测定K+和Ca2+的浓度。
1.3.4 MGML对细胞膜完整性的影响
根据Zhao Lei等[29]方法进行一些修改,通过测定细胞上清液中细胞成分含量的变化来评估细胞膜的完整性。将培养至对数期的短小芽孢杆菌在4 ℃、5 000 r/min离心5 min,收集菌体并用无菌生理盐水洗涤3 次,离心后重悬于无菌生理盐水中。将细菌悬浮液与不同质量浓度的MGML溶液(156.5 μg/mL和313.0 μg/mL,即0.5 MIC和1.0 MIC)混合,并在37 ℃下孵育。以相同体积的甲醇作对照。分别于0、1、2、4、6、8、10、12、14 h后取样,取样后于4 ℃、5 000 r/min离心5 min,得到上清液,经0.22 μm的滤膜过滤。过膜后通过测定OD260 nm和OD280 nm的变化来确定细胞内核苷酸和蛋白质的泄漏。
1.3.5 扫描电子显微镜观察
向培养至对数期(1h 107 CFU/mL)的短小芽孢杆菌(B. pumilus)菌悬液中加入不同浓度的半乳糖基月桂酸单甘酯,使其终浓度为0.5、1.0 MIC,37 ℃、180 r/min分别培养2 h取样,4 ℃、2 500 r/min离心10 min,用磷酸盐缓冲液洗3 次,弃上清液,用体积分数2.5%的戊二醛溶液4 ℃过夜固定。以相同体积的甲醇作对照。用磷酸盐缓冲液冲洗3 次,依次用50%、70%、90%和100%乙醇进行梯度脱水,每次脱水时间为5~10 min。脱水结束后,用乙醇-叔丁醇溶液(1∶1,V/V)置换20 min,最后用体积分数100%叔丁醇置换2 次,每次20 min。置换后将样品进行冷冻干燥处理,干燥后的样品进行离子溅射仪喷镀后,扫描电子显微镜观察、拍照。
1.3.6 MGML对细菌基因组的影响
收集对数期的短小芽孢杆菌并用新鲜的NB培养基调节细菌细胞悬液(OD600 nm=0.5)。向菌悬液中加入不同质量浓度的MGML(156.5、313.0、939.0 μg/mL,即0.5、1.0 MIC和3.0 MIC),置于37 ℃、180 r/min恒温摇床中培养,以相同体积的甲醇作对照。分别于0、30、60、180 min取样,按细菌基因组提取试剂盒的说明提取细菌DNA。在室温下进行质量分数1%的琼脂糖凝胶电泳(125 V、30 min),电泳结束溴化乙锭(ethidium bromide,EB)染色20 min,用凝胶成像仪观察。
1.3.7 DNA结合实验
在Gao Yan等[30]的紫外光谱法和荧光光谱法的基础上进行调整,研究MGML与DNA的相互作用。
1.3.8 紫外光谱检测
收集对数期的短小芽孢杆菌用于DNA提取。检测提取的DNA,得到A260 nm/A280 nm>1.8,符合实验要求。调整DNA质量浓度(30 ng/mL)后,将不同质量浓度的MGML(0、93.9、156.5、313.0、626.0、939.0 μg/mL,即0、0.3、0.5、1.0、2.0 MIC和3.0 MIC)加入到DNA溶液中,于37 ℃反应30 min,检测混合物在200~400 nm间的紫外吸收光谱。
1.3.9 荧光光谱检测
通过荧光光谱法测定EB和DNA反应的最佳比例。固定EB的质量浓度为50 ng/μL,将不同质量浓度的DNA(44、84、94、104、114 ng/μL)与EB溶液混合,置于37 ℃反应30 min,使用荧光酶标仪检测荧光信号。设置激发波长为535 nm,扫描范围为550~800 nm。
向EB-DNA复合体系中加入不同质量浓度的MGML(0、0.3、0.5、1.0、2.0、3.0 MIC),置于37 ℃反应30 min,反应结束后在激发波长535 nm、扫描范围550~800 nm条件下测定荧光光谱。
1.3.10 蛋白电泳检测
将Zhang Yu等[31]方法加以修改,测定短小芽孢杆菌可溶性菌体蛋白条带和分子质量的变化。即在不同质量浓度的MGML(156.5、313.0、939.0 μg/mL,即0.5、1.0、3.0 MIC)处理下,将对数期的短小芽孢杆菌在37 ℃、180 r/min分别培养30、60、120 min。以相同体积的甲醇作为对照。取样后,于4 ℃、8 000 r/min离心5 min,弃去上清液,磷酸盐缓冲液清洗3 次。将菌体沉淀重悬于无菌蒸馏水中,加入20 μL蛋白上样缓冲液,沸水浴加热5 min。冷却至室温后,8 000 r/min离心10 min,取15 μL上清液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)。浓缩胶质量分数5%,分离胶质量分数12%,电泳结束后用考马斯亮蓝染色,脱色完成后进行拍照。
1.4 数据统计与分析
所有实验均做3 次生物学重复,数据表示为平均 值±标准差,SAS 8.0程序用于统计分析。
2 结果与分析
2.1 MGML对短小芽孢杆菌的MIC
甘油糖脂,一种两亲性非离子糖脂,具有抗菌和表面活性剂的特性。对枯草芽孢杆菌、大肠杆菌、白色念珠菌和黑曲霉均表现出抗菌活性,MIC范围为 60~80 μg/mL[23];而且对产生ESBL的大肠杆菌U655、嗜麦芽寡养单胞菌B929和肠炎菌肠杆菌也有很好的抑制作用,MIC为100 μg/mL[25]。由实验结果可知,MGML对短小芽孢杆菌的MIC为313 μg/mL(0.718 mmol/L),高于早期报道的抑制其他微生物的MIC[23],但低于鼠李糖脂对短小芽孢杆菌的MIC(大于1.6 mmol/L)[32]。
2.2 生长抑制曲线
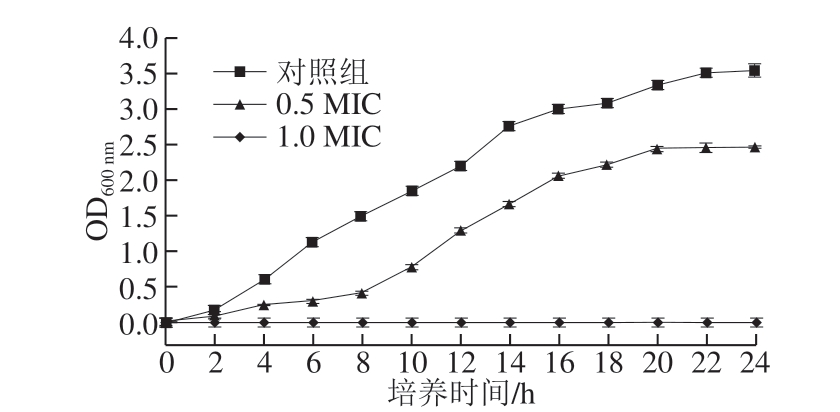
图 1 MGML对短小芽孢杆菌生长曲线的影响
Fig. 1 Effect of MGML on cell growth of B. pumilus
由图1可知,短小芽孢杆菌在2 h后开始进入对数生长期,并在16 h到达稳定期;当培养基中加入0.5 MIC MGML时,细菌生长缓慢,延滞期延长,8 h后才开始进入对数期,说明低质量浓度的MGML可能干扰短小芽孢杆菌细胞的合成代谢;而当MGML的质量浓度达到1.0 MIC时,培养基中未出现浑浊现象,无菌体生长,表明短小芽孢杆菌细胞的生长被完全抑制。该结果与鼠李糖脂对单核细胞增生李斯特菌的抑制[33]相似。此外,还可观察到MGML对短小芽孢杆菌的生长抑制作用呈现出质量浓度-时间依赖性。
2.3 细胞膜的通透性

图 2 短小芽孢杆菌细胞外K+(A)和Ca2+(B)浓度
Fig. 2 Effect of MGML on extracellular K+ (A) and Ca2+ (B) concentrations from B. pumilus cells
通过测定细胞外K+和Ca2+的含量来判断MGML对短小芽孢杆菌细胞膜的通透性是否有影响。由图2可知,与对照组相比,经MGML处理后,上清液中K+和Ca2+的浓度显著增加(P<0.05)。由图2A可知,处理组中 K+的释放量随MGML质量浓度增加和作用时间的延长呈上升的趋势;图2B表示Ca2+的释放量随作用时间变化的曲线,前30 min内Ca2+的释放量显著增加(P<0.05),30~180 min变化相对平缓。由此可知,K+和Ca2+的释放量均与MGML的质量浓度和处理时间呈正相关,证明MGML增加了短小芽孢杆菌细胞膜的渗透性,从而导致细胞内的K+和Ca2+外泄。
2.4 MGML对细胞膜完整性的影响
细胞膜是细菌的天然保护屏障。正常条件下,细胞内的大分子物质如蛋白质和核苷酸(包括DNA和RNA)不能穿透膜。但当细菌暴露于某些抗菌剂时,细胞膜的完整性将受到损害,从而导致细胞内物质释放到外部环境中,使其在260 nm和280 nm波长处的紫外吸收增加[29]。 因此,260 nm和280 nm波长处的紫外吸收可作为评估细胞膜完整性的指标。图3显示了MGML存在和不存在情况下短小芽孢杆菌细菌上清液的紫外吸收,对照组的吸光强度基本无变化;用MGML处理后,260 nm和280 nm波长处的吸光强度明显均明显增加,且随着MGML作用时间延长和质量浓度的增加,吸光值增加越明显,表明细胞内的大分子物质(核酸和蛋白质)释放量增加,细胞膜破裂程度增加。结果与来自铜绿假单胞菌OBP1的鼠李糖脂对金黄色葡萄球菌(MTCC 3160)和肺炎克雷伯菌(MTCC 618)细胞膜损伤[34]的报道一致。表明MGML可能破坏短小芽孢杆菌细胞膜的完整性。
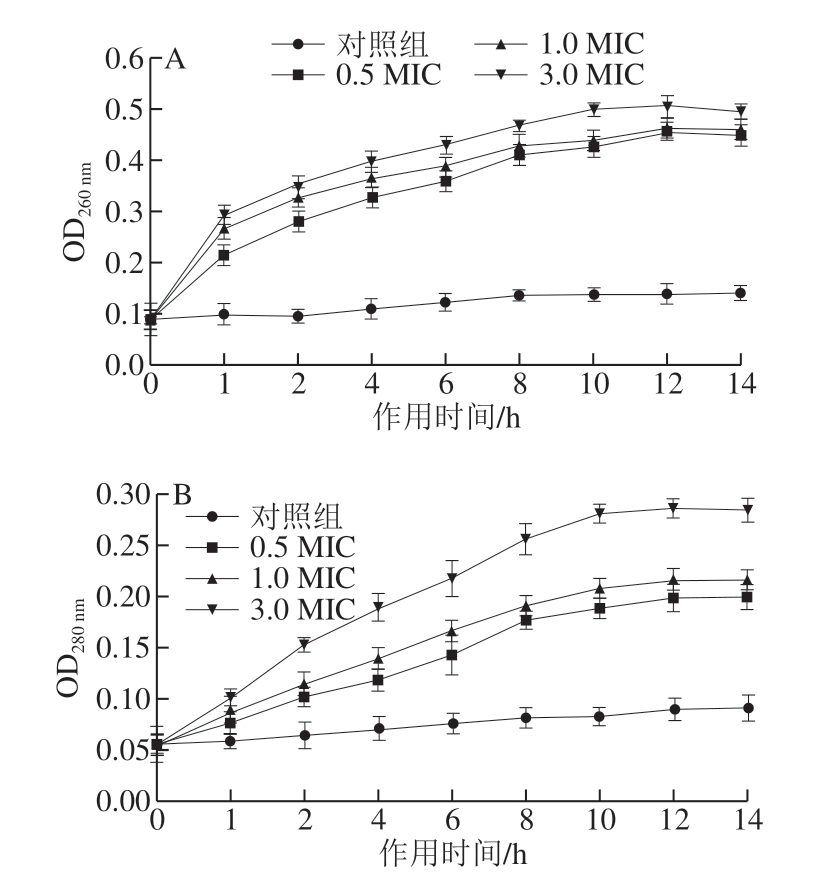
图 3 MGML作用后短小芽孢杆菌260 nm(A)和280 nm(B)波长处 紫外吸收物质的变化
Fig. 3 Effect of MGML on leakage of UV-absorbing substances at 260 nm (A) and 280 nm (B) of B. pumilus
2.5 扫描电子显微镜观察结果

图 4 MGML处理2 h后短小芽孢杆菌的扫描电子显微镜图
Fig. 4 Scanning electron micrographs of B. pumilus treated by MGML
由图4可知,对照组短小芽孢杆菌菌体呈完整状态,细胞边缘整齐、轮廓清晰,呈均匀的短杆状,菌体表面可观察到细小的颗粒状物质;经MGML作用后,菌体形态发生变化,出现褶皱,向内凹陷、轮廓变得模糊,菌体表面的颗粒状物质消失,这些颗粒状物质可能是菌体分泌的胞外多糖[35],由于MGML的加入影响了细菌胞外多糖的合成或分泌;且随质量浓度的增加,菌体出现穿孔和断裂现象,可使细胞内物质外泄,最终可导致菌体死亡。此电子显微镜结果与前面离子和大分子物质泄漏结果相一致,表明MGML作用于短小芽孢杆菌后可使其细胞膜的通透性改变。
2.6 MGML对短小芽孢杆菌基因组DNA合成的影响

图 5 MGML处理后短小芽孢杆菌基因组DNA的葡聚糖凝胶电泳图
Fig. 5 Agarose gel electrophoresis of DNA from B. pumilus treated with different concentrations of MGML
通过葡聚糖凝胶电泳观察MGML对短小芽孢杆菌基因组DNA合成的影响。如图5所示,用MGML处理不同时间后短小芽孢杆菌的基因组未出现弥散状态,表明MGML没有让基因组DNA产生断裂现象[35]。作用时间为30 min时,基因组无明显变化;但随作用时间的延长,处理组的细菌DNA条带强度变淡变窄,且随着质量浓度增加和时间的延长,效果越明显。DNA条带减弱的原因可能是MGML可以改变细胞膜的通透性使细胞内的DNA释放到细胞外,导致DNA含量降低,这与细胞成分释放的结果一致(图3);还可能是MGML进入到细胞内影响DNA的合成[36],从而导致DNA含量降低。
2.7 DNA结合实验结果
由于MGML具有透过细胞膜进入细胞内部结构的潜力,可能与DNA发生作用,因此通过紫外光谱和荧光光谱研究MGML与DNA之间的相互作用。
通常,小分子物质与DNA的非共价相互作用涉及3 种结合模式:嵌入、沟槽结合和核酸分子表面上的长矩组装[38]。紫外吸收光谱法是研究小分子物质与核酸相互作用最方便有效的方法之一。化合物结合DNA后,DNA双螺旋结构的变化和空间构型的改变可反映在光谱上。增色效应与减色效应是与DNA双螺旋结构密切相关的光谱学特性[30,39]。因此,用紫外光谱法研究MGML与DNA的相互作用。图6A显示,当DNA质量浓度一定时,随着MGML质量浓度的增加,其最大吸收峰丰度也随之增强,出现了明显的增色效应,这可能与DNA双螺旋结构的损伤有关[30]。表明MGML可能与DNA的双螺旋结构作用,影响其行使正常功能。
EB竞争性结合实验用于进一步证明MGML与短小芽孢杆菌DNA之间的相互作用。由光谱学性质可知,游离的EB和DNA在水性环境下荧光强度非常低,而当EB与DNA结合后可使荧光强度明显增大。因此,使用EB作为荧光探针研究DNA与MGML之间的相互作用。为确定DNA-EB的最佳比例,固定EB的质量浓度为 50 ng/μL,改变DNA的质量浓度(44、84、94、104、114 ng/μL)。图6B显示,随着DNA质量浓度的增加,体系的荧光强度逐渐增加,当DNA质量浓度不小于 94 ng/μL时,体系的荧光强度不再变化,即当DNA-EB质量浓度比为1.88∶1时,系统达到饱和状态。
固定DNA-EB的质量浓度比为1.88∶1,向其中加入不同质量浓度的MGML(图6C)。可观察到随着MGML质量浓度的增加发生了明显的荧光猝灭现象,且质量浓度越大,效果越明显。据报道,EB与DNA结合是典型的插嵌模型,结合常数为2h 106 L/mol[39]。因而用MGML取代EB是不可能的,所以,荧光猝灭可能是由于MGML与DNA-EB复合物的结合,并且沟槽结合可能是重要的结合模式[28]。

图 6 MGML与DNA的相互作用
Fig. 6 Interactions between MGML and DNA
2.8 SDS-PAGE分析结果
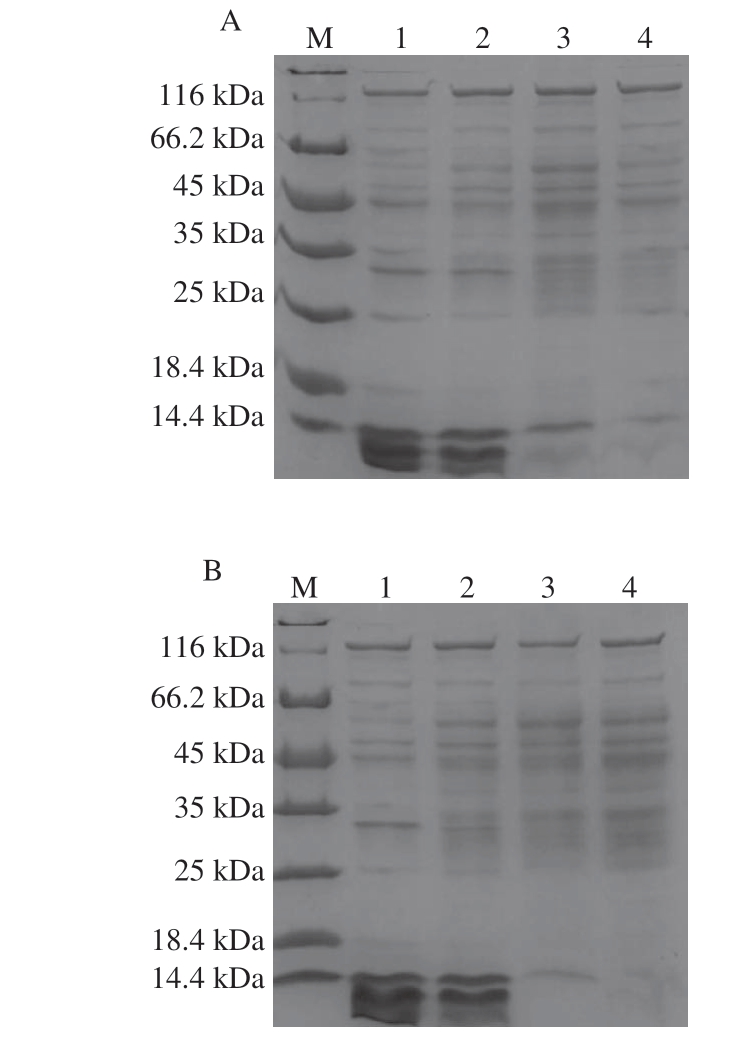
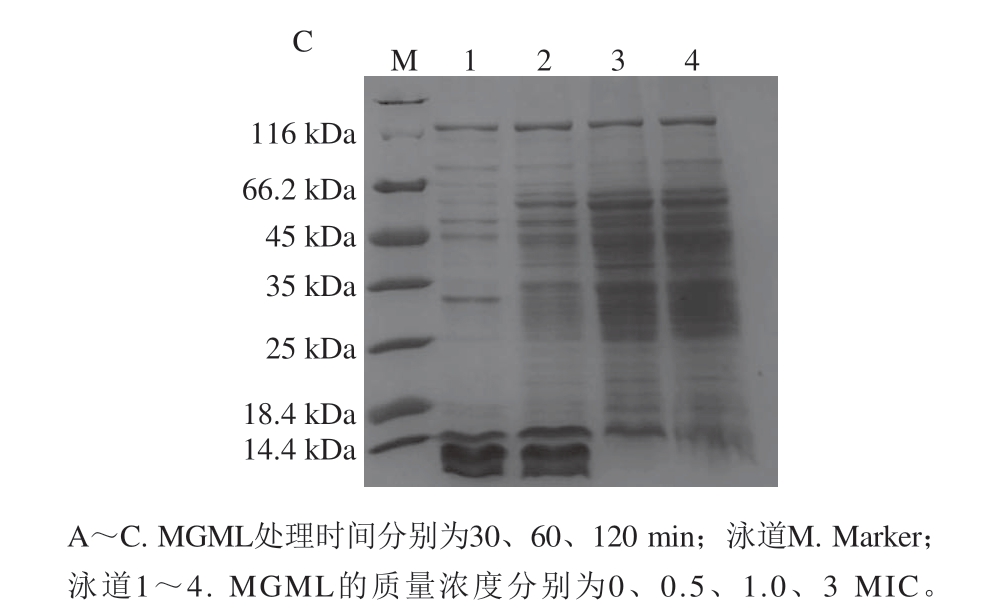
图 7 用MGML处理和未处理的短小芽孢杆菌的细胞可溶性 蛋白质的SDS-PAGE图谱
Fig. 7 SDS-PAGE profiles of cellular soluble proteins from B. pumilus treated and untreated with MGML
由图7可知,经MGML处理后的蛋白图谱与对照组的蛋白图谱明显不同。对于小分子蛋白(小于14.4 kDa),随着作用时间的延长和MGML质量浓度的增加,蛋白条带减弱甚至消失,这可能是由于细胞膜受损将小分子蛋白质泄漏到外部环境中,从而导致蛋白质含量降低,这与细胞成分释放到无细胞上清液中蛋白质含量变化结果一致(图3)。相反,随着作用时间延长和MGML质量浓度的增加,大分子蛋白(25 kDa)的条带变得更亮,可能与细胞膜受损有助于大分子蛋白的提取有关。比较处理组与对照组,当其他大分子蛋白条带灰度随着作用时间延长和MGML质量浓度增加而增强时,一条约25 kDa的蛋白条带灰度减弱,表明MGML可能还会干扰或阻断细菌某些蛋白质的合成[29]。
3 结 论
本实验通过MIC、细菌生长曲线、细胞膜完整性、扫描电子显微镜及菌体DNA和蛋白质的变化,研究了MGML对短小芽孢杆菌的抑菌机理。结果表明,MGML的MIC为0.313 mg/mL,可对短小芽孢杆菌产生较明显的抑制作用;各指标测定结合扫描电子显微镜结果表明,MGML可使细胞膜的通透性增大,破坏细胞膜的完整性,使细胞内物质外泄,影响菌体正常生长代谢,最终导致菌体死亡;DNA结合实验表明,MGML可对菌体DNA产生影响,从而影响菌体分裂繁殖,抑制细菌的生长。
这些结果表明,MIC的MGML作为抗短小芽孢杆菌菌株的抗菌剂是有效的,MGML可以作为食品工业中一种潜在的生物食品防腐剂,为其向天然、安全的方向发展提供理论参考和研究思路。
[1] CASPERS M P M, SCHUREN F H J, VAN ZUIJLEN A C M, et al. A mixed-species microarray for identification of food spoilage bacilli[J]. Food Microbiolology, 2011, 28(2): 245-251. DOI:10.1016/j.fm.2010.03.010.
[2] FERNÁNDEZ-NO I C, BÖHME K, CAAMAÑO-ANTELO S, et al. Identification of single nucleotide polymorphisms (SNPs) in the 16S rRNA gene of foodborne Bacilluls spp.[J]. Food Microbiology, 2015, 46: 239-245. DOI:10.1016/j.fm.2014.08.010.
[3] SUOMINEN I, ANDERSSON M, ANDERSSON M, et al. Toxic Bacillus pumilus from indoor air, recycled paper pulp, Norway spruce, food poisoning outbreaks and clinical samples[J]. Systematic and Applied Microbiology, 2001, 24(2): 267-276. DOI:10.1078/0723-2020-00025.
[4] SONG Jianghua, WU Zhiran, ZHANG Lixin, et al. First report of Bacillus pumilus causing fruit rot on muskmelon (Cucumis melo) in China[J]. Plant Disease, 2018, 102(2): 439-443.
[5] MBOZOA A B V, KOBAWILAA S C, ANYOGU A, et al. Investigation of the diversity and safety of the predominant Bacillus pumilus sensu lato and other Bacillus species involved in the alkaline fermentation of cassava leaves for the production of Ntoba Mbodi[J]. Food Control, 2017, 82: 154-162. DOI:10.1016/j.foodcont.2017.06.018.
[6] NIEMINEN T, RINTALUOMA N, ANDERSSON M, et al. Toxinogenic Bacillus pumilus and Bacillus licheniformis from mastitic milk[J]. Veterinary Microbiology, 2007, 124(3): 329-339. DOI:10.1016/j.vetmic.2007.05.015.
[7] PEREIRA A P M, SANT’ANA A S. Diversity and fate of spore forming bacteria in cocoa powder, milk powder, starch and sugar during processing: a review[J]. Trends in Food Science & Technology, 2018, 76: 101-118. DOI:10.1016/j.tifs.2018.04.005.
[8] ZIANE M, UVERT O, CHEVALIER P L, et al. Identification and characterization of aerobic spore forming bacteria isolated from commercial camel’s milk in south of Algeria[J]. Small Ruminant Research, 2016, 137: 59-64. DOI:10.1016/j.smallrumres.2016.03.004.
[9] EL-HEFNY M, MOHAMED A A, SALEM M Z M, et al. Chemical composition, antioxidant capacity and antibacterial activity against some potato bacterial pathogens of fruit extracts from phytolacca dioica, and ziziphus spina-christi, grown in Egypt[J]. Scientia Horticulturae, 2018, 233: 225-232. DOI:10.1016/j.scienta.2018.01.046.
[10] DADAŞOĞLU F. Effect of essential oil of Satureja hortensis against Bacillus pumilus, which cause of soft rot on some plants[C]// American Institute of Physics Conference Series. Melville: AIP Publishing LLC, 2017. DOI:10.1063/1.4981724.
[11] FROM C, HORMAZABAL V, GRANUM P E. Food poisoning associated with pumilacidin-producing Bacillus pumilus in rice[J]. International Journal of Food Microbiology, 2007, 115(3): 319-324. DOI:10.1016/j.ijfoodmicro.2006.11.005.
[12] MONNIER N, FURLAN A, BOTCAZON C, et al. Rhamnolipids from Pseudomonas aeruginosa are elicitors triggering Brassica napus protection against Botrytis cinerea without physiological disorders[J]. Frontiers in Plant Science, 2018, 9: 1170-1183.
[13] ALFINDEE MN, ZHANG Qian, SUBEDI Y P, et al. One-step synthesis of carbohydrate esters as antibacterial and antifungal agents[J]. Bioorganic & Medicine Chemistry, 2018, 26(3): 765-774. DOI:10.1016/j.bmc.2017.12.038.
[14] PERINELLI D R, LUCARINI S, FAGIOLI L, et al. Lactose oleate as new biocompatible surfactant for pharmaceutical applications[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2018, 124: 55-62. DOI:10.1016/j.ejpb.2017.12.008.
[15] OLANYA O M, ASHBY R D, NIEMIRA B A, et al. Reduction in Listeria monocytogenes, Salmonella enterica and Escherichia coli O157:H7 in vitro and on tomato by sophorolipid and sanitiser as affected by temperature and storage time[J]. International Journal of Food Science & Technology, 2018, 53(5): 1303-1315. DOI:10.1111/IJFS.13711.
[16] AL-FADHLI A, WAHIDULLA1 S, D’SOUZA L. Glycolipids from the red alga Chondria armata (Kütz.) Okamura[J]. Glycobiology, 2006, 16(10): 902-915. DOI:10.1093/glycob/cwl018.
[17] SHENG Xin, LIU Xiuying, CAO Peng, et al. Structural roles of lipid molecules in the assembly of plant PSII-LHCII supercomplex[J]. Biophysics Reports, 2018, 4: 189-203.
[18] DA COSTA E, SILVA J, MENDONÇA S H, et al. Lipidomic approaches towards deciphering glycolipids from microalgae as a reservoir of bioactive lipids[J]. Marine Drugs, 2016, 14(5): 1-27. DOI:10.3390/md14050101.
[19] PLOUGUERNÉ E, DA GAMA B A, PEREIRA R C, et al. Glycolipids from seaweeds and their potential biotechnological applications[J]. Frontiers in Cellular and Infection Microbiology, 2014, 4: 174-178. DOI:10.3389/jcimb.2014.00174.
[20] SAYANOVA O, MIMOUNI V, ULMANN L, et al. Modulation of lipid biosynthesis by stress in diatoms[J]. Philosophical Transactions of the Royal Society B Biological Sciences, 2017, 372: 20160407.
[21] CATENI F, BONIVENTO P, PROCIDA G, et al. Chemoenzymatic synthesis and antimicrobial activity evaluation of monogalactosyl diglycerides[J]. European Journal of Medicinal Chemistry, 2008, 43(1): 210-221. DOI:10.1016/j.ejmech.2007.03012.
[22] MARTINS A, VASAS A, VIVEIROS M, et al. Antibacterial properties of compounds isolated from Carpobrotus edulis[J]. International Journal of Antimicrobial Agents, 2011, 37(5): 438-444. DOI:10.1016/j.ijantimicag.2011.01.016.
[23] EL BAROTY G S, EL-BAZ F K, ABDELMOEIN A, et al. Evaluation of glycolipids of some Egyptian marine algae as a source of bioactive substances[J]. International Research Journal of Pharmacy, 2011, 2(3): 2114-2128.
[24] PONGMUANGMUL S, PHUMIAMORN S, SANGUANSERMSRI P, et al. Anti-herpes simplex virus antivities of monogalactosyl diglyceride and digalactosyl diglyceride from Clinacanthus nutans, a traditional Thai herbal medicine[J]. Asian Pacific Journal of Tropical Biomedicine, 2016, 6(3): 192-197. DOI:10.1016/j.apjtb.2015.12.014.
[25] AHAMED A A P, RASHEED M U, NOORANI K P M, et al. In vitro antibacterial activity of MGDG-palmitoyl from Oscillatoria acuminata NTAPC05 against extended-spectrum β-lactamase producers[J]. Journal of Antibiotics, 2017, 70(6): 754-762. DOI:10.1038/ja.2017.40.
[26] 齐丹萍. 半乳糖基甘油酯酶促合成及抗生物活性的评价[D]. 南京: 南京农业大学, 2015: 69-80.
[27] KANG D H, SIRAGUSA G R. A rapid twofold dilution method for microbial enumeration and resuscitation of uninjured and sublethally injured bacteria[J]. Letters in Applied Microbiology, 2001, 33(3): 232-236. DOI:10.1046/j.1472-765x.2001.00988.x.
[28] WU Yanping, BAI Jinrong, ZHONG Kai, et al. A dual antibacterial mechanism involved in membrane disruption and DNA binding of 2R, 3R-dihydromyricetin from pine needles of Cedrus deodara, against Staphylococcus aureus[J]. Food Chemistry, 2017, 218: 463-470. DOI:10.1016/j.foodchem.2016.07.090.
[29] ZHAO Lei, ZHANG Heyan, HAO Tianyang, et al. In vitro antibacterial activities and mechanism of sugar fatty acid esters against five food-related bacteria[J]. Food Chemistry, 2015, 187: 370-377. DOI:10.1016/j.foodchem.2015.04.108.
[30] GAO Yan, LI Junsheng, HUANG Gaoxia, et al. Spectroscopic studies on the interaction between anthragallol and DNA using of ethidium bromide as a fluorescence probe[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2015, 141: 239-243. DOI:10.1016/j.saa.2015.01.049.
[31] ZHANG Yu, WU Yuting, ZHENG Wei, et al. The antibacterial activity and antibacterial mechanism of a polysaccharide from Cordyceps cicadae[J]. Journal of Functional Foods, 2017, 38: 273-279. DOI:10.1016/j.jff.2017.09.047.
[32] DUSANE D H, VENKATANANCHARAIAH Y, ZINJARDE S S, et al. Rhamnolipid mediated disruption of marine Bacillus pumilus biofilms[J]. Colloids anad Surfaces B: Biointerfaces, 2010, 81(1): 242-248. DOI:10.1016/j.colsurfb.2010.07.013.
[33] LUANA M, MARCIA N. Antimicrobial activity of rhamnolipids against Listeria monocytogenes and their synergistic interaction with nisin[J]. Food Control, 2013, 29(1): 138-142. DOI:10.1016/j.foodcont.2012.06.009.
[34] BHARALI P, SAIKIA J P, RAY A, et al. Rhamnolipid (RL) from Pseudomonas aeruginosa OBP1: a novel chemotaxis and antibacterial agent[J]. Colloids and Surfaces B: Biointerfaces, 2013, 103: 502-509. DOI:10.1016/j.colsurfb.2012.10.064.
[35] 王松柏. 海洋细菌Bacillus pumilus PLM4抗肿瘤胞外多糖的初步 研究[D]. 南宁: 广西大学, 2005: 45-56.
[36] 郝刚, 施用晖, 唐亚丽, 等. 抗菌肽BuforinII衍生物与大肠杆菌基因组DNA的作用机制[J]. 微生物学报, 2010, 50(3): 328-333.
[37] WANG Li, YUAN Qing, CHEN Sunhong, et al. Antimicrobial activity and molecular mechanism of the CRES protein[J]. PLoS ONE, 2012, 7(11): e48368-e48368. DOI:10.1371/journal.pone.0048368.
[38] ZHANG Yuetian, FENG Ruizhang, LI Lixia, et al. The Antibacterial mechanism of terpinen-4-ol against Streptococcus agalactiae[J]. Current Microbiology, 2018, 75(9): 1214-1220. DOI:10.1007/s00284-018-1512-2.
[39] YOLA M L, OZALTM N. Electrochemical studies on the interaction of an antibacterial drug nitrofurantoin with DNA[J]. Journal of Electroanalytical Chemistry, 2011, 653: 56-60. DOI:10.1016/j.jelechem.2011.01.03.
[40] ZHANG Guowen, HU Xing, FU Peng. Spectroscopic studies on the interaction between carbaryl and calf thymus DNA with the use of ethidium bromide as a fluorescence probe[J]. Journal of Photochemidtry and Photobiology B: Biology, 2012, 108: 53-61. DOI:10.1016/j.jphotobio.2011.12.011.