西兰花(Brassica oleracea var. italica)是十字花科芸薹属甘蓝种的一个变种,含有多种有益化合物,例如硫代葡萄糖苷(简称为硫苷)、蛋白质和VC等[1]。硫苷是十字花科蔬菜中一种重要的次生代谢物质。西兰花中主要的硫苷有萝卜硫苷(glucoraphanin,GRA)、屈曲花苷、3-吲哚基甲基硫苷和1-甲氧基吲哚基-3-甲基硫苷[2-4],其中GRA占西兰花中总硫苷含量的50%以上[5-6]。GRA本身并无生物活性[7],当植物受到机械损伤或被食用时,GRA与内源芥子酶(myrosinase,MYR)发生酶解反应生成一系列产物,包含异硫氰酸盐(isothiocyanates,ITC)、硫氰酸盐和腈[8-10]。GRA的酶解产物萝卜硫素(sulforaphane,SFN)被认为是最有效的天然抗癌化合物之一[11],研究表明SFN能够抑制体内I相致癌酶的产生,诱导产生II相解毒酶,如谷胱甘肽硫转移酶、苯醌氧化还原酶和血红素氧化酶I等,并增强其活性和竞争性,抑制CYP2EI化学致癌基因的表达,从而保护DNA、RNA、蛋白质等体内大分子不受损伤[12-15]。
日常生活中,大多数蔬菜在食用前一般都会经过烹饪加工,研究发现烹饪不仅会引起蔬菜中化学成分的显著变化,而且会影响化学预防化合物的生物利用度和含量[1]。一些研究表明选择适当的烹饪方法可以增强化合物的可用性,从而改善健康状况。Rungapamestry等[16]研究发现食用微波加热2 min的西兰花后,人体对SFN的吸收提高了大约3 倍。Tabart等[17]用不同烹饪方式处理西兰花,微波烹饪的第1分钟SFN含量增加了4~6 倍,第5分钟SFN含量增加了1.7 倍。目前,大多数家庭主要采取蒸、煮、炒和微波的烹饪方式加工蔬菜。许多研究表明,煮、炒和微波这3 种烹饪方式会造成西兰花中硫苷和ITC的大量损失[18-20];相比之下,蒸制对其造成的损失最小,因此很多学者认为蒸制是较好的选择。然而这4 种烹饪方式都会对西兰花中的内源MYR活性造成不可逆的损失和抑制,导致GRA-SFN转化和人体对SFN的吸收降低。为了增加人体对SFN的吸收,可以考虑在食用过程中添加外源MYR来提高GRA-SFN的转化率。本实验主要研究了4 种常用的家庭烹饪方式(蒸、煮、炒和微波)及烹饪时间对西兰花中GRA和SFN含量的影响,以及添加外源MYR对西兰花中GRA-SFN转化率的影响,以期为人们选择适宜的烹饪方法、提高西兰花有益化合物的获取量提供理论参考。
1 材料与方法
1.1 材料与试剂
以兰州桃海市场购买的新鲜‘瑞农’西兰花为实验材料,用蒸馏水冲洗干净,晾干后置于4 ℃冰箱待用。
甲醇(色谱纯)、乙酸乙酯、体积分数95%乙醇溶液、四甲基溴化铵、磷酸二氢钾、磷酸氢二钾、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、丙三醇、硫酸铵、抗坏血酸、二硫苏糖醇、聚乙二醇6000 甘肃中瑞化工有限公司;黑芥子硫苷酸钾、GRA、SFN标准品 美国Sigma公司。
1.2 仪器与设备
多功能电热锅 山东淄博周村楠北电器厂;RE-52型旋转蒸发仪 上海亚荣生化仪器厂;DS-8510DTH型超声波振荡仪 上海生析超声仪器有限公司;雷磁DDSJ-308F电导率仪 上海仪电科学仪器股份有限公司; DW-86L390低温保存箱 青岛澳柯玛股份有限公司; BCD-642WDVMU1冰箱 青岛海尔股份有限公司; CTO-15C高效液相色谱(high performance liquid chromatography,HPLC)仪 日本岛津公司。
1.3 方法
1.3.1 烹饪方法
本实验采用了蒸、煮、炒和微波4 种烹饪方法,实验样品处理方法如下,所有处理均重复3 次。
蒸:准确称取西兰花5 g,称取6 份,按料液比1∶100在蒸锅内加入3 000 mL蒸馏水,800 W下加热至沸腾后,将称好的西兰花放置在蒸盘上分别蒸制0、1、2、4、6、8 min,处理完成后室温下冷却,吸液纸吸干表面的水后液氮速冻,置于低温冰箱(-70 ℃)待用。
煮:准确称取西兰花5 g,称取6 份,按料液比1∶100在蒸锅内加入3 000 mL蒸馏水,800 W下加热至沸腾后,将称好的西兰花放置在蒸锅内分别煮制0、1、2、4、6、8 min,处理完成后室温下冷却,吸液纸吸干表面的水后液氮速冻,置于低温冰箱(-70 ℃)待用。
炒:准确称取西兰花5 g,称取6 份,在蒸锅内加入10 mL菜籽油,油热后将西兰花倒入锅内进行翻炒。分别炒制0、1、2、4、6、8 min后室温下冷却,吸油纸吸干材料表面的油后液氮速冻,置于低温冰箱(-70 ℃)待用。
微波:准确称取西兰花5 g,称取6 份,将称好的西兰花放置在微波炉内,在700 W(中火)下分别加热0、1、2、4、6、8 min,处理完成后室温下冷却,液氮速冻,置于低温冰箱(-70 ℃)待用。
1.3.2 GRA提取及检测
1.3.2.1 GRA标准曲线的绘制
20 mg纯度为99%的GRA标准品溶解于20 mL去离子水中,质量浓度为1 mg/mL,配制5、20、40、80、120、160、200 μg/mL梯度溶液,建立GRA标准曲线及回归方程Y=5 975.6X-6 995.9(R2=0.999),式中,X为GRA质量浓度,Y为峰面积。
1.3.2.2 GRA的提取
参考叶珊珊[21]的方法并略作改进。取1.3.1节制备的样品5 g,以料液比1∶4加入20 mL 80%(体积分数,下同)乙醇溶液,80 ℃下水浴20 min。过滤并收集滤液,将样品研磨成糊状,按料液比1∶12加入60 mL 80%乙醇溶液,80 ℃下水浴20 min,超声处理15 min,过滤并收集滤液,重复两次。合并滤液,55 ℃旋转蒸发浓缩至膏状。用甲醇溶解并定容至10 mL。
1.3.2.3 HPLC法测定GRA含量
利用HPLC仪检测GRA含量,采用Hypersil BDS C18柱(250 mmh 4.6 mm,5 μm);流动相为甲醇-水(体积比4∶96,含质量分数0.1%四甲基溴化铵);流速 0.8 mL/min;柱温35 ℃;检测波长226 nm;进样量20 μL。测得峰面积代入1.3.2.1节回归方程计算GRA含量。
1.3.3 SFN的提取及检测
1.3.3.1 SFN的提取
参考胡翠珍等[22]的方法。黄芥子粉碎,过筛。称取5 g芥子粉按料液比1∶20加入蒸馏水100 mL,25 ℃超声振荡30 min后,抽滤除杂得粗MYR液,其中MYR活性为0.7 U/g(干质量)。取1.3.1节制备的样品5 g,以料液比1∶5加入25 mL MYR液(以相同体积蒸馏水作为对照),37 ℃水浴60 min后以料液比1∶20加入100 mL 95%乙醇溶液,超声处理30 min,过滤。收集滤液,65 ℃旋转蒸发至液体完全蒸干,10 mL蒸馏水冲洗蒸馏瓶,以体积比1∶3加入30 mL乙酸乙酯,萃取两次,合并乙酸乙酯相,50 ℃旋转蒸发溶液至膏状,用甲醇溶解并定容至10 mL。
1.3.3.2 SFN标准曲线的制作
20 mg纯度为99%的SFN标准品溶解于20 mL去离子水中,质量浓度为1 mg/mL,配制5、20、60、120、180、250 μg/mL梯度溶液,建立SFN标准曲线及回归方程Y=3h 10-5X-0.510 4(R2=0.999),式中,X为峰面积,Y为SFN质量浓度。
1.3.3.3 HPLC法测定SFN含量
利用HPLC仪检测SFN含量,采用WondaSil C18柱(150 mmh 4.6 mm,5 μm),有机相为甲醇,水相为超纯水,二元高压洗脱程序为:0.01 min 35%甲醇,12 min 35%甲醇,20 min 100%甲醇,25 min 35%甲醇;流速0.8 mL/min;柱温35 ℃;检测波长201 nm;进样量20 μL。将测得峰面积代入1.3.3.2节回归方程计算SFN含量。
1.3.4 西兰花中MYR的提取与测定
1.3.4.1 材料处理方法
准确称取西兰花2 g,称取6 份,按1.3.1节步骤分别制备蒸、煮、炒和微波制样品。所有处理均重复3 次。
1.3.4.2 MYR的提取及活性的测定
参考丁艳等[23]的方法提取MYR并测定活性,略作改进。取1.3.4.1节制备的样品2 g,加入20 mL 10 mmol/L 磷酸钾缓冲液(其中添加1 mmol/L EDTA、3 mmol/L二硫苏糖醇、质量分数5%甘油,pH 7.2),冰浴研磨,4 层纱布过滤除滤渣,滤液在4 ℃下12 000 r/min离心15 min,取上清液,加入固体硫酸铵使上清液饱和度达到55%,4 ℃放置30 min,12 000 r/min冷冻离心15 min,使MYR聚集,取沉淀溶于4 mL去离子水中,并用去离子水透析4 ℃过夜,透析袋取出后表面擦干,放入盛有质量分数10%聚乙二醇溶液的烧杯内,4 ℃放置0.5 h,得到MYR提取浓缩液。在试管中加入1.50 mL磷酸钾缓冲液(pH 6.5)、500 μL抗坏血酸溶液(1 mmol/L)、50 μL黑芥子硫苷酸钾溶液(25.18 mmol/L)和20 μL MYR提取液,分别在37 ℃条件下保温,混合平衡1 min。置于1 cm光路石英比色皿中,37 ℃反应30 min,测定227 nm波长处吸光度,按公式(1)计算酶活力。在pH 6.5、37 ℃条件下,以每分钟催化1 μmol黑芥子硫苷酸钾所需要的酶量为一个酶活力单位(U)。
式中:n为反应时间内MYR降解黑芥子硫苷酸钾的物质的量/μmol;t为反应时间/min;VE为酶液体 积/mL;VEX为提取液体积/mL;m为样品质量/g。
1.3.5 细胞膜透性测定
细胞膜透性测定参考林毅雄等[24]的方法。取1.3.4节中冷冻前蒸、炒和微波处理的样品2 g,置于25 mL试管内,加入20 mL去离子水,让样品完全浸在水中,将试管放置在干燥器用内真空泵抽真空30 min,电导率仪测定电导率R1,然后将试管沸水浴加热15 min,取出冷却至室温后测定电导率R2,相对电导率用公式(2)计算。
煮制样品电导率的测定:取1.3.4节冷冻前的煮制样品2 g,放置在加入20 mL去离子水的试管内,封口膜封口后放入蒸锅内分别加热0、1、2、4、6、8 min,取出试管室温下冷却,测定相对电导率。
以上处理均重复3 次。
1.4 数据统计与分析
用Excel 2010软件对实验数据进行整理并绘图,用SPSS 19.0软件对数据进行方差分析,并进行Duncan’s差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 不同烹饪方式下烹饪时间对西兰花中GRA含量的影响
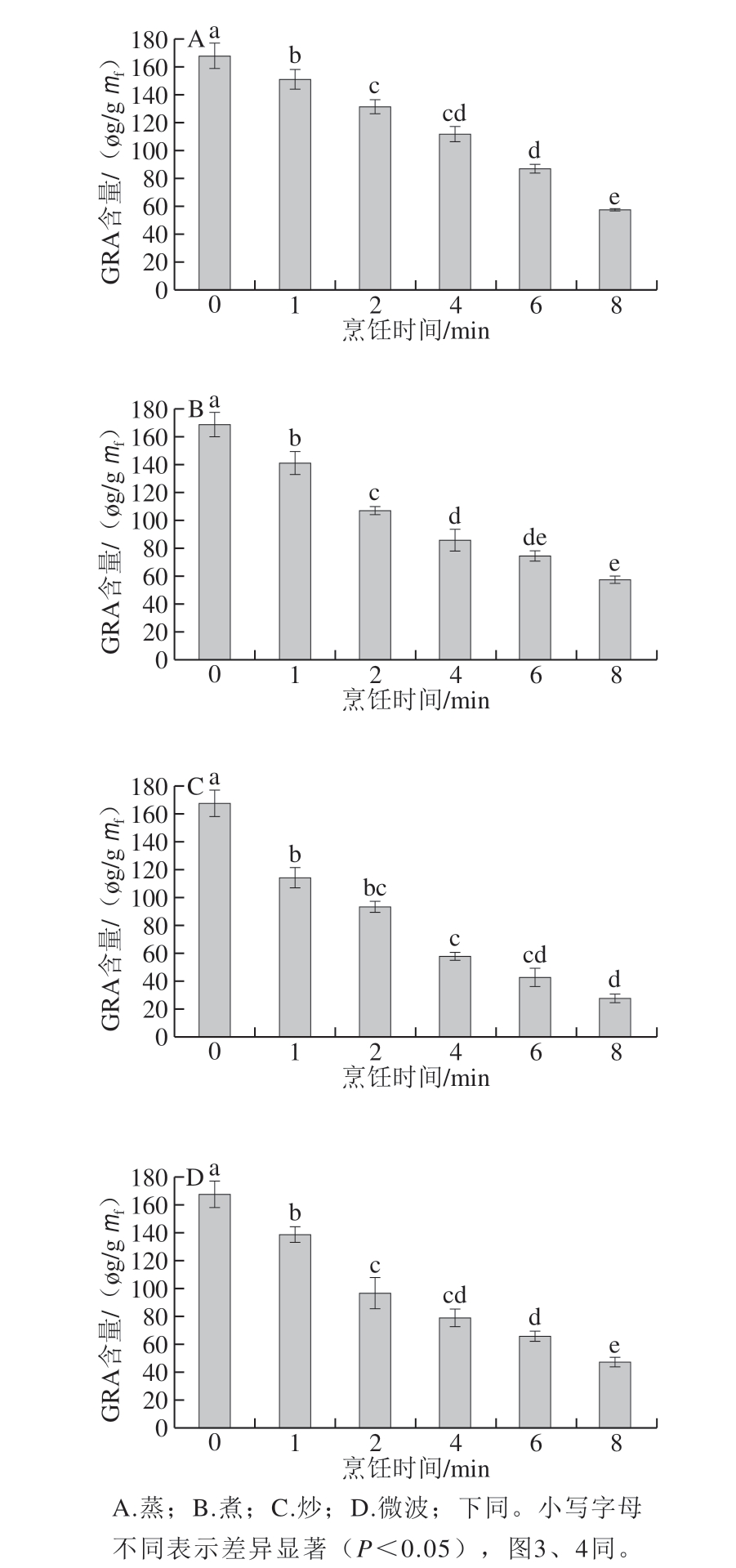
图 1 不同烹饪方式下烹饪时间对西兰花中GRA含量的影响
Fig. 1 Effect of cooking time on GRA content in broccoli cooked by different methods
GRA是SFN的前体物质,烹饪过程中GRA的损失会影响SFN的获取量。4 种烹饪方式下,烹饪时间对西兰花内源GRA含量的影响如图1所示。未处理的西兰花GRA含量(168.14 μg/g)最高,随着烹饪时间的延长西兰花内源GRA含量呈下降趋势,各处理组差异明显。由图1可知,与0 min相比,2 min蒸制、煮制、炒制和微波处理使GRA含量分别减少了35.93、61.41、74.41 μg/g和70.69 μg/g;8 min时GRA含量分别减少了65.48%、65.92%、82.91%和71.85%。由此可见蒸制处理时GRA损失较少,炒制处理时GRA损失最大。这说明蒸制相对其他3 种烹饪方式较为温和,烹饪材料内保留了较多的GRA。
2.2 不同烹饪方式下烹饪时间以及添加外源MYR对西兰花中SFN含量的影响
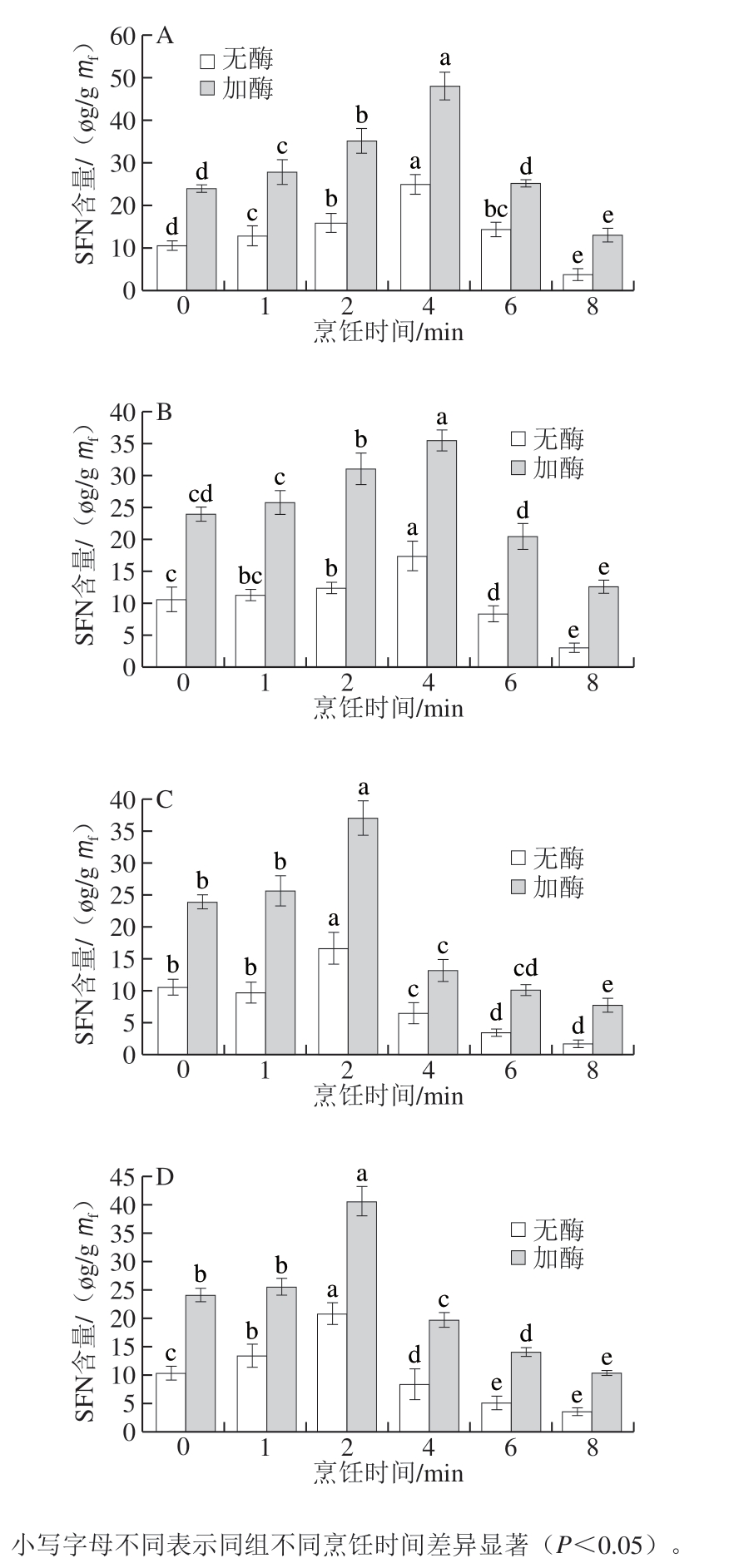
图 2 不同烹饪方式下烹饪时间以及添加外源MYR对 西兰花中SFN含量的影响
Fig. 2 Effect of cooking time and exogenous myrosinase addition on SFN content in broccoli cooked by different methods
研究表明加热可以提高SFN提取量[25-26],但鲜见关于添加外源MYR效应的报道。如图2所示,4 种烹饪方式下,西兰花SFN含量随着烹饪时间的延长呈先升后降的趋势,添加外源MYR使各处理组SFN含量均增加,且各处理组间差异明显。鲜西兰花中SFN含量为10.59 μg/g,蒸制和煮制处理时SFN含量在第4分钟达到最大值,分别为25.07 μg/g和17.43 μg/g,分别比鲜西兰花增加了14.48 μg/g和6.84 μg/g;添加外源MYR蒸制和煮制热处理4 min时SFN含量分别为48.10 μg/g和 35.56 μg/g,分别比鲜西兰花增加了23.03 μg/g和18.13 μg/g。 炒制和微波处理时SFN含量均在第2分钟达到最大值,分别为16.69 μg/g和20.96 μg/g,分别比鲜西兰花增加了6.10 μg/g和10.37 μg/g;添加外源MYR炒制和微波处理2 min时SFN含量分别为36.93 μg/g和40.70 μg/g,分别比鲜西兰花增加了20.24 μg/g和19.74 μg/g。这说明短时间热处理和添加外源酶可提高西兰花中GRA-SFN转化率,增加SFN获取量。
2.3 不同烹饪方式下烹饪时间对西兰花内源MYR活力的影响
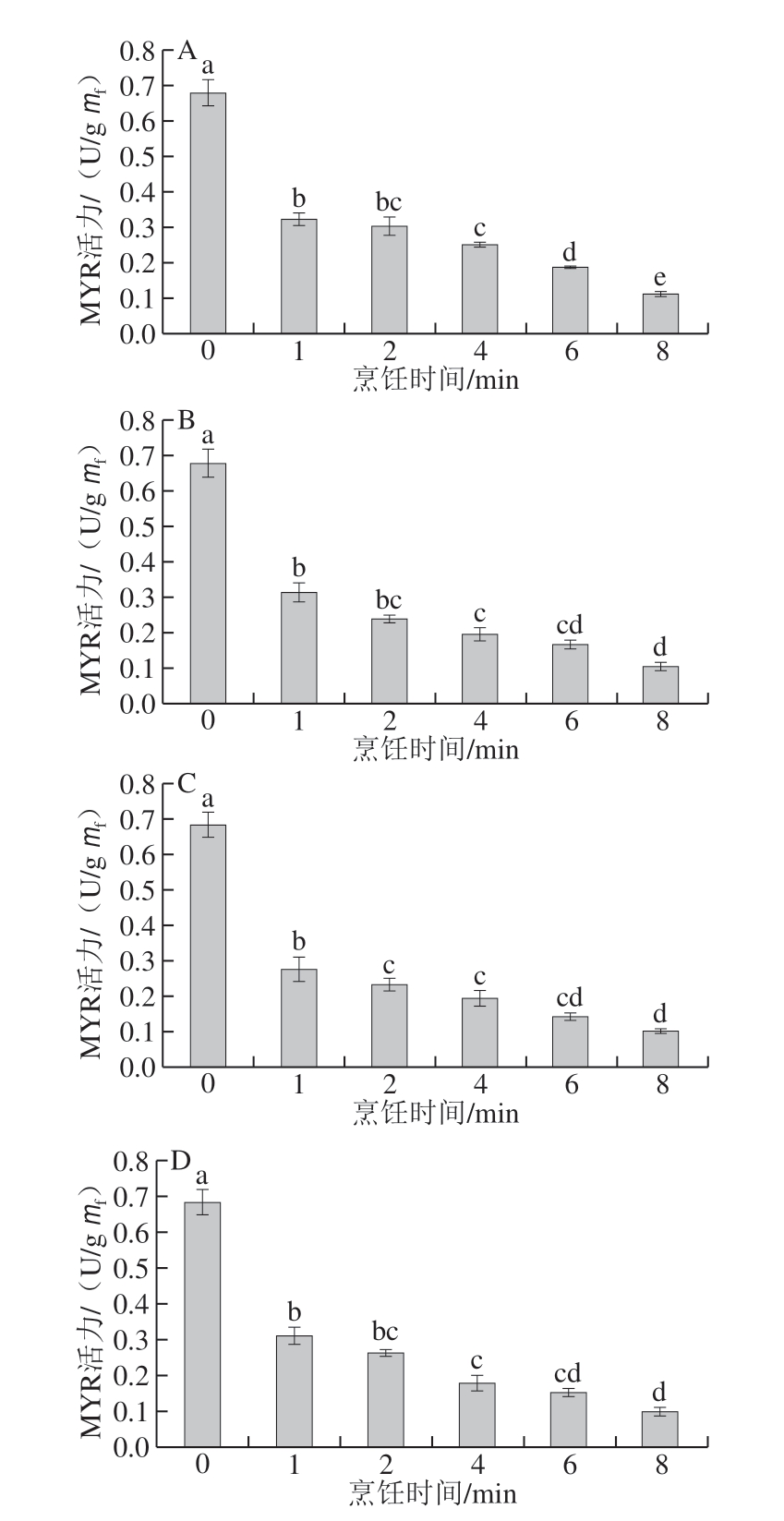
图 3 不同烹饪方式下烹饪时间对西兰花内源MYR活力的影响
Fig. 3 Effect of cooking time on MYR activity in broccoli cooked by different methods
4 种烹饪方式下,烹饪时间对西兰花内源MYR活力的影响如图3所示。随着烹饪时间的延长,西兰花内源MYR活力呈减弱的趋势,各处理组差异明显。鲜西兰花内源MYR活力为0.681 U/g,蒸、煮、炒和微波处理1 min时内源MYR活力分别下降至0.325、0.314、0.276 U/g 和0.315 U/g;8 min时分别为0.112、0.108、0.103 U/g和0.105 U/g,各处理组差异较小。
2.4 不同烹饪方式下烹饪时间对西兰花细胞膜透性的影响
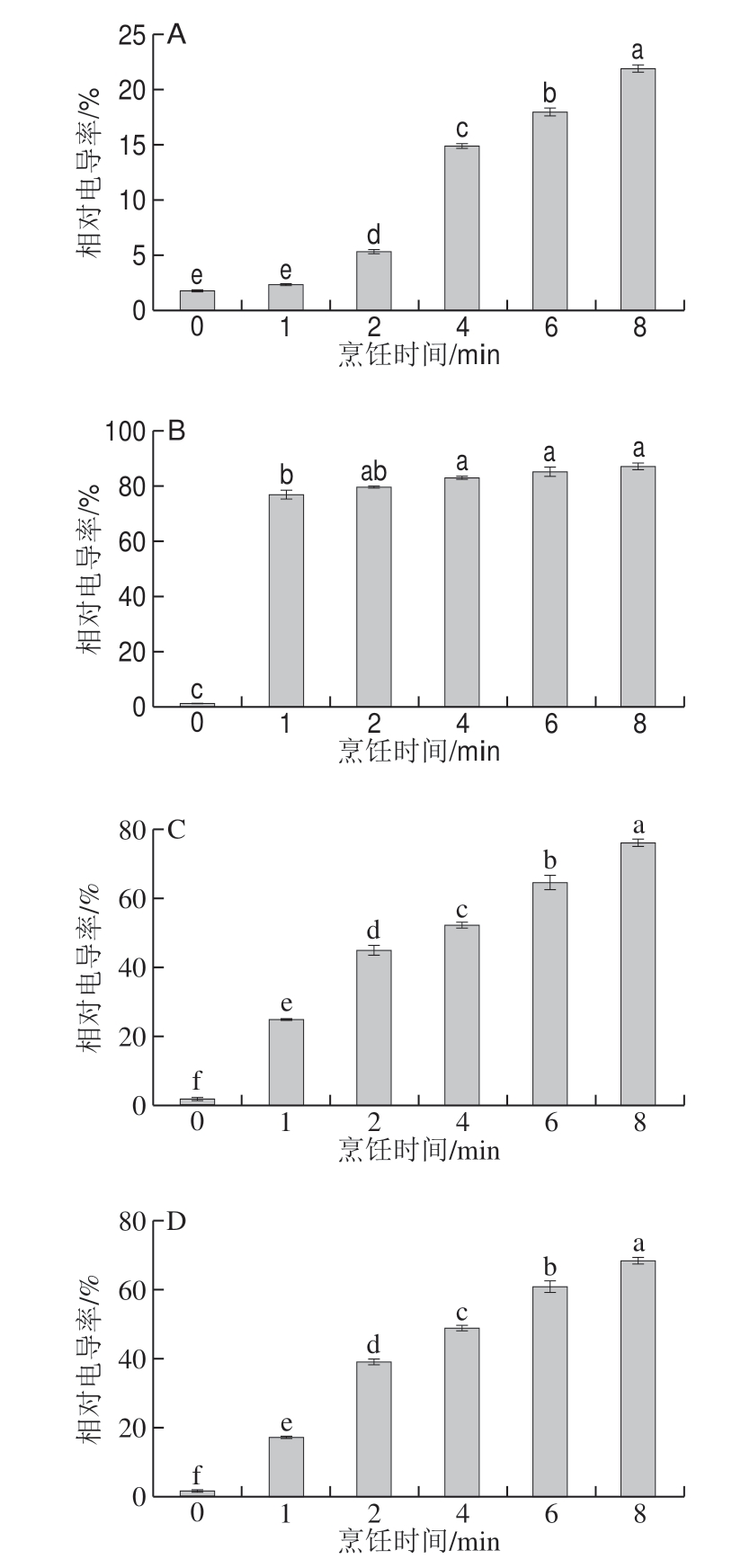
图 4 不同烹饪方式下烹饪时间对西兰花细胞膜透性的影响
Fig. 4 Effect of cooking time on cell membrane penetrability in broccoli cooked by different methods
烹饪加工过程中加热或机械损伤会造成蔬菜细胞膜受损,从而引起GRA和SFN的流失,检测相对电导率有助于了解细胞膜的受损程度。4 种烹饪方式下,烹饪时间对西兰花细胞膜透性的影响如图4所示。鲜西兰花相对电导率为2%,经过烹饪处理后细胞膜透性增大,导致相对电导率增大,与0 min相比,蒸制、煮制、炒制和微波处理8 min时西兰花相对电导率分别增加至20%、85%、74%和66%,蒸制、炒制和微波处理组在8 min内差异显著,煮制处理组2 min后差异不显著。与蒸制相比,煮制、炒制和微波在8 min内对细胞膜损伤较大。
3 讨 论
加热是生活中烹饪蔬菜的常用方式,例如蒸、煮、炒和微波处理都会对蔬菜中的硫苷含量及其水解产物的形成和生物利用度产生较大影响[27]。大量研究表明,在加热处理时蔬菜中的硫苷含量会减少,烹饪时间越长硫苷损失越多,然而蒸制是一种较为温和的烹饪方式,可以使蔬菜保留更多的硫苷[1]。Yuan Gaofeng等[28]研究结果表明炒制、微波和煮制3 种方式使西兰花脂肪族硫苷含量分别显著降低了55%、60%和41%,蒸制处理时几乎没有变化。Tabart等[17]研究结果表明蒸制15 min和煮制20 min时西兰花中总硫苷含量保留较多,微波处理19 min时总硫苷含量几乎没有变化。本研究结果表明相同处理时间内蒸制西兰花可以保留更多的GRA,煮制、炒制和微波处理造成硫苷的损失量高于蒸制。Soares等[1]认为蒸制过程中西兰花和水之间接触面积较小,导致硫苷损失较少。本研究结果表明蒸制相对于其他3 种烹饪方式对细胞膜损伤较小,这或许也是蒸制处理下硫苷损失较少的部分原因。
MYR和表皮硫特异蛋白(epithiospecifier protein,ESP) 对GRA酶解产物类型和含量有较大的影响。正常情况下,西兰花中GRA在MYR作用下生成SFN,ESP会抑制SFN的生成,使GRA向无抗癌活性的萝卜硫腈方向水解[29]。Matusheski等[25]的研究表明西兰花中ESP耐热性较MYR差,加热后易失活,西兰花芽苗在60 ℃水浴10 min后ESP完全失活,SFN生成量显著增加。Wang等[26] 发现汽蒸1~3 min可以生成较多的SFN和较少的萝卜硫腈,推测原因是该条件既能使ESP失活,还能保持较高的MYR活力。Hanschen等[27]研究了在煮制芸薹属蔬菜过程中硫苷浸出和降解的动力学以及硫苷降解产物的形成,结果表明鲜苤蓝、白菜和紫甘蓝中ITC类物质4-甲硫基丁基异硫氰酸盐、2-丙烯基异硫氰酸盐和3-丁烯基异硫氰酸盐含量随烹饪时间的延长呈先升后降的变化趋势,MYR活力呈下降趋势。本研究结果表明4 种烹饪方式下随着烹饪时间的延长SFN含量呈先升后降的趋势,MYR活力随着烹饪时间的延长呈下降的趋势。
人体能够从十字花科蔬菜中摄取有益ITC化合物的含量取决于蔬菜中硫苷含量、MYR和ESP活性以及烹饪条件等因素。蔬菜在烹饪加热过程中硫苷含量会随着烹饪时间的延长下降,同时MYR和ESP活性也会随着烹饪时间的延长降低。已有报道称硫苷可以被人体肠道细菌中的MYR水解生成ITC,但是肠道中MYR的作用微弱,因此植物的内源MYR活力对于硫苷的酶解至关重要[30]。李瑞敏[31]对十字花科芽苗的联合水解进行研究,结果表明西兰花芽苗与萝卜属萝卜、芝麻菜属芝麻菜芽苗和油菜芽苗进行联合水解后,SFN的含量分别增加至2.03、2.32、1.95 倍。通过对芽苗联合水解机制初步探测得知,将西兰花芽苗与芸薹属以外的十字花科芽苗或与ESP活性较低的芸薹属芽苗联合水解均能促进SFN的生成,使人体从十字花科植物芽苗中获取更高含量的抗癌活性物质。本研究结果表明通过添加外源MYR使各处理组SFN含量都得到了提高,这说明添加适宜的外源MYR可以补充加热造成西兰花中MYR的损失,提高西兰花中 GRA-SFN转化率,增加SFN获取量。
4 结 论
本研究结果表明,在4 种家庭常用烹饪方式(蒸制、煮制、炒制和微波处理)下随着烹饪时间的延长,‘瑞农’西兰花中GRA含量呈下降趋势,SFN含量呈先升后降趋势,MYR活力减弱。4 种烹饪方式中蒸制相对于其他3 种烹饪方式可保留更多的GRA,从而可以获得更多的抗癌有益化合物SFN。因此,从健康角度建议人们在食用西兰花时选择蒸制的烹饪方法。
[1] SOARES A, CARRASCOSA C, ANTÓNIO R. Influence of different cooking methods on the concentration of glucosinolates and vitamin C in broccoli[J]. Food and Bioprocess Technology, 2017, 10(8): 1387-1411. DOI:10.1007/s11947-017-1930-3.
[2] VALLEJO F, GARCÍA-VIGUERA C, TOMÁS-BARBERÁN F A. Changes in broccoli (Brassica oleracea L. var. italic) health-promoting compounds with inflorescence development[J]. Journal of Agricultural and Food Chemistry, 2003, 51(13): 3776-3782. DOI:10.1021/jf0212338.
[3] MEYER M, ADAM S T. Comparison of glucosinolate levels in commercial broccoli and red cabbage from conventional and ecological farming[J]. European Food Research and Technology, 2008, 226(6): 1429-1437. DOI:10.1007/s00217-007-0674-0.
[4] GLISZCZYŃSKA-SWIGŁO A, CISKA E, PAWLAK-LEMAŃSKA K, et al. Changes in the content of health-promoting compounds and antioxidant activity of broccoli after domestic processing[J]. Food Additives and Contaminants, 2006, 23(11): 1088-1098. DOI:10.1080/02652030600887594.
[5] SANTIAGO P, MORENO D A, CRISTINA G. Genotypic effects on the phytochemical quality of seeds and sprouts from sommercial broccoli cultivars[J]. Food Chemistry, 2011, 125(2): 348-354. DOI:10.1016/j.foodchem.2010.09.004.
[6] MARTINEZ-VILLALUENGA C, FRIAS J, GULEWICZ P, et al. Food safety evaluation of broccoli and radish sprouts[J]. Food and Chemical Toxicology, 2008, 46(5): 1635-1644. DOI:10.1016/j.fct.2008.01.004.
[7] MAHN A, PEREZ C. Optimization of an incubation step to maximize sulforaphane content in pre-processed broccoli[J]. Journal of Food Science and Technology, 2016, 53(11): 4110-4115. DOI:10.1007/s13197-016-2386-6.
[8] SANCHEZ-PUJANTE P J, BORJA-MARTINEZ M, PEDRENO M A, et al. Biosynthesis and bioactivity of glucosinolates and their production in plant in vitro cultures[J]. Planta, 2017, 246(1): 19-32. DOI:10.1007/s00425-017-2705-9.
[9] CHEN Y S. Regulation of plant glucosinolate metabolism[J]. Planta, 2007, 226(6): 1343-1352. DOI:10.1007/s00425-007-0627-7.
[10] GRUBB C D, ABEL S. Glucosinolate metabolism and its control[J]. Trends in Plant Science, 2006, 11(2): 89-100. DOI:10.1007/s00425-017-2705-9.
[11] ELBARBRY F, ELRODY N. Potential health benefits of sulforaphane: a review of the experimental, clinical and epidemiological evidences and underlying mechanisms[J]. Journal of Medicinal Plants Research, 2011, 5: 473-484. DOI:10.1021/jm101271s.
[12] KENSLER T W, CURPHEY T J, MAXIUTENKO Y, et al. Chemoprotection by organosulfur inducers of phase 2 enzymes: dithiolethiones and dithiins[J]. Drug Metabolism and Drug Interactions, 2000, 17(1/2/3/4): 3-22. DOI:10.1515/DMDI.2000.17.1-4.3.
[13] MUNDAY R, MUNDAY C M. Induction of phase II detoxification enzymes in rats by plant-derived isothiocyanates: comparison of allyl isothiocyanate with sulforaphane and related compounds[J]. Journal of Agriculture and Food Chemistry, 2004, 52(7): 1867-1871. DOI:10.1021/jf030549s.
[14] TALALAY P, FAHEY J W, HOLTZCLAW W D, et al. Chemoprotection against cancer by phase 2 enzyme induction[J]. Toxicology Letters (Shannon), 1995, 82/83: 173-179. DOI:10.1016/0378-4274(95)03553-2.
[15] ZHANG Y, TALALAY P, CHO C G, et al. A major inducer of anticarcinogenic protective enzymes from broccoli: isolation and elucidation of structure[J]. Proceedings of the National Academy of Sciences, 1992, 89(6): 2399-2403. DOI:10.1073/pnas.89.6.2399.
[16] RUNGAPAMESTRY V, DUNCAN A J, FULLER Z, et al. Effect of cooking brassica vegetables on the subsequent hydrolysis and metabolic fate of glucosinolates[J]. Proceedings of the Nutrition Society, 2007, 66(1): 69-81. DOI:10.1017/s0029665107005319.
[17] TABART J, PINCEMAIL J, KEVERS C, et al. Processing effects on antioxidant, glucosinolate, and sulforaphane contents in broccoli and red cabbage[J]. European Food Research and Technology, 2018, 244(12): 2085-2094. DOI:10.1007/s00217-018-3126-0.
[18] VALLEJO F, TOMAS-BARBERAN F A, GARCÍA-VIGUERA C. Glucosinolates and vitamin C content in edible parts of broccoli florets after domestic cooking[J]. European Food Research and Technology, 215(4): 310-316. DOI:10.1007/s00217-002-0560-8.
[19] CONAWAY C C, GETAHUN S M, LIEBES L L, et al. Disposition of glucosinolates and sulforaphane in humans after ingestion of steamed and fresh broccoli[J]. Nutrition and Cancer, 2000, 38(2): 168-178. DOI:10.1207/s15327914nc382_5.
[20] DEKKER M, VERKERK R, JONGEN W M F. Predictive modelling of health aspects in the food production chain: a case study on glucosinolates in cabbage[J]. Trends in Food Science & Technology, 2000, 11(4/5): 174-181. DOI:10.1016/S0924-2244(00)00062-5.
[21] 叶珊珊. 西兰花中萝卜硫苷的提取及降解产物抑菌活性研究[D]. 杭州: 浙江工商大学, 2013: 13-14.
[22] 胡翠珍, 李胜, 马绍英, 等. 响应面优化西兰花中萝卜硫素复合提取工艺[J]. 食品工业科技, 2016, 37(4): 271-277. DOI:10.13386/j.issn1002-0306.2016.04.046.
[23] 丁艳, 李丽倩, 顾振新, 等. 7 种十字花科种子中黑芥子酶降解油菜籽饼粕中硫苷的产物比较分析[J]. 食品科学, 2014, 35(13): 1-7. DOI:10.7506/spkx1002-6630-201413001.
[24] 林毅雄, 林艺芬, 陈莲, 等. 解偶联剂DNP处理对采后龙眼果实呼吸作用和细胞膜透性的影响[J]. 中国食品学报, 2018, 18(2): 191-196. DOI:10.16429/j.1009-7848.2018.02.024.
[25] MATUSHESKI N V, JUVIK J A, JEFFERY E H. Heating decreases epithiospecifier protein activity and increases sulforaphane formation in broccoli[J]. Phytochemistry, 2004, 65(9): 1273-1281. DOI:10.1016/j.phytochem.2004.04.013.
[26] WANG G C, FARNHAM M, JEFFERY E H. Impact of thermal processing on sulforaphane yield from broccoli (Brassica oleracea L. ssp. italica)[J]. Journal of Agricultural and Food Chemistry, 2012, 60(27): 6743-6748. DOI:10.1021/jf2050284.
[27] HANSCHEN F S, KUHN C, NICKEL M, et al. Leaching and degradation kinetics of glucosinolates during boiling of brassica oleracea vegetables and the formation of their breakdown products[J]. Food Chemistry, 2018, 263: 240-250. DOI:10.1016/j.foodchem.2018.04.069.
[28] YUAN Gaofeng, SUN Bo, YUAN Jing, et al. Effects of different cooking methods on health-promoting compounds of broccoli[J]. Journal of Zhejiang University, 2009, 10(8): 580-588. DOI:10.1631/jzus.B0920051.
[29] WILLIAMS D J, CRITCHLEY C, PUN S, et al. Epithiospecifier protein activity in broccoli: the link between terminal alkenyt glucosinolates and sulphoraphane nitrite[J]. Phytochemistry, 2008, 69(16): 2765-2773. DOI:10.1016/j.phytochem.2008.09.018.
[30] 郭丽萍. 热激、低氧及JA和ABA调控西兰花芽苗萝卜硫素形成 机理[D]. 南京: 南京农业大学, 2015: 15-16.
[31] 李瑞敏. 十字花科芽苗中硫代葡萄糖苷及其水解产物的研究[D]. 北京: 北京化工大学, 2016: 53-56.