谷物蛋白消化率是指在一定条件下,蛋白质被蛋白酶水解为肽类及氨基酸等可溶性物质氮含量占谷物蛋白总氮量的比例[1-3],也有文献将其理解为可溶性蛋白质量占物料蛋白总质量的比例[4-5]。蛋白质消化率的传统测定采用动物实验进行[6],虽然结果准确,但评价过程费时费力,而且成本较高。谷物蛋白消化率的体外测定具有速度快、成本低的优势,因此受到了国内外的广泛重视,并取得重要进展。目前胃-胰蛋白酶两步体外消化法已成为测定谷物蛋白体外消化率的主要方法[6-10],其原理是将谷物蛋白进行酶解,然后过滤得到未被酶解的残留蛋白,利用谷物粗蛋白总量扣除未被酶解的残留蛋白量,即可计算谷物蛋白的体外消化率。
然而笔者在研究中发现,文献报道的有关谷物蛋白体外消化率的测定方法,在操作步骤上存在一定的差异,对于蛋白沉淀剂三氯乙酸(trichloroacetic acid,TCA)的使用描述不一致,甚至出现了相互矛盾的测定步骤,这可能对测定结果产生重要影响。例如, 黄沧海[2]、张丽英[5]、王卫国[11]等将饲料酶解后直接抽滤,滤渣烘干后用凯氏定氮法测定蛋白含量,然后利用饲料总蛋白含量扣除酶解后的残留蛋白含量,计算得出样品的蛋白消化率;而朱逸欣等[12]在饲料酶解液过滤前,加入质量分数5%的TCA沉淀溶液中的蛋白质,然后过滤沉淀,利用凯氏定氮法测定滤渣中残留蛋白含量,计算蛋白消化率。唐茂妍[13]、梁明[14]和武建堂[15]等则在酶解液过滤前,加入质量分数20%的磺基水杨酸以沉淀蛋白质,余下步骤与前述相同并计算蛋白消化率。
综合分析上述测定方法可知,酶解液在过滤前是否加TCA或磺基水杨酸以沉淀蛋白质,已成为上述两类操作方法的主要区别。笔者认为,由于谷物酶解液除了含有谷物蛋白质及其降解产物外,还含有酶解时加入的胃蛋白酶和胰蛋白酶,因此,TCA、磺基水杨酸这些蛋白沉淀剂的加入势必会引起胃-胰蛋白酶的沉淀,这将影响过滤残渣中蛋白质含量,进而影响蛋白体外消化率的测定结果。
为了规范谷物蛋白质体外消化率的测定方法,本研究选取大米、小米、玉米和藜麦[16-17]4 种谷物,采用胃蛋白酶-胰酶两步法测定其蛋白质消化率,并在酶解液过滤前分别进行加TCA与不加TCA的对比实验操作,通过比较这两种操作方法对蛋白消化率测定结果的影响程度,最终确定合理的实验操作步骤。本研究对规范谷物蛋白消化率的实验操作具有参考意义和应用价值。
1 材料与方法
1.1 材料与试剂
藜麦由山西华青藜麦生物科技有限公司提供;大米由天津市宝坻区欢喜稻蟹养殖专业合作社提供;小米(‘晋谷21’)和玉米(‘中地88’)由山西省农业科学院玉米研究所提供。胃蛋白酶(10 000 IU/g)和胰蛋白酶(30 000 IU/g)购自上海源叶生物科技有限公司。盐酸、氢氧化钠、TCA、磷酸氢二钠、磷酸二氢钠均为国产分析纯。
1.2 仪器与设备
YB-250型高速多功能粉碎机 永康市速峰工贸有限公司;HNY-200D型恒温培养振荡器 天津市欧诺仪器仪表有限公司;H2050R型高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;UDK 159型全自动凯氏定氮仪 意大利VELP公司;MAPADA型紫外分光光度计 上海美谱达仪器有限公司。
1.3 方法
1.3.1 4 种谷物总蛋白含量的测定
将谷物粉碎,按照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》测定蛋白含量。
1.3.2 胃蛋白酶、胰蛋白酶溶液的配制
准确移取6.1 mL浓盐酸,加蒸馏水稀释到1 000 mL。将上述稀盐酸加热升温到42~45 ℃,取下,加入20 g活力为10 000 IU/g的生化级胃蛋白酶。轻轻摇动使其溶解,得到胃蛋白酶质量浓度为20 mg/mL的溶液,酶活力为200 IU/mL。
准确称取3.521 g磷酸二氢钠(NaH2PO4g 2H2O),溶于100 mL蒸馏水,得到浓度为0.2 mol/L的磷酸二氢钠溶液;准确称取7.164 g磷酸氢二钠(Na2HPO4g 12H2O),溶于100 mL蒸馏水,得到浓度为0.2 mol/L的磷酸氢二钠溶液。
准确移取5.3 mL 0.2 mol/L磷酸二氢钠溶液和94.7 mL 0.2 mol/L磷酸氢二钠溶液,配制成100 mL 0.2 mol/L 磷酸缓冲溶液(p H 8.0),将上述溶液加热升温到4 2 ~4 5 ℃,加入0.5 g 活力为3 0 0 0 0 I U/g 的生化级胰蛋白酶。轻轻摇动使其溶解,得到胰蛋白酶质量浓度为5 mg/mL的溶液,酶活力为150 IU/mL。
1.3.3 谷物蛋白体外消化率的测定(加TCA)
采用胃-胰蛋白酶两步消化法测定4 种谷物蛋白质体外消化率[18-19],具体操作如下:称取1.0 g谷物(精确至0.000 1 g)于100 mL离心管中,加入pH 2.0的胃蛋白酶溶液(20 mg/mL)10 mL,将离心管置于(37f 1)℃恒温培养振荡器中,振摇速率190 r/min。3 h后取下,添加0.5 mol/L NaOH溶液2.0 mL和pH 8.0的胰蛋白酶溶液(5 mg/mL)30 mL,混合液于37 ℃继续振摇2 h。取出离心管,立即加入质量分数10% TCA 10 mL,摇匀后静置1 h以沉淀未降解成氨基酸和小分子肽的可溶性蛋白质。在4 ℃下离心(11 000 r/min、20 min),去上清液,沉淀用蒸馏水洗涤、离心,重复两次。取沉淀,于60 ℃烘箱烘干,采用凯氏定氮法测定沉淀物的蛋白含量,按公式(1)计算体外消化率。
1.3.4 谷物蛋白体外消化率的测定(不加TCA)
除不加TCA沉淀蛋白外,其他操作步骤同1.3.3节。
1.3.5 胃蛋白酶和胰蛋白酶中蛋白质量浓度的测定精确称取0.2 g胃蛋白酶或胰蛋白酶,按照GB 5009.5—2016 测定胃蛋白酶或胰蛋白酶中蛋白质的质量浓度。
1.3.6 TCA对胃蛋白酶和胰蛋白酶沉淀的影响
1.3.6.1 胃蛋白酶与胰蛋白酶标准曲线的绘制
以水为参照,将胃蛋白酶和胰蛋白酶分别稀释成不同质量浓度的水溶液,在280 nm波长处测定吸光度,利用吸光度与蛋白酶溶液中蛋白质量浓度之间的关系绘制标准曲线。
1.3.6.2 TCA加入量对蛋白酶溶液沉淀效果的影响
按照质量分数10% TCA溶液与胃蛋白酶或胰蛋白酶溶液体积比分别为1∶1、2∶1、3∶1、4∶1、5∶1混合后,室温沉淀1 h,离心(11 000 r/min、10 min),取上清液在280 nm波长处测吸光度。根据蛋白酶标准曲线计算上清液中未沉降的蛋白酶质量浓度。以蛋白酶溶液中蛋白质量浓度为纵坐标,以TCA溶液与蛋白酶溶液之间的体积比为横坐标,绘制蛋白酶沉降曲线。按式(2)计算蛋白沉降率。
1.3.6.3 胃-胰蛋白酶沉淀物中蛋白背景值的测定
不加谷物样品,按照1.3.3节方法进行操作,胃-胰蛋白混合酶溶液中加入质量分数10% TCA溶液10 mL后静置、抽滤,测定沉淀中蛋白质量。按式(3)计算蛋白干扰率。
1.4 数据处理与分析
结果以平均值±标准差表示。采用SPSS 17.0软件中单因素方差分析进行数据分析,若差异达到显著 (P<0.05),则进行Duncan’s法多重比较。
2 结果与分析
2.1 胃蛋白酶和胰蛋白酶中蛋白含量
胃蛋白酶和胰蛋白酶中蛋白含量的测定结果如表1所示。
表 1 胃蛋白酶和胰蛋白酶中蛋白含量
Table 1 Protein contents in pepsin and trypsin
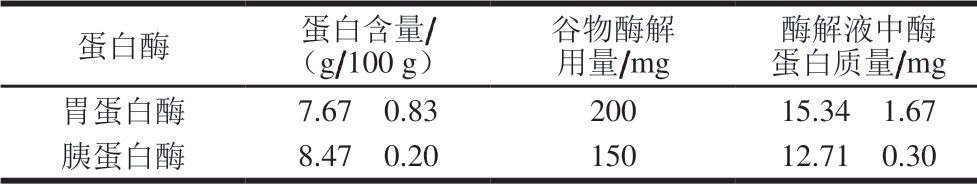
蛋白酶 蛋白含量/(g/100 g)谷物酶解用量/mg酶解液中酶蛋白质量/mg胃蛋白酶 7.67f 0.83 200 15.34f 1.67胰蛋白酶 8.47f 0.20 150 12.71f 0.30
由表1可看出,胃蛋白酶中蛋白含量为7.67 g/100 g,胰蛋白酶中蛋白含量为8.47 g/100 g。在谷物酶解液中,胃蛋白酶加入量为200 mg,其中蛋白质量为15.34 mg;胰蛋白酶加入量为150 mg,其中蛋白质量为12.71 mg,两种酶中蛋白总质量为28.05 mg。在消化率的测定过程中,谷物用量为1 000 mg,因此,如果胃-胰 蛋白酶能够全部被TCA沉淀,则将导致谷物蛋白质含量测定结果偏高2.80%。
2.2 TCA对胃蛋白酶溶液中蛋白质量浓度的影响
质量分数1 0% T C A 与胃蛋白酶溶液(酶液初始质量浓度4.76 mg/mL,其中蛋白质量浓度为 4.76 mg/mLh 7.67%=0.365 mg/mL)分别按照1∶1、2∶1、3∶1、4∶1、5∶1的体积比混合后,室温沉淀1 h,离心(11 000 r/min、10 min),取上清液测蛋白质量浓度,结果见图1。
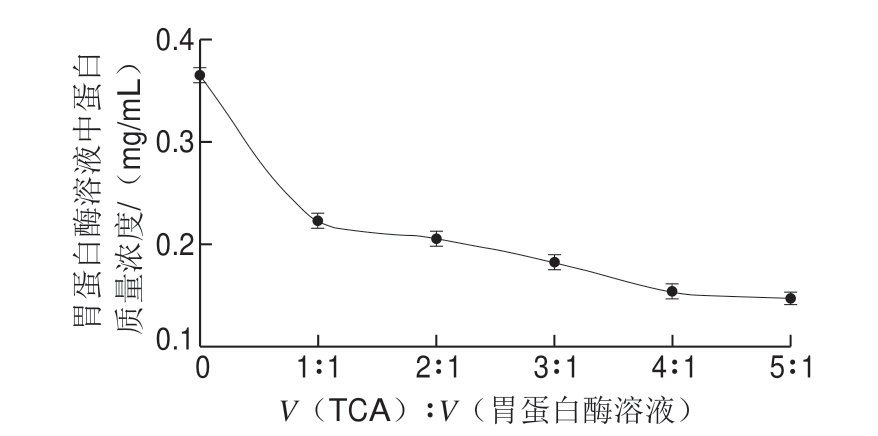
图 1 TCA加入量对胃蛋白酶溶液中蛋白质量浓度影响
Fig. 1 Effect of TCA on protein concentration in pepsin solution
由图1 可见,胃蛋白酶中蛋白质初质量浓度为0.365 mg/mL,随着TCA溶液加入体积的增加,酶溶液中蛋白质量浓度逐渐减小。当TCA溶液与胃蛋白酶溶液体积比为4∶1时,酶溶液中蛋白质量浓度基本保持不变。根据胃蛋白酶沉降曲线,最终确定TCA溶液与胃蛋白酶溶液体积比为4∶1,即可达到最佳的蛋白沉淀效果。
不过从图1可以看出,胃蛋白酶沉淀并不完全,当TCA与胃蛋白酶溶液体积比在1∶1~5∶1之间变化时,胃蛋白酶的沉降率为39.28%~58.92%。以最高的沉降率计算,胃蛋白酶(用量200 mg)在测定过程中对谷物沉淀蛋白含量的干扰率为0.9%。
2.3 TCA对胰蛋白酶滤液中蛋白质浓度的影响
质量分数10% TCA与胰蛋白酶溶液(酶液初始质量浓度3.57 mg/mL,其中蛋白质量浓度为3.57 mg/mLh 8.47%=0.302 mg/mL)分别按照1∶1、2∶1、3∶1、4∶1、5∶1的体积比混合后,室温沉淀1 h。离心(11 000 r/min、10 min),取上清液测蛋白质量浓度,结果见图2。
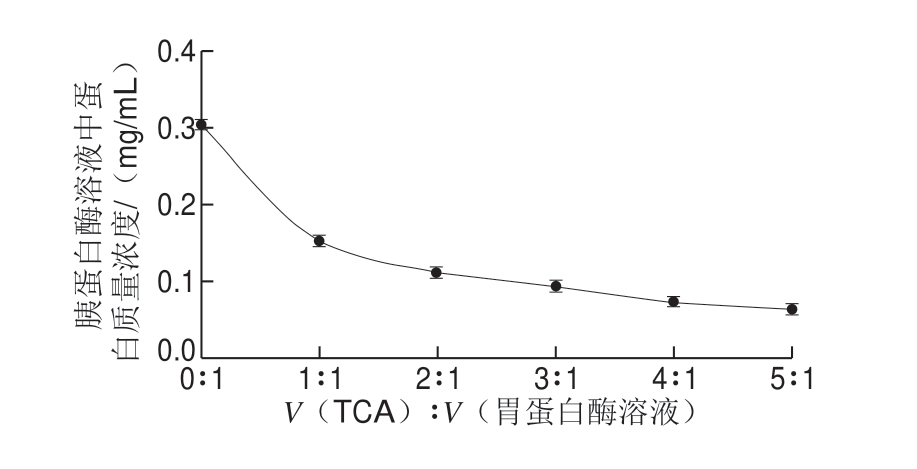
图 2 TCA加入量对胰蛋白酶溶液中蛋白浓度影响
Fig. 2 Effect of TCA on protein concentration in trypsin solution
由图2 可见,胰蛋白酶中蛋白初始质量浓度为0.302 mg/mL,随TCA溶液体积的增加,胰蛋白酶中蛋白质量浓度有明显下降趋势。当TCA溶液与胰蛋白酶溶液之比为4∶1时,胰蛋白酶中蛋白浓度已基本不再变化。根据胰蛋白酶沉降曲线,确定V(TCA)∶V(胰蛋白酶溶液)为4∶1即可达到最佳的蛋白沉淀效果。当 V(TCA)∶V(胰蛋白酶溶液)在1∶1~5∶1之间变化时,胰蛋白酶的沉降率为50.33%~80.13%。以最高的沉降率计算,胰蛋白酶(用量150 mg)在测定过程中对沉淀蛋白含量的干扰率为1.02%。
对比图1与图2可知,TCA溶液对胰蛋白酶的沉降效果优于胃蛋白酶。沉淀效果的差异可能与二者的等电点有关。胰蛋白酶的等电点pI为10.8[20],而胃蛋白酶具有极低的等电点(如猪胃蛋白为pH 1.0)[21]。在相同的酸性沉淀条件下,蛋白质的等电点越高,其所带正电荷的数量越多,就越容易与带负电荷的TCA形成沉淀。
2.4 TCA对谷物蛋白体外消化率测定的影响
谷物蛋白酶溶液在过滤前采取加入TCA与不加入TCA两种操作,过滤得到的沉淀中蛋白含量差异见表2。
表 2 TCA对酶解过滤沉淀中蛋白含量的影响
Table 2 Effect of TCA on protein content in precipitates from hydrolysate filtration
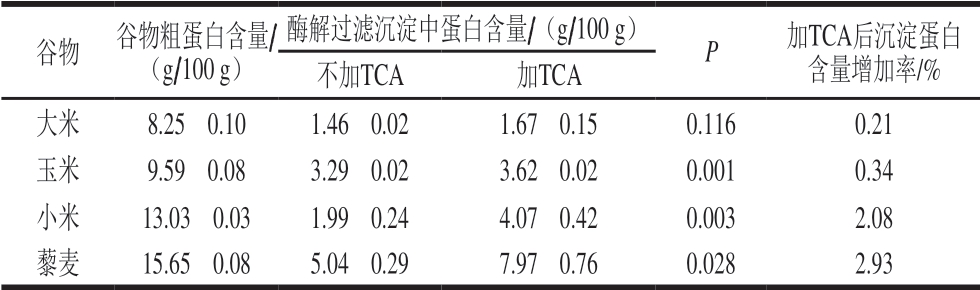
注:P小于0.05表示同类谷物加与不加TCA蛋白沉淀剂的统计学差异显著。表3同。
谷物 谷物粗蛋白含量/(g/100 g)酶解过滤沉淀中蛋白含量/(g/100 g) P 加TCA后沉淀蛋白含量增加率/%不加TCA 加TCA大米 8.25f 0.10 1.46f 0.02 1.67f 0.15 0.116 0.21 玉米 9.59f 0.08 3.29f 0.02 3.62f 0.02 0.001 0.34 小米 13.03f 0.03 1.99f 0.24 4.07f 0.42 0.003 2.08 藜麦 15.65f 0.08 5.04f 0.29 7.97f 0.76 0.028 2.93
由表2可知,谷物蛋白酶解液在过滤前采取加入TCA后,沉淀中蛋白质含量明显增加,除了大米之外,均有显著性差异(P<0.05)。同时发现,谷物粗蛋白质含量越高,TCA对沉淀蛋白含量的增加效果就越明显。胃-胰蛋白酶的沉淀不是导致测定结果升高的唯一原因。结合前述2.1~2.3节的研究结果可知,胃-胰蛋白酶沉淀对谷物蛋白含量的影响不会超过1.92%(胃蛋白酶0.9%,胰蛋白酶1.02%),而TCA对小米和藜麦沉淀蛋白含量的影响均超过了2%。因此可以认为,除了蛋白酶之外,可溶性谷物蛋白也发生了沉淀,且谷物蛋白初始含量越高,沉淀现象就越明显。
在表2数据的基础上对谷物蛋白体外消化率进行计算,结果列于表3。
表 3 TCA加入对谷物蛋白体外消化率的影响
Table 3 Effect of TCA on the in vitro digestibility of cereal protein
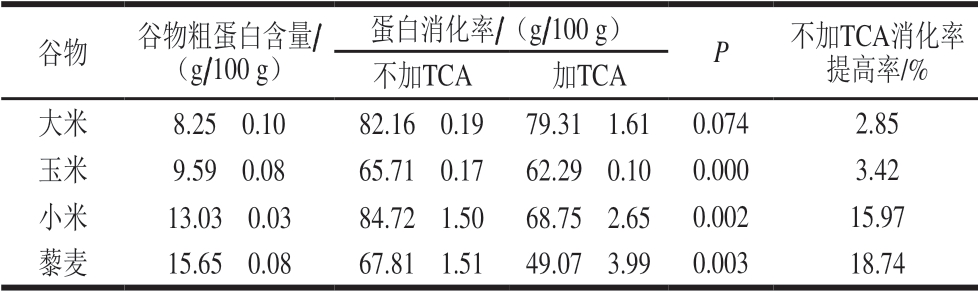
谷物 谷物粗蛋白含量/(g/100 g)蛋白消化率/(g/100 g) P 不加TCA消化率提高率/%不加TCA 加TCA大米 8.25f 0.10 82.16f 0.19 79.31f 1.61 0.074 2.85玉米 9.59f 0.08 65.71f 0.17 62.29f 0.10 0.000 3.42小米 13.03f 0.03 84.72f 1.50 68.75f 2.65 0.002 15.97藜麦 15.65f 0.08 67.81f 1.51 49.07f 3.99 0.003 18.74
根据蛋白体外消化率计算公式,谷物酶解后的沉淀中残留蛋白含量越高,蛋白消化率的计算结果就越低,也就是说,TCA的加入对沉淀蛋白含量的影响及其对消化率的影响恰好呈相反趋势。由表3可知,谷物蛋白酶解液如果采取不加TCA而直接过滤的操作方式,蛋白消化率测定结果将明显偏高(P=0.002<0.01),其中大米、玉米、小米、藜麦4 种谷物蛋白的体外消化率分别提高了2.85%、3.42%、15.97%和18.74%,酶解液过滤前添加TCA能够纠正结果偏高现象。本研究还发现,谷物蛋白初始含量越高,TCA对其蛋白消化率的影响就越大。造成这种现象的原因推测有两个:一是酶解液中存在未被胃-胰蛋白酶降解成小分子肽及氨基酸的可溶性蛋白质,TCA的加入促使这些蛋白进入沉淀中,导致消化率计算结果降低;二是酶解液中谷物蛋白、胃蛋白酶和胰蛋白酶在TCA的作用下发生共沉淀,引起消化率测定结果进一步降低。可以这样认为,加入TCA使谷物中可溶性蛋白形成沉淀属于正常纠偏,而使胃-胰蛋白酶发生沉淀则属于过度纠偏。
一般而言,谷物蛋白在酶解过程中首先是溶解,其次是降解。因此,谷物中粗蛋白含量越高,酶解一定时间后其所含有的可溶性蛋白含量就越高,相应地被TCA所沉淀的蛋白数量就越多,消化率测定结果的下降程度也就越大。就蛋白的共沉淀而言,有研究认为,植物蛋白在采取等电点沉淀、酸-热沉淀等提取过程中,可以与蛋类蛋白、血蛋白、酵母蛋白形成共沉淀,最终得到多种蛋白的混合物[22-24]。在本研究中,谷物蛋白含量越高,酶解液中就蛋白质量浓度就越大,加入TCA时蛋白沉降现象就越明显。在这种情况下,谷物蛋白会对酶蛋白形成包裹而一同沉淀。在共沉淀过程中,相同浓度的TCA会导致更多的胃-胰蛋白酶发生沉淀,对结果的干扰程度增大。因此,谷物蛋白与胃-胰蛋白酶形成共沉淀是一个不容忽视的因素。
2.5 TCA法测定谷物蛋白体外消化率的公式修正
通过上述分析可知,在酶解法测定谷物蛋白消化率的过程中,不加TCA会引起测定结果偏高,而加入TCA又会同时引起谷物可溶性蛋白和酶的一同沉淀,最终导致结果偏低。因此,该测定方法必须加以修正,需要合理扣除胃-胰蛋白酶沉淀所造成的影响。本研究提出了修正公式(式(4))。
式中:NT为蛋白样品总的粗蛋白含量/(g/100 g);N f为样品消化结束时加入T C A 后沉淀中蛋白含 量/(g/100 g);Ne为胃-胰蛋白酶混合液与TCA形成沉淀中的蛋白含量/(g/100 g)。
4 种谷物采用修正公式得到的蛋白消化率结果列于表4。由表4可以看出,修正后谷物蛋白消化率测定数值均较修正前有所升高,提高幅度在1.78%~3.39%之间。因此,在谷物蛋白体外消化率的测定中,不扣除胃-胰蛋白酶空白对照值将导致测定结果偏低。
表 4 修正前后4 种谷物蛋白消化率的比较(TCA法)
Table 4 Comparison of protein digestibility of four kinds of grains before and after modification (TCA method)
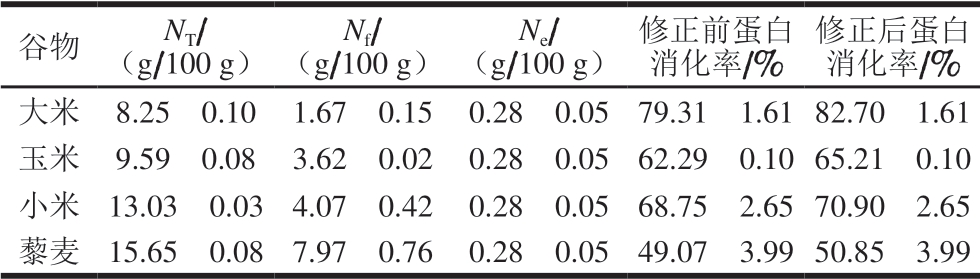
谷物 NT/(g/100 g)Nf/(g/100 g)Ne/(g/100 g)修正前蛋白消化率/% 修正后蛋白消化率/%大米 8.25f 0.10 1.67f 0.15 0.28f 0.05 79.31f 1.61 82.70f 1.61玉米 9.59f 0.08 3.62f 0.02 0.28f 0.05 62.29f 0.10 65.21f 0.10小米 13.03f 0.03 4.07f 0.42 0.28f 0.05 68.75f 2.65 70.90f 2.65藜麦 15.65f 0.08 7.97f 0.76 0.28f 0.05 49.07f 3.99 50.85f 3.99
3 讨 论
3.1 蛋白体外消化率的概念有待进一步明确
蛋白质体外消化率测定方法不统一,源于对蛋白质体外消化率概念认识上的差异。比如有文献认为, 蛋白质的消化率是指可溶性蛋白质占物料总蛋白质的比例[4-5,25];但也有文献认为,蛋白质的体外消化率是指蛋白质被蛋白酶水解为肽类及氨基酸等可溶性物质氮含量占谷物蛋白总氮量的比例[1-3]。基于第二种观点考虑,加入TCA的目的是沉淀未被降解成小肽及氨基酸的可溶性蛋白质。从人体和动物营养吸收的原理进行分析,在酶解液中加入TCA的操作是有道理的,但一定要扣除TCA与胃-胰蛋白酶沉淀所造成的干扰,否则仍然不能得出准确结果。
3.2 正确扣除TCA-酶蛋白沉淀的背景值
既然TCA能够与胃蛋白酶和胰蛋白酶形成沉淀而对谷物蛋白体外消化率的测定形成干扰,那么在测定过程中就应该扣除这一干扰。有文献采用式(5)计算谷物蛋白体外消化率[26-29]。
式中:N0为蛋白样品加入TCA后测定的不溶性氮 质量/mg;Nt为蛋白样品消化t时刻加入TCA后的不溶性氮质量/mg。
在上述公式中,谷物粗蛋白测定过程中也加入了TCA,其目的就是通过平行操作的方式以扣除TCA的干扰,其实这种操作没有抓住问题的关键。因为在谷物粗蛋白总量测定过程中,谷物完全在消化管中消化,通过凯氏定氮法测定蛋白质含量时没有任何损失,故在此步骤加TCA没有任何作用。而在谷物酶解之后加入TCA,胃蛋白酶和胰蛋白酶会一同沉淀,外源蛋白(胃-胰蛋白)对测定结果干扰仍然存在。因此,上述处理并没有真正扣除胃-胰酶蛋白的空白对照值。
4 结 论
本实验以大米、玉米、小米、藜麦4 种谷物为研究对象,采用胃-胰蛋白酶两步法,在酶解液过滤前分别进行加TCA与不加TCA的对比研究。结果表明,不加TCA沉淀酶解液中的可溶性谷物蛋白将导致测定结果偏高,而加入TCA但不扣除胃-胰蛋白酶空白对照值,则导致测定结果偏低。本研究认为,采用沉淀法测定谷物蛋白体外消化率时,以加入TCA沉淀剂为宜,但在计算过程中必须单独扣除胃-胰蛋白酶的空白对照值。
[1] 李美华. 对测定大豆蛋白消化率的看法[J]. 调味副食品科技, 1982(9): 25-27.
[2] 黄沧海, 陈东晓. 几种蛋白质原料体外消化率测定方法的比较[J]. 饲料工业, 2005, 26(20): 48-51. DOI:10.3969/j.issn.1001-991X.2005.20.015.
[3] PRICE M L, BUTLER L G, ROGLER J C, et al. Overcoming the nutritionally harmful effects of tannin in sorghum grain by treatment with inexpensive chemicals[J]. Journal of Agricultural and Food Chemistry, 1979, 27(2): 441-445.DOI:10.1021/jf60222a052.
[4] 咸树智, 薛红芬. 酱油蒸煮料蛋白消化率测定方法探讨[J]. 调味副食品科技, 1983(6): 13-15.
[5] 张丽英, 王燕华, 隋连敏. 动物性饲料体外蛋白质消化率测定的关键控制点[J]. 饲料工业, 2005, 26(19): 31-32. DOI:10.3969/j.issn.1001-991X.2005.19.009.
[6] 肖芹, 常玲玲, 沈一茹, 等. 磷酸对肉鸡消化道pH值、消化酶活性和蛋白消化率的影响[J]. 中国家禽, 2016, 38(4): 23-28. DOI:10.16372/j.issn.1004-6364.2016.04.006.
[7] HARNEDY P A, PARTHSARATHY V, MCLAUGHLIN C, et al. Blue whiting (Micromesistius poutassou) muscle protein hydrolysate with in vitro and in vivo antidiabetic properties[J]. Journal of Functional Foods, 2018, 40: 137-145. DOI:10.1016/j.jff.2017.10.045.
[8] TANG C H. Functional properties and in vitro digestibility of buckwheat protein in products: influence of processing[J]. Journal of Food Engineering, 2007, 82: 568-576. DOI:10.1016/j.jfoodeng.2007.01.029.
[9] ZHENG M G, CHAO C, YU J L, et al. Effects of chain length and degree of unsaturation of fatty acids on structure and in vitro digestibility of starch-protein-fatty acid complexes[J]. Journal of Agricultural and Food Chemistry, 2018, 66: 1872-1880. DOI:10.1021/acs.jafc.7b04779.
[10] FAGEER A S M, BABIKER E E, EL TINAY A H. Effect of malt pretreatment and/or cooking on phytate and essential amino acids contents and in vitro protein digestibility of corn flour[J]. Food Chemistry, 2004, 88: 261-265. DOI:10.1016/j.foodchem.2004.01.040.
[11] 王卫国, 邓金明, 廖再生. 饲料粉碎粒度与蛋白质消化率的体外消化试验研究[J]. 粮食与饲料工业, 2000(11): 16-19. DOI:10.3969/j.issn.1003-6202.2000.11.008.
[12] 朱逸欣, 江国永. 模拟动物体内蛋白消化试验探索[J]. 饲料与畜牧, 2013(10): 56-57.
[13] 唐茂妍. 胃蛋白酶-胰酶两步法体外评定加酶饲料蛋白质消化率的研究[D]. 南京: 南京农业大学, 2002: 1-57.
[14] 梁明, 杨维仁. 胃蛋白酶-胰蛋白酶两步体外消化法评定豆粕粉碎粒度[J]. 中国粮油学报, 2013, 28(3): 87-91. DOI:10.3969/j.issn.1003-0174.2013.03.017.
[15] 武建堂, 左进华, 董海洲. 双螺杆挤压对花生蛋白体外消化率影响研究[J]. 粮食与油脂, 2008(10): 25-28. DOI:10.3969/j.issn.1008-9578.2008.10.008.
[16] 李润青. 静乐着力打造“中国藜麦之乡”[J]. 农产品加工, 2013(10): 20. DOI:10.3969/j.issn.1671-9646.2013.10.011.
[17] BAJAJ Y P S. Biotechnology in agriculture and forestry[M]. Berlin: Springer, 1988: 386-403. DOI:10.1007/978-3-642-73520-2_19.
[18] 张吉鹍, 张震宇, 李龙瑞, 等. 功能大豆寡肽蛋白饲料中蛋白质体外消化率蛋白溶解率蛋白水解度与乳酸含量的测定[J]. 江西饲料, 2013(6): 2-3. DOI:10.3969/j.issn.1008-6137.2013.06.002.
[19] 龙佩. 超声波和脱酰胺改性对谷物蛋白体外消化率的影响[D]. 无锡: 江南大学, 2015: 9-10.
[20] 李君兰. 牛羊胰酶提取、胰蛋白酶纯化及其酶学特性研究[D]. 兰州: 甘肃农业大学, 2011: 6.
[21] 齐艳荣. 胃蛋白酶的生物提取法中分离纯化技术的研究进展[J]. 科技资讯, 2010(20): 7. DOI:10.16661/j.cnki.1672-3791.2010.20.003.
[22] 齐慧红, 周春霞, 朱潘红, 等. 罗非鱼-豆粕共沉淀蛋白的提取及溶解性、氨基酸组成分析[J]. 食品与发酵工业, 2018, 44(1): 166-172. DOI:10.13995/j.cnki.11-1802/ts.014795.
[23] ALU’DATT M H, ALLI I, NAGADI M. Preparation, characterization and properties of whey-soy proteins co-precipitates[J]. Food Chemistry, 2012, 134(1): 294-300. DOI:10.1016/j.foodchem.2012.02.142.
[24] ALU’DATT M H, AL-RABADI G J, ALLI I, et al. Protein coprecipitates: a review of their preparation and functional properties[J]. Food and Bioproducts Processing, 2013, 91: 327-335. DOI:10.1016/j.fbp.2012.11.011.
[25] 赵谋明, 刘雷, 赵亚琦, 等. 美拉德反应对花生分离蛋白体外消化特性的影响[J]. 四川大学学报(自然科学版), 2017, 54(5): 1101-1106. DOI:10.3969/j.issn.0490-6756.2017.05.036.
[26] 甄红敏, 栾广忠, 胡新中, 等. 灭酶方法对燕麦淀粉和蛋白质体外消化特性的影响[J]. 麦类作物学报, 2011, 31(3): 475-479. DOI:10.1009-1041(2011)03-0475-05.
[27] 王金梅, 张占琴, 王学军, 等. 菜籽蛋白的制备及其体外模拟消化[J]. 中国油脂, 2008, 33(9): 10-15. DOI:10.3321/j.issn:1003-7969.2008.09.003.
[28] 崔亚丽. 颗粒度对豆浆品质及蛋白质消化率的影响[D]. 杨凌: 西北农林科技大学, 2012: 12.
[29] 范冬雪, 李静洁, 杨金芹, 等. 热处理对小米蛋白体外消化率的 影响[J]. 中国食品学报, 2016, 16(2): 56-61. DOI:10.16429/j.1009-7848.2016.02.009.