葵花籽是一种重要的油料作物,我国葵花籽资源丰富,主要用于制油。葵花籽制油后产生的副产物——葵花籽粕富含30%的优质蛋白[1],其必需氨基酸的含量(除赖氨酸外)均高于或接近联合国粮食及农业组织推荐值[2],可作为天然植物蛋白的重要来源,也是生物活性肽的良好来源,如抗菌肽[3]、抗氧化肽[4]、降压肽[5-6]。然而,目前葵花籽粕利用率不高,多用作饲料或直接抛弃。因此,有效利用葵花籽副产物对于葵花籽高值化利用是十分必要的。
辐照是一种常用于食品保鲜和改变食品特性的方法[7],通过辐照使食品暴露于非电离和电离状态以破坏食物中的微生物、病毒或细菌的结构,从而达到杀菌的效果,辐照还能改变蛋白质的结构,从而改变其特性[8]。辐照技术多应用于食物杀菌,目前研究者也逐渐关注其在改变蛋白质特性方面的应用[9-12]。有研究通过γ射线照射大豆蛋白,原蛋白的结构被破坏,蛋白降解成多肽,多肽重新交联、凝聚。这被应用于大豆豆粕和浓缩蛋白,γ射线照射提高了豆粕和浓缩蛋白的性能[11]。电子束辐照是辐照技术的一种,与其他辐照技术相比,电子束辐照不产生辐射废料且无危险,能够在短时间内产生高能量,并且利用率高、成本低。利用电子束辐照能够改变蛋白的性能,使其可以被广泛地应用[12]。研究发现电子束辐照可以改善蛋清蛋白粉、核桃蛋白粉、玉米粉的特性,如热稳定性、水解性、抑制凝胶特性[13-15]。关于电子束辐照对葵花籽蛋白性能的影响,目前尚鲜有报道。
本研究采用脱脂后的葵花籽粕为原料,通过场发射扫描电子显微镜观察电子束辐照对葵花籽蛋白微观结构的影响,利用低场核磁、激光粒度仪进一步探究电子束辐照对葵花籽蛋白特性的影响和形成原因,为葵花籽粕的高值化利用和电子束辐照的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
脱脂葵花籽:压榨法提油后剩余的部分,蛋白质量分数约为30.75%,水分质量分数为8.3%。
Alcalase FG 2.4 L碱性蛋白酶(酶活力为170 000 U/g) 南宁庞博生物工程有限公司;三氟乙酸(色谱纯) 美国Sigma公司;乙腈(色谱纯) 美国Spectrum化学试剂公司;其他试剂均为国产分析纯。
1.2 仪器与设备
LCQ液相色谱-质谱联用仪(配有电喷雾离子源及Xcalibur1.2数据处理系统) 美国Finnigan公司;1100高效液相色谱系统(配有可变波长紫外检测器和 Rev.A.06.03色谱工作站) 美国惠普公司;10 MeV/15 kW辐照电子直线加速器 长春易孚辐照加速器有限公司; JSM-6700F场发射扫描电子显微镜 日本电子日株式会社;E-1045型离子溅射仪 日本日立高新技术有限公司;Zetasizer nano ZS90激光粒度仪 英国Malvern仪器有限公司;NMI20-030H-1核磁共振(nuclear magnetic resonance,NMR)成像分析仪 上海纽迈电子科技有限公司;ESJ60-4电子天平 沈阳龙腾电子有限公司;电热鼓风干燥箱 上海一恒科学仪器有限公司;DK-8D恒温水浴槽 上海精宏试验设备有限公司;Starter-300便携式pH计 上海奥豪斯仪器有限公司。
1.3 方法
1.3.1 葵花籽蛋白电子束辐照
参考林松毅等[16]的方法,用高速粉碎机将脱脂葵花籽打碎成粉,过100 目筛,称取100 g脱脂葵花籽粉放入塑料自封袋,压平,放入电子束辐照室,辐照采用10 MeV/15 kW电子加速器,样品在室温下进行辐照,剂量率为0.5 kGy/h,辐照时间分别为5、10、15、20 h,对应的辐照剂量分别为2.5、5.0、7.5、10.0 kGy,经过电子束辐照后将样品放入-80 ℃冰箱保存。
1.3.2 扫描电子显微镜观察微观结构
参考Sun Na等[17]的方法对电子束辐照处理前后的葵花籽蛋白粉进行电子显微镜扫描。将洁净的铝箔片粘附于样品台上,称取1 mg葵花籽粉样品置于铝箔片上,将样品台置于离子溅射仪的样品舱中,在15 mA的电流下喷金90 s,将样品台装入电子显微镜观察室,焦距调至600、2 000 倍,选取清晰视野进行观察。
1.3.3 LF-NMR分析
参考Lin Songyi等[18]的方法对样品进行低场核磁(low field-NMR,LF-NMR)分析。称取经不同辐照处理的样品2.5 g溶于25 mL蒸馏水中,取3 mL溶液放入玻璃瓶中,将玻璃瓶至直径为10 mm的核磁管中进行检测,利用CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列测定样品的自旋-自旋弛豫时间(T2)。采样参数:采用的射频线圈直径为60 mm,中心频率为22 MHz,采样点数为1 984 972,质子共振频率为22 Hz,CPMG序列测定T2弛豫时间,半回声时间(90°脉冲到100°脉冲的时间)为0.6 ms。
1.3.4 葵花籽肽粉的制备与分析
参考Lin Songyi等[19]的方法,将辐照后的葵花籽粉溶于蒸馏水中,得到质量浓度为5 g/100 mL的溶液,在90 ℃保温10 min,冷却至45 ℃,加入1 mmol/L NaOH溶液调节pH值为8,并保持pH值稳定,加入3 000 U/g碱性蛋白酶水解3 h(保持pH值恒定),将pH值调至中性,在90 ℃水浴下灭酶10 min。冷却至室温,10 000 r/min离心15 min,取上清液,将所得的上清液冷冻干燥后所得物质即为葵花籽蛋白肽粉。
水解度参考文献[20]采用pH-stat法测定,以滴定葵花籽蛋白肽所消耗的标准NaOH溶液体积,按照公式(1)计算水解度[20]。
式中:V表示维持pH值恒定为8所消耗的NaOH的体积/mL;c表示NaOH的浓度/(mmol/L);m表示被水解的蛋白质量/g;hmt表示蛋白质中肽键的总数/(mmol/g); α表示水解过程中葵花籽蛋白中的α-氨基的解离度,具体按公式(2)计算。
式中:pH表示当前溶液的pH值;pK表示水解过程中释放的α-氨基的平均解离度,取决于温度、肽链长度和末端氨基酸的性质。
参考Lin Songyi等[21]的方法,采用激光粒度仪测定样品肽的粒度,每份样品测定3 次。
1.4 数据处理与统计
数据采用SPSS 19.0软件进行单因素方差分析,采用独立样品的t检验进行差异显著性分析,结果用平均值±标准差表示,显著性水平为P<0.05。
2 结果与分析
2.1 不同剂量辐照的葵花籽蛋白粉微观结构分析结果
由图1所示,未经过辐照的葵花籽蛋白粉形状完整,表面圆润光滑,边界明显;经2.5 kGy辐照后,表面开始出现凹凸不平,但仍然保持完整的颗粒结构;当辐照量增至5.0 kGy后,样品表面破碎、凹凸不平。当辐照强度达到7.5 kGy时,样品表面完整性遭到破坏,边界不明显,呈破碎状。研究结果与Jin Yan[14]、Xue Peiyu[15]等的报道结果一致,说明辐照会改变蛋白质微观结构,破坏其表面结构完整性,而且辐照剂量越大,破坏程度越高。Lee等[22]发现这种现象与蛋白分子和氧自由基的相互作用有关,辐照会使水产生氧自由基,氧自由基可以促进蛋白表面发生断裂,从而使蛋白更易破碎。
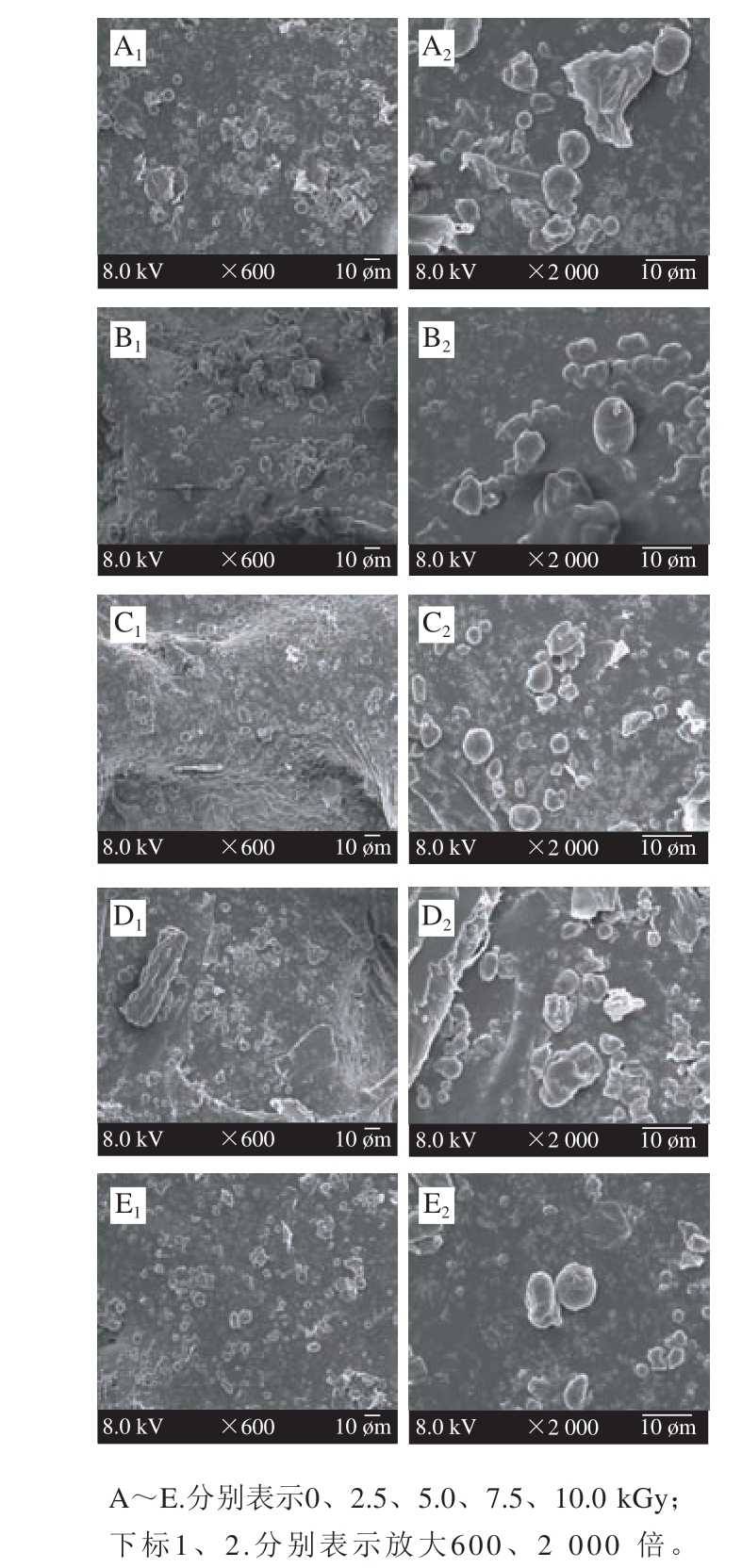
图 1 不同剂量辐照后的葵花籽蛋白粉的扫描电子显微镜图
Fig. 1 Scanning electron microphotographs of sunflower seed protein powder irradiated by different doses of EBI
2.2 不同剂量辐照后的葵花籽蛋白粉的LF-NMR结果
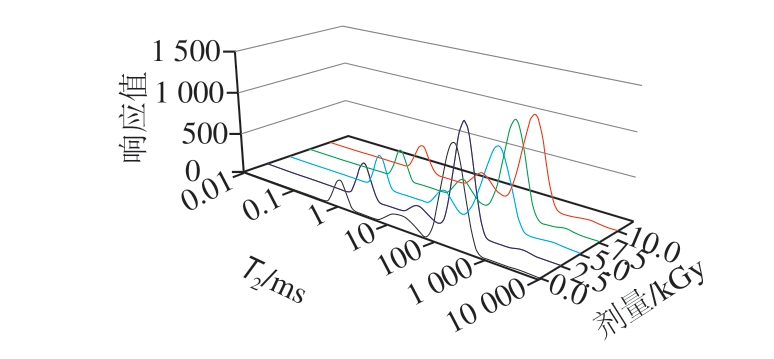
图 2 经不同辐照剂量处理的葵花籽蛋白粉的LF-NMR图谱
Fig. 2 LF-NMR curves of sunflower seed protein powder irradiated by different doses of EBI
LF-NMR是一种新型的无损检测技术,通过T2弛豫时间的变化能够推测蛋白结构的变化。由图2可以看出,根据弛豫时间的不同可分为3 种氢质子组分,包括结合水、吸附水、自由水[23]。结合水是指与蛋白分子紧密结合的水,在图中对应弛豫时间为1~5 ms,用T21表示;吸附水是指与蛋白分子表面结合的水,在图中对应弛豫时间为10~90 ms,用T22表示;自由水是指蛋白质分子周围的游离水,在图中对应弛豫时间为100~1 000 ms,用T23表示,相应峰面积可以表征对应水分含量。弛豫时间和振幅随着辐照剂量的变化而变化。
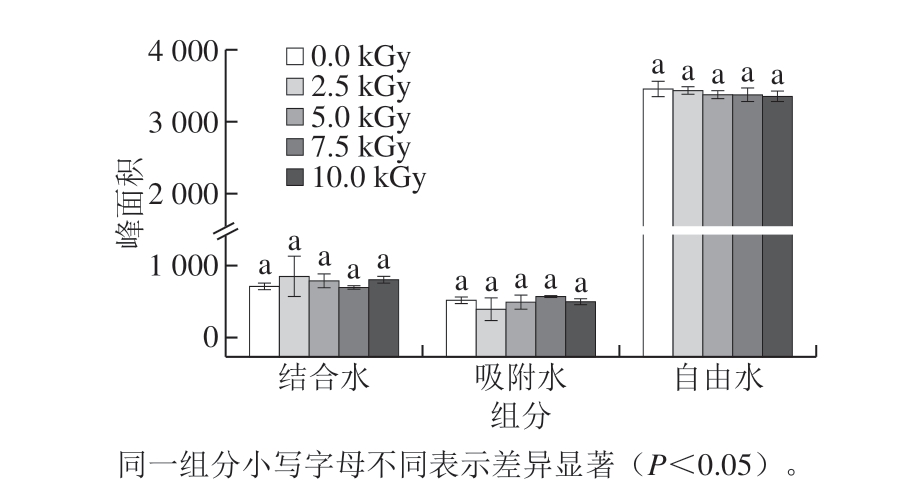
图 3 经不同辐照剂量处理的葵花籽蛋白粉的结合水、吸附水、 自由水峰面积
Fig. 3 Peak area of bound water, adsorbed water and free water of sunflower seed protein powder irradiated by different doses of EBI
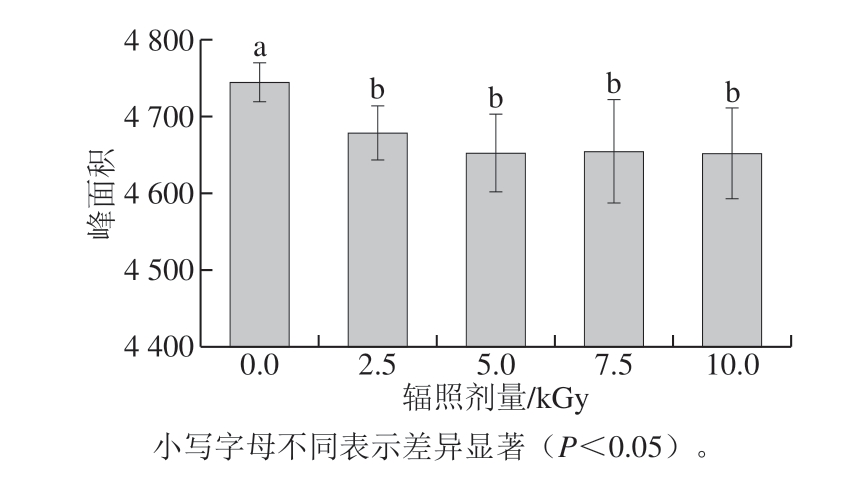
图 4 经不同辐照剂量处理的葵花籽蛋白粉总水峰面积
Fig. 4 Peak area of total water of sunflower seed protein powder irradiated by different doses of EBI
从图3可以看出,葵花籽蛋白粉中主要成分为自由水,其次是结合水和吸附水,与未经辐照处理的葵花籽蛋白粉相比,经辐照处理的葵花籽蛋白粉的自由水含量有降低的趋势,但无显著性差异(P>0.05);总水分含量发生显著降低(P<0.05),且不同辐照剂量处理的葵花籽蛋白粉之间总水分含量无显著性差异(P>0.05)(图4)。结果表明,辐照处理可以降低葵花籽蛋白粉的水分含量。Schmid等[24]研究表明辐照可以使蛋白聚集和交联,不同剂量的辐照产生不同的能量,由此导致蛋白产生不同程度的变性、聚集,使水分含量降低。
2.3 辐照对葵花籽蛋白水解度的影响
用蛋白酶水解蛋白是获得活性多肽的主要途径,水解度是衡量蛋白水解情况的重要指标[25]。本研究采用碱性蛋白酶水解葵花籽蛋白,分析不同辐照剂量对葵花籽蛋白水解度的影响,其水解度如图5所示。随着水解时间的延长,未辐照和辐照后的葵花籽蛋白的水解度均呈现逐渐增加的趋势。同一水解时间,0~5.0 kGy葵花籽蛋白的水解度无显著差异(P>0.05),而辐照强度7.5~10.0 kGy组葵花籽蛋白的水解度显著高于0~5.0 kGy处理组(P<0.05)。水解180 min时,未经电子束辐照的葵花籽蛋白的水解度为19.33%,7.5 kGy辐照处理使葵花籽蛋白的水解度增加到了24.67%,说明高于7.5 kGy剂量的电子束辐照可促进葵花籽蛋白的水解。本研究结果与Jin Yan[14]、Bak[26]、Karthika[27]等的结果一致,即电子束辐照可以增强蛋清蛋白、稻秸、木质纤维素的水解。可能是由于辐照产生的自由基破坏了底物的结构,使多肽链断裂,增加了酶与底物的接触面积,促进了酶解反应的进行[28]。结合扫描电子显微镜、LF-NMR结果,7.5 kGy剂量的电子束辐照破坏了葵花籽蛋白粉的表面结构完整性,增强了其水解特性。
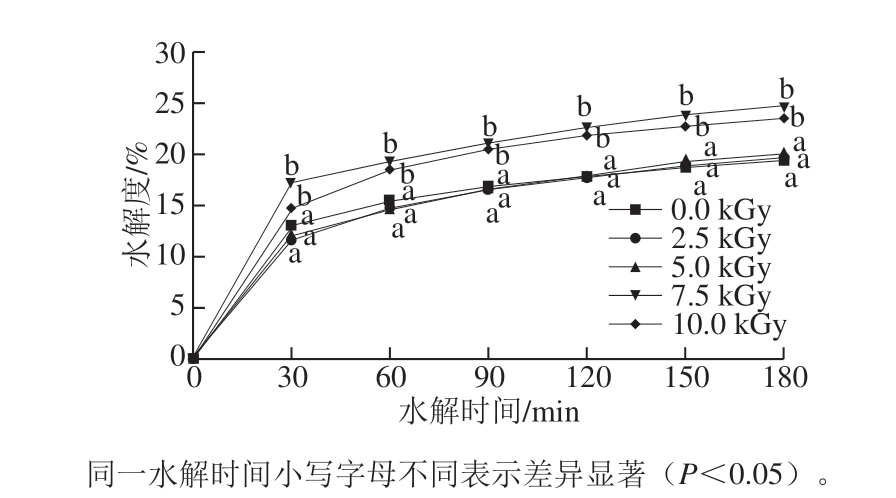
图 5 经不同辐照剂量处理的葵花籽蛋白的水解度
Fig. 5 Hydrolysis degree of sunflower seed protein irradiated by different doses of EBI
2.4 不同辐照剂量的葵花籽蛋白肽的粒径分析结果

图 6 经不同辐照剂量处理的葵花籽蛋白肽的粒径
Fig. 6 Particle sizes of sunflower seed peptide irradiated by different doses of EBI
将不同剂量辐照后的葵花籽蛋白粉进行酶解后,采用激光粒度仪测定葵花籽蛋白肽粒径大小。由图6可知,与未经辐照处理的样品相比,当辐照剂量小于5 kGy时,经过辐照处理的葵花籽蛋白肽的粒径没有发生显著性变化(P>0.05),辐照剂量由5.0 kGy增加至7.5 kGy时,葵花籽蛋白肽的粒径显著降低(P<0.05),由(490.4±20.8)nm降低至(263.3±39.2)nm。本研究结果与葵花籽蛋白的水解度变化趋势一致,辐照剂量达到7.5 kGy时,葵花籽蛋白的水解度最高,产生的蛋白肽粒径最小,10.0 kGy处理组粒径与7.5 kGy处理组粒径差异不显著(P>0.05);说明高于7.5 kGy剂量的辐照处理促进葵花籽蛋白的酶解反应,使其水解产生粒度更小的肽。同样地,Morales等[29]也发现辐照会引起粒度分布的变化。Lee等[30]报道过辐照会使蛋白构象产生不可逆的变化,包括断裂、聚集或交联。结合扫描电子显微镜结果,说明电子束辐照可能造成蛋白断裂,经酶解后产生粒度更小的肽。
3 结 论
本研究采用电子束辐照技术对葵花籽蛋白进行非热加工处理,发现辐照会改变葵花籽蛋白微观结构,破坏其表面结构完整性,造成穿孔和破碎,而且辐照剂量越大,破坏程度越高。经2.5 kGy辐照后葵花籽蛋白粉表面出现很多孔隙,开始变得凹凸不平,但仍然保持完整的颗粒结构;当辐照强度达到7.5 kGy时,样品表面完整性遭到破坏,边界不明显,呈破碎状。然而,辐照剂量达到7.5 kGy以上时,葵花籽蛋白的水解度增加,促进其水解产生粒度更小的葵花籽蛋白肽,说明电子束辐照提高了葵花籽蛋白的水解特性。本研究结果为电子束辐照在改善蛋白质性能方面的应用提供了理论依据。
[1] UGOLINI L, CINTI S, RIGHETTI L, et al. Production of an enzymatic protein hydrolyzate from defatted sunflower seed meal for potential application as a plant biostimulant[J]. Industrial Crops and Products, 2015, 75: 15-23. DOI:10.1016/j.indcrop.2014.11.026.
[2] 高荣丽, 陶冠军, 杨严俊. 葵花籽粕的综合利用[J]. 食品工业科技, 2006, 27(7): 138-140. DOI:10.7666/d.y967881.
[3] ZHAO P, WANG H, QIU Y, et al. Screening antimicrobial peptides from hydrolysates of sunflower seed meal protein hydrolyzing with proteases[J]. Journal of Biobased Materials and Bioenergy, 2017, 11(5): 516-520; 525. DOI:10.1166/jbmb.2017.1705.
[4] 董聪, 李芳, 王琳, 等. 双酶酶解葵花籽粕蛋白制备抗氧化多肽的研究[J]. 食品工业科技, 2015, 36(11): 116-121; 126. DOI:10.13386/j.issn1002-0306.2015.11.015.
[5] MEGÍAS C, DEL MAR Y M, PEDROCHE J, et al. Purification of an ACE inhibitory peptide after hydrolysis of sunflower (Helianthus annuus L.) protein isolates[J]. Journal of Agricultural and Food Chemistry, 2004, 52(7): 1928-1932. DOI:10.1021/jf034707r.
[6] 拉升·再尼西, 李伟, 敬思群, 等. 酶解法制备葵花籽粕ACE抑制肽[J]. 食品工业, 2018, 39(9): 32-35.
[7] KUAN Y H, BHAT R, PATRAS A, et al. Radiation processing of food proteins: a review on the recent developments[J]. Trends in Food Science & Technology, 2013, 30(2): 105-120. DOI:10.1016/j.tifs.2012.12.002.
[8] FARKAS J, MOHÁCSI-FARKAS C. History and future of food irradiation[J]. Trends in Food Science and Technology, 2011, 22(2): 121-126. DOI:10.1016/j.tifs.2010.04.002.
[9] SOLIMAN E A, FURUTA M. Influence of γ-irradiation on mechanical and water barrier properties of corn protein-based films[J]. Radiation Physics and Chemistry, 2009, 78(7/8): 651-654. DOI:10.1016/j.radphyschem.2009.03.053.
[10] WU Y, WANG Y, REN G, et al. Improvement of fish meal replacements by soybean meal and soy protein concentrate in golden pompano diet through γ-ray irradiation[J]. Aquaculture Nutrition, 2016, 22(4): 873-880. DOI:10.1111/anu.12303.
[11] TAGHINEJAD-ROUDBANEH M, EBRAHIMI S R, AZIZI S, et al. Effects of electron beam irradiation on chemical composition, antinutritional factors, ruminal degradation and in vitro protein digestibility of canola meal[J]. Radiation Physics and Chemistry, 2010, 79(12): 1264-1269. DOI:10.1016/j.radphyschem.2010.07.007.
[12] KIM H J, JUNG S , YONG H I , et al. Improvement of microbiological safety and sensorial quality of pork jerky by electron beam irradiation and by addition of onion peel extract and barbecue flavor[J]. Radiation Physics & Chemistry, 2014, 98(5): 22-28. DOI:10.1016/j.radphyschem.2014.01.003.
[13] ZHAO Y, SUN N, LI Y, et al. Effects of electron beam irradiation (EBI) on structure characteristics and thermal properties of walnut protein flour[J]. Food Research International, 2017, 100: 850-857. DOI:10.1016/j.foodres.2017.08.004.
[14] JIN Yan, LIANG Rong, LIU Jingbo, et al. Effect of structure changes on hydrolysis degree, moisture state, and thermal denaturation of egg white protein treated by electron beam irradiation[J]. LWTFood Science and Technology, 2017, 77: 134-141. DOI:10.1016/j.lwt.2016.11.025.
[15] XUE Peiyu, ZHAO Yue, WEN Chengrong, et al. Effects of electron beam irradiation on physicochemical properties of corn flour and improvement of the gelatinization inhibition[J]. Food Chemistry, 2017, 233: 467-475. DOI:10.1016/j.foodchem.2017.04.152.
[16] 林松毅, 王可, 刘静波. 电子束辐照技术提高玉米蛋白粉酶解效果[J]. 农业工程学报, 2014, 30(22): 300-308. DOI:10.3969/j.issn.1002-6819.2014.22.037.
[17] SUN Na, CUI Pengbo, JIN Ziqi, et al. Contributions of molecular size, charge distribution, and specific amino acids to the ironbinding capacity of sea cucumber (Stichopus japonicus) ovum hydrolysates[J]. Food Chemistry, 2017, 230: 627-636. DOI:10.1016/j.foodchem.2017.03.077.
[18] LIN Songyi, YANG Shuailing, LI Xinfang, et al. Dynamics of water mobility and distribution in soybean antioxidant peptide powders monitored by LF-NMR[J]. Food Chemistry, 2016, 199: 280-286. DOI:10.1016/j.foodchem.2015.12.024.
[19] LIN Songyi, LIU Xuanting, LIU Bolong, et al. Optimization of pine nut (Pinus koraiensis) meal protein peptides on immunocompetence in innate and adaptive immunity response aspects[J]. Food and Agricultural Immunology, 2017, 28(1): 109-120. DOI:10.1080/095401 05.2016.1228835.
[20] LIN S, WANG J, ZHAO P, et al. Optimized antioxidant peptides fractions preparation and secondary structure analysis by MIR[J]. International Journal of Biological Macromolecules, 2013, 59: 151-157. DOI:10.1016/j.ijbiomac.2013.04.008.
[21] LIN Songyi, LIANG Rong, LI Xingfang, et al. Effect of pulsed electric field (PEF) on structures and antioxidant activity of soybean source peptides-SHCMN[J]. Food Chemistry, 2016, 213: 588-594. DOI:10.1016/j.foodchem.2016.07.017.
[22] LEE M, LEE S, SONG K B. Effect of γ-irradiation on the physicochemical properties of soy protein isolate films[J]. Radiation Physics and Chemistry, 2005, 72(1): 35-40. DOI:10.1016/j.radphyschem.2004.01.006.
[23] YANG S L, LIU X Y, ZHANG M D, et al. Moisture-absorption and water dynamics in the powder of egg albumen peptide, Met-Pro-Asp-Ala-His-Leu[J]. Journal of Food Science, 2017, 82(1): 53-60. DOI:10.1111/1750-3841.13573.
[24] SCHMID M, PRINZ T K, MÜLLER K, et al. UV radiation induced cross-linking of whey protein isolate-based films[J]. International Journal of Polymer Science, 2017, 5: 1-6. DOI:10.1155/2017/1846031.
[25] 苏玉玲, 刘雯, 田波, 等. 基于人工神经网络的碱性蛋白酶水解乳清蛋白预测模型的建立[J]. 食品工业科技, 2014, 35(7): 100-103. DOI:10.13386/j.issn1002-0306.2014.07.019.
[26] BAK J S, KO J K, HAN Y H, et al. Improved enzymatic hydrolysis yield of rice straw using electron beam irradiation pre-treatment[J]. Bioresource Technology, 2008, 100(3): 1285-1290. DOI:10.1016/j.biortech.2008.09.010.
[27] KARTHIKA K, ARUN A B, MELO J S, et al. Hydrolysis of acid and alkali presoaked lignocellulosic biomass exposed to electron beam irradiation[J]. Bioresource Technology, 2013, 129: 646-649. DOI:10.1016/j.biortech.2012.12.048.
[28] SOLIMAN E A, FURUTA M. Influence of γ-irradiation on mechanical and water barrier properties of corn protein-based films[J]. Radiation Physics and Chemistry, 2009, 78(7/8): 651-654. DOI:10.1016/j.radphyschem.2009.03.053.
[29] MORALES R, MARTÍNEZ K D, PIZONES RUIZ-HENESTROSA V M, et al. Modification of foaming properties of soy protein isolate by high ultrasound intensity: particle size effect[J]. Ultrasonics Sonochemistry, 2015, 26: 48-55. DOI:10.1016/j.ultsonch.2015.01.011.
[30] LEE Y, SONG K B. Effect of gamma-irradiation on the molecular properties of myoglobin[J]. Journal of Biochemistry and Molecular Biology, 2002, 35(6): 590-594. DOI:10.5483/BMBRep.2002.35.6.590.