目前,食物过敏性疾病发病率在全世界范围内持续上升[1]。食物过敏是指机体针对摄入的食物产生的一种有害、具有复发性的特定免疫反应,以免疫球蛋白E(immunoglobulins E,IgE)介导的食物过敏反应为主,即速发型过敏反应,也叫I型超敏反应[2]。研究发现一些具有抗氧化性、抗炎作用的生物活性成分(如黄酮类的多酚物质)具有抗过敏功效[3-5]。
甘草是一种被广泛应用的药食同源植物,甘草酸(glycyrrhizic acid,GA)是甘草中最重要的活性成分之一,又称甘草甜素[6]。GA是一种五环三萜系列皂苷[7], 对动物的免疫功能具有影响作用,可能与其抗炎、抗病毒性相关[8]。有研究发现,GA在炎症相关核转录因子的核因子κB(nuclear factor kappa-B,NF-κB)信号通路、丝裂原活化蛋白激酶信号通路中具有关联[9]。
从患有肿瘤的Wistar大鼠体内分离克隆得到的大鼠嗜碱性粒细胞(rat basophilic leukemia cells,RBL)与黏膜肥大细胞相似,可以在细胞表面正常表达IgE高亲和力受体,并可被抗原激发而发生脱颗粒释放导致炎症[10]。β-氨基己糖苷酶(β-hexosaminidase,HEX)是脱颗粒的一种生物标志物,释放后不会和组胺一样很快被分解,其释放水平通常用作判断RBL或肥大细胞的脱颗粒程度[11]。
有研究显示,激发过敏反应的信号传导过程与胞内钙离子水平密切相关,基质交互分子1(stromal interaction molecule 1,STIM1)和瞬时受体I型电位通道(transient receptor potential cation channel, subfamily C, member 1,TRPC1)蛋白对钙离子释放、传导有调 控作用[12-13]。
目前对GA的抗过敏作用机理尚缺乏深入了解。本研究通过建立小鼠被动皮肤过敏(passive cutaneous anaphylaxis,PCA)和过敏性皮炎模型来确定GA的抗过敏功效,并在分析GA是否具有降低胞内钙离子水平作用的基础上,探究钙离子通道蛋白的表达水平在GA处理前后的差异,确定GA是否通过影响钙离子通道蛋白的表达来影响钙离子水平。以期为深入探究GA的抗过敏机理及治疗过敏反应开拓新的方法。
1 材料与方法
1.1 动物、材料与试剂
雌性BALB/c小鼠(生产许可证号:SCXK(京)2012-0001),4~5 周龄,体质量18~22 g,SPF级,购于维通利华公司。
大鼠RBL白血病细胞系RBL-2H3购自中国科学院细胞库,来源于美国菌类保藏中心,编号CRL-2256TM,在含有质量分数15%胎牛血清、1%青霉素/链霉素/两性霉素B的Eagle’s MEM培养基中,37 ℃、5% CO2条件下培养。
牛血清白蛋白、小鼠抗二硝基苯酚IgE单克隆抗体、二硝基苯基化人血清白蛋白(dinitrophenylated human serum albumin,DNP-HSA)、伊文思蓝染液 美国Sigma公司;肿瘤坏死因子α(tumor necrosis factor receptor-α,TNF-α)检测试剂盒 美国eBioscience 公司;小鼠组胺酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 武汉华美生物工程有限公司;超纯RNA提取试剂 日本TaKaRa 公司。
1.2 仪器与设备
Centrifuge 5804 R型低温高速离心机 德国Eppendorf公司;JB5374-91型电子天平 常熟市金羊砝码仪器有限公司;Varloskan Flash多功能酶标仪 美国 Thermo Scientific公司;水浴锅 德国Peter Huber Kältemaschinenbau公司。
1.3 方法
1.3.1 雌性BALB/c小鼠PCA实验
为明确GA的抗过敏功效,本研究建立了雌性BALB/c 小鼠PCA模型,经抗原激发后,检测血清中的组胺质量浓度,并通过向小鼠耳部注射伊文思蓝染液来检测其血管通透性的改变。
参考Zhou Cui等[14]的方法,将50 只BALB/c小鼠正常饲养于SPF屏障系统内,按体质量随机分为5 组,每组10 只,分别为阴性对照组、色甘酸钠组(50 mg/kg mb)、 G A 低 剂 量 组(1 m g/k g m b)、G A 中 剂 量 组 (10 mg/kg mb)、GA高剂量组(100 mg/kg mb)。
第0天给予小鼠右耳注射抗DNP-IgE致敏,之后连续3 d,各组动物分别灌胃给予生理盐水、色甘酸钠以及GA低、中、高3 个剂量处理,每天1 次。最后1 次灌胃后,尾静脉注射200 μL抗原DNP-HSA与质量分数1%伊文思蓝染液的混合物(体积比1∶1),激发小鼠的被动过敏反应。
抗原激发20 min后,各组小鼠分别进行内眦静脉丛采血,收集于预先装有抗凝剂的离心管中。静置1 h后,经2 000h g离心20 min后,吸取上层血清,-80 ℃保存。组胺质量浓度采用ELISA试剂盒进行测定,具体测定步骤参照试剂盒说明书,组胺质量浓度越高,说明肥大细胞脱颗粒越严重,PCA反应越剧烈。抗原刺激后,观察小鼠耳部颜色变化。采血后处死小鼠,取鼠耳组织匀浆后浸泡于甲酰胺溶液中,利用分光光度计分析浸提液630 nm波长处的吸光度。
1.3.2 雌性BALB/c小鼠过敏性皮炎实验
为探究GA在治疗接触性过敏性皮炎中发挥的作用及机理,建立雌性BALB/c小鼠过敏性皮炎模型,并测定小鼠耳肿胀程度和血清中TNF-α质量浓度。参考 Wang Jing等[15]的方法,将50 只BALB/c小鼠正常饲养于SPF屏障系统内,随机分为5 组,每组10 只,分别为阴性对照组、模型组以及GA低剂量组(1 mg/kg mb)、 G A 中 剂 量 组(1 0 m g/k g m b)、G A 高 剂 量 组(100 mg/kg mb)。
小鼠于实验前1 d腹部脱毛,范围约3 cmh 3 cm,实验第1天脱毛部位均匀涂以体积分数1%二硝基氟苯(2,4-dinitrofluorobenzene,DNFB)丙酮橄榄油(丙酮、橄榄油体积比4∶1)溶液50 μL进行致敏,实验第2天重复强化致敏1 次。首次致敏后当天开始灌胃GA溶液0.2 mL,阴性对照组和模型组给予等体积的生理盐水,连续5 d。实验第5天灌胃后,小鼠双耳各均匀涂1% DNFB丙酮橄榄油溶液10 μL进行激发。阴性对照组在相同部位仅涂以丙酮橄榄油溶液作对照。在激发前及激发后24 h,分别用游标卡尺测量小鼠双侧耳中部的厚度,计算激发前后的耳厚度差,厚度差越大,说明过敏性皮炎反应越剧烈。
小鼠摘眼球取血,分离血清置于-20 ℃冰箱中待测。采用ELISA试剂盒测定血清中TNF-α质量浓度,TNF-α质量浓度越高,说明过敏性皮炎反应越剧烈。
1.3.3 HEX释放水平测定
参考陈晨等[16]的方法,将5h 105 个/mL的RBL-2H3细胞以200 µL/孔接种到96 孔细胞培养板上,培养24 h。用PBS洗涤后,加入1 μg/mL抗DNP-IgE(100 µL/孔,用不含胎牛血清的培养液稀释,阴性对照孔不加),在培养箱中培养2 h。细胞给予100 μL/孔不同质量浓度(0、100、333、500、1 000 μg/mL)的GA处理20 min后,弃掉上清液,用Tyrode’s缓冲液洗涤2 次,各组依次加入100 ng/mL DNP-HSA(50 µL/孔,Tyrode’s缓冲液稀释),在37 ℃反应45 min,将96 孔板置于冰上冷却15 min以终止反应。转移30 μL上清液至另一个96 孔板,加入50 µL含1.3 mg/mL 4-硝基苯基-N-乙酰基-β-D-氨基葡萄糖的柠檬酸溶液,37 ℃反应1 h。加200 µL碳酸钠缓冲液终止反应,测定405 nm波长处的吸光度。全部释放组用1% Trition X-100代替过敏原处理细胞,阴性对照组用PBS代替过敏原处理细胞。结果以HEX释放率表示,如式(1)所示计算。
1.3.4 胞内钙离子水平的测定
参考潘雪刁等的方法[17],将细胞接种到6 cm的培养皿中,利用1 μg/mL抗DNP-IgE在37 ℃下致敏2 h后,使用D-hank’s缓冲液洗细胞两次,之后将细胞转移到1.5 mL离心管中,再冲洗两次,以相同密度重悬于1 mL含有2 μmol/L Fluo-3 AM的细胞染色缓冲液中,37 ℃下避光孵育30 min,冲洗两次,离心并重悬,将1h 105 个/mL细胞接种到96 孔板中,刺激之前30 s检测基础Ca2+水平,30 s时加入100 ng/mL DNP-HSA刺激,连续测定5 min,采用全波长扫描仪检测激发波长488 nm、发射波长525 nm处的荧光强度。Ca2+浓度([Ca2+]i)的计算如公式(2)所示。
式中:Kd为荧光剂与Ca2+形成配合物的解离常数(400 nmol/L);Fmin是荧光剂没有结合Ca2+时的荧光强度(采用含5 mmol/L乙二醇二乙醚二胺四乙酸的D-hank’s缓冲液处理细胞);Fmax是荧光剂被Ca2+饱和时的荧光强度(采用0.1% Triton X-100处理细胞);F为样品的荧光强度。
1.3.5 GA对钙离子通道蛋白表达的影响
根据申婷婷等[18]的方法,经过细胞致敏、GA孵育、抗原刺激后,用RIPA裂解液提取细胞总蛋白。用BCA试剂盒进行蛋白质量浓度测定后,进行Western blot实验,将蛋白以20 µg/孔点样至质量分数5%~15%的十二烷基硫酸钠-聚丙烯酰胺凝胶上进行电泳。在80 V恒压下电转印2 h,将蛋白条带印迹到硝酸纤维素膜上。采用TBST/质量分数5%牛血清白蛋白封闭1 h,加入1∶4 000兔源TRPC1单克隆抗体或1∶4 000兔源STIM1单克隆抗体孵育过夜后,用TBST洗涤6 次(5 min/次)。加入1∶8 000 HRP标记羊抗兔IgG抗体孵育1 h,用TBST洗涤8 次(5 min/次)。然后加入HRP-DAB增强显色液进行显色。蛋白表达量以相对灰度表示。
1.3.6 GA处理对STIM1、TRPC mRNA水平的影响
经过细胞致敏、GA孵育、抗原刺激后,用超纯RNA提取试剂提取组织样本中总RNA。实验操作按产品说明书进行。用RNase free H2O溶解沉淀,并将RNA溶液保存于-80 ℃冰箱中。取5 μL RNA用质量分数1%琼脂糖凝胶进行电泳,检测RNA的完整性。用反转录试剂盒中的gDNA Eraser对RNA中残留的基因组DNA进行消化处理。用反转录试剂盒进行反转录。对STIM1、TRPC这两个基因使用荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪器进行检测。
1.4 数据统计与分析
采用SPSS 18.0软件对测定的数据进行单因素方差分析,采用GraphPad Prism 5.01软件作图,其中细胞实验 n=3、小鼠实验n=10;P<0.05表示差异显著。
2 结果与分析
2.1 GA对PCA小鼠耳部毛细血管通透性的影响
色甘酸钠具有抗过敏作用,已作为抗过敏药品用于临床治疗。本研究通过耳部注射抗DNP-IgE建立了PCA小鼠模型,在给予PCA小鼠色甘酸钠和GA处理之后,再由小鼠尾静脉注射伊文思蓝。用甲酰胺溶液提取各组小鼠耳部组织中的伊文思蓝并进行吸光度分析,结果如图1所示,色甘酸钠组和不同剂量GA组的吸光度都极显著低于阴性对照组(P<0.01),而100 mg/kg mb GA组显著低于色甘酸钠和1 mg/kg mb和10 mg/kg mb GA组。结果说明GA能够降低致敏模型小鼠耳部毛细血管通透性。

图 1 GA对PCA小鼠耳部血管通透性的影响
Fig. 1 Effect of GA on ear vascular permeability of PCA mice
2.2 GA对PCA小鼠血清组胺质量浓度的影响

图 2 GA对PCA小鼠血清组胺质量浓度的影响
Fig. 2 Effect of GA on histamine level in serum of PCA mice
鼠尾静脉注射抗原后,采血测定各组PCA小鼠的组胺质量浓度。如图2所示,色甘酸钠和GA各剂量组PCA小鼠的组胺水平都极显著低于阴性对照组 (P<0.01),且对组胺质量浓度的降低效果与GA剂量有正相关性。在1~100 mg/kg mb范围内,GA剂量与抑制肥大细胞脱颗粒的作用呈现正相关性。
2.3 GA对DIAD小鼠耳肿胀度的影响
为评价GA对过敏性肿胀是否有治疗、缓解作用,建立了DNFB诱导皮炎(DNFB-induced atopic dermatitis,DIAD)小鼠模型,小鼠耳肿胀度是DIAD小鼠的标志症状之一。检测结果显示高剂量GA处理的DIAD小鼠耳厚度显著低于DNFB组小鼠(P<0.05)(表1)。
表 1 GA对DIAD小鼠耳肿胀度的影响
Table 1 Effect of GA on ear swelling of DIAD mice
注:*.与DNFB组相比差异显著(P<0.05)。下同。
指标 阴性对照组 DNFB组 DNFB+GA(1 mg/kg)组DNFB+GA(10 mg/kg)组DNFB+GA(100 mg/kg)组耳厚度/mm 0.00f 0.00 0.12f 0.05 0.10f 0.12 0.08f 0.03 0.06f 0.02*
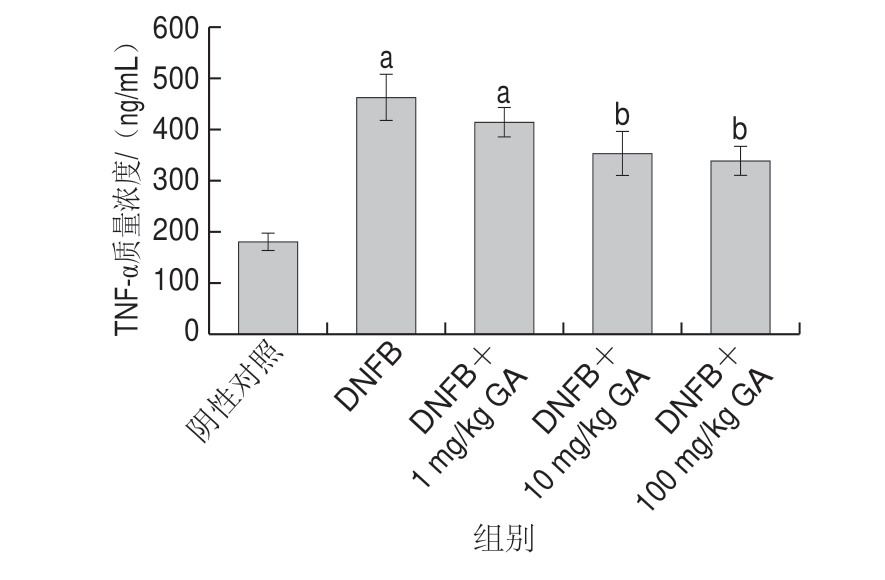
图 3 GA对DIAD小鼠血清TNF-α质量浓度的影响
Fig. 3 Effects of GA on TNF-α level in serum of DIAD mice
过敏原激活肥大细胞后会产生许多细胞因子,比如TNF-α,在过敏模型中,TNF-α水平越高表明过敏反应越剧烈。对小鼠血清中TNF-α质量浓度的检测结果显示,GA处理能够降低DIAD小鼠血清中TNF-α质量浓度。 如图3所示,10 mg/kg或更高剂量GA处理组的TNF-α质量浓度极显著低于DNFB组(P<0.01)。表明GA能够降低过敏性皮炎小鼠血清的TNF-α质量浓度。
2.4 GA对肥大细胞脱颗粒的抑制作用
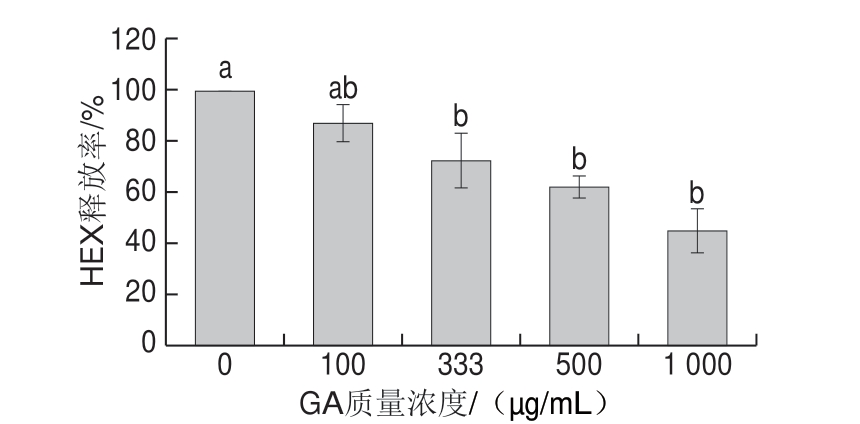
图 4 GA 对RBL-2H3细胞释放HEX的抑制作用
Fig. 4 Inhibitory effect of GA on the release of HEX in RBL-2H3 cells
肥大细胞脱颗粒能引发机体产生过敏症状,HEX释放率是反映细胞脱颗粒水平的生物指标。实验结果显示,GA处理能显著抑制RBL-2H3细胞的HEX释放。如 图4所示,500、1 000 μg/mL的GA处理使HEX的释放率分别下降37.9%和54.8%,说明GA能抑制肥大细胞脱颗粒。
2.5 GA处理对胞内钙离子水平的影响
GA处理抑制了肥大细胞脱颗粒,为了探究其作用机制,本研究测定了其对胞内钙离子浓度的影响。用钙离子荧光探针Fluo-3 AM分析IgE致敏的RBL-2H3细胞内钙离子浓度的变化。结果显示,GA能够抑制抗原诱导的胞内Ca2+浓度上升。如图5所示,500 μg/mL和 1 000 μg/mLGA处理显著降低了细胞内Ca2+浓度。说明GA可能通过调节细胞内Ca2+浓度影响细胞的脱颗 粒反应。

图 5 GA处 理对RBL-2H3细胞内Ca2 浓度的影响
浓度的影响
Fig. 5 Effect of GA on intracellular Ca2+ level of RBL-2H3 cells
2.6 GA处理对钙离子通道蛋白表达水平的影响
已有研究表明STIM1和TRPC1蛋白对钙离子的释放和传导有调控作用。RBL-2H3细胞经过抗DNP-IgE致敏后再进行GA处理,并给予DNP-HSA刺激。对提取的细胞mRNA进行实时荧光PCR分析,结果表明,GA对STIM1和TRPC1的mRNA转录有一定的抑制作用(表2)。
表 2 GA对STIM1和TRPC1 mRNA表达水平的影响
Table 2 Effect of GA on mRNA levels of STIM1 and TRPC1

注:+.添加;-.未添加。
DNP-HSA GA质量浓度/(μg/mL) STIM1 mRNA表达水平 TRPC1 mRNA表达水平--1.00 1.00 +-1.91 2.21 +500 1.36 1.51 +1 000 1.46 1.59
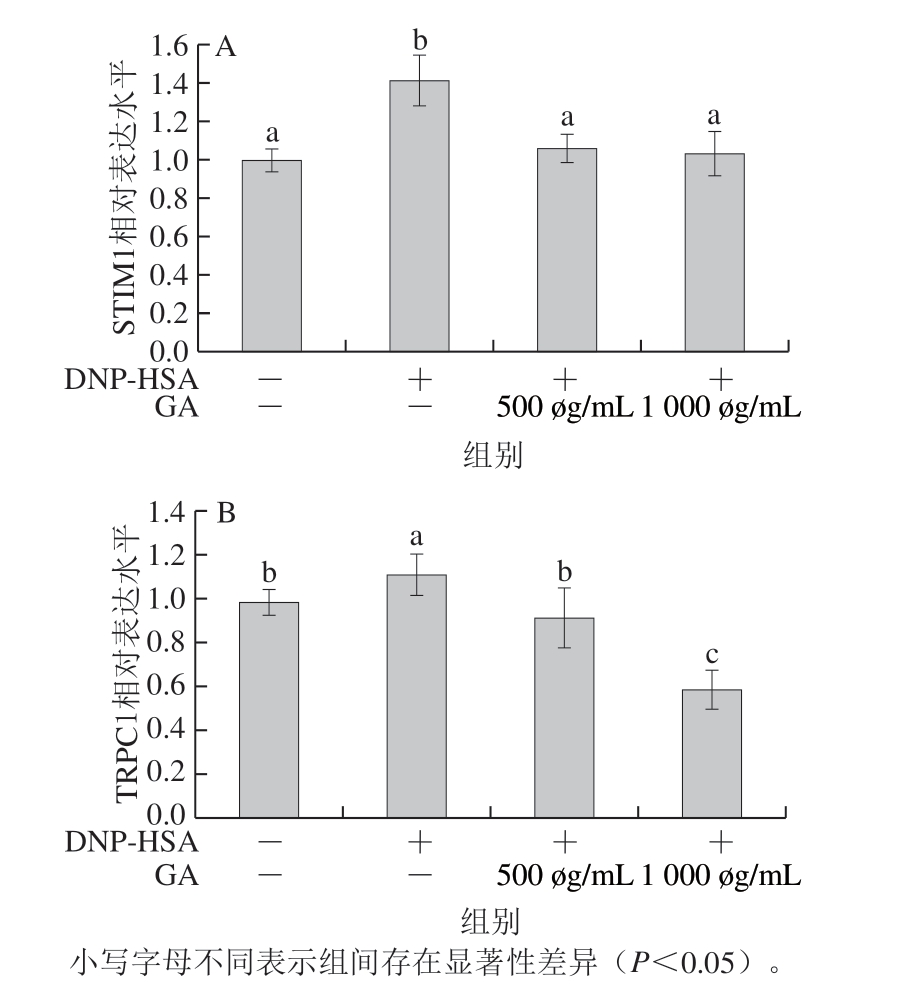
图 6 GA对STIM1(A)、TRPC1(B)蛋白表达水平的影响
Fig. 6 Effect of GA on the expression levels of STIM1 (A)and TRPC1 (B) proteins
免疫印迹结果如图6所示,500 μg/mL和1 000 μg/mL的GA处理显著降低了细胞内STIM1和TRPC1蛋白的表达水平(P<0.05)。这证明GA可能通过调控钙离子通道蛋白的表达来影响胞内钙离子浓度,从而抑制细胞的脱颗粒及介质的释放。在1 000 μg/mLGA处理的细胞中,TRPC1表达水平甚至低于未给予抗原刺激的阴性对照组,这进一步表明GA对TRPC1表达有显著的抑制作用。
3 讨 论
组胺在变应性鼻炎、支气管哮喘等过敏引起的呼吸道慢性炎症性疾病的发生过程中起关键作用,具有强烈的疏通血管作用,并能增加毛细血管和微静脉的管壁通透性,使血浆漏入组织,导致局部组织水肿[20-21]。有学者研究发现,色甘酸钠的主要作用是稳定肥大细胞膜、抑制钙离子内流、进而抑制抗原激发后的组胺释放[22]。
在本研究中,GA处理能够降低PCA模型小鼠血清中的组胺水平,且10 mg/kg mb GA与50 mg/kg mb色甘酸钠具有同等的降组胺功效。本研究还显示10 mg/kg或更高剂量的GA能显著降低PCA模型小鼠血管通透性和DIAD模型小鼠血清中TNF-α水平。此外,RBL-2H3细胞研究结果证明GA可以在安全无毒的剂量下抑制RBL-2H3细胞释放HEX,说明GA能够抑制肥大细胞脱颗粒引发的过敏反应。这些结果进一步证实了GA的抗过敏作用。
关于更进一步的作用机理,已有一些研究结果显示某些信号通路相关因子(如NF-κB、MAPK、TLRs、PI3K、Akt、TOR等)与GA的抗过敏作用存在关联性[9,23]。但目前对GA抗过敏作用的机制仍然缺乏全面、深入的了解。
相关研究表明,脱颗粒过程通常依赖于钙离子的调控作用,参与调控的钙包括来源于胞内库中释放的钙离子,也包括由膜通道进入胞内的胞外钙[24]。
TRPC1蛋白是调控胞内库中钙离子释放的关键因子,STIM1蛋白是参与调控胞外钙离子进入胞内的通道蛋白[13,25]。 本研究发现在mRNA水平和蛋白水平上,GA处理对TRPC1蛋白和STIM1蛋白的表达均有抑制作用。由此可以推测,GA可能通过调控钙离子释放和转运蛋白因子的表达水平,降低抗原激发后的胞内钙离子浓度,进而呈现抑制脱颗粒的抗过敏作用,其机制如图7所示,其中Orai1是参与钙调控的一种膜蛋白。
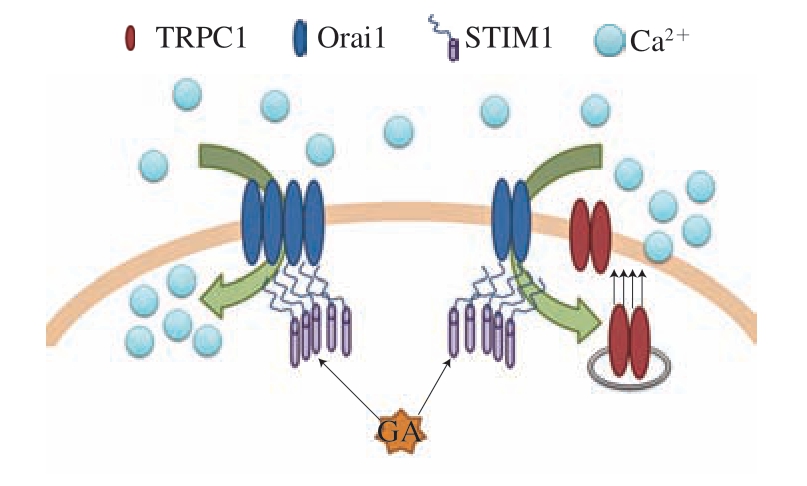
图 7 GA调控钙离子转运机理
Fig. 7 Mechanism of action of GA in regulating calcium ion transport
此外,GA对钙离子的调控作用也可能直接或间接地抑制小鼠血清中组胺水平升高、血管通透性增大和血清中TNF-α水平增加等过敏反应,这还需要展开更加深入的研究。
[1] YU W, DMH F, NADEAU K C. Food allergy: immune mechanisms, diagnosis and immunotherapy[J]. Nature Reviews Immunology, 2016, 16(12): 751-765. DOI:10.1038/nri.2016.111.
[2] SATHE S K, LIU C, ZAFFRAN V D. Food Allergy[J]. Annual Review of Food Science & Technology, 2016, 7(1): 191-220. DOI:10.1146/annurev-food-041715-033308.
[3] CUERVO A, HEVIA A, LÓPEZ P, et al. Phenolic compounds from red wine and coffee are associated with specific intestinal microorganisms in allergic subjects[J]. Food & Function, 2015, 7(1): 104-109. DOI:10.1039/C5FO00853K.
[4] MLCEK J, JURIKOVA T, SKROVANKOVA S, et al. Quercetin and its anti-allergic immune response[J]. Molecules, 2016, 21(5): 623. DOI:10.3390/molecules21050623.
[5] PLUNDRICH N J, BANSODE R R, FOEGEDING E A, et al. Proteinbound vaccinium fruit polyphenols decrease IgE binding to peanut allergens and RBL-2H3 mast cell degranulation in vitro[J]. Food & Function, 2017, 8(4): 1611-1621. DOI:10.1039/c7fo00249a.
[6] 崔永明, 余龙江, 敖明章, 等. 甘草总黄酮对油脂抗氧化作用研究[J]. 食品科学, 2007, 28(11): 119-121. DOI:10.3321/j.issn:1002-6630.2007.11.023.
[7] 谢松梅, 崔慧斐. 甘草酸的研究进展[J]. 食品与药品, 2006, 8(3): 1-5. DOI:10.3969/j.issn.1672-979X.2006.03.001.
[8] 刘丽萍, 任翠爱, 赵宏艳. 甘草酸的免疫调节作用研究进展[J]. 中国实验方剂学杂志, 2010, 16(6): 272-276. DOI:10.3969/j.issn.1005-9903.2010.06.085.
[9] 安春耀, 李昌玲, 刘德山. 甘草酸干预炎症信号通路新进展[J]. 云南中医中药杂志, 2017, 38(9): 73-76. DOI:10.3969/j.issn.1007-2349.2017.09.034.
[10] 徐艳峰, 侯粉霞, 杨慧芳, 等. Wistar大鼠的自发肿瘤病变及其发生率[J]. 中国实验动物学报, 2014, 22(2): 75-79. DOI:10.3969/j.issn.1005-4847.2014.02.017.
[11] PASSANTE E, FRANKISH N. The RBL-2H3 cell line: its provenance and suitability as a model for the mast cell[J]. Inflammation Research, 2009, 58(11): 737-745. DOI:10.1007/s00011-009-0074-y.
[12] DENG Z, ZINK T, CHEN H Y, et al. Impact of actin rearrangement and degranulation on the membrane structure of primary mast cells: a combined atomic force and laser scanning confocal microscopy investigation[J]. Biophysical Journal, 2009, 96(4): 1629-1639. DOI:10.1016/j.bpj.2008.11.015.
[13] SANCHEZ-MIRANDA E, IBARRA-SANCHEZ A, GONZALEZESPINOSA C. Fyn kinase controls FcεRI receptor-operated calcium entry necessary for full degranulation in mast cells[J]. Biochemical and Biophysical Research Communications, 2010, 391(4): 1714-1720. DOI:10.1016/j.bbrc.2009.12.139.
[14] ZHOU Cui, LUDMILA T, SUN Na, et al. BALB/c mice can be used to evaluate allergenicity of different food protein extracts[J]. Food & Agricultural Immunology, 2016, 27(5): 589-603. DOI:10.1080/09540105. 2015.1129600.
[15] WANG Jing, SUN Na, ZHOU Cui, et al. Food proteins from different allergen families sensitize BALB/c mice to family-specific immune responses[J]. Journal of Immunotoxicology, 2014, 11(2): 172-179. DOI:10.3109/1547691x.2013.819053.
[16] 陈晨, 孙拿拿, 李永宁, 等. 食物致敏性评价RBL-2H3细胞模型的研究[J]. 实用预防医学, 2018, 25(5): 513-516. DOI:10.3969/j.issn.1006-3110.2018.05.001.
[17] 潘雪刁, 朱邦豪, 马丽, 等. 灯盏花素对人脐静脉内皮细胞胞内Ca2+水平的调控作用[J]. 中国药理学通报, 2007, 23(5): 672-677. DOI:10.3321/j.issn:1001-1978.2007.05.028.
[18] 申婷婷, 杨举, 王宫, 等. 基于免疫印迹定量分析的总蛋白提取方法比较[J]. 生物技术, 2018, 28(4): 366-371.
[19] 郭胤仕, 许以平, 徐艳华. 过敏原对支气管哮喘患者Th1/Th2作用影响的研究[J]. 中国免疫学杂志, 2008(2): 179-183; 187.
[20] 李宏伟, 刘玉新. 实用医药基础[M]. 浙江: 浙江大学出版社, 2006: 34.
[21] 温禾, 姚煦. 抗组胺药物的抗炎特性[J]. 中华临床免疫和变态反应杂志, 2017, 11(1): 69-73. DOI:10.3969/j.issn.1673-8705.2017.01.013.
[22] 梅丹, 郭翠玲, 李大魁, 等. 色甘酸钠的药理及应用新进展[J]. 中国药房, 1998, 9(3): 135-136.
[23] FENG L, ZHU M M, ZHANG M H. Protection of glycyrrhizic acid against AGEs-induced endothelial dysfunction through inhibiting RAGE/NF-κB pathway activation in human umbilical vein endothelial cells[J]. Journal of Ethnopharmacology, 2013, 148(1): 27-36. DOI:10.1016/j.jep.2013.03.035.
[24] COHEN R, HOLOWKA D A, BAIRD B A. Real-time imaging of Ca2+ mobilization and degranulation in mast cell[M]. New York: Humana Press, 2015: 347-363.
[25] SOBRADILLO D, HERNÁNDEZMORALES M, UBIERNA D, et al. A reciprocal shift in transient receptor potential channel 1 (TRPC1) and stromal interaction molecule 2 (STIM2) contributes to Ca2+ remodeling and cancer hallmarks in colorectal carcinoma cells[J]. Journal of Biological Chemistry, 2014, 289(42): 28765-28782. DOI:10.1074/jbc.M114.581678.