绿豆(Vigna radiata (L.) Wilczek)是我国主要杂粮作物之一,含有丰富的蛋白质、淀粉、纤维素、矿物质以及人体所需的必需氨基酸[1-2],其中蛋白质量分数达19.5%~33.1%[3]。目前,我国对绿豆的工业化加工多用于淀粉、粉丝等产品的制取,其副产物绿豆蛋白多是作为生产废料或牲畜饲料,造成了蛋白资源的浪费和环境污染[4]。近年来的研究发现食源性蛋白肽因其具有抗氧化、降血压、抗菌、抗肿瘤、预防癌症、调节免疫等生物活性功能从而吸引了广大学者的关注[5-10]。有研究表明,食源性蛋白肽具有免疫活性,可提高机体免疫力、增强巨噬细胞的增殖和吞噬能力,降低疾病的 发生[11]。有研究发现肽的生物活性与其分子质量、氨基酸序列等有关,王鹏[12]从榛仁蛋白水解物中提取的肽段Pro-Glu-Asp-Glu-Phe-Arg在适当浓度下可提高淋巴细胞增殖率,提高机体免疫能力。武文佳[13]研究发现经分级后的小麦胚芽蛋白水解物分子质量越低,免疫效果越好。Yoshikawa等[14]分别从大豆水解物和大米清蛋白水解物中筛选出免疫肽段,并推测含有Pro、Arg氨基酸的肽段具有较好的免疫效果。
本课题组前期研究发现绿豆肽具有免疫活性,为了得到具有较高活性的绿豆免疫肽,本实验以绿豆肽为原料,采用葡聚糖凝胶G-15进行层析分离,将不同级分绿豆肽分别作用于RAW264.7细胞,分析不同细胞处理组的吞噬能力、核酸、糖原、细胞因子等免疫活性指标,筛选出具有较高活性的免疫肽级分,并对其进行结构分析,以期为进一步阐明绿豆肽的免疫调节作用机制提供技术支撑,也为绿豆肽在食品保健及医药领域的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
绿豆蛋白粉 山东招远市温记食品有限公司;碱性蛋白酶 丹麦诺维信公司;葡聚糖凝胶SephadexG-15 上海宝曼生物科技有限公司;胎牛血清、青链霉素混 合液 北京索莱宝生物科技有限公司;DMEM高糖培养基/改良杜氏伊格尔培养基 上海慧颖生物科技有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS) 北京梦怡美生物科技有限公司;胰蛋白酶、细胞培养皿 美国赛默飞世尔科技有限公司;无水乙醇(分析纯) 天津市科密欧化学试剂有限公司;吖啶橙荧光染色试 剂盒 北京吉美生物技术有限公司;过碘酸席夫染色液试剂盒 安徽雷根生物技术公司。
1.2 仪器与设备
细胞培养箱 上海玺恒实业有限公司;数显恒温水浴锅 常州荣冠实验分析仪器厂;超净工作台 郑州 宏朗仪器设备有限公司;低速离心机 张家港市凯迪机械有限公司;高速冷冻离心机 北京时代北利离心机有限公司;电子显微镜 深圳市博视达光学仪器有限公司;HG-9707电脑紫外检测仪、DLH-2电脑恒流泵、BSZ-160F电脑自动部分收集器 上海精科实业有限 公司;API 3000型三重四极杆质谱仪 美国AB SCIEX公司;荧光显微镜 上海天省仪器有限公司。
1.3 方法
1.3.1 绿豆肽的制备
实验室自行制备绿豆肽,将购买的绿豆蛋白粉配制成质量分数为7%的样品溶液,用1 mol/L的NaOH溶液调pH值至8.5,加入质量分数1%碱性蛋白酶后于55 ℃水浴搅拌,用1 mol/L的NaOH溶液使pH值保持恒定,当水解度达到25%时终止水解,调节pH值至7.0,并在搅拌中迅速升温至95 ℃,保持10 min使酶失活,获得绿豆肽溶液,冷冻干燥备用。
1.3.2 绿豆肽的分级
采用Sephadex G-15层析凝胶柱进行分离,凝胶柱规格为1 cmh 40 cm,样品上样量2 mL,样品质量浓度为0.1 g/mL,以蒸馏水为流动相,流速1 mL/min,洗脱5 h,220 nm波长处(HG-9707紫外检测器)检测出峰情况,收集不同洗脱时间的绿豆肽溶液,冷冻干燥备用。采用Collection Microsoft软件进行数据分析,计算峰面积。
1.3.3 不同级分绿豆肽对RAW264.7细胞增殖率的影响
RAW264.7巨噬细胞以1h 105 个/mL的浓度接种到96 孔板,在37 ℃、5% CO2的培养条件下预培养2 h后,分别加入质量浓度为200 mg/mL分级后的绿豆肽溶液,以等体积的PBS作为空白对照,培养4 h后直接加入20 μL中性红染色液,细胞培养箱内孵育2 h,除去含有中性红染色液的培养液,加入200 μL中性红检测裂解液,室温摇床裂解10 min后于690 nm波长处测定吸光度。
1.3.4 不同级分绿豆肽对巨噬细胞糖原的影响
取细胞板,将固定好的各组分巨噬细胞固定液甩净,滴加蒸馏水至覆盖细胞爬片,清洗3~4 次,每次5 min。去除蒸馏水,滴加高锰酸钾溶液氧化10 min。去除残液,滴加蒸馏水浸泡5 min。去除残液,滴加席夫染液染色15 min后,蒸馏水清洗3~4 次,每次5 min,去除残液,以苏木精复染1 min,自来水反蓝5 min。染色完成后,依次以体积分数75%、85%、95%乙醇溶液和无水乙醇(分析纯)、无水乙醇(色谱纯)浸泡,每次浸泡1 min,取出,于干净的载玻片上滴加一滴甘油乙醇,将细胞爬片倒扣于载玻片上,显微镜观察染色结果。
1.3.5 不同级分绿豆肽对RAW264.7巨噬细胞核酸的影响
分别取不同组分的巨噬细胞于干净的载玻片上,加入适量95%乙醇溶液固定细胞5 min,滴加2 滴质量分数0.01%吖啶橙染液,染色5 min后盖上盖玻片,吸去盖玻片周围多余液体,在荧光显微镜下选择蓝色激发光滤片观察染色情况。
1.3.6 不同级分绿豆肽对巨噬细胞的细胞因子的影响
取对数生长期巨噬细胞按照1h 105 个/孔的数目接种至6 孔板中,置于37 ℃、5%的CO2培养条件下预培养24 h,设置空白组、LPS刺激组、不同级分绿豆肽组,不同级分绿豆肽组每孔加入20 μL质量浓度为200 mg/mL的不同级分绿豆肽,LPS刺激组加入20 μL质量浓度为200 μg/mL的LPS溶液,空白组加入等体积PBS,相同条件下培养24 h后收集上清液,按照白细胞介素(interleukin,IL)-6、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒说明书操作,测定各细胞因子水平。
1.3.7 不同级分绿豆肽对LPS刺激巨噬细胞的细胞因子分泌量的影响
取对数生长期巨噬细胞按照1h 105 个/孔的数目接种至6 孔板中,置于37 ℃、5% CO2培养条件下预培养24 h,设置空白组、LPS刺激组、不同级分绿豆肽抑制组,不同级分绿豆抑制肽组每孔加入20 μL质量浓度为200 mg/mL的不同级分绿豆肽,然后加入20 μL质量浓度为200 μg/mL的LPS溶液,LPS刺激组加入20 μL质量浓度为200 μg/mL的LPS溶液后再加入20 μL PBS,空白组加入40 μL PBS,相同条件下培养24 h后收集上清液,按照IL-6、IL-1β、TNF-α的ELISA试剂盒说明书操作,测定各细胞因子水平。
1.3.8 绿豆肽的结构鉴定
参照吴芳玲等[15]的方法测定绿豆肽的结构。
1.4 数据统计与分析
所得数据均为重复实验平均值,采用Statistix 8软件对数据进行分析,平均值之间显著性差异(P<0.05)通过Tukey HSD进行多重比较分析。采用SigmaPlot 13.0和Excel 6.0软件作图。
2 结果与分析
2.1 SephadexG-15层析分离绿豆肽
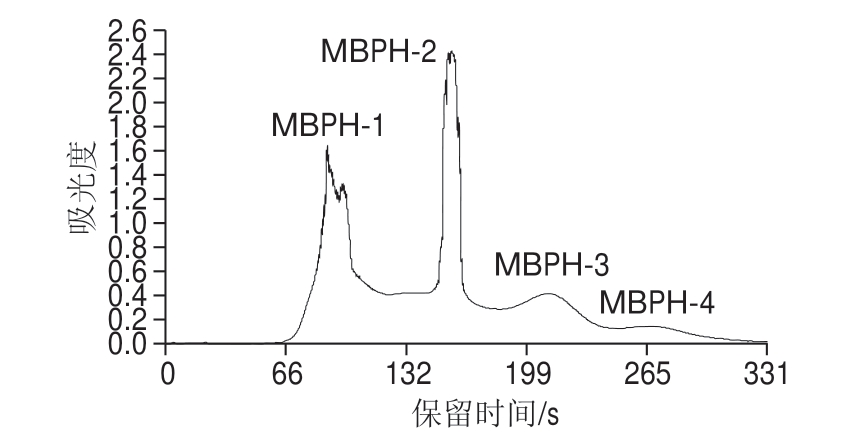
图 1 绿豆肽分级层析谱图
Fig. 1 Chromatographic separation of mung bean peptides
由图1可知,绿豆肽被分成4 个级分MBPH-1、MBPH-2、MBPH-3和MBPH-4,根据葡聚糖凝胶分离性质可知不同级分绿豆肽的分子质量由大到小为MBPH-1>MBPH-2>MBPH-3>MBPH-4。采用Collection Microsoft软件对峰面积进行计算,结果如下:MBPH-1(2 400.58)、MBPH-2(2 294.41)、MBPH-3(1 165.28)、MBPH-4(420.00),其中MBPH-4级分绿豆肽量较少,不足以进行后续分析,遂与MBPH-3级分绿豆肽合并,统一归为MBPH-3级分。
2.2 不同级分绿豆肽对RAW264.7细胞增殖率的影响
表 1 不同级分绿豆肽以及未分级绿豆肽对巨噬细胞增殖率的影响
Table 1 Effect of mung bean protein hydrolysate and separated peptides on the proliferation rate of macrophages
注:同行肩标小写字母不同表示差异显著(P<0.05)。
组别 MBPH-1组 MBPH-2组 MBPH-3组 未分级绿豆肽组增殖率/% 1.460f 0.003c 2.280f 0.017b 9.050f 0.192a 0.630f 0.004c
表1反映不同级分绿豆肽对巨噬细胞增殖率的影响,由实验结果可知,不同处理组绿豆肽均对巨噬细胞增殖有促进效果,且呈梯度增加,巨噬细胞增殖率由低到高依次是未分级绿豆肽<MBPH-1<MBPH-2<MBPH-3,其中MBPH-3级分促进效果最佳,MBPH-3组的增殖率为9.050%,相比MBPH-2、MBPH-1、未分级绿豆肽组分别增高6.77%、7.75%、8.42%,已有研究表明,巨噬细胞增殖能力可以作为评估巨噬细胞是否活化的重要指标[16]。当巨噬细胞受到刺激因子、表皮生长因子、肿瘤促进因子等生长因子诱导的情况下会促使巨噬细胞增殖[17]。综上所述,不同级分绿豆肽以及未分级的绿豆肽均对巨噬细胞无毒害作用,能够促进巨噬细胞活化,提高免疫力,且MBPH-3绿豆肽促进效果最优。
2.3 不同级分绿豆肽对RAW264.7巨噬细胞糖原的影响
巨噬细胞中的糖类物质经过碘酸氧化形成双醛基,醛基又与席夫试剂中的无色品红结合,形成紫红色物质,附着于含有多糖类的包浆中,染色的深浅可直接反映糖类物质的含量。由图2可知,LPS刺激组和不同级分绿豆肽组细胞内紫红色结块偏多,染色程度加深,此时细胞内糖原含量升高,空白组细胞内颗粒分散稀疏。不同级分绿豆肽组糖原含量相比空白组差异显著 (P<0.05),其中MBPH-3级分促进效果最佳。巨噬细胞是一种非特异性免疫细胞,在免疫系统中发挥着至关重要的作用[18],也有研究表明免疫细胞在受到外界刺激时会迅速改变糖代谢方式以便产生炎症因子抵抗外界抗原刺激[19]。综上所述,不同级分绿豆肽可促进巨噬细胞改变代谢方式,使糖原含量升高,从而促进炎症因子的释放,调节细胞免疫活性。

图 2 不同级分绿豆肽对巨噬细胞糖原的影响(×200)
Fig. 2 Effects of mung bean peptides on glycogen in macrophages (× 200)
2.4 不同级分绿豆肽对RAW264.7巨噬细胞核酸的影响

图 3 不同级分绿豆肽对巨噬细胞核酸的影响(×400)
Fig. 3 Effects of mung bean peptides on nucleic acids in macrophages (× 400)
体积分数95%乙醇溶液可改变巨噬细胞膜通透性,吖啶橙可嵌入核酸双链的碱基对之间,从而与DNA结合,于530 nm波长处荧光发射峰下呈现黄绿色荧光;带正电荷的吖啶橙与带负电荷的单链核酸的磷酸根产生静电吸引结合,在640 nm波长处荧光发射峰下呈现红绿色荧光。如图3所示,LPS刺激组与不同级分绿豆肽组细胞体积变大、突触长而粗,核内的DNA呈黄绿色,基质内的RNA呈红绿色,相比空白组荧光强度明显增强,其中MBPH-3级分绿豆肽促进效果最佳。有研究表明核酸代谢活性的增强有利于激活巨噬细胞各种生命活动。综上所述,不同级分绿豆肽可促进核酸的代谢,提高巨噬细胞的活性,从而调节免疫功能,结果显示MBPH-3级分促进效果更为明显。
2.5 不同级分绿豆肽对小鼠巨噬细胞细胞因子的影响

图 4 不同级分绿豆肽对巨噬细胞细胞因子的影响
Fig. 4 Effects of mung bean peptides on macrophage cytokine secretion
细胞因子是由免疫细胞和某些非免疫细胞经刺激而合成分泌的一类具有广泛生物学活性的小分子蛋白,具有调节天然免疫、获得性免疫、细胞生长和损伤组织修复等多种功能[20]。图4反映了不同级分绿豆肽对巨噬细胞细胞因子IL-6、IL-1β和TNF-α分泌量的影响。IL-6是在感染和损伤刺激下产生的一种多效性细胞因子,能调节多种细胞功能,包括细胞增殖、细胞分化、免疫防御机制等,主要由淋巴细胞、巨噬细胞等细胞分泌[21]。由图4 可知,LPS刺激组的IL-6分泌量明显高于空白组以及不同级分绿豆肽组,这是由于LPS刺激巨噬细胞,导致巨噬细胞活化,从而上调了细胞因子IL-6的表达。不同级分绿豆肽组间对比发现,MBPH-1、MBPH-2、MBPH-3绿豆肽都具有提高IL-6分泌的能力,且MBPH-3组细胞因子分泌量高于其他组分,分泌量为1 566.47 pg/mL。IL-1β是内皮细胞活化因子,是一种起免疫调节作用的激素样肽类物质,即为炎症前期细胞因子,主要由活化的吞噬细胞产生,在免疫应答中起着重要作用[22]。由图4可以看出,不同级分绿豆肽组可促进巨噬细胞分泌IL-1β,其中MBPH-3组促进效果最佳,但分泌量显著低于LPS刺激组,是因为LPS作为内毒素其刺激性强于不同级分绿豆肽组,所以分泌量高于其他级分绿豆肽组。TNF-α由多核巨噬细胞产生,是一种具有广泛生物活性能直接杀伤肿瘤细胞且对正常细胞无明显毒性的细胞因子,是迄今为止所发现的直接杀伤肿瘤作用最强的生物活性因子之一[23]。由图4可知,不同级分绿豆肽刺激组TNF-α的分泌量趋势与IL-6、IL-1β相似,且MBPH-3组的细胞因子分泌量高于其他级分绿豆肽组,但低于LPS刺激组细胞因子分泌量,MBPH-1、MBPH-2、MBPH-3组TNF-α分泌量分别为565.16、537.63、828.13 pg/mL,均高于空白组 (436.18 pg/mL),显著低于LPS刺激组。综上分析,不同级分绿豆肽可以通过促进促炎因子IL-6、IL-1β和TNF-α的分泌,从而在促炎途径中发挥免疫调节作用。
2.6 不同级分绿豆肽对LPS刺激巨噬细胞细胞因子的影响

图 5 不同级分绿豆肽对LPS刺激巨噬细胞细胞因子的影响
Fig. 5 Effects of mung bean peptides on cytokine secretion in macrophage stimulated by LPS
图5反映的是不同级分绿豆肽对LPS诱导的巨噬细胞细胞因子(IL-6、IL-1β、TNF-α)分泌量的影响。LPS刺激组的IL-6、IL-1β、TNF-α分泌量显著高于不同级分绿豆肽处理组以及空白组,而不同级分绿豆肽对LPS刺激的巨噬细胞细胞因子分泌水平有一定的抑制效果,且MBPH-3处理组抑制能力最佳,其TNF-α、IL-1β和IL-6分泌量分别为2 152.94、1 058.81、859.96 pg/mL,相比LPS刺激组(2 923.19、3 707.09、2 880.74 pg/mL)有一定抑制作用。这表明不同级分绿豆肽可抑制LPS刺激巨噬细胞分泌炎症因子,可推断在机体受到外界刺激时,不同级分绿豆肽可通过拮抗炎症的作用发挥免疫调节功能。刘效森等[24]研究表明补充生物活性肽QRPR可以抵御LPS刺激RAW264.7细胞引起的炎症反应作用。这与本研究结果一致。
2.7 高免疫活性绿豆肽结构鉴定结果
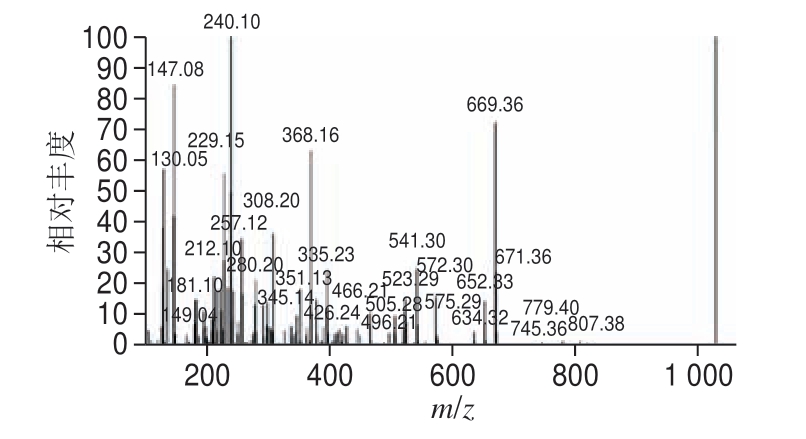
图 6 MBPH-3的一级质谱图
Fig. 6 Mass spectrum of MBPH-3
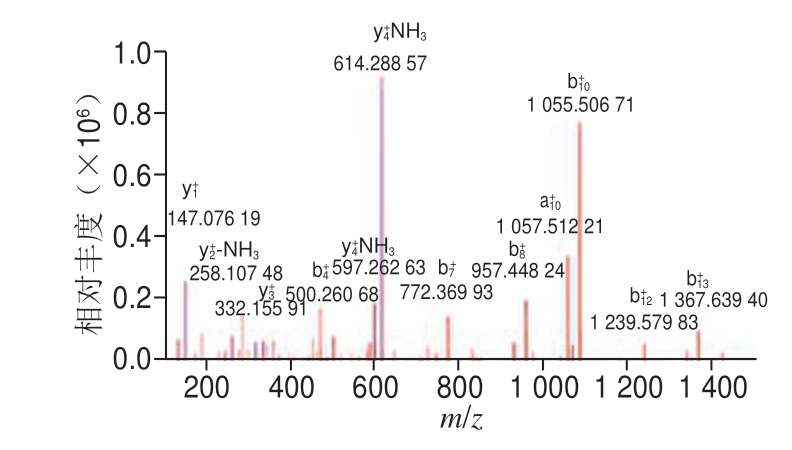
图 7 MBPH-3的二级质谱图
Fig. 7 Tandem mass spectrum of MBPH-3
质谱法是多肽结构确证的重要手段,用质谱法测定肽类的相对分子质量及进行序列分析具有分析速度快、步骤简单、用量、结果准确等优点[25-27]。图6、7为MBPH-3绿豆肽质谱图,根据b离子片段和y离子片段可推算出C端、N端氨基酸分子质量分别为132、132、181、75 Da和115、119、149 Da,通过氨基酸分子质量推测氨基酸序列为Asn-Asn-Tyr-Gly-Pro-Thr-Met,其分子质量为903 Da。
3 讨 论
食源性蛋白肽的分子质量与其生物活性有关,王璐等[28]的研究也证实蛋白水解物分子质量与其免疫活性存在一定的关系,其中分子质量小于1 000 Da的水解物其免疫活性较强。且研究还发现含有疏水性氨基酸的肽段免疫效果极佳[29]。本实验结果得出绿豆肽的分子质量与其活性呈负相关,且具有较高活性的绿豆肽级分中含有酪氨酸、甘氨酸和脯氨酸等疏水性氨基酸。这与王璐[28]和阮晓慧[29]等的研究结果一致。
有研究发现食源性蛋白肽对机体的先天免疫和适应性免疫反应均有不同程度的免疫调节作用,其可诱导或调节细胞因子和抗体的产生,增强巨噬细胞活力,刺激淋巴细胞增殖等,抑制宿主细胞对LPS诱导的炎症反应,从而提高机体的免疫能力。本实验得出不同级分绿豆肽可提高机体的非特异性免疫反应,可刺激巨噬细胞增殖,而且绿豆肽分子质量越小,其增殖率越高;而且小分子质量绿豆肽处理组的巨噬细胞糖原含量,核酸代谢水平均优于空白组和LPS刺激组,这些研究结果均表明绿豆肽可显著活化巨噬细胞,刺激其增殖,并提高细胞的核酸代谢水平,且小分子质量绿豆肽的效果尤为明显,这就表明绿豆肽的免疫活性与其分子质量紧密相关。而且细胞因子研究结果也发现绿豆肽可以增强巨噬细胞的IL-6、IL-1β和TNF-α等细胞因子的表达量,但其表达量均显著低于LPS刺激组;与其他处理组相比,MBPH-3级分的细胞因子表达量较高。绿豆肽可激活巨噬细胞,发挥免疫活性,但其不会引起机体的炎症反应,并且这与绿豆肽的分子质量具有一定的相关性;通过绿豆肽对LPS诱导巨噬细胞的细胞因子表达研究结果发现,绿豆肽可显著抑制LPS诱导巨噬细胞促炎细胞因子的表达,且MBPH-3级分的抑制效果最佳。以上研究均说明绿豆肽可增强正常巨噬细胞的活力,提高其抗感染性;同时,绿豆肽对于炎性细胞又可发挥拮抗炎症的作用,且绿豆肽的免疫活性与其分子质量具有相关性。
有研究表明具有较高免疫活性的食源性蛋白肽大都包含2~10 个氨基酸序列,且具有一定的疏水性。MBPH-3级分的鉴定结果得出其分子质量为903 Da,氨基酸序列为Asn-Asn-Tyr-Gly-Pro-Thr-Met的七肽。有研究发现免疫调节肽的常见残基是疏水氨基酸,如甘氨酸(Gly)、脯氨酸等(Pro)、苯丙氨酸(Phe)、谷氨酸(Glu)、酪氨酸(Tyr)等,而且疏水氨基酸和谷氨酰胺、酪氨酸(Tyr)、半胱氨酸(Cys)、天冬酰胺(Asn)的一个或多个残基促进了食源性蛋白肽的免疫活性[30-31]。本实验结果进一步证实蛋白肽的氨基酸序列在2~10 个之间具有较高的免疫活性,且含有较高疏水性氨基酸残基的肽级分其免疫活性也强。
综上所述,绿豆肽具有免疫调节能力,免疫活性与其肽级分呈一定的相关性,分子质量为903 Da的肽链免疫活性较高,该级分能增强巨噬细胞增殖能力、促进核酸合成以及糖酵解的进行,可激活正常巨噬细胞的细胞因子IL-6、L-1β和TNF-α的表达,又能抑制LPS诱导产生IL-6、L-1β和TNF-α等细胞因子。其中,具有较高免疫活性的MBPH-3级分中主要氨基酸序列为Asn-Asn-Tyr-Gly-Pro-Thr-Met。
[1] KEONG Y S, KEE B B, YONG H W, et al. In vivo antioxidant and hypolipidemic effects of fermented mung bean on hypercholesterolemic mice[J]. Evidence-Based Complementary and Alternative Medicine, 2015, 2015: 1-6. DOI:10.1155/2015/508029.
[2] TIAN Qian, ZHANG Wenlan, LI Qun, et al. Research progress of quality characteristics and comprehensive utilization of mung beans[J]. Agricultural Science & Technology, 2017, 18(1): 127-133; 136.
[3] MENDOZA E M T, ADACHI M, BERNARDO A E N, et al. Mungbean [Vigna radiata (L.) Wilczek] globulins: purification and characterization[J]. Journal of Agricultural and Food Chemistry, 2001, 49(3): 1552-1558. DOI:10.1021/jf001041h.
[4] 张会娟, 胡志超, 吕小莲, 等. 我国绿豆加工利用概况与发展分析[J]. 江苏农业科学, 2014, 42(1): 234-236.
[5] 毛晶, 王鹏, 王祖浩, 等. 松仁谷蛋白抗氧化肽的分离纯化及一级结构鉴定[J]. 食品科学, 2017, 38(3): 59-63. DOI:10.7506/spkx1002-6630-201703010.
[6] YATHISHA U G, ISHANI B, IDDYA K, et al. Antihypertensive activity of fish protein hydrolysates and its peptides[J]. Critical Reviews in Food Science and Nutrition, 2019, 59(15): 2363-2374. DOI:10.1080/10408398.2018.1452182.
[7] BECHINGER B, GORR S U. Antimicrobial peptides[J]. Journal of Dental Research, 2017, 96(3): 254-260. DOI:10.1177/0022034516679 973.
[8] 王鹏, 王明爽, 刘春雷, 等. 榛仁免疫活性肽分离纯化及结构鉴定[J]. 食品科学, 2018, 39(3): 200-205. DOI:10.7506/spkx1002-6630-201803031.
[9] YAO Y, CHEN F, WANG M F, et al. Antidiabetic activity of mungbean extracts in diabetic KK-AYMICE[J]. Journal of Agricultural and Food Chemistry, 2008, 56: 8869-8873. DOI:10.1021/jf8009238.
[10] CIAN R E, LÓPEZ-POSADAS R, DRAGO S R, et al. A Porphyra columbina hydrolysate upregulates IL-10 production in rat macrophages and lymphocytes through an NF-kB, and p38 and JNK dependent mechanism[J]. Food Chemistry, 2012, 134: 1982-1990. DOI:10.1016/j2013.03.134.
[11] 滕婷, 林慧敏, 张丽芬, 等. 活性肽免疫调节作用的研究进展[J]. 医学理论与实践, 2012, 25(13): 1575-1577; 1579.
[12] 王鹏. 榛仁免疫活性肽结构解析及其对炎症反应的免疫调节作用[D]. 长春: 吉林农业大学, 2018: 17-18.
[13] 武文佳. 小麦胚芽蛋白的免疫活性评价及球蛋白免疫活性肽的结构鉴定与机理研究[D]. 广州: 华南理工大学, 2017: 22-23.
[1 4] Y O S H I K A W A M, K I S H I K, T A K A H A S H I M, e t a l. Immunostimulating peptide derived from soybean protein[J]. Annals of the New York Academy of Sciences, 2010, 685(1): 375-376. DOI:10.1111/j.1749-6632.1993.tb35892.x.
[15] 吴芳玲, 储艳秋, 陈新, 等. 电喷雾电离质谱法研究影响五肽间非共价作用的主要因素[J]. 高等学校化学学报, 2018, 39(9): 1927-1933.
[16] 叶蕾, 阎洁, 张文, 等. 文蛤寡肽对RAW264.7细胞的免疫调节 作用[J]. 水产学报, 2019, 43(2): 410-418.
[17] 王科, 庞辉, 梁春梅, 等. 不同剂量异鼠李素对炎症损伤小鼠巨噬细胞RAW264.7增殖能力的影响及其机制探讨[J]. 山东医药, 2018, 58(39): 48-51.
[18] HUANG Q, WANG T, WANG H Y. Ginsenoside Rb2 enhances the anti-inflammatory effect of ω-3 fatty acid in LPS-stimulated RAW264.7 macrophages by upregulating GPR120 expression[J]. Acta Pharmacologica Sinica, 2017, 38(2): 192-200. DOI:10.1038/aps.2016.135.
[19] 吉甜甜. 巨噬细胞极化与记忆性T细胞维持中的糖原代谢调控及作用研究[D]. 武汉: 华中科技大学, 2017: 5-6.
[20] 吴晓勇, 李冬云, 陈信义. 细胞因子网络调控与免疫性血小板减少性紫癜相关性研究[J]. 现代生物医学进展, 2009, 9(7): 1369-1372.
[21] 朱俊宇, 范霞, 梁华平. AhR调控炎性细胞因子的研究进展[J]. 免疫学杂志, 2017, 21(1): 73-77.
[22] 董海玲. 白三烯B4、5-羟色胺和白介素-1β在玫瑰糠疹中的表达及意义[D]. 石家庄: 河北医科大学, 2008: 12-13.
[23] 李世芳, 刘泽众, 常惠芸. 细胞因子佐剂研究进展[J]. 中国畜牧兽医, 2017, 44(1): 296-301.
[24] 刘效森, 王仕凯, 王依楠, 等. 补充生物活性肽QRPR对巨噬细胞RAW264.7抵御脂多糖刺激的作用[J]. 中国生物制品学杂志, 2018, 31(6): 613-616.
[25] 白进发, 刘志强, 刘宁, 等. 合成多肽的电喷雾质谱研究[J]. 分析化学, 2005, 33(5): 661-664.
[26] 王英武, 王玲, 顾景凯, 等. 电喷雾-串联四极杆-飞行时间质谱法分析寡肽的一级结构[J]. 分析化学, 2003(6): 709-712.
[27] 崔勐, 刘志强, 宋凤瑞, 等. 气相条件下金属离子/肽复合物电喷雾串联质谱研究[J]. 高等学校化学学报, 2001, 22(7): 1111-1113.
[28] 王璐, 陈月华, 许宙, 等. 大米免疫活性肽水解用酶的筛选[J]. 食品与机械, 2015, 31(2): 38-42.
[29] 阮晓慧, 韩军岐, 张润光, 等. 食源性生物活性肽制备工艺、功能特性及应用研究进展[J]. 食品与发酵工业, 2016, 42(6): 248-253.
[30] HE X Q, CAO W H, PAN G K, et al. Enzymatic hydrolysis optimization of Paphia undulate and lymphocyte proliferation activity of the isolated peptide fractions[J]. Journal of the Science of Food and Agriculture, 2015, 95(7): 1544-1553. DOI:10.1002/jsfa.6859.
[31] CHALAMAIAH M, YU W L, WU J P. Immunomodulatory and anticancer protein hydrolysates (peptides) from food proteins: a review[J]. Food Chemistry, 2018, 245: 205-222. DOI:10.1016/j.foodchem.2017.10.087.