α-乳白蛋白(α-lactalbumin,α-LA)是一种由乳腺腺泡上皮合成的特殊蛋白质,广泛存在于人、牛、山羊、骆驼、马等哺乳动物的乳汁中[1]。α-LA由123 个氨基酸残基组成,其分子质量约为14.2 kDa[2]。α-LA在牛乳中的质量浓度为1.0~1.5 g/L[3],约占总蛋白的3.4%[4];在人乳中质量浓度为2~3 g/L[5],占总蛋白的25%~35%[6]。研究发现,α-LA具有合成乳糖[7]、抑菌[8]、抗病毒[9-11]、免疫调节[12]、抗氧化[13]、抗癌[14]等多种生物学功能。我国每年有大量新生儿需要以配方奶粉为主食[15],由于α-LA是人乳中的主要蛋白质,因此在婴儿配方奶粉中强化α-LA可以缩小牛乳喂养与母乳喂养的差距[16]。Davis等[17]研究发现与喂养标准配方奶粉的婴儿相比,α-LA强化配方奶粉喂养婴儿与母乳喂养婴儿的胃肠道耐受性更为相似,便秘或返流问题的发生率也随之降低。
从食品安全和婴儿健康的角度考虑,工厂会在乳粉生产时对其进行一定程度的加热[18],而在加工过程中所采用的加工工艺对于婴儿配方奶粉的营养、感官等都有影响,高热处理会对牛乳成分造成较大的热损伤,乳中乳糖异构化和降解、乳清蛋白变性、美拉德反应也更为严重[19]。α-LA作为一种热敏性成分,巴氏杀菌是否影响其生物活性尚不明确[20]。目前我国对α-LA在婴儿配方奶粉中的添加量没有具体规定,巴氏杀菌后的α-LA对肠道免疫机制方面的研究也鲜见报道。
本研究以α-LA为原料,探究经巴氏杀菌方式热处理后的α-LA对正常人肠道上皮细胞株(human intestinal epithelial cells,HIEC)免疫活性的影响变化,探讨巴氏杀菌后的α-LA对人肠道免疫作用可能的机制,从而掌握α-LA在婴儿配方奶粉中适宜添加的剂量范围,以及充分保持其免疫调节活性的热加工工艺技术参数,为进一步对新型α-LA强化婴儿配方奶粉加工工艺提供参考。
1 材料与方法
1.1 材料与试剂
牛α-LA(纯度99%) 美国HILMAR公司;HIEC 北纳生物细胞公司;RPMI-1640完全培养基、胰酶、0.25%乙二胺四乙酸 美国GIBCO公司;胎牛血清 以色列B I 公司;H a n k’s 液、二甲基亚砜 北京BioTopped公司;青霉素-链霉素溶液(100×)、胃蛋白酶、胰蛋白酶(≥250 U/mg) 北京Solarbio生物科技有限公司;细胞凋亡检测试剂盒、细胞周期试剂盒、Cell Counting Kit-8(CCK-8)试剂盒 南京建成生物科技有限公司;其余化学试剂均为国产分析纯。
1.2 仪器与设备
HF90型CO2培养箱 北京市六一仪器厂;BPG-9070A 型鼓风干燥箱 上海一恒科技有限公司;AE-31型 倒置显微镜 麦克奥迪实业集团有限公司;DSX-280B型 高压灭菌锅 上海申安公司; 血球计数板 上海求精生化试剂仪器有限公司;3K15型高速冷冻离心机 德国Sigma公司;BSA224S型分析天平 德国Sartorius公司;Airall流式细胞仪 美国BD公司;圆二色光谱仪 日本JASCO公司。
1.3 方法
1.3.1 α-LA的加热处理
以工厂常用的杀菌方式为依据,确定本实验所用的热处理方式为63 ℃处理30 min、72 ℃处理15 s、85 ℃处理15 s、95 ℃处理10 min。准确称量5 份α-LA,每份各1 g,加入去离子水10 mL并将其充分混合均匀,分别于63 ℃处理30 min、72 ℃处理15 s、85 ℃处理15 s、95 ℃处理10 min,另一份不做任何加热处理。热处理后所有α-LA样品保存于4 ℃备用。
1.3.2 模拟婴儿肠道消化α-LA
配制人工胃液:取稀盐酸用pH计调节至pH 4,每100 mL添加胃蛋白酶0.8 g(按每毫克蛋白消耗22.75 U计[21]); 将上述4 种经不同热处理与未经热处理的α-LA溶液分别与100 mL人工胃液混合,于37 ℃恒温摇床上以135 r/min消化水解1.5 h;经胃蛋白酶消化后的蛋白液用pH计调节至pH 6.5。
配制人工肠液:取磷酸二氢钾0.68 g加入到上述消化液中,混合均匀后再添加胆盐0.12 g[22]、胰蛋白酶1 g(按每毫克蛋白消耗3.45 U计[21]),不断振荡使其均匀混合;37 ℃恒温摇床上以135 r/min消化水解2 h,然后沸水浴5 min灭活,最后用0.22 μm滤器过滤除菌备用。得到的蛋白消化液通过真空冷冻干燥处理后,置于4 ℃保存备用[23-24]。
1.3.3 不同热处理方式的α-LA二级结构的测定
将63 ℃处理30 min、72 ℃处理15 s、85 ℃处理15 s、95 ℃处理10 min组与未经热处理的α-LA分别配制为蛋白质量浓度0.2 g/L的溶液,取2 mL。圆二色光谱仪扫描范围为190~250 nm,实验温度为20 ℃,样品池光程为2 mm,灵敏度为100 mdeg/cm,取8 次扫描的平均值。利用圆二色光谱仪测定α-LA的二级结构,采用曲线拟合软件[25-26]计算α-LA的二级结构中α-螺旋、β-折叠、 β-转角和无规卷曲的相对含量。
1.3.4 细胞培养和试剂配制
将HIEC复苏后,培养于含10%(质量分数,下同)胎牛血清以及1%青霉素-链霉素溶液(100×)的 RPMI-1640完全培养液中,并将细胞置于37 ℃含5% CO2的培养箱中,每2 d更换1 次培养液,待贴壁细胞达到80%左右时,按照25 cm2的培养瓶加入1 mL胰酶的比例加入适量胰酶消化,进行传代培养或细胞冻存。分别将63 ℃处理30 min、72 ℃处理15 s、85 ℃处理15 s、95 ℃处理10 min组与未经热处理的消化后α-LA用含有3%胎牛血清和1%青霉素-链霉素溶液(100×)的RPMI-1640培养液配制成0.01、0.05、0.10、0.15、0.20 mg/mL溶液,置于4 ℃保存备用。
1.3.5 不同热处理方式的α-LA对HIEC增殖的影响
将100 μL(1h 105 个/mL)处于对数生长期的HIEC接种到96 孔板中,培养24 h后,弃原培养液,分别将100 μL 0、0.01、0.05、0.10、0.15、0.20 mg/mL不同热处理及不经热处理的α-LA加入含3%胎牛血清的培养基中,每组设6 个复孔,培养48 h后,在避光状态下,向每孔中加入10 μL的CCK-8溶液,将培养板放回培养箱中再培养2 h后立即使用酶标仪测定在450 nm波长处的吸光度。计算不同质量浓度、不同热处理方式的α-LA作用HIEC后其增殖率的变化,从而筛选出效果较佳的两个样品质量浓度用于后续实验。以正常细胞为对照。细胞增殖率计算公式如下。
1.3.6 不同热处理方式的α-LA对HIEC周期的影响
用质量浓度为0.10、0.20 mg/mL不同热处理及不经热处理的α-LA分别处理HIEC 48 h后,按照细胞周期试剂盒说明书收集漂浮及贴壁细胞,用4 ℃磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤细胞后,加入4 ℃预冷的体积分数70%乙醇溶液,置于4 ℃固定24 h后,再用PBS洗涤细胞,向每组细胞样品中加入碘化丙啶(propidium iodide,PI)染色液0.5 mL,重悬,37 ℃避光温浴30 min,在488 nm波长处采用流式细胞仪检测,数据采用ModFit LT软件进行分析[27]。
1.3.7 不同热处理方式的α-LA对HIEC凋亡的影响
在6 孔细胞培养板上每孔接种5h 105 个对数生长期的HIEC,铺板24 h后,分别加入质量浓度为0.1、 0.2 mg/mL不同热处理及不经热处理的α-LA,48 h后按照细胞凋亡试剂盒说明书收集漂浮及贴壁细胞,用PBS洗涤1 次,随后向细胞样品中加入Annexin V-FITC结合液195 μL、Annexin V-FITC 5 μL,轻轻混匀,避光于室温下孵育15 min;加入PI染色液10 μL,混匀,避光染色5 min,1 h内采用流式细胞仪检测。
1.4 数据统计与分析
每组实验重复3 次。数据均使用Statistix 8软件进行分析,并用Origin 8.5软件作图,结果以平均值±标准差表示。P<0.05为差异显著。
2 结果与分析
2.1 不同热处理方式对α-LA二级结构的影响
圆二色光谱法广泛应用于蛋白质二级结构的测定,因具备测定快速、简便以及对构象变化灵敏等特点,成为目前蛋白质构象研究的主要手段之一。通过圆二色光谱测定不同热处理方式的α-LA二级结构相对含量结果见表1。
表 1 不同热处理方式的α-LA二级结构相对含量
Table 1 Secondary structure relative contents of α-LA treated by different heating methods
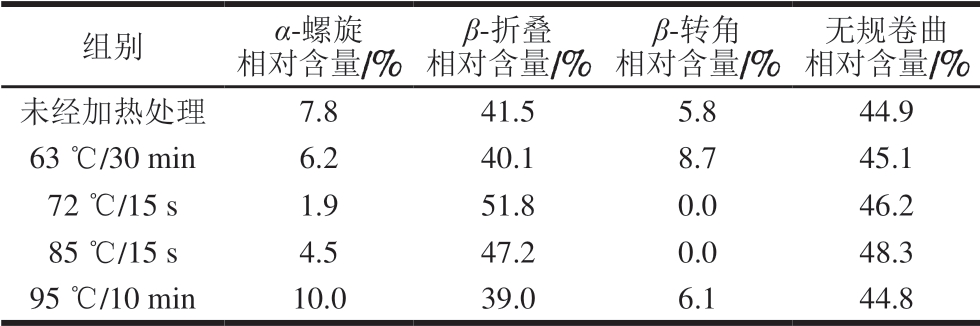
组别 α-螺旋相对含量/%β-折叠相对含量/%β-转角相对含量/%无规卷曲相对含量/%未经加热处理 7.8 41.5 5.8 44.9 63 ℃/30 min 6.2 40.1 8.7 45.1 72 ℃/15 s 1.9 51.8 0.0 46.2 85 ℃/15 s 4.5 47.2 0.0 48.3 95 ℃/10 min 10.0 39.0 6.1 44.8
由表1可知,未经加热处理的α-LA二级结构主要为β-折叠和无规卷曲,分别占41.5%和44.9%,经不同加热方式处理后,α-LA的二级结构相对含量在一定范围内发生了变化,其中,经72 ℃加热15 s的α-LA变化最明显。与未经加热处理组相比,经72 ℃加热15 s的α-LA的α-螺旋相对含量减少了5.9%,β-折叠和无规卷曲相对含量分别增加10.3%和1.3%,β-转角完全消失。经85 ℃加热15 s的α-LA的二级结构也发生明显改变。与未经加热处理组相比,经85 ℃加热15 s的α-LA α-螺旋相对含量减少了3.3%,β-折叠和无规卷曲相对含量分别增加5.7%和3.4%,β-转角完全消失。综上所述,在经72 ℃加热15 s和85 ℃加热15 s的α-LA中,全部β-转角以及部分α-螺旋转化为β-折叠和无规卷曲。经95 ℃加热10 min的α-LA各二级结构相对含量又恢复至未经加热处理组水平的趋势,这有待进一步研究。
2.2 不同热处理方式的α-LA对HIEC增殖的影响
细胞增殖是经过细胞生长、DNA复制和细胞分裂使细胞数目增加的过程。通过CCK-8法检测不同热处理方式及未经热处理的α-LA作用HIEC 48 h后的细胞增殖情况,结果如图1所示。
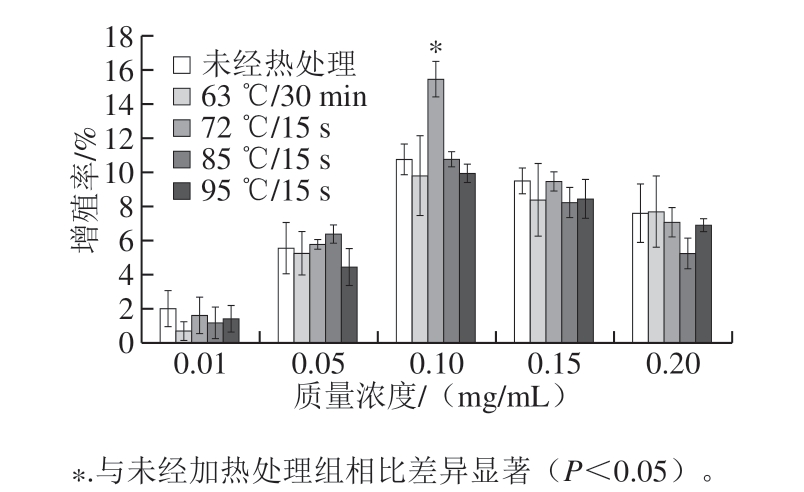
图 1 不同热处理方式的α-LA对HIEC增殖作用的影响
Fig. 1 Effect of α-LA with different heat treatments on the proliferation of HIEC
从图1可以看出,与未经加热处理组相比,经不同热处理方式及未经热处理的α-LA在0.01~0.20 mg/mL范围内作用HIEC 48 h后,对HIEC的增殖能力均有促进作用。在0.01~0.10 mg/mL质量浓度范围,细胞增殖率随着α-LA质量浓度的增加而逐渐上升,并且相同条件处理样品在不同质量浓度下细胞增殖率存在明显差异。在0.10~0.20 mg/mL质量浓度范围,随着α-LA质量浓度的增加,细胞增殖率反而逐渐降低,这可能是由于在高质量浓度下,一部分α-LA水解物结合在一起,不能完全发挥促进增殖的作用,这有待进一步的研究。不同热处理方式及未经热处理的α-LA均在质量浓度为0.10 mg/mL时达到最大增殖促进效果,其中,经过72 ℃处理15 s的α-LA对HIEC的增殖促进效果最佳,与未经加热处理的α-LA相比差异显著(P<0.05)。结果表明,HIEC数量的增加与α-LA质量浓度呈现出一定的剂量效应关系,达到最大增殖效果时,α-LA的质量浓度 为0.10 mg/mL,加热方式为72 ℃处理15 s。而通过分析不同加热方式对α-LA二级结构的变化结果可知,经72 ℃处理15 s的α-LA二级结构相对含量变化最明显,这可能是由于加热使α-LA促进细胞增殖的活性基团暴露,这有待进一步研究。
Izumi等[28]研究证实,α-LA的水解产物可以促进哺乳期大鼠的肠上皮隐窝细胞增殖,增加肠道长度,促进肠道生长和成熟。Lin等[29]研究发现低质量浓度α-LA可使小鼠单核巨噬细胞RAW 264.7细胞活力增强。 Sternhagen等[30]也得出类似的结果,即Caco-2细胞的增殖率可在低质量浓度的α-LA刺激下呈现上升趋势。
本研究为了进一步探讨α-LA促进HIEC增殖的机制是否与细胞周期、细胞凋亡相关,利用流式细胞术检测α-LA质量浓度为0.10、0.20 mg/mL时细胞周期与凋亡率的变化。
2.3 不同热处理方式的α-LA对HIEC周期的影响
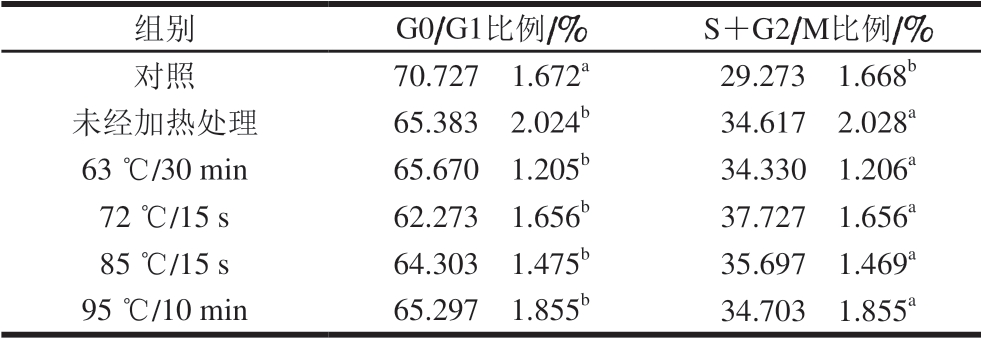
细胞周期指细胞从一次有丝分裂结束到下一次有丝分裂完成的过程,分为DNA合成前期(G1期)、DNA合成期(S期)、DNA合成后期(G2期)和有丝分裂期(M期),长期停滞在G1期的细胞又称为G0期。通过流式细胞术检测不同热处理方式的α-LA作用HIEC 48 h后对细胞周期的影响,结果如图2所示。
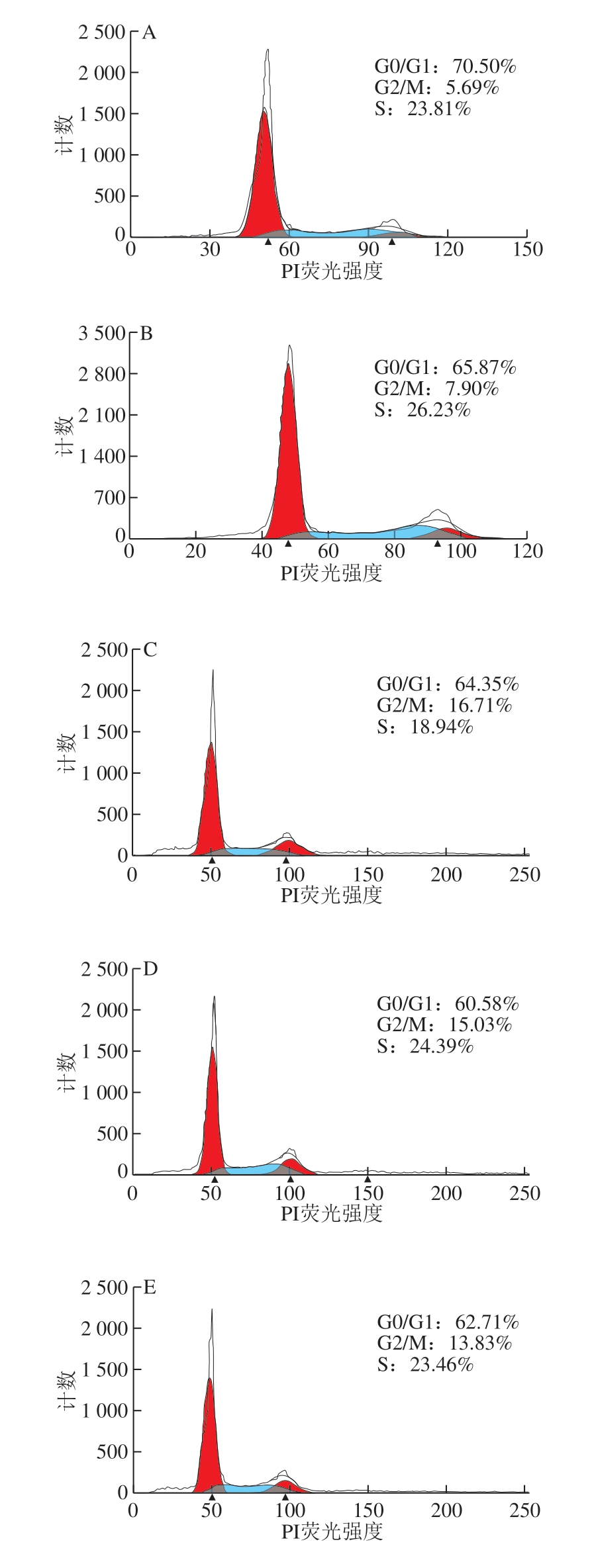
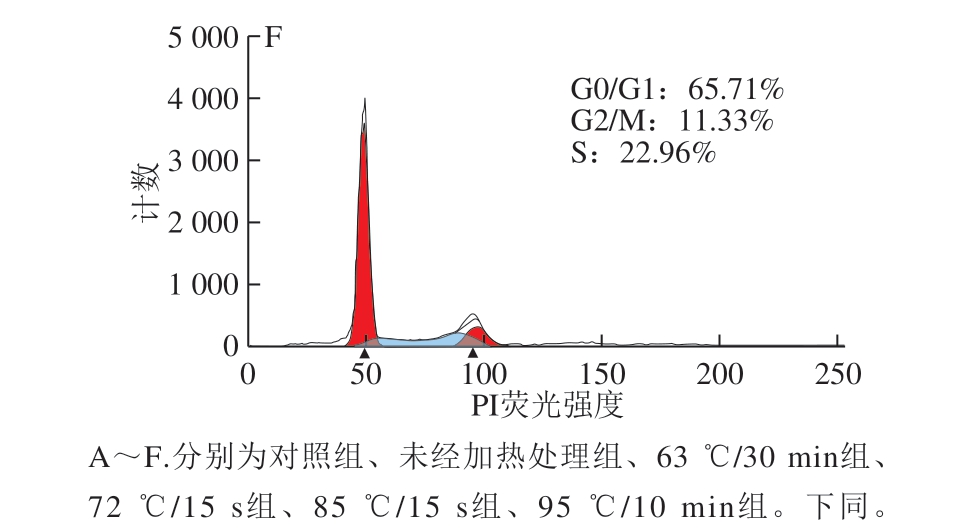
图 2 0.10 mg/mL α-LA对HIEC周期的影响
Fig. 2 Effect of α-LA at 0.10 mg/mL on HIEC cell cycle
表 2 0.10 mg/mL α-LA作用HIEC 48 h的细胞周期分布
Table 2 Cell cycle distribution of HIEC treated with α-LA at 0.10 mg/mL for 48 h
注:同列肩标小写字母不同表示差异显著(P<0.05)。下同。
组别 G0/G1比例/% S+G2/M比例/%对照 70.727f 1.672a 29.273f 1.668b未经加热处理 65.383f 2.024b 34.617f 2.028a 63 ℃/30 min 65.670f 1.205b 34.330f 1.206a 72 ℃/15 s 62.273f 1.656b 37.727f 1.656a 85 ℃/15 s 64.303f 1.475b 35.697f 1.469a 95 ℃/10 min 65.297f 1.855b 34.703f 1.855a
当质量浓度为0.10 mg/mL时,经不同热处理及未加热处理的α-LA作用HIEC 48 h后,细胞周期中 G0/G1、S+G2/M期的细胞分布情况如图2、表2所示。与对照组相比,5 个给药组G0/G1期的细胞比例均显著减少(P<0.05),S期和G2/M期的细胞比例均显著增加 (P<0.05)。结果表明,0.10 mg/mL α-LA可以促进细胞进入S期和G2/M期,从而增加进行正常分裂的细胞比例,达到促进细胞增殖的效果;不同加热方式处理的α-LA与未经热处理的α-LA相比,HIEC的周期分布变化无显著性差异,说明本实验选择的加热方式对HIEC的细胞周期影响不明显。
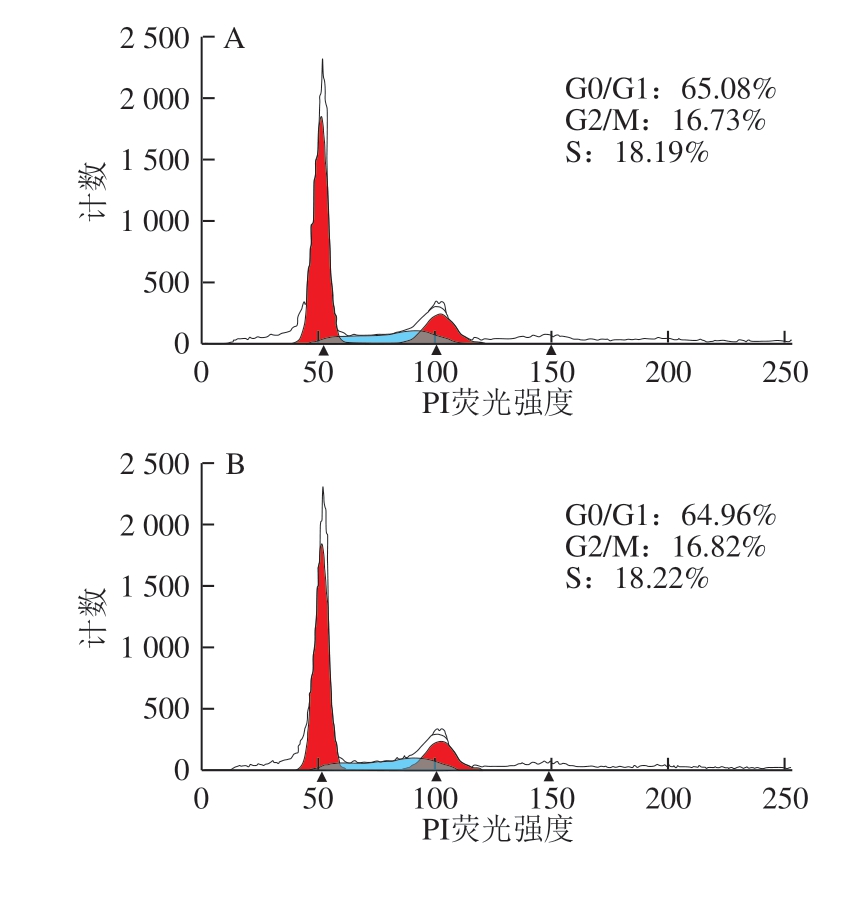
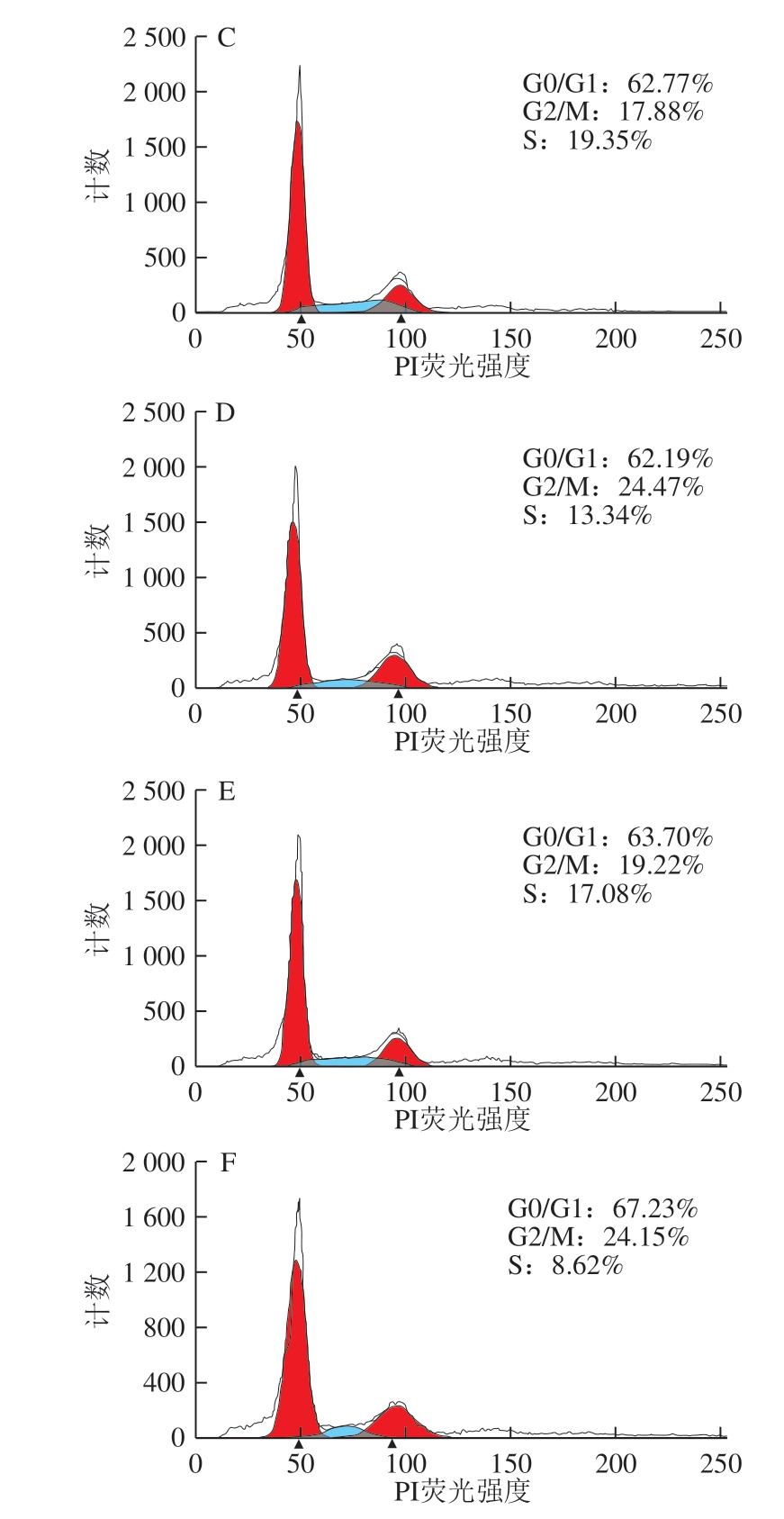
图 3 0.20 mg/mL α-LA对HIEC周期的影响
Fig. 3 Effect of α-LA at 0.20 mg/mL on HIEC cell cycle
表 3 0.20 mg/mL α-LA作用HIEC 48 h的细胞周期分布
Table 3 Cell cycle distribution of HIEC treated with α-LA at 0.20 mg/mL for 48 h

组别 G0/G1比例/% S+G2/M比例/%对照 68.680f 3.135a 31.320f 3.135a未经加热处理 67.340f 2.355a 32.660f 2.365a 63 ℃/30 min 65.443f 3.099a 34.557f 3.099a 72 ℃/15 s 64.100f 1.721a 35.900f 1.731a 85 ℃/15 s 65.247f 1.387a 34.753f 1.393a 95 ℃/10 min 68.213f 1.743a 31.787f 1.743a
当质量浓度为0.20 mg/mL时,经不同热处理及未加热处理的α-LA作用HIEC 48 h后,细胞周期中G0/G1、 S+G2/M期的细胞分布情况如图3、表3所示。与对照组相比,5 个给药组的G0/G1期的细胞比例均有所降低, S+G2/M期的细胞比例增加,但差异不显著。结果表明,0.20 mg/mL α-LA对HIEC的细胞周期影响不大;α-LA对HIEC周期的影响具有一定的剂量依赖性,与细胞增殖的结果一致。
2.4 不同热处理方式的α-LA对HIEC凋亡的影响
细胞凋亡指由基因控制的细胞自主有序的死亡。通过流式细胞术检测不同热处理方式的α-LA作用HIEC 48 h后对细胞凋亡率的影响,结果如图4所示。

图 4 0.10 mg/mL α-LA对HIEC凋亡的影响
Fig. 4 Effect of α-LA at 0.10 mg/mL on apoptosis of HIEC
表 4 0.10 mg/mL的α-LA作用HIEC 48 h的细胞凋亡率
Table 4 Apoptosis rates of HIEC treated with α-LA at 0.10 mg/mL for 48 h

组别 晚期凋亡率/% 早期凋亡率/% 总凋亡率/%对照 12.767f 0.907a 4.533f 0.764a 17.300f 1.670a未经加热处理 5.567f 1.026bc 2.867f 0.651a 8.433f 1.662bc 63 ℃/30 min 6.700f 1.277bc 3.433f 1.250a 10.133f 2.511bc 72 ℃/15 s 4.033f 1.779c 2.367f 0.473a 6.400f 2.100c 85 ℃/15 s 6.767f 0.851bc 3.133f 1.150a 9.900f 2.000bc 95 ℃/10 min 4.833f 1.943c 2.800f 0.794a 7.633f 2.654bc
当质量浓度为0.10 mg/mL时,经不同热处理及未经加热处理的α-LA作用HIEC 48 h后,细胞凋亡情况如图4、 表4所示。与对照组相比,5 个给药组的细胞晚期凋亡率以及总凋亡率均显著降低(P<0.05)。结果表明,0.10 mg/mL α-LA对HIEC凋亡有明显抑制作用,并且这种作用不受本实验中加热方式的影响。
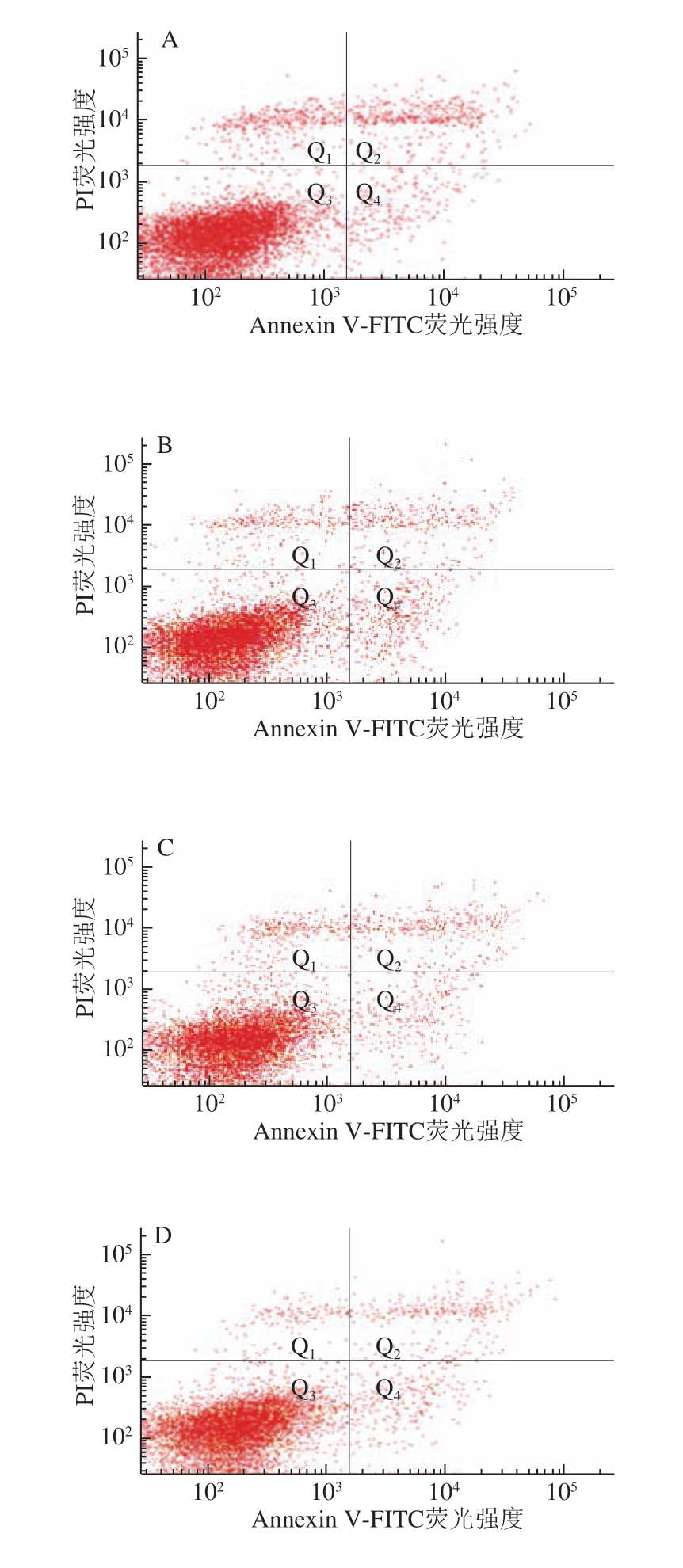

图 5 0.20 mg/mL α-LA对HIEC凋亡的影响
Fig. 5 Effect of α-LA at 0.20 mg/mL on apoptosis of HIEC
表 5 0.20 mg/mL α-LA作用HIEC 48 h的细胞凋亡率
Table 5 Apoptosis rates of HIEC treated with α-LA at 0.20 mg/mL for 48 h
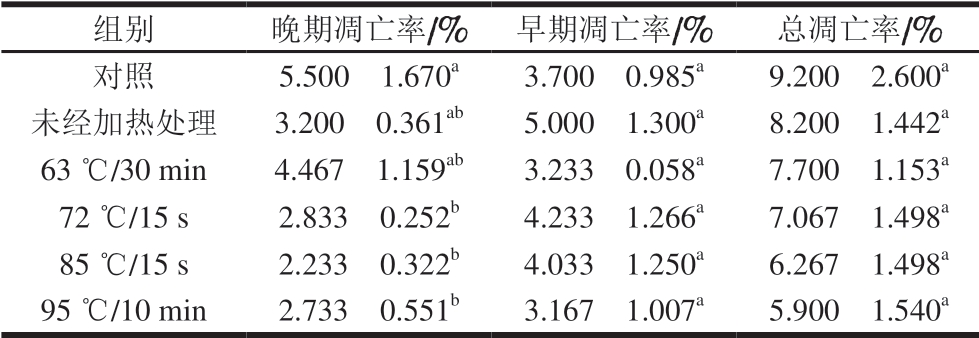
组别 晚期凋亡率/% 早期凋亡率/% 总凋亡率/%对照 5.500f 1.670a 3.700f 0.985a 9.200f 2.600a未经加热处理 3.200f 0.361ab 5.000f 1.300a 8.200f 1.442a 63 ℃/30 min 4.467f 1.159ab 3.233f 0.058a 7.700f 1.153a 72 ℃/15 s 2.833f 0.252b 4.233f 1.266a 7.067f 1.498a 85 ℃/15 s 2.233f 0.322b 4.033f 1.250a 6.267f 1.498a 95 ℃/10 min 2.733f 0.551b 3.167f 1.007a 5.900f 1.540a
当质量浓度为0.20 mg/mL时,经不同热处理及未经加热处理的α-LA作用HIEC 48 h后,HIEC凋亡情况如 图5、表5所示。5 个给药组细胞总凋亡率与对照组相比均有所降低,但差异不显著。说明0.20 mg/mL α-LA对HIEC凋亡率影响不大;α-LA抑制HIEC凋亡的作用效果具有一定剂量依赖性,与细胞增殖和细胞周期的结果一致。
3 结 论
不同热处理α-LA对HIEC增殖的作用效果具有一定的剂量依赖性,其作用机制与细胞周期、细胞凋亡相关。根据HIEC的来源和特性,本研究结果表明,优化的热处理牛α-LA在适宜的添加量下应用于婴儿配方奶粉中,可能发挥促进婴儿肠道上皮细胞生长,进而调节婴幼儿免疫的能力。推荐热处理α-LA的添加量为0.10 mg/mL,与乳粉加工巴氏杀菌方式结合的最佳热处理工艺条件为72 ℃、15 s,以保持α-LA的生物活性。其具体应用与产品开发需进一步研究。
[1] 仲玉梅. α-乳白蛋白在婴儿营养中的重要性[J]. 食品工业科技, 1992, 13(2): 52-57.
[2] RUIZ-VALDEPENAS M V, CAMPUZANO S, TORRENTERODRIGUEZ R M, et al. Electrochemical magnetic beads-based immunosensing platform for the determination of α-lactalbumin in milk[J]. Food Chemistry, 2016, 213: 595-601. DOI:10.1016/j.foodchem.2016.07.004.
[3] DELAVARI B, SABOURY A A, ATRI M S, et al. Alpha-lactalbumin: a new carrier for vitamin D3, food enrichment[J]. Food Hydrocolloids, 2015, 45: 124-131. DOI:10.1016/j.foodhyd.2014.10.017.
[4] CRITTENDEN R G, BENNETT L E. Cow’s milk allergy: a complex disorder[J]. Journal of the American College of Nutrition, 2005, 24(Suppl 6): 582-591. DOI:10.1080/07315724.2005.10719507.
[5] WADA Y, PHINNEY B S, WEBER D, et al. In vivo, digestomics of milk proteins in human milk and infant formula using a suckling rat pup model[J]. Peptides, 2017, 88: 18-31. DOI:10.1016/j.peptides.2016.11.012.
[6] MA J, LI Q, LI Y, et al. Expression of recombinant human α-lactalbumin in milk of transgenic cloned pigs is sufficient to enhance intestinal growth and weight gain of suckling piglets[J]. Gene, 2016, 584(1): 7-16. DOI:10.1016/j.gene.2016.02.024.
[7] RYAN M P, WALSH G. The biotechnological potential of whey[J]. Reviews in Environmental Science & Bio/Technology, 2016, 15(3): 1-20. DOI:10.1023/B:RESB.0000023052.17433.0e.
[8] BRÜCK W M, KELLEHER S L, GIBSON G R, et al. rRNA probes used to quantify the effects of glycomacropeptide and alphalactalbumin supplementation on the predominant groups of intestinal bacteria of infant rhesus monkeys challenged with enteropathogenic Escherichia coli[J]. Journal of Pediatric Gastroenterology and Nutrition, 2003, 37(3): 273-280. DOI:10.1097/00005176-200309000-00014.
[9] BERKHOUT B, DERKSEN G C H, BACK N K T, et al. Structural and functional analysis of negatively charged milk proteins with anti-HIV activity[J]. AIDS Research and Human Retroviruses, 1997, 13(13): 1101-1107. DOI:10.1089/aid.1997.13.1101.
[10] HILL D R, NEWBURG D S. Clinical applications of bioactive milk components[J]. Nutrition Reviews, 2015, 73(7): 463-476. DOI:10.1093/nutrit/nuv009.
[11] NG T B, CHEUNG R, WONG J H, et al. Antiviral activities of whey proteins[J]. Applied Microbiology & Biotechnology, 2015, 99(17): 6997-7008. DOI:10.1007/s00253-015-6818-4.
[12] GAUTHIER S F, POULIOTY, SAINT-SAUVEURD. Immunomodulatory peptides obtained by the enzymatic hydrolysis of whey proteins[J]. International Dairy Journal, 2006, 16(11): 1315-1323. DOI:10.1016/j.idairyj.2006.06.014.
[13] JAKOPOVIĆ K L, BARUKČIĆ I, BO ANIĆ R. Physiological significance, structure and isolation of α-lactalbumin[J]. Mljekarstvo, 2016, 66(1): 3-11. DOI:10.15567/mljekarstvo.2016.0101.
ANIĆ R. Physiological significance, structure and isolation of α-lactalbumin[J]. Mljekarstvo, 2016, 66(1): 3-11. DOI:10.15567/mljekarstvo.2016.0101.
[14] NONGONIERMA A B, FITZGERALD R J. Bioactive properties of milk proteins in humans: a review[J]. Peptides, 2015, 73: 20-34. DOI:10.1016/j.peptides.2015.08.009.
[15] 徐睿锶, 吴楠. 婴幼儿配方奶粉生产技术的现状及展望[J]. 科技风, 2018(20): 244.
[16] 姜红, 李向红, 王薇, 等. 高乳清蛋白婴儿配方奶对新生儿生长发育及氨基酸代谢的影响[J]. 中华实用儿科临床杂志, 2012, 27(19): 1482-1484. DOI:10.3969/j.issn.1003-515X.2012.19.008.
[17] DAVIS A M, HARRIS B J, LIEN E L, et al. α-Lactalbumin-rich infant formula fed to healthy term infants in a multicenter study: plasma essential amino acids and gastrointestinal tolerance[J]. European Journal of Clinical Nutrition, 2007, 62(11): 1294-1301. DOI:10.1038/sj.ejcn.1602848.
[18] 杨怀谷, 郑楠, 王加启. 巴氏杀菌乳和超高温灭菌乳营养价值及卫生安全对比研究[J]. 中国乳业, 2016(7): 62-67. DOI:10.3969/j.issn.1671-4393.2016.07.020
[19] 杨晋辉, 李松励, 郑楠, 等. 热处理对牛乳成分的影响以及热敏感指标的变化研究进展[J]. 食品科学, 2017, 38(7): 302-308. DOI:10.7506/spkx1002-6630-201707048.
[20] CROWLEY S V, DOWLING A P, CALDEO V, et al. Impact of α-lactalbumin: β-lactoglobulin ratio on the heat stability of model infant milk formula protein systems[J]. Food Chemistry, 2016, 194: 184-190. DOI:10.1016/j.foodchem.2015.07.077.
[21] NGUYEN T T P, BHANDARI B, CICHERO J, et al. Gastrointestinal digestion of dairy and soy proteins in infant formulas: an in vitro, study[J]. Food Research International, 2015, 76(Pt 3): 348-358. DOI:10.1016/j.foodres.2015.07.030.
[22] 冯炎雯, 李娜, 徐纪璇, 等. 脂质体在婴儿体外胃肠道消化的膜结构稳定性[J]. 食品科学, 2017, 38(13): 60-65. DOI:10.7506/spkx1002-6630-201713010.
[23] WADA Y, LÖNNERDAL B. Bioactive peptides released from in vitro digestion of human milk with or without pasteurization[J]. Pediatric Research, 2015, 77: 546-553. DOI:10.1038/pr.2015.10.
[24] ISLAM M A, DEVLE H, COMI I, et al. Ex vivo digestion of raw, pasteurised and homogenised milk: effects on lipolysis and proteolysis[J]. International Dairy Journal, 2017, 65: 14-19. DOI:10.1016/j.idairyj.2016.09.008.
[25] CHENY H, YANG J T, CHAU K H. Determination of the helix and β form of proteins in aqueous solution by circular dichroism[J]. Biochemistry, 1974, 13(16): 3350-3359. DOI:10.1021/bi00713a027.
[26] SREERAMA N, VENYAMINOV S Y, WOODY R W. Estimation of protein secondary structure from circular dichroism spectra: inclusion of denatured proteins with native proteins in the analysis[J]. Analytical Biochemistry, 2000, 287(2): 243-251. DOI:10.1006/abio.2000.4879.
[27] 包永睿, 王帅, 孟宪生, 等. 薏苡仁脂肪酸类成分对人肝癌细胞株SMMC-7721细胞周期及细胞凋亡的影响[J]. 中成药, 2014, 36(2): 235-239. DOI:10.3969/j.issn.1001-1528.2014.02.004.
[28] IZUMI H, ISHIZUKA S, INAFUNE A, et al. α-Lactalbumin hydrolysate stimulates glucagon-like peptide-2 secretion and small intestinal growth in suckling rats[J]. Journal of Nutrition, 2009, 139(7): 1322-1327. DOI:10.3945/jn.109.106401.
[29] LIN I C, SU S L, KUO C D. Induction of cell death in RAW264.7 cells by alpha-lactalbumin[J]. Food and Chemical Toxicology, 2008, 46(3): 842-853. DOI:10.1016/j.fct.2007.10.010.
[30] STERNHAGEN L G, ALLEN J C. Growth rates of a human colon adenocarcinoma cell line are regulated by the milk protein alphalactalbumin[J]. Advances in Experimental Medicine and Biology, 2001, 501: 115-120. DOI:10.1007/978-1-4615-1371-1_14.