顺铂(cis-diamminedichloroplatinum,CDDP)是临床上广泛应用的一种抗癌药物,在目前临床应用的联合化疗方案中,以CDDP为主药或有CDDP参与配伍的占70%~80%,并且CDDP在多种恶性肿瘤的治疗中都取得了显著疗效[1-2]。但CDDP在治疗过程中会对人体造成许多毒副作用,其中肾毒性最为严重[3-5]。葡萄籽原花青素(grape seed proanthocyanidin,GSP)是具有多种活性功能的一类多酚化合物的总称,具有保护心血管、免疫、抗炎、抗菌、抗过敏、抗肿瘤、抗病毒活性等生理功能[6-8]。由于结构中含有大量的酚羟基,GSP具有很强的抗氧化活性[9-10]。其中生物活性最强的是低聚GSP(oligomeric-GSP,O-GSP)[11]。GSP对肺癌、卵巢癌、皮肤癌、前列腺癌、结肠癌等均有不同程度的抑制作用,可以诱导癌细胞凋亡[12];O-GSP可增强CDDP对人肺癌细胞A549的杀伤作用[13]。此外,O-GSP还具有强大的清除自由基、抗氧化、抗动脉粥样硬化等作用[14-15]。
研究表明,氧化应激是CDDP诱发肾毒性的主要原因,而线粒体功能障碍是CDDP诱发肾毒性的中心 环节[16-18]。前期研究表明,O-GSP对CDDP诱发的肾毒性具有拮抗作用,但其作用机制尚不明确[19]。此外,O-GSP对CDDP引起的肾脏细胞线粒体损伤是否具有保护作用及其作用机制还鲜见报道。因此,本研究用CDDP建造人胚肾细胞HEK293毒性模型,通过检测细胞内抗氧化指标、线粒体功能指标及细胞凋亡率,探究O-GSP对CDDP所致HEK293细胞线粒体损伤的保护作用及机制。
1 材料与方法
1.1 材料与试剂
HEK293细胞 北京协和医学院基础学院细胞中心。
CDDP注射用冻干型粉剂(使用时用无菌生理盐水配制) 山东齐鲁制药厂;O-GSP(色谱级,原花青素纯度≥99%,其中含二聚体56%(质量分数,后同)、三聚体12%、四聚体6.6%、单体和其他大分子寡聚体20.4%,使用时用蒸馏水现用现配) 天津尖峰天然产物研究开发有限公司;胎牛血清 美国Gibico公司;DMEM 培养液 美国Introvigen公司;双抗 美国Sigma公司;胰酶 美国Genview公司。
还原型谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)、己糖激酶(hexokinase,HK)、 苹果酸脱氢酶(malic dehydrogenase,MDH)、乳酸脱氢酶(lactic dehydrogenase,LDH)检测试剂盒 南京建成生物工程研究所;BCA蛋白浓度测定试剂盒、活性氧(reaction oxygen species,ROS)检测试剂盒、ATP检测试剂盒、线粒体膜电位检测试剂盒 碧云天生物技术研究所;细胞凋亡试剂盒 美国Genview公司。
1.2 仪器与设备
5840R型低温高速离心机 德国Eppendorf公司;WFZUV-4802H型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;BS110S型电子天平 美国Sartorius公司;多功能酶标仪 美国Thermo公司;流式细胞仪 美国BD FASCailbur公司。
1.3 方法
1.3.1 细胞培养
HEK293细胞常规培养于含有质量分数15%胎牛血清和1%双抗的DMEM高糖培养基中,培养箱环境为37 ℃、5% CO2,饱和湿度。每隔1 d换一次培养基,待细胞融合至80%~90%时用胰酶消化,1∶2进行传代,每3~4 d传代1 次。选用对数生长期的细胞进行后续实验。
1.3.2 细胞分组及处理
参考前期研究,细胞分为4 个实验组:对照组,未加入CDDP和O-GSP;CDDP组,加入20 mg/L CDDP;O-GSP组,加入16 mg/L O-GSP;CDDP+O-GSP组,加入20 mg/L CDDP前4 h加入16 mg/L O-GSP[19]。继续培养24 h。
1.3.3 HEK293细胞蛋白含量及MDA和还原型GSH含量测定
细胞经1.3.2节方法处理后,消化并收集细胞,后用磷酸盐缓冲液(phosphate buffered saline,PBS)洗两遍,离心弃上清液,再用PBS重悬。将装有细胞悬液的离心管置于冰水浴中,超声破碎:功率300 W,3~5 s/次, 间隔3 0 s,重复3 ~5 次;取破碎好的匀浆液, 12 000 r/min离心10 min,收集上清液按照试剂盒说明书进行操作,测定细胞蛋白含量及MDA、还原型GSH含量。
1.3.4 细胞内ROS相对含量的检测
将HEK293细胞按1h 105 个/mL接种至6 孔板,并于37 ℃、5% CO2的培养箱中培养24 h。经1.3.2节方法处理后,去除培养液,加入1 mL含有10 mol/L 2’,7’-二氯荧光黄双乙酸盐的新鲜培养基,在37 ℃细胞培养箱内孵育20 min,用无血清细胞培养液洗涤细胞3 次,再用胰酶消化制成单细胞悬液,在1 000 r/min下离心5 min收集细胞。细胞用PBS重悬后,经200 目网过滤去除杂质,收集于流式细胞仪专用管内,上机检测,结果显示为流式直方图。
1.3.5 细胞内HK、LDH和MDH活力的检测
按照1.3.3节方法处理细胞,将细胞破碎并收集上清液,按照试剂盒说明书操作,检测细胞内HK、LDH和MDH活力。
1.3.6 细胞内ATP含量的检测
先将细胞按照1.3.4节方法正常培养24 h,经不同药物处理后,吸除培养液,每孔加入50 μL裂解液进行裂解,之后4 ℃、12 000 r/min离心5 min,取上清液,按照试剂盒说明测定细胞内ATP含量。
1.3.7 细胞内线粒体膜电位的检测
先将细胞按照1.3.4节方法正常培养24 h,经不同药物处理后,用胰酶消化各孔细胞,制成单细胞悬液,细胞悬液在1 000 r/min下离心5 min收集细胞,重复1 次。将细胞重悬于0.5 mL细胞培养液中,加入0.5 mL JC-1(新型阳离子羰花青染料)染色工作液,颠倒数次混匀。细胞培养箱中37 ℃孵育20 min。1 000 r/min、4 ℃离心5 min,沉淀细胞,弃上清液。用JC-1染色缓冲液(1×)洗涤2 次,再用500 μL JC-1染色缓冲液(1×)重悬后,200 目网过滤去除杂质,收集于流式细胞仪专用管内,上机检测。染色后收集细胞,采用红色的FL-2通道,结果以第一象限与第四象限荧光强度的比值反映受损细胞线粒体膜电位的下降情况。
1.3.8 细胞凋亡率的检测
先将细胞按照1.3.4节方法正常培养24 h,经不同药物处理后,吸除培养基,用胰酶消化并制成细胞悬液,1 000 r/min离心10 min,弃上清液。1 mL PBS洗涤细胞两次,然后将细胞重悬于200 mL Binding Buffer中,加入10 mL Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)轻轻混匀,避光室温反应15 min,再加入300 μL Binding Buffer以及5 μL溴化丙锭(propidium iodide,PI),在1 h内上机检测。
1.4 数据统计与分析
应用SPSS 22.0软件进行统计分析,实验结果重复3 次,数据均以平均值±标准差表示。组间差异采用单因素方差分析处理。P<0.01判断为具有极显著性差异。采用Origin 9.1软件作图。
2 结果与分析
2.1 O-GSP对CDDP所致HEK293细胞氧化损伤的影响
2.1.1 O-GSP对CDDP所致HEK293细胞中MDA、还原型GSH含量变化的影响
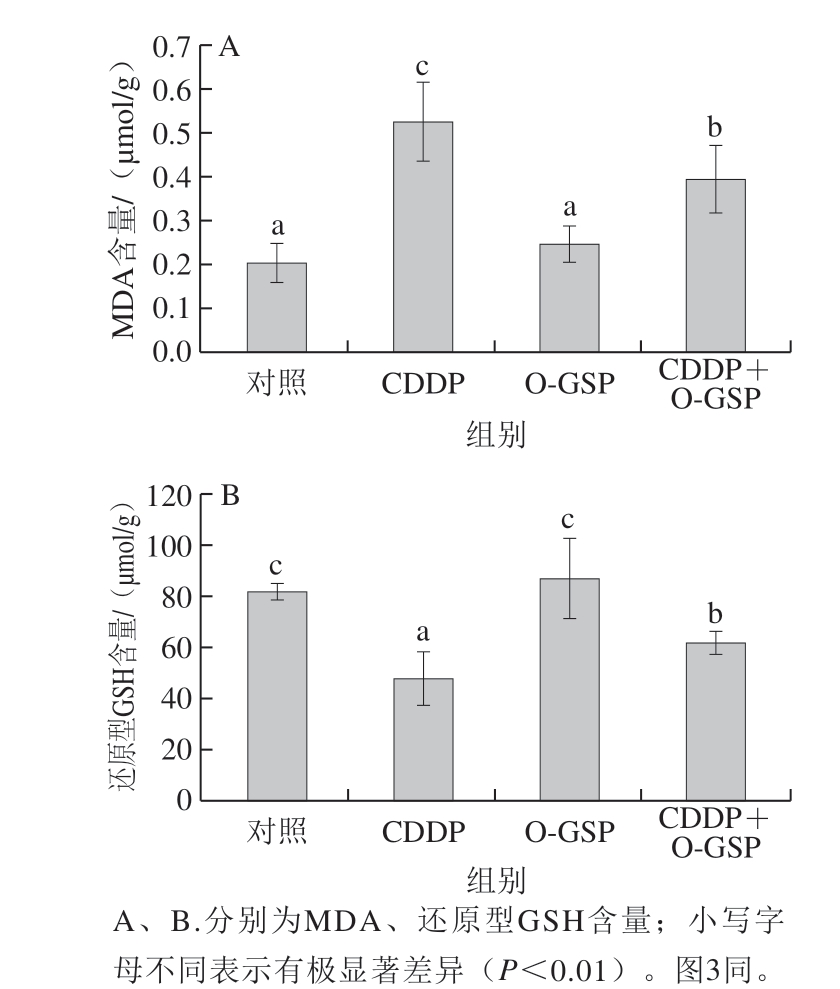
图 1 O-GSP对CDDP所致HEK293细胞抗氧化能力变化的影响
Fig. 1 Effect of O-GSP on CDDP-induced changes in antioxidant capacity in HEK293 cells
如图1所示,CDDP作用于HEK293细胞24 h,会使MDA含量较对照组极显著升高(P<0.01),还原型GSH含量较对照组极显著降低(P<0.01)。经O-GSP提前4 h孵育后再用CDDP作用24 h,该组的MDA含量较CDDP组极显著降低(P<0.01),而还原型GSH含量较CDDP组极显著升高(P<0.01)。与对照组相比,O-GSP单独作用于细胞,MDA含量和还原型GSH含量均无明显变化。表明O-GSP对CDDP所致的HEK293细胞氧化损伤有一定的保护作用。
2.1.2 O-GSP对CDDP所致HEK293细胞中ROS相对含量变化的影响
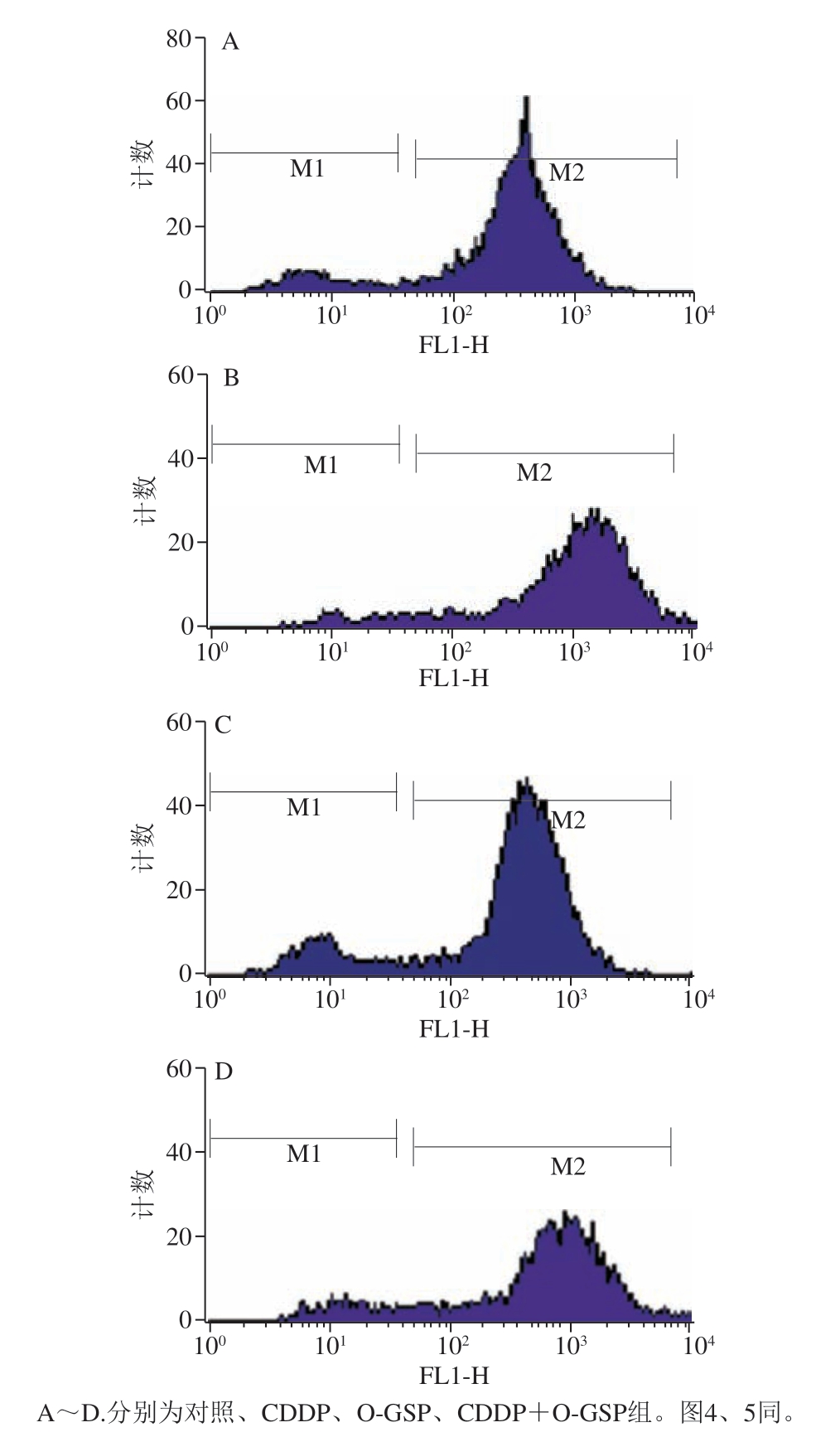
图 2 O-GSP对CDDP所致HEK293细胞ROS相对含量变化的影响
Fig. 2 Effect of O-GSP on CDDP-induced changes in ROS relative content in HEK293 cells
表 1 O-GSP对CDDP所致HEK293细胞ROS相对含量变化的影响
Table 1 Effect of O-GSP on CDDP-induced changes in ROS relative content in HEK293 cells
注:同行肩标小写字母不同表示差异极显著(P<0.01)。表2~3同。
组别 对照组 CDDP组 O-GSP组 CDDP+O-GSP组ROS相对含量/% 100.00f 7.55a 266.25f 6.32c 108.79f 5.24a 211.18f 5.53b
如图2及表1所示,CDDP能够导致细胞ROS相对含量较对照组极显著升高(P<0.01),而经O-GSP预处理的CDDP+O-GSP组ROS相对含量较CDDP组极显著降低(P<0.01)。与对照组比较,O-GSP单独作用细胞内ROS相对含量无明显变化。提示CDDP会引起细胞ROS生成量增加,而O-GSP预处理对这种变化有缓解作用。
2.2 O-GSP对CDDP所致HEK293细胞线粒体功能损伤的影响
2.2.1 O-GSP对CDDP所致HEK293细胞糖代谢酶活力的影响
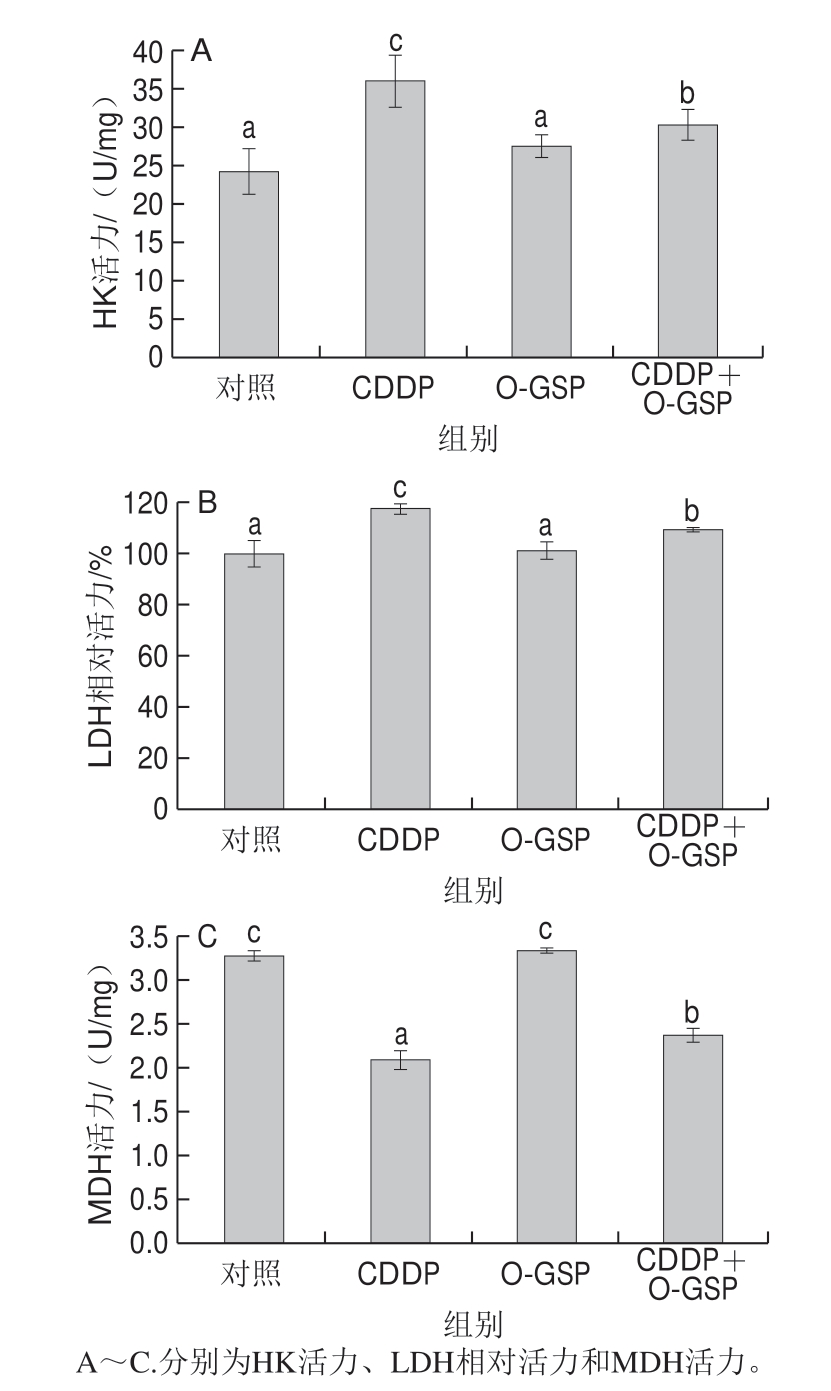
图 3 O-GSP对CDDP所致HEK293细胞糖代谢酶活力变化的影响
Fig. 3 Effect of O-GSP on CDDP-induced changes in glycometabolismrelated enzyme activities in HEK293 cells
如图3所示,CDDP单独作用于细胞24 h后,诱发HK活力和LDH相对活力较对照组极显著提升(P<0.01)。而与CDDP组相比,经O-GSP预处理的CDDP+O-GSP组HK活力和LDH相对活力均极显著降低(P<0.01)。与对照组相比,O-GSP单独作用使细胞HK活力和LDH相对活力均无明显变化。MDH活力的变化与HK和LDH恰好相反。CDDP使MDH活力较对照组极显著降低,而经O-GSP预处理的CDDP+O-GSP组MDH活力较CDDP组极显著升高(P<0.01)。与对照组相比,单独O-GSP给药使MDH活力无明显变化。表明O-GSP对CDDP诱导细胞内糖代谢酶活力的变化有明显的保护作用。
2.2.2 O-GSP对CDDP所致HEK293细胞中ATP相对含量变化的影响
表 2 O-GSP对CDDP所致HEK293细胞ATP相对含量变化的影响
Table 2 Effect of O-GSP on CDDP-induced changes in ATP relative content in HEK293 cells
组别 对照组 CDDP组 O-GSP组 CDDP+O-GSP组ATP相对含量/% 100.00f 4.34c 75.32f 6.38a 97.15f 0.91c 86.40f 4.83b
如表2所示,CDDP单独作用使细胞内ATP相对含量较对照组极显著降低(P<0.01)。与对照组相比,O-GSP单独作用使细胞内ATP相对含量无明显变化。而经O-GSP预处理4 h后再加CDDP,细胞内ATP相对含量较CDDP组极显著升高(P<0.01)。表明CDDP能够引起细胞产能减少,而O-GSP预处理在一定程度上对细胞产能减少的状况有所改善。
2.2.3 O-GSP对CDDP所致HEK293细胞线粒体膜电位变化的影响

图 4 O-GSP对CDDP所致HEK293细胞线粒体膜电位变化的影响
Fig. 4 Effect of O-GSP on CDDP-induced changes in mitochondrial transmembrane potential in HEK293 cells
表 3 O-GSP对CDDP所致HEK293细胞线粒体膜电位变化的影响
Table 3 Effect of O-GSP on CDDP-induced changes in mitochondrial transmembrane potential in HEK293 cells
组别 对照组 CDDP组 O-GSP组 CDDP+O-GSP组线粒体膜电位 6.13f 0.43c 1.91f 0.49a 6.62f 0.31c 3.22f 0.72b
由图4及表3可见,与对照组相比,CDDP组线粒体膜电位极显著降低(P<0.01),经过O-GSP预处理的CDDP+O-GSP组线粒体膜电位较CDDP组极显著升高(P<0.01)。而O-GSP单独作用使细胞中线粒体膜电位较对照组无明显变化。
2.3 O-GSP对CDDP所致HEK293细胞凋亡的影响
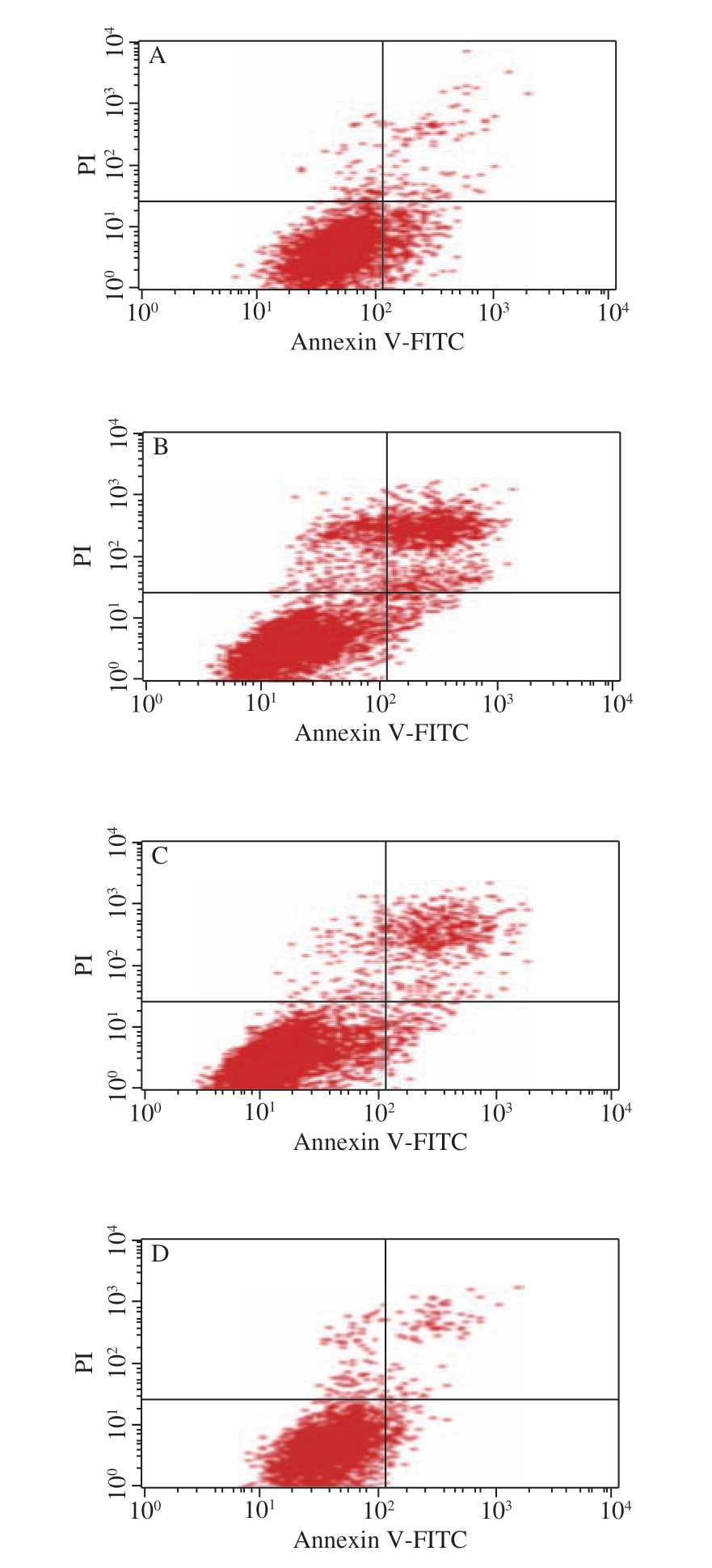
图 5 O-GSP对CDDP所致HEK293细胞凋亡的影响
Fig. 5 Effect of O-GSP on CDDP-induced apoptosis in HEK293 cells
表 4 O-GSP对CDDP所致HEK293细胞凋亡的影响
Table 4 Effect of O-GSP on CDDP-induced apoptosis in HEK293 cells
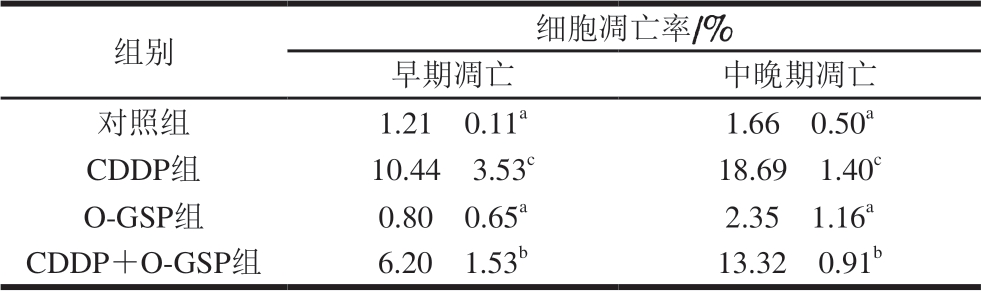
注:同列肩标小写字母不同表示有极显著差异(P<0.01)。
组别 细胞凋亡率/%早期凋亡 中晚期凋亡对照组 1.21f 0.11a 1.66f 0.50a CDDP组 10.44f 3.53c 18.69f 1.40c O-GSP组 0.80f 0.65a 2.35f 1.16a CDDP+O-GSP组 6.20f 1.53b 13.32f 0.91b
由图5及表4可见,与对照组相比,CDDP作用于细胞使细胞早期凋亡率和晚期凋亡率极显著升高(P<0.01)。O-GSP预处理使细胞的早期凋亡率和晚期凋亡率较CDDP组相比均极显著降低(P<0.01)。O-GSP单独作用对细胞的凋亡率未造成明显变化。表明O-GSP可能参与CDDP诱导的细胞凋亡途径并起到一定的保护作用。
3 讨 论
前期研究结果表明,CDDP对HEK293细胞生长有明显的抑制作用,随着CDDP浓度不断增大,对细胞生长的抑制率越来越明显[20]。原花青素作为一种有效的抗氧化剂对细胞损伤具有一定的保护作用,其中主要涉及对DNA损伤和氧化损伤的保护。有研究表明,GSP提取物治疗可通过降低氧化应激有效预防母鸡卵巢衰老 过程[21]。Uluso等[22]通过比较N-乙酰半胱氨酸和GSP对小鼠感应肾病的保护作用,发现GSP对小鼠肾细胞具有更好的保护作用。Gao Zhaoli等[23]研究结果表明,GSP提取物可通过Caspase-12通路在链脲霉素诱导的糖尿病性肾病中保护肾功能,减轻内质网应激诱导的细胞凋亡。
CDDP通过增加ROS的产生和抑制ROS的还原清除,增加细胞内ROS含量,引发氧化应激过程,最终造成肾脏细胞损伤。线粒体功能障碍是CDDP诱发肾毒性的中心环节,氧化应激与线粒体功能障碍之间互相影响[24-25]。 各种来源的自由基可攻击生物膜引发脂质过氧化作用,脂质过氧化的许多代谢产物对机体具有毒性作用,其中MDA的毒性最显著,它是生物膜中的多不饱和脂肪酸在受到自由基攻击后发生脂质过氧化的最终分解产物[26-27]。 MDA含量的异常增高会引起线粒体和细胞损伤,故机体或细胞中MDA含量可反映细胞抗氧化水平和脂质过氧化水平。本研究结果显示,CDDP可以诱发HEK293细胞中GSH含量极显著降低,同时使MDA含量极显著升高。说明GSH被CDDP消耗,降低了机体清除自由基的能力,从而发生氧化应激反应,这与先前其他相关研究的结果[28-29]一致。有研究表明,GSP具有较强的抗氧化能力,并且通过清除自由基对牙周病致病菌脂多糖诱发的 巨噬细胞氧化应激有显著的保护作用[6]。本研究中提前4 h对HEK293细胞采用O-GSP预处理并检测抗氧化指标,结果表明,O-GSP预处理组较CDDP组细胞中还原型GSH含量极显著升高,同时MDA含量极显著降低。说明O-GSP减轻了还原型GSH的损耗,并在一定程度上抑制了脂质过氧化,对CDDP诱发的氧化应激具有缓解作用。
CDDP进入细胞后,可以直接攻击线粒体裸露的DNA使其受损,造成线粒体功能障碍。其中引起的一系列氧化应激反应不仅能够抑制线粒体呼吸作用,减缓呼吸链的电子传递,增加ROS的产生,还会导致解偶联蛋白的表达上调,引起质子泄漏的发生,使得线粒体膜电位下降,最终降低ATP生成量[30]。MDH是三羧酸循环的标志酶,而HK和LDH是糖酵解过程的标志酶。线粒体通过三羧酸循环进行有氧呼吸的产能过程受到抑制,细胞所需能量匮乏,而糖酵解作用增强仅可提供少量能量。本研究对细胞糖代谢中酶活力的检测结果显示,CDDP作用于HEK293细胞24 h后,相较对照组,细胞内同时出现MDH活力极显著降低与HK活力、LDH相对活力极显著升高,这与先前相关研究结果[31]一致。ATP含量和线粒体膜电位的检测结果显示,CDDP导致HEK293细胞内ATP相对含量和线粒体膜电位均极显著降低,表明线粒体呼吸电子传递链受到抑制,使细胞内ATP相对含量减少,不能满足细胞正常生理活动需要。同时,上述过程引起的线粒体内膜泵送质子紊乱,导致线粒体跨膜电位降低,又进一步减少了ATP的生成。本研究结果表明,与CDDP组相比,经O-GSP预处理的细胞ROS相对含量极显著降低,MDH活力极显著升高,而HK活力、LDH相对活力极显著降低,此外,细胞内ATP相对含量和线粒体膜电位均显著升高。提示O-GSP对CDDP诱发的HEK293细胞糖代谢异常、ATP匮乏和线粒体膜电位降低均有一定的保护作用,该作用可能与O-GSP强抗氧化性有关,O-GSP有效地清除了细胞内的ROS,缓解了细胞内的氧化应激,减轻了细胞和线粒体的氧化损伤,从而对线粒体起到了保护作用。
研究显示,诱导肾小管上皮细胞凋亡是CDDP肾损伤的重要机制之一。其中,线粒体凋亡途径是CDDP诱导肾小管上皮细胞凋亡的主要途径[32]。前期研究结果显示,CDDP能够导致HEK293细胞凋亡率较对照组极显著升高。结合前一部分研究结果分析,内源性的线粒体通路参与了CDDP引起的HEK293细胞凋亡。Du Yu等[33]通过对心肌细胞H9C2细胞凋亡研究发现,O-GSP对心肌细胞H9C2凋亡具有一定的保护作用,该保护作用是通过诱导细胞内源性抗氧化酶活力实现的。此外,还有研究发现,O-GSP通过其抗氧化作用对H2O2诱导的成骨细胞MC3T3-E1细胞凋亡具有潜在的保护作用[34]。本研究中,与CDDP组相比,O-GSP预处理后HEK293细胞早期凋亡率和中晚期凋亡率均极显著降低。提示O-GSP对CDDP诱发的细胞凋亡具有潜在的保护作用,而这一作用可能是由于O-GSP能够缓解线粒体损伤,从而抑制了HEK293细胞由线粒体途径介导的细胞凋亡。
4 结 论
O-GSP预处理能够提高HEK293细胞的抗氧化能力,减轻CDDP造成的氧化损伤,并且能通过改善CDDP诱发的糖代谢异常及ATP相对含量和线粒体膜电位的降低,从而减轻CDDP诱发的细胞线粒体损伤。此外,O-GSP对CDDP诱发的细胞凋亡具有一定的抑制作用,该作用可能与抑制细胞凋亡的线粒体途径有关。说明O-GSP对CDDP诱发的HEK293细胞毒性具有明显的保护作用,且该作用与O-GSP保护CDDP所致线粒体损伤有关。O-GSP具有抗氧化等多种生理功能,是一种很有价值的天然产物,若加大研究力度,将其开发成为具有改善CDDP化疗期间肾功能损伤的保健食品,将会在一定程度上提高癌症化疗患者的生活质量,对癌症的临床治疗发挥更大的作用。
[1] GONZALEZ V M, FUERTES M A, ALONSO C, et al. Is cisplatininduced cell death always produced by apoptosis?[J]. Molecular Pharmacology, 2001, 59(4): 657-663. DOI:10.1124/mol.59.4.657.
[2] SANTOS N A G, RODRIGUES M A C, SANTOS N M M A C. Cisplatin-induced nephrotoxicity and targets of nephroprotection: an update[J]. Archives of Toxicology, 2012, 86(8): 1233-1250. DOI:10.1007/s00204-012-0821-7.
[3] ARANY I, SAFIRSTEIN R L. Cisplatin nephrotoxicity[J]. Seminars in Nephrology, 2003, 23(5): 460-464. DOI:10.1016/S0270-9295(03)00089-5.
[4] KART A, CIGREMIS Y, KARAMAN M, et al. Caffeic acid phenethyl ester (CAPE) ameliorates cisplatin-induced hepatotoxicity in rabbit[J]. Experimental and Toxicologic Pathology, 2010, 62(1): 45-52. DOI:10.1016/j.etp.2009.02.066.
[5] YOUSEF M I, SAAD A A, EL-SHENNAWY L K. Protective effect of grape seed proanthocyanidin extract against oxidative stress induced by cisplatin in rats[J]. Food and Chemical Toxicology, 2009, 47(6): 1176-1183. DOI:10.1016/j.fct.2009.02.007.
[6] HOUDE V, GRENIER D, CHANDAD F. Protective effects of grape seed proanthocyanidins against oxidative stress induced by lipopolysaccharides of periodontopathogens[J]. Journal of Periodontology, 2006, 77(8): 1371-1379. DOI:10.1902/jop.2006.050419.
[7] FRACASSETTI D, COSTA C, MOULAY L, et al. Ellagic acid derivatives, ellagitannins, proanthocyanidins and other phenolics, vitamin C and antioxidant capacity of two poder products from camucamu fruit (Myrciaria dubia)[J]. Food Chemistry, 2013, 139(1/2/3/4): 578-588. DOI:10.1016/j.foodchem.2013.01.121.
[8] PRASAD R, VAID M, KATIYAR S K. Grape proanthocyanidin inhibit pancreatic cancer cell growth in vitro and in vivo through induction of apoptosis and by targeting the PI3K/Akt pathway[J]. PLoS ONE, 2012, 7(8): e43064. DOI:10.1371/journal.pone.0043064.
[9] BAGCHI D, GARG A, KROHN R L, et al. Oxygen free radical scavenging abilities of vitamins C and E, and A grape seed proanthocyanidin extract in vitro[J]. Research Communications in Molecular Pathology and Pharmacology, 1997, 95(2): 179-189. DOI:10.1533/9781845698409.3.178.
[10] 戴妙妙. 紫娟茶中花青素提取物的抗氧化性研究[J]. 食品研究与开发, 2016, 37(9): 42-46. DOI:10.3969/j.issn.1005-6521.2016.09.010.
[11] 郭磊, 杨静玉, 王芳, 等. 葡萄籽提取物化学成分及药理活性的研究进展[J]. 沈阳药科大学学报, 2008(增刊1): 32-34. DOI:10.14066/j.cnki.cn21-1349/r.2008.s1.109.
[12] 江海洋, 张华. 葡萄籽原花青素的研究进展[J]. 临床误诊误治, 2012, 25(11): 97-100. DOI:10.3969/j.issn.1002-3429.2012.11.038.
[13] 王海, 连燕娜, 高丽萍. 低聚葡萄籽原花青素联合顺铂对A549细胞增殖及细胞周期的影响[J]. 食品科学, 2017, 38(7): 213-218. DOI:10.7506/spkx1002-6630-201707001.
[14] BAO L, CAI X, ZHANG Z, et al. Grape seed procyanidin B2 ameliorates mitochondrial dysfunction and inhibits apoptosis via the AMP activated protein kinase-silent mating typeinformation regulation 2 homologue 1-PPARγ co-activator-1α axis in rat mesangial cells underhigh-dose glucosamine[J]. The British Journal of Nutrition, 2014, 113(1): 1-10. DOI:10.1017/S000711451400347X.
[15] MACKENZIE G G, ADAMO A M, DECKER N P, et al. Dimeric procyanidin B2 inhibitsconstitutively active NF-κB in Hodgkin’s lymphoma cells independently of the presence of IκB mutations[J]. Biochemical Pharmacology, 2008, 75(7): 1461-1471. DOI:10.1016/j.bcp.2007.12.013.
[16] 赵艳萌, 高丽萍, 郭卓雨. 顺铂诱发肾毒性机制的研究进展[J]. 广东医学, 2013, 34(23): 3679-3681.
[17] WANG D, LIPPARD S J. Cellular processing of platinum anticancer drugs[J]. Nature Reviews Drug Discovery, 2005, 4(4): 307-320. DOI:10.1038/nrd1691.
[18] YAO X, PANICHPISAL K, KURTZMAN N, et al. Cisplatin nephrotoxicity: a review[J]. The American Journal of Chinese Medicine, 2007, 334(2): 115-124. DOI:10.1097/MAJ.0b013e31812dfe1e.
[19] 连燕娜, 高丽萍, 郭豫, 等. 低聚体葡萄籽原花青素对顺铂损伤HEK293细胞及抗癌活性的影响[J]. 食品科学, 2016, 37(7): 182-186. DOI:10.7506/spkx1002-6630-201607033.
[20] 李贞, 高丽萍, 冷洪涛, 等. 葡萄籽原花青素对顺铂所致人胚肾细胞毒性的拮抗作用[J]. 食品科学, 2011, 32(7): 315-318. DOI:10.7506/spkx1002-6630-201401046.
[21] LIU Xingting, LIN Xin, MI Yuling, et al. Grape seed proanthocyanidin extract prevents ovarian aging by inhibiting oxidative stress in the hens[J]. Oxidative Medicine and Cellular Longevity, 2018, 2018: 1-16. DOI:10.1155/2018/9390810.
[22] ULUSO Y S, OZKAN G, MUNGAN S, et al. GSPE is superior to NAC in the prevention of contrast-induced nephropathy: might this superiority be related to caspase1 and calpain1?[J]. Life Sciences, 2014, 103: 101-110. DOI:10.1016/j.lfs.2014.03.030.
[23] GAO Zhaoli, LIU Guangyi, HU Zhao, et al. Grape seed proanthocyanidins protect against streptozotocin-induced diabetic nephropathy by attenuating endoplasmic reticulum stress-induced apoptosis[J]. Molecular Medicine Reports, 2018, 18(2): 1447-1454. DOI:10.3892/mmr.2018.9140.
[24] 白世平, 罗绪刚, 吕林. 线粒体在细胞凋亡中的介导作用[J]. 生命科学, 2006, 18(4): 368-372. DOI:10.3969/j.issn.1004-0374.2006.04.014.
[25] SUGIHARA K, NAKANO S, KODA M, et al. Stimulatory effect of cisplatin on production of lipid peroxidation in renal tissues[J]. Japanese Journal of Pharmacology, 1987, 43(3): 247-252. DOI:10.1254/jjp.43.247.
[26] SHAO H Z, HSU W C, CHANG W T, et al. Cytotoxicity induced by grape seed proanthocyanidins role of nitric oxide[J]. Cell Biology and Toxicology, 2006, 22(3): 149-158. DOI:10.1007/s10565-006-0052-x.
[27] 冷洪涛, 高丽萍, 张海莲, 等. 枸杞多糖对顺铂所致人胚肾细胞毒性的拮抗作用[J]. 广东医学, 2011, 32(22): 2929-2931. DOI:10.3969/j.issn.1001-9448.2011.22.019.
[28] HU Q, ZHANG D D, WANG L, et al. Eriodictyol-7-O-glucoside, a novel Nrf2 activator, confers protection against cisplatin-induced toxicity[J]. Food and Chemical Toxicology, 2012, 50(6): 1927-1932. DOI:10.1016/j.fct.2012.03.059.
[29] SHAH K, KHAN F M, BADSHAH A, et al. Effect of cisplatin on glutathione redox status in isolated plasma and cytosolic fraction[J]. African Journal of Pharmacy and Pharmacology, 2013, 7(2): 37-45.DOI:10.5897/ajpp12.1072.
[30] EI-KHOURY T G, BAHR G M, ECHTAY K S. Muramyl-dipeptideinduced mitochondrial proton leak in macrophages is associated with upregulation of uncoupling protein 2 and the production of reactive oxygen and reactive nitrogen species[J]. The FEBS Journal, 2011, 278(17): 3054-3064. DOI:10.1111/j.1742-4658.2011.08226.x.
[31] NAQSHBANDI A, KHAN W M, RIZWAN S, et al. Studies on the protective effect of dietary fish oil on cisplatin induced nephrotoxicity in rats[J]. Food and Chemical Toxicology, 2012, 50(2): 265-273. DOI:10.1016/j.fct.2011.10.039.
[32] 冯乐平, 乔伟. 顺铂诱导肾小管上皮细胞程序性死亡的机理[J]. 吉林大学学报(医学版), 2008, 34(4): 581-584; 536; 729.
[33] DU Yu, GUO Huaifang, LOU Hongxiang. Grape seed polyphenols protect cardiac cells from apoptosis via induction of endogenous antioxidant enzymes[J]. Journal of Agricultural and Food Chemistry, 2007, 55(5): 1695-1701. DOI:10.1021/jf063071b.
[34] ZHANG Zhifei, ZHENG Leigang, ZHAO Zhenqun, et al. Grape seed proanthocyanidins inhibit H2O2-induced osteoblastic MC3T3-E1 cell apoptosis via ameliorating H2O2-induced mitochondrial dysfunction[J]. The Journal of Toxicological Sciences, 2014, 39(5): 803-813. DOI:10.2131/jts.39.803.