蛋白质是生命的物质基础,是由氨基酸组成的有机大分子。肽是由两个或两个以上的氨基酸经肽键链接而成,分子质量介于蛋白质和氨基酸之间[1-3]。功能性肽是指具有某种特定生物活性、对机体有益的肽类化合物[4]。功能性肽广泛存在于动物、植物以及微生物机体中,也可通过蛋白质降解或人工合成得到。来自于人体的内源性功能肽参与机体代谢,通过蛋白质降解或人工合成的外源性功能肽具有多种有益健康的生理功能。由于功能性肽分子质量较小、细胞透过性较好、易被人体消化吸收,且毒副作用极低,从而受到食品、药品、医疗等领域的高度关注[5-10]。
功能性肽的结构解析和功能开发一直是肽组学的研究热点,相关研究开发必须以从混合体系中获得高纯度目标肽产品为前提。然而,内源性功能肽的丰度很低,存在大量高丰度蛋白及其代谢产物的干扰,尤其是血清中包含着复杂的蛋白组成,且蛋白质含量在大于10 个数量级的动态范围内[11],如何有效地将低丰度内源性功能肽从高浓度蛋白混合物中提取出来具有巨大的挑战;蛋白降解或人工合成的肽混合物中存在游离氨基酸、不同分子质量和氨基酸单元的肽或者蛋白、反应助剂等,其产物组成复杂,通过简单的分离很难获得某一特定组分。针对内源性功能肽和外源性功能肽目前已经发展出了多种富集和分离方式,例如电泳技术[12]、膜分离技术[13]、色谱技术[14]等, 但是传统的分离纯化技术效果往往不理想、适用范围小,不利于功能性肽的进一步研究。近年来,科研人员研究报道了多种新型的分离富集方法及新型材料。本文对现有的分离和富集技术进行梳理总结,并阐述了各种方法的原理、适用对象、优缺点以及发展方向,以期为功能性肽的理论研究与开发利用提供参考。
1 功能性肽的分类
功能性肽通常是由两个及两个以上的α-氨基酸组成的具有特殊活性的肽类[15]。其分子质量一般小于6 ku[16],氨基酸组成和分子排列方式不同,其具有的生理功能不同。根据生物活性可以将功能性肽分为抗氧化肽、抗菌肽、血管紧张素转化酶抑制肽、抗肿瘤肽、免疫活性肽等[17];按照来源分为内源性功能肽和外源性功能肽。凡源于人体自身的肽被称为内源性功能肽;而外源性功能肽指人体之外的、存在于动植物和微生物中的肽,以及经蛋白质降解、氨基酸合成得到的肽。
1.1 外源性功能肽
人体以外的功能性肽类统称为外源性功能肽。按照获得途径不同,可以分为蛋白质降解肽、其他生物体内天然肽和氨基酸合成肽。蛋白质降解肽是通过酶解、微生物发酵、化学或物理等方法将蛋白质降解为具有功能活性的肽类。蛋白质降解肽是蛋白质的一级结构片段,一般由3~20 个氨基酸残基组成[18],具有抗氧化[19]、抗肿瘤[20]、抗炎[21]、抗菌[22]、抗高血压[23]等多种生物活性。肽的结构特性如链长、氨基酸组成、物理化学性质等[24]决定了其功能活性。
Shazly等[25]通过碱性蛋白酶、胰蛋白酶分别降解水牛乳酪蛋白和牛乳酪蛋白,获得了两种抗氧化肽牛酪蛋白水解物UF-VI CNH和水牛酪蛋白水解物UF-VI CBH,通过羟自由基清除能力、超氧化合物清除能力、氧自由基吸收能力以及Fe3+还原能力评价其抗氧化活性,发现采用碱性蛋白酶酶解得到的水牛酪蛋白水解物相对于牛酪蛋白水解物含有较多的疏水性氨基酸,具有较高的抗氧化活性。马俪珍等[26]以鲶鱼头、骨为原料和以脾淋巴细胞的转化程度为指标,探究了具有免疫活性的鲶鱼胶原多肽的优化酶解条件,发现经木瓜蛋白酶酶解、加酶量为1 600 U/g、酶解4 h、酶与底物质量浓度比1∶4.5时,酶解肽对脾淋巴细胞的增殖刺激效果最好。
人体以外的动植物及微生物体内也存在多种生物活性肽。王一名等[27]发现磷酸化南极磷虾肽能够改善大鼠骨质疏松症,显著降低大鼠的高骨转换率,显著改善骨微结构,提升骨密度;胡婧婷等[28]利用反相高效液相色谱法从人参中提取出了糖肽,以经β淀粉样蛋白25-35处理的鼠嗜铬细胞瘤PC12细胞为研究对象,发现人参糖肽能够有效抑制PC12细胞凋亡,当糖肽的质量浓度为1 g/L时,PC12细胞存活率达到(114.84f 6.23)%,促进了细胞增殖,具有神经细胞保护作用。
氨基酸合成肽是指由氨基酸合成的具有特定序列的肽。Mirzaei等[29]以酿酒酵母蛋白质水解产物纯化的活性肽(YGKPVAVPAR)为模板,合成了4 种不同的新型血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制肽(YHR-10、GA-8、GHA-8、PAR-3),该研究发现改变氨基酸组成,在C末端区域加入/替换疏水性残基Pro可以提高ACE抑制活性。Gu Longjian等[30]基于谷胱甘肽合成了两种新型肽,即ECH(Glu-Cys-His)和YECG(Tyr-Glu-Cys-Gly),其中三肽ECH显示出最高的1,1-二苯基-2-三硝基苯肼自由基清除活性(80.16%)和最强的Fe3+还原能力(A700 nm=0.378),四肽YECG对H2O2诱导的神经细胞PC12表现出了最佳抗损伤能力;研究还发现His或Tyr的存在和其位置的改变均会影响合成肽的电子供给能力或氧自由基吸收能力,从而影响合成肽的抗氧化活性。由此可见,对氨基酸合成肽的研究有利于探索生物活性肽结构与其活性之间的关系。
1.2 内源性功能肽
内源性功能肽是天然存在于人体内,参与人体代谢、运输、免疫、调节等各项生理活动的肽类,具有极其重要的作用,如神经肽、肽激素、生长因子、细胞内蛋白水解产物等,一般由3~50 个氨基酸构成[31]。人体内的内源性功能肽分为两种:一是天然存在的肽段,例如生长因子,通常具有特定的生物活性;二是经体内蛋白质降解所得的肽段[32]。蛋白质的翻译后修饰是产生内源性功能肽的必要过程,包括糖基化、乙酰化、磷酸化、甲基化、硫化、羧基化等。
糖肽是一种重要的内源性功能肽,对细胞表面识别、免疫应答、蛋白质折叠、转运、神经传导等生物转化过程有着重要作用[33]。糖肽具有微观不均一性,同一蛋白质具有不同的糖基化位点,并且同一位点上的糖链也有可能不同[34],糖基化多种多样的形式为糖肽的研究带来了困难。近年来,研究者们通过亲水作用色谱法[35]、凝集素 法[36]、硼酸修饰法[37]、酰肼化学法[38]等,从血清、尿液等样本中分离富集到了内源性糖肽,为部分疾病的研究及治疗提供了依据和基础,推动了肽组学的发展。
蛋白质磷酸化指由蛋白质激酶催化的、将ATP的磷酸基转移到底物蛋白质氨基酸残基(丝氨酸、苏氨酸、酪氨酸)上的过程[39]。磷酸化修饰是一种可逆的蛋白质修饰,通过磷酸化修饰可以调控蛋白质活性、影响信号传递过程[40]。蛋白质的磷酸化在生物体内普遍存在,它与生命体的健康、疾病息息相关。通过检测生物体内蛋白质磷酸化及去磷酸化的变化,可以掌握其生物活性调控的主要方式。
2 外源性功能肽的分离纯化
肽可用于功能性食品、药物(抗癌、抗炎等)、化妆品的研发等[41]。通过蛋白质降解或氨基酸合成得到的外源性功能肽是由游离氨基酸、不同分子质量的氨基酸组成的肽段、大量无机盐以及未水解蛋白质等物质组成的混合物。为了获得具有特定分子质量和氨基酸组成且具有特定功能活性的肽段,必须对混合物进行分离纯化。不同的肽分子具有不同的分子质量、带电性质以及不同性质(亲/疏水性、酸/碱性)的官能团,因此可以利用这些不同性质对混合物进行分离。现阶段常用的分离纯化方法有电泳技术、膜分离技术、色谱技术以及多种方法联用等。随着肽组学的研究深入,又出现了一些新型的分离方法及分离材料,例如介孔材料、探针等[42-44]。
2.1 膜分离技术
膜分离不同于传统意义上的过滤,其可以在一定的分子质量范围内进行肽混合物的精准分离,是单纯的物理作用,具有操作简单、不影响样品活性、适用性强等特点。根据膜的孔径大小可以分为微滤膜、超滤膜、纳滤膜和反渗透膜等。目前,超滤技术已经普遍用于酶解产物的分级分离中。
杨晓泉等[45]利用3、5 ku和10 ku的切向流超滤膜将大豆肽分为4 级,其中78.46%的大豆肽分子质量集中在5 ku以下,并研究了不同级分的功能特性。Butylina等[46]选用超滤(再生纤维素C10F膜)和纳滤(NTR 7450膜)组合对乳清衍生肽进行分级分离,并对甜乳清生产蛋白浓缩后获得的渗透物中的残留肽进行纯化和结构鉴定。然而超滤不能分离游离氨基酸、寡肽、糖、非蛋白氮和盐,纳滤只能将肽和乳糖分开,其他成分并不能有效去除。
膜分离技术通常作为肽分离纯化的第一步,不需化学反应,在常温条件下进行,过程简单,适宜大量混合物的分离。但是一定分子质量范围内存在着大量结构相似、质量相近的肽段;除此之外,肽的分离纯化容易受到脱盐的影响[47]。膜材料也容易堵塞和污染,不利于资源的回收与利用。因此,对于肽的分离纯化,膜分离技术的选择性并不高。
2.2 电泳技术
在电场的作用下,带电粒子向着与之电荷相反的电极移动,称为电泳。电泳技术是基于电迁移的高性能分离技术[48],被广泛用于蛋白质的分离。高效毛细管电泳分离利用毛细管代替传统的电泳槽,效率提高了几十倍,并且具有快速、高分辨率的特点[49]。用于肽分离的毛细管电泳有毛细管区带电泳、毛细管等速电泳、毛细管等电聚焦、毛细管凝胶电泳、亲和毛细管电泳、毛细管免疫电泳、芯片式毛细管电泳、阵列毛细管电泳等[50]。 Messana等[51]发现缓冲溶液的pH值影响肽的迁移率,进而影响毛细管电泳分离肽的效果。
陈均志等[52]采用毛细管电泳无胶筛分方式对复合酶处理的大豆蛋白酶解产物进行分离。通过使用pH 8.5的缓冲液(含100 mmol/L三羟甲基氨基甲烷/盐酸、质量分数0.1%聚氧化乙烯、质量分数0.1%十二烷基硫酸钠),运行电压为10 kV,分离出7 个不同的肽组分,分子质量集中在2 000~8 000 u。杨铭等[53]采用凝胶过滤及毛细管电泳对双酶(胃蛋白酶和胰蛋白酶)降解的酪蛋白产物进行分离纯化,经毛细管电泳共分离出38 个肽段,分子质量范围为400~800 u。
电泳技术具有分辨率高、分离速度快的特点,但是进样量少、光路短,限制了其在肽分离纯化中的大规模制备及应用。
2.3 色谱技术
色谱技术是最为普遍的肽分离纯化方法。色谱技术的原理是利用混合组分物理、化学性质的差异,使其在固定相和流动相中的分布程度不同,使各组分的移动速度不同,从而达到分离的目的[54]。常用的色谱技术有大孔树脂吸附层析、凝胶过滤层析、离子交换层析、亲和层析、反相高效液相色谱法等。
2.3.1 大孔树脂吸附层析
大孔树脂可将吸附和筛选相结合,利用各组分吸附力和分子质量大小不同进行分离。大孔树脂具有回收率高、选择性好、分离效率高、吸附条件温和等特点[55],广泛用于色素、多酚、生物活性肽等水溶性化合物的分离提纯[56]。
许英一等[57]选用6 种大孔树脂对苜蓿叶蛋白肽进行分离,筛选出具有最佳分离效果的树脂为DA201-C型;DA201-C型树脂为非极性,对疏水性较强的苜蓿叶蛋白肽的吸附性较强;优化后的分离工艺为:上样流速 0.5 mL/min、上样质量浓度10 mg/mL、洗脱剂为体积分数75%乙醇溶液、洗脱流速0.5 mL/min、洗脱体积200 mL;与优化前工艺相比,苜蓿蛋白肽的纯度提高了46.95%。
大孔树脂的比表面积及孔径相对较大,吸附容量大、分离快速并且可以循环利用。但是用于分离大小相似的肽组分时效果较差,且容易受到有机物污染。
2.3.2 凝胶过滤层析
凝胶过滤层析又称排阻层析或分子筛层析,根据分子质量的不同将各组分进行分离。常用的填料为聚丙烯酰胺凝胶、琼脂糖凝胶和葡聚糖凝胶。凝胶过滤层析的分离效果与截止尺寸、空隙体积和柱体积等因素 密切相关[58],具有设备简单、过程简便、无化学变化等特点[59],广泛用于蛋白质、多糖等物质的分离纯化。
王佳佳等[60]通过超滤、葡聚糖凝胶柱(Sephadex G-25)分离纯化具有肝修复作用的文蛤寡肽,首先采用截留分子质量为5 ku的超滤膜对酶解产物进行分离,分子质量小于5 ku的混合肽采用凝胶过滤层析进一步分离纯化,得到目标肽,其氨基酸序列为Gln-Leu-Asn-Trp-Asp。 周涵黎等[61]建立了凝胶过滤色谱(Superdex peptide 10/300GL)分离洋葱多肽的工艺,得到的目标肽对α-葡萄糖苷酶和α-淀粉酶的抑制率分别为53.8%和92.6%。
虽然凝胶过滤层析能够分离酶解产物中的活性物质,但对于分子尺寸相近的肽,无法进一步纯化。凝胶过滤的分离效果易受到基质颗粒的大小及均匀程度的影响,常与其他分离方法(例如超滤等)联用才能达到最终分离纯化的目的。
2.3.3 离子交换层析
离子交换色谱是依据样品各组分所带电荷不同,与固定相上的离子交换基团相互作用的程度不同实现组分分离的技术。吸附和解吸附是离子交换的两个主要步骤。离子交换色谱现已普遍应用于蛋白质、核酸、肽的分离纯化之中[62]。
陈季旺等[63]采用强酸性阳离子交换层析技术分离米糠蛋白酶解物超滤透过液中的类阿片拮抗肽,类阿片拮抗肽的等电点为6.0,当pH值小于5.0时,大部分肽段易于吸附,因此最适上样pH值为5.0;经离体豚鼠回肠检测,分离得到的具有活性的目标肽最低质量浓度为2 mg/mL,比超滤透过液的活性高。
与凝胶过滤法相比,离子交换的色谱基质会与目标肽结合,易受到洗脱液的影响,并且对于带电荷数相似的组分难以分离。离子交换层析通常与其他分离方法联用以获得较好的分离效果。
2.3.4 亲和层析
亲和层析一般用于分离纯化蛋白质、核酸、多糖等大分子物质,依据生物分子与配体之间可逆且专一的结合能力进行分离[64],具有高选择性、高回收率的特点[65]。亲和色谱可分为免疫亲和色谱、金属离子亲和色谱、拟生物亲和色谱(例如肽亲和色谱)[66]。
查娟等[67]以醋酸乙烯酯-甲基丙烯酸烯丙酯-甲基丙烯酸缩水甘油酯三元共聚物为基质,制备硼酸亲和色谱固定相,用于分离纯化云芝糖肽,优化的吸附缓冲液为含0.4 mol/L NaCl的0.2 mol/L磷酸盐缓冲液(pH 8.5),洗脱液为0.2 mol/L硼酸溶液;纯化云芝糖肽的蛋白含量与未优化之前相比提高了2.65 倍,糖含量提高了66%。硼酸共价亲和色谱具有很高的选择性,能够将不同结构的多糖肽分离。目前,亲和层析与其他色谱方法联用常用于蛋白等物质的生物分析。
2.3.5 反相高效液相色谱法
在高效液相色谱中,当流动相极性大于固定相极性时,即为反相高效液相色谱。反相高效液相色谱是根据样品与固定相之间的疏水作用差异进行分离。疏水作用弱或亲水的物质保留时间短,容易被排出,反之,疏水性相对较强的组分在柱内滞留时间较长[68-69]。当蛋白质、多肽分子通过色谱柱时,会发生去折叠使内部疏水性基团暴露,从而与疏水固定相相互作用,因此反相色谱技术广泛用于蛋白质/多肽的分离纯化[70]。反相色谱的固定相一般为硅胶,水用作基础溶剂,常用的有机溶剂有甲醛、乙腈等[71]。
孙冰玉等[72]采用反相高效液相色谱对大豆蛋白外啡肽β-CM-3进行定性定量的检测。优化的分离条件为:柱温25 ℃,柱压9.0 MPa,流动相为体积分数15%乙腈-0.1%三氟乙酸-水,等度洗脱,流速0.9 mL/min,洗脱时间60 min。标准肽的平均回收率为95.3%,分离的精密度、准确性、灵敏度均能满足要求。
反相高效液相色谱已广泛应用于功能性肽的分离纯化,其稳定性好、分离效率高、适用性广,对于分子质量小的样品分离效果显著。然而,反相高效液相色谱的分离效果受到诸多因素的影响,例如pH值、流速、温度、流动相等,其中pH值的影响最为显著。
2.4 其他新型分离方法及材料
随着科技的发展,常用的色谱、膜分离等方法呈现操作复杂、过程重复、仪器设备要求高、价格昂贵、样品损失多、易造成环境污染等问题,研究者们正在寻求高效快速的新方法和新材料,实现肽的分离纯化。
2.4.1 生物探针技术
生物探针技术依据合成探针与目标肽的特异性结合,使目标肽从酶解产物中分离出来。Fields等[73]鉴定出一组靶向Bowman-Birk抑制剂(Bowman-Birk inhibitor,BBI)的新合成肽,并证明了其在体外结合BBI的能力,将纯化的合成肽共价固定在超顺磁性微球上,用于进一步从大豆乳清混合物中分离BBI。这种方法创造了一步分离的可能,简化了分离步骤,从而降低了分离成本。
2.4.2 纳米材料
纳米材料具有孔径可调及表面可修饰官能团的特点,极大地促进了在生物分子的分离与识别方面的 应用[74]。依据目标肽的理化性质,合成的多孔聚合物纳米材料能对其进行特定的分离纯化。
Lan Xiongdiao等[75]采用反相微乳法制备了磁性琼脂糖微球,用以分离纯化蜥蜴鱼纤维蛋白ACE抑制肽。该研究将磁性琼脂糖微球经环氧基团修饰后,再在其外表面固定ACE,得到的微球可作为磁性介质分离分子质量小于5 ku的超滤水解产物。传统的ACE抑制肽分离纯化方法过程繁琐、处理时间较长,具有一定的局限性。通过固定ACE的纳米材料,可以实现ACE抑制肽的一步分离纯化,方便快捷。
2.5 多种方法联用
采用一种方式对蛋白质、肽等物质进行分离纯化,很难达生物分析的标准。多种方式联用可以实现肽混合物的精准分级分离,以获得高纯度的肽组分。
2.5.1 超滤-凝胶过滤色谱-高效液相色谱联用
谢晓霞等[76]采用3 ku的超滤膜、葡聚糖凝胶柱SephadexG-15和反相高效液相色谱从文蛤中提取呈味物质,并制备小分子的鲜味肽,最终从7 个鲜味组分中分离纯化得到了一种新型鲜味九肽。Pan Saikun等[77]使用类似的方法从浒苔蛋白的酶解产物中分离纯化ACE抑制肽;通过截留分子质量为10 ku的超滤膜,将酶解产物分成两个级分,并对活性最高的级分进一步利用凝胶过滤和反相高效液相色谱进行纯化,所得纯化肽的ACE抑制活性的半抑制浓度(50% of inhibitory concentration,IC50)为35.9 μmol/L; 体外模拟胃肠消化实验显示,纯化得到的ACE抑制肽具有较低的胃肠道酶敏感性。
2.5.2 离子交换色谱-凝胶过滤色谱-高效液相色谱联用
管骁等[78]分离纯化燕麦蛋白的胰蛋白酶水解产物,首先采用阳离子交换剂SP-Sephadex C-25和阴离子交换剂DEAE Sepharose Fast Flow,取2.5 mL酶解产物上样;取活性最高的组分利用Sephadex G-25凝胶过滤层析柱进行分离,上样量为2 mL,蒸馏水洗脱;最后取最高活性的组分利用C18(250 mmh 10.0 mm,10 μm)和BDS-C18(250 mmh 4.6 mm,5 μm)固定相进行两次反相高效液相分离,重复进样,多次收集。所得目标肽ACE抑制活性的IC50为77.3 μmol/L,氨基酸序列为Glu-Gly-Gly-Tyr-Arg。
大部分肽都以非活性形式存在于天然物质中,因而外源性功能肽的分离重点在于达到分离纯化的效果,同时保障功能性肽的自身活性。目前所使用的分离手段存在许多缺陷,例如过程繁琐、耗时长、不环保、提取率低、成本较高,分离方法也可能会影响肽的活性等。通常采用一种方法无法实现分离纯化,多种方式联用逐渐成为外源性功能肽分离的发展趋势。
3 内源性功能肽的富集
内源性功能肽控制并影响生物体内的代谢过程,其数量和功能与人的生理及病理状态直接相关,是潜在的生物标记物[79]。然而,含有内源性功能肽的生物样品中一般含有丰度和种类差异巨大的蛋白质组分,具有研究价值的内源性功能肽成分浓度极低(小于1 nmol/L)[80],且蛋白质和内源性功能肽的物理化学性质极其相似。因此,内源性功能肽在富集过程中容易受到高丰度蛋白及其他复杂成分的影响,选择性高效富集低丰度内源性功能肽成为生物分析的难点问题。糖基化和磷酸化是最重要的蛋白质翻译后修饰,在生物体的调节机制中起关键作用。因此,糖肽及磷酸肽的富集逐渐成为肽组学中的一个重要课题。按照肽的种类,富集方法可以分为糖肽的富集、磷酸肽的富集以及其他小分子肽的富集。
3.1 糖肽的富集
糖基化是重要的蛋白质翻译后的修饰之一,人体内约有一半以上的蛋白质会发生糖基化[81]。研究发现糖基化会影响蛋白质空间结构及传导运输,且蛋白质糖基化程度及糖链的结构变化也是导致疾病(如癌变)发生的重要标志。糖肽的富集是糖基化研究的一个重要组成部分,也是肽组学研究的关键步骤之一。糖肽的富集方法主要有凝集素亲和法、肼化学法、硼酸化学法、亲水作用法等。
3.1.1 凝集素亲和法
凝集素是一种可与多糖结合的蛋白,是最早运用于糖肽富集的物质。常用的凝集素材料有选择性结合甘露糖的伴刀豆凝集素A[82]、结合N-乙酰神经氨酸单元的接骨木凝集素[83]、与岩藻糖相结合的橙黄网胞盘菌凝集素[84]、 选择性识别N-乙酰葡糖胺的小麦胚芽凝集素[85]等。凝集素亲和法的缺陷在于它只能与其识别的糖型结合,在选定凝集素的情况下,只有选择性吸附特定组成的部分糖肽。如何更多地选择性覆盖糖肽种类及数量是凝集素富集的研究重点。Pan Yiting等[86]根据原子转移自由基聚合的原理,合成了一种以二氧化硅为内核、刷状聚合物链为外壳的纳米微粒。柔性非交联聚合物链增加了凝集素和糖肽的结合位点,提高了凝集素的负载量,减小了空间位阻,改善了两者的可接近性。
3.1.2 肼化学法
肼化学法富集糖肽的过程包括将糖链上的顺式邻二醇氧化成醛;醛基与固相支持物上的酰肼基团共价 偶联[87]。与凝集素亲和法不同,肼化学法可以吸附所有的糖蛋白。
Bai Haihong等[88]将酰肼功能化亲水聚合链固定在氧化石墨烯表面,用于选择性富集N-糖肽,在实际样品应用方面,从人血清样本中鉴定出了385 个N-糖基化位点、371 个N-糖肽和187 个N-糖蛋白,是已报道数量的3 倍。表明肼化学法可以应用于生物标记物的大规模筛选,以深入研究血清N-糖蛋白组。
3.1.3 硼酸化学法
在碱性溶液中,糖链上的顺式邻位和硼酸基团发生反应形成环状二酯,从而进行糖肽的吸附;在酸性溶液中,发生碱性溶液中的可逆反应,即环状二酯水解,从而实现糖肽的解吸。硼酸易于获得,稳定且适用性强。Liu Liping等[89]选用硼酸化修饰的TiO2纳米材料改性棉絮,通过亲水相互作用色谱富集糖肽;这种方式去除了大量的非糖肽,从辣根过氧化物酶消化产物中检测到了26 种糖肽。虽然硼酸化学法具有独特的可逆性,但是结合系数较弱,不能广泛用于糖肽的分析。Zhang Yong等[90] 开发了能够在碱性及酸性条件下稳定存在的新型苯基硼酸功能化材料,用于糖肽的富集;该种功能化材料具有低检测限(0.33 fmol/μL)、高浓缩效率(78.7%),以及高回收率(约90%),能够从5 μL人血清中鉴定出209 种糖蛋白中的463 种糖肽。Xie Yiqin等[91]合成了硼酸功能化磁性金属-有机骨架复合材料,该复合材料含有大量的硼酸位点和高灵敏度(0.5 fmol/μL),且具有磁性、便于分离,能在提高富集效率的同时节省大量的操作时间。
3.1.4 亲水作用法
糖肽中还有大量的羟基,可以依据其较强的亲水性与非糖肽分离。Li Ya等[92]通过“一锅法”合成大孔吸附树脂@微孔有机聚合物功能化树脂(macroporous adsorption resin @ microporous organic polymers,MAR@MOP),该材料的比表面积为131.3 m2/g,远高于原始MAR(57.8 m2/g),三相接触角由58.8°(MAR)下降到24°,具有良好的亲水作用;将其运用于小鼠肝脏胰蛋白酶消化液的富集,在100 μg样品中鉴定出了516 种糖基化蛋白中879 个独特的N-糖基化位点。为了解决低回收率的问题,Peng Yahui等[93]将聚乙烯亚胺(polyethylenimine,PEI)接枝在硅胶(silica gel,Sil)上得到PEI-Sil,作为亲水作用吸附的固定相,当目标糖肽与非糖肽质量比为1∶3 000时,PEI-Sil仍能表现出优异的富集能力。Song Yongyang等[94]通过乳液界面聚合法制备了孔径可调并具有亲/疏水基团的异质结构纳米颗粒,用于低丰度糖肽的分离,首先通过具有大孔结构、疏水基团的纳米颗粒去除高丰度疏水蛋白及非糖肽,再用具有小孔结构、亲水基团的纳米颗粒有效吸附亲水性的糖肽;经质谱分析,制得的纳米颗粒富集了22 个糖 肽信号。
3.2 磷酸肽的富集
磷酸化肽的富集容易受到高丰度蛋白的影响[95]。如何高效快速地富集磷酸化肽段是近年肽组学的研究热点。磷酸肽的富集方法主要有亲和色谱富集法、离子交换色谱法。
3.2.1 亲和色谱法
磷酸肽的亲和色谱法富集主要分为金属氧化物亲和色谱(metal oxide affinity chromatography,MOAC)法、固定化金属离子亲和色谱(immobilized metal affinity chromatography,IMAC)法和金属有机 骨架法。
MOAC是基于金属氧化物与磷酸基团的亲和作用,常用的金属氧化物有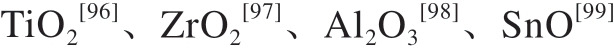 以及ZnO[100]等。其中,TiO2是最早也是最广应用的材料。Hong Yayun等[101]合成了具有较大比表面积和孔体积的中孔TiO2纳米材料,其大孔径及中空结构能够有效防止富集中的“阴影效应”;与小孔TiO2磁性材料相比,中空结构的TiO2材料显示出更高的富集选择性和更低的磷酸检测限(0.2 fmol/μL)。
以及ZnO[100]等。其中,TiO2是最早也是最广应用的材料。Hong Yayun等[101]合成了具有较大比表面积和孔体积的中孔TiO2纳米材料,其大孔径及中空结构能够有效防止富集中的“阴影效应”;与小孔TiO2磁性材料相比,中空结构的TiO2材料显示出更高的富集选择性和更低的磷酸检测限(0.2 fmol/μL)。
IMAC材料的合成比MOAC材料的合成操作简单,易于控制。随着磷酸肽富集研究的深入,发现IMAC材料中螯合化合物的富集效果严重依赖于吸附/洗脱条件,研究者们以此为改进技术的突破口,不断制备出新型材料。Hong Yayun等[102]通过PEI、植酸和Ti4+合成了具有良好亲水性的磁性二氧化硅微球,用于磷酸肽富集,从2 μL人血清中鉴定出132 个(总共276 个)糖蛋白的N-糖肽,从200 μg HeLa细胞提取物中鉴定出704 个磷蛋白上的磷酸肽。Zhu Baode等[103]将Bi3+、Fe3+和Zr4+ 3 种金属阳离子加入至TiO2中,合成了TiO2/Bi/Fe/Zr纳米复合材料,增加了材料的吸附位点。经Fe3+和Ti4+修饰的纳米材料分别对酸性和碱性磷酸肽具有不同的结合亲和力[104]。组合不同的金属离子可提高磷酸肽的富集效率和选择性。
金属有机骨架是用于磷酸肽富集的新型多孔材料,与MOAC和IMAC材料相比,具有较大的孔内比表面积和较好的富集效果。Xie Yiqin等[105]选用磁性铒(Er)合成了金属有机骨架材料Fe3O4@PDA@Er。在20 amol/μL的检测限内仍能检测到人血清样本中的5 个磷酸肽峰,说明该合成材料具有超高的灵敏性和选择性。Zhou Jianqiao等[106]制备了双功能磁性锆基金属有机骨架,该纳米颗粒中固有的Zrü O基团起到MOAC的作用,固定的Ti4+起到IMAC的作用,结合了IMAC和MOAC的亲和能力,具有大表面积(237.9 m2/g)和高结合力(100 mg/g),以及良好的富集回收率(84.8%)。
3.2.2 离子交换色谱法
离子交换色谱主要依据磷酸肽和非磷酸肽的电荷差异实现磷酸肽的富集。溶液的pH值是影响磷酸肽特异性吸附的重要因素。Alpert等[107]利用阴离子交换色谱富集磷酸肽,发现在pH值大于5的溶液中,磷酸肽带负电荷,在阴离子交换色谱(anion exchange chromatography,AEX)中保留完好;而当pH值小于2时,则有利于从未修饰的酸性肽中分离磷酸肽。在此基础上,Zhu Gangtian等[108]制备了高耐酸性的磁性straticulate-C3N4材料,这种AEX材料在pH值小于1.8的环境下仍能保持较高的特异性吸附能力。
3.3 其他低丰度肽的分离方法
除了磷酸肽及糖肽,生物体内还有多种与生物体代谢及与生理活动密切相关的内源性功能肽。研究发现瓜氨酸化在自身免疫性疾病类风湿关节炎中发挥着关键性作用[109]。在较低pH值下,瓜氨酸侧链脲基只与乙二醛发生反应[110]。Tutturen等[111]选择亲水性丙烯酰胺基珠(肌氨酸二甲基丙烯酰胺树脂)作为反应珠,将乙二醇衍生物固定在反应珠上,合成了特异性富集瓜氨酸的纳米材料,成功用于富集混有合成瓜氨酸肽(50 pmol)的胰蛋白酶牛血清白蛋白消化液(50 pmol)。
Palani等[112]合成了具有超顺磁性的Fe3O4@SiO2纳米材料,并在其表面修饰巯基官能团,从而特异性吸附半胱氨酰肽,去除其他复杂蛋白质组分的影响,快速富集半胱氨酰肽。Saraji等[113]制备了酰肼功能化磁性纳米粒子快速吸附N-末端丝氨酸和苏氨酸肽;吸附前,首先将目标肽中1,2-氨基醇的羟基氧化为醛基,然后将醛基与酰肼功能化磁性纳米粒子进行特异性结合。
此外,对于普遍内源性功能肽的富集,Z h a n g Quanqing等[114]合成了有序介孔二氧化硅-碳材料,碳和石墨烯的独特疏水性确保了肽富集的高效率,能够从20 μL人血清中富集892 种内源性功能肽(使用石墨烯@mSiO2,仅富集到344 种)。Yao Ning等[115]依据材料与肽间的疏水作用,利用氯二甲基辛基硅烷改性胺功能化磁性颗粒,制备了C8功能化磁性颗粒(约50 nm);与广泛运用的商业化C8功能化磁珠(1~10 μm)相比,它具有更加优异的磁性及更好的分散性,在人血清样本中,只需要富集约30 s,就可以鉴定出内源性功能肽。
纳米材料与色谱法联用富集内源性功能肽,能够去除复杂成分和高丰度蛋白的影响,并且能定向提取某种肽类。其已经成功应用于人血清、小鼠大脑提取物及人体其他体液中内源性功能肽的富集,但是纳米材料不适用于大量的生物分析,且纳米材料也不易与样品分离,造成目标肽污染。因此,需要研制出更加快速、高效、易于分离的新型纳米材料。
4 结 语
功能性肽可以用于功能性食品开发、疾病检测、美容用品研发等领域,具有极大的开发利用潜力。然而因其制备产物成分复杂或其本身含量极低,影响了分离和富集效果,制约了其功能的开发和利用。
关于外源性功能肽的分离纯化,目前所使用的各种分离手段存在不足之处。近年来,肽分离纯化的发展趋势是多种方法联用。尽管多种方法联用能够实现优势互补、分级分离,从而获得高纯的肽组分并进行结构分析,但是过程繁琐复杂、回收率低,对于特定功能的肽分离,效果并不理想。因此寻找更高效、快速的肽分离方法,将为肽的功能性研究和利用带来更广阔的发展空间。
关于低丰度内源性功能肽的富集,如何高效去除高丰度蛋白的影响、提高内源性功能肽的富集效率和回收率、实现大规模鉴定是方法成功的关键。介孔材料通过体积排阻效应可以有效去除高丰度蛋白,表面修饰的特定基团能够快速高效富集肽,因此,表面功能化的介孔材料能够选择性吸附具有特定结构的内源性功能肽,具有良好的发展前景。
功能性肽的深入研究与人类健康息息相关,其分离与富集技术的优化能够促进食品、药品等行业的快速发展,为实现这个目标需要借助其他领域的新材料、新方法,发展出便捷、高效、覆盖面广的分离和富集方法,才能更便捷、更高效地得到功能性肽,为国民健康奠定坚实的基础。
[1] 冯怀蓉, 张慧涛, 茆军. 多肽简介及应用[J]. 新疆农业科学, 2002, 39(1): 38-39. DOI:10.3969/j.issn.1001-4330.2002.01.013.
[2] CHALAMAIAH M, YU W L, WU J P. Immunomodulatory and anticancer protein hydrolysates (peptides) from food proteins: a review[J]. Food Chemistry, 2018, 245: 205-222. DOI:10.1016/j.foodchem.2017.10.087.
[3] LACOU L, LÉONIL J, GAGNAIRE V. Functional properties of peptides: from single peptide solutions to a mixture of peptides in food products[J]. Food Hydrocolloids, 2016, 57: 187-199. DOI:10.1016/j.foodhyd.2016.01.028.
[4] 胡晓, 孙恢礼, 李来好, 等. 我国酶解法制备水产功能性肽的研究进展[J]. 食品工业科技, 2012, 33(24): 410-413. DOI:10.13386/j.issn1002-0306.2012.24.062.
[5] 贺光祖, 谭碧娥, 肖昊, 等. 肠道小肽吸收利用机制及其营养功能[J]. 动物营养学报, 2015, 27(4): 1047-1054. DOI:10.3969/j.issn.1006-267x.2015.04.007.
[6] 车媛媛, 查向东, 劳泰财, 等. 抗菌肽的研究进展及其应用[J]. 广东 饲料, 2016, 25(12): 34-37. DOI:10.3969/j.issn.1005-8613.2016.12.009.
[7] 李勇. 生物活性肽研究现况和进展[J]. 食品与发酵工业, 2007, 33(1): 3-9. DOI:10.3321/j.issn:0253-990X.2007.01.002.
[8] ERAK M, BELLMANN-SICKERT K, ELS-HEINDL S, et al. Peptide chemistry toolbox-transforming natural peptides into peptide therapeutics[J]. Bioorganic & Medicinal Chemistry, 2018, 26(10): 2759-2765. DOI:10.1016/j.bmc.2018.01.012.
[9] LAMMI C, AIELLO G, BOSCHIN G, et al. Multifunctional peptides for the prevention of cardiovascular disease: a new concept in the area of bioactive food-derived peptides[J]. Journal of Functional Foods, 2019, 55: 135-145. DOI:10.1016/j.jff.2019.02.016.
[10] GIANFRANCESCHI G L, GIANFRANCESCHI G, QUASSINTI L, et al. Biochemical requirements of bioactive peptides for nutraceutical efficacy[J]. Journal of Functional Foods, 2018, 47: 252-263. DOI:10.1016/j.jff.2018.05.034.
[11] 秦洪强. 复杂生物样品中蛋白质/多肽的高效富集与选择性标记方法研究[D]. 北京: 中国科学院, 2013: 56-73.
[12] 崔波, 程云辉, 钟秋平. 毛细管电泳在多肽分离和检测中的应用[J]. 食品与机械, 2004, 20(3): 45-47; 58. DOI:10.3969/j.issn.1003-5788.2004.03.020.
[13] 黄文凯. 膜分离方法制备免疫活性大豆肽的研究[D]. 无锡: 江南大学, 2007: 4-7. DOI:10.7666/d.y1195319.
[14] 张祥民, 刘宝红, 张丽华, 等. 色谱技术分离蛋白酶解和蛋白/多肽的研究进展[J]. 中国科学: 化学, 2010, 40(5): 685-694.
[15] TU M L, CHENG S Z, LU W H, et al. Advancement and prospects of bioinformatics analysis for studying bioactive peptides from food-derived protein: sequence, structure, and functions[J]. Trends in Analytical Chemistry, 2018, 105: 7-17. DOI:10.1016/j.trac.2018.04.005.
[16] 余楠楠, 陈琛. 生物活性肽功能及制备技术研究进展[J]. 中国酿造, 2018, 37(9): 17-21. DOI:10.11882/j.issn.0254-5071.2018.09.004.
[17] 丛峰松. 神奇的小分子活性肽[M]. 上海: 上海交通大学出版社, 2015: 23-40.
[18] 鲁文玉, 于文静, 孙德群. 海洋生物活性肽在药物研发中的应用进展[J]. 有机化学, 2017, 37(7): 1681-1700. DOI:10.6023/cjoc201612062.
[19] 何传波, 邵杰, 魏好程, 等. 鲍内脏蛋白肽抗氧化和免疫调节活性[J]. 食品科学, 2018, 39(5): 206-212. DOI:10.7506/spkx1002-6630-201805031.
[20] 李梅青, 王康, 周鑫. 绿豆活性肽对HepG2肝癌细胞增殖的抑制 作用[J]. 中国食品学报, 2018, 18(10): 52-57. DOI:10.16429/j.1009-7848.2018.10.008.
[21] 张燕, 魏汝君, 潘风光, 等. 蛋清源活性肽抗氧化及抗炎活性[J]. 食品科学, 2018, 39(13): 153-158. DOI:10.7506/spkx1002-6630-201813023.
[22] 韩晓燕, 包郁明, 辛凤姣, 等. 棉籽抗菌活性肽的分离纯化及鉴定[J]. 食品科学, 2017, 38(11): 122-127. DOI:10.7506/spkx1002-6630-201711020.
[23] 赵俊良, 卢海鹏, 芒来, 等. 乳酸菌盐溶性蛋白培养物中血管紧张素转化酶抑制活性肽的测定及分离[J]. 食品科学, 2016, 37(9): 170-174. DOI:10.7506/spkx1002-6630-201609032.
[24] UDENIGWE C C, ALUKO R E. Food protein-derived bioactive peptides: production, processing, and potential health benefits[J]. Journal of Food Science, 2012, 77(1): 11-24. DOI:10.1111/j.1750-3841.2011.02455.x.
[25] SHAZLY A B, HE Z Y, EL-AZIZ M A, et al. Fractionation and identification of novel antioxidant peptides from buffalo and bovine casein hydrolysates[J]. Food Chemistry, 2017, 232: 753-762. DOI:10.1016/j.foodchem.2017.04.071.
[26] 马俪珍, 甄润英, 张建荣, 等. 具免疫活性的鲶鱼胶原多肽酶解工艺研究[J]. 食品工业科技, 2008, 29(4): 152-155. DOI:10.13386/j.issn1002-0306.2008.04.041.
[27] 王一名, 毛相朝, 曹雪, 等. 磷酸化南极磷虾肽调控Wnt/β-连接蛋白通路改善大鼠骨质疏松症[J]. 中国食品学报, 2018, 18(3): 8-15. DOI:10.16429/j.1009-7848.2018.03.002.
[28] 胡婧婷, 邱智东, 朱迪夫, 等. 人参糖肽的结构及其对Aβ25-35处理PC12细胞的抗凋亡作用[J]. 吉林大学学报(医学版), 2019, 45(2): 286-293. DOI:10.13481/j.1671-587x.20190213.
[29] MIRZAEI M, MIRDAMADI S, SAFAVI M, et al. In vitro and in silico studies of novel synthetic ACE-inhibitory peptides derived from Saccharomyces cerevisiae protein hydrolysate[J]. Bioorganic Chemistry, 2019, 87: 647-654. DOI:10.1016/j.bioorg.2019.03.057.
[30] GU Longjian, ZHAO Mouming, LI Wenzhi, et al. Chemical and cellular antioxidant activity of two novel peptides designed based on glutathione structure[J]. Food and Chemical Toxicology, 2012, 50(11): 4085-4091. DOI:10.1016/j.fct.2012.08.028.
[31] ROMANOVA E V, DOWD S E, SWEEDLER J V. Quantitation of endogenous peptides using mass spectrometry based methods[J]. Current Opinion in Chemical Biology, 2013, 17(5): 801-808. DOI:10.1016/j.cbpa.2013.05.030.
[32] SUN B, RANISH J A, UTLEG A G, et al. Shotgun glycopeptide capture approach coupled with mass spectrometry for comprehensive glycoproteomics[J]. Molecular& Cellular Proteomics, 2007, 6(1): 141-149. DOI:10.1074/mcp.T600046-MCP200.
[33] 于晶, 李晓敏, 李红梅, 等. 糖蛋白糖基化位点及糖型的多重质谱分析[J]. 分析化学, 2015, 43(4): 564-569. DOI:10.11895/j.issn.0253-3820.140912.
[34] 江静, 应万涛, 钱小红. 亲水相互作用色谱结合串联质谱多重碎裂模式在完整糖肽研究中的应用[J]. 分析化学, 2014, 42(2): 159-165. DOI:10.3724/SP.J.1096.2014.30310.
[35] JI Y S, LÜ R H, SONG S H, et al. Facile fabrication of zwitterionic magnetic composites by one-step distillation-precipitation polymerization for highly specific enrichment of glycopeptides[J]. Analytica Chimica Acta, 2019, 1053: 43-53. DOI:10.1016/j.aca.2018.12.003.
[36] LIU Y J, FU D M, YU L, et al. Oxidized dextran facilitated synthesis of a silica-based concanavalin a material for lectin affinity enrichment of glycoproteins/glycopeptides[J]. Journal of Chromatography A, 2016, 1455: 147-155. DOI:10.1016/j.chroma.2016.05.093.
[37] LIU L P, JIN S X, MEI P C, et al. Preparation of cotton wool modified with boric acid functionalized titania for selective enrichment of glycopeptides[J]. Talanta, 2019, 203: 58-64. DOI:10.1016/j.talanta.2019.05.050.
[38] BAI H H, PAN Y T, GUO C, et al. Synthesis of hydrazidefunctionalized hydrophilic polymer hybrid graphene oxide for highly efficient N-glycopeptide enrichment and identification by mass spectrometry[J]. Talanta, 2017, 171: 124-131. DOI:10.1016/j.talanta.2017.04.076.
[39] 严冬梅, 李洪. 磷酸化蛋白质检测技术研究进展[J]. 泸州西南医学院学报, 2006, 29(5): 460-461. DOI:10.3969/j.issn.1000-2669.2006.05.024.
[40] 石文昊, 童梦莎, 李恺, 等. 基于质谱的磷酸化蛋白质组学: 富集、检测、鉴定和定量[J]. 生物化学与生物物理进展, 2018, 45(12): 1250-1258. DOI:10.16476/j.pibb.2018.0292.
[41] SEWALD N, JAKUBKE H D. Peptides: chemistry and biology[M]. Weinheim: Wiley, 2002: 56-60.
[42] ACQUAH C, CHAN Y W, PAN S, et al. Structure-informed separation of bioactive peptides[J]. Journal of Food Biochemistry, 2019, 43: e12765. DOI:10.1111/jfbc.12765.
[43] KLAASSEN N, SPICER V, KROKHIN O V. Universal retention standard for peptide separations using various modes of highperformance liquid chromatography[J]. Journal of Chromatography A, 2019, 1588: 163-168. DOI:10.1016/j.chroma.2018.12.057.
[44] GIACOMETTI J, BURETIĆ-TOMLJANOVIĆ A. Peptidomics as a tool for characterizing bioactive milk peptides[J]. Food Chemistry, 2017, 230: 91-98. DOI:10.1016/j.foodchem.2017.03.016.
[45] 杨晓泉, 张新会, 陈山, 等. 大豆肽的分级膜分离研究[J]. 华南理工大学学报(自然科学版), 2003, 31(5): 16-20. DOI:10.3321/j.issn: 1000-565X.2003.05.004.
[46] BUTYLINA S, LUQUE S, NYSTRÖM M. Fractionation of whey-derived peptides using a combination of ultrafiltration andnanofiltration[J]. Journal of Membrane Science, 2006, 280(1/2): 418-426. DOI:10.1016/j.memsci.2006.01.046.
[47] 林谢凤, 郭洪辉. 纳滤膜对鱼鳞小分子胶原肽提取液脱盐性能的研究[J]. 渔业研究, 2015, 37(1): 43-49. DOI:10.14012/j.cnki.fjsc.2015.01.006.
[48] BENAVENTE F, PERO-GASCON R, PONT L, et al. Identification of antihypertensive peptides in nutraceuticals by capillary electrophoresismass spectrometry[J]. Journal of Chromatography A, 2018, 1579: 129-137. DOI:10.1016/j.chroma.2018.10.018.
[49] WANG X Q, HU Y H, QU F, et al. Multiple modes of capillary electrophoresis applied in peptide nucleic acid related study[J]. Journal of Chromatography A, 2017, 1501: 161-166. DOI:10.1016/j.chroma.2017.04.038.
[50] 崔波, 程云辉, 钟秋平. 毛细管电泳在多肽分离和检测中的应用[J]. 食品与机械, 2004, 20(3): 45-47; 58. DOI:10.3969/j.issn.1003-5788.2004.03.020.
[51] MESSANA I, ROSSETTI D V, CASSIANO L, et al. Peptide analysis by capillary (zone) electrophoresis[J]. Journal of Chromatography B: Biomedical Sciences and Applications, 1997, 699(1/2): 149-171. DOI:10.1016/s0378-4347(97)00198-9.
[52] 陈均志, 张海平, 顾玲, 等. 高效毛细管电泳-紫外检测法分离测定微波复合酶法大豆蛋白水解物中的多肽[J]. 食品工业科技, 2005, 26(8): 163-165. DOI:10.3969/j.issn.1002-0306.2005.08.055.
[53] 杨铭, 胡志和. 酪蛋白双酶水解物ACE抑制肽的分离纯化[J]. 食品科学, 2012, 33(9): 50-53.
[54] 李文龙, 张慧, 汤琦, 等. 高效液相色谱在多肽分离分析中的应用[J]. 分析仪器, 2018(1): 63-67. DOI:10.3969/j.issn.1001-232x.2018.01.011.
[55] ZHUANG M Z, ZHAO M M, LIN L Z, et al. Macroporous resin purification of peptides with umami taste from soy sauce[J]. Food Chemistry, 2016, 190: 338-344. DOI:10.1016/j.foodchem.2015.05.105.
[56] 刘春憬. 大孔吸附树脂在中药分离纯化中的研究进展[J]. 农产品加工, 2015(4): 54-57. DOI:10.3969/jissn.1671-9646(X).2015.02.043.
[57] 许英一, 吴红艳, 王宇, 等. 大孔树脂纯化苜蓿叶蛋白肽的工艺优化[J]. 食品与机械, 2019, 35(5): 167-171. DOI:10.13652/j.issn.1003-5788.2019.05.030
[58] DUONGLY K C, GABELLIS B. Chapter nine-gel filtration chromatography (size exclusion chromatography) of proteins[J]. Methods in Enzymology, 2016, 541: 105-114. DOI:10.1016/B978-0-12-420119-4.00009-4.
[59] 杨歌德, 姜玉梅, 周宏博. 凝胶过滤层析分离蛋白质实验中三种过滤介质分离效果的比较[J]. 哈尔滨医科大学学报, 2002, 36(3): 242-243. DOI:10.3969/j.issn.1000-1905.2002.03.025.
[60] 王佳佳, 赵莎莎, 杨最素, 等. 文蛤寡肽对小鼠急性肝损伤的保护作用[J]. 食品科学, 2017, 38(13): 190-195. DOI:10.7506/spkx1002-6630-201713031.
[61] 周涵黎, 吴悠, 李婷, 等. 洋葱多肽的凝胶色谱分离及体外降糖活性研究[J]. 食品科技, 2016, 41(9): 235-238. DOI:10.13684/j.cnki.spkj.2016.09.047.
[62] 钟芳, 张晓梅, 麻建国. 大豆肽的离子交换色谱分离及其活性评价[J]. 食品与机械, 2006, 22(5): 16-19. DOI:10.3969/j.issn.1003-5788.2006.05.004.
[63] 陈季旺, 姚惠源, 刘清, 等. 预分离米糠蛋白类阿片拮抗肽的离子交换工艺[J]. 食品科技, 2005, 30(6): 88-91. DOI:10.3969/j.issn.1005-9989.2005.06.029.
[64] 孙维敏. 抗体纯化中亲和色谱配体的研究进展[J]. 离子交换与吸附, 2005, 21(3): 283-288. DOI:10.3321/j.issn:1001-5493.2005.03.013.
[65] 姚凯, 张伟, 杨琳燕, 等. 免疫亲和色谱与固相微萃取联用技术研究进展[J]. 动物医学进展, 2016, 37(1): 88-92. DOI:10.3969/j.issn.1007-5038.2016.01.020.
[66] 刘望才, 朱家文. 亲和色谱技术研究进展[J]. 上海化工, 2007(4): 27-29. DOI:10.3969/j.issn.1004-017X.2007.04.009.
[67] 查娟, 刘坐镇, 邬行彦. 云芝糖肽的硼酸亲和色谱纯化[J]. 中国医药工业杂志, 2003, 34(2): 66-69. DOI:10.3969/j.issn.1001-8255.2003.02.009.
[68] 李文龙, 张慧, 汤琦, 等. 高效液相色谱在多肽分离分析中的应用[J]. 分析仪器, 2018(1): 63-67. DOI:10.3969/j.issn.1001-232x.2018.01.011.
[69] 韩香, 顾军. 高效液相色谱法在合成多肽分离与纯化中的应用[J]. 天津药学, 2003, 15(6): 42-44. DOI:10.3969/j.issn.1006-5687.2003.06.023.
[70] 朱晓囡, 苏志国. 反相液相色谱在蛋白质及多肽分离分析中的应用[J]. 分析化学, 2004, 32(2): 248-254. DOI:10.3321/j.issn:0253-3820.2004.02.030.
[71] 吕艳, 冯凤琴. 反相高效液相色谱定量分析多肽中的氨基酸组成[J]. 浙江农业科学, 2006, 1(2): 211-214. DOI:10.16178/j.issn.0528-9017.2006.02.040
[72] 孙冰玉, 石彦国, 胡春林, 等. 反相高效液相色谱法检测大豆蛋白外啡肽的研究[J]. 食品工业科技, 2010, 31(9): 339-342. DOI:10.13386/j.issn1002-0306.2010.09.033.
[73] FIELDS C, MALLEE P, MUZARD J, et al. Isolation of Bowman-Birk-Inhibitor from soybean extracts using novel peptide probes and high gradient magnetic separation[J]. Food Chemistry, 2012, 134(4): 1831-1838. DOI:10.1016/j.foodchem.2012.03.085.
[74] JIMENEZ-SOLOMON M F, SONG Q L, JELFSK K E. Polymer nanofilms with enhanced microporosity by interfacial polymerization[J]. Nature Materials, 2016, 15(7): 760-767. DOI:10.1038/nmat4638.
[75] LAN Xiongdiao, LIAO Dankui, WU Shanguang, et al. Rapid purification and characterization of angiotensin converting enzyme inhibitory peptides from lizard fish protein hydrolysates with magnetic affinity separation[J]. Food Chemistry, 2015, 182: 136-142. DOI:10.1016/j.foodchem.2015.02.004.
[76] 谢晓霞, 刘晏玮, 李学鹏, 等. 文蛤水煮液中鲜味肽的分离鉴定及呈味特性研究[C]// 中国食品科学技术学会第十五届年会论文摘要集, 青岛, 2018: 722-723.
[77] PAN Saikun, WANG Shujun, JING Lingling, et al. Purification and characterisation of a novel angiotensin-I converting enzyme (ACE)-inhibitory peptide derived from the enzymatic hydrolysate of enteromorphaclathrata protein[J]. Food Chemistry, 2016, 211: 423-430. DOI:10.1016/j.foodchem.2016.05.087.
[78] 管骁, 刘静, 王立, 等. 高活性燕麦蛋白源ACE抑制肽的制备、纯化及结构鉴定[J]. 高等学校化学学报, 2009, 30(10): 1992-1997. DOI:10.3321/j.issn:0251-0790.2009.10.016.
[79] DASGUPTA S, FRICKERLD. High-resolution analytical tools for quantitative peptidomics[J]. Comprehensive Analytical Chemistry, 2014, 63: 305-324. DOI:10.1016/B978-0-444-62651-6.00014-3.
[80] MÖHRING T, KELLMANN M, JÜRGENS M, et al. Top-down identification of endogenous peptides up to 9 kDa in cerebrospinal fluid and brain tissue by nanoelectrospray quadrupole time-of-flight tandem mass spectrometry[J]. Mass Spectrom, 2005, 40: 214-226. DOI:10.1002/jms.741.
[81] 刘玉洁. 亲和色谱材料的制备及在糖蛋白/糖肽分离分析中的应用研究[D]. 大连: 大连理工大学, 2016: 1-2.
[82] TOMANA M, NIEDERMEIER W, MESTECKY J, et al. Affinity chromatography of glycopeptides using concanavalin A[J]. Analytical Biochemistry, 1976, 72(1/2): 389-399. DOI:10.1016/0003-2697(76)90546-7.
[83] BROEKAERT W F, NSIMBA-LUBAKI M, PEETERS B, et al. A lectin from elder (Sambucus nigra L.) bark[J]. Biochemical Journal, 1984, 221: 163-169. DOI:10.1042/bj2210163.
[84] BERGSTRÖM M, ÅSTRÖM E, PÅHLSSON P, et al. Elucidating the selectivity of recombinant forms of Aleuriaaurantia lectin using weak affinity chromatography[J]. Journal of Chromatography B, 2012, 885/886: 66-72. DOI:10.1016/j.jchromb.2011.12.015.
[85] 李慧, 毕娟, 徐希明, 等. 麦胚凝集素化壳聚糖纳米粒及与 N-乙酰葡萄糖胺的结合作用[J]. 药学学报, 2012, 47(1): 131-134. DOI:10.16438/j.0513-4870.2012.01.022.
[86] PAN Yiting, BAI Haihong, MA Cheng, et al. Brush polymer modified and lectin immobilized core-shell microparticle for highly efficient glycoprotein/glycopeptide enrichment[J]. Talanta, 2013, 115: 842-848. DOI:10.1016/j.talanta.2013.06.031.
[87] 丁鹏, 陈掀, 李秀玲, 等. 基于纳米粒子的糖蛋白/糖肽分离富集方法[J]. 化学进展, 2015, 27(11): 1628-1639. DOI:10.7536/PC150513.
[88] BAI Haihong, PAN Yiting, GUO Cong, et al. Synthesis of hydrazidefunctionalized hydrophilic polymer hybrid graphene oxide for highly efficient N-glycopeptide enrichment and identification by mass spectrometry[J]. Talanta, 2017, 171: 124-131. DOI:10.1016/j.talanta.2017.04.076.
[89] LIU Liping, JIN Shanxia, MEI Pengcheng, et al. Preparation of cotton wool modified with boric acid functionalized titania for selective enrichment of glycopeptides[J]. Talanta, 2019, 203: 58-64. DOI:10.1016/j.talanta.2019.05.050.
[90] ZHANG Yong, JING Hongyu, WEN Tao, et al. Phenylboronic acid functionalized C3N4 facultative hydrophilic materials for enhanced enrichment of glycopeptides[J]. Talanta, 2019, 191: 509-518. DOI:10.1016/j.talanta.2018.09.016.
[91] XIE Yiqin, LIU Qianjing, LI Yan, et al. Core-shell structured magnetic metal-organic framework composites for highly selective detection of N-glycopeptides based on boronic acid affinity chromatography[J]. Journal of Chromatography A, 2018, 1540: 87-93. DOI:10.1016/j.chroma.2018.02.013.
[92] LI Ya, WANG Hongwei, YOU Xin, et al. Facile preparation of microporous organic polymers functionalized macroporous hydrophilic resin for selective enrichment of glycopeptides[J]. Analytica Chimica Acta, 2018, 1030: 96-104. DOI:10.1016/j.aca.2018.05.040.
[93] PENG Yahui, FU Dongmei, ZHANG Feifang, et al. A highly selective hydrophilic sorbent for enrichment of N-linked glycopeptides[J]. Journal of Chromatography A, 2016, 1460: 197-201. DOI:10.1016/j.chroma.2016.07.028.
[94] SONG Yongyang, LI Xiuling, FAN Junbing, et al. Interfacially polymerized particles with heterostructured nanopores for glycopeptide separation[J]. Advanced Materials, 2018, 30: 1-8. DOI:10.1002/adma.201803299.
[95] 龙星宇, 练鸿振. 基于质谱技术的磷酸化蛋白/多肽分离富集、鉴定及组学研究[J]. 色谱, 2016, 34(4): 357-359. DOI:10.3724/SP.J.1123.2016.03020.
[96] LIU H L, ZHOU J H, HUANG H Y, et al. Amine-functionalized TiO2 nanoparticles for highly selective enrichment of phosphopeptides[J]. Talanta, 2015, 143: 431-437. DOI:10.1016/j.talanta.2015.05.019.
[97] KWEON H K, HÅKANSSON K. Selective zirconium dioxidebased enrichment of phosphorylated peptides for mass spectrometric analysis[J]. Analytica Chemica Acta, 2006, 78: 1743-1749. DOI:10.1021/ac0522355.
[98] LI Y, LIU Y C, TANG J, et al. Fe3O4@Al2O3 magnetic core-shell microspheres for rapid and highly specific capture ofphosphopeptides with mass spectrometry analysis[J]. Journal of Chromatography A, 2007, 1172(1): 57-71. DOI:10.1016/j.chroma.2007.09.062.
[99] LEE J K, KIM Y K, CHOI B J, et al. SnO-decorated TiO2 nanoparticle with enhanced photocatalytic performance for methylene blue degradation[J]. Applied Surface Science, 2019, 480: 1089-1092. DOI:10.1016/j.apsusc.2019.02.175.
[100] SUN S T, MA H T, HAN G H, et al. Efficient enrichment and identification of phosphopeptides by cerium oxide using on-plate matrix-assisted laser desorption/ionization time-of-flight mass spectrometric analysism[J]. Rapid Commun Mass Spectrom, 2011, 25(13): 1862-1868. DOI:10.1002/rcm.505.
[101] HONG Yayun, ZHANQ liang, PU Chenlu, et al. Highly efficient enrichment of phosphopeptides from HeLa cells using hollow magnetic macro/mesoporous TiO2 nanoparticles[J]. Talanta, 2018, 187: 223-230. DOI:10.1016/j.talanta.2018.05.031.
[102] HONG Yayun, ZHAN Qiliang, ZHENG Yu, et al. Hydrophilic phytic acid-functionalized magnetic dendritic mesoporous silica nanospheres with immobilized Ti4+: a dual-purpose affinity material for highly efficient enrichment of glycopeptides/phosphopeptides[J]. Talanta, 2019, 197: 77-85. DOI:10.1016/j.talanta.2019.01.005.
[103] ZHU Baode, ZHOU Qian, ZHEN Deshuai, et al. Preparation of TiO2/Bi/Fe/Zr nanocomposite for the highly selective enrichment of phosphopeptides[J]. Talanta, 2019, 194: 870-875. DOI:10.1016/j.talanta.2018.10.073.
[104] LAIAC Y, TSAI C F, HSU C C, et al. Complementary Fe3+-and Ti4+-immobilized metal ion affinity chromatography for purification of acidic and basic phosphopeptides rapid commun[J]. Mass Spectrom, 2012, 26: 2186-2194. DOI:10.1002/rcm.6327.
[105] XIE Yiqin, DENG Chunhui. Highly efficient enrichment of phosphopeptides by a magnetic lanthanide metal-organic framework[J]. Talanta, 2016, 159: 1-6. DOI:10.1016/j.talanta.2016.05.075.
[106] ZHOU Jianqiao, LIANG Yulu, HE Xiwen, et al. Dual-functionalized magnetic metal-organic framework for highly specific enrichment of phosphopeptides[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(12): 11413-11421. DOI:10.1021/acssuschemeng.7b02521.
[107] ALPERT A J, HUDECZ O, MECHTLER K. Anion-exchange chromatography of phosphopeptides: weak anion exchange versus strong anion exchange and anion-exchange chromatography versus electrostatic repulsion-hydrophilic interaction chromatography[J]. Analytical Chemistry, 2015, 87(9): 4704-4711. DOI:10.1021/ac504420c.
[108] ZHU Gangtian, HE Xiaomei, CHEN Xi, et al. Magnetic graphitic carbon nitride anion exchanger for specific enrichment of phosphopeptides[J]. Journal of Chromatography A, 2016, 1437: 137-144. DOI:10.1016/j.chroma.2016.01.080.
[109] KLARESKOG L, RÖNNELID J, PADYUKOV L, et al. AlfredssonImmunity to citrullinated proteins in rheumatoid arthritis[J]. Annual Review of Immunology, 2008, 26: 651-675. DOI:10.1146/annurev.immunol.26.021607.090244.
[110] SENSHU T, SATO T, INOUE T K, et al. Detection of citrulline residues in deiminated proteins on polyvinylidene difluoride membrane[J]. Analytical Biochemistry, 1992, 203(1): 94-100. DOI:10.1016/0003-2697(92)90047-B.
[111] TUTTUREN A E V, HOLM A, JORGENSEN M, et al. A technique for the specific enrichment of citrulline-containing peptides[J]. Analytical Biochemistry, 2010, 403(1/2): 43-51. DOI:10.1016/j.ab.2010.04.012.
[112] PALANI A, LEE J S, HUH J, et al. Selective Enrichment of cysteinecontaining peptides using SPDP-functionalized superparamagnetic Fe3O4@SiO2 nanoparticles[J]. Application to Comprehensive Proteomic Profiling, 2008, 7(8): 3591-3596. DOI:10.1021/pr800067x.
[113] SARAJI M, YOUSEFI S. Hydrazide functionalized magnetic nanoparticles for specific extraction of N-terminal serine and threonine peptides[J]. Biomedical Chromatography, 2018, 32(10): e4305. DOI:10.1002/bmc.4305.
[114] ZHANG Quanqing, ZHANG Qinghe, XIONG Zhichao, et al. Facile preparation of mesoporous carbon-silica-coated graphene for the selective enrichment of endogenous peptides[J]. Talanta, 2016, 146: 272-278. DOI:10.1016/j.talanta.2015.08.068.
[115] YAO Ning, CHEN Hemei, LIN Huaqing, et al. Enrichment of peptides in serum by C8-functionalized magnetic nanoparticles for direct matrixassisted laser desorption/ionization time-of-flight mass spectrometry analysis[J]. Journal of Chromatography A, 2008, 1185(1): 93-101. DOI:10.1016/j.chroma.2008.01.047.