花生酱是以新鲜花生仁为原料,经烘烤、脱红衣、研磨等工艺制成的调味食品,其不仅含有丰富的植物蛋白、脂肪酸、组成合理的植物油脂及矿物质等,还含有VE、甾醇和白藜芦醇等天然活性成分[1]。花生仁在高温烘烤下发生的美拉德反应、脂肪氧化反应、蛋白质和氨基酸降解反应,可产生多种挥发性风味成分[2-3],烘烤后的花生仁再经研磨,挥发性风味成分得以充分散发,使得花生酱呈现出独特的浓郁香味。近年来对花生酱品质的研究不仅关注其理化稳定性,同时更关注其食品安全性[4-7]和风味特征性[8],以满足消费者对高品质花生酱安全、营养、美味的需求。LS/T 3311—2017《花生酱》和QB/T 1733.4—2015《花生酱》中均规定花生酱应具有浓郁的熟花生香味,口感细腻无异味。花生酱的风味受到诸多因素影响,如花生品种、花生仁品质、花生仁烘烤条件、花生酱储存条件等,其中花生仁烘烤是其风味形成的最关键因素,烘烤温度过低,美拉德反应程度低,会导致风味不足[9];烘烤温度过高不仅会产生焦糊味,同时会造成VE、甾醇等营养成分的损失[10],甚至会产生多环芳烃[11]等有害成分。目前对于花生与花生油的风味研究较多[12-14],而关于花生酱风味的研究却鲜有报道[15]。
本实验采用不同温度对花生仁进行烘烤后制作花生酱,利用顶空固相微萃取与气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用技术对花生酱中主要挥发性成分进行检测分析,并结合花生酱风味感官评价及花生酱酸价、过氧化值、VE、甾醇、色泽等指标的综合评价,研究花生酱制作过程中花生仁烘烤温度对花生酱风味与综合品质的影响,以期为花生酱生产条件的优化提供支持。
1 材料与方法
1.1 材料与试剂
花生仁、花生果原料品种为‘罗汉果308’,产地辽宁,取自山东一花生油加工企业。
胆甾烷醇(纯度不低于95%) 美国Sigma公司;α-、γ-、β-、δ-生育酚和α-、γ-、β-、δ-生育三烯酚标准品北京三区生物技术有限公司;正己烷(色谱纯) 美国VBS公司;超纯水由Milli-Q超纯水机制得。
1.2 仪器与设备
7890B/5975B GC-MS仪、7890B GC仪 美国Agilent公司;50/30 μm DVB/CAR/PDMS萃取纤维头美国Supelco公司;e2695-UV2475高效液相色谱仪 美国Waters公司;TA7-L384D烤箱 广东美的集团有限公司;28型破碎机 曲阜龙达机械科技有限公司;JML-80胶体磨温州龙湾华威机械厂;Chroma Meters CR-400色彩色差仪日本柯尼卡美能达有限公司。
1.3 方法
1.3.1 花生酱制作及花生油提取
花生酱制取工艺流程:精选花生仁→烘烤→破碎→风选脱皮→胶体磨研磨→装瓶冷却
取500 g精选的优质花生仁平铺于烤盘,放入预热至设定温度(分别为130、140、150、160 ℃)的烤箱中烘烤30 min,烘烤花生仁冷却后经破碎机破碎为小瓣花生碎,再经风选脱除红衣,之后投入预消毒的胶体磨进行研磨,研磨完成后装瓶冷却。
花生酱中花生油的提取:取100 g花生酱,加入200 mL正己烷,于60 ℃水浴搅拌1 h使油脂充分溶出,抽滤得到混合油,60 ℃旋转蒸发除去溶剂,得到花生油。
1.3.2 花生酱挥发性成分的检测分析
采用顶空固相微萃取与GC-MS技术对花生酱中主要挥发性成分进行检测分析。
固相微萃取条件:称取5 g花生酱样品置于20 mL顶空瓶中,60 ℃恒温预热15 min,将老化后的固相微萃取头插入顶空瓶,吸附30 min后取出萃取头立即插入GC进样口,解吸3 min。
色谱条件:前进样口温度250 ℃;载气为氦气(纯度不低于99.999%);恒流模式,流速1.8 mL/min,进样模式,不分流进样。升温程序:40 ℃保持3 min,随后以4 ℃/min速率升至230 ℃,保持8 min。
质谱条件:离子源温度230 ℃;传输线温度240 ℃;电子轰击离子源;电子能量:70 eV;质量扫描范围m/z 30~500。
定性定量分析:将检测的各组分质谱信息与NIST质谱库进行匹配定性,仅报道正反匹配度均大于80(最大值100)的结果。除去仪器自身带有的挥发性硅烷类杂质,各种化合物的相对含量采用峰面积归一化法计算。
1.3.3 花生酱油脂中VE和甾醇组分含量测定
VE组分含量参照GB/T 26635—2011《动植物油 生育酚及生育三烯酚含量测定高效液相色谱法》和温运启等[16]的方法测定。取0.50 g从花生酱中提取的花生油置于10 mL棕色容量瓶中,用正己烷定容,经0.22 μm有机滤膜过滤后,用高效液相色谱测定。色谱条件:NH2柱(250 mm×4.6 mm,5 μm),流速0.8 mL/min,柱温40 ℃;2475荧光检测器,激发波长298 nm,发射波长325 nm。
甾醇组分含量参照GB/T 25223—2010《动植物油脂 甾醇组成和甾醇总量的测定 气相色谱法》和郑淑敏[17]的方法测定。取2 mg/mL的内标1 mL置于50 mL平底烧瓶中,氮气吹干,取适量花生油进行皂化,用乙醚提取未皂化物并水洗至中性,旋转蒸发除去溶剂,点板后刮出甾醇带用乙醚萃取,旋转蒸干后进行衍生并用氮气吹干;正己烷溶解后经0.22 μm滤膜进入进样瓶,待GC分析。
1.3.4 花生酱油脂中酸价及过氧化值测定
酸价测定参照GB 5009.229—2016《食品安全国家标准 食品中酸价的测定》;过氧化值测定参照GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》。
1.3.5 花生酱色泽的测定
花生酱色泽采用色差仪测定[18]。取适量花生酱置于培养皿中,先校正色差仪,再紧贴培养皿下表面进行测定,取上、下、左、右、中心5 个点测定花生酱的亮度(L*值)、红绿度(a*值)、黄蓝度(b*值),结果取5 个点的平均值。
1.3.6 花生酱风味的感官评价
花生酱风味感官评价参照刘晓君[19]对花生油风味的评价方法,选择10 名经过培训的感官评价员,对花生酱中的青草味、坚果味、烘烤味、甜味、青草味、油脂味、烧焦味等特征风味及风味强度进行嗅闻,气味强度以9点标度法表示(其中1~9依次为极弱至极强),记录各感官评价员的评价结果,结果以风味轮呈现。
1.4 数据处理与分析
用Microsoft Excel软件对数据进行处理,用Origin 8.0软件作图。
2 结果与分析
2.1 烘烤温度对花生酱中挥发性成分的影响
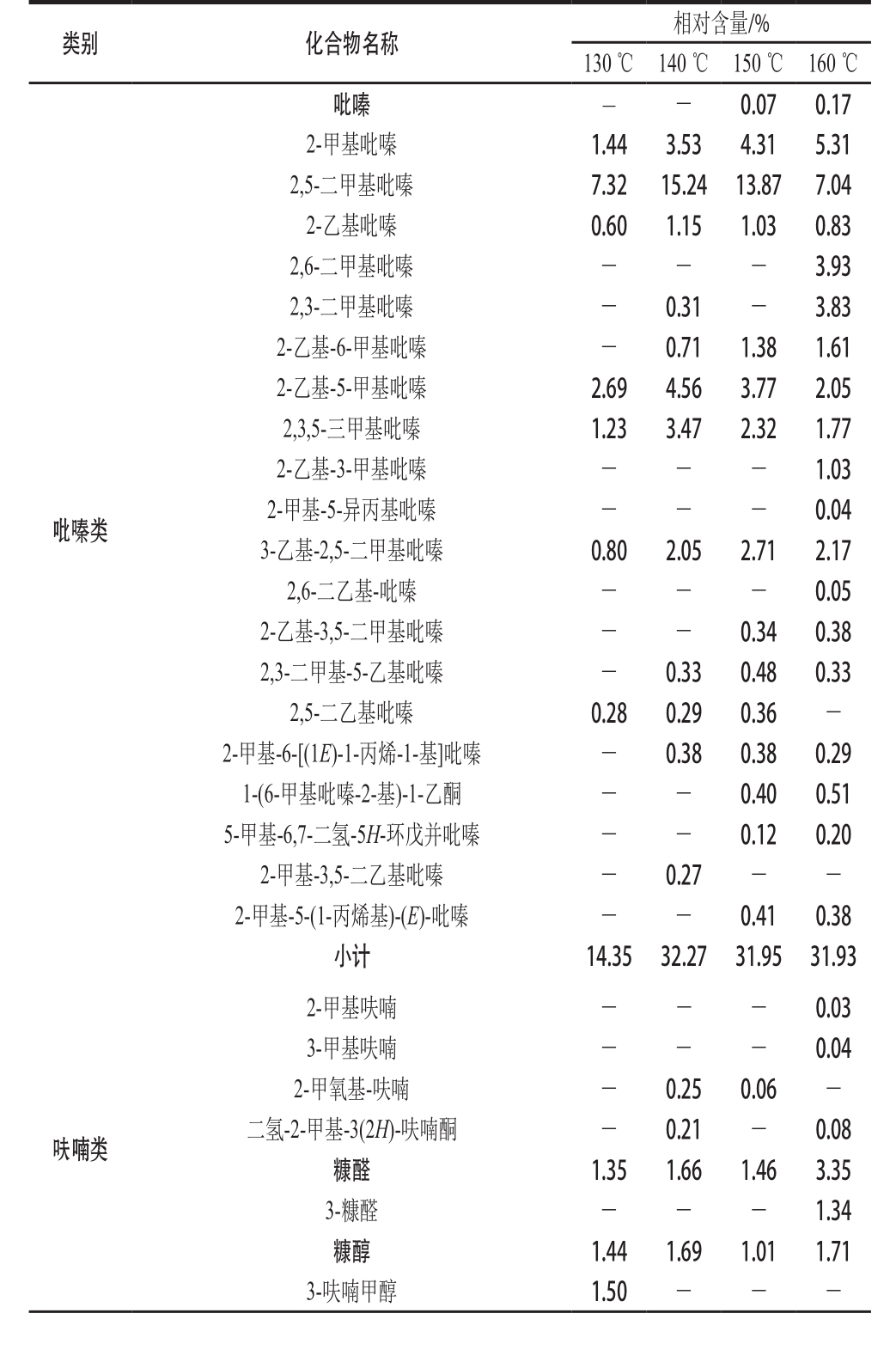
不同烘烤温度制作花生酱中挥发性成分如表1所示。
表1 不同烘烤温度制作花生酱中挥发性成分种类及相对含量
Table 1 Types and relative contents of flavor components in peanut butter prepared at different baking temperatures
类别 化合物名称 相对含量/%130 ℃ 140 ℃ 150 ℃ 160 ℃吡嗪类吡嗪 - - 0.07 0.17 2-甲基吡嗪 1.44 3.53 4.31 5.31 2,5-二甲基吡嗪 7.32 15.24 13.87 7.04 2-乙基吡嗪 0.60 1.15 1.03 0.83 2,6-二甲基吡嗪 - - - 3.93 2,3-二甲基吡嗪 - 0.31 - 3.83 2-乙基-6-甲基吡嗪 - 0.71 1.38 1.61 2-乙基-5-甲基吡嗪 2.69 4.56 3.77 2.05 2,3,5-三甲基吡嗪 1.23 3.47 2.32 1.77 2-乙基-3-甲基吡嗪 - - - 1.03 2-甲基-5-异丙基吡嗪 - - - 0.04 3-乙基-2,5-二甲基吡嗪 0.80 2.05 2.71 2.17 2,6-二乙基-吡嗪 - - - 0.05 2-乙基-3,5-二甲基吡嗪 - - 0.34 0.38 2,3-二甲基-5-乙基吡嗪 - 0.33 0.48 0.33 2,5-二乙基吡嗪 0.28 0.29 0.36 -2-甲基-6-[(1E)-1-丙烯-1-基]吡嗪 - 0.38 0.38 0.29 1-(6-甲基吡嗪-2-基)-1-乙酮 - - 0.40 0.51 5-甲基-6,7-二氢-5H-环戊并吡嗪 - - 0.12 0.20 2-甲基-3,5-二乙基吡嗪 - 0.27 - -2-甲基-5-(1-丙烯基)-(E)-吡嗪 - - 0.41 0.38小计 14.35 32.27 31.95 31.93呋喃类2-甲基呋喃 - - - 0.03 3-甲基呋喃 - - - 0.04 2-甲氧基-呋喃 - 0.25 0.06 -二氢-2-甲基-3(2H)-呋喃酮 - 0.21 - 0.08糠醛 1.35 1.66 1.46 3.35 3-糠醛 - - - 1.34糠醇 1.44 1.69 1.01 1.71 3-呋喃甲醇 1.50 - - -
续表1

相对含吡咯类1-甲基吡咯 5.63 5.16 1.41 1.88吡咯 - - 0.41 0.37 2-甲基吡咯 - - 0.10 -3-甲基吡咯 - 0.35 0.16 0.14 1-丁基吡咯烷 - - - 0.13 1-苯基吡咯烷 - - - 0.06 1-甲基-1H-吡咯-2-甲醛 - - - 0.45 2-吡咯甲醛 - - 0.17 1.22 2-乙酰基-3,4,5,6(1,4,5,6,)-四氢吡啶 - - 0.15 -1-(1H-吡咯-2-基)-乙酮 0.25 0.33 0.37 0.37 3-乙酰基吡咯 0.23 - - -2-吡咯烷酮 - - - 0.16 4-(氨基磺酰基)-N-[(1-乙基-2-吡咯烷基)甲基]-2-甲氧基-苯甲酰胺 - - - 0.05 1,5-二甲基-2-吡咯甲腈 4.47 7.48 18.57 15.85 1H-吡咯-3-羧酸,5-甲酰基-甲酯 - - 0.03 0.07 3-甲基-4-苯基-1H-吡咯 - - 0.08 0.06小计 10.58 13.32 21.45 20.80吡啶类吡啶 - - 0.09 -2-氨基-5-甲基吡啶 0.78 0.56 - -N-乙酰基-4(H)-吡啶 - - - 0.59 1-(2-吡啶基)-乙酮 - - - 0.07 2-乙酰基-3,4,5,6(1,4,5,6,)-四氢吡啶 - - 0.15 -4-吡啶羧酸甲酯 - - 0.10 -1-乙酰基-1,2,3,4-四氢-吡啶 - - - 0.11小计 0.78 0.56 0.34 0.76噻唑类4-甲基-5-羟乙基噻唑 - - 0.20 -噻唑 - - - 0.03 4-甲基噻唑 - - - 0.04 2,4-二甲基噻唑 - - - 0.02 4-甲基-5-羟乙基噻唑 0.20 0.08 0.20 0.12小计 0.20 0.08 0.40 0.22 4H-吡喃-4-酮,2,3-二氢-3,5-二羟基-6-甲基 - - - 0.36 2,5-二甲基嘧啶 - - - -4H-吡喃-4-酮,2,3-二氢-3,5-二羟基-6-甲基 - - - 0.36 1-甲基-2-哌啶甲酸乙酯 - - - 0.02 1-丁基哌啶 - - - 0.06 1-(2-氨乙基)哌啶 - - - 0.10 1-甲基哌啶 - - - 0.05 2-乙基苯并咪唑 - - - 0.09 5-氨基吲哚 - - - 0.10小计 - - - 1.13其他杂环类
续表1
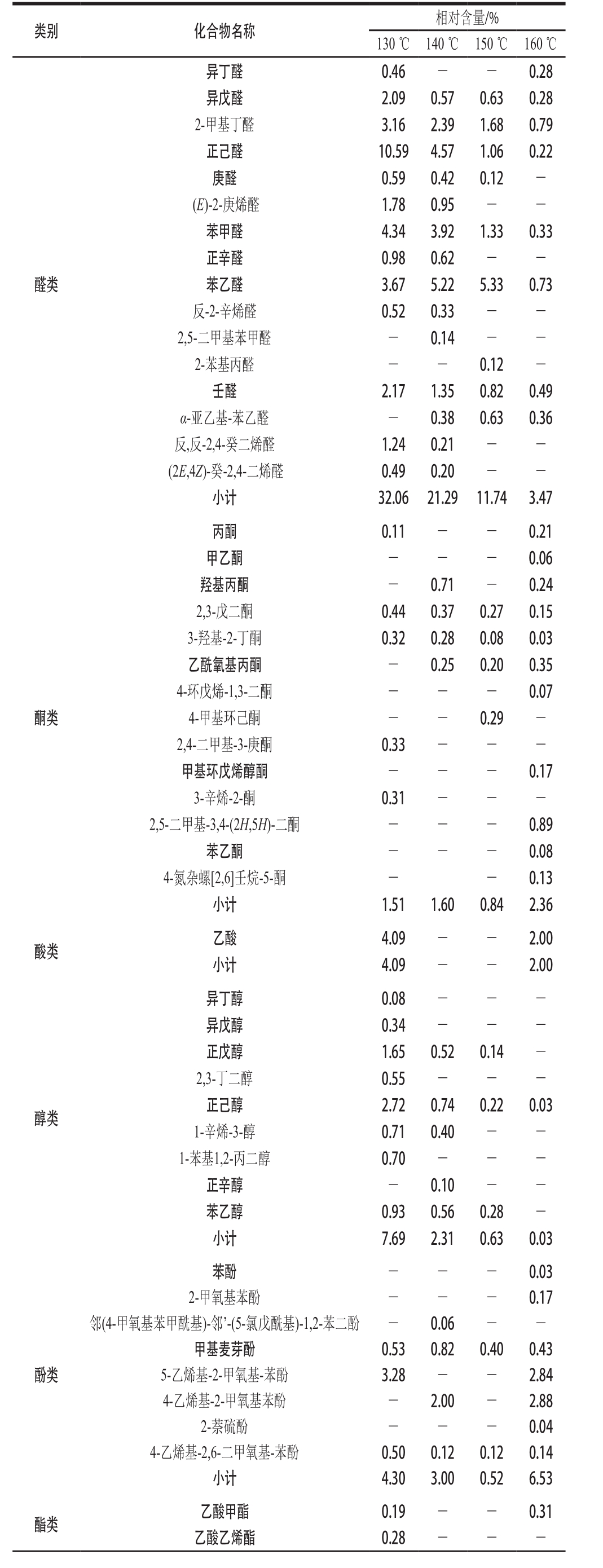
醛类异丁醛 0.46 - - 0.28异戊醛 2.09 0.57 0.63 0.28 2-甲基丁醛 3.16 2.39 1.68 0.79正己醛 10.59 4.57 1.06 0.22庚醛 0.59 0.42 0.12 -(E)-2-庚烯醛 1.78 0.95 - -苯甲醛 4.34 3.92 1.33 0.33正辛醛 0.98 0.62 - -苯乙醛 3.67 5.22 5.33 0.73反-2-辛烯醛 0.52 0.33 - -2,5-二甲基苯甲醛 - 0.14 - -2-苯基丙醛 - - 0.12 -壬醛 2.17 1.35 0.82 0.49 α-亚乙基-苯乙醛 - 0.38 0.63 0.36反,反-2,4-癸二烯醛 1.24 0.21 - -(2E,4Z)-癸-2,4-二烯醛 0.49 0.20 - -小计 32.06 21.29 11.74 3.47丙酮 0.11 - - 0.21甲乙酮 - - - 0.06羟基丙酮 - 0.71 - 0.24 2,3-戊二酮 0.44 0.37 0.27 0.15 3-羟基-2-丁酮 0.32 0.28 0.08 0.03乙酰氧基丙酮 - 0.25 0.20 0.35 4-环戊烯-1,3-二酮 - - - 0.07 4-甲基环己酮 - - 0.29 -2,4-二甲基-3-庚酮 0.33 - - -甲基环戊烯醇酮 - - - 0.17 3-辛烯-2-酮 0.31 - - -2,5-二甲基-3,4-(2H,5H)-二酮 - - - 0.89苯乙酮 - - - 0.08 4-氮杂螺[2,6]壬烷-5-酮 - - 0.13小计 1.51 1.60 0.84 2.36酸类 乙酸 4.09 - - 2.00小计 4.09 - - 2.00酮类醇类异丁醇 0.08 - - -异戊醇 0.34 - - -正戊醇 1.65 0.52 0.14 -2,3-丁二醇 0.55 - - -正己醇 2.72 0.74 0.22 0.03 1-辛烯-3-醇 0.71 0.40 - -1-苯基1,2-丙二醇 0.70 - - -正辛醇 - 0.10 - -苯乙醇 0.93 0.56 0.28 -小计 7.69 2.31 0.63 0.03酚类苯酚 - - - 0.03 2-甲氧基苯酚 - - - 0.17邻(4-甲氧基苯甲酰基)-邻’-(5-氯戊酰基)-1,2-苯二酚 - 0.06 - -甲基麦芽酚 0.53 0.82 0.40 0.43 5-乙烯基-2-甲氧基-苯酚 3.28 - - 2.84 4-乙烯基-2-甲氧基苯酚 - 2.00 - 2.88 2-萘硫酚 - - - 0.04 4-乙烯基-2,6-二甲氧基-苯酚 0.50 0.12 0.12 0.14小计 4.30 3.00 0.52 6.53酯类 乙酸甲酯 0.19 - - 0.31乙酸乙烯酯 0.28 - - -
续表1

注:-.未检出。
类别 化合物名称 相对含量/%130 ℃ 140 ℃ 150 ℃ 160 ℃丙酮酸甲酯 - - - 0.03二乙二醇二乙酸酯 - - 0.06 -γ-丁内酯 - - 0.23 -4-羟基丁酸乙酰酯 - - - 0.19 δ-戊内酯 - - 0.24 -α-甲基-γ-丁内酯 1.01 0.73 - -正己酸乙烯酯 - 0.31 - -泛酰内酯 - 0.71 0.58 0.36甲酸辛酯 0.32 - - -小计 1.79 1.75 1.10 0.89烯烃类苯乙烯 - - 0.06 0.05(Z)-3-甲基-4-十一碳烯 - 0.92 - -(+)-柠檬烯 0.28 0.42 - -3-羟基-4-甲氧基苯乙烯 - 2.00 2.88 -小计 0.28 3.35 2.94 0.05醚类甲基丙基醚 - - - 0.01甲乙醚 0.08 - - -二甲基二硫醚 0.28 0.33 0.23 0.17小计 0.36 0.33 0.23 0.18烷烃类正戊烷 1.23 - - -2-乙基-氧杂环丁烷 1.47 - - -庚烷 1.68 0.41 - -2,2,4,6,6-五甲基庚烷 3.60 2.06 0.64 0.23 3,5-二甲基辛烷 0.90 - 0.29 -2,2,4,4-四甲基辛烷 0.48 - - -5-乙基-2-甲基辛烷 - 0.22 - -3,3-二甲基已烷 0.23 - - -十一烷 0.38 - - -正十二烷 0.77 0.56 0.26 -正十三烷 - 0.15 - -小计 10.73 3.40 1.18 0.23苯环类甲苯 0.54 0.28 0.11 0.07乙苯 0.18 - - -邻硝基甲苯 - 2.87 - -小计 0.73 3.15 0.11 0.07
由表1可以看出,4 个花生酱样品中共检测出16 类挥发性成分。不同烘烤温度制作的花生酱样品中挥发性成分的种类有较大差别,譬如,2-吡咯甲醛、5-甲基呋喃醛、呋喃酮等物质在低温烘烤的样品中未检出,1-辛烯-3-醇、正戊醇、正辛醛等成分在高温烘烤的样品中未检出。这些风味成分种类及含量的差异导致了不同烘烤温度制作花生酱所呈现出的不同风味特征。
吡嗪类化合物是花生酱中最主要的挥发性成分,它们由Strecker降解反应(氨基酸与α-二羰基化合物反应,失去一分子CO2而降解成为少一个碳原子的醛类及氨基酮,各种不同的特殊醛类亦称Strecker醛类,是造成食品不同香气的因素之一)产物中的α-氨基酮类缩合而成[20-21],对烘烤食品如花生酱、烘焙咖啡豆等持有的烤香、烘焙香和坚果香具有重要贡献[22]。Baker等[23]的研究发现2,5-二甲基吡嗪与烤花生香气最为相关。有报道指出乙基取代吡嗪如2-乙基吡嗪、2,5-二乙基吡嗪、2-乙基-5-甲基吡嗪具有足够低的阈值使得它们可以为花生酱呈现丰富的烘烤坚果香味[19]。由表1可以看出,吡嗪类化合物的相对含量随着温度的变化呈现先升高后维持不变的趋势。130 ℃条件下吡嗪类物质相对含量为14.35%,140 ℃时吡嗪类相对含量明显升高至32.27%,其中2-乙基吡嗪、2,5-二甲基吡嗪、2-乙基-5-甲基吡嗪这几种对烤花生香味最为关键的吡嗪类物质[24]在140 ℃条件下含量达到最高,为花生酱提供了浓郁的烘烤坚果香,当温度升高至150 ℃和160 ℃时,吡嗪类物质总体相对含量并无明显变化,但是吡嗪类物质的种类有所增加,结构更加复杂的吡嗪类物质开始生成,例如5-甲基-6,7-二氢-5H-环戊并吡嗪在高温烘烤的花生酱样品中被检测出,曾被报道具有棕榈糖芳香气味[25]。
呋喃类化合物对烘烤及炒制食品的风味贡献一般为焦糖味、坚果味[20],由表1可以看出,烘烤温度由130 ℃升高至160 ℃,呋喃类物质的相对含量由10.57%升高至29.33%,其中2,3二氢苯并呋喃是含量最多的呋喃类物质,随着温度升高相对含量由5.23%升高至19.63%。呋喃酮类和呋喃醛类的环酮分子中的烯醇化结构单元被认为是焦糖味化合物的特征结构[26],它们在高于130 ℃的烘烤温度下才生成。糠醛和糠醇也被报道可呈现焦糖味和油脂味[27]。
吡咯类化合物的相对含量随着温度升高明显增加,由130 ℃时的10.58%升高至160 ℃时的20.80%。吡啶类化合物含量较少(相对含量均小于1%)。有报道指出吡咯类[28]和吡啶类[29]可提供烧焦气味,它们可能是高温烘烤制取花生酱的焦味来源之一。在160 ℃烘烤条件下检测到了哌啶、咪唑等物质,它们在低于160 ℃的温度下未检出,这意味着这些物质可能需要较高的温度才能生成,有报道指出咪唑可由呋喃环转化生成[30]。
醛类化合物是花生酱中最主要的非杂环类挥发性成分,脂肪族醛类如正己醛、反-2辛烯醛、壬醛来自于脂肪的降解反应,对花生酱的风味贡献主要是清香味与青草味[31]。在130 ℃时醛类化合物的相对含量为32.06%,随着温度升高,醛类化合物大量减少,在160 ℃时醛类物质相对含量仅为3.47%。苯甲醛和苯乙醛是芳香族氨基酸苯丙氨酸的降解产物,具有与脂肪族醛不一样的风味特征,分别具有类杏仁味和类蜂蜜味[25],其中苯甲醛在130、140、150、160 ℃烘烤条件下的相对含量为分别4.34%、3.92%、1.33%、0.33%,随烘烤温度升高逐渐减少。低温烘烤条件下这些醛类物质的大量存在可能与花生酱呈现甜香味有关,高温烘烤条件下醛类化物质的大量减少导致花生酱甜香味逐渐消失,烘烤香甚至焦香味逐渐成为主导气味。有报道指出酚类也可以提供烧焦气味[26]。酸类、酯类、醇类和烷烃类的阈值很高,一般认为对整体风味的贡献很小[32]。
2.2 烘烤温度对花生酱风味感官评价的影响
根据不同风味项得分制作风味轮,烘烤温度对花生酱风味感官评价的结果如图1所示。
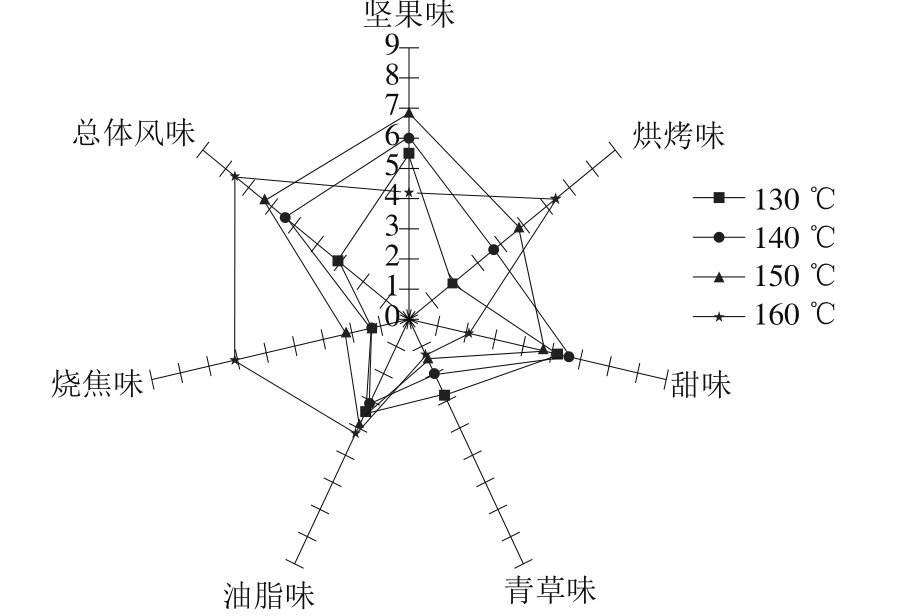
图1 不同烘烤温度制作花生酱的风味轮
Fig. 1 Flavor profile of peanut butter prepared at different baking temperatures
由图1可以看出,随烘烤温度的增加,花生酱的总体风味得分逐渐升高。130 ℃制取花生酱的总体风味得分最低,其风味特征主要表现为青草味与甜香味,烘烤味与油脂味不明显,几乎没有焦糊味;140 ℃制取花生酱的总体风味得分迅速升高,可以闻见浓郁的烘烤坚果味,青草味开始明显减弱;烘烤温度升高至150 ℃,青草味与甜味呈逐渐减弱,烘烤味继续增强,同时焦糊味开始出现;160 ℃烘烤温度的总体风味得分最高,甜味与青草味几乎消失,焦糊味也最为明显。风味感官评价结果与GC-MS检测得出的挥发性成分含量的变化基本一致,即挥发性风味物质的含量不同会导致不同温度烘烤制取花生酱呈现出不同的风味特征,较低烘烤温度下花生酱挥发性成分以醛类相对含量最多,花生酱样品呈现甜香味和青草味,较高烘烤温度下花生酱挥发性成分以吡嗪类含量最多,花生酱样品呈现烘烤味和焦香味。
2.3 烘烤温度对花生酱中VE和甾醇含量的影响

图2 烘烤温度对花生酱中VE组分含量的影响
Fig. 2 Effect of baking temperature on vitamin E content in peanut butter
从图2可以看出,花生酱中所检测出的VE组分有α-生育酚、γ-生育酚、δ-生育酚3 种,其中γ-生育酚含量最高,α-生育酚含量次之,δ-生育酚含量最少,不同温度VE总量为22.72~23.73 mg/100 g,这与温运启等[16]的研究结果一致。烘烤温度对花生酱中VE各组分及总量含量的影响并不明显,刘晓君[19]也曾报道炒籽过程对花生油中VE含量没有显著影响。

图3 烘烤温度对花生酱中甾醇组分含量的影响
Fig. 3 Effect of baking temperature on sterol content in peanut butter
由图3可以看出,花生酱中检测出的甾醇主要有菜油甾醇、豆甾醇、β-谷甾醇、谷甾烷醇,其中β-谷甾醇含量最高,菜油甾醇和豆甾醇次之,谷甾烷醇含量最低,总量为126.47~139.25 mg/100 g,这与张建书等[33]的研究结果一致。烘烤对花生酱中的甾醇各组分及总量含量的影响并不明显,这可能是由于烘烤时间较短,同时甾醇在高温下性质稳定不易分解。
2.4 烘烤温度对花生酱酸价、过氧化值及色泽的影响
表2 烘烤温度对花生酱酸价和过氧化值的影响
Table 2 Effect of baking temperature on acid value and peroxide value of peanut butter

烘烤温度/℃ 酸价/(mg/g) 过氧化值/(mmol/kg)130 0.40±0.01 24.07±0.28 140 0.70±0.02 20.68±0.13 150 0.50±0.02 6.09±0.07 160 0.50±0.02 5.16±0.02
由表2可以看出,4 个烘烤温度制取花生酱的酸价均低于LS/T 3311—2017中规定限量(不高于3 mg/g),随烘烤温度上升其酸价变化不明显;花生酱的过氧化值在130 ℃时较高,超出LS/T 3311—2017中规定的上限(不高于0.25 g/100 g(即9.85 mmol/kg)),这可能是由于该温度下花生酱中的油脂大量分解,产生较多的过氧化物,随着烘烤温度的升高,花生酱的过氧化值呈现明显的下降趋势,刘晓君[19]研究花生仁炒籽强度与花生油过氧化值关系也呈现类似规律。油脂的氧化是一种动态过程,过氧化物的产生与分解同时存在,随烘烤温度升高,美拉德反应产生的大量褐变物质可抑制过氧化反应[34-35],过氧化物的分解速率大于其形成速率,导致氢过氧化物含量急剧下降。

图4 不同烘烤温度下花生酱的色泽变化
Fig. 4 Effect of baking temperature on color of peanut butter
由图4可以看出,花生酱色值随烘烤温度变化明显,随着烘烤温度的升高,花生酱亮度(L*值)呈现持续下降趋势,红绿度(a*值)呈上升趋势,黄蓝度(b*值)先上升后下降。感官观察可见,烘烤温度130 ℃时,花生酱呈现淡黄色,随着烘烤温度升高黄色逐渐加深,140、150 ℃时开始转变为棕黄色,此时花生酱光泽适中,食欲感好,160 ℃时呈现深褐色,颜色深,光泽度较低,食欲感较差。
3 结 论
对新鲜花生仁进行不同温度烘烤后制取花生酱,采用顶空固相微萃取与GC-MS技术对花生酱样品的挥发性风味物质进行分析鉴定,结果表明,4 个花生酱样品中共检测出16 类挥发性成分。不同烘烤温度制取花生酱样品的风味成分有明显区别,烘烤温度为130 ℃时,花生酱的挥发性成分中醛类相对含量为32.06%、吡嗪类相对含量为14.35%、呋喃类相对含量为10.57%;烘烤温度140 ℃时,醛类相对含量为21.29%、吡嗪类相对含量为32.27%、呋喃类相对含量为13.61%,其中2-乙基吡嗪、2,5-二甲基吡嗪、2-乙基-5-甲基吡嗪等花生酱特征性风味物质在140 ℃时相对含量达到最高;烘烤温度为150 ℃时,醛类相对含量为11.74%、吡嗪类相对含量为31.95%、呋喃类相对含量为26.58%;烘烤温度为160 ℃时,醛类相对含量为3.47%、吡嗪类相对含量为31.93%、呋喃类相对含量为29.33%。通过风味感官评价发现,130 ℃条件下花生酱主导风味为甜香味;140 ℃条件下花生酱烘烤香气浓郁且伴随轻微甜香,无焦糊味;150 ℃条件下时烘烤坚果香气加强,同时开始出现轻微焦糊味;160 ℃条件下,甜香味消失,焦糊味明显,并且随着烘烤温度的升高,花生酱的总体风味强度逐渐增加。花生酱中VE含量随温度变化不明显,甾醇含量随着温度升高呈现小幅度下降趋势。花生酱亮度随着温度的升高逐渐降低,红绿度持续升高,黄蓝度先升高后降低。花生酱的酸价随温度变化不明显,过氧化值随着烘烤温度的上升呈现下降趋势。综合来看,以烘烤温度140 ℃、烘烤时间30 min为最佳烘烤条件。
[1] 李淑莹, 刘国琴. 发芽提高花生中主要脂溶性营养物质的含量[J]. 现代食品科技, 2018, 34(4): 30-38. DOI:10.13982/j.mfst.1673-9078.2018.04.006.
[2] 王丽, 王强, 罗红霞, 等. 花生烘烤条件优化及主要风味物质研究[J].食品工业, 2015, 36(5): 24-27.
[3] SHU C K, WALLER G R. Volatile components of roasted peanuts:comparative analyses of the basic fraction[J]. Journal of Food Science,2010, 36(4): 579-583. DOI:10.1111/j.1365-2621.1971.tb15134.x.
[4] 谭彩霞. 海藻酸钠流变特性对花生酱品质影响的研究及花生酱生产HACCP的建立[D]. 济南: 齐鲁工业大学, 2017: 37-38.
[5] 李凌峰, 徐延良, 王金来, 等. 小麦纤维及复合乳化剂对花生酱稳定性的影响[J]. 食品工业科技, 2013, 34(22): 232-237; 245.DOI:10.13386/j.issn1002-0306.2013.22.074.
[6] 焦慧泽, 陆世清, 洪体玉. 免疫亲和结合超高效液相色谱-串联质谱法测定花生酱中黄曲霉毒素B1、B2、G1、G2[J]. 化学研究与应用,2018, 30(11): 1918-1923.
[7] 陈璐瑶. 花生酱中黄曲霉毒素富集规律及其削减技术研究[D].福州: 福建农林大学, 2018: 13-17.
[8] LI C C, HOU L X. Review on volatile flavor components of roasted oilseeds and their products[J]. Grain & Oil Science and Technology,2018, 1(4): 151-156. DOI:10.3724/SP.J.1447.GOST.2018.18052.
[9] 林茂, 孟繁博, 黄道梅, 等. 电子鼻结合全二维气相色谱质谱分析铜仁珍珠花生烘烤前后挥发性风味成分的变化[J]. 花生学报, 2018,47(4): 26-32. DOI:10.14001/j.issn.1002-4093.2018.04.005.
[10] 郭锐. 油脂和食品体系中甾醇的热迁移及氧化稳定性研究[D].合肥: 合肥工业大学, 2017: 22-24.
[11] 石龙凯, 刘玉兰, 崔瑞福, 等. 油籽炒籽条件对油脂中多环芳烃含量影响的研究[J]. 中国粮油学报, 2016, 31(3): 79-83; 90. DOI:10.3969/j.issn.1003-0174.2016.03.015.
[12] 刘云花. 低温压榨花生油风味强化技术研究[D]. 秦皇岛: 河北科技师范学院, 2017: 16-19.
[13] 林茂, 吕建伟, 马天进, 等. 花生挥发性风味物质研究进展[J].食品研究与开发, 2013, 34(12): 106-110. DOI:10.3969/j.issn.1005-6521.2013.12.031.
[14] 史文青, 薛雅琳, 何东平. 花生挥发性香味识别的研究[J]. 中国粮油学报, 2012, 27(7): 58. DOI:10.3969/j.issn.1003-0174.2012.07.012.
[15] 楼飞, 刘源, 孙晓红, 等. 花生酱挥发性风味成分的鉴定[J]. 食品科学,2009, 30(24): 393-396. DOI:10.3321/j.issn:1002-6630.2009.24.089.
[16] 温运启, 刘玉兰, 王璐阳, 等. 不同食用植物油中维生素E组分及含量研究[J]. 中国油脂, 2017, 42(3): 35-39. DOI:10.3969/j.issn.1003-7969.2017.03.007.
[17] 郑淑敏. 玉米油精炼过程中游离甾醇和甾醇酯含量变化研究[D].郑州: 河南工业大学, 2016: 15-28.
[18] 魏心如, 李伟明, 闫海鹏, 等. 冷却鸡肉肉色色差计评定方法标准化[J].食品科学, 2014, 35(24): 189-193. DOI:10.7506/spkx1002-6630-201424036.
[19] 刘晓君. 炒籽对花生油风味和品质的影响[D]. 无锡: 江南大学,2011: 45.
[20] CHO I H, LEE S, JUN H R, et al. Comparison of volatile maillard reaction products from tagatose and other reducing sugars with amino acids[J]. Food Science & Biotechnology, 2010, 19(2): 431-438.DOI:10.1007/s10068-010-0061-7.
[21] SCALONE G L L, TATIANA C, NORBERT D K, et al. Influence of free amino acids, oligopeptides, and polypeptides on the formation of pyrazines in Maillard model systems[J]. Journal of Agricultural and Food Chemistry, 2015, 63(22): 5364-5372. DOI:10.1021/acs.jafc.5b01129.
[22] SOMOZA V. The Maillard reaction in food and medicine[J]. Molecular Nutrition & Food Research, 2010, 51(4): 381-382. DOI:10.1002/mnfr.200790005.
[23] BAKER G L, CORNELL J A, GORBET D W, et al. Determination of pyrazine and flavor variations in peanut genotypes during roasting[J].Journal of Food Science, 2010, 68(1): 394-400. DOI:10.1111/j.1365-2621.2003.tb14171.x.
[24] 李淑荣, 王丽, 张春红, 等. 烘烤花生中关键香味化合物的研究[J].中国农业科学, 2010, 43(15): 3199-3203. DOI:10.3864/j.issn.0578-1752.2010.15.018.
[25] HO C W, AIDA W M W, MASKAT M Y, et al. Changes in volatile compounds of palm sap (Arenga pinnata) during the heating process for production of palm sugar[J]. Food Chemistry, 2007, 102(4): 1156-1162. DOI:10.1016/j.foodchem.2006.07.004.
[26] 孙宝国. 食用调香术[M]. 北京: 化学工业出版社, 2003: 39-40.
[27] FLAMENT I, BESSIÈRETHOMAS Y. Coffee flavor chemistry[M].New Jersey: John Wiley & Sons, 2002: 1-424.
[28] PARLIMENT T H, MORELLO M J, MCGORRIN R J. Thermally generated flavors, maillard, microwave and extrusion processes[M].Washington, DC: American Chemical Society, 2010: 209-210.
[29] 申桂英, 姚云成, 张一宾. 吡啶类化合物及其应用[M]. 北京: 化学工业出版社, 2015: 1-9.
[30] STROGANOVA T Y A, VASILIN V K, KRAPIVIN G D. Furan ring transformation as key stage in the synthesis of 5H,12H-benzo[4,5]imidazo[1,2-a]pyrrolo[1,2-d]pyrazines[J]. Chemistry of Heterocyclic Compounds, 2018, 54(2): 1-9. DOI:10.1007/s10593-018-2253-7.
[31] BAILEY A E, SWERN D, MATTIL K F, et al. Bailey’s industrial oil and fat products[J]. Nature, 2005, 157: 822-823.
[32] WEI F, YANG M, ZHOU Q I, et al. Varietal and processing effects on the volatile profile of rapeseed oils[J]. LWT-Food Science and Technology, 2012, 48(2): 323-329. DOI:10.1016/j.lwt.2012.04.007.
[33] 张建书, 王强, 刘红芝, 等. 不同地区花生品种VE、植物甾醇组成与含量的分析比较[J]. 食品科学, 2012, 33(22): 191-195.
[34] LÓPEZ-GALILEA I, ANDUEZA S, LEONARDO I D, et al.Influence of torrefacto roast on antioxidant and pro-oxidant activity of coffee[J]. Food Chemistry, 2006, 94(1): 75-80. DOI:10.1016/j.foodchem.2004.10.052.
[35] NOOSHKAM M, VARIDI M, BASHASH M. The Maillard reaction products as food-born antioxidant and antibrowning agents in model and real food systems[J]. Food Chemistry, 2018, 275: 644-660.DOI:10.1016/j.foodchem.2018.09.083.