膳食天然抗氧化剂如植物黄酮类化合物可以有效缓解氧化应激,抑制多种疾病的发生及发展,提高人体健康水平[1]。开展天然植物抗氧化剂的相关研究具有良好的实际应用价值,并有助于扩充植物功能成分的相关营养学知识[2-3]。然而,由于黄酮化合物的生物可及性较低,限制了其生物活性的发挥[4]。黄酮类化合物的低稳定性和非靶向释放也与黄酮化合物活性的降低有关[5]。因此,提高植物黄酮类化合物在胃肠消化过程中的生物可及性是提高其健康效益的关键[6]。
在胃肠道消化中,不同消化阶段的pH值变化较大,减弱胃肠道消化过程中的竹叶黄酮降解对提高生物可及性具有重要意义[7-8]。含有黄酮类化合物的食物到达小肠,然后进入血液。一般来说,同时食用含有其他食物基质和黄酮类化合物的食物有助于提高黄酮化合物的生物可及性,抵消体内不同消化阶段pH值的变化对黄酮化合物的降解[9]。研究发现,食品中的淀粉和纤维素产生的物理空隙限制了消化液和黄酮混合过程,有效降低了黄酮类化合物的降解,有助于更多的黄酮化合物到达肠壁,进而被吸收或者代谢[10-12]。本课题组在前期的研究中发现,水溶性的膳食纤维素黄原胶有助于提高模拟消化过程中4 种竹叶黄酮的生物可及性[13]。然而,果胶对黄酮类化合物保护作用的相关研究鲜见报道,需要进一步深入探索。
体外模拟胃肠消化模型因可提供筛选食物成分的机会、研究期限短、研究成本低,并可以避免使用动物模型而引起的伦理问题,从而得到了广泛的关注[14-16]。现有研究表明,体外胃肠消化模型已被广泛应用于食品或药品的模拟消化过程,并应用于分析不同处理对目标化合物的活性影响和活性分子生物可及性的相关研究中[17-18]。
近年来,竹叶黄酮化合物因具有抗氧化、抗炎、抗心血管疾病等良好的生物活性而受到广泛关注[19]。据报道,提取自竹叶中的竹叶黄酮类化合物的特征性成分为荭草苷、异荭草苷、牡荆素和异牡荆素[20-21],其结构式如图1所示。

图1 4 种竹叶黄酮的结构式
Fig. 1 Structures of isoorientin, orientin, isovitexin and vitexin from bamboo leaves
目前相关研究主要集中在黄酮类化合物的抗氧化活性等方面[22-23]。然而,鲜有研究阐明胃肠道消化过程对竹叶黄酮生物可及性的影响[13],而良好的生物可及性是竹叶黄酮发挥其生物活性的基础。前期研究发现,在模拟肠道消化时,添加果胶可显著提升竹叶提取物中竹叶黄酮的生物可及性。因此,本研究采用体外模拟胃肠消化模型测定竹叶黄酮化合物的生物可及性,结合超高效液相色谱(ultra-high performance liquid chromatography,UPLC)仪分析阐明果胶对竹叶黄酮提取物中4 种特征性成分体外模拟胃肠消化过程中的保护作用。实验中,采用主成分分析和聚类分析相结合的方法,研究了4 种黄酮类化合物在体外模拟胃肠消化过程中的变化,相关研究有助于阐明体外消化过程中竹叶黄酮生物可及性的变化,对竹叶黄酮类功能食品的开发具有良好的促进作用。
1 材料与方法
1.1 材料与试剂
竹叶 浙江圣氏生物有限公司;果胶、福林-酚试剂、α-淀粉酶 美国西格玛奥德里奇试剂公司;胃蛋白酶、胰酶、胆酸钠 上海阿拉丁生化试剂公司;荭草苷、异荭草苷、牡荆素、异牡荆素等化合物的标准品由实验室自行制备(纯度>97%)。其他试剂为分析纯或色谱纯。
1.2 仪器与设备
Bioteck离心机、多功能酶标仪 美国贝克曼库尔特有限公司;ACQUITY UPLC柱分析系统 美国沃特世科技公司;漩涡混匀仪 德国IKA公司;机械搅拌器 上海沪析实业有限公司;扫描电子显微镜 德国卡尔蔡司公司。
1.3 方法
1.3.1 样品制备
样品制备参照文献[13]并略作修改,简述如下:采用实验室用小型磨粉机磨碎竹叶(Pleioblastus kongosanensis f. aureostriatus)样品后,按照料液比1∶10(m/m)加入蒸馏水后,进行机械搅拌,室温搅拌过夜,提取竹叶黄酮。提取所得的混合物经旋转蒸发浓缩后进行冷冻干燥,收集固体粉末(竹叶黄酮提取物)用于后续实验。添加果胶组样品制备过程如下:竹叶黄酮提取物经水溶解后,与制备好的果胶溶液混合(竹叶黄酮提取物终质量浓度10 mg/mL、果胶终浓度质量浓度8 mg/mL),漩涡混匀后4 ℃避光过夜。以直接消化组的样品(不添加果胶,竹叶黄酮提取物终质量浓度10 mg/mL)作为对照。测定竹叶黄酮提取物总酚、总黄酮含量。
1.3.2 总酚含量测定
采用福林-酚法测定竹叶黄酮提取物的总酚含量[24]。将不同体积(0、30、60、90、120、150 µL)的0.1 mg/mL没食子酸工作溶液加入离心管后,加入40 µL福林-酚试剂,再加入100 µL、质量分数10%碳酸钠溶液。用去离子水将反应体系定容至1 mL,反应90 min后,采用酶标仪在765 nm波长处测定吸光度,制作标准曲线,依据标准曲线计算总酚含量,结果以每克干物质中没食子酸质量表示,单位为mg/g。
1.3.3 总黄酮含量测定
总黄酮含量的测定参考文献[25]的方法,以儿茶素为标准品,依据标准曲线计算,结果以每克干物质中儿茶素质量表示,单位为mg/g。
1.3.4 体外消化模型的建立
体外模拟胃肠道消化参考González-Montoya等[26]的方法并略作修改。取18 mL竹叶黄酮提取物溶液(含果胶或不含果胶),加入2 mL α-淀粉酶,以形成模拟口腔消化液(pH 7.0),漩涡后37 ℃孵育10 min后,用盐酸溶液(1 mol/L)调整pH值到2.0±0.1,同时取4 个样(每个样体积为400 µL)作为口腔消化后的样品(记为A10),将收集好的A10样品的pH值调整到7.0±0.1后进行相关指标的测定。然后,取1 mL的胃蛋白酶(10 mg/mL)加入到取样后剩余的A10样品溶液中,37 ℃孵育 90 min,再将溶液的pH值调整到7.0±0.1后进行取样,得到模拟胃消化后的样品B90(取4 个样,每个400 µL)。在取样后剩余的B90样品中加入2.5 mL的胰酶(8 mg/mL)和2.5 mL胆酸盐溶液(50 mg/mL)中形成模拟肠道消化液,37 ℃孵育 90 min后,在95 ℃水浴加热10 min终止反应,得到模拟肠道消化后的样品C90(取样4 个,每个400 µL)。取样结束后,所有样品经冷冻干燥,干燥后的粉末贮藏在-20 ℃以备后续分析。
经体外模拟消化的3 个阶段(口腔、胃、肠)后,直接消化组的样品分别记为dA10、dB90、dC90,添加果胶后消化的样品记为pA10、pB90、pC90,原始样品未经体外模拟消化处理的样品记为O。
1.3.5 竹叶黄酮质量浓度和生物可及性的测定
采用UPLC测定10 mg/mL竹叶黄酮提取物消化前后及果胶添加组消化后的竹叶黄酮(异荭草苷、荭草苷、异牡荆素、牡荆素)质量浓度。将不同消化阶段的样品溶解在1 mL甲醇中,漩涡充分混匀,然后8 000×g离心15 min,取上清液1 μL进行UPLC分析。UPLC分析采用ACQUITY UPLC BEH C8色谱柱(150 mm×2.1 mm,1.7 μm),流动相A(乙腈)、流动相B(体积分数0.1%磷酸溶液)的体积比为82∶18,流速为0.21 mL/min。依据340 nm波长处的吸光度,经由标准曲线计算溶液中4 种竹叶黄酮的质量浓度,并计算其生物可及性,生物可及性是模拟消化后样品中的竹叶黄酮质量浓度与原始样品中竹叶黄酮质量浓度的比值[27]。
1.3.6 扫描电子显微镜观察
为了考察添加果胶的效果,将8 mg/mL果胶溶液、10 mg/mL竹叶黄酮提取物溶液、果胶和竹叶黄酮提取物终质量浓度分别为8、10 mg/mL的混合溶液按照扫描电子显微镜样品测试要求制备样品后,观察其颗粒形貌。
1.4 数据统计与分析
采用主成分分析和聚类分析研究不同处理样品中4 种竹叶黄酮质量浓度的聚类趋势,数据差异采用SPSS 19.0软件的单因素方差分析方法进行比较,P<0.05时表示差异显著,采用Origin软件作图。
2 结果与分析
2.1 总酚含量及UPLC定量结果
未经消化的竹叶黄酮提取物中总酚含量为(78.834±1.287)mg/g,总黄酮含量为(79.932±2.076)mg/g。4 种竹叶黄酮的UPLC如图2所示,未经消化的10 mg/L竹叶黄酮提取物溶液中异荭草苷、荭草苷、异牡荆素、牡荆素的质量浓度分别为239.251、67.052、58.123、27.04 mg/L。
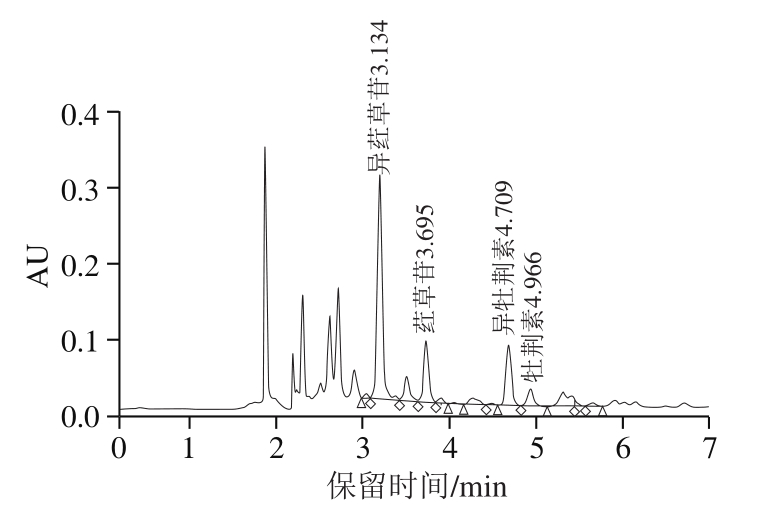
图2 4 种竹叶黄酮的UPLC谱图
Fig. 2 UPLC profile of four bamboo flavonoids
2.2 体外模拟消化中各阶段不同样品组的黄酮质量浓度

图3 不同体外模拟消化阶段各样品中4 种竹叶黄酮的质量浓度
Fig. 3 Concentrations of bamboo leaf flavonoids at different simulated in vitro digestion stages
在各阶段不同样品中的4 种竹叶黄酮化合物中,异荭草苷质量浓度最高,其次为荭草苷、异牡荆素、牡荆素。与直接消化样品和添加果胶的样品相比,原始样品中竹叶黄酮的质量浓度最高。如图3所示,与直接消化样品相比,在3 个阶段消化过程中,添加果胶均显著抑制了4 种竹叶黄酮质量浓度的降低(P<0.05)。经口腔消化后,与直接消化组相比,添加果胶组的异荭草苷质量浓度显著提高(从150.4 mg/L提高到207.8 mg/L),荭草苷、异牡荆素和牡荆素的质量浓度分别提高了17.7%、41.4%和35.1%(图3A)。胃模拟消化添加果胶样品后,与直接消化样品相比,异荭草苷、荭草苷、异牡荆素、牡荆素质量浓度分别增加25.1%、32.2%、40.9%、56.7%(图3B)。与直接消化相比,添加果胶可提高肠模拟消化后4 种竹叶黄酮的质量浓度(图3C)。
2.3 不同处理后竹叶黄酮质量浓度变化的线性关系
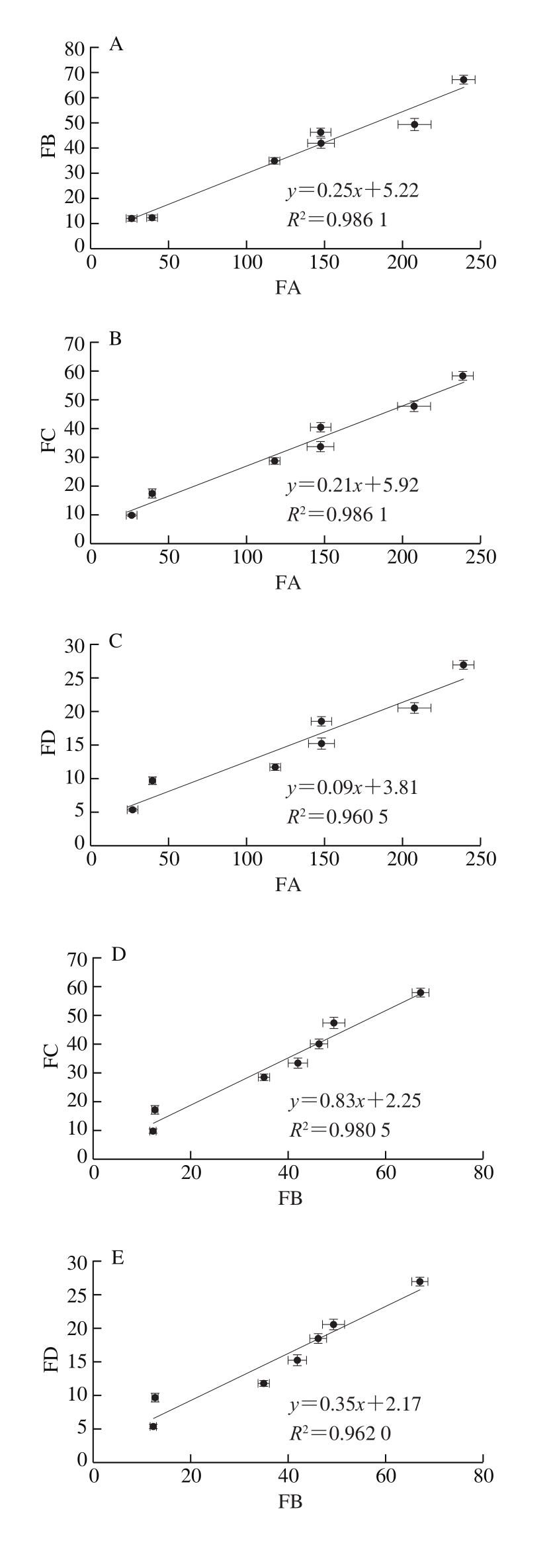
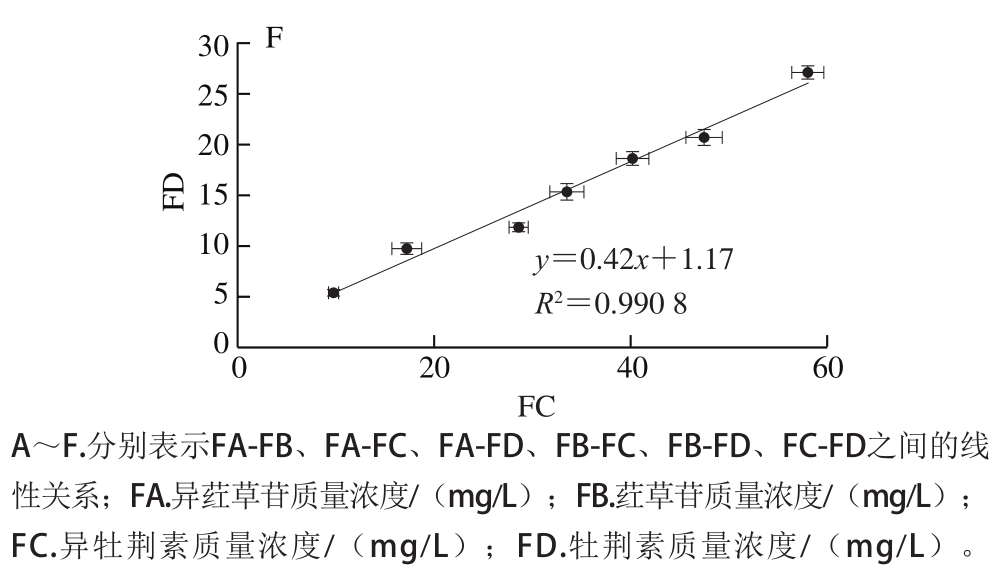
图4 4 种竹叶黄酮质量浓度变化的线性关系
Fig. 4 Linear relationships between contents of four bamboo leaf flavonoids
为了评价果胶的保护性能,采用多元分析方法揭示不同处理模拟消化阶段4 种竹叶黄酮质量浓度之进行线性拟合,结果如图4所示。4 次重复的7 种样品(原始样品+3 个阶段直接消化组样品+3 个阶段果胶添加组样品)的不同竹叶黄酮质量浓度之间存在良好的线性关系。并且,线性相关性可能与不同竹叶黄酮的结构相似性有关联[27-28]。
2.4 肠道消化后4 种竹叶黄酮的生物可及性及热图分析结果
为了进一步揭示果胶的保护作用,分别对直接消化和添加果胶的两组样品中4 种竹叶黄酮在肠道消化后的生物可及性进行研究,结果如表1所示。添加果胶的样品与直接消化样品相比,4 种竹叶黄酮经肠道消化后的生物可及性显著提高,其中异牡荆素和牡荆素的生物可及性分别提高了75.1%和80.2%。比较发现,相较于荭草苷和异荭草苷,果胶对异牡荆素和牡荆素的生物可及性提升更为明显。生物可及性的差异可能是黄酮分子结构不同导致的[29]。研究表明,营养物质的生物可及性与其结构存在相关性[28]。含植物多酚及纤维素的食物基质中,植物多酚与纤维之间的相互作用能改变多酚经胃肠道消化后的释放与吸收效率[27]。果胶的添加显著提高了4 种竹叶黄酮的生物可及性(P<0.05),使其能够更多地到达肠壁进而进入循环系统,从而更好地发挥其生物活性。本研究中,果胶对提升肠道异牡荆素和牡荆素的生物可及性的效果显著优于异荭草苷和荭草苷。异牡荆素和牡荆素互为同分异构体,荭草苷和异荭草苷互为同分异构体,这表明竹叶黄酮结构和生物可及性之间的关联性。
表1 模拟肠道消化后4 种竹叶黄酮的生物可及性
Table 1 Bioaccessibility of four bamboo leaf flavonoids after stimulated intestinal digestion in the presence and absence of pectin

注:同列肩标小写字母不同表示差异显著(P<0.05);*.与直接消化组相比,果胶添加组生物可及性的增加率。
处理组 生物可及性/%异荭草苷 荭草苷 异牡荆素 牡荆素直接消化组 11.02±1.21a17.35±0.82a16.97±1.14a19.96±1.01a果胶添加组 16.47±2.76b19.86±0.53b29.71±2.73b35.97±2.14b增加率*/% 49.5 14.5 75.1 80.2
热图分析(图5)结果也表明了异牡荆素和牡荆素在同样处理时其质量浓度变化接近,而荭草苷和异荭草苷的质量浓度变化接近,两对同分异构体展示了不同的聚类趋势。Kermani等[30]的研究也表明,不同的聚类趋势可能由竹叶黄酮的结构差异引起。

图5 4 种竹叶黄酮的热图分析
Fig. 5 Heatmap analysis of the concentrations of four bamboo leaf flavonoids at different digestion stages
2.5 主成分分析和聚类分析结果
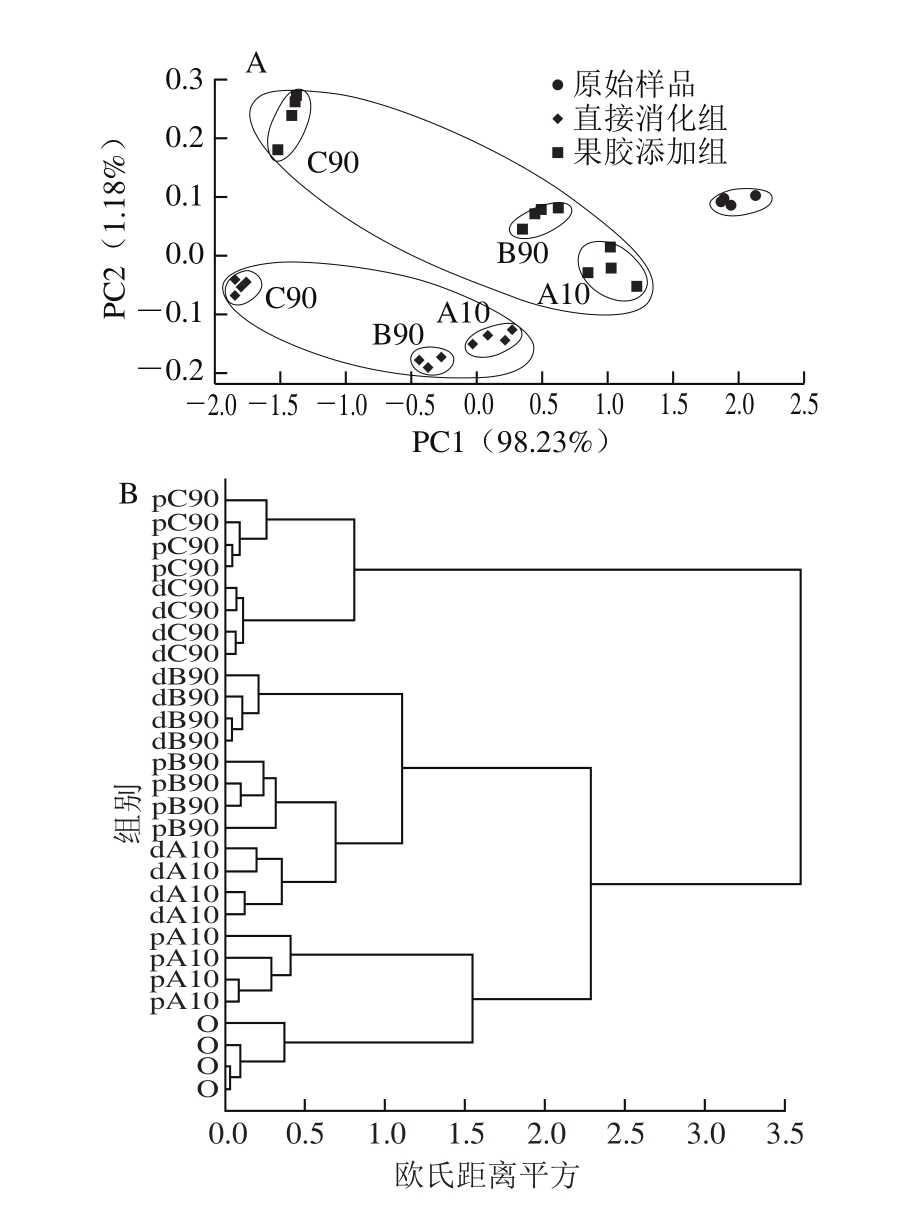
图6 不同处理后样品中竹叶黄酮质量浓度的主成分分析(A)及聚类分析(B)
Fig. 6 Principal components analysis plot (A) and cluster analysis plot (B)for the concentrations of four bamboo leaf flavonoids at different digestion stages in the presence and absence of pectin
采用主成分分析法对果胶原始样品、直接消化组样品和果胶添加组样品在消化过程中4 种竹叶黄酮的质量浓度进行分析,结果如图6A所示,前两个主成分可以累计贡献率达到99.41%,可以表征原始数据变化的大部分特征信息。不同组别的样品分布在不同区域,原始样品聚为一类,直接消化组聚为一类,果胶添加组聚为一类,说明主成分分析可以很好地反映样品处理的分类信息。此外,同一组组内样品的分布不同,揭示了不同消化阶段产生的效果不同。与直接消化组样品相比,果胶添加样品和原始样品的分布区域更接近,存在聚类趋势。此外,在添加果胶的3 个阶段的样品中,pA10样品与原始样品较接近,其次是pB90样品,证实了同一组内样品经不同的消化阶段处理后存在不同的聚类趋势。
对样品进行聚类分析(图6B),当欧氏距离平方为1.5时,pA10样本与原始样本趋于聚类。当欧氏距离平方为1.2时,dA10、dB90和pB90趋于聚类。当欧氏距离平方为0.8时,dC90和pC90样本趋于聚类。聚类趋势分析结果也能表明,模拟肠道消化对竹叶黄酮质量浓度的影响大于口腔和胃消化的影响,果胶的加入能提升不同模拟消化阶段中竹叶黄酮的质量浓度及其生物可及性。
2.6 黄酮生物可及性变化的机制

图7 果胶分子提升竹叶黄酮分子生物可及性示意图(A)和不同样品的扫描电子显微镜图(B)
Fig. 7 Schematic diagram illustrating the protective effect of pectin on bamboo leaf flavonoids (A) and corresponding scanning electron microscope images (B)
果胶是一种膳食纤维,包括胶凝(光滑区域)和非胶凝(粗糙区域)两部分,果胶分子的连续半乳糖酸盐单位形成两个链之间稳定的交联结构[31]。半乳糖醛酸和(或)羟基之间的氢键有助于链缔合[32]。因此,果胶复合物可以成功用于开发亲水生物活性分子的递送体系[33]。Chen Hua[34]、Jo[35]等研究认为,纤维或淀粉的空腔结构可以用来容纳生物活性分子以抑制消化处理造成的活性分子的分解。黄酮分子通过作用于细胞内的受体蛋白,发挥抗炎抗氧化应激等生物活性,这种相互作用多通过氢键、范德华力、疏水作用力等交联,其中氢键起着重要作用[36]。本实验根据已有研究[31-33]和不同溶液扫描电子显微镜图(图7B)推断得到,在果胶溶液中添加竹叶黄酮提取物后,竹叶黄酮可以通过氢键及树枝空间与果胶分子结合(图7A),进而果胶颗粒发挥其对黄酮分子的保护作用[29,37]。果胶的添加有助于增加竹叶黄酮在消化过程中的稳定性,从而降低竹叶黄酮在消化液中的消化,提升竹叶黄酮在体外模拟消化过程中的生物可及性,使到达肠壁的竹叶黄酮量增加,进而进入循环系统,得以发挥其生物功效。
3 结 论
通过体外模拟口腔、胃、肠消化并结合UPLC分析,探究果胶对竹叶提取物中竹叶黄酮化合物的保护作用。结果表明,果胶提升了竹叶黄酮在体外模拟消化过程中的生物可及性,其中,使肠道消化后异牡荆素和牡荆素生物可及性提高了75.1%和80.2%。采用主成分分析和聚类分析的方法对不同处理的聚类趋势进行了阐述,证实果胶的加入对竹叶黄酮分子生物可及性有显著提升。综上所述,果胶对竹叶黄酮的生物可及性具有增强作用,本研究对于相关功能性产品的开发具有良好的理论及应用价值。
[1] GENTILE D, FORNAI M, PELLEGRINI C, et al. Dietary flavonoids as a potential intervention to improve redox balance in obesity and related co-morbidities: a review[J]. Nutrition Research Reviews, 2018,31(2): 239-247. DOI:10.1017/S0954422418000082.
[2] MA Y, HE Y, YIN T J, et al. Metabolism of phenolic compounds in LPS-stimulated Raw264.7 cells can impact their anti-inflammatory efficacy: indication of hesperetin[J]. Journal of Agricultural and Food Chemistry, 2018, 66: 6042-6052. DOI:10.1021/acs.jafc.7b04464.
[3] ZHAO Z, WU M, ZHAN Y, et al. Characterization and purification of anthocyanins from black peanut (Arachis hypogaea L.) skin by combined column chromatography[J]. Journal of Chromatography A,2017, 1519: 74-82. DOI:10.1016/j.chroma.2017.08.078.
[4] ELEGBEDE J L, LI M, JONES O G, et al. Interactions between flavonoid-rich extracts and sodium caseinate modulate protein functionality and flavonoid bioaccessibility in model food systems[J]. Journal of Food Science, 2018,83(5): 1229-1236. DOI:10.1111/1750-3841.14132.
[5] PEREZ-MORAL N, SAHA S, PHILO M, et al. Comparative bio-accessibility, bioavailability and bioequivalence of quercetin,apigenin, glucoraphanin and carotenoids from freeze-dried vegetables incorporated into a baked snack versus minimally processed vegetables: evidence from in vitro models and a human bioavailability study[J]. Journal of Functional Foods, 2018, 48: 410-419.DOI:10.1016/j.jff.2018.07.035.
[6] MANDALARI G, VARDAKOU M, FAULKS R, et al. Food matrix effects of polyphenol bioaccessibility from almond skin during simulated human digestion[J]. Nutrients, 2016, 8(9): 568.DOI:10.3390/nu8090568.
[7] RIBAS-AGUSTÍ A, MARTÍN-BELLOSO O, SOLIVA-FORTUNY R,et al. Food processing strategies to enhance phenolic compounds bioaccessibility and bioavailability in plant-based foods[J]. Critical Reviews in Food Science and Nutrition, 2018, 58(15): 2531-2548.DOI:10.1080/10408398.2017.1331200.
[8] XIANG D, FAN L, HOU X L, et al. Uptake and transport mechanism of dihydromyricetin across human intestinal Caco-2 cells[J]. Journal of Food Science, 2018, 83: 1941-1947. DOI:10.1111/1750-3841.14112.
[9] MARTÍNEZ-LAS HERAS R, PINAZO A, HEREDIA A, et al.Evaluation studies of persimmon plant (Diospyros kaki) for physiological benefits and bioaccessibility of antioxidants by in vitro simulated gastrointestinal digestion[J]. Food Chemistry, 2017, 214:478-485. DOI:10.1016/j.foodchem.2016.07.104.
[10] GONZÁLEZ-SARRÍAS A, ESPÍN J C, TOMÁS-BARBERÁN F A. Non-extractable polyphenols produce gut microbiota metabolites that persist in circulation and show antiinflammatory and free radical-scavenging effects[J]. Trends in Food Science and Technology, 2017, 69: 281-288. DOI:10.1016/j.tifs.2017.07.010.
[11] QUIRÓS-SAUCEDA A E, PALAFOX-CARLOS H, SÁYAGO-AYERDI S G, et al. Dietary fiber and phenolic compounds as functional ingredients: interaction and possible effect after ingestion[J].Food & Function, 2014, 5: 1063-1072. DOI:10.1039/C4FO00073K.
[12] VIUDA-MARTOS M, LUCAS-GONZALEZ R, BALLESTERCOSTA C, et al. Evaluation of protective effect of different dietary fibers on polyphenolic profile stability of maqui berry (Aristotelia chilensis (Molina) Stuntz) during in vitro gastrointestinal digestion[J].Food & Function, 2018, 9: 573-584. DOI:10.1039/C7FO01671A.
[13] 李占明, 蔡泓历, 梁奕, 等. 黄原胶对体外模拟胃肠道消化过程中4种竹叶黄酮生物可及性的影响[J]. 食品科学, 2019, 40(21): 58-64.DOI:10.7506/spkx1002-6630-20180920-214.
[14] AYYASH M, JOHNSON S K, LIU S Q, et al. In vitro investigation of bioactivities of solid-state fermented lupin, quinoa and wheat using Lactobacillus spp.[J]. Food Chemistry, 2019, 275: 50-58.DOI:10.1016/j.foodchem.2018.09.031.
[15] AYYASH M, AL-NUAIMI A K, AL-MAHADIN S, et al. In vitro investigation of anticancer and ACE-inhibiting activity, α-amylase and α-glucosidase inhibition, and antioxidant activity of camel milk fermented with camel milk probiotic: a comparative study with fermented bovine milk[J]. Food Chemistry, 2018, 239: 588-597.DOI:10.1016/j.foodchem.2017.06.149.
[16] ESFANJANI A F, ASSADPOUR E, JAFARI S M, Improving the bioavailability of phenolic compounds by loading them within lipidbased nanocarriers[J]. Trends in Food Science and Technology, 2018,76: 56-66. DOI:10.1016/j.tifs.2018.04.002.
[17] TOMAS M, BEEKWILDER J, HALL R D, et al. Industrial processing versus home processing of tomato sauce: effects on phenolics,flavonoids and in vitro bioaccessibility of antioxidants[J]. Food Chemistry, 2017, 220: 51-58. DOI:10.1016/j.foodchem.2016.09.201.
[18] GAYOSO L, CLAERBOUT A, CALVO M I, et al. Bioaccessibility of rutin, caffeic acid and rosmarinic acid: influence of the in vitro gastrointestinal digestion models[J]. Journal of Functional Foods,2016, 26: 428-438. DOI:10.1016/j.jff.2016.08.003.
[19] YU Y, LI Z M, CAO G T, et al. Bamboo leaf flavonoids extracts alleviate oxidative stress in HepG2 cells via naturally modulating reactive oxygen species production and Nrf2-mediated antioxidant defense responses[J]. Journal of Food Science, 2019, 84(6): 1609-1620.DOI:10.1111/1750-3841.14609.
[20] ZHANG Y, JIAO J J, LIU C M, et al. Isolation and purification of four flavone C-glycosides from antioxidant of bamboo leaves by macroporous resin column chromatography and preparative highperformance liquid chromatography[J]. Food Chemistry, 2008, 107:1326-1336. DOI:10.1016/j.foodchem.2007.09.037.
[21] WU D, CHEN J Y, LU B Y, et al. Application of near infrared spectroscopy for the rapid determination of antioxidant activity of bamboo leaf extract[J]. Food Chemistry, 2012, 135: 2147-2156.DOI:10.1016/j.foodchem.2012.07.011.
[22] MATERSKA M. Flavone C-glycosides from Capsicum annuum L.:relationships between antioxidant activity and lipophilicity[J].European Food Research Technology, 2015, 240: 549-557.DOI:10.1007/s00217-014-2353-2.
[23] CHEN G J, LI C F, WANG S S, et al. Characterization of physicochemical properties and antioxidant activity of polysaccharides from shoot residues of bamboo (Chimonobambusa quadrangularis):effect of drying procedures[J]. Food Chemistry, 2019, 292: 281-293.DOI:10.1016/j.foodchem.2019.04.060.
[24] CHEN L, WU J, LI Z, et al. Metabolomic analysis of energy regulated germination and sprouting of organic mung bean (Vigna radiata)using NMR spectroscopy[J]. Food Chemistry, 2019, 286: 87-97.DOI:10.1016/j.foodchem.2019.01.183.
[25] CHEN L, TAN G J T, PANG X Y, et al. Energy regulated nutritive and antioxidant properties during the germination and sprouting of broccoli sprouts (Brassica oleracea var. italica)[J]. Journal of Agricultural and Food Chemistry, 2018, 66: 6975-6985. DOI:10.1021/acs.jafc.8b00466.
[26] GONZÁLEZ-MONTOYA M, HERNÁNDEZ-LEDESMA B, SILVÁN J M, et al. Peptides derived from in vitro gastrointestinal digestion of germinated soybean proteins inhibit human colon cancer cells proliferation and inflammation[J]. Food Chemistry,2018, 242: 75-82. DOI:10.1016/j.foodchem.2017.09.035.
[27] PETRY F C, MERCADANTE A Z. Impact of in vitro digestion phases on the stability and bioaccessibility of carotenoids and their esters in mandarin pulps[J]. Food & Function, 2017, 8: 3951-3963.DOI:10.1039/C7FO01075C.
[28] PALMERO P, PANOZZO A, COLLE I, et al. Role of structural barriers for carotenoid bioaccessibility upon high pressure homogenization[J]. Food Chemistry, 2016, 199: 423-432.DOI:10.1016/j.foodchem.2015.12.062.
[29] CHEN L, TENG H, XIE Z L, et al. Modifications of dietary flavonoids towards improved bioactivity: an update on structure-activity relationship[J]. Critical Reviews in Food Science and Nutrition, 2018,58(4): 513-527. DOI:10.1080/10408398.2016.1196334.
[30] KERMANI Z J, SHPIGELMAN A, PHAM H T T, et al. Functional properties of citric acid extracted mango peel pectin as related to its chemical structure[J]. Food Hydrocolloids, 2015, 44: 424-434.DOI:10.1016/j.foodhyd.2014.10.018.
[31] ALBA K, KONTOGIORGOS V. Pectin at the oil-water interface:relationship of molecular composition and structure to functionality[J].Food Hydrocolloids, 2017, 68: 211-218. DOI:10.1016/j.foodhyd.2016.07.026.
[32] KASTNER H, EINHORN-STOLL U, DRUSCH S. Structure formation in sugar containing pectin gels: influence of gel composition and cooling rate on the gelation of non-amidated and amidated low-methoxylated pectin[J]. Food Hydrocolloids, 2017, 73: 13-20.DOI:10.1016/j.foodhyd.2017.06.023.
[33] WANG Q, REN Y R, DING Y P, et al. The influence of pH and enzyme cross-linking on protein delivery properties of WPI-beet pectin complexes[J]. Food Research International, 2018, 105: 678-685.DOI:10.1016/j.foodres.2017.11.076.
[34] CHEN Hua, YAO Yuan. Phytoglycogen improves the water solubility and Caco-2 monolayer permeation of quercetin[J]. Food Chemistry,2017, 221: 248-257. DOI:10.1016/j.foodchem.2016.10.064.
[35] JO M, BAN C, GOH K K, et al. Gastrointestinal digestion and stability of submicron-sized emulsions stabilized using waxy maize starch crystals[J]. Food Hydrocolloids, 2018, 84: 343-352. DOI:10.1016/j.foodhyd.2018.06.026.
[36] XU Y, XIE L H, XIE J H, et al. Pelargonidin-3-O-rutinoside as a novel α-glucosidase inhibitor for improving postprandial hyperglycemia[J].Chemical Communications, 2019, 55(1): 39-42. DOI:10.1039/C8CC07985D.
[37] JAKOBEK L. Interactions of polyphenols with carbohydrates, lipids