淀粉是由直链淀粉和支链淀粉组成的天然大分子聚合物,其中直链淀粉在配体的诱导下可形成单螺旋链腔体结构,这种“内腔疏水外侧亲水”的单螺旋链结构能够作为一种主体分子,通过疏水相互作用与疏水性客体分子形成复合物[1-2]。例如,它可以与一些客体分子如碘、脂类、黄酮类、表面活性剂等形成螺旋复合物[3]。通常,直链淀粉复合物的制备主要采用KOH/HCl溶液法[4]、水/二甲基亚砜法[5]和酶促聚合法[6]。这些方法存在生产周期长、成本高、产品得率低或有化学试剂残留等问题,不适用于功能食品或营养强化食品的加工。近年来,采用物理法(超声辅助制备法[7]、热溶法[8]、蒸汽喷射蒸煮法[9]、高压均质法[10]、挤压蒸煮法[11]、球磨法[12]等)制备淀粉复合物受到了广泛的关注。其中,球磨法是利用诸如摩擦、碰撞、剪切等外力作用来改变淀粉颗粒结构和性质的物理改性方法,具有操作简单、可控性强、可间歇也可连续工作、研磨物料便于更换、成本低、环境友好等优点[13]。研究结果表明,球磨处理能够改变淀粉的理化性质,包括溶解性、相对结晶度、颗粒形态和粒径分布、分子质量、直链淀粉/支链淀粉比等[13-14]。刘灿灿等[15]研究了槟榔芋淀粉的球磨和辛烯基琥珀酸酯化复合改性,结果显示,与原淀粉相比,球磨和酯化复合改性淀粉在球磨机械力作用下分子链断裂,更容易吸水,淀粉的膨润力、透明度和溶解度明显增强。本课题组前期研究发现,淀粉与茶多酚共球磨处理后淀粉颗粒团聚黏连,抗性淀粉含量增多,淀粉的特征衍射峰强度减弱,相对结晶度下降[16]。
芹菜素是一种黄酮类化合物,它可以抑制α-淀粉酶的活性,导致淀粉的水解速率减缓,抗性淀粉含量增加,进而可以控制机体的血糖水平[17]。刘春颖等[18]也探讨了芹菜素对α-葡萄糖苷酶、麦芽糖酶和蔗糖酶活性的影响,结果表明,芹菜素可以竞争性抑制α-葡萄糖苷酶、麦芽糖酶和蔗糖酶的活性。Panda等[19]发现,灌胃芹菜素后能显著降低糖尿病小鼠的血糖水平,这些对于降低糖尿病患者餐后血糖浓度具有重要的指导意义。但芹菜素的水溶性和脂溶性均较差,直接口服后胃肠道吸收差,生物利用率低[20]。因此,本实验选用球磨法制备玉米淀粉-芹菜素复合物,旨在将芹菜素与玉米淀粉相结合,通过芹菜素的释放和抑制消化酶(α-淀粉酶和α-葡萄糖苷酶)的活性从而降低和延缓淀粉的消化。同时在球磨的作用下降低芹菜素的结晶度,增加其表面活性及分散度,提高其溶出度[21],最终提高芹菜素的生物利用率。
1 材料与方法
1.1 材料与试剂
玉米淀粉(食品级)(水分质量分数13%~14%、直链淀粉质量分数20%~30%) 山东寿光巨能金玉米开发有限公司;芹菜素(纯度高于98%) 天津江莱生物有限公司;芹菜素标准品(纯度不低于98%) 上海源叶生物科技有限公司;葡萄糖标准品 天津市化学试剂一厂;猪胰α-淀粉酶(290 U/mL) 美国Sigma公司;糖化酶(15 U/mL) 北京Solarbio公司;乙腈(色谱纯) 天津市津东天正精细化学试剂厂;甲醇(色谱纯)、无水乙醇 德国默克有限公司。
1.2 仪器与设备
XQM-0.4型星式球磨机 湖南长沙天创粉末科技有限公司;TU-1810型紫外-可见分光光度计 上海精密科学仪器有限公司;XL-30型扫描电子显微镜 荷兰飞利浦公司;D/max 2500型X射线衍射仪 日本理学株式会社;Vector-22型傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)仪 德国布鲁克仪器公司;BS-2FS型立式恒温恒湿摇床 苏州威尔实验用品有限公司;高效液相色谱分析仪 美国Agilent公司;Q50热重分析仪 上海莱睿科学仪器有限公司。
1.3 方法
1.3.1 淀粉-芹菜素复合物的制备方法及单因素试验
玉米淀粉-芹菜素复合物的制备参考文献[16]报道的方法。将芹菜素和玉米淀粉置于陶瓷罐(100 mL)中,再加入不同直径(5、10 mm和15 mm)的氧化锆球共30.0 g。将球磨机负荷设定为15.0 g,设定球、料质量比接近2∶1,球、料总体积控制在球磨罐总体积的1/3~2/3范围内,转速设定为700 r/min,分别以球磨处理时间和m(玉米淀粉)∶m(芹菜素)为单因素变量进行淀粉-芹菜素复合物的制备。首先考察球磨处理时间的影响:将10.0 g玉米淀粉和1.0 g芹菜素放入球磨罐中进行球磨,共处理35 h,以5 h为间隔找出较佳的球磨处理时间。
确定较佳的球磨时间后,将球磨时间固定不变,考察m(玉米淀粉)∶m(芹菜素)的影响,以10.0 g玉米淀粉分别和0.5、1.0、1.5、2.0、2.5 g的芹菜素混合研磨,确定复合物制备的较佳玉米淀粉/芹菜素质量比。球磨处理结束后,用无水乙醇洗去复合物表面未结合的芹菜素,抽滤,将所得复合物在37 ℃的恒温干燥箱中烘干,研磨并过100 目筛。实验过程中采用球磨玉米淀粉作为空白对照,即不加芹菜素进行球磨30 h的实验组。淀粉与芹菜素物理混合物的制备方法:根据实验所筛选的较佳条件下制备的复合物中玉米淀粉含量和芹菜素含量,精确称量928.5 mg玉米淀粉和71.5 mg芹菜素,放置于10 mL带盖离心管中,振荡5 min后过100 目筛,作为方法对照。
1.3.2 淀粉-芹菜素复合物中芹菜素含量及复合率的测定
复合物中芹菜素的含量测定参考Wang Keqin等[22]的方法。精确称取复合物200 mg,置于10 mL容量瓶中,用甲醇溶液定容,于25 ℃条件下超声30 min,冷却至室温,取上清液过0.22 μm滤膜待用。色谱条件如下:色谱柱C18(150 mm×4.6 mm,5 μm);流动相乙腈-水(35∶65,V/V);流速1.0 mL/min;柱温35 ℃;紫外检测波长为270 nm;进样量10 μL。
采用外标法计算球磨后复合物中芹菜素含量,根据芹菜素的标准品校正曲线方程Y=37.30X-33.06,进样质量浓度在0~160 μg/mL范围内芹菜素含量与峰面积呈良好的线性关系(R2=0.999)。芹菜素的复合率按式(1)计算。
式中:ma为复合物中芹菜素的质量/mg;mb为初始投入芹菜素的质量/mg。
1.3.3 淀粉-芹菜素复合物的结构表征
1.3.3.1 扫描电子显微镜观察
将导电胶依次固定在扫描电子显微镜样品台上,用药匙将样品均匀平整地铺在导电胶表面,吹扫多余的样品颗粒。用离子溅射镀膜仪在样品表面镀金60 s。用扫描电子显微镜进行观察并拍照,加速电压设为6 kV,放大倍数为2 000 倍[23]。
1.3.3.2 X射线衍射分析
取适量样品于托盘片的中央,用光滑的玻片将样品压成厚1 mm、宽13 mm的薄片并固定。采用连续扫描的方式,测定条件如下:电压40 kV,电流35 mA,2θ扫描区域4°~35°,扫描速率4°/min,采样步宽0.02°,缝宽为2 mm,接收狭缝宽为1 mm[24]。
1.3.3.3 FT-IR分析
在玛瑙研钵中加入样品约2 mg、溴化钾150 mg,均匀研磨,然后将混合物倒入压片器中压成近透明的片材,片厚1 mm左右,随后取出样品薄片进行红外光谱扫描。扫描范围为500~4 000 cm-1,光谱分辨率为4 cm-1,信号扫描累计16 次。
1.3.3.4 热重分析
选用铟标定仪器,依次取10 mg左右样品置于样品铂金坩埚中,升温区间25~600 ℃,升温速率为10 ℃/min。氮气作为保护气体,气体流量60 mL/min。
1.3.4 淀粉-芹菜素复合物的体外消化性测定
玉米淀粉-芹菜素复合物的体外消化性测定参考Sang等[25]的方法并稍作改进。考虑m(玉米淀粉)∶m(芹菜素)的不同对实际可用于消化淀粉含量的影响,在消化性测定中,以复合物样品中含有200 mg淀粉的量为基准称取样品。分别将不同m(玉米淀粉)∶m(芹菜素)的复合物(质量比分别为20∶1、20∶2、20∶3、20∶4、20∶5)放置于5 个装有20 mL pH 5.2磷酸盐缓冲溶液的烧杯中,在37 ℃、40 r/min转速恒温摇床上平衡5 min后依次倒入5 个透析袋中,并在透析袋中加入6 颗氧化锆球(直径5 mm)、10 mL混酶(α-淀粉酶290 U/mL、糖化酶15 U/mL),用夹子夹紧透析袋两端,将透析袋分别放入装有80 mL磷酸盐缓冲溶液的烧杯中并做标记,盖上保鲜膜。在0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 h时各取样2 mL,取样后及时用等体积磷酸盐缓冲溶液补足溶液体积。采用3,5-二硝基水杨酸法测定吸光度。葡萄糖释放量的测定采用外标法,依据葡萄糖的标准品校正曲线方程Y=10.61X-0.018,进样质量浓度在0~50 μg/mL范围内葡萄糖的含量与吸光度呈良好的线性关系(R2=0.998)。体外消化率按式(2)计算。
式中:ma为葡萄糖的释放量/mg;mb为淀粉的质量/mg。
1.4 数据统计与分析
采用Origin 8.0软件处理实验数据,结果取3 次实验的平均值,以平均值±标准差表示。显著性分析采用邓肯氏多重比较,P<0.05为差异显著。
2 结果与分析
2.1 制备条件对淀粉-芹菜素复合物中芹菜素含量和复合率的影响
2.1.1 球磨处理时间对复合物中芹菜素含量和复合率的影响

图1 球磨处理时间对复合物中芹菜素含量和复合率的影响
Fig. 1 Effect of ball milling time on the content and percent complexation of apigenin in the complex
由图1可知,球磨时间5~10 h时,芹菜素的含量和复合率上升趋势明显,这可能是由于玉米淀粉的结构在球磨外力的作用下开始发生改变,直链淀粉单螺旋空腔已经大量暴露,使得芹菜素和淀粉包合速率加快。当球磨时间从10 h延长到30 h时,芹菜素的含量和复合率上升趋势减缓,可能是直链淀粉可供芹菜素占据的单螺旋结合点逐渐减少造成的。当球磨时间超过30 h后,直链淀粉与芹菜素的结合量开始下降,可能是球磨时间过长,玉米淀粉的形态和结构均被破坏,可供芹菜素结合的位点也随之被破坏。因此,玉米淀粉-芹菜素复合物制备的较优球磨时间为30 h。
2.1.2 m(玉米淀粉)∶m(芹菜素)对复合物中芹菜素含量和复合率的影响

图2 m(玉米淀粉)∶m(芹菜素)对复合物中芹菜素含量和复合率的影响
Fig. 2 Effect of starch∶apigenin ratio on the content and percent complexation of apigenin in the complex
由图2可知,当m(玉米淀粉)∶m(芹菜素)从20∶1增加到20∶4时,随着芹菜素比例的增加,玉米淀粉-芹菜素复合物中芹菜素的含量逐渐增加到71.5 mg/g,芹菜素的复合率在m(玉米淀粉)∶m(芹菜素)为20∶4时达到最高(35.7%)。当m(玉米淀粉)∶m(芹菜素)由20∶4增加到20∶5时,复合物中的芹菜素含量基本不变,说明直链淀粉单螺旋空腔上的结合位点已被芹菜素占据完全。从图2中还可以看出,m(玉米淀粉)∶m(芹菜素)大于20∶4后芹菜素的复合率开始下降,这可能是由于,当投入的芹菜素过量时,会影响淀粉的球磨改性效果,所形成直链淀粉的结合位点增加有限,过量的芹菜素并不会与淀粉结合,导致芹菜素的复合率下降,造成了芹菜素的浪费。因此,球磨法制备复合物的玉米淀粉-芹菜素的较优质量比为20∶4。
2.2 淀粉-芹菜素复合物的结构表征
2.2.1 扫描电子显微镜分析结果
由图3可知,芹菜素形貌为无规则晶体状颗粒(图3a)。玉米原淀粉呈不规则的颗粒状,颗粒棱角明显、不圆润,颗粒大小不均匀(图3b)。将二者物理混合后结果显示,芹菜素附着在玉米淀粉颗粒表面,淀粉和芹菜素的形状均未改变(图3c)。球磨后的芹菜素呈团聚态(图3d)。球磨后的玉米淀粉(图3e)与玉米原淀粉在形貌上存在明显差异,主要表现在球磨后淀粉颗粒表面破碎,出现裂纹,多个淀粉颗粒团聚形成更大的淀粉粒子。这主要是淀粉受球磨碰撞力、挤压力及摩擦力所致[14]。与球磨后的淀粉相比,采用球磨法制备的复合物因芹菜素的迁入淀粉表面无裂纹,淀粉颗粒表面变得更加粗糙,淀粉颗粒的破损度和团聚现象明显提高,芹菜素与淀粉黏连形成扁平颗粒状聚集体(图3f)。

图3 芹菜素、玉米淀粉、物理混合物、球磨芹菜素、球磨玉米淀粉、复合物的扫描电子显微镜图(2 000×)
Fig. 3 SEM images of apigenin, corn starch and their physical mixture,as well as milled apigenin, milled corn starch and their complexes (2 000 ×)
2.2.2 X射线衍射分析结果

图4 芹菜素、玉米淀粉、物理混合物、球磨芹菜素、球磨玉米淀粉、复合物的X射线衍射图
Fig. 4 X-ray diffraction patterns of apigenin, corn starch and their physical mixture, as well as milled apigenin, milled corn starch and their complexes
由图4曲线a可知,芹菜素出现许多很强的X射线衍射峰,表明其具有良好的结晶结构。球磨后的芹菜素(图4曲线d)在2θ为25.0°~33.0°之间的衍射峰明显减弱,部分衍射峰消失,说明单独球磨处理芹菜素可以降低芹菜素的结晶度,但其结晶性仍较明显。玉米原淀粉(图4曲线b)在2θ为15.0°、17.0°、18.0°和23.0°处出现衍射峰,表明玉米淀粉具有A型结晶结构[26]。二者经物理混合物后,X射线衍射谱图显示其保留了玉米淀粉和芹菜素二者的部分结晶特征(图4曲线c)。由图4曲线e可知,球磨处理后玉米淀粉的特征衍射峰消失,淀粉的结晶度明显下降。造成这种结果的原因可能是,球磨机械力使淀粉分子链间的排布方式改变,减弱了分子间及分子内氢键的相互作用,导致分子链排列杂乱无序所致[27]。与玉米原淀粉和芹菜素物理混合物相比,采用球磨法制备的复合物(图4曲线f)并没有显示原淀粉和芹菜素各自的特征衍射峰,淀粉-芹菜素复合物基本处于无定形状态,表明玉米淀粉与芹菜素之间存在相互作用,一方面芹菜素的迁入加速了淀粉结晶结构的消失;另一方面,淀粉的存在增加了芹菜素的分散度,有利于芹菜素结晶结构的破坏。
2.2.3 FT-IR分析结果
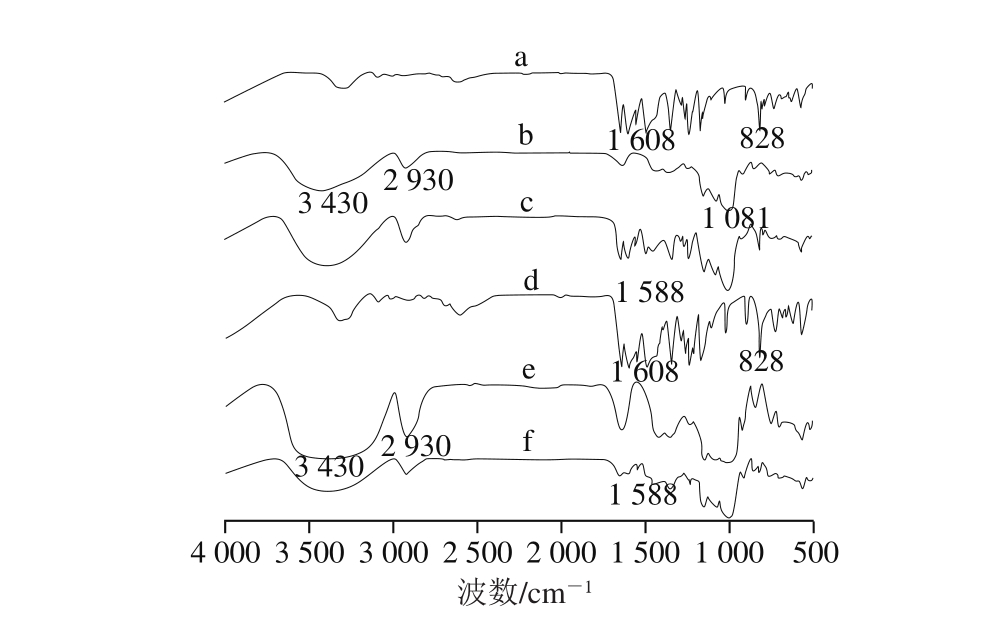
图5 芹菜素、玉米淀粉、物理混合物、球磨芹菜素、球磨玉米淀粉、复合物的FT-IR图
Fig. 5 FT-IR of apigenin, corn starch and their physical mixture, as well as milled apigenin, milled corn starch, and their complexes
由图5可知,芹菜素(图5曲线a)在1 608~1 588、828 cm-1处为苯环特征吸收峰[28],球磨后的芹菜素(图5曲线d)与原芹菜素(图5曲线a)相比没有原基团的消失也没有新基团的产生,说明球磨作用没有破坏芹菜素的分子基团结构。原玉米淀粉(图5曲线b)在3 100~3 700 cm-1处是羟基O—H伸缩振动吸收峰,2 800~3 050 cm-1处为饱和的C—H伸缩振动吸收峰,1 081 cm-1处为环氧基C—O—C特征吸收峰。球磨处理后的淀粉(图5曲线e)在3 080~3 730 cm-1处的羟基O—H特征吸收峰明显比玉米原淀粉(图5曲线b)强,这主要归因于球磨处理使氢键的结合模式发生改变,说明球磨作用改变了淀粉分子间氢键的相互作用[29]。将玉米淀粉和芹菜素物理混合后(图5曲线c),玉米原淀粉和芹菜素的特征峰叠合,但仍然具有芹菜素的苯环特征吸收峰。与物理混合物(图5曲线c)相比,玉米淀粉-芹菜素复合物(图5曲线f)在1 608~1 588、828 cm-1处的芹菜素的苯环特征吸收峰基本消失,说明淀粉与芹菜素有较强的相互作用,可能是大量的芹菜素与玉米淀粉发生复合作用,芹菜素被包结于淀粉的螺旋空腔内或空腔间,使得芹菜素的特征吸收峰不再明显。FT-IR显示玉米淀粉和芹菜素发生了相互作用,但没有生成新的基团,说明两者之间发生的是非共价相互作用。
2.2.4 热重分析结果
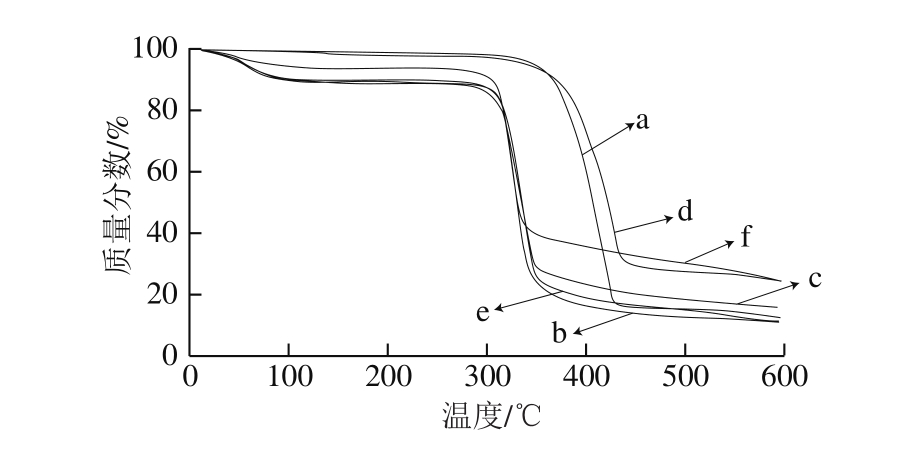
图6 芹菜素、玉米淀粉、物理混合物、球磨芹菜素、球磨玉米淀粉、复合物的热重分析曲线
Fig. 6 Thermal gravimetric curves of apigenin, corn starch and their physical mixture, as well as milled apigenin, milled corn starch,and their complexes
由图6可以看出,芹菜素(图6曲线a)及球磨芹菜素(图6曲线d)只有一个热失重峰,其起始分解温度约在365 ℃,稳定性相对最高,且球磨后芹菜素的热稳定性增强。玉米淀粉(图6曲线b)、球磨后的玉米淀粉(图6曲线e)、物理混合物(图6曲线c)的失重曲线在300 ℃之前基本相似,均在100 ℃前先失水,到300 ℃时达到第一个平台期;当温度从300 ℃升高至350 ℃之间进入第二失重阶段,350 ℃时之后进入第二个平台期。最终玉米淀粉(图6曲线b)、球磨玉米淀粉(图6曲线e)、物理混合(图6曲线c)剩余质量分别为初始质量的11.11%、11.52%、13.46%。从图6还可以看出,复合物(图6曲线f)在100 ℃和300~350 ℃两个失重阶段的质量损失均低于球磨淀粉(图6曲线e)和其物理混合物(图6曲线c),复合物的最终剩余质量为初始质量的22.14%,说明与芹菜素复合后提高了淀粉的热稳定性。
2.2.5 体外消化性分析结果
由图7可知,当体外模拟消化时间从0 h延长到4 h时,所有样品的消化率都呈现增加的趋势,4 h后消化率基本维持不变。由图7还可以看出,在体外模拟消化性实验中,球磨后玉米淀粉(图7曲线a)的消化率最高(约50%),而玉米原淀粉(图7曲线b)的体外消化率最高只有43%。这是由于球磨使玉米淀粉颗粒和结晶结构遭到破坏,呈现非晶态结构,淀粉酶更容易进入淀粉颗粒内部对淀粉进行酶解,因此更有利于淀粉的消化。与玉米淀粉(图7曲线b)和球磨玉米淀粉(图7曲线a)相比,玉米淀粉-芹菜素复合物的消化率显著降低。这与芹菜素的加入有关,根据庄俊钰等[30]的报道,芹菜素对α-淀粉酶的抑制率为27.6%,有着较高的酶抑制活性。玉米淀粉-芹菜素复合物(图7曲线c~e)的最终消化率分别为28.9%、25.7%、18.8%,随着复合物中芹菜素含量的增加,淀粉的消化率逐渐下降,说明芹菜素的含量与淀粉的消化率呈负相关性。这与屠洁等[31]研究得出的芹菜素能与α-葡萄糖苷酶分子底物结合部位的氨基酸基团形成氢键和疏水作用,从而竞争性地抑制α-葡萄糖苷酶对淀粉的最终消化作用这一结论相一致。
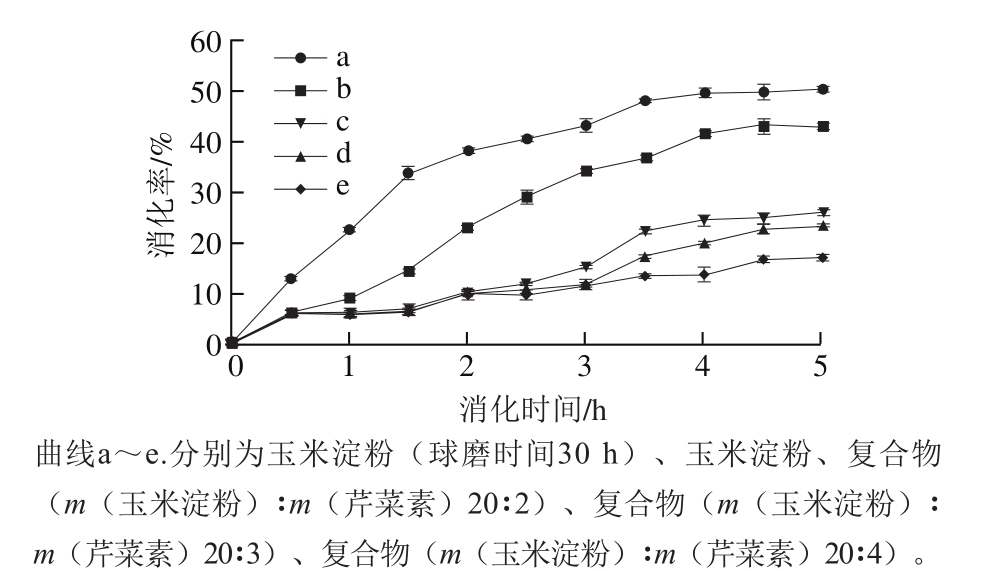
图7 玉米淀粉、球磨玉米淀粉、复合物的体外消化性分析
Fig. 7 In vitro digestibility of corn starch, milled corn starch and their complexes
3 结 论
通过球磨法制备玉米淀粉-芹菜素复合物的较优条件为球磨时间30 h、m(玉米淀粉)∶m(芹菜素)为5∶1,在此条件下芹菜素的复合率最高,为35.7%,每克淀粉中的芹菜素质量为71.5 mg。扫描电子显微镜结果显示球磨使得玉米淀粉颗粒形貌发生改变,表面变得粗糙有裂纹,并发生团聚现象。芹菜素在长时间的球磨外力下与淀粉相互结合形成复合物。复合物表面粗糙无裂纹,呈扁平颗粒状聚集体。X射线衍射分析表明,形成复合物后淀粉的特征衍射峰强度减弱,淀粉的结晶结构被破坏,结晶度降低,且芹菜素的存在加速了淀粉结晶区的破坏。FT-IR显示玉米淀粉和芹菜素发生了相互作用,但没有生成新的基团,说明两者之间发生的是非共价相互作用。热重分析结果表明形成复合物的热稳定性增强。体外消化性评价结果显示淀粉-芹菜素复合物的形成,能抑制淀粉的消化,减缓淀粉的酶解速率,增加淀粉的抗消化性。球磨法虽然具有操作简单、成本低、环境友好等优点,但由于影响因素较多而重现性较差,今后在放大实验过程中应该充分考虑相关影响因素,如设备型号、球磨方式、球磨罐体积、球料比等。
[1] ANJAJE E O, WANG Y J. Effects of chemical and enzymatic modifications on starch-linoleic acid complex formation[J]. Food Chemistry, 2017, 217: 9-17. DOI:10.1016/j.foodchem.2016.08.072.
[2] RONG Z W, FENG T. Preparation and structure characterization of amylose-flavor molecules inclusion compound[J]. Cereals & Oils,2011, 9: 1-5. DOI:10.1109/IEMBS.1991.684680.
[3] KIM H I, KIM H R, CHOI S J, et al. Preparation and characterization of the inclusion complexes between amylosucrase-treated waxy starch and palmitic acid[J]. Food Science and Biotechnology, 2017, 26(2):323-329. DOI:10.1007/s10068-017-0044-z.
[4] 申瑞玲, 张亚蕊, 景新俊, 等. 藜麦淀粉-硬脂酸复合物的制备及性质研究[J]. 河南农业科学, 2018(2): 135-139. DOI:10.15933/j.cnki.1004-3268.2018.02.026.
[5] LALUSH I, BAR H, ZAKARIA I, et al. Utilization of amylose-lipid complexes as molecular nanocapsules for conjugated linoleic acid[J].Biomacromolecules, 2005, 6(1): 121-130. DOI:10.1021/bm049644f.
[6] 孙平, 张颖, 高辉, 等. 辛烯基琥珀酸淀粉酯的酶促合成及性能分析[J]. 中国食品添加剂, 2015(1): 77-83. DOI:10.3969/j.issn.1006-2513.2015.01.007.
[7] LIU P, WANG R, KANG X, et al. Effects of ultrasonic treatment on amylose-lipid complex formation and properties of sweet potato starch-based fi lms[J]. Ultrasonics Sonochemistry, 2018, 44: 215-222.DOI:10.1016/j.ultsonch.2018.02.029.
[8] MARINOPOULOU A, PAPASTERGIADIS E, RAPHAELIDES S N, et al. Morphological characteristics, oxidative stability and enzymic hydrolysis of amylose-fatty acid complexes[J]. Carbohydrate Polymers, 2016, 141: 106-115. DOI:10.1016/j.carbpol.2015.12.062.
[9] FANTA G F, SHOGREN R L, SALCH J H. Steam jet cooking of high-amylose starch-fatty acid mixtures. an investigation of complex formation 1[J]. Carbohydrate Polymers, 1999, 38(1): 1-6.DOI:10.1016/s0144-8617(98)00104-0.
[10] MENG S, MA Y, CUI J, et al. Preparation of corn starch-fatty acid complexes by high-pressure homogenization[J]. Starch-Stärke, 2015,66(9/10): 809-817. DOI:10.1002/star.201400022.
[11] 杨庆余, 罗志刚, 肖志刚, 等. 低温挤压法制备玉米淀粉-GMS复合物及其回生性质研究[J]. 现代食品科技, 2017, 33(1): 132-138; 158.
[12] 郎双静, 王立东. 球磨研磨对荞麦淀粉结构及性质的影响[J]. 农产品加工, 2019(4): 4-8.
[13] TAN X Y, ZHANG B J, LING C, et al. Effect of planetary ballmilling on multi-scale structures and pasting properties of waxy and high-amylose cornstarches[J]. Innovative Food Science & Emerging Technologies, 2015, 30: 198-207. DOI:10.1016/j.ifset.2015.03.013.
[14] TIAN Y L, YING M, SHI F Y, et al. The effect of ball milling treatment on structure and porosity of maize starch granule[J].Innovative Food Science & Emerging Technologies, 2011, 12(4): 586-593. DOI:10.1016/j.ifset.2011.06.009.
[15] 刘灿灿, 黄群, 孙潇鹏, 等. 槟榔芋淀粉与其球磨酯化淀粉理化性质比较[J]. 食品与机械, 2018, 34(5) : 44-48. DOI:10.13652/j.issn.1003-5788.2018.05.009.
[16] 李梦楠, 张黎明, 郝利民, 等. 茶多酚-高直链玉米淀粉共研磨混合物的制备与结构表征[J]. 食品工业科技, 2019, 40(7): 1-7.DOI:10.13652/j.issn.1003-5788.2018.05.009.
[17] 宋彦显, 闵玉涛. 抗性淀粉防治糖尿病和肥胖症功能的研究进展[J]. 中国食物与营养, 2009(7): 48-50. DOI:10.3969/j.issn.1006-9577.2009.07.017.
[18] 刘春颖, 蒋淼, 屠洁, 等. 芹菜素对鼠肠α-葡萄糖苷酶的抑制活性研究[J]. 中国食品添加剂, 2013(4): 90-95. DOI:10.3969/j.issn.1006-2513.2013.04.006.
[19] PANDA S, KAR A. Apigenin (4’,5,7-trihydroxyflavone) regulates hyperglycaemia, thyroid dysfunction and lipid peroxidation in alloxaninduced diabetic mice[J]. Journal of Pharmacy & Pharmacology, 2010,59(11): 1543-1548. DOI:10.1211/jpp.59.11.0012.
[20] 胡海洋, 刘任, 刘丹, 等. 口服芹菜素固体脂质纳米粒制剂学及药动学研究[J]. 中国药学杂志, 2009, 44(6): 448-451.
[21] 江波, 印春华. 提高难溶性药物口服生物利用度的方法[J].中国医药工业杂志, 2002, 33(7): 358-362. DOI:10.3969/j.issn.1001-8255.2002.07.019.
[22] WANG Keqin, LUO Junwu, CHEN Jingping, et al. Study on apigenin quantitation analysis from celery extractions by high-performance liquid chromatography (HPLC) and high-performance lamina chromatography (HPTLC)[J]. Food Science, 2008, 29(4): 291-295.
[23] YANG G Y, YU W T, ZHENG J, et al. Scanning electron microscopy observation on foliar micromorphology of oolong tea germplasms[J].Journal of Southern Agriculture, 2018, 49(10): 2020-2027.
[24] NARA S, KOMIYA T. Studies on the relationship between watersatured state and crystallinity by the diffraction method for moistened potato starch[J]. Starch-Stärke, 1983, 35(12): 407-410. DOI:10.1002/star.19830351202.
[25] SANG I S, KIM H J, HA H J, et al. Effect of hydrothermal treatment on formation and structural characteristics of slowly digestible nonpasted granular sweet potato starch[J]. Starch-Stärke, 2010, 57(9):421-430. DOI:10.1002/star.200400377.
[26] LI W, FANG C, JING F, et al. Physically modified common buckwheat starch and their physicochemical and structural properties[J].Food Hydrocolloids, 2014, 40(10): 237-244. DOI:10.1016/j.foodhyd.2014.03.012.
[27] ZHENG Y, HU L, DING N, et al. Physicochemical and structural characteristics of the octenyl succinic ester of ginkgo starch[J].International Journal of Biological Macromolecules, 2017, 94: 566-570. DOI:10.1016/j.ijbiomac.2016.10.017.
[28] 袁伟文, 顾敏芬, 陈维, 等. 红外漫散射技术用于芹菜素与环糊精包合物的研究[J]. 光谱学与光谱分析, 2018, 38(增刊1): 93-94.
[29] 陈玲, 黄嫣然, 李晓玺, 等. 红外光谱在研究改性淀粉结晶结构中的应用[J]. 中国农业科学, 2007, 40(12): 2821-2826. DOI:10.3321/j.issn:0578-1752.2007.12.022.
[30] 庄俊钰, 李汴生, 王三永. 罗望子壳降血糖活性化学成分的研究[J].现代食品科技, 2011, 27(7): 773-776; 762. DOI:10.3969/j.issn.1673-9078.2011.07.011.
[31] 屠洁, 陈钧, 刘冠卉, 等. 芹菜素抑制α-葡萄糖苷酶的分子机制研究[J].生物技术, 2015, 25(4): 369-374.