转谷氨酰胺酶(transglutaminase,TGase)广泛存在于鱼类中,其主要作用是催化肌原纤维蛋白中谷氨酰胺残基的γ-酰胺基与赖氨酸残基的ɛ-氨基发生交联作用,生成分子内或分子间ɛ-(γ-Glu)-Lys非二硫共价键,促进蛋白网状结构的形成[1-2]。热诱导鱼糜凝胶的形成包括凝胶化、凝胶劣化与凝胶熟化3 个阶段,研究认为鱼肉蛋白的凝胶化有赖于其内源性TGase介导的蛋白质非二硫共价键的交联,形成的鱼糜凝胶强度与TGase活力正相关[3-4]。Tsukamasa等[5]指出沙丁鱼鱼糜较高的凝胶强度与其内源性TGase活性较高、可以更好地促进蛋白发生交联有关;Benjakul等[6-7]发现内源性TGase能诱导蛋白质交联,在两种大眼鲷鱼糜的凝胶增强中起重要作用,而几种TGase的激活剂和抑制剂对4 种热带鱼类(大眼鱼、梭鱼、鳍鲷和大眼鲷)鱼糜的非二硫键共价交联及其凝胶形成能力产生影响。可见鱼糜含有内源性TGase,其活性与鱼糜凝胶品质密切相关。
电子束辐照是一种新型的食品加工技术,在食品保鲜、质量和安全控制、品质改进等领域应用广泛,电子束辐照能引起蛋白构象的改变,导致蛋白变性、聚集或凝胶化,同时也能改变鱼糜内源性酶的结构及其活性,从而影响鱼糜凝胶的形成[8-9]。如Deng Siyao等[10]利用电子束辐照处理梅鱼鱼糜,发现5 kGy剂量可以显著提高鱼糜凝胶强度,这可能与辐照引起鱼肉肌原纤维蛋白α-螺旋含量的下降有关;Malik等[11]研究发现辐照作用于向日葵蛋白,引起蛋白α-螺旋含量降低和β-折叠含量增加;顾可飞[12]发现电子束辐照能抑制液态多酚氧化酶的活性;罗华彬等[13]认为电子束辐照通过影响带鱼鱼糜肌原纤维结合型丝氨酸蛋白酶和组织蛋白酶L的二级结构,抑制这两种内源性蛋白酶活性,减轻对肌原纤维蛋白的降解作用,从而起到防止凝胶劣化、有利于形成高品质带鱼鱼糜凝胶的作用。
带鱼鱼糜所含内源性TGase也与带鱼鱼糜凝胶化作用有关[14]。为进一步阐述电子束辐照对鱼糜凝胶特性的影响机理,本实验以0~9 kGy电子束辐照带鱼鱼糜,提取鱼糜中的内源性TGase,测定酶活力及其最适反应温度和pH值,并通过傅里叶变换红外光谱、圆二色光谱分析酶的二级结构,探究电子束辐照对带鱼鱼糜TGase的影响机理,旨在为利用电子束辐照改进鱼糜及其制品品质提供依据。
1 材料与方法
1.1 材料与试剂
冷冻带鱼鱼糜购自宁波飞日水产实业有限公司,-20 ℃贮藏备用。
DL-二硫苏糖醇(DL-dithiothreitol,DTT)、单丹磺酰尸胺(monodansylcadaverine,MDC) 美国Sigma公司;N,N-二甲基化酪蛋白 北京索莱宝公司;其余试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
NBL-1020电子直线加速器 宁波超能科技股份有限公司;UMC 5型真空斩拌机 德国Stephan Machinery公司;Biofuge Stratos台式高速冷冻离心机 德国Thermo Scientific SORVALL公司;SpectraMax i3多功能酶标仪 美国Molecular Devices公司;J-1500圆二色光谱仪 日本JASCO公司;FWT-60薄膜剂量计 美国远西公司。
1.3 方法
1.3.1 鱼糜辐照处理
冷冻带鱼鱼糜,300 g/袋真空包装。设置电子直线加速器能量为10 MeV,辐照剂量分别为0、1、3、5、7、9 kGy,采用FWT-60薄膜剂量计,通过分光光度法标定吸收剂量,该剂量计经中国计量科学院比对,剂量误差小于±3%,其中以0 kGy为对照组。辐照时样品整齐排列,设置3 个平行;辐照后冰藏保存样品,并在2 h内进行TGase的提取和鱼糜凝胶的制作。
1.3.2 TGase的提取及其活力的测定
TGase的提取及其活力的测定参照杨方[15]、Takagi[16]等的方法略作修改。取各组鱼糜5 g,加入预冷的Tris-HCl缓冲液(0.1 mol/L pH 7.5、含10 mmol/L NaCl)15 mL,冰浴中缓慢搅拌30 min后离心(16 000×g、4 ℃、30 min),上清液用硫酸铵沉淀,冷冻离心10 min,沉淀用Tris-HCl缓冲液溶解,即为TGase酶液。将酶液放入透析袋中过夜,纯化后冷冻干燥。
将冻干TGase粉末溶于蒸馏水中,制成TGase酶液。取2 mL酶液,加入2 mL反应液(含2 mg/mL N,N-二甲基化酪蛋白、5 mmol/L CaCl2、30 μmol/L MDC、3 mmol/L DTT、50 mmol/L Tris-HCl,pH 7.5),37 ℃下反应10 min,加入1 mol/L (NH4)2SO4溶液终止反应。酶标仪测定荧光强度,激发波长为350 nm,发射波长为480 nm,以每分钟转化1 μmol底物所需要的酶量为1 个活力单位(U)。
1.3.3 TGase最适反应温度与最适反应pH值的测定
将反应体系温度分别设置为0、25、35、40、45、55、65、75、85 ℃,其余按照1.3.2节方法测定TGase活力,确定辐照对TGase最适反应温度的影响。将反应体系分别设置为不同pH值(4.0、5.0、6.0、7.0、7.5、8.0、9.0、10.0)的Tris缓冲液,其余按照1.3.2节方法测定TGase活力,确定辐照对TGase最适反应pH值的影响。
1.3.4 TGase的傅里叶变换红外光谱分析
准确称取干燥TGase样品1.0 mg,与溴化钾粉末以质量比1∶100混合均匀,压片扫描(400~4 000 cm-1),采用Peakfit 4.12软件计算TGase中各二级结构单元的相对含量。
1.3.5 TGase的圆二色光谱分析
参照Guan Aiyan等[8]的方法略作修改。采用圆二色光谱仪,选用光径为1 mm的石英样品池,在远紫外区(190~250 nm)对0.2 mg/mL TGase溶液进行扫描,扫描速率为50 nm/min,响应时间0.25 s,以蒸馏水作空白。利用仪器自带软件杨氏模量程序计算各二级结构的相对含量。
1.3.6 鱼糜凝胶强度和保水性的测定
样品处理及凝胶强度测定参考邓思瑶等[17]的方法。取各组带鱼鱼糜,置于真空斩拌机中低温空斩2 min,添加鱼糜质量2.5%的食盐继续斩拌8 min。将斩拌后的鱼糜溶胶灌入直径2.5 cm、长约10 cm的肠衣,两头扎紧肠衣,再进行二段式加热凝胶化(40 ℃加热60 min后90 ℃高温凝胶化30 min),冷却得到鱼糜凝胶,4 ℃放置12 h后进行凝胶强度和保水性分析。
将鱼糜凝胶样品切割为表面光滑、长度约2 cm的柱体备用。压缩模式测凝胶强度(P0.5 s探头),测前、测试、测后速率均为1.0 mm/s,压缩比50%、10 g触发力。
保水性参照文献[18]方法测定。取待测凝胶样品,切片(厚度0.2 cm)四等分,双层滤纸包裹离心(3 000×g,10 min)。记离心管质量为m/g,离心前后离心管与样品总质量分别为m1/g和m2/g,按下式计算保水性。
1.4 数据处理与分析
实验设置3~6 个平行,数据以平均值±标准偏差表示,采用Origin 9.0软件作图,通过SPSS 19.0软件方差分析法进行显著性分析,以P<0.05表示差异显著。
2 结果与分析
2.1 电子束辐照对带鱼鱼糜TGase活力的影响
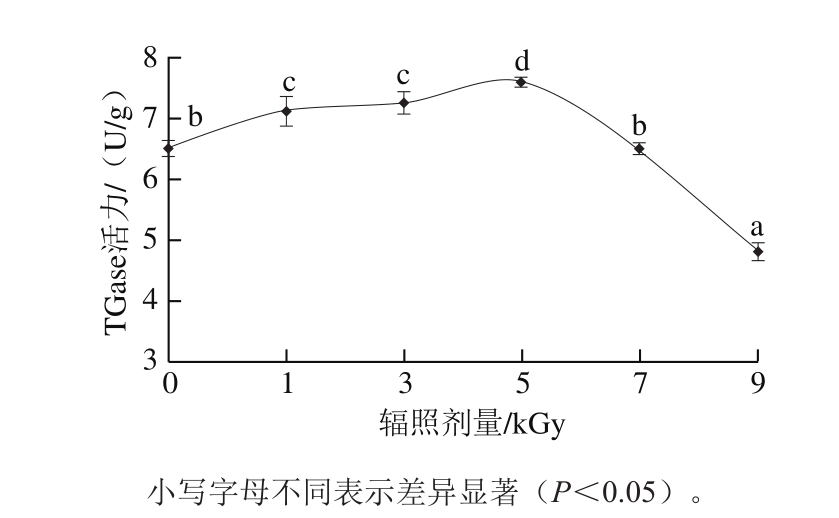
图1 电子束辐照对TGase活力的影响
Fig. 1 Effect of EB irradiation on the activity of TGase
TGase有促进蛋白形成凝胶网状结构、增强鱼糜凝胶的硬度和弹性等作用,较高的TGase活性有利于鱼糜凝胶的形成。由图1可知,随着辐照剂量的增加,鱼糜内源性TGase活力先上升后下降,5 kGy组鱼糜中的TGase活力最高,并显著高于对照组及其他剂量处理组(P<0.05),7 kGy和9 kGy组TGase活力低于对照组,尤其是9 kGy组TGase活力显著降低。罗华彬等[13]发现电子束辐照处理会降低带鱼鱼糜蛋白酶的活性,随着辐照剂量的增加,内源性蛋白酶活性降低,当剂量为5 kGy及以上时下降程度更为显著;顾可飞[12]发现当电子束辐照剂量为8.69 kGy时,液态多酚氧化酶的相对活力损失85%;赵菊鹏[19]发现不同剂量辐照桔小实蝇各龄幼虫后,均不同程度诱导了羧酸酯酶的活性升高;郑秀艳等[20]认为0.75~4.50 kGy辐照不会对脂肪氧化酶活性产生明显影响;戴群等[21]对茶叶分别进行4、7、10 kGy和12 kGy辐照,发现4 kGy组过氧化物酶活力及4 、7 kGy和10 kGy组多酚氧化酶活力均高于对照组。可见,辐照对酶活性的影响与剂量及酶的种类有关,不同酶对辐照的敏感性不一。本实验中,1、3 kGy和5 kGy剂量能激活TGase活性,其中5 kGy组效果最显著,但7 kGy和9 kGy剂量则抑制TGase活性。原因在于辐照有可能影响蛋白结构,也能改变鱼糜内源酶的空间构象。推测较低剂量辐照能促进TGase肽链的伸展,活性基团的适当暴露有利于酶催化肌原纤维蛋白中谷氨酰胺残基的γ-酰胺基与赖氨酸残基的ɛ-氨基发生交联,而随着辐照剂量的继续增加,TGase分子上暴露基团之间的相互作用增强,从而削弱了酶分子对底物的亲和能力,导致酶活力下降。
2.2 电子束辐照对带鱼鱼糜TGase最适反应温度和pH值的影响
由表1可知,9 kGy组鱼糜TGase的最适反应温度为45 ℃,其余组均为40 ℃。在55~75 ℃区间内,各组鱼糜TGase活力有所降低,而在85 ℃时TGase活力急剧下降。电子束辐照后鱼糜内源性TGase对温度的敏感性不同,25 ℃时对照组鱼糜TGase活力最大,35 ℃和40 ℃时,1、3、5 kGy组鱼糜TGase活力高于对照组,而在45 ℃条件下,对照组和5、7 kGy组鱼糜TGase活力基本接近,并高于其余组。
表1 电子束辐照对不同温度下TGase活力的影响
Table 1 Effect of EB irradiation on the activity of TGase at different temperatures U/g
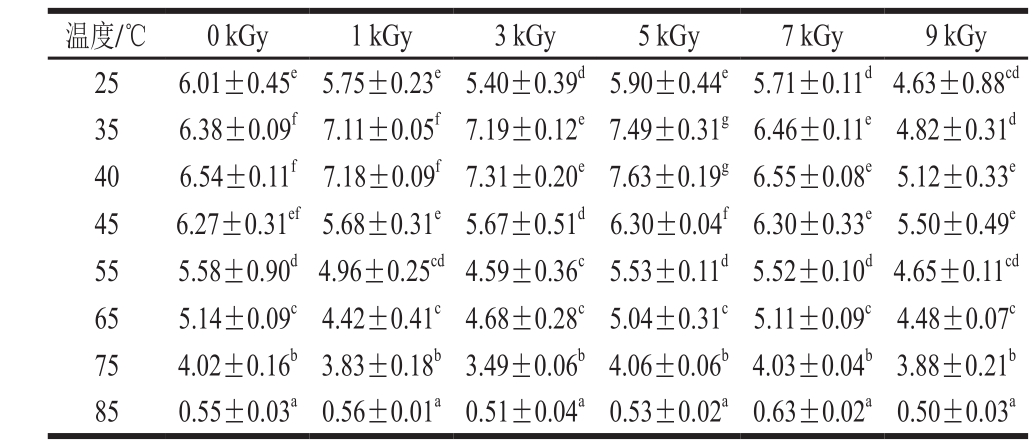
注:同列肩标小写字母不同表示差异显著(P<0.05)。表2、3同。
温度/℃ 0 kGy 1 kGy 3 kGy 5 kGy 7 kGy 9 kGy 25 6.01±0.45e5.75±0.23e5.40±0.39d5.90±0.44e5.71±0.11d4.63±0.88cd 35 6.38±0.09f7.11±0.05f7.19±0.12e7.49±0.31g6.46±0.11e4.82±0.31d 40 6.54±0.11f7.18±0.09f7.31±0.20e7.63±0.19g6.55±0.08e5.12±0.33e 45 6.27±0.31ef5.68±0.31e5.67±0.51d 6.30±0.04f 6.30±0.33e5.50±0.49e 55 5.58±0.90d4.96±0.25cd4.59±0.36c5.53±0.11d5.52±0.10d 4.65±0.11cd 65 5.14±0.09c4.42±0.41c4.68±0.28c5.04±0.31c5.11±0.09c4.48±0.07c 75 4.02±0.16b3.83±0.18b3.49±0.06b4.06±0.06b4.03±0.04b3.88±0.21b 85 0.55±0.03a0.56±0.01a0.51±0.04a0.53±0.02a0.63±0.02a0.50±0.03a
表2 电子束辐照对不同pH值下TGase活力的影响
Table 2 Effect of EB irradiation on the activity of TGase at different pH levels U/g
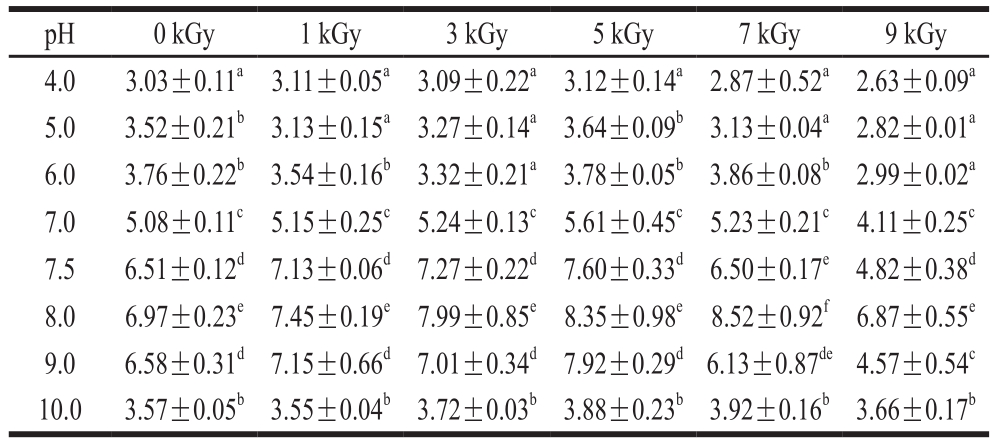
images/BZ_83_201_1507_1181_1554.png4.0 3.03±0.11a 3.11±0.05a 3.09±0.22a 3.12±0.14a 2.87±0.52a2.63±0.09a 5.0 3.52±0.21b 3.13±0.15a 3.27±0.14a 3.64±0.09b 3.13±0.04a 2.82±0.01a 6.0 3.76±0.22b 3.54±0.16b 3.32±0.21a3.78±0.05b 3.86±0.08b 2.99±0.02a 7.0 5.08±0.11c 5.15±0.25c5.24±0.13c 5.61±0.45c 5.23±0.21c 4.11±0.25c 7.5 6.51±0.12d 7.13±0.06d 7.27±0.22d7.60±0.33d 6.50±0.17e4.82±0.38d 8.0 6.97±0.23e 7.45±0.19e 7.99±0.85e 8.35±0.98e 8.52±0.92f 6.87±0.55e 9.0 6.58±0.31d 7.15±0.66d 7.01±0.34d7.92±0.29d6.13±0.87de4.57±0.54c 10.0 3.57±0.05b 3.55±0.04b 3.72±0.03b 3.88±0.23b 3.92±0.16b 3.66±0.17b
由表2可以得出,各组带鱼鱼糜内源性TGase的最适反应pH值在8.0左右,辐照处理没有改变TGase的最适反应pH值。鱼的种类及其生活的环境温度会影响鱼类内源性TGase的最适反应温度和最适反应pH值。Worratao等[22]从罗非鱼鱼肉中分离得到TGase,测定其最适反应温度为50 ℃,鳙鱼内源性TGase的最适反应温度约为40 ℃[23],罗非鱼和鳙鱼TGase的最适反应pH值均为7.0~7.5,而红金线鱼、长尾大眼鲷、真鲷鱼TGase的最适反应pH值分别为8.5~9.0、8.0、9.0~9.5[24-26]。本实验中带鱼鱼糜TGase的最适反应温度和pH值与其他鱼种也基本吻合。严菁[27]研究了TGase作用于鲢鱼鱼糜的最适反应温度,认为在37 ℃时TGase具有较高的活力;孙静静[28]在TGase对草鱼糜凝胶性的影响研究中认为,温度保持在42 ℃有利于提高TGase活力,形成品质更好的鱼糜凝胶。
和大多数酶一样,pH值会影响酶分子上基团的解离,影响酶和底物分子的结合;高温下酶和底物分子运动加快,碰撞机会增加,进而提高酶的催化活性,但高温同时会引起酶分子变性失活。经电子束辐照处理,各组鱼糜内源性TGase的活力随着pH值或温度的升高呈现先升高后下降趋势,并均在pH 8.0、温度40~45 ℃时活力达到最大,可见辐照处理影响鱼糜内源性TGase的活性,但并没有明显改变TGase的最适反应pH值和最适反应温度。在热诱导鱼糜凝胶形成的过程中,低温段采取40 ℃加热有利于辐照鱼糜内源性TGase发挥催化作用,促进鱼糜的凝胶化作用。
2.3 电子束辐照对带鱼鱼糜TGase二级结构的影响
2.3.1 傅里叶变换红外光谱分析结果

图2 TGase的傅里叶变换红外光谱图
Fig. 2 Fourier transform infrared spectra of TGase
红外光谱在多个波段对蛋白质分子中的化学基团具有特征吸收带,可以反映蛋白质的二级结构信息[29-31]。由图2可知,各组鱼糜TGase在红外区出现若干个特征吸收峰,其中1 051 cm-1左右处吸收峰代表分子中的C—O伸缩振动;1 515~1 570 cm-1为酰胺II带的特征吸收区域,由60%的N—H弯曲振动和40%的C—N伸缩振动引起;1 600~1 700 cm-1为酰胺I带的吸收峰,谱峰指认比较成熟,其对应关系分别为β-折叠(1 610~1 639 cm-1)、无规卷曲(1 640~1 650 cm-1)、α-螺旋(1 651~1 660 cm-1)、β-转角(1 661~1 670 cm-1),酰胺I带的吸收峰能较好地反映蛋白质的二级结构;3 300 cm-1左右为酰胺A带的吸收峰,波数的变化与酶分子中氢键的变化有关[32]。通常高温或辐照等处理会破坏分子内的氢键作用,影响蛋白质的二级结构单元,使得峰位迁移。
表3 TGase二级结构相对含量(傅里叶变换红外光谱)
Table 3 Secondary structure fractions of TGase (Fourier transform infrared spectroscopy)
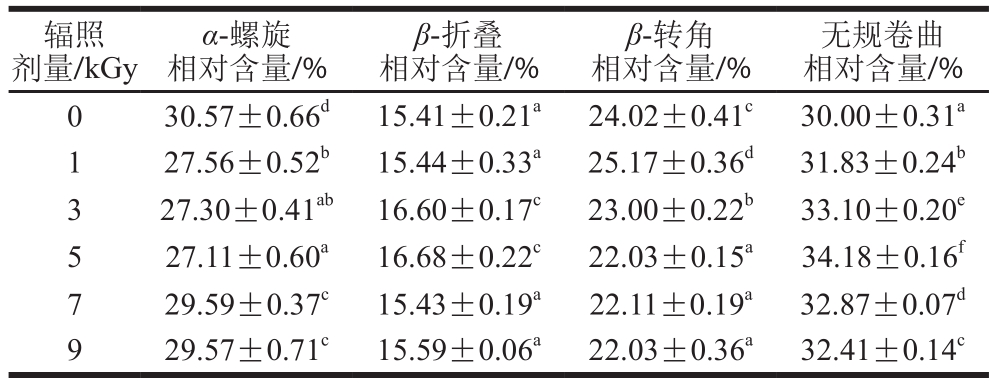
辐照剂量/kGy无规卷曲相对含量/%0 30.57±0.66d 15.41±0.21a 24.02±0.41c 30.00±0.31a 1 27.56±0.52b 15.44±0.33a 25.17±0.36d 31.83±0.24b 3 27.30±0.41ab 16.60±0.17c 23.00±0.22b 33.10±0.20e 5 27.11±0.60a 16.68±0.22c 22.03±0.15a 34.18±0.16f 7 29.59±0.37c 15.43±0.19a 22.11±0.19a 32.87±0.07d 9 29.57±0.71c 15.59±0.06a 22.03±0.36a 32.41±0.14c α-螺旋相对含量/%β-折叠相对含量/%β-转角相对含量/%
与对照组相比,辐照组鱼糜TGase在红外区的特征吸收峰发生不同程度偏移,其中酰胺I带峰由高波数(1 654 cm-1)向低波数(1 649 cm-1)移动,可见电子束辐照改变了鱼糜TGase的空间结构,分子中的二级结构单元组成发生了变化。对酰胺I带进行高斯曲线拟合分析,根据积分面积计算TGase二级结构的相对含量,结果见表3。TGase中α-螺旋和无规卷曲相对含量最高,β-折叠相对含量最低。结合图2,辐照组鱼糜TGase酰胺I带峰由高波数向低波数移动,分子中部分α-螺旋转变为无规卷曲、β-折叠等结构,尤其在5 kGy组最为明显,这与表3中5 kGy组α-螺旋相对含量达最低值(27.11%),无规卷曲相对含量达最大值(34.18%)相一致。
2.3.2 圆二色光谱分析结果

图3 TGase的圆二色光谱图
Fig. 3 Circular dichroism spectra of TGase at different irradiation doses
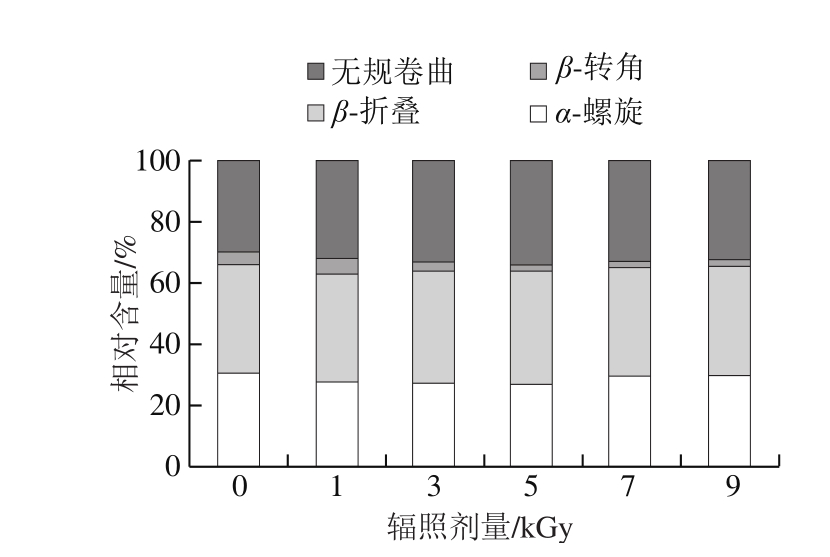
图4 TGase的二级结构相对含量(圆二色光谱)
Fig. 4 Secondary structure fractions of TGase determined by circular dichroism spectroscopy
不同剂量辐照带鱼鱼糜TGase的圆二色光谱结果见图3,各二级结构的相对含量见图4。圆二色光谱与傅里叶变换红外光谱所表征的TGase二级结构相对含量的变化趋势一致,具体数值的差异可能是由于计算方法存在差别。由图4可知,辐照剂量低于5 kGy时,随着辐照剂量的增加TGase中α-螺旋相对含量减少,β-折叠和无规卷曲相对含量增加,超过5 kGy则相反。至5 kGy时TGase二级结构中α-螺旋相对含量达最小值,而β-折叠及无规卷曲相对含量达最大值。说明低于5 kGy辐照剂量可以促使α-螺旋转化为β-折叠和无规卷曲。
结合辐照处理对TGase活力的影响,推测辐照导致酶蛋白结构的变化,在一定剂量下,α-螺旋中规则有序的氢键稳定性遭到破坏,展开的多肽链暴露出更多的基团,在分子重新聚集时部分形成β-折叠,部分转变为无规卷曲,而这种变化有利于酶活性基团的暴露并进一步和底物结合。Cao Hongwei等[33]将TGase添加到鱼糜中,发现微波加热20 min时TGase活力及鱼糜凝胶强度最大,并认为TGase活性的增加与其α-螺旋含量下降有关;顾可飞[12]发现当辐照剂量超过4.83 kGy时,随着电子束辐照剂量的增加,多酚氧化酶α-螺旋、β-折叠和β-转角含量不断下降,而无规卷曲含量上升;Herrero等[29]用8 kGy电子束辐射鲑鱼肉,发现鱼肉蛋白的α-螺旋比例显著下降,而β-折叠、β-转角和无规卷曲比例增多;Lee等[34]在分析γ射线对肌红蛋白结构的影响时,也发现随剂量的升高,肌红蛋白α-螺旋含量降低,无规卷曲含量升高。可见,辐照对大多数蛋白来说,会破坏其有序的构象单元,增加无规卷曲的含量。
2.4 电子束辐照对带鱼鱼糜凝胶强度和保水性的影响

图5 电子束辐照对带鱼鱼糜凝胶强度和保水性的影响
Fig. 5 Effect of EB irradiation on gel strength and water-holding capacity of surimi gel
如图5所示,辐照后鱼糜凝胶强度和保水性均显著高于对照组(P<0.05),并在5 kGy处理组达到最大值,分别为875 g·cm和94.30%,显著高于对照组(380 g·cm和82.00%),这与5 kGy剂量处理能显著提升带鱼鱼糜TGase活性相一致。电子束辐照会对带鱼鱼糜内源性TGase产生影响,提升或降低鱼糜凝胶强度,同时辐照也会引起鱼糜肌原纤维蛋白、其他内源性酶发生变化,从而影响鱼糜凝胶的形成。本实验室在辐照对鱼糜凝胶特性的研究中,也发现适宜剂量(5~7 kGy)的辐照处理会改变鱼糜蛋白分子的交联度,使其凝胶网状结构更加紧密,同时也能通过抑制鱼糜内源性肌原纤维结合型丝氨酸蛋白酶和组织蛋白酶L的活性,减轻对肌原纤维蛋白的降解作用,从而起到防止凝胶劣化、增强其凝胶强度和保水性的作用[9,13,17]。电子束辐照对鱼糜凝胶强度和保水性等宏观凝胶特性的影响,是鱼糜中肌原纤维蛋白、内源性酶等微观分子结构变化的综合结果。
3 结 论
电子束辐照处理对带鱼鱼糜内源性TGase的酶学特性产生影响,随着辐照剂量由1 kGy增加到9 kGy,TGase活力呈现先上升后降低,5 kGy剂量处理能显著提升鱼糜TGase活性,辐照不影响TGase的最适反应pH值,除9 kGy处理组外,各组鱼糜TGase的最适反应温度均为40 ℃。为形成更好的鱼糜凝胶,通常采用二段式加热,低温段温度设置为40 ℃有利于TGase发挥最适作用;辐照引起鱼糜TGase分子中的二级结构单元转变,导致其构象变化,适宜剂量电子束辐照能使TGase酶蛋白分子中结构相对紧密的α-螺旋和β-转角结构转化为较松散的β-折叠及无规卷曲,有利于TGase活性基团的暴露,有效提高鱼糜TGase活性,促进带鱼鱼糜凝胶的形成。
[1] YIN T, PARK J W. Optimum processing conditions for slowly heated surimi seafood using protease-laden Pacific whiting surimi[J]. LWTFood Science and Technology, 2015, 63(1): 490-496. DOI:10.1016/j.lwt.2015.02.033.
[2] AN H, PETERS M Y, SEYMOUR T A. Roles of endogenous enzymes in surimi gelation[J]. Trends in Food Science & Technology, 1996,7(10): 321-327. DOI:10.1016/0924-2244(96)10035-2.
[3] PAKER I, MATAK K E. Impact of sarcoplasmic proteins on texture and color of silver carp and Alaska pollock protein gels[J]. LWTFood Science and Technology, 2015, 63(2): 985-991. DOI:10.1016/j.lwt.2015.04.045.
[4] CHANARAT S, BENJAKUL S, H-KITTIKUN A. Comparative study on protein cross-linking and gel enhancing effect of microbial transglutaminase on surimi from different fish[J]. Journal of the Science of Food and Agriculture, 2012, 92(4): 844-852. DOI:10.1002/jsfa.4656.
[5] TSUKAMASA Y, SATO K, SHIMIZU Y, et al. ε-(γ-Glutamyl)lysine crosslink formation in sardine myofibril sol during setting at 25 ℃[J].Journal of Food Science, 1993, 58(4): 785-787. DOI:10.1111/j.1365-2621.1993.tb09358.x.
[6] BENJAKUL S, VISESSANGUAN W. Transglutaminase-mediated setting in bigeye snapper surimi[J]. Food Research International, 2003,36(3): 253-266. DOI:10.1016/S0963-9969(02)00167-9.
[7] BENJAKUL S, VISESSANGUAN W, PECHARAT S. Suwari gel properties as affected by transglutaminase activator and inhibitors[J]. Food Chemistry, 2004, 85(1): 91-99. DOI:10.1016/j.foodchem.2003.06.007.
[8] GUAN Aiyan, MEI Kalin, LÜ Mingchun, et al. The effect of electron beam irradiation on IgG binding capacity and conformation of tropomyosin in shrimp[J]. Food Chemistry, 2018, 264: 250-254.DOI:10.1016/j.foodchem.2018.05.051.
[9] LIN Xianping, YANG Wenge, XU Dalun, et al. Effect of electron irradiation and heat on the structure of hairtail surimi[J].Radiation Physics and Chemistry, 2015, 114: 50-54. DOI:10.1016/j.radphyschem.2015.05.028.
[10] DENG Siyao, LÜ Liangyu, YANG Wenge, et al. Effect of electron irradiation on the gel properties of Collichthy slucidus surimi[J].Radiation Physics and Chemistry, 2017, 130: 316-320. DOI:10.1016/j.radphyschem.2016.08.022.
[11] MALIK M A, SHARMA H K, SAINI C S. Effect of gamma irradiation on structural, molecular, thermal and rheological properties of sunflower protein isolate[J]. Food Hydrocolloids, 2017, 72: 312-322.DOI:10.1016/j.foodhyd.2017.06.011.
[12] 顾可飞. 电子束辐照对多酚氧化酶活性及结构的影响[J]. 辐射研究与辐射工艺学报, 2017, 35(3): 48-53. DOI:10.11889/j.1000-3436.2017.rrj.35.030401.
[13] 罗华彬, 林露, 高星, 等. 电子束辐照对带鱼鱼糜内源性蛋白酶活性及其构象单元的影响[J]. 食品科学, 2019, 40(9): 23-28.DOI:10.7506/spkx1002-6630-20180405-057.
[14] 孙京新, 徐幸莲, 汤晓艳, 等. 转谷氨酰胺酶制剂对带鱼鱼糜制品质构特性的影响[J]. 中国食品学报, 2004, 4(1): 35-38.
[15] 杨方, 夏文水. 鱼肉内源酶对发酵鱼糜凝胶特性的影响[J]. 食品与发酵工业, 2015, 41(11): 18-22. DOI:10.13995/j.cnki.11-1802/ts.201511004.
[16] TAKAGI J, SAITO Y, KIKUCHI T, et al. Modification of transglutaminase assay: use of ammonium sulfate to stop the reaction[J]. Analytical Biochemistry, 1986, 153(2): 295-298. DOI:10.1016/0003-2697(86)90095-3.
[17] 邓思瑶, 杨文鸽, 徐大伦, 等. 电子束辐照对梅鱼鱼糜肌原纤维蛋白结构及凝胶特性的影响[J]. 现代食品科技, 2017, 33(1): 139-144;172. DOI:10.7506/spkx1002-6630-201618037.
[18] SÁNCHEZ-GONZÁLEZ I, CARMONA P, MORENO P, et al. Protein and water structural changes in fi sh surimi during gelation as revealed by isotopic H/D exchange and Raman pectroscopy[J]. Food Chemistry,2008, 106(1): 56-64. DOI:10.1016/j.foodchem.2007.05.067.
[19] 赵菊鹏. 辐照对桔小实蝇检疫除害及酶活性影响的研究[D]. 广州:华南农业大学, 2011: 2. DOI:10.7666/d.Y2014958.
[20] 郑秀艳, 孟繁博, 林茂, 等. 60Co-γ辐照对花生杀菌效果及其品质的影响[J]. 现代食品科技, 2018, 34(1): 91-96; 67. DOI:10.13982/j.mfst.1673-9078.2018.1.015.
[21] 戴群, 张永旗. 辐照对茶叶中茶多酚、过氧化物酶、多酚氧化酶含量及活性的影响[J]. 江苏教育学院学报(自然科学版), 2007, 24(4): 41-43.
[22] WORRATAO A, YONGSAWATDIGUL J. Cross-linking of actomyosin by crude tilapia (Oreochromis niloticus) transglutaminase[J]. Journal of Food Biochemistry, 2007, 27(1): 35-51. DOI:10.1111/j.1745-4514.2003.tb00265.x.
[23] 娄忠纬. 鳙鱼中转谷氨酰胺酶性质的研究及其对鱼糜凝胶化的影响[D]. 杭州: 浙江工商大学, 2015: 25. DOI:10.7666/d.Y2750803.
[24] HEMUNG B O, YONGSAWATDIGUL J. Partial purification and characterization of transglutaminase from threadfin bream (Nemipterus sp.)liver[J]. Journal of Food Biochemistry, 2008, 32(2): 182-200.DOI:10.1111/j.1745-4514.2008.00154.x.
[25] NOZAWA H, MAMEGOSHI S, SEKI N. Partial purification and characterization of six transglutaminase from ordinary muscles of various fi shes and marine inverterbrates[J]. Comparative Biochemistry and Physiology B, 1997, 118(2): 313-317. DOI:10.1016/S0305-0491(97)00062-X.
[26] YASUEDA H, KUMAZAWA Y, MOTOKI M. Purification and characterization of a tissue-type transglutaminase from red sea bream(Pagrus major)[J]. Bioscience, Biotechnology, and Biochemistry,1994, 58(11): 2041-2045. DOI:10.1271/bbb.58.2041.
[27] 严菁. 转谷氨酰胺酶对淡水鱼糜凝胶特性的影响[D]. 武汉: 华中农业大学, 2003: 20. DOI:10.7666/d.Y547802.
[28] 孙静静. 转谷氨酰胺酶对草鱼糜凝胶性的影响[D]. 杭州: 浙江大学,2012: 43.
[29] HERRERO A M, CARMONA P, ORDONEZ J A, et al. Raman spectroscopic study of electron-beam irradiated cold-smoked salmon[J]. Food Research International, 2009, 42(1): 216-220.DOI:10.1016/j.foodres.2008.10.010.
[30] OKUNO A, KATO M, TANIGUCHI Y. The secondary structure of pressure- and temperature-induced aggregates of equine serum albumin studied by FT-IR spectroscopy[J]. Biochimica et Biophysica Acta-Proteins and Proteomics, 2006, 1764(8): 1407-1412. DOI:10.1016/j.bbapap.2006.06.006.
[31] DOGAN A, SIYAKUS G, SEVERCAN F. FTIR spectroscopic characterization of irradiated hazelnut (Corylus avellana L.)[J].Food Chemistry, 2007, 100(3): 1106-1114. DOI:10.1016/j.foodchem.2005.11.017.
[32] 张秋会, 黄现青, 李苗云, 等. 傅里叶红外光谱法研究肌肉蛋白质的二级结构[J]. 食品与发酵工业, 2015, 41(10): 247-251.DOI:10.13995/j.cnki.11-1802/ts.201510045.
[33] CAO Hongwei, FAN Daming, JIAO Xidong, et al. Intervention of transglutaminase in surimi gel under microwave irradiation[J]. Food Chemistry, 2018, 268: 378-385. DOI:10.1016/j.foodchem.2018.06.067.
[34] LEE Y, SONG K B. Effect of gamma-irradiation on the molecular properties of myoglobin[J]. Journal of Biochemistry & Molecular Biology, 2002, 35(6): 590-594. DOI:10.5483/BMBRep.2002.35.6.590.