猪肉是我国肉类消费的主体,热鲜猪肉或冷鲜猪肉在-18 ℃以下冻结保存是目前应用广泛、效果较好且成本较低的一种猪肉贮藏方法[1],但目前我国冷冻肉存在汁液流失严重、色泽裂变等质量问题,严重影响了我国肉品产业的发展[2]。目前,肉品冻结方式主要包括空气冻结、直接接触冻结、间接接触冻结,新兴冻结方式有均温冻结、被膜包裹冻结以及高压冷冻冻结等,其中,空气冻结采用空气作介质,经济实用,应用最为广泛[3]。目前也有以液体为介质的冷冻方式,属于浸渍式冻结方法,就是将食品浸渍在低温液体环境中快速降至冰点后均匀降温,保持食品原有品质,如今大多应用在大型食品如冷冻鱼和火腿等的保存,很少应用在猪肉冷冻保存上[4]。
肉的保水性指的是肉的持水能力,是衡量冷冻肉品质的最重要指标之一[5]。目前在探究肉的保水性影响机理方面,主要有以下几种研究观点:一是通过蛋白质分子的静电荷效应影响,表现在肉品pH值的升高和降低[6];二是蛋白质降解的影响,主要可以用肌浆蛋白和肌原纤维蛋白的降解解释[7-9];三是肌肉组织空间结构变化的影响,表现在纤维网络空间的变化、肌节的长度变化以及水分组成分布的变化等[10-12]。
本实验以猪肉为研究对象,分别对样品进行液浸冷冻处理和空气冻结处理,研究比较了两种冷冻处理对冻结样品保水性的影响,并通过比较样品的pH值、水分组成、蛋白质降解和组织结构的观察结果等,探究了不同冻结方式对冻结样品保水性的影响机制,旨在为优化工业上猪肉冷冻处理工艺提供技术支撑。
1 材料与方法
1.1 材料与试剂
选取常规屠宰工艺屠宰后的猪胴体(北京三元猪),屠宰后在1 h内从胴体上分割出背最长肌(北京中瑞食品有限公司)作为实验材料。样品质量为(400±1)g,尺寸约为16 cm×8 cm×4.5 cm。
冷冻液体 南京中丰益农业科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
SSN-11E USB专业型温度记录仪 深圳宇问加壹传感系统有限公司;液体制冷设备 南京中丰益生物技术有限公司;ME电子天平、Seven2Go-单通道便携式pH计梅特勒-托利多仪器(上海)有限公司;电子恒温水浴锅 北京中兴伟业仪器有限公司;321LS系列电子天平 普利赛斯称重设备有限公司;MINI MR-60核磁共振成像仪 上海纽迈电子科技有限公司;均质器株式会社日本精机制作所;漩涡混合器 金坛市白塔新宝仪器厂;SU8020透射电子显微镜 日本电子株式会社;Axio Examiner光学显微镜 蔡司(中国)有限公司;NanoDrop 8000分光光度计 赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 原料处理
将背最长肌随机分成3 组,进行不同方式的处理。第1组(冷鲜):0~4 ℃冷却成熟24 h,后放置在4 ℃环境下冷藏贮存;第2组(空气冷冻):0~4℃冷却成熟24 h后,放置在(-20±2)℃低温库中冻结,当中心温度达到(-20±2)℃时,放置在-20 ℃冰箱中贮藏;第3组(液浸冷冻):将样品直接浸渍在(-20±2)℃的液体中冷却冻结,当中心温度达到(-20±2)℃时,放置在-20 ℃冰箱中贮藏。
第2、3组分别在贮藏时间为3 d和3 个月时,进行指标测定;其中第1组样品仅测定贮藏3 d的相关指标,作为另两组样品的对照组。
1.3.2 冻结过程中的中心温度测定
将专业型温度记录仪插入肉块中心位置后,进行真空包装,打开温度记录仪记录肉块冻结过程中温度的变化情况。
1.3.3 冻结损失率和解冻汁液流失率的测定
取两组冻结处理组样品,分别在冻结前(m1/g)、解冻前(m2/g)和解冻后(m3/g)称质量,按照公式(1)、(2)分别计算解冻汁液流失率和冻结损失率。
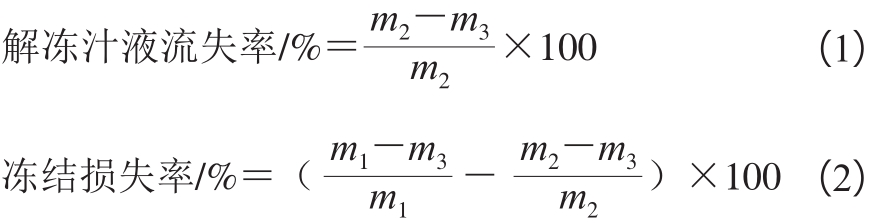
1.3.4 蒸煮损失率的测定
取一定大小的两组解冻后肉样和冷鲜肉样,按照NY/T 2793—2015《肉的食用品质客观评价方法》[13]进行蒸煮损失率的测定,按照公式(3)计算蒸煮损失率。
式中:m4、m5分别表示猪肉蒸煮前和蒸煮后的质量/g。
1.3.5 pH值测定
pH值采用经过校正的便携式pH计进行测定。用锥子插入肉中形成测试孔,并将pH计的电极直接插入孔中,直接读数。
1.3.6 水分分布测定
低场核磁共振技术是通过检测肉品中氢原子核在磁场中的弛豫特性得到肉品中水分分布的信息,是目前国际上用于研究肌肉水分分布及确定水分组分的最有效手段之一[14]。本研究低场核磁共振横向弛豫时间T2通过核磁共振成像分析仪进行测定。选择肉中氢质子共振频率为22.3 MHz,测量温度为30 ℃,选择硬脉冲CPMG序列(Carr-Purcell-Meiboom-Gill sequence),设置参数为:90°脉冲和180°脉冲之间的时间是200 μs,重复采样4 次,重复间隔时间是1 800 ms,模拟增益为20。测量时将大小为5 cm×10 cm×5 cm的冻结样品放置在样品槽中,每个测试至少3 个重复。为避免肉样水分蒸发,在20 min内完成样品的制备和测定。得到CPMG指数衰减曲线后,应用核磁共振弛豫时间反演拟合软件Ver4.09进行反演,使用综合迭代法算法,得到T2的相关数据。
1.3.7 蛋白的提取及测定
依据Liu Gang等[15]的方法提取蛋白,并进行些许调整。称取不同处理的冻结样品各5 g,加入15 mL低离子浓度磷酸缓冲液(含0.1 mol/L NaCl、5 mmol/L EDTA,pH 7.4),用预冷的均质器以8 000×g转速进行均质,之后4 ℃、12 000×g离心5 min,取其上清液即为肌浆蛋白溶液。取上述沉淀用低离子浓度的磷酸缓冲液冲洗3 次,冲洗方法为:加入25 mL缓冲液,漩涡振荡混匀,再12 000×g离心5 min。冲洗后取沉淀2 g,加入18 mL高离子浓度磷酸缓冲液(含20 mmol/L磷酸缓冲液、0.6 mol/L NaCl、5 mmol/L EDTA、4 mmol/L MgCl2,pH 7.4),漩涡振荡混匀,在4 ℃环境下过夜。次日于4 ℃下以15 000×g离心5 min,取上清液即为肌原纤维蛋白。
以分子质量范围为6.5~245 kDa的宽分子质量标准蛋白作为对照,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析肉样中肌浆蛋白、肌原纤维蛋白的降解情况,分离胶质量分数为12%,浓缩胶质量分数为5%,5 倍上样缓冲液与蛋白样品体积比1∶1,采用NanoDrop分光光度计测定提取到的肌浆蛋白和肌原纤维蛋白的蛋白质量浓度,上样时将肌浆蛋白质量浓度调至10 mg/mL,上样体积为10 μL,将肌纤维蛋白质量浓度均调至5 mg/mL,上样体积为20 μL。电泳测定时浓缩胶电压90 V,分离胶电压110 V,用考马斯亮蓝G250染色20 min后脱色,直至无色,即可得到清晰的蛋白质条带。
1.3.8 组织结构观察
分别采用扫描电子显微镜和光学显微镜对不同贮藏时间的两组冻结样品中心部位的组织结构进行观察比较,具体参考余小领等[5]的方法。
1.4 数据处理与分析
运用SPSS 20软件对测定数据进行显著性分析,分析方法为Kruskal-Wallis H检验,应用MATLAB 2014b和Origin 9.0软件作图。
2 结果与分析
2.1 不同冻结方式对猪肉冻结时间的影响
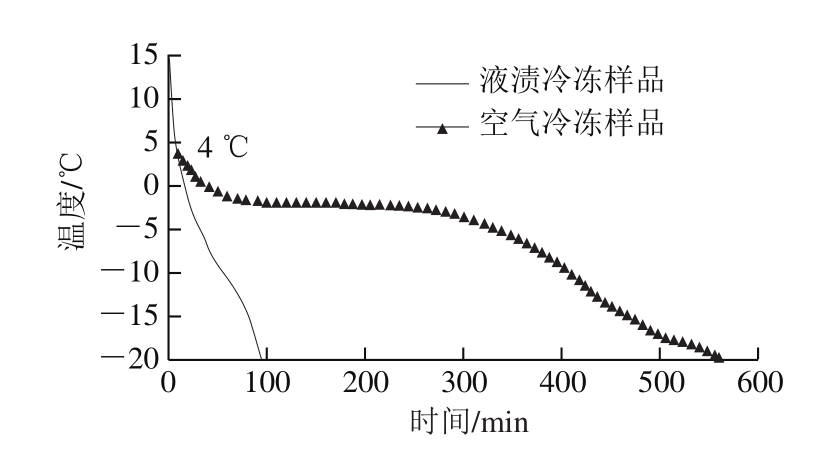
图1 不同冻结方式猪肉冻结过程中的温度变化
Fig. 1 Change in internal temperature of pork during freezing process
空气冷冻样品初始温度为4 ℃,是因为该样品是先冷却成熟后再冷冻处理的,液浸冷冻样品初始温度为15 ℃,二者在冻结过程中的温度变化如图1所示。液浸冷冻样品冻结时间为93 min,从4 ℃降至-20 ℃的时间为86 min;空气冷冻样品从4 ℃降至-20 ℃的时间为551 min,前者冻结速率明显高于后者。在温度为-1~-5 ℃之间,肉样内部的水分逐渐冻结成为冰晶,空气冷冻样品降温持续时间较长,说明形成的最大冰晶带更大[16]。
2.2 不同冻结方式对猪肉保水性的影响
表1 不同冻结方式对猪肉保水性的影响
Table 1 Comparison of water-holding capacity of frozen meat subjected to different freezing methods

注:同行肩标小写字母不同表示差异显著(P<0.05)。表2同。
指标 3 d 3 个月冷鲜猪肉 空气冷冻 液浸冷冻 空气冷冻 液浸冷冻解冻汁液流失率/% 0.71±0.25a 0.42±0.16b 0.80±0.51a 0.71±0.44a冻结损失率/% 1.77±0.98b 0.43±0.19d 4.10±0.89a 1.54±0.64c蒸煮损失率/% 22.28±2.38a 24.94±2.78a 23.63±3.95a 20.90±3.09a 18.76±2.63a
如表1所示,在贮藏3 d时,液浸冷冻处理组猪肉解冻汁液流失率显著低于空气冷冻处理组(P<0.05),而贮藏3 个月时,液浸冷冻处理组样品的解冻汁液流失率低于空气冷冻处理组,但无显著性差异(P>0.05),但在贮藏3 d和3 个月时,空气冷冻处理组猪肉冻结损失率均显著高于液浸冷冻处理组(P<0.05),表明在冷冻贮藏过程中液浸冷冻方式处理的冻结样品升华损失的水分较少,而解冻过程中液浸冷冻处理组样品液化损失的水分相对较少。在贮藏3 d和3 个月时,液浸冷冻处理组猪肉蒸煮损失率均小于空气冷冻处理组猪肉,但均未达到显著水平(P>0.05)。指标整体结果表明,冷冻贮藏期间,液浸冷冻处理方式的冻结样品在保水性上优于空气冷冻处理的冻结样品。
2.3 不同冻结方式对猪肉pH值的影响
pH值是影响肉中酶活性、蛋白质变性以及嫩度的主要因素之一[17]。从图2可以看出,贮藏3 d时,3 种处理方式的样品pH值无显著性差异,但在贮藏3 个月时,液浸冷冻处理组样品pH值显著高于空气冷冻处理组(P<0.05)。且液浸处理组pH值一直高于冷却成熟结束后的冷鲜肉贮藏的初始值,而空气冷冻处理样品在贮藏3 个月时低于其初始值。另一方面,液浸冷冻样品在两个时间点的pH值无显著性差异(P>0.05),而空气冷冻样品随着贮藏时间的延长,pH值显著降低(P<0.05)。按照pH值对肉的保水性影响机制,肌肉成熟的过程中产生乳酸,引起pH值下降,当pH值达到主要蛋白质的等电点(肌球蛋白等电点为5.4)时,蛋白质相互吸引降低了对水分的吸引,使得肌原纤维之间距离缩小,还会导致肌原纤维的网络结构发生收缩,引起保水性下降[18];因此液浸冷冻样品pH值在贮藏过程中无显著变化是使得其具有较好保水性的影响因素之一。
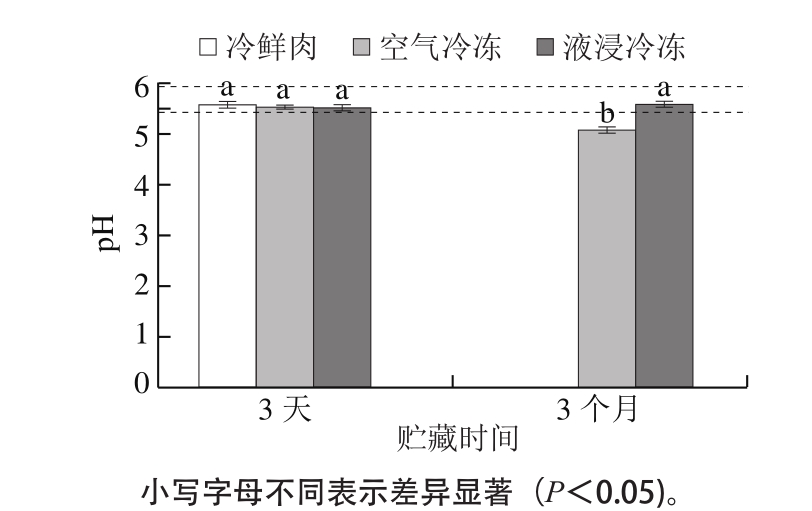
图2 不同冻结方式肉样的pH值变化
Fig. 2 Comparison of pH of frozen pork subjected to different
freezing methods
2.4 不同冻结方式对猪肉水分分布的影响
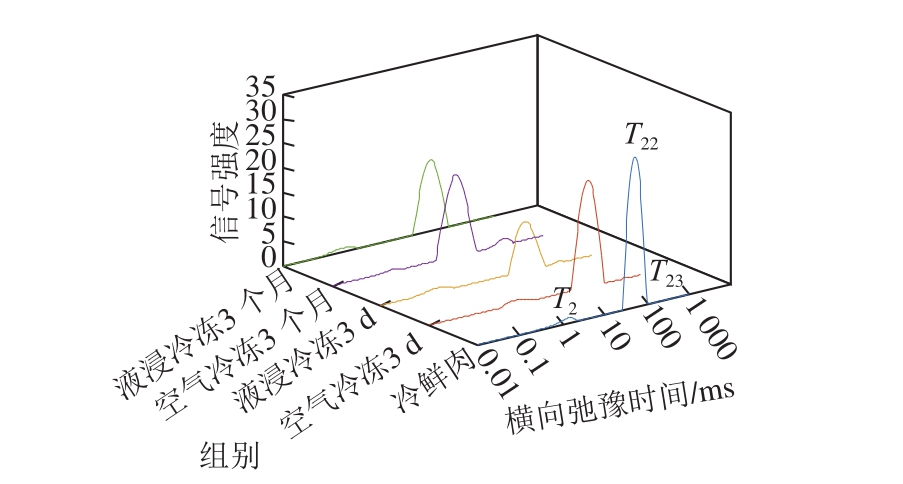
图3 不同冻结方式肉样横向弛豫时间分布图
Fig. 3 Distribution of transverse relaxation time T2 in meat samples subjected to different methods
弛豫时间是描述弛豫过程的时间常数,肉与肉制品中水分的横向弛豫时间T2呈多指数衰减[19],可以反映样品中水分子的自由度,能区分出不同状态水的分布情况和自由移动程度[20],分别为与大分子相互作用的水(结合水,T21)、肌原纤维和网状组织中的水(不易流动水,T22)以及细胞外水(自由水,T23)[21-22]。不同T2区间的积分面积占总积分面积的比例表示各个区间氢质子的相对含量[23]。图3所示为各组样品的T2谱图,均有3 个峰,分别代表T21(0~10 ms)、T22(10~100 ms)和T23(100~1 000 ms),所有样品的T22峰比例最高,表明样品中水分大多以不易流动水形式存在。具体的峰顶点时间、峰面积和峰比例见表2。
表2 不同冻结方式肉样的横向弛豫时间比较
Table 2 Comparison of T2parameters in different frozen pork samples

注:同行肩标大写字母不同表示差异极显著(P<0.01)。
指标 3 d 3 个月冷鲜肉 空气冷冻 液浸冷冻 空气冷冻 液浸冷冻T21峰顶点时间/ms 0.850±0.010 1.050±0.020 0.230±0.020 0.280±0.010 0.240±0.010 T21峰面积 15.163±0.263bA 13.833±0.137cA 16.457±0.207aA 4.633±0.273dB 15.547±0.257bA T21峰比例 0.040±0.002bB 0.039±0.002bB 0.080±0.004aA 0.010±0.002cC 0.060±0.003aA T22峰顶点时间/ms 51.537±1.133 54.947±1.963 25.737±1.583 15.390±0.251 29.357±0.223 T22峰面积 390.203±13.993aA361.630±12.140aA181.620±8.470dC327.153±13.047bA253.417±11.817cB T22峰比例 0.960±0.003a 0.959±0.004a 0.901±0.010b 0.950±0.008a 0.943±0.003b T23峰顶点时间/ms 714.703±12.343 441.890±14.460 166.180±6.770 118.040±8.631 285.313±13.623 T23峰面积 0.221±0.002eE 0.720±0.002dD 2.860±0.003bB 13.695±0.009aA 1.060±0.003cC T23峰比例 0.001 0±0.000 1eE0.002 0±0.000 2dD0.010 0±0.002 0bB0.040 0±0.002 0aA0.004 0±0.000 1cC
由表2可知,不同冻结处理方式对3 种状态水的分布均有不同程度的影响。在贮藏时间为3 d时,与冷鲜肉相比,液浸冷冻处理样品T21峰面积显著增加(P<0.05),峰比例极显著增加(P<0.01),T22的峰面积极显著降低(P<0.01),T22峰比例显著降低(P<0.05),T23的峰面积和峰比例均极显著增加(P<0.01);空气冷冻处理样品的T21峰面积显著降低(P<0.05),T21峰比例无显著性变化(P>0.05),T22的峰面积和峰比例均无显著性变化(P>0.05),T23的峰面积和峰比例则均极显著增加(P<0.01)。由此来看,贮藏时间为3 d时,与冷鲜肉相比,液浸冷冻样品结合水含量和自由水含量均显著增加,不易流动水含量显著降低;空气冷冻样品结合水含量显著降低,但结合水相对含量无显著变化,且有降低的趋势,不易流动水含量和相对含量无显著变化,但有降低的趋势,自由水含量和相对含量均极显著增加。
随着贮藏时间的延长,不同冻结处理方式样品的3 种状态水分布也有显著性差异。虽然贮藏3 个月样品与冷鲜肉相比,变化趋势与贮藏时间3 d相同,但贮藏时间3 个月与贮藏时间3 d的样品相比,液浸冷冻样品T21峰面积显著降低(P<0.05),其峰比例无显著变化(P>0.05),T22峰面积极显著增加(P<0.01),其峰比例无显著变化(P>0.05),T23峰面积和峰比例均极显著降低(P<0.01);空气冷冻样品T21峰面积和峰比例极显著降低(P<0.01),T22峰面积显著降低(P<0.05),其峰比例无显著变化(P>0.05),T23峰面积和峰比例极显著增加(P<0.01)。由此来看,随着贮藏时间的延长,液浸冷冻样品自由水含量及相对含量均极显著降低,结合水含量显著降低,相对含量无显著变化,但有降低的趋势;不易流动水含量显著升高,相对含量无显著变化,但有升高的趋势。空气冷冻样品结合水含量及相对含量均极显著降低;不易流动水含量显著降低,相对含量无显著变化,但有降低的趋势;自由水含量和相对含量均极显著增加。
实验结果表明,在贮藏时间3 d和3 个月时,与冷鲜肉相比,液浸冷冻处理样品中的不易流动水向结合水和自由水移动,这可能是因为液浸冷冻样品未经过冷却成熟,自身的结合水含量更高,但经过冻结后,自由水含量高于冷鲜肉[24],而空气冷冻处理样品中的结合水和不易流动水向自由水移动,这可能是因为冻结后冰晶的生长破坏部分细胞,自由水含量增加[25];而在贮藏3 个月过程中,随着贮藏时间延长,液浸冷冻处理样品中的自由水和结合水向不易流动水移动,液浸冷冻具有较快的冷却速率,贮藏期间pH值无明显变化,根据Bertram等[26]的研究,不易流动水含量的增加可能是因为肉样内无氧引发的反应使得细胞内通透性增加引起肌丝空间增加,吸水能力增强,从而引起胞内水含量增加;而空气冷冻处理样品中的结合水和不易流动水向自由水移动,空气冷冻冷却速率较低,贮藏期间pH值逐渐降低,根据Bertram等[27]的研究,这可能是因为pH值的降低诱导了肌原纤维网状结构收缩而引起了物理变化,吸水能力减弱,且引起了蛋白质静电荷减少,使其水合作用减弱,导致结合水和不易流动水含量减少,自由水含量增加。而李春等[28]将冷却猪肉在相对湿度约80%、温度(2±1)℃的常规常湿环境中冷却24 h和朱迎春等[29]将牛背最长肌在2 ℃和-1.5 ℃环境中贮藏0~15 d,均发现不易流动水含量先增加后降低。因此,液浸冷冻和空气冷冻处理在相同的贮藏条件时,水分分布产生差异可能是因为液浸冷冻速率较高,蛋白质结构等变化较慢,处于组分变化前期阶段,因此不易流动水含量先升高,这也与pH值变化结果一致,后期可以延长贮藏时间进行比较。
2.5 不同冻结方式对猪肉蛋白质降解的影响
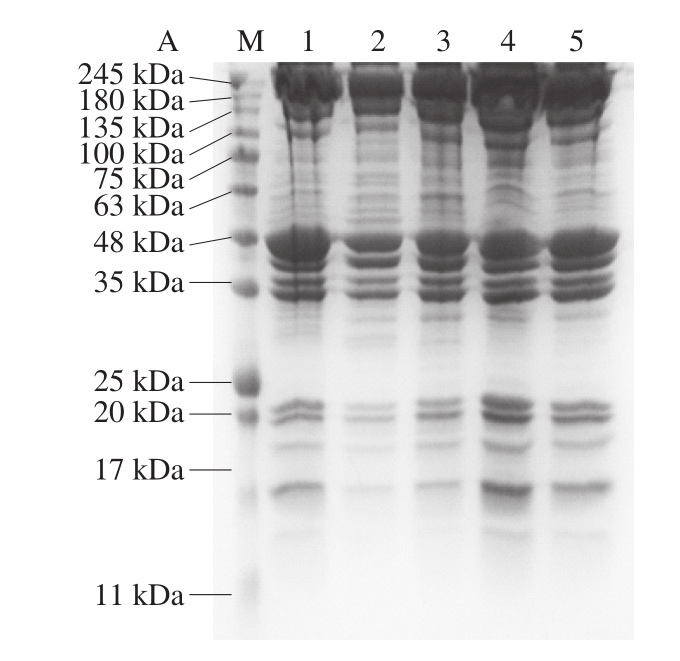

图4 不同冻结方式对猪肉蛋白质降解的影响
Fig. 4 Changes in protein degradation in frozen pork subjected to different freezing methods
如图4A、B所示,两组冷冻处理的样品与冷鲜肉样品相比,SDS-PAGE条带的数量与降解的蛋白分子质量均无明显变化,表明在3 个月内,两种冷冻方式有效地抑制了肌浆蛋白和肌原纤维蛋白的降解。Kristensen等[30]研究发现,冷鲜猪肉样品在贮藏第4天开始出现蛋白质的轻微降解,而在本研究中,在冷冻处理前样品中的蛋白质还未开始出现降解。即猪肉直接冻结时,两种冻结处理方式均未造成猪肉肌原纤维蛋白和肌浆蛋白的明显降解,说明冻结样品保水性的差别并不能通过肌原纤维蛋白和肌浆蛋白的降解进行解释。
2.6 不同冻结方式对猪肉组织结构的影响

图5 不同冻结方式及贮藏时间的样品扫描电子显微镜图
Fig. 5 Scanning electron micrographs of pork samples subjected to different freezing methods at different freezing storage times
通过扫描电子显微镜和光学显微镜观察猪肉纤维横截面,分别可以得到冰晶在肉中的分布状况和形态变化。从图5可以看出,与贮藏3 d的冷鲜肉相比,空气冷冻和液浸冷冻处理样品的肌束都不同程度变小,组织间有较为明显的间隔和空洞,是冰晶升华留下的空间[31],冰晶尺寸的增大会引起肌束的挤压从而导致两种冻结样品的保水性降低[32]。在贮藏3 d和3 个月时,液浸冻结样品的肌间空隙小于空气冻结样品,这是因为空气冷冻样品的肌纤维空隙中的水分相对液浸冷冻样品来说更多流向肌纤维外的空隙,从而空气冷冻样品水分损失更多,与保水性的结果是一致的。图6中的现象与图5大体相同且更为明显,均与2.2节测定的保水性相关的指标变化情况一致。

图6 不同冻结方式及贮藏时间的样品组织结构
Fig. 6 Microstructures of pork samples subjected to different freezing methods at different freezing storage times
3 结 论
在冻藏期间,液浸冷冻处理的猪肉保水性优于空气冷冻处理样品;不同冻结方式对猪肉pH值和水分迁移影响显著,液浸冷冻处理样品pH值在贮藏过程中无显著性变化,而空气冷冻处理样品的pH值显著降低,引起肌原纤维距离减小,这可能是引起冻结肉保水性降低的一个重要原因;液浸冷冻处理样品在贮藏过程中不易流动水向自由水和结合水迁移,而空气冷冻处理样品中不易流动水和结合水向自由水迁移,直接导致了冻结肉保水性的不同。冻藏3 个月内,不同冻结方式处理样品的肌原纤维蛋白和肌浆蛋白未出现明显降解,不能直接解释两种冻结样品的保水性不同。不同冻结方式处理对样品冰晶结构变化影响较大,液浸冻结样品的肌间空隙小于空气冻结样品,进一步解释了液浸冷冻处理样品保水性较好的原因。
综合指标分析,冻藏期间,液浸冷冻处理样品的保水性更好,与pH值、水分分布、组织结构等有直接关系,与肌原纤维蛋白和肌浆蛋白降解无直接关系。深入探讨更长贮藏时间的不同冻结处理样品的保水性相关指标以及影响指标的变化是进一步研究的方向。
[1] 王丹竹, 田科雄. 冷冻肉品质与时间和温度变化的关系[J]. 中国畜禽种业, 2012, 8(8): 24-26. DOI:10.3969/j.issn.1673-4556.2012.08.015.
[2] 余小领, 周光宏, 徐幸莲. 肉品冷冻工艺及冻结方法[J]. 食品工业科技, 2006(5): 199-202. DOI:10.3969/j.issn.1002-0306.2006.05.065.
[3] 田国庆. 食品冷加工工艺[M]. 北京: 机械工业出版社, 2003: 84-85.
[4] 余小领. 冷冻和解冻工艺对猪肉保水性和组织结构的影响研究[D].南京: 南京农业大学, 2007: 13-20.
[5] 余小领, 李学斌, 赵良, 等. 常规冷冻冻藏对猪肉保水性和组织结构的影响[J]. 农业工程学报, 2008, 24(12): 264-268. DOI:10.3321/j.issn:1002-6819.2008.12.054.
[6] 余小领, 白云, 李学斌, 等. 宰后不同时间冻结对猪肉保水性和组织结构的影响[J]. 食品与发酵工业, 2007, 33(3): 18-22. DOI:10.3321/j.issn:0253-990X.2007.03.006.
[7] 丁一, 黄莉, 夏秀芳, 等. 冻藏对肌原纤维蛋白结构特性与功能特性的影响[J]. 包装与食品机械, 2013, 31(4): 55-59. DOI:10.3969/j.issn.1005-1295.2013.04.015.
[8] MELODY J L, LONERGAN S M, ROWE L J, et al. Early postmortem biochemical factors influence tenderness and water-holding capacity of three porcine muscles[J]. Journal of Animal Science, 2004, 82(4):1195-1205. DOI:10.1093/ansci/82.4.1195.
[9] ZENG Z, LI C, ERTBJERG P. Relationship between proteolysis and water-holding of myofibrils[J]. Meat Science, 2017, 131: 48-55.DOI:10.1016/j.meatsci.2017.04.232.
[10] OFFER G, TRINICK J. On the mechanism of water holding in meat:the swelling and shrinking of myofibrils[J]. Meat Science, 1983, 8(4):245-281. DOI:10.1016/0309-1740(83)90013-x.
[11] TASONIERO G, BERTRAM H C, YOUNG J F, et al. Relationship between hardness and myowater properties in Wooden Breast affected chicken meat: a nuclear magnetic resonance study[J].LWT-Food Science and Technology, 2017, 86: 20-24. DOI:10.1016/j.lwt.2017.07.032.
[12] HINRICHS R, G Ö TZ J, WEISSER H. Water-holding capacity and structure of hydrocolloid-gels, WPC-gels and yogurts characterised by means of NMR[J]. Food Chemistry, 2003, 82(1): 155-160.DOI:10.1016/s0308-8146(02)00539-3.
[13] 农业部. 肉的食用品质客观评价方法: NY/T 2793—2015[S]. 北京:中国农业出版社, 2015: 4-6.
[14] 姜晓文, 韩剑众. 生鲜猪肉持水性的核磁共振研究[J]. 食品工业科技, 2009, 30(7): 128-130; 133.
[15] LIU Gang, XIONG Youling L.. Contribution of lipid and protein oxidation to rheological differences between chicken white and red muscle myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry, 1996, 44(3): 779-784. DOI:10.1021/jf9506242.
[16] 田雪. 肉类在冻结过程中的变化[J]. 肉类研究, 2003, 17(2): 22-38.DOI:10.3969/j.issn.1001-8123.2003.02.016.
[17] 张亚芬, 张晓辉. 肉品检验中pH值测定的意义[J]. 吉林农业,2014(3): 47. DOI:10.3969/j.issn.1674-0432.2014.03.074.
[18] OFFER G. Modelling of the formation of pale, soft and exudative meat: effects of chilling regime and rate and extent of glycolysis[J].Meat Science, 1991, 30(2): 157-184. DOI:10.1016/0309-1740(91)90005-b.
[19] BROWN R J S, CAPOZZI F, CAVANI C, et al. Relationships between 1H NMR relaxation data and some technological parameters of meat: a chemometric approach[J]. Journal of Magnetic Resonance,2000, 147(1): 89-94. DOI:10.1006/jmre.2000.2163.
[20] HAN M Y, ZHANG Y J, FEI Y, et al. Effect of microbial transglutaminase on 1NMR relaxometry and microstructure of pork myofibrillar protein gel[J]. European Food Research and Technology,2009, 228(4): 665-670. DOI:10.1007/s00217-008-0976-x.
[21] BERTRAM H C, KARLSSON A H, ANDERSEN H J. The significance of cooling rate on water dynamics in porcine muscle from heterozygote carriers and non-carriers of the halothane gene: a lowfield NMR relaxation study[J]. Meat Science, 2003, 65(4): 1281-1291.DOI:10.1016/s0309-1740(03)00038-x.
[22] 程天赋, 蒋奕, 张翼飞, 等. 基于低场核磁共振研究不同解冻方式对冻猪肉食用品质的影响[J]. 食品科学, 2019, 40(7): 20-26.DOI:10.7506/spkx1002-6630-20171127-333.
[23] TORNBERG E, WAHLGREN M, BR ØNDUM J, et al. Pre-rigor conditions in beef under varying temperature- and pH-falls studied with rigometer, NMR and NIR[J]. Food Chemistry, 2000, 69(4):407-418. DOI:10.1016/s0308-8146(00)00053-4.
[24] 周玄, 刘成国, 赵毓芝. 宰后处理方式对冷却肉保水性的影响的研究进展[J]. 安徽农业科学, 2011, 39(10): 5914-5916. DOI:10.3969/j.issn.0517-6611.2011.10.098.
[25] 施雪, 夏继华, 卢进峰, 等. 冻结、解冻过程对肌肉品质的影响[J].食品工业, 2012, 33(7): 21-24.
[26] BERTRAM H C, SCH Á FER A, ROSENVOLDA K, et al. Physical changes of significance for early post mortem water distribution in porcine M. longissimus[J]. Meat Science, 2004, 66(4): 915-924.DOI:10.1016/S0309-1740(03)00188-8.
[27] BERTRAM H C, D Ø NSTRUP S, KARLSSON A H, et al. Post mortem energy metabolism and pH development in porcine M. longissimusdorsi as affected by two different cooling regimes. a 31P-NMR spectroscopic study[J]. Magnetic Resonance Imaging, 2001,19(7): 993-1000. DOI:10.1016/S0730-725X(01)00412-X.
[28] 李春, 张录达, 任发政, 等. 利用低场核磁共振研究冷却条件对猪肉保水性的影响[J]. 农业工程学报, 2012, 28(23): 243-249.DOI:10.3969/j.issn.1002-6819.2012.23.032.
[29] 朱迎春, 李茜, 马俪珍, 等. 不同包装方式和贮藏温度对牛肉保水性的影响[J]. 食品研究与开发, 2016, 37(22): 15-19. DOI:10.3969/j.issn.1005-6521.2016.22.004.
[30] KRISTENSEN L, PURSLOW P P. The effect of ageing on the water-holding capacity of pork: role of cytoskeletal proteins[J]. Meat Science, 2001, 58(1): 17-23. DOI:10.1016/s0309-1740(00)00125-x.
[31] NGAPO T M, BABARE I H, REYNOLDS J, et al. A preliminary investigation of the effects of frozen storage on samples of pork[J]. Meat Science, 1999, 53(3): 169-177. DOI:10.1016/s0309-1740(99)00052-2.
[32] 黄鸿兵, 徐幸莲, 周光宏. 冷冻贮藏过程中温度波动对猪肉肌间冰晶、颜色和新鲜度的影响[J]. 食品科学, 2006, 27(8): 49-52.DOI:10.3321/j.issn:1002-6630.2006.08.006.