我国绿豆种植面积及产量居世界前列,是最大的绿豆出口国,绿豆种植主要分布在吉林、内蒙古、河北、安徽、陕西等省[1]。据报道,绿豆中淀粉质量分数为31.1%、氮质量分数为0.05%、总脂质质量分数为0.32%,并含有多种维生素和矿质元素,是植物蛋白质的重要来源[2-4]。但目前我国对绿豆产业的重视程度不够,对绿豆淀粉的开发利用还处于起步阶段,导致绿豆的加工开发难以跟上现代化食品工业的发展步伐[5]。
氧化淀粉能显著改善天然淀粉不溶于冷水,在酸、热等条件下不稳定的现象。目前最常用的氧化剂为次氯酸钠、过氧化氢等,常用的催化剂为金属离子,但其使用会导致淀粉产品中有金属离子残留。近年来,2,2,6,6-四甲基哌啶-1-氧自由基(2,2,6,6-tetramethyl-piperidine-1-oxyl,TEMPO)催化氧化法引起了研究人员的兴趣,它可在仲醇存在的情况下特异性地氧化伯醇基团。de Nooy等提出以TEMPO为催化剂,以溴化钠和次氯酸钠为氧化剂的催化氧化体系,葡聚糖及其衍生物伯醇基被迅速完全氧化[6],该体系在单糖和双糖氧化中同样适用[7]。TEMPO-次氯酸钠介导氧化已应用于各种多糖的氧化,Bragd等对马铃薯淀粉的无溴氧化进行了研究,当温度低于20 ℃和pH值低于9.0时,马铃薯淀粉的解聚作用非常微弱,在35 ℃、pH 8.5时制备的氧化淀粉溶胀和溶解能力、透明度增加,并能延迟淀粉凝胶退化[8]。因此本研究选择TEMPO为催化剂,其反应条件温和、选择性好、用量少,是一种绿色环保氧化方法。超声处理是常用的物理加工技术,具有频率高、波长短、穿透性强等特点,研究表明,超声辅助法是一种适应性强、使用方便、效果良好的聚合物改性方法[9-11]。
本研究旨在以绿豆淀粉为原料,探索超声辅助TEMPO催化氧化法制备氧化淀粉的工艺参数,探究超声处理对淀粉氧化的影响,并对氧化淀粉进行结构表征和性质分析。以期为氧化淀粉制备方法的探索和绿豆深加工提供新的思路。
1 材料与方法
1.1 材料与试剂
绿豆淀粉 河南恩苗食品有限公司;次氯酸钠天津市北辰方正试剂厂;TEMPO(纯度高于98%)酷尔化学科技(北京)有限公司;盐酸、氢氧化钠、无水乙醇、硫代硫酸钠、酚酞均为分析纯。
1.2 仪器与设备
JRA-20CQ智能型低温超声波萃取仪 无锡杰瑞安仪器设备有限公司;SK6210HP超声波清洗器上海科导超声仪器有限公司;KQ-500DE数控超声波清洗器 昆山市超声仪器有限公司;L6S紫外-可见分光光度计 上海仪电科学仪器有限公司;DHR-1旋转流变仪美国TA公司;90Plus Zeta型Zeta电位及粒度分析仪 美国布鲁克海文仪器公司;IRTracer-100傅里叶变换红外光谱仪 岛津企业管理(中国)有限公司;S-4800扫描电子显微镜 日本株式会社日立制作所;Ultima IV组合式多功能X射线衍射仪 日本理学株式会社。
1.3 方法
1.3.1 绿豆氧化淀粉制备
绿豆TEMPO氧化淀粉制备:准确称取20 g(干基质量)绿豆原淀粉为原料,加入适量蒸馏水配制成质量分数40%左右的淀粉乳液,将质量分数0.1%的TEMPO作为催化剂溶于淀粉乳中,固定反应温度10 ℃,反应时间90 min,依次考察氧化剂次氯酸钠的添加量、反应pH值对氧化度及得率的影响,反应过程中不断揽拌,并用2 mol/L的氢氧化钠溶液控制溶液pH值,待反应结束后,用适量NaHSO3溶液终止反应,调节pH值为6.5,静置1 h后,加入200 mL的无水乙醇,醇沉8 h,之后抽滤并用体积分数60%乙醇溶液反复洗涤,直至溶液呈中性为止,将固形物放入电热鼓风干燥箱中(50 ℃)干燥,之后研磨、粉碎,即得绿豆氧化淀粉产品,每个样品重复3 次[12]。
氧化剂添加量对淀粉氧化度及得率的影响:氧化剂的添加量以氧化剂物质的量与淀粉含有葡萄糖单元物质的量比表示,记为氧化剂物质的量比,固定氧化反应过程中TEMPO添加量0.1%、反应温度10 ℃、反应时间90 min、反应pH 8.5左右,探讨氧化剂添加量对淀粉氧化度及得率的影响。
反应pH值对淀粉氧化度及得率的影响:固定氧化反应过程中TEMPO添加量0.1%,反应温度10 ℃,反应时间90 min,氧化剂添加量1.5∶1(以氧化剂物质的量与淀粉含有葡萄糖单元物质的量比表示,后同),探讨反应pH值对淀粉氧化度及得率的影响。
超声辅助氧化淀粉制备:固定氧化反应过程中TEMPO添加量0.1%,氧化剂添加量1.5∶1,反应温度10 ℃,反应时间90 min,反应pH 8.5左右,固定超声功率500 W,选择超声频率分别为25、45、53 kHz,考察超声处理对氧化度及得率的影响。
1.3.2 氧化度的测定
参考Mattisson等[13]的方法稍作修改。称取5 g氧化淀粉于150 mL烧杯中,加入25 mL 0.1 mol/L的HCl溶液,充分搅拌后过滤,并用去离子水洗至无氯离子为止(脱灰,用硝酸盐检验),脱灰后将样品转移到500 mL烧杯中,加入300 mL去离子水,加热煮沸5~7 min,以酚酞作为指示剂,用0.1 mol/L的氢氧化钠溶液滴定到终点,消耗的体积记为V1/mL。空白实验:在500 mL的烧杯中加入5 g原淀粉和300 mL蒸馏水并糊化,用氢氧化钠标准溶液滴定至酚酞变色,消耗的体积记为V2/mL。氧化度以羧基质量分数表示,可由下式计算。
式中:m1为氧化淀粉质量/g;m2为原淀粉质量/g;c为氢氧化钠溶液浓度/(mol/L)。
1.3.3 氧化淀粉得率测定
将醇沉后的淀粉乳液抽滤并用无水乙醇反复洗涤,直至溶液呈中性为止,将固形物放入电热鼓风干燥箱中(50 ℃)干燥,恒质量后研磨、粉碎,根据干燥后固形物质量比干燥前固形物质量计算得率。
1.3.4 扫描电子显微镜观察淀粉颗粒微观形貌
参考钱建亚等[14]的方法稍作修改,将绿豆原淀粉及不同条件制备的氧化淀粉过100 目筛,取少量用双面胶固定在支持网上并喷金,将喷金后的样品固定在试样支持器中,对淀粉的颗粒形貌进行观察并拍摄照片。
1.3.5 傅里叶变换红外光谱分析淀粉颗粒结构变化
参考Ding Longlong等[15]的方法,将绿豆原淀粉及不同条件制备的氧化淀粉过100 目筛,采用KBr压片法,将样品置于傅里叶变换红外光谱仪中进行400~4 000 cm-1内全波段扫描,扫描次数为32 次。
1.3.6 淀粉结晶结构分析
参考杨小玲等[16]的方法稍作修改,将绿豆原淀粉及不同条件制备的氧化淀粉过100 目筛备用,选用玻璃样品架,将样品放入样品架的凹槽中,用毛玻璃压平,将样品插入样品台,关闭防护门,进行样品测试,扫描范围5°~55°,步长0.02°。
1.3.7 淀粉Zeta电位的测定
将绿豆原淀粉及不同条件制备的氧化淀粉配制成4 mg/mL的淀粉乳液,加热煮沸5 min后冷却至25 ℃左右,置于样品槽内,插入电极,进行测定。
1.3.8 淀粉黏度的测定
准确称量6 g绿豆原淀粉及不同条件制备的氧化淀粉,转移至三口圆底烧瓶内,加100 mL蒸馏水,配制成质量分数6%的淀粉乳液,水浴加热至95 ℃,在此温度下中速搅拌15 min,糊化结束后冷却至室温,置于流变仪中,在剪切速率0.1~100 s-1内测定其黏度。
1.3.9 淀粉粒径的测定
将绿豆原淀粉及不同条件制备的氧化淀粉配制成4 mg/mL的淀粉乳液,加热煮沸5 min后冷却至25 ℃左右,置于粒度分析仪样品槽内进行测定。
1.3.10 淀粉透光率的测定
参考梁建兰等[17]的方法稍作修改,准确称量0.5 g绿豆原淀粉及不同条件制备的氧化淀粉,加50 mL蒸馏水,水浴煮沸加热15 min不断搅拌,并维持原有体积,冷却至25 ℃,在620 nm波长处测定其透光率,以蒸馏水为空白(透光率100%)。
1.3.11 淀粉溶解度的测定
参考岳晓霞等[18]的方法稍作修改,准确称量2.5 g绿豆原淀粉及不同条件制备的氧化淀粉,加50 mL蒸馏水,配制成质量分数5%的淀粉乳液,85 ℃搅拌30 min,冷却至室温后4 000 r/min离心10 min,取上清液于100 ℃下烘干,于105 ℃烘至恒质量。溶解度即为上清液干燥后的淀粉质量与淀粉样品干物质的质量比。
1.4 数据统计分析
实验平行测定3 次,结果表示为平均值±标准差;采用SPSS 17.0软件的Duncan多重检验进行显著性分析,显著水平为P<0.05。
2 结果与分析
2.1 绿豆氧化淀粉条件优化结果
2.1.1 氧化剂添加量对淀粉氧化度及得率的影响

图1 氧化剂添加量对淀粉氧化度及得率的影响
Fig. 1 Effect of oxidant amount on degree of oxidation and yield of oxidized starch
从图1可以看出,氧化淀粉的氧化度随着氧化剂添加量的增加而增加,当氧化剂与淀粉含有葡萄糖单元物质的量比从1∶1增加到1.5∶1时,氧化度从27.88%提高到51.08%,增加了83.21%;而当氧化剂添加量继续增加时,氧化度无明显改变,说明氧化反应已基本完成。此外,次氯酸钠添加量过多时,氧化剂是过量的,同时从实验数据来看添加量越大时误差也越大,氧化淀粉的得率呈下降趋势,因此,次氯酸钠与淀粉含有葡萄糖单元物质的量比1.5∶1左右较为合适。
2.1.2 反应pH值对淀粉氧化度及得率的影响

图2 反应pH值对淀粉氧化度及得率的影响
Fig. 2 Effect of reaction pH on degree of oxidation and yield of
oxidized starch
从图2可以看出,氧化度随pH值先增大后减小,pH 8.5~9.0时氧化度最高,最大值近50%,但当pH值继续增大时,氧化度降低,当溶液碱性减弱或增强时,氧化度均有不同程度的下降。这是因为,在淀粉的葡萄糖单元C2、C3和C6这3 个碳原子上有游离的羟基,在弱碱性条件下,TEMPO共氧化体系主要是氧化C6的羟基,因为C6羟基空间位阻小且是伯碳原子,伯碳原子上的氢更易以质子的形式离去,因此更容易被氧化[19]。
从图2还可以看出,随着pH值的增大得率显著下降,一方面是由于在强碱性条件下pH值的提高会降低氧化反应速率[20];另一方面是由于反应介质的碱性增强加剧了淀粉的降解,但在弱碱性条件下,淀粉以中性形式存在,反应速度较快。综上,TEMPO氧化体系氧化淀粉反应pH值以8.5为宜。
2.1.3 超声频率对淀粉氧化度及得率的影响

图3 不同超声频率对淀粉氧化度及得率的影响
Fig. 3 Effect of ultrasonic frequency on degree of oxidation and yield of oxidized starch
从图3中可以看出,不同超声频率对淀粉氧化度的影响各不相同,未超声处理组的氧化度为40.54%,超声25 kHz处理组的氧化度为41.42%,较未超声组增长了2.17%,45 kHz和53 kHz处理组的氧化度分别为35.50%和28.49%,较未超声组降低了12.43%和29.72%。可能是因为超声波可以促进淀粉分子降解,使分子链断裂,超声波频率越大,产生的部分空化泡半径大于淀粉颗粒半径[21],对其造成的破坏作用减弱,导致淀粉颗粒与氧化剂之间的接触面积减少,氧化度降低。
从图3可以看出,氧化淀粉得率变化趋势与氧化度相一致,低频超声促进氧化反应的进行,而高频抑制氧化反应的进行,得率随着频率的升高呈现显著下降趋势。
2.2 扫描电子显微镜观察结果
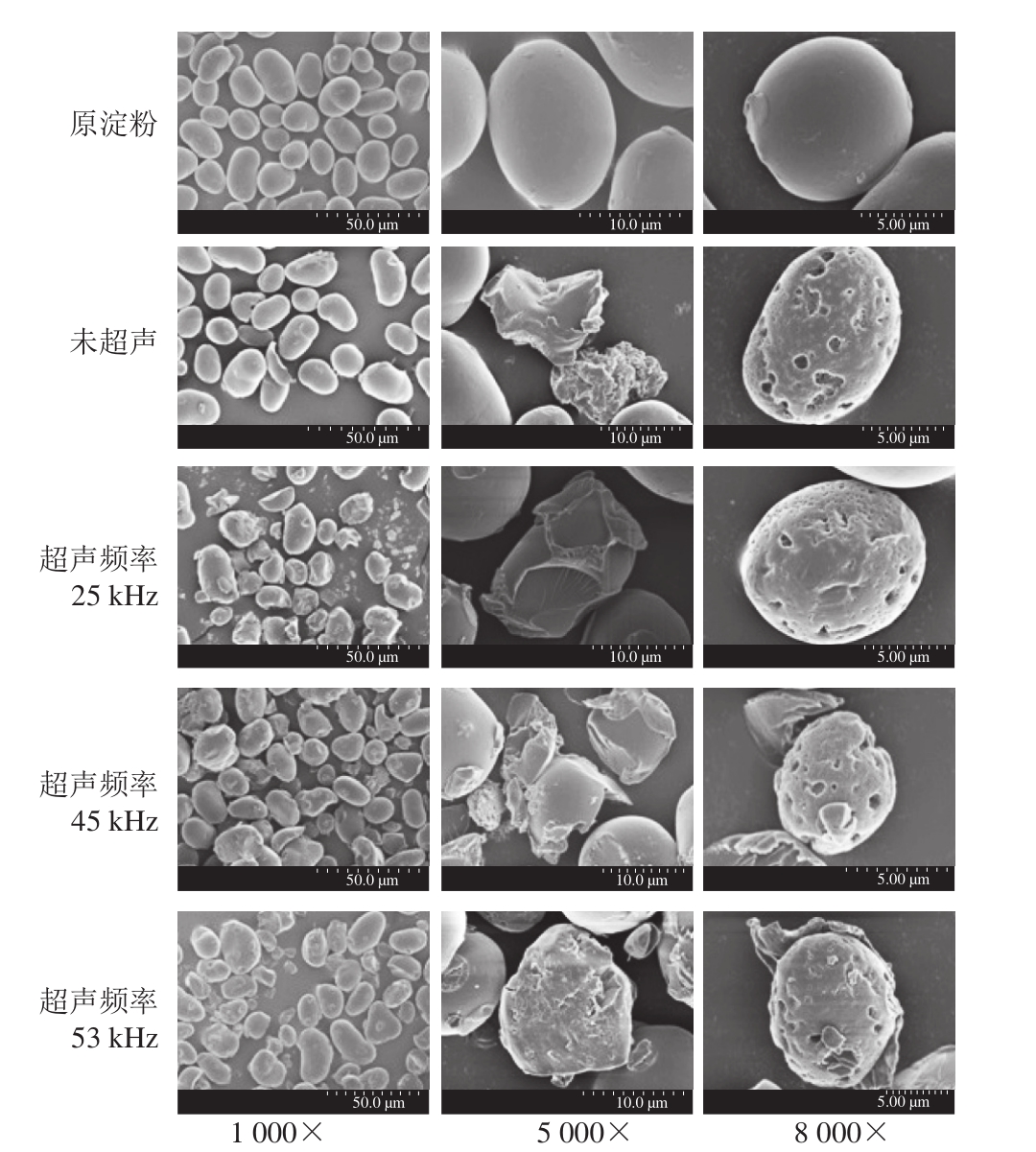
图4 绿豆原淀粉及氧化淀粉扫描电子显微镜图
Fig. 4 Scanning electron microscopic images of intact and oxidized mung bean starch
由图4可以看出,绿豆原淀粉颗粒完整、表面光滑致密、无缺陷及裂纹;绿豆淀粉经未超声氧化处理后,颗粒表面出现明显的破损裂纹,表面有较多的孔洞出现,部分颗粒破裂,与文献[22]结果一致。绿豆淀粉经25 kHz超声和氧化剂同时作用时,淀粉破损颗粒数量增多,表面同样受到侵蚀,变得粗糙,出现孔洞,且超声频率25 kHz作用的淀粉氧化程度较高,淀粉表面损坏程度变大。这可能是因为超声波作用于淀粉溶液时,淀粉颗粒受到强大的冲击作用,造成局部高温高压,使分子内部结构发生改变,出现孔洞,超声波与氧化剂同时作用,促进淀粉大颗粒分子降解;因此淀粉颗粒表面出现更多、更深的孔洞。超声频率45 kHz处理的氧化淀粉表面粗糙,有破损裂纹,颗粒受到侵蚀,但与未超声及超声频率25 kHz氧化淀粉相比孔洞及破碎颗粒出现较少;超声53 kHz处理的氧化淀粉表面粗糙,有破损裂纹,颗粒受到侵蚀,但与超声频率45 kHz氧化淀粉相比孔洞出现较少,颗粒破碎数量减少。
2.3 傅里叶变换红外光谱分析结果
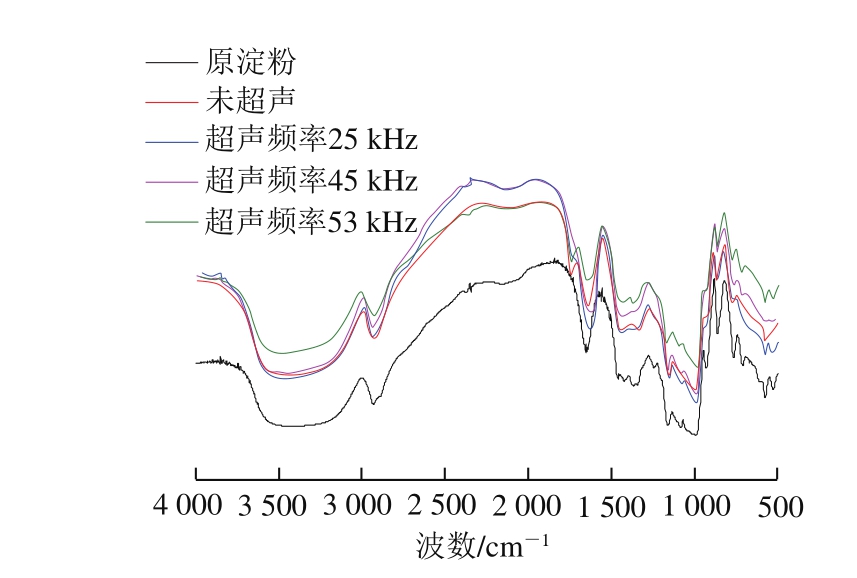
图5 绿豆原淀粉及氧化淀粉傅里叶变换红外光谱图
Fig. 5 Fourier transform infrared spectra of raw and oxidized mung bean starch
从图5中可以看出,原淀粉在3 460 cm-1处吸收峰峰宽变窄,主要是由于氧化剂进入淀粉颗粒内部,产生了一定的氧化降解作用,从而导致淀粉颗粒结构松散,淀粉大分子间氢键缔合作用减弱[23]。各个处理组保持了在562、990、1 158、1 349、2 929 cm-1处的淀粉特征吸收峰;与原淀粉比较,改性后的氧化淀粉葡萄糖单元中OH的O—H伸缩振动(3 435cm-1)吸收峰急剧变弱,说明氧化作用发生在C2、C3、C6的—OH,同时还可发现,未超声处理组和超声25 kHz处理组在1 733 cm-1处出现了较弱的吸收峰,可以判断其是由C=O的伸缩振动引起的,说明产物中有一定数量的羧基存在,未超声处理组和超声25、45、53 kHz处理组在1 613~1 637 cm-1出现了明显的羧基吸收峰,说明淀粉被成功氧化,得到了目标产物。
2.4 淀粉结晶结构分析结果
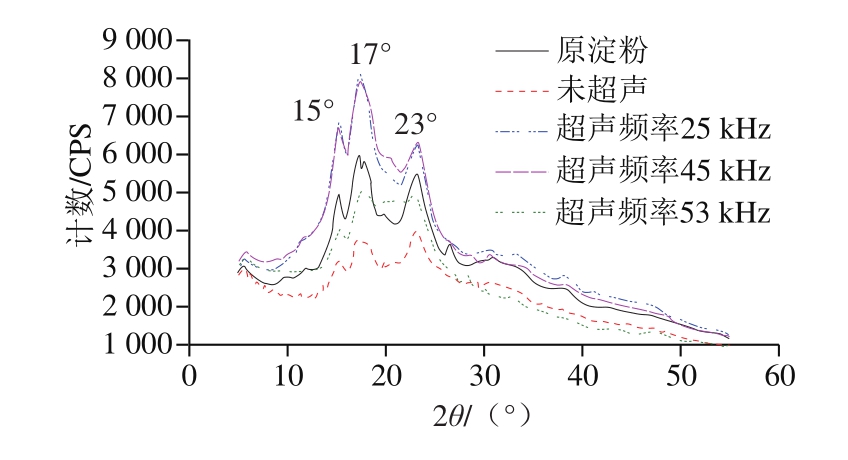
图6 绿豆原淀粉及氧化淀粉X射线衍射图
Fig. 6 X-ray diffraction patterns of raw and oxidized mung bean starch
从图6可以看出,绿豆原淀粉具有尖锐的峰形,在衍射角2θ分别为15°、17°、23°下有较强的衍射峰,其中2θ为17°是原淀粉最强的衍射峰,与原淀粉相比,氧化淀粉的衍射峰及位置都没有发生改变,主要原因可能是淀粉颗粒没有通过凝胶化破坏,反应主要发生在无定形区中,氧化剂不会渗透到淀粉颗粒中以改变晶体结构,该结果与Chávez-Murillo等[24]报道的结果一致,但与Zhang Yurong等[25]的结果不同,在其研究中,淀粉在反应前被凝胶化,以释放直链淀粉和支链淀粉链中的所有羟基,当凝淀粉被过氧化氢氧化时,分子链随着氧化程度的增加而解聚,进而改变了晶体结构的类型。
2.5 淀粉Zeta电位分析结果
表1 绿豆原淀粉及氧化淀粉的Zeta电位
Table 1 Zeta potential of raw and oxidized mung bean starch
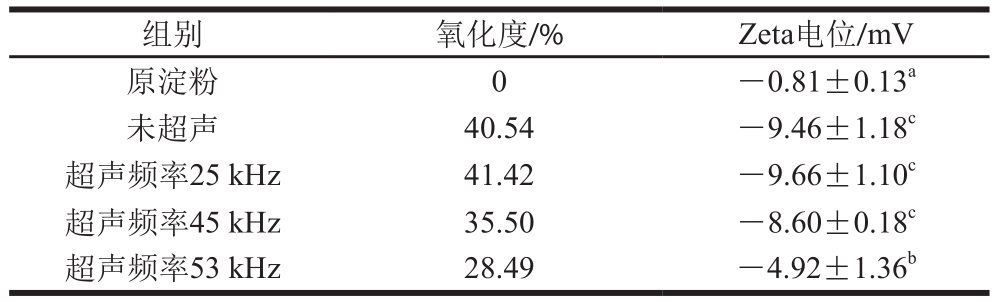
注:同列肩标小写字母不同表示差异显著(P<0.05)。下同。
组别 氧化度/% Zeta电位/mV原淀粉 0 -0.81±0.13a未超声 40.54 -9.46±1.18c超声频率25 kHz 41.42 -9.66±1.10c超声频率45 kHz 35.50 -8.60±0.18c超声频率53 kHz 28.49 -4.92±1.36b
由表1可知,原淀粉及氧化淀粉均带负电,与原淀粉相比,不同处理条件下淀粉的Zeta电位绝对值均增大,未超声处理组与超声25 kHz处理组的电位相近,是因为这两个处理组的氧化度基本一致,而超声45 kHz和超声53 kHz处理组的电位绝对值较低,是因为这两组的氧化度较低,由此可以得出,电位的高低与氧化度有很大关系,氧化度越高,羧基含量越高,溶液中的阴离子增多,导致溶液带负电。
2.6 淀粉黏度分析结果

图7 不同处理方式对绿豆淀粉黏度的影响
Fig. 7 Effect of ultrasonic treatments on viscosity of mung bean starch
如图7所示,淀粉经氧化处理后其糊的黏度比原淀粉显著降低,原淀粉的黏度为35 Pa·s,超声53 kHz处理组的氧化度为28.49%,黏度下降为0.3 Pa·s,而当超声频率降低时,其黏度逐渐下降,但下降速率变得很缓慢,黏度由0.3 Pa·s降至0.04 Pa·s。
次氯酸钠氧化淀粉黏度降低的原因是淀粉链氧化裂解,导致淀粉分子尺寸减小[26-27],带负电荷羧基的存在会削弱分子相互作用,从而降低其凝胶黏度,并且随着氧化度的增加,氧化淀粉的直链淀粉含量逐渐降低,螺旋结构破裂,降低了碘与直链淀粉形成蓝色包合物的能力;此外,直链淀粉的线性结构和随机排列使其更易于氧化降解[28]。
2.7 淀粉粒径分析结果
表2 绿豆原淀粉及氧化淀粉的粒径
Table 2 Granule size of raw and oxidized mung bean starch
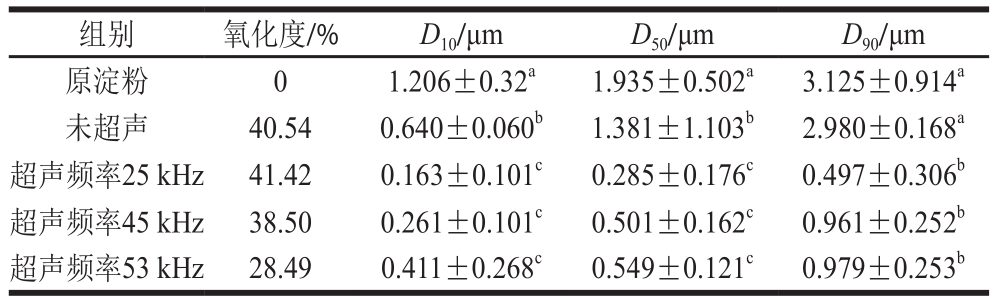
组别 氧化度/% D10/μm D50/μm D90/μm原淀粉 0 1.206±0.32a 1.935±0.502a 3.125±0.914a未超声 40.54 0.640±0.060b 1.381±1.103b 2.980±0.168a超声频率25 kHz 41.42 0.163±0.101c 0.285±0.176c 0.497±0.306b超声频率45 kHz 38.50 0.261±0.101c 0.501±0.162c 0.961±0.252b超声频率53 kHz 28.49 0.411±0.268c 0.549±0.121c 0.979±0.253b
从表2中可以看出,与原淀粉相比,不同处理条件下淀粉的粒径均减小,超声处理组的粒径均小于未超声处理组,超声频率25 kHz处理的氧化淀粉粒径最小,以D50为例,25 kHz处理组比原淀粉减小了85.27%,超声处理组氧化淀粉的粒径比未超声处理组至少减小了60.25%。产生这种现象的原因可能是淀粉分子在氧化剂与超声波双重作用下,淀粉结构出现部分损伤,包括孔状、凹陷、部分剥离等,氧化剂能深入淀粉分子内部,使部分淀粉分子发生降解,从而导致淀粉整体颗粒变小,不同频率产生不同强度的空化效应,高频时空化效应减弱,因此,低频时淀粉颗粒具有更小的粒径[29-30]。
2.8 淀粉透光率分析结果
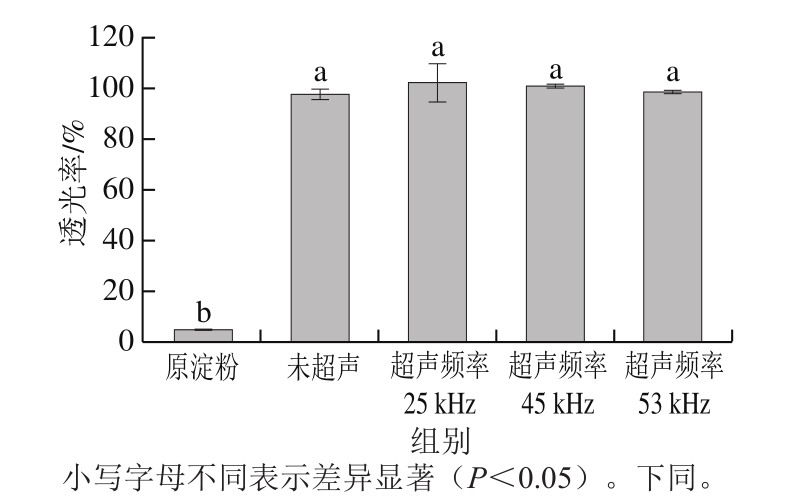
图8 不同处理方式对绿豆淀粉透光率的影响
Fig. 8 Effect of ultrasonic treatments on transmittance of mung bean starch
由图8可知,与原淀粉相比,不同处理条件下绿豆淀粉的透光率均大幅增加,未超声氧化淀粉的透光率为98.11%,比原淀粉的透光率增加了1 870%,超声25 kHz条件下的氧化淀粉透明度最好,比原淀粉的透光率增加了1 962%,氧化度越高,透光率越大。产生这种现象可能是因为超声作用促进淀粉颗粒结构被破坏[31],氧化淀粉中特别是羧基亲水基团的存在阻碍了分子的重新结合,羧基的取代与解聚结合导致氧化淀粉的糊剂透明度更高,淀粉的溶解度越大,其糊状物就越透明[26,32]。
2.9 淀粉溶解度分析结果
由图9可知,与原淀粉相比,不同处理条件下淀粉的溶解度均显著增加,超声25 kHz条件下的氧化淀粉溶解度最好。与原淀粉相比,未超声氧化淀粉的溶解度增加了740%,超声频率25 kHz制备的氧化淀粉溶解度比未超声氧化淀粉增加了4.2%,超声45 kHz和53 kHz的溶解度与未超声处理组的差异不显著。氧化淀粉溶解度的增加可能是因为氧化和超声波处理都能有效使淀粉的颗粒结构变得疏松,从而使淀粉更易溶,淀粉颗粒完整性的弱化与引入羧基后淀粉聚合物的负电荷有关[26],氧化度越高,淀粉分子颗粒间的结合力被削弱,导致其颗粒膨胀,增加了水分子与淀粉游离羟基结合的几率,从而使淀粉溶解度增大。
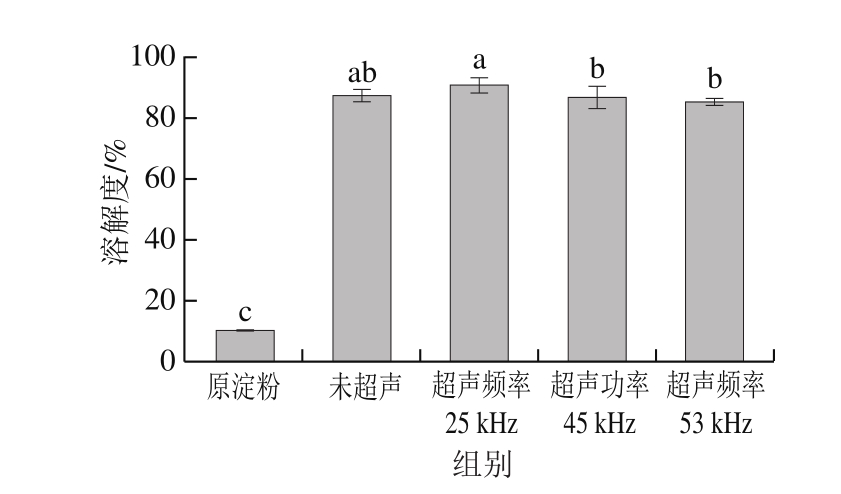
图9 不同处理方式对绿豆淀粉溶解度的影响
Fig. 9 Effect of ultrasonic treatments on solubility of mung bean starch
3 结 论
氧化淀粉制备最佳工艺条件:氧化剂与淀粉含有葡萄糖单元物质的量比1.5∶1、反应pH 8.5~9.0左右、反应时间90 min、反应温度10 ℃;超声辅助处理结果表明:超声频率25 kHz时,淀粉氧化度最高(41%),得率为95%,低频可以促进氧化反应的进行,高频不利于淀粉氧化反应的进行。扫描电子显微镜结果显示,氧化淀粉颗粒破碎减小,表面出现较多孔洞及凹陷,超声频率25 kHz制备的氧化淀粉颗粒明显减小;傅里叶变换红外光谱结果显示,氧化淀粉在1 610 cm-1左右出现了明显的羧基吸收峰,说明淀粉被成功氧化;X射线衍射结果显示,原淀粉经不同方式变性后,破坏程度不足以使其晶型改变;淀粉经氧化后,一些性质发生了极大改变,与原淀粉相比,氧化淀粉氧化度越高,黏度越低,粒径减小,且超声辅助使氧化淀粉具有更小的粒径,溶解度、透光率增加,带电荷量增加。综上,超声辅助成功制备了绿豆氧化淀粉,结构性质分析表明更小的粒径、更大的溶解度将有利于绿豆淀粉产品的进一步开发利用。
[1] 孙明威, 周振亚. 制约我国绿豆生产与贸易问题的研究[J]. 中国合作经济, 2016, 29(9): 58-61. DOI:10.3969/j.issn.1006-6063.2016.09.019.
[2] HOOVER R, LI Y X, HYNES G, et al. Physicochemical characterization of mung bean starch[J]. Food Hydrocolloids, 1997,11(4): 401-408. DOI:10.1016/S0268-005X(97)80037-9.
[3] JIANG Bin, LI Wenhao, HU Xiaosong, et al. Rheology of mung bean starch treated by high hydrostatic pressure[J]. International Journal of Food Properties, 2015, 18(1): 81-92. DOI:10.1080/10942912.2013.819363.
[4] GUNARATNE A, GAN R Y, WU K, et al. Physicochemical properties of mung bean starches isolated from four varieties grown in Sri Lanka[J]. Starch-Stärke, 2018, 70(4): 195-204. DOI:10.1002/star.201700129.
[5] 谢宇希, 邵楚瑶, 王婷, 等. 绿豆淀粉果冻的加工工艺研究[J].食品工业科技, 2019, 40(7): 150-154; 160. DOI:10.13386/j.issn1002-0306.2019.07.026.
[6] DE NOOY A E J, BESEMER A C, BEKKUM H V. Highly selective nitroxyl radical-mediated oxidation of primary alcohol groups in water-soluble glucans[J]. Carbohydrate Research, 1995, 269(1): 89-98.DOI:10.1016/0008-6215(94)00343-E.
[7] CHATTERJEE C, PONG F, SEN A. Chemical conversion pathways for carbohydrates[J]. Green Chemistry, 2015, 17(1): 40-71.DOI:10.1039/c4gc01062k.
[8] BRAGD P L, BESEMER A C, VAN BEKKUM H. Bromide-free TEMPO-mediated oxidation of primary alcohol groups in starch and methyl alpha-D-glucopyranoside[J]. Carbohydrate Research, 2000,328(3): 355-363. DOI:10.1016/S0008-6215(00)00109-9.
[9] ZHU Bo, LIU Jianli, GAO Weidong. Process optimization of ultrasound-assisted alcoholic-alkaline treatment for granular cold water swelling starches[J]. Ultrasonics Sonochemistry, 2017, 38: 579-584. DOI:10.1016/j.ultsonch.2016.08.025.
[10] ZHU Fan. Impact of ultrasound on structure, physicochemical properties,modifications, and applications of starch[J]. Trends in Food Science &Technology, 2015, 43(1): 1-17. DOI:10.1016/j.tifs.2014.12.008.
[11] CHU Huijuan, WEI Hongliang, ZHU Jing. Ultrasound enhanced radical graft polymerization of starch and butyl acrylate[J]. Chemical Engineering and Processing-Process Intensification, 2015, 90: 1-5.DOI:10.1016/j.cep.2015.02.002.
[12] 胡爱军, 曲莹, 郑捷, 等. 豌豆氧化淀粉超声法制备的影响因素及其性质[J]. 中国食品学报, 2018, 18(4): 156-161. DOI:10.16429/j.1009-7848.2018.04.021.
[13] MATTISSON M F, LEGENDRE K A. Determination of carboxyl content of oxidized starches[J]. Analytical Chemistry, 1952, 24(12):1942-1944. DOI:10.1021/ac60072a019.
[14] 钱建亚, KUHN M. 荞麦淀粉的性质[J]. 粮食加工, 2000, 25(3): 42-45. DOI:10.3969/j.issn.1007-6395.2000.03.016.
[15] DING Longlong, ZHANG Yanhua, GU Jiyou, et al. Determination of the carboxyl content of oxidized starch by Fourier transform infrared(FTIR) spectroscopy[J]. Spectroscopy and Spectral Analysis, 2014,34(2): 401-404. DOI:10.3964/j.issn.1000-0593(2014)02-0401-04.
[16] 杨小玲, 赵维, 陈佑宁, 等. 超声波辅助酸法制备红薯抗性淀粉及其结构表征[J]. 中国粮油学报, 2018, 33(1): 107-110; 117. DOI:10.3969/j.issn.1003-0174.2018.01.019.
[17] 梁建兰, 刘秀凤, 李志博, 等. 板栗淀粉与板栗变性淀粉性质的比较[J].中国粮油学报, 2011, 26(1): 65-68.
[18] 岳晓霞, 毛迪锐, 赵全, 等. 玉米淀粉与玉米变性淀粉性质比较研究[J]. 食品科学, 2005, 26(5): 116-118. DOI:10.3321/j.issn:1002-6630.2005.05.022.
[19] 曹晶晶, 杨益琴. TEMPO/NaBr/NaClO体系下氧化淀粉的制备及其结构性能表征[J]. 南京林业大学学报(自然科学版), 2011, 35(2): 88-92. DOI:10.3969/j.jssn.1000-2006.2011.02.019.
[20] 谭义秋. 淀粉氧化反应机理的探究[J]. 农产品加工(学刊), 2007,6(4): 46-48; 51. DOI:10.3969/j.issn.1671-9646-B.2007.04.014.
[21] 黄利波, 吴胜举, 周凤梅. 影响声化学产额的几个因素[J]. 声学技术,2005, 24(4): 210-214. DOI:10.3969/j.issn.1000-3630.2005.04.005.
[22] VANIER N L, EL HALAL S L M, DIAS A R G, et al. Molecular structure, functionality and applications of oxidized starches: a review[J]. Food Chemistry, 2017, 221(8): 1546-1559. DOI:10.1016/j.foodchem.2016.10.138.
[23] BUSTILLOS-RODRIGUEZ J C, ORDONEZ-GARCIA M, TIRADOGALLEGOS J M, et al. Physicochemical, thermal and rheological properties of native and oxidized starch from corn landraces and hybrids[J].Food Biophysics, 2019, 14(2): 182-192. DOI:10.1007/s11483-019-09569-z.
[24] CHÁVEZ-MURILLO C E, WANG Y J, BELLO-PÉREZ L A.Morphological, physicochemical and structural characteristics of oxidized barley and corn starches[J]. Starch-Stärke, 2010, 60(11): 634-645. DOI:10.1002/star.200800016.
[25] ZHANG Yurong, WANG Xiuli, ZHAO Guoming, et al. Preparation and properties of oxidized starch with high degree of oxidation[J].Carbohydrate Polymers, 2012, 87(4): 2554-2562. DOI:10.1016/j.carbpol.2011.11.036.
[26] KAUR M, BHULLAR G K. Partial characterization of Tamarind(Tamarindus indica L.) kernel starch oxidized at different levels of sodium hypochlorite[J]. International Journal of Food Properties, 2016,19(3): 605-617. DOI:10.1080/10942912.2015.1038722.
[27] NAKNAEN P, TOBKAEW W, CHAICHALEOM S K. Properties of jackfruit seed starch oxidized with different levels of sodium hypochlorite[J]. International Journal of Food Properties, 2017, 20(5):979-996. DOI:10.1080/10942912.2016.1191868.
[28] KUAKPETOON D, WANG Y J. Characterization of different starches oxidized by hypochlorite[J]. Starch-Stärke, 2015, 53(5): 211-218.DOI:10.1002/1521-379X.
[29] LIU Jibo, CHEN Jinqing, YIN Zhoulan, et al. Effect of ultrasound frequency on the precipitation process of supersaturated sodium aluminate solution[J]. The Chinese Journal of Process Engineering,2004, 4(2): 130-135. DOI:10.3321/j.issn:1009-606X.2004.02.007.
[30] ZHANG Qingan, FU Xizhe, MARTIN J F G. Effect of ultrasound on the interaction between (-)-epicatechin gallate and bovine serum albumin in a model wine[J]. Ultrasonics Sonochemistry, 2017, 37:405-413. DOI:10.1016/j.ultsonch.2017.01.031.
[31] SANDHU K S, KAUR M, SINGH N, et al. A comparison of native and oxidized normal and waxy corn starches: physicochemical, thermal,morphological and pasting properties[J]. LWT-Food Science and Technology, 2008, 41(6): 1000-1010. DOI:10.1016/j.lwt.2007.07.012.
[32] DE CONTO L C, PLATA-OVIEDO M S V, STEEL C J, et al. Physicochemical, morphological, and pasting properties of pine nut (Araucaria angustifolia) starch oxidized with different levels of sodium hypochlorite[J]. Starch-Stärke, 2011, 63(4): 198-208. DOI:10.1002/star.201000133.
 Changxin*
Changxin*